蜡样芽胞杆菌(Bacillus cereus)是一种革兰氏阳性、可产生毒素的兼性厌氧型细菌,是一种引起食源性疾病的病原体[1]。世界范围内大约有1.4%~12%的食源性疾病爆发是由蜡样芽胞杆菌引起的[2]。2018年欧盟报告了98起蜡样芽胞杆菌食物中毒事件,相关确诊病例达1 538例[3]。根据2002—2017年的监测数据,我国由蜡样芽胞杆菌引发的食源性疾病事件占总食源性疾病事件的10.83%,表明该菌引发的食品安全风险具有较高的发生概率。近年来该类事件呈现频发态势,其潜在危害性需要引起高度重视。
在食品工业中,蜡样芽胞杆菌的污染源来自营养细胞、孢子和生物被膜。蜡样芽胞杆菌由于其孢子的存在,一旦进入到食品生产线中很难被清除。蜡样芽胞杆菌孢子具有疏水性,可以黏附于食品加工管道中的不锈钢表面,此后孢子萌发形成生物被膜,使其对食品加工过程中的清洗具有更强的抵抗能力[4]。生物被膜是由细菌细胞及其自身产生的胞外聚合物质(extracellular polymeric substances,EPS)组成,包括多糖、蛋白质、核酸和脂质。EPS为生物被膜提供了机械稳定性,并形成了独特的三维空间结构[5]。生物被膜的存在使食品安全面临严重威胁,并带来了经济和健康方面的不利影响。
蜡样芽胞杆菌产生的肠毒素和呕吐型毒素(cereulide)是其导致食源性疾病暴发的主要罪魁祸首,分别引起腹泻症状和呕吐症状[2]。引起腹泻症状的溶血型肠毒素(hemolysin BL,Hbl)、非溶血型肠毒素(nonhemolytic enterotoxin,Nhe)、细胞毒素(cytotoxin,CytK)等相对不稳定,而cereulide具有很强的耐热性和抗消化酶作用,甚至可在121 ℃下存活90 min[6-8]。Cereulide作为K+载体,其结构与抗生素缬氨霉素相似,可破坏哺乳动物细胞膜并抑制线粒体活性,导致呕吐、肝损伤、多器官功能衰竭等症状,严重时可致命[9-11]。鉴于cereulide相较于肠毒素有更高的环境耐受性,应重点关注其在食品加工环境中的形成规律和潜在风险。
蜡样芽胞杆菌生物被膜内亦可产生cereulide,蜡样芽胞杆菌的生物被膜可为菌体产生的cereulide提供附着位点,但cereulide不会随生物被膜的分散而分散,而是附着于生物被膜的残基,对环境造成持续污染[12]。目前蜡样芽胞杆菌的生物被膜形成、cereulide产生的规律已经被深入研究,但关于生物被膜形成、cereulide产生之间的关联性研究较少,深入研究二者之间的关系对于推动食品工业中的风险评估发展具有重要意义。本文对蜡样芽胞杆菌生物被膜与cereulide形成规律及其相关性、检测方法、清除方法进行了综述,以期对蜡样芽胞杆菌的致病机理和综合防控提供一定的参考。
1 蜡样芽胞杆菌生物被膜与cereulide的形成
1.1 蜡样芽胞杆菌生物被膜的形成
生物被膜是微生物在生长过程中为适应生存环境而形成的一种与浮游菌相对应的菌细胞群体,它附着于活力组织或无活力组织表面,由其产生的EPS包裹的菌体细胞构成。蜡样芽胞杆菌的生物被膜大部分在气-液界面形成,在液体培养基的表面会形成有结构的膜,而在固体琼脂培养基上形成结构复杂的菌落。蜡样芽胞杆菌分离株形成生物被膜的能力存在极大差异,其影响因素包括菌株来源及生理特点、生长介质、培养温度和时间。研究表明,蜡样芽胞杆菌生物被膜形成能力存在显著菌株特异性差异。不同来源分离株(人源/食品源)在生物被膜形成能力上表现出明显差异[13],产cereulide的菌株间生物被膜形成量可相差10倍以上[14]。即使同一菌种内不同菌株,其生物被膜形成能力也存在统计学显著差异[15]。环境因素对生物被膜形成具有重要调控作用。金属离子(Mn2+、亚铁血红素)可显著影响生物被膜形成量[16]。研究表明,30 ℃、中性pH环境最有利于生物被膜发育。在添加葡萄糖、麦芽糖的培养基中,生物被膜的生物量和代谢活性显著提升[17]。同样,材料表面特性显著影响生物被膜形成效率。不同材质表面生物被膜形成能力依次为玻璃>不锈钢>聚氯乙烯>聚丙烯,其中食品接触过的不锈钢表面生物被膜生成量最高,且菌体存活时间延长[18]。培养基类型(TSB/BHI)和培养时间(48 h/24 h)也会影响生物被膜发育水平[19]。以上研究多为基于蜡样芽胞杆菌生物被膜进行的研究,仅揭示了蜡样芽胞杆菌生物被膜形成规律,并未提及到蜡样芽胞杆菌生物被膜形成与cereulide形成的关系。
1.2 蜡样芽胞杆菌cereulide的形成
Cereulide是一种十二环型多肽([D-O-Leu-D-Ala-L-O-Val-L-Val]3)[20],该毒素分子质量大小只有1.2 kDa。温度、pH、水分活度是影响cereulide形成的主要因素,除此之外,cereulide的形成还受到氧气及营养物质的调控。当温度低于30 ℃时,cereulide的产量一般随温度的升高而增加,研究发现,在12~30 ℃时,呕吐型蜡样芽胞杆菌F4810/72菌株在乳制品、果蔬类、谷物类食品中cereulide产量随温度升高而增加,当温度超过30 ℃后,cereulide的形成会受到抑制[21]。呕吐型蜡样芽胞杆菌分离株在12 ℃或30 ℃的牛奶中产生cereulide,而10 ℃的牛奶中不产生[22]。蜡样芽胞杆菌生长的基质pH值对cereulide产量也会有影响。在烘烤食品中,pH>5.6时才可检测到cereulide的产生,并随着pH的升高,cereulide的产量会升高[23]。此外,在pH值为6.0~7.0的中性食物(如巴拿酱、肝脏香肠和熟米饭)中,F4810/72产生的cereulide在比其他条件下[如奶酪(pH=7.9)和甜点(pH=5.1)]更多[24]。不同食物中酸碱性导致的cereulide浓度不一致的原因可能是不同食品成分的额外影响。食物水分活度差异同样会影响cereulide的形成。在水分活度为0.982的米饼类食物中,cereulide的积累量最高;在水分活度为0.988的肉饼类食品中,cereulide的积累量最高;在水分活度为0.800~0.820的果酱、松糕等食品中,cereulide的浓度低于检测限[23]。由此可见,不同食物基质中cereulide积累量最大时对应的水分活度不同。食品中水分活度的变化通常是由盐浓度变化引起的,因此改变盐浓度对cereulide形成量的变化不可忽略。研究发现,当NaCl质量浓度从0 g/L升高到25 g/L时,呕吐型标准菌株F4810/72产生的cereulide产量下降了近60%,盐浓度升高引起水分活度下降,导致毒素首次产生时间延长,并降低了最大生成量[25]。食品中的营养物质同样对cereulide形成产生影响,在以往的研究中,在蜡样芽胞杆菌生长中添加葡萄糖或不同种类的氨基酸会使cereulide的产量变化[26-29]。氧气含量同样是cereulide产生的影响因素之一,蜡样芽胞杆菌可在无氧或有氧的环境下生长,但随着氧气比例的减少,蜡样芽胞杆菌cereulide的产量逐渐减少[28]。呕吐型蜡样芽胞杆菌在氧含量低于1.6%的条件下,cereulide的生成会受到抑制[30]。目前关于cereulide的形成机制研究均和影响其生成因素有关,且现有研究未探究生物被膜内cereulide形成机制。
1.3 蜡样芽胞杆菌生物被膜与cereulide之间的关系
相较于浮游生长的蜡样芽胞杆菌产生cereulide的研究,生物被膜内生成cereulide的研究少之又少。在cereulide对于生物被膜的影响方面,蜡样芽胞杆菌可以在生物被膜内分泌代谢产物和毒素,毒素可能在生物被膜群落中具有功能性作用。在先前的研究中,蜡样芽胞杆菌产生的一种与细胞壁肽酶相关的肠毒素(CwpFM)被认为参与了生物被膜的形成[31]。这种现象在其他菌株中也存在,α毒素是金黄色葡萄球菌分泌的一种溶血毒素,是生物被膜发育过程中细胞间通讯所必需的[32]。然而,目前还不清楚毒素是否在蜡样芽胞杆菌的生物被膜中发挥类似的特定功能。革兰氏阳性细菌利用分泌的多肽作为细胞间通信的自动诱导剂,以应对高细胞群密度如生物被膜等环境。Cereulide可能作为蜡样芽胞杆菌群体感应的自动诱导剂,可能在生物被膜的形成中发挥作用[33-34]。由于生物被膜基质中的高细胞密度和稀缺的营养物质,多物种生物被膜内会发生不同菌种之间的竞争,许多细菌分泌分子,帮助它们排除生物被膜中的竞争细菌。先前研究表明,枯草芽胞杆菌可以产生一种名为YIT的生物被膜相关毒素,以攻击生物被膜中的竞争对手[35]。在生物被膜对于cereulide的影响方面,生物被膜可以为cereulide提供更多的附着位点,生物被膜可以成为cereulide的持续性污染源。目前来说,关于蜡样芽胞杆菌生物被膜形成与cereulide之间的关系的研究较少。值得注意的是,关于生物被膜与cereulide的形成调控机制中某些基因的表达具有关联性。在蜡样芽胞杆菌生物被膜的形成过程中,Spo0A、AbrB、CodY、SpoVG等调节因子相互作用,通过调节特定基因的表达,影响生物被膜的形成、成熟和维持。Spo0A通过调节与生物被膜形成相关的基因表达,直接参与调控生物被膜的形成和维持。AbrB是一个全局调节因子,影响蜡样芽胞杆菌的生物学行为,AbrB通过调节基因表达,可能在生物被膜的形成过程中发挥作用。CodY是一个全局调控蛋白,参与细菌的适应性和代谢调节。CodY通过感知环境信号,例如营养条件,调控与生物被膜相关的基因表达,参与调控生物被膜形成。SpoVG在蜡样芽胞杆菌的生物被膜形成中通过调节Spo0A的转录水平,发挥调控作用。研究表明,spo0A和abrB基因的表达水平与蜡样芽胞杆菌生物被膜形成能力呈显著正相关。通过分析11株产cereulide菌株及 2 株参考菌株的基因表达特征,发现这2个基因在生物被膜调控网络中发挥正向调控作用。值得注意的是,该研究仅验证了基因表达与生物被膜发育的关联性,但未讨论spo0A和abrB基因与cereulide产生之间的调控关系[36]。在cereulide的合成过程中,CodY、AbrB、Spo0A同样作为调节因子起到调控作用。ΔcodY 突变可显著影响蜡样芽胞杆菌F4810/72菌株的cesA和cesB基因表达时序。通过实时荧光定量 PCR 技术检测发现,ΔcodY 突变株的cesA和cesB基因转录峰值出现在菌体生长早期阶段,mRNA表达量较野生型菌株显著上调34~60倍[37]。这一结果揭示了codY基因可能在菌体对数生长期前对ces基因家族行使负调控功能。AbrB可与cesP基因启动子区域结合阻碍转录起始复合物的形成,抑制cereulide的合成,低水平磷酸化的Spo0A可能会通过调控abrB基因的转录从而间接影响cereulide的合成过程。蜡样芽胞杆菌的生物被膜形成与呕吐毒素的形成过程中具有相同的调控因子,研究呕吐型蜡样芽胞杆菌生物被膜状态下调控因子的作用方式,同时分析其内关于cereulide形成的关键ces基因簇的转录水平,对于研究蜡样芽胞杆菌生物被膜与cereulide之间的关系提供清晰的思路。综上所述,蜡样芽胞杆菌的生物被膜与cereulide在形成机制上具有类似的表现,因此研究生物被膜与cereulide二者之间形成的外在表现以及基因层面上的调控机制,对于防控食品加工过程中的蜡样芽胞杆菌所造成的风险具有重要意义。图1对前文讨论的内容进行了总结,其中cereulide调控生物被膜的形成需进行更深入的研究。
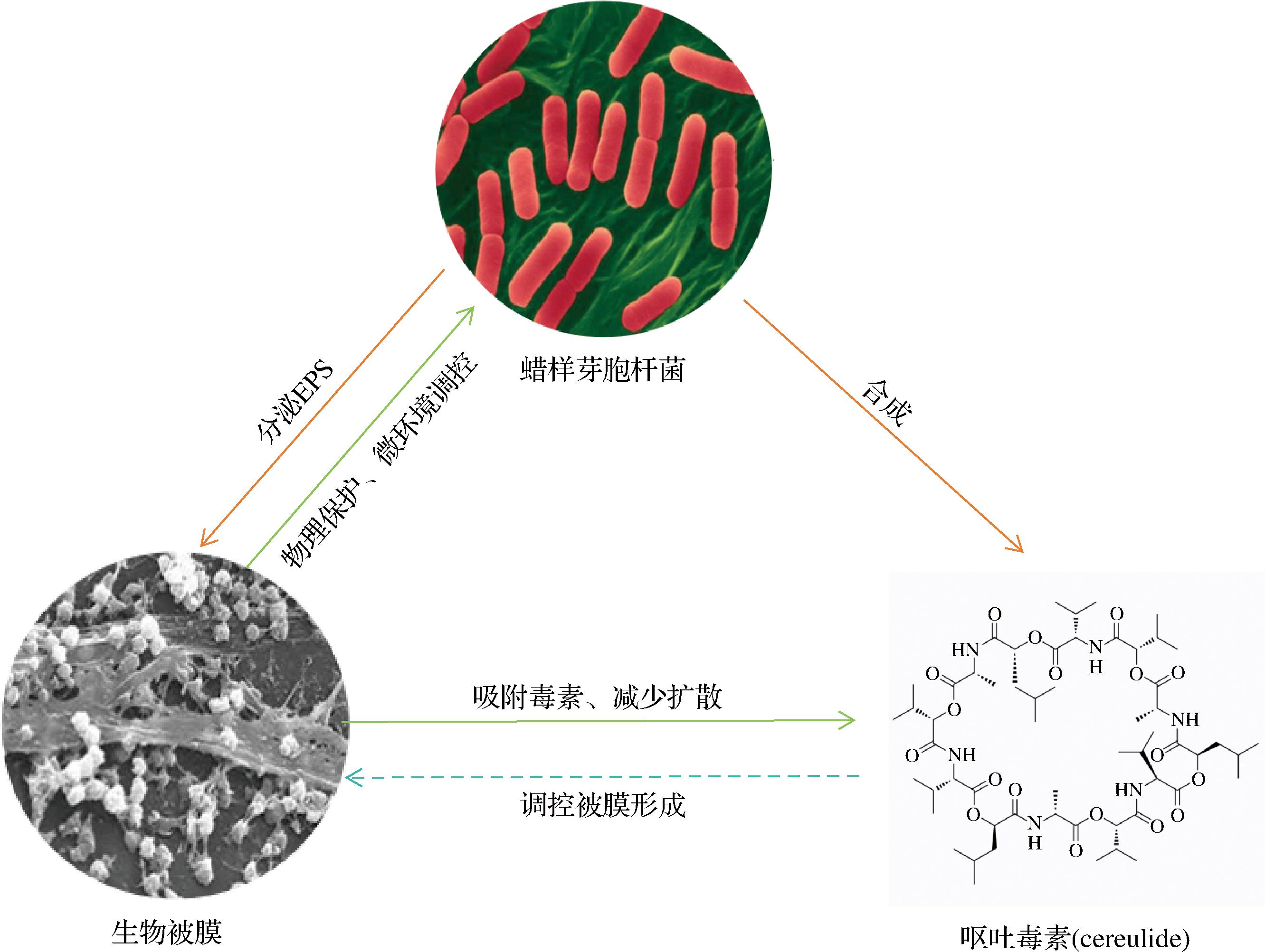
图1 呕吐型蜡样芽胞杆菌菌体、生物被膜与呕吐毒素之间关系
Fig.1 Interrelationships among vegetative cells,biofilms,and cereulide in emetic B.cereus
2 蜡样芽胞杆菌与cereulide的检测方法
2.1 蜡样芽胞杆菌的检测
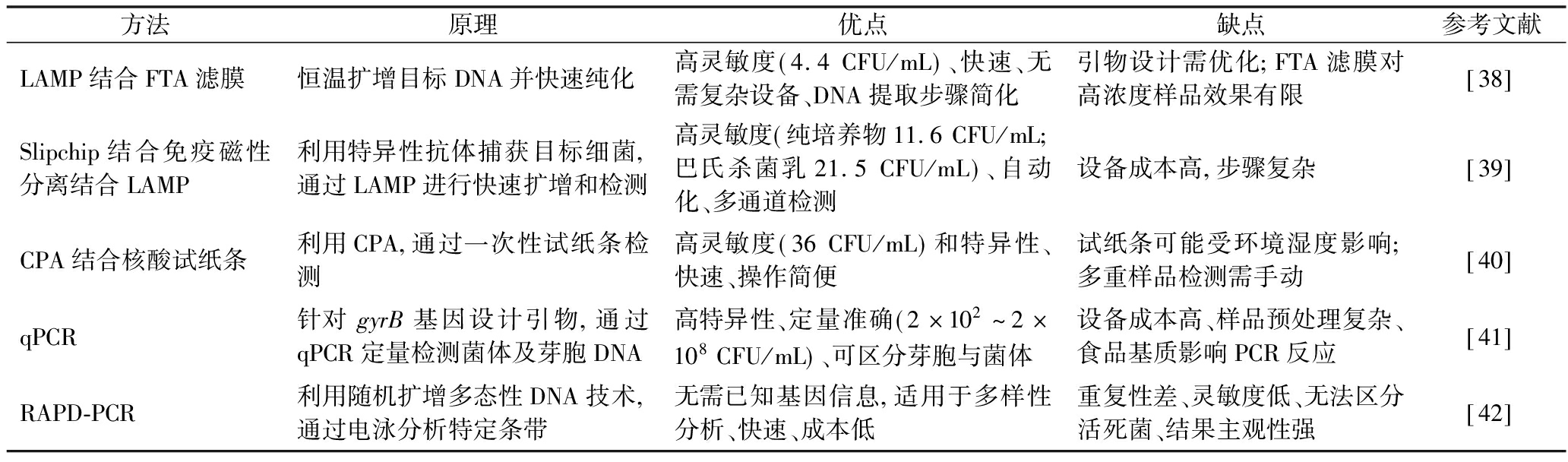
蜡样芽胞杆菌作为一种高危险性的条件致病菌,准确、高效的检测蜡样芽胞杆菌对防控由蜡样芽胞杆菌引起的食物中毒具有重要意义。表1总结了针对蜡样芽胞杆菌发展的快速检测技术,主要包括分子扩增技术或其与分离技术的联合使用。环介导等温扩增(loop-mediated isothermal amplification,LAMP)技术因高灵敏度和无需复杂设备的优势被广泛应用,结合弗林德斯技术协会(Flinders technology associates,FTA)开发的滤膜纯化DNA或集成Slipchip可实现自动化检测。交叉引物扩增(cross-priming amplification,CPA)结合核酸试纸条操作简单,通过双标记产物实现防污染检测,灵敏度达3.6×10-1 CFU/mL,但该技术依赖试纸条稳定性。实时荧光定量PCR(quantitative real-time polymerase chain reaction,qPCR)技术可靶向特异基因,具有极高的特异性与灵敏性,针对不同特异基因,可以区分蜡样芽胞杆菌菌体与芽胞或其他菌体。传统随机扩增多态性DNA结合PCR(random amplified polymorphic DNA PCR,RAPD-PCR)利用随机引物扩增,成本低但重复性差,灵敏度有限(>107 CFU/g)。相比于GB 4789.14—2014《食品安全国家标准 食品微生物学检验 蜡样芽胞杆菌检验》提供的蜡样芽胞杆菌检验方法,分子扩增技术具有更高的灵敏度及更短的检测时间。每种检测方法优缺点不一,应从实际出发,充分利用不同检测方法的优势。
表1 蜡样芽胞杆菌快速检测方法
Table 1 Rapid detection method for B.cereus
方法原理优点缺点参考文献LAMP结合FTA滤膜恒温扩增目标DNA并快速纯化高灵敏度 4.4CFU/mL 、快速、无需复杂设备、DNA提取步骤简化引物设计需优化 FTA滤膜对高浓度样品效果有限 38 Slipchip结合免疫磁性分离结合LAMP利用特异性抗体捕获目标细菌 通过LAMP进行快速扩增和检测高灵敏度 纯培养物11.6CFU/mL 巴氏杀菌乳21.5CFU/mL 、自动化、多通道检测设备成本高 步骤复杂 39 CPA结合核酸试纸条利用CPA 通过一次性试纸条检测高灵敏度 36CFU/mL 和特异性、快速、操作简便试纸条可能受环境湿度影响 多重样品检测需手动 40 qPCR针对gyrB基因设计引物 通过qPCR定量检测菌体及芽胞DNA高特异性、定量准确 2×102~2×108CFU/mL 、可区分芽胞与菌体设备成本高、样品预处理复杂、食品基质影响PCR反应 41 RAPD-PCR利用随机扩增多态性DNA技术 通过电泳分析特定条带无需已知基因信息 适用于多样性分析、快速、成本低重复性差、灵敏度低、无法区分活死菌、结果主观性强 42
2.2 蜡样芽胞杆菌cereulide的检测
蜡样芽胞杆菌cereulide的检测可分为检测产毒菌株和直接检测cereulide两大类。产cereulide的菌株可通过PMA-qPCR技术,针对cereulide合成基因(ces基因簇),实现高灵敏鉴定,排除死菌干扰。全基因组测序和基质辅助激光解吸电离飞行时间质谱分别可以从基因组和蛋白质谱层面提供全面分析,但成本较高且依赖数据库。关于蜡样芽胞杆菌cereulide的检测方法,表2进行了总结。其中动物实验与细胞实验无法直接定量毒素且费用和实验要求高,不适合大面积推广。液相色谱-质谱联用技术被认为是cereulide检测和定量的金标准,使用的最多,且灵敏准确,但该方法前处理步骤复杂。胶束电动色谱(micellar electrokinetic chromatography,MEKC)技术利用cereulide的疏水性,通过电场驱动分离,紫外检测器定量,但其灵敏度低于质谱。荧光传感器基于cereulide与K+的特异性结合,具有更宽的线性范围(0.02~40 μg/mL),可检测实际样品如大米中的cereulide,但未验证高蛋白或高脂肪食品中的性能。综上,cereulide的检测发展方向为注重定量、准确性、高效性,后续cereulide检测发展也应当以此趋势为目标,进一步推动其在食品工业和临床诊断中的应用,解决传统方法耗时长、依赖设备的痛点。
表2 蜡样芽胞杆菌cereulide的检测方法
Table 2 Method for detection of cereulide from B.cereus

方法原理优点缺点参考文献动物实验通过动物呕吐反应或肝细胞毒性判断毒素存在可直观反映毒素生物活性伦理争议、成本高昂、半定量、灵敏度低 43 细胞实验利用HEp-2细胞空泡化或猪精子运动抑制检测毒素经济简便 可模拟毒素生物效应半定量、耗时久、易受其他毒素干扰 43 液相色谱-质谱联用技术 LC-MS/MS、HPLC-MS 液相色谱分离+质谱电离 通过特征离子峰定量毒素检验金标准、灵敏度高、可定量设备昂贵、前处理复杂 44 MEKCMEKC分离疏水性分子 紫外检测定量无需复杂设备、分离效率高、检测范围适中 2~30ng/mL 灵敏度低于质谱、应用范围窄 45 荧光传感器基于cereulide特异结合K+ 使用荧光探针检测高灵敏度 0.01μg/mL 、宽线性范围 0.02~40μg/mL 、均相检测、双重验证、稳定性环境条件敏感、复杂基质干扰、前处理复杂 46
3 蜡样芽胞杆菌生物被膜与cereulide的清除
3.1 生物被膜清除
用于清除生物被膜的策略通常分为3种:1)EPS破坏;2)通过影响群体感应诱导生物被膜破坏;3)杀死生物被膜内的持久性细胞。当前研究表明,蜡样芽胞杆菌缺乏与介导生物被膜发育的群体感应分子相关的信息。由于细菌被生物被膜基质很好地保护,直接杀死生物被膜内细胞的效率很低[47]。因此,EPS破坏是蜡样芽胞杆菌生物被膜清除的重要途径,EPS的存在会阻碍化学试剂的渗透,使其不容易到达靶细胞,并且会减轻剪切力的作用[48]。德国有研究针对蜡样芽胞杆菌的消毒手段,使用基于两性表面活性剂和过氧乙酸的消毒剂进行处理,2种消毒剂通过杀灭蜡样芽胞杆菌的孢子来减少生物被膜的生成,实验证明,含过氧乙酸的消毒剂可将菌株数量从初始的28%降到3%,含两性表面活性剂消毒剂则从33%降至21%,含过氧乙酸消毒剂的消毒效率高于含两性表面活性剂的消毒剂,过氧乙酸消毒剂的有效性在高蛋白负荷下轻微受损,在低温下完全不受损,而两性表面活性剂在高蛋白负荷和低温下的有效性显著降低[49]。
近年来,酶制剂去除生物被膜研究逐渐深入,酶制剂与底物的结合具有高度专一性,且酶制剂具有高效、专一、无污染等优势。由于蜡样芽胞杆菌菌株的多样性,经酶处理的生物被膜的反应各不相同,可以被抑制、消除,甚至增强。先前研究显示,在ATCC10987、BC72、BC4、BC10等菌株产生的生物被膜中使用了不同类型的针对多糖、环境DNA和蛋白质的酶。在多糖降解酶中,纤维素酶、淀粉葡萄糖苷酶和α-淀粉酶可有效抑制BC4生物被膜。然而,只有纤维素酶和淀粉葡萄糖苷酶分别能够抑制ATCC10987和BC72生物被膜的产生,而在BC10中,使用这些酶处理均未观察到抑制作用。并且在BC10中,淀粉葡萄糖苷酶和纤维素酶的存在使生物被膜的形成增强,而在α-淀粉酶处理下,ATCC10987生物被膜的形成也得到了增强[50]。除了单独酶处理之外,应用酶与化学物质的结合对蜡样芽胞杆菌生物被膜的去除也得到了应用,并已被证明比单一酶、混合酶或化学物质的单独处理更有效。将丝氨酸蛋白酶、纤维素酶和半纤维素酶以及α-淀粉酶分别与阴离子表面活性剂结合,去除不锈钢表面肉类或脱脂牛奶中形成的生物被膜。结果表明,联合处理可使肉中和脱脂牛奶中的BC98/4细胞分别去除2.25 lg CFU/cm2和1.32 lg CFU/cm2。此外,在肉类中,相对于对照组结果,胞外多糖的清除量为对照组的14.6倍,在脱脂牛奶中是对照组的2.67倍。与NaOH处理相比,使用0.05%和0.5%NaOH降低贴壁细胞和胞外多糖质量的效果低于酶处理,说明酶与阴离子表面活性剂结合是减少BC98/4生物被膜的最有效方法[51]。
综上所述,使用酶去除蜡样芽胞杆菌生物被膜的研究十分有限,且针对于呕吐型蜡样芽胞杆菌的生物被膜的清除方法还未得到深入的研究,并且在蜡样芽胞杆菌清除后的cereulide变化未进行深入探究,因此,开发对于呕吐型蜡样芽胞杆菌生物被膜的清除方法对于减轻蜡样芽胞杆菌造成的食源性危害,提高食品安全水平是非常必要的。
3.2 Cereulide清除
Cereulide因其稳定性、耐受性强,使用常规的手段无法进行清除。一般从三方面入手清除cereulide:1)抑制毒素形成;2)物理化学清除;3)生物防治与综合防控。乳糖被证实可通过调控蜡样芽胞杆菌的代谢途径显著抑制cereulide的合成[52],直接添加至食品(如谷物、乳制品)中可降低毒素生成量,且成本低、安全性高。长链多磷酸盐通过螯合阳离子、抑制ces基因转录及干扰关键调控通路,选择性阻断cereulide的生物合成[53]。通过两步层析结合,在单克隆抗体生产过程中可高效清除cereulide[54],这对cereulide的清除方法可提供参考。Cereulide的清除仍需要进一步研究,未来可基于抑制cereulide合成的关键酶非核糖体肽合成酶(nonribosomal peptide synthetase,NRPS),通过开发针对NRPS的特异性抑制剂或肽酶降解技术,高效特异的对cereulide进行清除。
4 结论与展望
蜡样芽胞杆菌由于其孢子和生物被膜的存在,更容易在食品加工环境中持留,造成持续性污染。呕吐型蜡样芽胞杆菌产生的cereulide由于其高耐受性、致病能力易导致严重临床症状。目前,关于蜡样芽胞杆菌生物被膜和cereulide的形成规律研究已有初步进展,主要研究是从环境因素影响、基因调控方面出发,但关于生物被膜与cereulide二者之间联系的研究尚不够深入。目前,蜡样芽胞杆菌及其cereulide的检测方法呈现出多元化发展,除传统方法GB 4789.14—2014《食品安全国家标准 食品微生物学检验 蜡样芽胞杆菌检验》外,分子生物学和免疫学方法也被应用于蜡样芽胞杆菌检测中,方法侧重点不一。基于酶制剂清除生物被膜相比于传统杀菌剂清除具有更高的效率,但使用酶对蜡样芽胞杆菌生物被膜清除研究相对较少,针对不同酶制剂作用效果具体研究不够深入。Cereulide的清除仍处于基本阶段,尚未开发出高效特异的清除手段。
针对本文总结蜡样芽胞杆菌相关内容,提出以下几点展望:1)开展关于蜡样芽胞杆菌生物被膜及其cereulide之间形成规律研究,明确生物被膜形成与毒素合成的关联,从源头降低食源性中毒风险;2)以多技术整合为基础,开发更迅速、灵敏、低成本检测蜡样芽胞杆菌与cereulide技术,兼顾快速、灵敏与现场检测需求;3)深入探究酶制剂及酶与其他试剂结合清除生物被膜方法,开发更高效特异性清除cereulide方法,减轻蜡样芽胞杆菌食源性危害。
[1] YANG S,WANG Y T,LIU Y T,et al.Cereulide and emetic Bacillus cereus:Characterizations,impacts and public precautions[J].Foods,2023,12(4):833.
[2] JOVANOVIC J,ORNELIS V F M,MADDER A,et al.Bacillus cereus food intoxication and toxicoinfection[J].Comprehensive Reviews in Food Science and Food Safety,2021,20(4):3719-3761.
[3] RODRIGO D,ROSELL C M,MARTINEZ A.Risk of Bacillus cereus in relation to rice and derivatives[J].Foods,2021,10(2):302.
[4] LI Y M,WANG M,LI Y Q,et al.Two novel antimicrobial peptides against vegetative cells,spores and biofilm of Bacillus cereus[J].Food Control,2023,149:109688.
[5] LIU Y,GE W W,SUN Y X,et al.Unraveling the ecological interactions between dairy strains Bacillus licheniformis and Bacillus cereus during the dual-species biofilm formation[J].Food Microbiology,2025,128:104716.
[6] MENG J N,LIU Y J,SHEN X,et al.Detection of emetic Bacillus cereus and the emetic toxin cereulide in food matrices:Progress and perspectives[J].Trends in Food Science &Technology,2022,123:322-333.
[7] YUAN L,MATSUDA A,ABDELAZIZ M N S,et al.Effects of EGCg and theaflavins on emetic toxin-producing Bacillus cereus in vitro[J].European Food Research and Technology,2024,250(12):2949-2959.
[8] KRANZLER M,WALSER V,STARK T D,et al.A poisonous cocktail:Interplay of cereulide toxin and its structural isomers in emetic Bacillus cereus[J].Frontiers in Cellular and Infection Microbiology,2024,14:1337952.
[9] THERY M,COUSIN V L,TISSIERES P,et al.Multi-organ failure caused by lasagnas:A case report of Bacillus cereus food poisoning[J].Frontiers in Pediatrics,2022,10:978250.
[10] YANG Y,FOSTER J T,YI M,et al.Phenotypic homogeneity of emetic Bacillus cereus isolates in China[J].Letters in Applied Microbiology,2021,73(5):646-651.
[11] LI D Y,LIN R Q,XU Y Y,et al.Cereulide exposure caused cytopathogenic damages of liver and kidney in mice[J].International Journal of Molecular Sciences,2021,22(17):9148.
[12] YANG S,WANG Y T,REN F C,et al.Applying enzyme treatments in Bacillus cereus biofilm removal[J].LWT,2023,180:114667.
[13] HUSSAIN M S,TANGO C N,OH D H.Inactivation kinetics of slightly acidic electrolyzed water combined with benzalkonium chloride and mild heat treatment on vegetative cells,spores,and biofilms of Bacillus cereus[J].Food Research International,2019,116:157-167.
[14] PARKAR S G,FLINT S H,BROOKS J D.Evaluation of the effect of cleaning regimes on biofilms of thermophilic bacilli on stainless steel[J].Journal of Applied Microbiology,2004,96(1):110-116.
[15] HWANG D,OH T Y,BAEK S Y,et al.Enterotoxin genes,biofilm formation,and antimicrobial and disinfectant resistance of Bacillus cereus isolates from primary producing stages[J].Food Control,2022,141:109196.
[16] HUSSAIN M S,KWON M,OH D H.Impact of manganese and heme on biofilm formation of Bacillus cereus food isolates[J].PLoS One,2018,13(7):e0200958.
[17] ZHOU J W,WU Y H,LIU D H,et al.The effect of carbon source and temperature on the formation and growth of Bacillus licheniformis and Bacillus cereus biofilms[J].LWT,2023,186:115239.
[18] 马悦,吴谦,吴希阳,等.培养条件及接触材料对大米中蜡样芽孢杆菌生物被膜形成的影响[J].食品与发酵工业,2015,41(12):64-69.MA Y,WU Q,WU X Y,et al.Effects of culture condition and contact surface on formation of Bacillus cereus biofilm from rice[J].Food and Fermentation Industries,2015,41(12):64-69.
[19] KWON M,HUSSAIN M S,OH D H.Biofilm formation of Bacillus cereus under food-processing-related conditions[J].Food Science and Biotechnology,2017,26(4):1103-1111.
[20] LEONG S S,KOREL F,KING J H.Bacillus cereus:A review of “fried rice syndrome” causative agents[J].Microbial Pathogenesis,2023,185:106418.
[21] ELLOUZE M,BUSS DA SILVA N,ROUZEAU-SZYNALSKI K,et al.Modeling Bacillus cereus growth and cereulide formation in cereal-,dairy-,meat-,vegetable-based food and culture medium[J].Frontiers in Microbiology,2021,12:639546.
[22] TORII T,OHKUBO Y.Distribution of cereulide-producing Bacillus cereus in raw milk in Hokkaido,Japan,and evaluation of cereulide production[J].International Dairy Journal,2023,144:105693.
[23] J
 SKEL
SKEL INEN E L,H
INEN E L,H GGBLOM M M,ANDERSSON M A,et al.Potential of Bacillus cereus for producing an emetic toxin,cereulide,in bakery products:Quantitative analysis by chemical and biological methods[J].Journal of Food Protection,2003,66(6):1047-1054.
GGBLOM M M,ANDERSSON M A,et al.Potential of Bacillus cereus for producing an emetic toxin,cereulide,in bakery products:Quantitative analysis by chemical and biological methods[J].Journal of Food Protection,2003,66(6):1047-1054.
[24] DOMMEL M K,FRENZEL E,STRASSER B,et al.Identification of the main promoter directing cereulide biosynthesis in emetic Bacillus cereus and its application for real-time monitoring of ces gene expression in foods[J].Applied and Environmental Microbiology,2010,76(4):1232-1240.
[25] DOMMEL M K,LÜCKING G,SCHERER S,et al.Transcriptional kinetic analyses of cereulide synthetase genes with respect to growth,sporulation and emetic toxin production in Bacillus cereus[J].Food Microbiology,2011,28(2):284-290.
[26] AGATA N,OHTA M,MORI M,et al.Growth conditions of and emetic toxin production by Bacillus cereus in a defined medium with amino acids[J].Microbiology and Immunology,1999,43(1):15-18.
[27] TIAN S,XIONG H R,GENG P L,et al.CesH represses cereulide synthesis as an alpha/beta fold hydrolase in Bacillus cereus[J].Toxins,2019,11(4):231.
[28] J
 SKEL
SKEL INEN E L,H
INEN E L,H GGBLOM M M,ANDERSSON M A,et al.Atmospheric oxygen and other conditions affecting the production of cereulide by Bacillus cereus in food[J].International Journal of Food Microbiology,2004,96(1):75-83.
GGBLOM M M,ANDERSSON M A,et al.Atmospheric oxygen and other conditions affecting the production of cereulide by Bacillus cereus in food[J].International Journal of Food Microbiology,2004,96(1):75-83.
[29] APETROAIE-CONSTANTIN C,SHAHEEN R,ANDRUP L,et al.Environment driven cereulide production by emetic strains of Bacillus cereus[J].International Journal of Food Microbiology,2008,127(1-2):60-67.
[30] RAJKOVIC A,UYTTENDAELE M,DELEY W,et al.Dynamics of boar semen motility inhibition as a semi-quantitative measurement of Bacillus cereus emetic toxin (cereulide)[J].Journal of Microbiological Methods,2006,65(3):525-534.
[31] TRAN S L,CORMONTAGNE D,VIDIC J,et al.Structural modeling of cell wall peptidase CwpFM (EntFM) reveals distinct intrinsically disordered extensions specific to pathogenic Bacillus cereus strains[J].Toxins,2020,12(9):593.
[32] LIU J Y,JIA J J,LIU M,et al.A novel indolylbenzoquinone compound HL-J6 suppresses biofilm formation and α-toxin secretion in methicillin-resistant Staphylococcus aureus[J].International Journal of Antimicrobial Agents,2023,62(5):106972.
[33] MILLER M B,BASSLER B L.Quorum sensing in bacteria[J].Annual Review of Microbiology,2001,55:165-199.
[34] 邓杰,尚楠.芽孢杆菌群体感应系统研究进展[J].生物加工过程,2024,22(5):492-499.DENG J,SHANG N.Research progress on the quorum sensing system of Bacillus[J].Chinese Journal of Bioprocess Engineering,2024,22(5):492-499.
[35] KOBAYASHI K,IKEMOTO Y.Biofilm-associated toxin and extracellular protease cooperatively suppress competitors in Bacillus subtilis biofilms[J].PLoS Genetics,2019,15(10):e1008232.
[36] PARK E J,HUSSAIN M S,WEI S,et al.Genotypic and phenotypic characteristics of biofilm formation of emetic toxin producing Bacillus cereus strains[J].Food Control,2019,96:527-534.
[37] FRENZEL E,DOLL V,PAUTHNER M,et al.CodY orchestrates the expression of virulence determinants in emetic Bacillus cereus by impacting key regulatory circuits[J].Molecular Microbiology,2012,85(1):67-88.
[38] QI Z,ZHANG W,YUAN Y W,et al.Rapid detection of Bacillus cereus in pasteurized milk using loop-mediated isothermal amplification method and FTA filtering technique[J].Journal of Biotechnology,2008,136:S51-S52.
[39] LI X L,WANG S Y,ZHAI Z Y,et al.Slipchip-based immunomagnetic separation combined with loop-mediated isothermal amplification for rapid detection of Bacillus cereus with tetracycline resistance gene tetL in pasteurized milk[J].Food Control,2022,140:109122.
[40] ZHANG J,DI B,SHAN H B,et al.Rapid detection of Bacillus cereus using cross-priming amplification[J].Journal of Food Protection,2019,82(10):1744-1750.
[41] LIANG L J,WANG P,QU T M,et al.Detection and quantification of Bacillus cereus and its spores in raw milk by qPCR,and distinguish Bacillus cereus from other bacteria of the genus Bacillus[J].Food Quality and Safety,2022,610.1093:fqsafe.
[42] CALVIGIONI M,CARA A,CELANDRONI F,et al.Characterization of a Bacillus cereus strain associated with a large feed-related outbreak of severe infection in pigs[J].Journal of Applied Microbiology,2022,133(2):1078-1088.
[43] AGATA N,MORI M,OHTA M,et al.A novel dodecadepsipeptide,cereulide,isolated from Bacillus cereus causes vacuole formation in HEp-2 cells[J].FEMS Microbiology Letters,1994,121(1):31-34.
[44] WANG Y T,LIU Y T,YANG S,et al.Effect of temperature,pH,and aw on cereulide synthesis and regulator genes transcription with respect to Bacillus cereus growth and cereulide production[J].Toxins,2024,16(1):32.
[45] OH M H,COX J M.Quantitative analysis of the Bacillus cereus emetic toxin,cereulide,using micellar electrokinetic chromatography‐capillary electrophoresis[J].Journal of Food Safety,2010,30(3):652-665.
[46] MENG J N,SHEN H R,LUO L,et al.Engineered DNAzyme enables homogeneous detection of cereulide via polychromic fluorescence modality[J].Analytical Chemistry,2023,95(37):14135-14142.
[47] BYUN K H,KANG M,KOO M S,et al.Potential risk of biofilm-forming Bacillus cereus group in fresh-cut lettuce production chain[J].Food Research International,2024,191:114692.
[48] REN F C,CHEN Y H,YANG S,et al.Characterization of emetic Bacillus cereus biofilm formation and cereulide production in biofilm[J].Food Research International,2024,192:114834.
[49] ERNST C,SCHULENBURG J,JAKOB P,et al.Efficacy of amphoteric surfactant-and peracetic acid-based disinfectants on spores of Bacillus cereus in vitro and on food premises of the German armed forces[J].Journal of Food Protection,2006,69(7):1605-1610.
[50] LIM E S,BAEK S Y,OH T,et al.Strain variation in Bacillus cereus biofilms and their susceptibility to extracellular matrix-degrading enzymes[J].PLoS One,2021,16(6):e0245708.
[51] LEQUETTE Y,BOELS G,CLARISSE M,et al.Using enzymes to remove biofilms of bacterial isolates sampled in the food-industry[J].Biofouling,2010,26(4):421-431.
[52] ZHENG Y,XU W X,GUO H,et al.The potential of lactose to inhibit cereulide biosynthesis of emetic Bacillus cereus in milk[J].International Journal of Food Microbiology,2024,411:110517.
[53] FRENZEL E,LETZEL T,SCHERER S,et al.Inhibition of cereulide toxin synthesis by emetic Bacillus cereus via long-chain polyphosphates[J].Applied and Environmental Microbiology,2011,77(4):1475-1482.
[54] WETTERHALL M,GRÖNBERG A,GRÖNLUND S,et al.Removal of B.cereus cereulide toxin from monoclonal antibody bioprocess feed via two-step protein A affinity and multimodal chromatography[J].Journal of Chromatography B,Analytical Technologies in the Biomedical and Life Sciences,2019,1118-1119:194-202.