赤藓糖醇作为四碳线性多元醇类甜味剂(图1),具有低热量与高耐受性特性,天然存在于葡萄、蘑菇及酱油等发酵食品中[1-2]。其甜度达蔗糖的70%~90%,常与甜菊糖苷复配以中和异味,高溶解热特性还可赋予食品清凉口感[3-4]。赤藓糖醇作为一种糖替代品,约90%摄入量经肾脏快速排出,不参与能量代谢且不引起人体血糖变化,但单次超过35 g(安全剂量0.6~0.8 g/kg)可能引发腹泻等不适[5-6]。此外,赤藓糖醇能抑制口腔致龋菌黏附,降低蛀牙风险[7]。
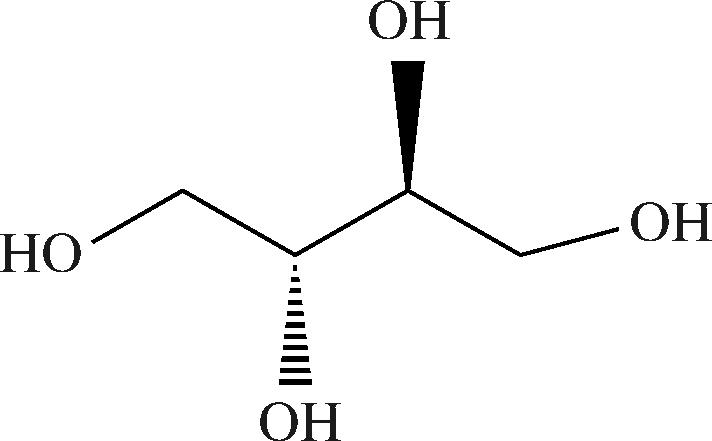
图1 赤藓糖醇分子结构式
Fig.1 Molecular structure formula of erythritol
虽然赤藓糖醇有诸多优点,但其生产成本相较于木糖醇、山梨糖醇和麦芽糖醇等甜味剂相对较高,导致赤藓糖醇的使用量和知名度低于同类产品。因此,迫切需要优化生产工艺来降低成本,同时提升赤藓糖醇的纯度、生产效率和总产量。本文重点对发酵菌种改良、发酵培养基组成、发酵工艺的选择进行了总结,通过整合和比较分析,剖析现有技术的不足,利用发酵菌种代谢途径和发酵工艺的相关理论知识,提出改进方法,以期为降低食品工业制备赤藓糖醇的成本、降低能耗、提高产品纯度,提供参考。
1 微生物发酵法的研究现状
鉴于化学合成的局限性,微生物发酵已成为赤藓糖醇生产的主要方式。酵母菌、细菌和丝状真菌已被证实可发酵生产赤藓糖醇,但细菌和丝状真菌的产量较低,因此,赤藓糖醇工业规模上的生产主要是通过酵母属对葡萄糖进行发酵生产,这些葡萄糖主要来源于酶水解后的玉米和小麦[8](图2)。已知各种酵母菌如假丝酵母属(Candida)、毕赤氏酵母属(Pichia)、念珠菌属(Moniliella)、圆酵母属(Torula)、三角酵母属(Trigonopsis)和耶氏酵母属(Yarrowia)均能利用葡萄糖发酵生产赤藓糖醇,但假丝酵母和耶氏酵母等也可利用甘油生产赤藓糖醇[9]。
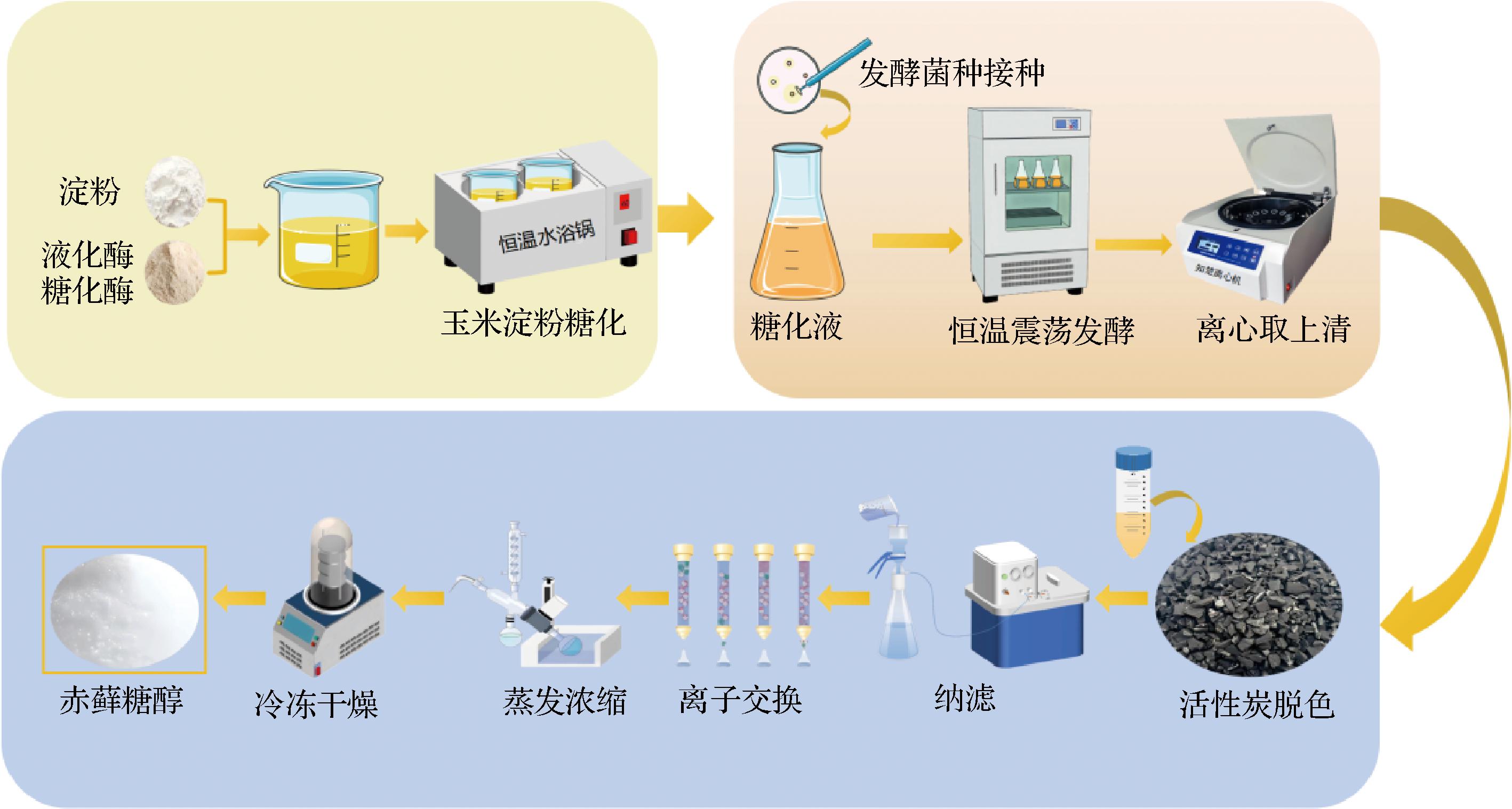
图2 赤藓糖醇生产工艺流程图
Fig.2 Flow chart of erythritol production process
1.1 酵母菌发酵生产赤藓糖醇
目前,酵母菌已经被广泛应用于合成多种化学物质。其中解脂耶氏酵母(Yarrowia lipolytica)凭借优异的生产效率、良好的安全性以及对多种底物的高适应性,已经成为工业化生产赤藓糖醇的首选菌株[10]。在酵母菌发酵生产赤藓糖醇的过程中,主要的碳源是葡萄糖和甘油[11-12]。
1.1.1 酵母菌利用葡萄糖生产赤藓糖醇
葡萄糖是生产赤藓糖醇的主要底物,其生物合成通过磷酸戊糖途径进行,包括氧化阶段生成核酮糖-5-磷酸和非氧化阶段生成赤藓糖-4-磷酸[13](图3)。赤藓糖-4-磷酸在激酶作用下转化为赤藓糖,再经还原酶作用生成赤藓糖醇[14]。RYWI SKA等[15]通过利用Y.lipolytica K1UV15对葡萄糖进行分批补料发酵,在总葡萄糖质量浓度为300 g/L、(NH4)2SO4质量浓度为3.6 g/L时,发酵150 h赤藓糖醇质量浓度到148 g/L。SUWANAPETCH等[16]采用Moniliella sp.BCC25224在200 g/L葡萄糖和13 g/L大豆粉的培养基中,摇瓶振荡发酵120 h,赤藓糖醇质量浓度达到39.3 g/L。
SKA等[15]通过利用Y.lipolytica K1UV15对葡萄糖进行分批补料发酵,在总葡萄糖质量浓度为300 g/L、(NH4)2SO4质量浓度为3.6 g/L时,发酵150 h赤藓糖醇质量浓度到148 g/L。SUWANAPETCH等[16]采用Moniliella sp.BCC25224在200 g/L葡萄糖和13 g/L大豆粉的培养基中,摇瓶振荡发酵120 h,赤藓糖醇质量浓度达到39.3 g/L。

图3 酵母中赤藓糖醇的合成途径
Fig.3 Synthesis pathway of erythritol in yeast
1.1.2 酵母菌利用甘油生产赤藓糖醇
甘油是一种较新的赤藓糖醇生产底物,也是Y.lipolytica生长代谢的理想碳源。甘油在激酶作用下生成3-磷酸甘油,随后通过甘油-3-磷酸脱氢酶和三磷酸酯异构酶转化为3-磷酸甘油醛[17-18]。部分3-磷酸甘油醛和磷酸二羟丙酮可转化为果糖-1,6-二磷酸,最终生成果糖-6-磷酸[17](图3)。在转酮酶的催化下,3-磷酸甘油醛和6-磷酸果糖一同进入磷酸戊糖途径[17]。该途径中,省略了磷酸戊糖途径的氧化阶段。此外,甘油的代谢产物可通过6-磷酸果糖转化为葡萄糖-6-磷酸,进入磷酸戊糖途径[19]。
当Y.lipolytica以甘油为底物发酵生产赤藓糖醇时,其最大浓度与以葡萄糖为碳源时产生的最高浓度相当,不过产率相对较低[20]。RYMOWICZ等[20]的研究表明,Y.lipolytica不仅能够从纯甘油中生产赤藓糖醇,还能从许多工业过程产生的废品粗甘油中生产赤藓糖醇。因此,利用粗甘油生产赤藓糖醇,不仅可以降低生产成本,同时也促进了废品的有效利用。但粗甘油的成分因来源不同而异,可能含有甲醇、盐或金属等污染物,因此赤藓糖醇的工业化生产主要采用葡萄糖作为底物。各种底物合成赤藓糖醇的途径如图3所示。
1.2 细菌发酵生产赤藓糖醇
某些细菌菌株能够通过葡萄糖发酵产生赤藓糖醇,但产量较低,通常作为发酵过程的副产物生成[21]。乳酸菌在异型乳酸发酵过程中,通过磷酸转酮酶代谢糖类,生成乙酰磷酸和3-磷酸甘油醛等中间产物,最终转化为乳酸、乙醇或乙酸(图4)[22-23]。TYLER等[24]的研究表明,乳酸菌Lactobacillus florum无需在厌氧条件下可利用葡萄糖生产2.04 g/L赤藓糖醇。
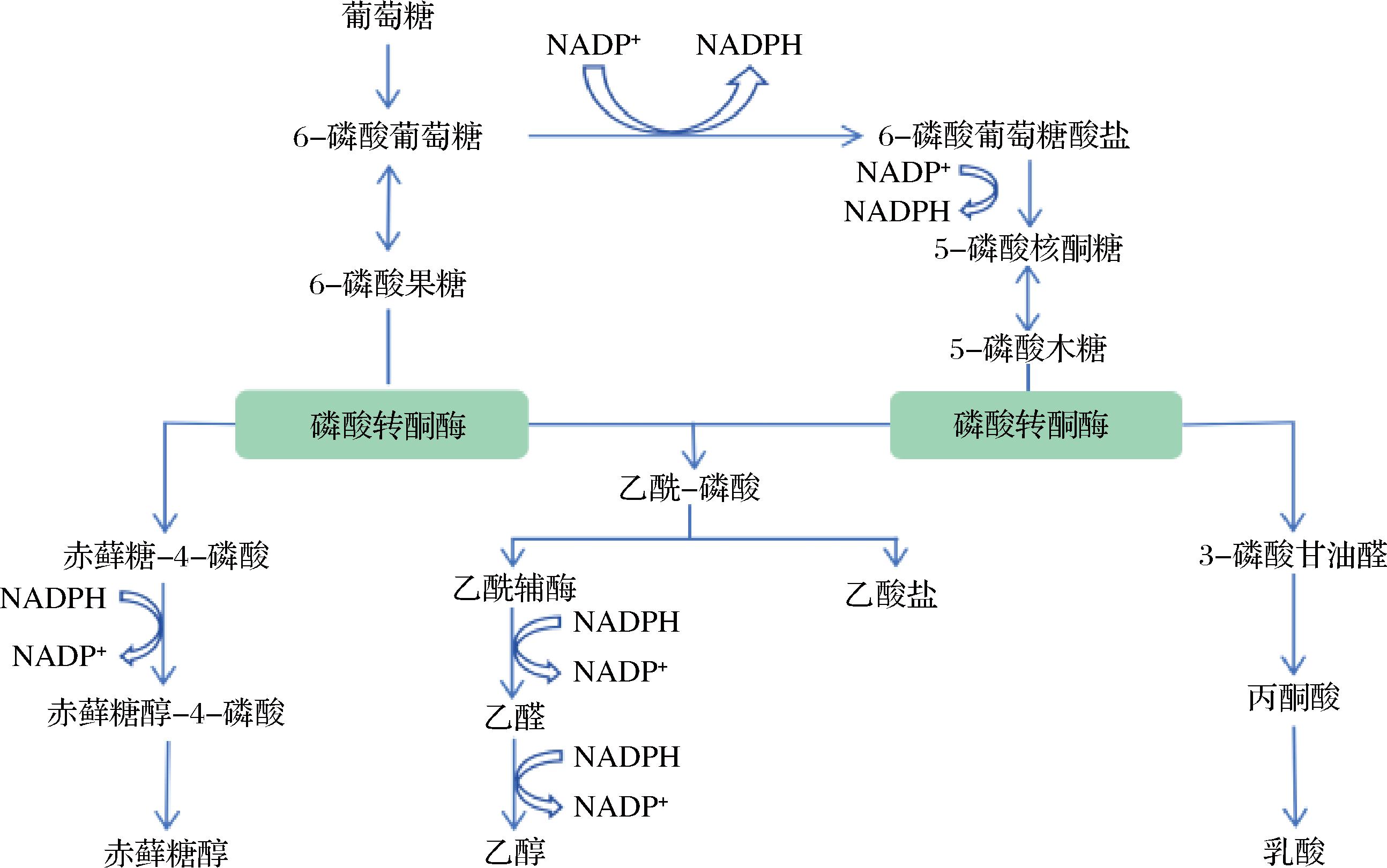
图4 细菌利用葡萄糖合成赤藓糖醇的途径[14]
Fig.4 Pathway of biosynthesis of erythritol by bacteria using glucose[14]
1.3 丝状真菌发酵生产赤藓糖醇
丝状真菌也是通过磷酸戊糖途径合成赤藓糖醇,其中4-D-赤藓糖醇磷酸盐通过脱磷酸化作用转化为赤藓糖醇[25]。虽然丝状真菌发酵生产赤藓糖醇产量不如酵母菌高,但它们能利用木质纤维素材料生长,意味着未来可以利用农业废弃物作为碳源生产赤藓糖醇[26]。ZHAO等[26]研究表明添加麦秆生物炭能有效提高固态发酵中赤藓糖醇的产量,最大累积产量可达195.9 mg/gds,而不添加生物炭对照组的赤藓糖醇产量则仅有185.4 mg/gds。WANG等[27]研究发现在Trichoderma reesei中过表达赤藓糖还原酶后,在经碱性有机溶剂预处理小麦秸秆上发酵42 h赤藓糖醇产量达到4.4 mg/mL,而未预处理的产量仅有2.1 mg/mL。通过持续优化底物选择、菌株性能、代谢通路和发酵工艺,以木质纤维素为碳源生产赤藓糖醇的方法具有很大潜力。
2 改进赤藓糖醇生产的方法
由于从葡萄糖中生产赤藓糖醇已经是一个成熟过程,因此进一步优化此过程的空间有限,并且在过去的5年中,针对该过程的研究很少。此外,考虑到葡萄糖本身作为一种价值较高的化合物,通过采用糖蜜、粗甘油、木糖母液和玉米芯等作为碳源进行发酵,有可能进一步降低赤藓糖醇生产成本。除了使用价格低廉的物质替代碳源和氮源外,还可以通过菌种改良和发酵工艺改进等方法进一步降低生产成本。
2.1 发酵菌种的改良
2.1.1 菌种的选育与诱变
在蜂蜜和花粉等高糖环境中,可筛选出具有生产赤藓糖醇能力且耐高渗的野生菌株,但从自然界筛选出的野生菌株生产效率较低,对其进行人工诱变是获得赤藓糖醇高产菌株的主要方法[28]。SAVERGAVE等[29]通过对Candida magnoliae NCIM3470进行物理和化学诱变得到突变体R23菌株,其赤藓糖醇产量达到60.3 g/L,是原菌株的4倍,赤藓糖还原酶活性是原菌株的2倍。GUO等[28]对Aureobasidium GCMCC3.0837进行紫外诱变得到突变体ER35,其从木糖中生产的赤藓糖醇的能力相较于原始菌株提高了50.92%。QIU等[30]通过紫外诱变处理Y.lipolytica BBE-18,获得突变菌yliUA8,其赤藓糖醇产量达到148 g/L,显著高于原始菌株BBE-18的43 g/L。综上所述对发酵菌种进行诱变处理后筛选高产菌株可以有效提高赤藓糖醇产量。
2.1.2 菌种代谢途径的改造
赤藓糖还原酶是生产赤藓糖醇的关键酶,其活性和对NADPH的依赖性成为赤藓糖醇生产效率的限制节点。与传统菌种改良相比,代谢工程通过定向改造代谢途径的酶基因活性提高酶活力,进而提高赤藓糖醇产量,具有缩短发酵周期和提高发酵效率等优势[31]。赵思佳等[31]的研究表明,通过表达磷酸戊糖途径中的关键酶基因(转醛酶、转酮酶、磷酸己糖异构酶、6-磷酸葡萄糖脱氢酶)能显著提高赤藓糖醇产量。因此,调控这些关键酶基因的表达对提高赤藓糖醇产量至关重要,尤其是在目标产物的限速阶段。MIRO CZUK等[32]以Y.lipolytica A101为研究对象,探讨了葡萄糖糖酵解途径中甘油激酶基因和甘油-3-磷酸脱氢酶基因对赤藓糖醇产量的影响(图5)。研究表明,通过表达甘油激酶基因可使赤藓糖醇产量增加24%。尽管单独过表达甘油-3-磷酸脱氢酶基因未提升产量,但2种基因共同表达时,赤藓糖醇总产量提高了35%[33]。
CZUK等[32]以Y.lipolytica A101为研究对象,探讨了葡萄糖糖酵解途径中甘油激酶基因和甘油-3-磷酸脱氢酶基因对赤藓糖醇产量的影响(图5)。研究表明,通过表达甘油激酶基因可使赤藓糖醇产量增加24%。尽管单独过表达甘油-3-磷酸脱氢酶基因未提升产量,但2种基因共同表达时,赤藓糖醇总产量提高了35%[33]。
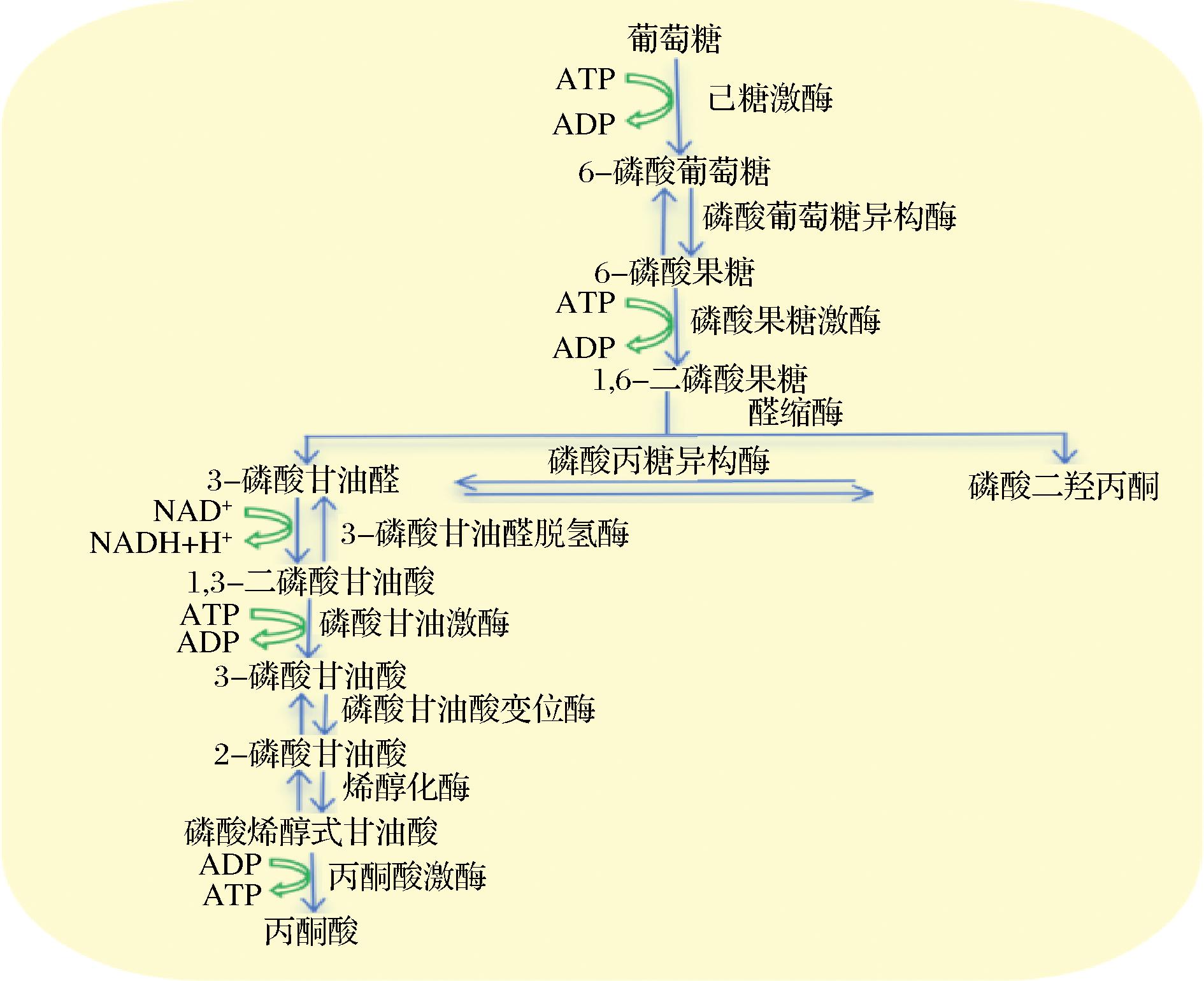
图5 葡萄糖糖酵解途径
Fig.5 Glucose glycolysis pathway
在Y.lipolytica的研究中发现[34-35],过表达磷酸戊糖途径中的转醛醇酶、葡萄糖-6-磷酸脱氢酶、6-磷酸葡萄糖酸脱氢酶或转酮醇酶等基因,可显著提升赤藓糖醇产量。MASI等[36]的研究表明,以T.reesei为研究对象,通过编码赤藓糖还原酶的err1基因的过表达,显著提高了T.reesei在纤维素或半纤维素中赤藓糖醇的产量。此外,除关键酶基因过表达外,敲除分解赤藓糖醇途径的酶基因也能提高其产量,CARLY等[11]通过敲除Y.lipolytica W29的赤藓酮糖激酶基因,使赤藓糖醇产率提高至0.49 g/g。
综上所述,代谢途径改造是提升微生物发酵法生产赤藓糖醇产量的有效方法。然而,目前研究多集中于低产菌株,对工业菌种的改造较少。未来可将此方法应用于工业菌种,以提高赤藓糖醇的工业化产量。
2.2 发酵培养基的改进
2.2.1 使用廉价碳源
在赤藓糖醇产业化生产过程中,最常使用的底物为葡萄糖,其发酵效果良好,但价格较高且副产物较多。因此,目前普遍采用的策略是通过利用替代发酵底物以进一步降低生产成本。现有的研究已经尝试使用粗甘油、木糖母液、糖蜜、废弃食用油等替代葡萄糖生产赤藓糖醇。其中,粗甘油、糖蜜是葡萄糖碳源替代物的研究热点。
粗甘油是生物柴油工业的副产品,将其用于发酵生产赤藓糖醇不仅能降低成本,还能解决废弃物处理问题[37]。目前,Y.lipolytica是粗甘油生产赤藓糖醇的常用菌株,而Moniliella megachiliensis也能将粗甘油转化为赤藓糖醇[38]。
糖蜜作为成本低廉的制糖工业副产物,已有研究探讨将其用作赤藓糖醇生产的碳源。SESHADRINATHAN等[39]研究发现,在Candida magnoliae的作用下,将糖蜜(273.96 g/L)、酵母膏(10.25 g/L)和KH2PO4(3.28 g/L)添加到培养基中时,赤藓糖醇的产量为99.54 g/L,纯度达到94%。其主要副产物为甘油(占比5.4%),其次是微量的蔗糖和甘露醇。
木糖也被视为赤藓糖醇微生物发酵生产过程中的潜在底物。GUO等[28]研究发现经过紫外线诱变处理的Aureobasidium pulluans GCMCC3.0837变异株ER35,能够以木糖为底物生产藓糖醇,其产量达到31.75 g/L,生产率为0.22 g/(L·h)。虽然木糖作为发酵底物生产赤藓糖醇的产量低于葡萄糖和甘油,但通过进一步优化木糖的发酵过程,有望利用含木糖的玉米芯、木糖母液等,实现成本效益更高的赤藓糖醇生产。
废弃食用油是Y.lipolytica发酵生产赤藓糖醇的一种廉价替代碳源,但不溶于水限制了其进一步利用。LIU等[40]研究结果表明,使用丝瓜海绵作为物理分散剂加入到油基培养基中,取代传统的化学乳化剂,实现了赤藓糖醇培养的高效底物分散。此外,通过扩大规模和分批料培养,2种培养策略联合使用时,赤藓糖醇的产量可达114.3 g/L。
综上所述,利用粗甘油、糖蜜、废弃食用油和木糖母液等低成本工业副产品作为碳源生产赤藓糖醇,不仅能够降低生产成本、提高资源利用率,还为废弃物处理提供了可持续的解决方案。但粗甘油、废弃食用油和木糖母液化学成分复杂且来源有限。我国制糖工业、淀粉加工等行业每年都产生大量副产物糖蜜,利用糖蜜发酵生产赤藓糖醇,不仅符合绿色生产,还能有效降低其生产成本。
2.2.2 使用廉价氮源
氮源的种类和浓度显著影响赤藓糖醇产量,因此优化不同菌株的最佳氮源类型及添加量对实现高产至关重要[37]。贾伟[41]以丛梗孢酵母为菌株,研究不同氮源如酵母膏、玉米浆、大豆粉、硫酸铵和干酪素对赤藓糖醇产量的影响,发现酵母膏作为氮源时产量最高,可达57.91 g/L,其次是玉米浆作为氮源时产量为29.60 g/L。RAKICKA等[34]比较了Y.lipolytica Wratislavia K1菌株利用有机氮源和无机氮源合成赤藓糖醇的效果,发现添加4.6 g/L硫酸铵时,赤藓糖醇质量浓度最高可达103.4 g/L。LEE等[42]研究发现,以玉米浆粉和酵母膏混合物为氮源时,Pseudozyma tsukubaensis和Moniliella sp.的赤藓糖醇产量最高,达245 g/L。以上研究表明,硫酸铵、酵母膏和玉米浆均能提高赤藓糖醇产量,但综合考虑成本与产量等因素,玉米浆更适合工业生产,因其价格低廉且来源广泛。此外,玉米浆作为高浓度酸性有机废水,处理难度大且成本高,直接排放不仅浪费资源,还会对环境造成严重污染[43]。玉米浆的处理已成为玉米淀粉加工企业副产物处理中最棘手的问题[44]。因此利用玉米浆生产赤藓糖醇,可以节约成本、减少污染,有助于企业朝着高效、节能、绿色发展的方向迈进,也为玉米深加工产业的可持续发展提供不竭动力。
2.2.3 补充营养物质
在赤藓糖醇生产过程中,除了基本的培养基成分,矿物质、维生素、无机盐等的添加也对生产效率有显著影响。补充矿物质对于提高葡萄糖或甘油生产赤藓糖醇的效率具有显著作用。TOMASZEWSKA-HETMAN等[45]研究发现,在Y.lipolytica从甘油中生物合成赤藓糖醇的过程中,添加Mn2+、Cu2+可以显著提升其生产效率。在添加25 mg/L Mn2+时赤藓糖醇产量增加14.5%,而添加2.5 mg/L Cu2+时可加快发酵速率,提高生产率。JANEK等[46]的研究表明,Y.lipolytica对Fe2+和Zn2+具有很高的耐受性,这一点对其在粗甘油中的生长至关重要。适量的Zn2+,如添加0.25 mmol ZnSO4,能够显著提高赤藓糖醇产量37%,并对赤藓糖还原酶的活性有积极影响。这些发现强调了在赤藓糖醇生产中适当添加矿物质的重要性。
RYWI SKA等[47]研究发现,在Torula sp.和Y.lipolytica将葡萄糖和甘油转化为赤藓糖醇的过程中,适当增加硫胺素含量能显著提升其产量。酵母膏是硫胺素的良好来源,微生物培养中添加少量的酵母膏(1 g/L)可以满足对硫胺素的需求[48]。
SKA等[47]研究发现,在Torula sp.和Y.lipolytica将葡萄糖和甘油转化为赤藓糖醇的过程中,适当增加硫胺素含量能显著提升其产量。酵母膏是硫胺素的良好来源,微生物培养中添加少量的酵母膏(1 g/L)可以满足对硫胺素的需求[48]。
添加少量无机盐也能提高赤藓糖醇的产量,尤其是在补充KH2PO4时,可以显著提高赤藓糖醇产量[39]。在Torula sp.的摇瓶实验中得到了验证,赤藓糖醇质量浓度从原来的46.3 g/L提高到56.6 g/L。
综上所述,在赤藓糖醇的生产过程中,合理补充矿物质、维生素以及无机盐能够显著提高产量和生产效率,这表明优化培养基成分是提升赤藓糖醇生物合成效率的重要策略。
2.3 发酵工艺的改进
2.3.1 调节渗透压
渗透压是影响赤藓糖醇生产的关键因素之一。在培养基中,葡萄糖和甘油的存在可显著提升渗透压。含有300 g/L甘油的培养基渗透压为3.17 Osmol/kg,而使用相同浓度葡萄糖的培养基的渗透压仅为1.6 Osmol/kg[49]。YANG等[50]的研究表明,渗透压的提高能够有效增加赤藓糖醇的产量,同时降低副产物的生成。然而,过高的渗透压会导致酵母生长迟滞期的延长,进而影响赤藓糖醇的生产效率。因此,在发酵过程中,可通过发酵过程监测,在发酵初期渗透压不宜过高,赤藓糖醇合成阶段可以适当提高,发酵后期则根据菌体生长状态和赤藓糖醇合成情况灵活调整,以维持菌体稳定性和产物质量。
通过采用更为复杂的发酵工艺有可能将其渗透压控制在适宜的范围。YANG等[50]提出了一种两阶段渗透压控制技术,这种方法被用于Y.lipolytica的甘油分批补料发酵过程中。初始渗透压为4.25 Osmol/kg,通过补充甘油,在发酵的前96 h维持在相似水平。当甘油几乎耗尽时,通过加入新的甘油将渗透压提升至4.94 Osmol/kg,并持续该过程直至甘油完全耗尽。与始终维持在4.96 Osmol/kg渗透压的发酵相比,该研究采用的渗透压调控手段使得赤藓糖醇产量提高25.7%,生产率提高2.2%。另一种方法是通过逐渐添加无机盐来改变渗透压。Y.lipolytica在含75 g/L的NaCl发酵培养基中赤藓糖醇产量最高。但NaCl初始质量浓度为75 g/L时,Y.lipolytica生物合成赤藓糖醇的过程大约持续215 h,其中大约一半的时间菌株生长处于迟滞阶段。当初始盐质量浓度为25 g/L 或50 g/L时,通过在培养后的24 h逐步提升盐质量浓度至75 g/L,生物合成动力学参数的提升幅度在14%~20%,并且赤藓糖醇的最大质量浓度达到了81.2 g/L[51]。
综上所述在发酵过程中采用分阶段加入发酵底物或者添加无机盐使菌种处在一个适宜生长的发酵环境可以提高赤藓糖醇产量。
2.3.2 发酵工艺的选择
发酵工艺是决定发酵后赤藓糖醇浓度最重要因素之一,主要有分批发酵、分批补料发酵和连续发酵3种发酵工艺(表1)。
表1 不同发酵工艺对赤藓糖醇产量的影响
Table 1 Effects of different fermentation processes on the yield of erythritol

菌株名称底物/碳源发酵工艺赤藓糖醇产量/ g/L 参考文献Aureobasidiumsp.MutantSN-124A葡萄糖分批发酵170 8 AureobasidiumpulluansGCMCC3.0837木糖分批发酵31.75 28 Y.lipolyticaM53废弃食用油分批发酵114 40 MoniliellapollinisMUCL28141糖蜜分批发酵100 52 Y.lipolyticaK1粗甘油连续分批发酵170 21 Torulasp.葡萄糖连续分批发酵192 53 Moniliellatomentosavar.Pollinis葡萄糖连续分批发酵170 54 Candidamagnoliae葡萄糖两阶段分批补料187 55 Y.lipolyticaMK1纯甘油重复分批培养224 56 Pseudozymatsukubaensis葡萄糖分批补料发酵243 51
注:“Aureobasidium”为金担子菌属,“Torula”为圆酵母属,“Moniliella”为念珠菌属,“Candida”为假丝酵母属,“Yarrowia”为耶氏酵母属,“Pseudozyma tsukubaensis”为筑培念珠菌。
在分批发酵过程中,通常是在发酵初期一次性加入培养基和发酵菌种,待全部发酵底物被消耗殆尽,再进行提取产物和副产物。分批发酵工艺简单、操作简便,但其在赤藓糖醇产率和浓度上相较于其他发酵工艺表现出一定的劣势。在甘油生物合成的情况下,分批反应器中赤藓糖醇的最终质量浓度通常在40~60 g/L左右[49],但最高可达109.2 g/L[57]。
在分批补料发酵过程中,发酵底物的数量会至少进行一次或者多次的更新,以此提高生产效率[58]。以Pseudozyma tsukubaensis对葡萄糖的发酵为例,在分批发酵和分批补料发酵2种发酵工艺的赤藓糖醇产量相似,均超过了240 g/L。但分批补料发酵的产率几乎是前者的2倍,达到了2.84 g/(L·h)[58]。
连续发酵技术虽在多个行业广泛应用,但在赤藓糖醇生产中的研究较少。张金祥等[59]的研究中,提出了一种利用连续发酵工艺生产赤藓糖醇的方法,该方法采用多种类型的膜技术以实现高浓度赤藓糖醇的溶液与生物质的有效分离。在此过程中,葡萄糖生物合成赤藓糖醇的产率可达到252 g/L,转化率为72%。然而,该方法存在的主要局限性在于维持膜稳定性困难。
分批补料发酵和连续发酵技术在赤藓糖醇生产中展现出显著优势,尤其是分批补料发酵在提高生产效率方面表现突出,而连续发酵技术虽具有潜力,但其膜稳定性问题仍需进一步解决,未来通过优化工艺和材料,有望实现更高效、更经济的赤藓糖醇生产模式。
3 结论与展望
随着公众健康意识的提高,消费者在选择食品时越来越注重口感、健康和功能性的均衡,并有意识的控制糖的摄入量,这导致对天然非糖甜味剂的需求急剧上升。赤藓糖醇凭借其众多优点,广受市场欢迎,导致其需求量逐年上升。然而,尽管全球大部分人口面临超重或肥胖问题,但是赤藓糖醇较高的零售价格阻碍了其在大众消费者中的进一步推广。基于此,本文系统总结了微生物发酵法制备赤藓糖醇的关键技术进展,揭示当前微生物发酵法仍面临菌种效率不足、底物成本高及工艺瓶颈等问题。研究表明,通过菌种改良可显著提升产率;利用工业副产物作为碳源和氮源的替代物可降低成本并兼具环保效益;在发酵工艺上分批补料发酵结合渗透压动态调控使产率提升。但粗甘油等底物杂质复杂性、赤藓糖醇合成限速步骤的代谢机制不清以及规模化生产中的传质与副产物控制仍是主要瓶颈。未来研究可聚焦多组学驱动的工业菌株代谢网络重构,整合木质纤维素水解物与工业废料构建循环生产体系,并开发基于人工智能的实时工艺调控技术,以实现赤藓糖醇的低成本、绿色化、规模化生产,同时完善法规标准以拓展其应用场景。
[1] 杨文丽.基于蔗糖原料的赤藓糖醇工程菌株构建[D].济南:齐鲁工业大学,2023.YANG W L.Construction of erythritol engineering strain based on sucrose raw material[D].Jinan:Qilu University of Technology,2023.
[2] 王建彬,郭传庄,王松江,等.发酵产赤藓糖醇研究进展[J].食品工业,2021,42(4):372-375.WANG J B,GUO C Z,WANG S J,et al.Research progress of erythritol produced through fermentation[J].The Food Industry,2021,42(4):372-375.
[3] 马寅龙,田大芝.赤藓糖醇的功能特性及其饮料开发研究进展[J].饮料工业,2024,27(4):74-79.MA Y L,TIAN D Z.Functional properties of erythritol and its progress in the development of beverages[J].Beverage Industry,2024,27(4):74-79.
[4] 张妍,张丽,李宝磊,等.赤藓糖醇的国内外研究进展[J].饮料工业,2022,25(5):76-79.ZHANG Y,ZHANG L,LI B L,et al.Research progress of erythritol at home and abroad[J].Beverage Industry,2022,25(5):76-79.
[5] 张译尹,邢晓蕊,王茹.赤藓糖醇的生物学功能及临床应用研究进展[J].食品与发酵工业,2024,50(3):357-365.ZHANG Y Y,XING X R,WANG R.Advances in biological functions and clinical applications of erythritol[J].Food and Fermentation Industries,2024,50 (3):357-365.
[6] KAWANO R,OKAMURA T,HASHIMOTO Y,et al.Erythritol ameliorates small intestinal inflammation induced by high-fat diets and improves glucose tolerance[J].International Journal of Molecular Sciences,2021,22(11):5558.
[7] 中国食品科学技术学会.赤藓糖醇的科学共识[J].中国食品学报,2022,22(12):405-412.Chinese Institute of Food Science and Technology.Scientific consensus on erythritol[J].Journal of Chinese Institute of Food Science and Technology,2022,22(12):405-412.
[8] KHATAPE A B,DASTAGER S G,RANGASWAMY V.An overview of erythritol production by yeast strains[J].FEMS Microbiology Letters,2022,369(1):fnac107.
[9] 李砷,牟志勇,严鑫,等.解脂耶氏酵母产赤藓糖醇研究进展[J].食品科学,2023,44(17):196-203.LI S,MU Z Y,YAN X,et al.Research progress on erythritol production by Yarrowia lipolytica[J].Food Science,2023,44(17):196-203.
[10] DAZA-SERNA L,SERNA-LOAIZA S,MASI A,et al.From the culture broth to the erythritol crystals:An opportunity for circular economy[J].Applied Microbiology and Biotechnology,2021,105(11):4467-4486.
[11] CARLY F,VANDERMIES M,TELEK S,et al.Enhancing erythritol productivity in Yarrowia lipolytica using metabolic engineering[J].Metabolic Engineering,2017,42:19-24.
[12] LI M,NI Z F,LI Z Z,et al.Research progress on biosynthesis of erythritol and multi-dimensional optimization of production strategies[J].World Journal of Microbiology &Biotechnology,2024,40(8):240.
[13] ORTIZ S R,HEINZ A,HILLER K,et al.Erythritol synthesis is elevated in response to oxidative stress and regulated by the non-oxidative pentose phosphate pathway in A549 cells[J].Frontiers in Nutrition,2022,9:953056.
[14] 周芸琪,李红娇,李克文,等.外源基因表达对解脂亚罗酵母糖醇代谢影响的初步研究[J].食品与发酵工业,2021,47(16):90-96.ZHOU Y Q,LI H J,LI K W,et al.Effect of exogenous gene expression on sugar alcohol metabolism of Yarrowia lipolytica[J].Food and Fermentation Industries,2021,47(16):90-96.
[15] RYWI SKA A,TOMASZEWSKA-HETMAN L,JUSZCZYK P,et al.Enhanced production of erythritol from glucose by the newly obtained UV mutant Yarrowia lipolytica K1UV15[J].Molecules,2024,29(10):2187.
SKA A,TOMASZEWSKA-HETMAN L,JUSZCZYK P,et al.Enhanced production of erythritol from glucose by the newly obtained UV mutant Yarrowia lipolytica K1UV15[J].Molecules,2024,29(10):2187.
[16] SUWANAPETCH C,VANICHSRIRATANA W.Media optimization for erythritol production by Moniliella sp.BCC25224[J].Sugar Tech,2022,25:257-261.
[17] 王冰.低分子量β-1,3-葡聚糖的制备及其应用研究[D].无锡:江南大学,2021.WANG B.Preparation and application of low molecular weight β-1,3-glucan[D].Wuxi:Jiangnan University,2021.
[18] 刘通通.凝结芽孢杆菌产乳酸过程碳代谢阻遏效应调控研究[D].呼和浩特:内蒙古工业大学,2021.LIU T T.Regulation of carbon metabolism repression during lactic acid production by Bacillus coagulans[D].Hohhot:Inner Mongolia University of Technology,2021.
[19] 黄良刚,肖博文,王文佳,等.代谢工程改造解脂耶氏酵母高效合成赤藓糖醇研究进展[J].生物工程学报,2024,40(3):665-686.HUANG L G,XIAO B W,WANG W J et al.Advances in efficient biosynthesis of erythritol by metabolic engineering of Yarrowia lipolytica[J].Chinese Journal of Biotechnology,2024,40(3):665-686.
[20] RYMOWICZ W,RYWI SKA A,MARCINKIEWICZ M.High-yield production of erythritol from raw glycerol in fed-batch cultures of Yarrowia lipolytica[J].Biotechnology Letters,2009,31(3):377-380.
SKA A,MARCINKIEWICZ M.High-yield production of erythritol from raw glycerol in fed-batch cultures of Yarrowia lipolytica[J].Biotechnology Letters,2009,31(3):377-380.
[21] TOMITA S,INAOKA T,ENDO A,et al.Raw material-dependent changes in bacterial and compositional profiles are involved in insufficient pH decrease in natural lactic fermentation of Brassica rapa leaves[J].Food Chemistry,2024,437:137934.
[22] DOMINGUES R,BONDAR M,PALOLO I,et al.Xylose metabolism in bacteria:Opportunities and challenges towards efficient lignocellulosic biomass-based biorefineries[J].Applied Sciences,2021,11(17):8112.
[23] 吴佳嫱.凝结芽孢杆菌LA204利用木薯发酵生产乳酸的研究[D].武汉:华中农业大学,2018.WU J Q.Study on production of lactic acid from cassava fermentation by Bacillus coagulans LA204[D].Wuhan:Huazhong Agricultural University,2018.
[24] TYLER C A,KOPIT L,DOYLE C,et al.Polyol production during heterofermentative growth of the plant isolate Lactobacillus florum 2F[J].Journal of Applied Microbiology,2016,120(5):1336-1345.
[25] MART U G A,COMAN V,VODNAR D C.Recent advances in the biotechnological production of erythritol and mannitol[J].Critical Reviews in Biotechnology,2020,40(5):608-622.
U G A,COMAN V,VODNAR D C.Recent advances in the biotechnological production of erythritol and mannitol[J].Critical Reviews in Biotechnology,2020,40(5):608-622.
[26] ZHAO C H,LIU X Y,ZHAN T,et al.Production of cellulase by Trichoderma reesei from pretreated straw and furfural residues[J].RSC Advances,2018,8(63):36233-36238.
[27] WANG N,CHI P,ZOU Y W,et al.Metabolic engineering of Yarrowia lipolytica for thermoresistance and enhanced erythritol productivity[J].Biotechnology for Biofuels,2020,13:176.
[28] GUO J,LI J X,CHEN Y F,et al.Improving erythritol production of Aureobasidium pullulans from xylose by mutagenesis and medium optimization[J].Applied Biochemistry and Biotechnology,2016,180(4):717-727.
[29] SAVERGAVE L S,GADRE R V,VAIDYA B K,et al.Strain improvement and statistical media optimization for enhanced erythritol production with minimal by-products from Candida magnoliae mutant R23[J].Biochemical Engineering Journal,2011,55(2):92-100.
[30] QIU X L,XU P,ZHAO X R,et al.Combining genetically-encoded biosensors with high throughput strain screening to maximize erythritol production in Yarrowia lipolytica[J].Metabolic Engineering,2020,60:66-76.
[31] 赵思佳,王晓璐,孙纪录,等.代谢工程改造毕赤酵母生产赤藓糖醇[J].生物技术通报,2023,39(8):137-147.ZHAO S J,WANG X L,SUN J L,et al.Modification of Pichia pastoris for erythritol production by metabolic engineering[J].Biotechnology Bulletin,2023,39(8):137-147.
[32] MIRO CZUK A M,RZECHONEK D A,BIEGALSKA A,et al.A novel strain of Yarrowia lipolytica as a platform for value-added product synthesis from glycerol[J].Biotechnology for Biofuels,2016,9(1):180.
CZUK A M,RZECHONEK D A,BIEGALSKA A,et al.A novel strain of Yarrowia lipolytica as a platform for value-added product synthesis from glycerol[J].Biotechnology for Biofuels,2016,9(1):180.
[33] 赵静宇,陈泉,马琳琳,等.常压室温等离子体(ARTP)诱变介导的赤藓糖醇生产菌的筛选与优化[J].生物加工过程,2022,20(3):263-269.ZHAO J Y,CHEN Q,MA L L,et al.Screening and optimization of erythritol-producing bacteria mediated by atmospheric and room temperature plasma (ARTP) mutagenesis[J].Chinese Journal of Bioprocess Engineering,2022,20(3):263-269.
[34] RAKICKA M,RUKOWICZ B,RYWI SKA A,et al.Technology of efficient continuous erythritol production from glycerol[J].Journal of Cleaner Production,2016,139:905-913.
SKA A,et al.Technology of efficient continuous erythritol production from glycerol[J].Journal of Cleaner Production,2016,139:905-913.
[35] 孙锡友.微生物发酵法生产赤藓糖醇的研究[D].石家庄:河北科技大学,2020.SUN X Y.Study on the production of erythritol by microbial fermentation[D].Shijiazhuang:Hebei University of Science and Technology,2020.
[36] MASI A,STARK G,PFNIER J,et al.Exploration of Trichoderma reesei as an alternative host for erythritol production[J].Biotechnology for Biofuels and Bioproducts,2024,17(1):90.
[37] 隋松森,王松江,郭传庄,等.微生物发酵法产赤藓糖醇的研究进展[J].中国食品添加剂,2021,32(6):125-131.SUI S S,WANG S J,GUO C Z,et al.Research progress in erythritol production by microbial fermentation[J].China Food Additives,2021,32(6):125-131.
[38] 李春芳.赤藓糖醇发酵条件优化的研究进展[J].食品安全导刊,2021(19):163-164.LI C F.Research progress on optimization of erythritol fermentation conditions[J].China Food Safety Magazine,2021(19):163-164.
[39] SESHADRINATHAN S,CHAKRABORTY S.Fermentative production of erythritol from cane molasses using Candida magnoliae:Media optimization,purification,and characterization[J].Sustainability,2022,14(16):10342.
[40] LIU X Y,YU X J,GAO S,et al.Enhancing the erythritol production by Yarrowia lipolytica from waste oil using loofah sponge as oil-in-water dispersant[J].Biochemical Engineering Journal,2019,151:107302.
[41] 贾伟.丛梗孢酵母赤藓糖醇产生条件优化的研究[D].天津:天津大学,2012.JIA W.Optimization of erythritol production conditions of a Moniliella sp.strain[D].Tianjin:Tianjin University,2012.
[42] LEE J K,HA S J,KIM S Y,et al.Increased erythritol production in Torula sp.by Mn2+and Cu2+[J].Biotechnology Letters,2000,22(12):983-986.
[43] 任淑东.裂殖壶菌高密度发酵和农副产品处理液利用[D].大连:大连理工大学,2018.REN S D.High density fermentation of Schizomycetes and utilization of treatment fluid for agricultural and sideline products[D].Dalian:Dalian University of Technology,2018.
[44] 成建国.高效硫酸盐还原菌群的筛选、固定化及其在玉米浆脱硫中的应用[D].武汉:华中农业大学,2023.CHENG J G.Screening and immobilization of highly effective sulfate reducing bacteria and its application in desulfurization of corn pulp[D].Wuhan:Huazhong Agricultural University,2023.
[45] TOMASZEWSKA-HETMAN L,RYMOWICZ W,RYWI SKA A.Waste conversion into a sweetener:Development of an innovative strategy for erythritol production by Yarrowia lipolytica[J].Sustainability,2020,12(17):7122.
SKA A.Waste conversion into a sweetener:Development of an innovative strategy for erythritol production by Yarrowia lipolytica[J].Sustainability,2020,12(17):7122.
[46] JANEK T,DOBROWOLSKI A,BIEGALSKA A,et al.Characterization of erythrose reductase from Yarrowia lipolytica and its influence on erythritol synthesis[J].Microbial Cell Factories,2017,16(1):118.
[47] RYWI SKA A,TOMASZEWSKA-HETMAN L,LAZAR Z,et al.Application of new Yarrowia lipolytica transformants in production of citrates and erythritol from glycerol[J].International Journal of Molecular Sciences,2024,25(3):1475.
SKA A,TOMASZEWSKA-HETMAN L,LAZAR Z,et al.Application of new Yarrowia lipolytica transformants in production of citrates and erythritol from glycerol[J].International Journal of Molecular Sciences,2024,25(3):1475.
[48] CHEN X G,TIAN Z,CHENG H N,et al.Adsorption process and mechanism of heavy metal ions by different components of cells,using yeast (Pichia pastoris) and Cu2+ as biosorption models[J].RSC Advances,2021,11(28):17080-17091.
[49] TOMASZEWSKA-HETMAN L,RYWI SKA A.Erythritol biosynthesis from glycerol by Yarrowia lipolytica yeast:Effect of osmotic pressure[J].Chemical Papers,2016,70(3):272-283.
SKA A.Erythritol biosynthesis from glycerol by Yarrowia lipolytica yeast:Effect of osmotic pressure[J].Chemical Papers,2016,70(3):272-283.
[50] YANG L B,ZHAN X B,ZHENG Z Y,et al.A novel osmotic pressure control fed-batch fermentation strategy for improvement of erythritol production by Yarrowia lipolytica from glycerol[J].Bioresource Technology,2014,151:120-127.
[51] JAGTAP S S,BEDEKAR A A,SINGH V,et al.Metabolic engineering of the oleaginous yeast Yarrowia lipolytica PO1f for production of erythritol from glycerol[J].Biotechnology for Biofuels,2021,14(1):188.
[52] HIJOSA-VALSERO M,GARITA-CAMBRONERO J,PANIAGUA-GARC A A I,et al.By-products of sugar factories and wineries as feedstocks for erythritol generation[J].Food and Bioproducts Processing,2021,126:345-355.
A A I,et al.By-products of sugar factories and wineries as feedstocks for erythritol generation[J].Food and Bioproducts Processing,2021,126:345-355.
[53] LIN S J,WEN C Y,WANG P M,et al.High-level production of erythritol by mutants of osmophilic Moniliella sp.[J].Process Biochemistry,2010,45(6):973-979.
[54] PÉREZ-BIBBINS B,TORRADO-AGRASAR A,SALGADO J M,et al.Xylitol production in immobilized cultures:A recent review[J].Critical Reviews in Biotechnology,2016,36(4):691-704.
[55] GHEZELBASH G R,NAHVI I,MALEKPOUR A.Erythritol production with minimum by-product using Candida magnoliae mutant[J].Prikladnaia Biokhimiia i Mikrobiologiia,2014,50(3):324-328.
[56] MIRO CZUK A M,RAKICKA M,BIEGALSKA A,et al.A two-stage fermentation process of erythritol production by yeast Y.lipolytica from molasses and glycerol[J].Bioresource Technology,2015,198:445-455.
CZUK A M,RAKICKA M,BIEGALSKA A,et al.A two-stage fermentation process of erythritol production by yeast Y.lipolytica from molasses and glycerol[J].Bioresource Technology,2015,198:445-455.
[57] YANG L B,ZHAN X B,ZHU L,et al.Optimization of a low-cost hyperosmotic medium and establishing the fermentation kinetics of erythritol production by Yarrowia lipolytica from crude glycerol[J].Preparative Biochemistry and Biotechnology,2016,46(4):376-383.
[58] MOHAMED H,NAZ T,LIU Q,et al.Fed-batch fermentation of Mucor circinelloides reveals significant improvement in biomass and lipid accumulation through performance evaluation,chemical analysis,and expression profiling[J].Bioresource Technology,2024,398:130540.
[59] 张金祥,齐丹萍,赵伟,等.一种连续发酵生产赤藓糖醇的方法:中国,CN115404243A[P].2022-11-29.ZHANG J X,QI D P,ZHAO W,et al.The invention relates to a continuous fermentation method for producing erythritol:China,CN115404243A[P].2022-11-29.