肠道是个体内微生物最密集的场所,是重要的“微生物器官”。肠道生态系统的动态平衡是由一些核心物种维持,健康肠道微生物群组成相对稳定,人体代谢和免疫系统会因肠道微生物变化而受到影响。
饮食是影响肠道微生物菌群的重要因素之一,对肠道微生物组成、功能和代谢活动进行调节,肠道微生物会因摄入的食物释放相关代谢产物,从而对肠道免疫力进行调控。而地理因素、生活方式和种族等因素构成了饮食的差异性,间接影响了肠道微生物群。研究发现,肠道微生物基因和组成会受到饮食的影响,同样地,肠道微生物群结构的差异性也会改变食物营养价值。
当前饮食是通过饮食加工方式、食品添加剂、饮食成分、饮食方式等来影响肠道微生物菌群。过度加工的饮食可能会破坏原料营养成分,并且含有抑制部分有益菌生长的防腐剂等。部分食品添加剂会破坏肠道黏液层,增加细菌易位风险且可能促进代谢综合征的发生。饮食成分和饮食方式的差异性会影响肠道微生物菌群的组成和稳定性。不同种类和含量的饮食成分对肠道微生物菌群的影响不同,比如膳食脂肪可以增加有益细菌的丰度来调节肠道菌群;不饱和脂肪酸可以改变肠道微生物菌群的组成;膳食纤维能够迅速改变人体肠道微生物组的组成等等。不同饮食方式对肠道微生物菌群的影响也不同,比如高糖高脂饮食会促进致病菌增殖,抑制有益菌并增加肠道通透性,诱发低度慢性炎症;高盐饮食会影响肠道微生物、肠道内代谢以及肠道免疫;素食则会使肠道微生物的丰富度和多样性增加等等。
但是饮食影响肠道微生物菌群的研究也存在多方面问题,对饮食如何影响肠道微生物菌群的机制研究不深入,没有进行分类研究,也没有考虑到个体差异造成的影响等。需要深化机制研究,对存在的不同问题结合技术制定个性化饮食方案,优化饮食干预手段等。
影响肠道微生物菌群的因素有很多,但是在影响微生物群组成的环境因素中,饮食是最容易改变的,也是最容易获得的治疗干预形式。短期饮食和特定的饮食干预已被证明可以迅速改变肠道多样性。合理改变饮食方式和成分,及时添加膳食补充剂,不仅可以改善紊乱的肠道微生物菌群,有助于健康的肠道微生物菌群保持稳定,还可能对由肠道微生物菌群失衡导致的肠道疾病起到治疗的效果。因此本文综述了饮食成分和饮食方式对肠道微生物的影响及调控,论述了膳食补充剂对肠道微生物菌群的影响,并指出了现有研究存在的不足以及对其未来通过饮食干预治疗疾病的前景进行了展望。
1 饮食成分及方式对肠道微生物菌群影响
1.1 饮食成分对肠道微生物菌群的影响
1.1.1 蛋白质
在常量营养素中,蛋白质的质量和数量都可以影响肠道微生物群的组成和多样性。肠道微生物的组成会受到膳食蛋白质水平的影响。段格艳等[1]采用16S rDNA测序分析微生物组成,结果表明低蛋白质饲料相较于正常蛋白质饲料,芽孢杆菌门(Bacillota)即原厚壁菌门(Firmicutes)以及放线菌门(Actinomycetota)相对丰度发生了显著增加,但是拟杆菌门(Bacteroidota)的相对丰度则明显降低。PANASEVICH等[2]发现肥胖、高吞噬性2型糖尿病大鼠食用大豆蛋白可改变微生物群[乳杆菌属(Lactobacillus)的相对丰度增加],减少肝脏脂肪变性,降低已知具有生物活性的脂质种类(甘油二酯)并诱导胆汁酸信号改变,改善胆固醇稳态。蛋白质还可以通过调节肠道菌群和代谢产物的组成来降低高胆固醇血症仓鼠的血清胆固醇水平。TONG等[3]揭示了不同来源的蛋白质通过改变易受饮食影响的肠道菌群,来调节胆固醇代谢,其调节效果的差异主要归因于菌群的改变,研究发现豌豆蛋白与猪肉蛋白的交叉干预显著增加了鼠杆状菌科(Muribaculaceae)、瘤胃球菌属(Ruminococcus)和毛螺菌科(Lachnospiraceae)的比例,而真杆菌科(Eubacteriaceae)和丹毒丝菌科(Erysipelotrichaceae)的比例则相应减少,由此可见,豌豆蛋白对血清胆固醇水平的抑制作用是由鼠杆状菌科的微生物引起的,而猪肉蛋白对血清胆固醇水平的抑制作用则是由丹毒丝菌科的微生物引起的。
1.1.2 脂肪
摄入的膳食脂肪量(数量、质量)都可能对肠道微生物菌群的组成产生影响,比如不饱和脂肪酸可以通过提高拟杆菌门与芽孢杆菌门的比例使肠道微生物菌群的组成发生变化。膳食脂肪可以对肠道菌群起到调节作用,来控制肥胖,除了增加有益细菌的丰度,脂肪调节促/抗炎饮食能力,还可以通过增加有利于健康的微生物丰度来增加单链脂肪酸的产量[4]。肠道微生物群作用于未被酶促反应完全水解的膳食纤维和蛋白质,然后结肠细菌的纤维发酵会导致短链脂肪酸(short chain fatty acid,SCFA)形成,如乙酸(C-2)、丙酸(C-3)和丁酸(C-4),特别是后者,对维持健康肠道屏障起到积极作用,对肠道健康产生有益影响。n-3多不饱和脂肪酸可以改善肠道微生物特征组成,增加巴恩斯氏菌属(Barnesiella)、乳杆菌属、卟啉单胞菌科(Porphyromonadaceae)和拟杆菌属(Bacteroides)及拟杆菌门的丰度并诱导 SCFAs(主要包括乙酸、丙酸和丁酸)的形成[5]。
1.1.3 碳水化合物
食物中能量来源主要是碳水化合物。肠道微生物可以通过降解食物中未经过前肠消化的碳水化合物,来为自身的生长繁殖提供碳源和能源。抗性淀粉经过肠道微生物菌群发酵可以生成具有益生作用的短链脂肪酸,从而对脂质代谢进行调控。肠道微生物区系的组成、多样性和丰富度的重塑都与抗性淀粉的发酵有密切联系,通过肠道微生物区系对抗性淀粉的发酵产生淀粉降解酶,促进肠道代谢产物的产生,从而改善肠道屏障功能[6]。纤维摄入增加能够将纤维发酵为短链脂肪酸的结肠细菌的丰度,植物碳水化合物多样性的增加可增加群落多样性。缺乏膳食纤维促使肠道菌群功能从分泌降解纤维酶转化为降解黏液,从而造成黏液层变薄。
膳食纤维的摄入能够迅速改变人体肠道微生物组的组成。乳杆菌属是肠道有益菌属的重要组成之一,而膳食纤维是乳杆菌属重要的能量来源,可能促进肠道中乳杆菌属增殖[7]。MARTINÉZ等[8]通过研究10名健康参与者在3周内每天补充33 g抗性淀粉(resistant starch,RS)2型(由未糊化颗粒组成的天然颗粒淀粉)或4型(化学改性淀粉)对人类粪便微生物群组成的影响,发现RS 4型显著减少芽孢杆菌门丰度,增加拟杆菌门和放线菌门丰度,而RS 2型在门水平上没有产生变化。双歧杆菌属(Bifidobacterium)可以有效利用抗性淀粉降解使结肠pH降低,使得病原菌不适宜在此环境下生存[9]。
1.2 特殊饮食方式对肠道微生物菌群的影响
1.2.1 高脂饮食
高脂饮食是指摄入热量和脂肪含量过高食物的饮食方式。高脂饮食会破坏肠道微生物平衡,影响肠道微生物的多样性与分布。
WEI等[10]采用微生物-代谢物网络和相关性分析,发现了高脂饮食可以影响粪便微生物及其代谢产物的组成,引起脂代谢紊乱。LIU等[11]通过液相色谱串联质谱分析技术对高脂饮食小鼠粪便样本进行代谢组学分析,并使用香农指数(Shannon indexes)和辛普森指数(Simpson indexes)比较了高脂饮食组和标准喂食组之间小鼠的肠道微生物群多样性,发现长期喂食高脂饮食确实降低了肠道微生物群的多样性,特别是一些共生细菌,如拟杆菌科 (Bacteroidaceae)和阿克曼氏菌属(Akkermansia)丰度降低;该研究还表明了高脂饮食会进一步降低肠道中吲哚-3-乙酸的水平,促进抗生素耐受性的形成,在治疗细菌感染中存在潜在危害和风险。有研究通过剂量反应荟萃分析,表明了长期暴露于高脂饮食下,肠上皮细胞生理改变造成了大肠埃希氏菌(Escherichia coli)胆碱分解代谢升高,从而增加了循环三甲胺氧化物(trimethylamine oxide,TMAO)的水平,而TMAO对肠道微生物群有潜在的危害[12]。
1.2.2 高糖饮食
高糖饮食明显改变肠道微生物整体结构,长期的高糖饮食会使乳杆菌属、别样棒菌属(Allobaculum)等相对丰度下降,异普雷沃氏菌属(Alloprevotella)、螺杆菌属(Helicobacter)等丰度增加[13]。
通过评估代谢因子、炎症生物标志物和肠道屏障功能,MHD OMAR等[14]发现高半乳糖和果糖对代谢因子和肠道完整性标志物有潜在的不良影响,但对肠道炎症没有影响。田威龙等[15]通过16S rRNA基因高通量测序方法对高脂高糖饮食组粪便的微生物组成并与普通饮食组进行对比,比较二者微生物组成的动态变化和组间差异,发现高脂高糖饮食导致个体肠道微生物中芽孢杆菌门丰度增加,而拟杆菌门丰度减少,肠道内微生物多样性降低,其结构也发生改变。张芹等[16]发现正常组小鼠粪便菌群多样性更高,而高糖组粪便中拟杆菌门丰度减少但芽孢杆菌门丰度显著增加。
1.2.3 高盐饮食
高盐饮食可以扰乱肠道内稳态,对肠道微生物、肠道内代谢以及肠道免疫都有影响。高盐饮食会导致代谢紊乱并促进肠道内有毒代谢物生成,从而使其积累并促使其穿越肠屏障到达各组织器官,加重机体负担[17]。
DO等[18]研究发现长期摄入含盐量高的食物会破坏肠道微生物平衡,与正常组小鼠相比其体内乳杆菌属和脱硫弧菌属(Desulfovibrio)的比例较低。高盐饮食还会增加肠道通透性,从而导致细菌代谢产物穿过肠道屏障移位至肾脏,造成肾脏损伤。WILLEBRAND等[19]研究表明高盐饮食会减少体内鼠李糖乳酪杆菌(Lacticaseibacillus rhamnosus)的丰度,增加芽孢杆菌门/拟杆菌门的比例。BIER等[20]通过对16S rRNA扩增子采用高通量焦磷酸测序,发现高盐饮食会降低棒杆菌属(Corynebacterium)丰度,而欧文氏菌属(Erwinia)和克里斯滕森氏菌科(Christensenellaceae)细菌丰度增加。
1.2.4 素食
素食是一种不摄入肉类、家禽、鱼类和海鲜等动物源性产品的饮食方式,部分严格素食者戒食蛋类及奶制品。素食者通常摄入较多的谷物、蔬菜、水果等,相较于杂食者,素食者摄食的胆固醇较少,摄入的食物中含有较多的抗氧化维生素(维生素A、维生素C)和碳水化合物(膳食纤维)、多酚(类黄酮类物质)等成分[21]。
素食会使肠道微生物的丰富度和多样性增加。DENG等[22]以Chao1为指标研究对比80名中国女性的肠道微生物群落,发现素食者组比杂食者组肠道微生物的丰富度更高。与杂食者相比,素食者通常具有更高的细菌多样性和更高的普雷沃氏菌属(Prevotella)与拟杆菌属的比例,以及更少的肠杆菌科(Enterobacteriaceae)丰度,包括大肠埃希氏菌[23]。素食者和纯素食者的毛螺菌科和瘤胃球菌属的丰度更高,副拟杆菌属(Parabacteroides)和别样杆菌属(Alistipes)的丰度更低[24]。
1.2.5 地中海饮食
地中海饮食是一种传统的位于地中海附近国家的饮食方式,其特色是甜食和动物肉类摄入量较低,以大量蔬果、谷物和坚果作为主要食物,摄入的不饱和脂肪酸量高,饱和脂肪酸量少[25]。
梁金丽等[26]通过对粪便样本开展16S rDNA检测,包括乳杆菌属、双歧杆菌属、芽孢杆菌属(Bacillus)和大肠埃希氏菌等,发现地中海饮食能显著增加乳杆菌属和双歧杆菌属等特定肠道益生菌的丰度,并通过对相关促炎症因子的抑制而间接影响神经功能从而缓解不良情绪,阻止机体往焦虑或抑郁障碍的方向发展。MESLIER等[27]发现地中海饮食还会使降解纤维的普氏栖粪杆菌(Faecalibacterium prausnitzii)的丰度增加,并上调了微生物的丁酸代谢相关碳水降解基因水平,导致尿石素、粪便胆汁酸降解和胰岛素敏感性增加。
1.2.6 营养不良
饮食是人类摄入营养素的主要方式,并且食物经过与肠道微生物的互相作用,食物被转化为可易于肠道吸收的成分。一旦肠道微生物菌群紊乱,免疫系统与营养间的平衡就会被打破,宿主会产生慢性炎症反应,而长时间慢性炎症会导致脂肪细胞增大,使得各种疾病产生和进一步发展。营养不良是一种营养素失调的表现,可能由营养素摄入不足、摄入过多或者吸收消化障碍导致[28]。
COLEY等[29]采用动物实验证明了饮食可以通过肠道微生物来影响宿主的生理机能和调节神经系统的发育和功能,表明肠道微生物组会因营养不良而改变,使拟杆菌门细菌含量下降,同时假单胞菌门(Pseudomonadota)的细菌种类与数量明显增加,并导致早期营养不良,对生长和发育产生有害影响。GHOSH等[30]对不同程度营养不良的印度儿童的肠道微生物进行分析,发现埃希氏菌属(Escherichia)、志贺氏菌属(Shigella)、肠杆菌属(Enterobacter)、链球菌属(Streptococcus)和韦荣氏球菌属(Veillonella)与营养指数呈负相关;罗斯拜瑞氏菌属(Roseburia)、丁酸弧菌属(Butyrivibrio)和考拉杆菌属(Phascolarctobacterium)与营养指数呈显著正相关。营养不良还会导致胰岛素样生长因子2(insulin-like growth factor-2,IGF2)甲基化降低,严重影响微生物群的成熟。
1.3 膳食补充剂对肠道微生物菌群的影响
1.3.1 低聚糖
低聚糖是一种被普遍运用于食品加工中的食物配料,常见于婴幼儿和老年人的食品中,多添加于乳制品和保健食品中。可以直接作为单独原料加工成保健食品,有着调节血脂、调节免疫、调节肠道微生物菌群等作用。
母乳低聚糖是一种天然产生于母乳中的低聚糖分子,具有多项保健功能。且因为与肠黏膜上皮细胞上的细胞黏附抗体有类似的结构,低聚糖可以通过竞争相似附着位点的方式使细菌无法黏附于肠黏膜,同时还可以增加乳杆菌属的相对丰度,促进婴儿肠道中特定有益微生物的生长[31]。CHENG等[32]通过动物实验研究表明,以含有低聚半乳糖的日粮喂养的小鼠粪便中拟杆菌属、副萨特氏菌属(Parasutterella)和拟普雷沃氏菌属的相对丰度均显著升高。低聚半乳糖还会通过影响宿主肠腔中短链脂肪酸的浓度,从而对宿主的肠道功能起到一定的调节的作用[33]。
1.3.2 植物多糖
植物多糖可以调节肠道微生物群组成及功能,有助于有益菌增殖的同时抑制有害菌生长,从而使肠黏膜屏障结构和功能保持完整,增强或调节肠道免疫系统细胞因子表达水平[34]。
蒋文浩[35]研究发现紫锥菊多糖可以提高小鼠粪便中总短链脂肪酸含量,且紫锥菊多糖干预可提高乳杆菌属及拟杆菌属相对丰度,降低肠杆菌属、志贺氏菌属、肠球菌属(Enterococcus)和别样杆菌属相对丰度。JING等[36]研究发现,党参多糖可以通过上调双歧杆菌属、乳杆菌属和阿克曼氏菌属相对丰度,降低脱硫弧菌属和螺杆菌属的相对丰度,来恢复结肠炎小鼠的肠道稳态。
TANG等[37]研究发现黄芪多糖和党参多糖联合应用可改善结肠炎小鼠的临床症状,菌群分析发现拟杆菌门丰度增加,芽孢杆菌门和假单胞菌门丰度减少,表明其对建立免疫平衡和减轻结肠黏膜损伤具有一定的治疗作用。WANG等[38]通过质子核磁共振光谱结合多变量模式识别分析宿主和微生物的代谢以及16S rRNA基因测序监测肠道微生物群的动态变化发现复合多糖[枸杞多糖、茯苓多糖和香菇多糖(1∶1∶1,质量比)]显著增加了双歧杆菌属、乳杆菌属、异杆菌属和寡源菌属(Oligella)4种细菌的相对丰度,而肠球菌属的相对丰度显著下降,该复合多糖可能对婴儿肠道微生物菌群的定植和功能成熟起到促进作用,且对保持肠道微生态系统健康有着积极作用。
1.3.3 真菌多糖
GUO等[39]通过对肠道微生物群落组成分析,发现高剂量的灰树花多糖[900 mg/(kg·d)]补充显著提高了别样杆菌属的相对丰度,并降低了链球菌属、肠球菌属、葡萄球菌属(Staphylococcus)和气球菌属(Aerococcus)的相对丰度,对糖尿病小鼠肠道菌群组成有明显的调节作用。SU等[40]基于体外发酵实验,发现金针菇多糖通过提高双歧杆菌科(Bifidobacteriaceae)和拟杆菌科的数量以及减少毛螺菌科和肠球菌科(Enterococcaceae)的数量来调节肠道微生物群的组成。
1.3.4 维生素
维生素和肠道微生物菌群之间存在高水平的相互作用。一些维生素可以由肠道微生物菌群产生,而其他维生素基于微环境内的浓度可以调节有益/有害物种。维持细胞功能完整性离不开维生素A,维生素A是细胞及组织增殖分化的关键影响因素,特别是对于黏膜快速增殖的细胞及其屏障功能,更加必不可少[41],维生素A对肠道内免疫系统的影响是直接对免疫细胞产生作用,并且进一步影响肠道微生物菌群。维生素A极显著影响前期双歧杆菌以及前后期盲肠内大肠埃希氏菌、沙门氏菌、乳杆菌属的数量[42]。ELLIS等[43]的研究结果表明膳食维生素K缺乏改变了肠道微生物群落的组成,通过收集盲肠内容物进行DNA提取和16S rRNA测序,收集粪便用于分析维生素K含量,发现在雌性小鼠中维生素K缺乏组乳杆菌属相对丰度最低,拟杆菌属和瘤胃球菌属相对丰度最高。
1.3.5 多酚类物质
体外研究表明,多酚类物质可以抑制潜在的致病菌生长,如幽门螺杆菌(Helicobacter pylori)、葡萄球菌属等,并促进潜在有益菌乳杆菌属和双歧杆菌属的增殖。花青素、酚酸(表儿茶素、对香豆酸和邻香豆酸)等黄酮类化合物以及槲皮素、芦丁、绿原酸和咖啡酸等多酚类化合物可增加有益肠道微生物群(如双歧杆菌属和乳杆菌属)的丰度,并减少人体肠道中潜在致病细菌定植的数量。
动物和临床实验表明,多酚可以调节肠道微生物多样性。CLADIS等[44]研究发现肠道微生物菌群的多样性和结构随着添加蓝莓多酚提取物的剂量而显著改变,添加蓝莓多酚会使芽孢杆菌门与拟杆菌门细菌丰度减少,且高剂量组变形菌丰度增加。LI等[45]建立了头孢克肟诱导的肠道微生物菌群失调的小鼠模型,研究口服绿茶多酚对失调肠道菌群的组成、结构和功能的调节作用,发现绿茶多酚可以显著缓解由抗生素处理引起的肠道微生物群丰富度和多样性的降低,并显著增加了有益微生物如乳杆菌属、阿克曼氏菌属、布劳特氏菌属(Blautia)、罗斯拜瑞氏菌属和真杆菌属(Eubacterium)的相对丰度。
沈鑫婷等[46]研究发现发芽绿豆多酚提取物可以通过减轻炎症反应和调节肠道菌群的丰度(芽孢杆菌门和变形杆菌门相对丰度显著降低,拟杆菌门丰度显著升高)来改善小鼠2型糖尿病。HUANG等[47]发现大豆异黄酮(soybean isoflavones,SI)会降低芽孢杆菌门与拟杆菌门的比率,经过SI处理后法克兰氏菌属(Facklamia)、咸海鲜球菌属(Jeotgalicoccus)、摩根氏菌属(Morganella)丰度显著减少,而影响正常生物体的关键有益菌属如乳杆菌属、阿德勒氏菌属(Adlercreutzia)、粪球菌属(Coprococcus)、瘤胃球菌属、丁酸球菌属(Butyricicoccus)和脱硫弧菌属丰度增加。从而发现SI有益于体重控制,其具体机制与调节肠道微生物菌群、改变消化酶活性,进而影响碳水化合物的吸收和代谢。
发酵食品中含有丰富的多酚化合物。LIU等[48]发现普洱茶提取物通过调节微生物组学和代谢组学,可以改善慢性酒精诱导的氧化应激、炎症、脂质蓄积、肝脏和结肠损伤,恢复酒精诱导的粪便微生物群生态失调,提高潜在有益细菌(双歧杆菌属和异杆菌属)的相对丰度,并减少潜在有害细菌(螺杆菌属和拟杆菌属)的相对丰度。SUO等[49]发现红酒中多酚经过胃肠道的模拟水解后具有很高的稳定性,在很大程度上可以完整地到达结肠并与肠道微生物相互作用,明显增加普雷沃氏菌属、拟杆菌属、琥珀酸弧菌属(Succinivibrio)和异普雷沃氏菌属的相对丰度,而降低乳杆菌属、微小杆菌属(Exiguobacterium)、链形小杆菌属(Catenibacterium)和瘤胃球菌属的相对丰度,有助于增强人类肠道微生物的丰富性和多样性,具有潜在的益生元特性。
1.3.6 益生菌
益生菌定植于宿主肠道中,可以通过刺激免疫细胞来调节免疫系统、生成抑菌物质[50]、与有害菌竞争肠道黏膜表面的位点等方式来减少潜在有害菌群的数量,同时还可以增加有益菌的数量和活性,使得肠道中微生物菌群丰富性增加并维持其稳定[51]。益生菌还可以减轻肠道弱炎症导致的症状,使宿主的肠道微生物菌群保持平衡,因此补充益生菌可以作为一种新治疗方法用于弱炎症症状的缓解以及在肠道微生物菌群发生紊乱时使其恢复稳定。
燕阳等[52]通过收集粪便样品进行高通量测序,研究发现益生菌可以使人体免疫因子水平提高,保护肠上皮细胞形态,并且可以通过增加肠道中有益菌的相对丰度来调节肠道微生物菌群的组成和结构。与对照组小鼠的肠道相比,添加益生菌组肠道中的拟杆菌属和疣微菌门(Verrucomicrobiota)丰度降低明显,芽孢杆菌属(Bacillus)丰度显著增加。DE WOLFE等[53]研究发现给予益生菌治疗参与者的肠道微生物在第0周和第4周之间拟杆菌属丰度显著减少,在第8周时疣微菌科(Verrucomicrobiaceae)丰度降低。S NCHEZ等[54]使用离体结肠模型研究表明补充益生菌对健康个体的肠道微生物产生了显著影响,增加了双歧杆菌属、乳杆菌属的丰度和丁酸盐的水平,并减少了支链脂肪酸(branched chain fatty acids,BCFA)和铵
NCHEZ等[54]使用离体结肠模型研究表明补充益生菌对健康个体的肠道微生物产生了显著影响,增加了双歧杆菌属、乳杆菌属的丰度和丁酸盐的水平,并减少了支链脂肪酸(branched chain fatty acids,BCFA)和铵![]() 的产生。
的产生。
1.4 特殊饮食方式和膳食补充剂影响肠道微生物菌群对比
如表1~表2所示,饮食方式和膳食补充剂对肠道微生物的组成和数量都有影响,在门水平上主要对芽孢杆菌门、拟杆菌门、放线菌门、假单胞菌门、疣微菌门有影响,在属水平上的影响多集中于乳杆菌属、拟杆菌属、肠杆菌属、双歧杆菌属等。
表1 特殊饮食方式对肠道微生物菌群影响
Table 1 Impact of special dietary patterns and dietary supplements on gut microbiota
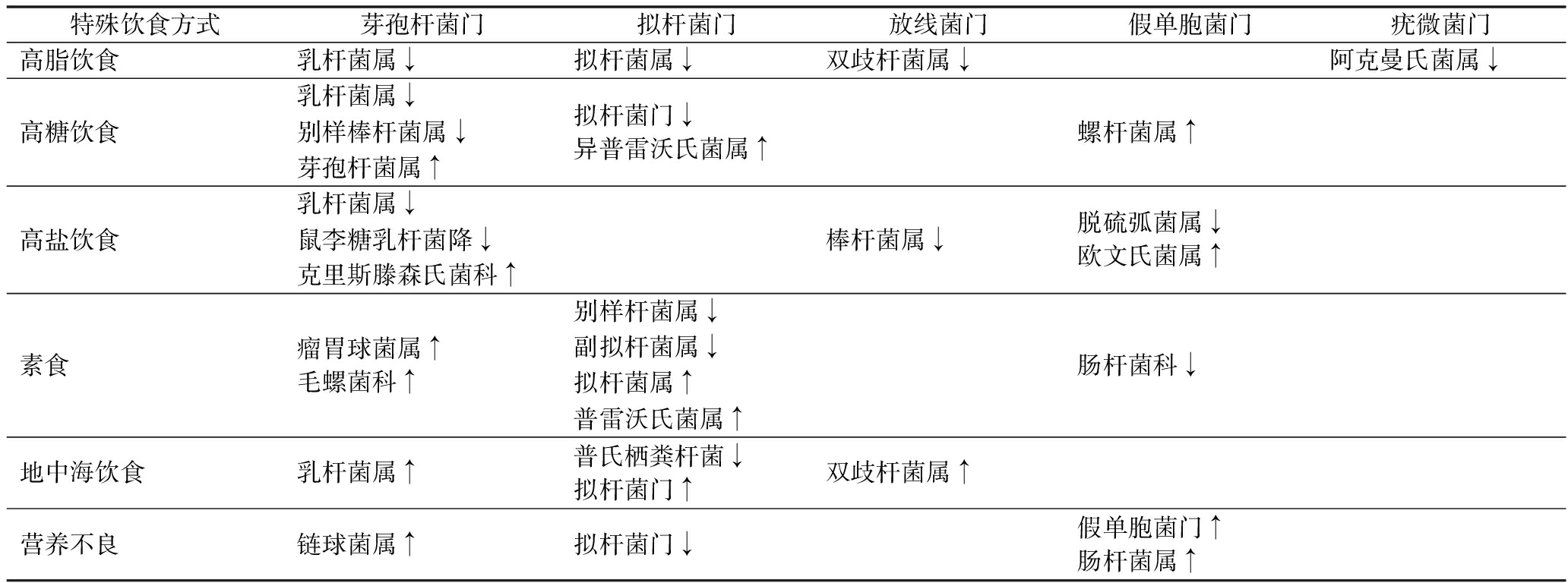
特殊饮食方式芽孢杆菌门拟杆菌门放线菌门假单胞菌门疣微菌门高脂饮食乳杆菌属↓拟杆菌属↓双歧杆菌属↓阿克曼氏菌属↓高糖饮食乳杆菌属↓别样棒杆菌属↓芽孢杆菌属↑拟杆菌门↓异普雷沃氏菌属↑螺杆菌属↑高盐饮食乳杆菌属↓鼠李糖乳杆菌降↓克里斯滕森氏菌科↑棒杆菌属↓脱硫弧菌属↓欧文氏菌属↑素食瘤胃球菌属↑毛螺菌科↑别样杆菌属↓副拟杆菌属↓拟杆菌属↑普雷沃氏菌属↑肠杆菌科↓地中海饮食乳杆菌属↑普氏栖粪杆菌↓拟杆菌门↑双歧杆菌属↑营养不良链球菌属↑拟杆菌门↓假单胞菌门↑肠杆菌属↑
注:↑,相对丰度增加;↓,相对丰度减少(下同)。
表2 膳食补充剂对肠道微生物菌群影响
Table 1 Impact of dietary supplements on gut microbiota

膳食补充剂芽孢杆菌门拟杆菌门放线菌门假单胞菌门疣微菌门低聚糖母乳低聚糖低聚半乳糖乳杆菌属↑拟杆菌属↑肠杆菌属↓异普雷沃氏菌属↑副萨特氏菌属↑植物多糖紫锥菊多糖党参多糖肠球菌属↓别样杆菌属↓乳杆菌属↑拟杆菌属↑乳杆菌属↑双歧杆菌属↑肠杆菌属↓志贺氏菌属↓螺杆菌属↓脱硫弧菌属↓阿克曼氏菌属↑真菌多糖金针菇多糖灰树花多糖毛螺菌科↓肠球菌科↓链球菌属↓肠球菌属↓气球菌属↓葡萄球菌属↓拟杆菌科↑双歧杆菌科↑别样杆菌属↓多酚类物质大豆异黄酮红酒多酚绿茶多酚乳杆菌属↑粪球菌属↑丁酸球菌属↑瘤胃球菌属↑乳杆菌属↓瘤胃球菌属↓链形小杆菌属↓乳杆菌属↑真杆菌属↑布劳特氏菌属↑拟杆菌属↑普雷沃氏菌属↑异普雷沃氏菌属↑法克兰氏菌属↓咸海鲜球菌属↓阿德勒氏菌属↑摩根氏菌属↓脱硫弧菌属↑琥珀酸弧菌属↑罗斯拜瑞氏菌属↑阿克曼氏菌属↑益生菌乳杆菌属↑芽孢杆菌属↑拟杆菌属↓双歧杆菌属↑疣微菌门↓疣微菌科↓
不良饮食方式如高脂饮食和高糖饮食等会导致肠道内有害菌增殖(芽孢杆菌属、螺杆菌属等),有益菌减少(乳杆菌属、双歧杆菌属等),肠道微生物丰富性降低,肠道微生物菌群失衡。通过改变饮食方式(素食、地中海饮食等)或者添加合适的膳食补充剂(植物多糖、多酚、益生菌等)可以恢复肠道微生物多样性,改善肠道微生物紊乱,维持肠道内微生物菌群平衡,可能达到预防和治疗的效果。
2 饮食成分与肠道微生物关系研究展望
虽然饮食成分与肠道微生物关系已经进行了多方面的研究,但是仍然存在一些问题有待解决,比如,肠道微生物菌群可能受环境、地理等因素影响,在控制变量时应注意可能存在对实验产生影响的其他因素;在测定过程中存在误差以及不能完全排除残余和未测量的混杂因素;许多研究目前只应用于实验动物方面,如小鼠、大鼠等,尚未进行人类临床验证实验,所以研究成果能否直接应用于人类还有待检验;许多实验都缺乏对饮食因素影响肠道微生物相关机制的深入研究,使得在治疗和临床方面的应用无法有效进行。在实验进行方面,研究中相对较小的样本量可能具有有限的统计敏感性;迄今为止无法对食品和人源性菌株进行比较;在研究饮食成分对肠道微生物菌群影响时多为多种成分共同作用,很难分离单一成分进行单因素试验排除干扰项等。
针对上述问题,首先应该在条件允许的范围内排除可能存在的干扰因素进行实验,对实验环境因素等多加控制;进行尽可能多的临床前或者人类干预研究;辨别潜在机制以及建立更全面的参考基因库。相信随着研究方法和技术的不断拓展与进步,饮食成分与肠道微生物菌群的研究会更加细致深入,为未来膳食补充剂的研发、饮食干预及治疗相关疾病提供新的思路和发展。
[1] 段格艳,宋博,陈晓安,等.低蛋白质饲粮中添加构树全株发酵饲料对育肥猪脂肪沉积和肠道微生物组成的影响[J].动物营养学报,2022,34(4):2186-2195.DUAN G Y,SONG B,CHEN X A,et al.Effects of low-protein diet supplemented with fermented Broussonetia papyrifera feed on fat deposition and gut microbiota composition of finishing pigs[J].Chinese Journal of Animal Nutrition,2022,34(4):2186-2195.
[2] PANASEVICH M R,SCHUSTER C M,PHILLIPS K E,et al.Soy compared with milk protein in a Western diet changes fecal microbiota and decreases hepatic steatosis in obese OLETF rats[J].The Journal of Nutritional Biochemistry,2017,46:125-136.
[3] TONG L T,XIAO T Z,WANG L L,et al.Plant protein reduces serum cholesterol levels in hypercholesterolemia hamsters by modulating the compositions of gut microbiota and metabolites[J].iScience,2021,24(12):103435.
[4] COELHO O G L,C NDIDO F G,DE C
NDIDO F G,DE C SSIA GONÇALVES ALFENAS R.Dietary fat and gut microbiota:Mechanisms involved in obesity control[J].Critical Reviews in Food Science and Nutrition,2019,59(19):3045-3053.
SSIA GONÇALVES ALFENAS R.Dietary fat and gut microbiota:Mechanisms involved in obesity control[J].Critical Reviews in Food Science and Nutrition,2019,59(19):3045-3053.
[5] TAO F Z,XING X,WU J N,et al.Enteral nutrition modulation with n-3 PUFAs directs microbiome and lipid metabolism in mice[J].PLoS One,2021,16(3):e0248482.
[6] 贺巧玲,孙在兴,曹敏,等.碳水化合物通过调节肠道微生物区系改善肥胖相关代谢综合征的研究进展[J].现代食品,2022,28(8):58-64.HE Q L,SUN Z X,CAO M,et al.Research progress of carbohydrates in improving obesity and related metabolic syndrome by regulating intestinal microflora[J].Modern Food,2022,28(8):58-64.
[7] 肖炜.不同膳食类型人群肠道来源发酵乳杆菌缓解炎症性肠病的差异效果探究[D].无锡:江南大学,2021.XIAO W.Exploring the differential ameliorative effects of human intestinal Lactobacillus fermentum from different diets on inflammatory bowel disease[D].Wuxi:Jiangnan University,2021.
[8] MART NEZ I,KIM J,DUFFY P R,et al.Resistant starches types 2 and 4 have differential effects on the composition of the fecal microbiota in human subjects[J].PLoS One,2010,5(11):e15046.
NEZ I,KIM J,DUFFY P R,et al.Resistant starches types 2 and 4 have differential effects on the composition of the fecal microbiota in human subjects[J].PLoS One,2010,5(11):e15046.
[9] TURRONI F,PEANO C,PASS D A,et al.Diversity of bifidobacteria within the infant gut microbiota[J].PLoS One,2012,7(5):e36957.
[10] WEI W,JIANG W B,TIAN Z,et al.Fecal g.Streptococcus and g.Eubacterium_coprostanoligenes_group combined with sphingosine to modulate the serum dyslipidemia in high-fat diet mice[J].Clinical Nutrition,2021,40(6):4234-4245.
[11] LIU Y,YANG K N,JIA Y Q,et al.Gut microbiome alterations in high-fat-diet-fed mice are associated with antibiotic tolerance[J].Nature Microbiology,2021,6(7):874-884.
[12] YOO W,ZIEBA J K,FOEGEDING N J,et al.High-fat diet-induced colonocyte dysfunction escalates microbiota-derived trimethylamine N-oxide[J].Science,2021,373(6556):813-818.
[13] 谢海胜.高糖饮食干预下AD模型小鼠肠道菌群结构和血浆代谢谱变化的研究[D].杭州:浙江工业大学,2017.XIE H C.The alterations of gut microbiota structure and plasma metabolite profile through a high-sugar dietary intervention in AD modle mice[D].Hangzhou:Zhejiang University of Technology,2017.
[14] MHD OMAR N A,FRANK J,KRUGER J,et al.Effects of high intakes of fructose and galactose,with or without added fructooligosaccharides,on metabolic factors,inflammation,and gut integrity in a rat model[J].Molecular Nutrition &Food Research,2021,65(6):2001133.
[15] 田威龙,司景磊,刘笑笑,等.高脂高糖饮食对小型猪肠道微生物的影响[J].畜牧兽医学报,2022,53(4):1143-1153.TIAN W L,SI J L,LIU X X,et al.Effects of high-fat and high-sugar diet on intestinal microbiota in mini-pigs[J].Acta Veterinaria et Zootechnica Sinica,2022,53(4):1143-1153.
[16] 张芹,周中凯,任晓冲.高通量测序技术研究高糖饮食对小鼠肠道菌群的影响[J].食品安全质量检测学报,2015,6(5):1776-1782.ZHANG Q,ZHOU Z K,REN X C.Comparision of intestinal microbiota in mice with normal and high-sugar diet using MiSeq high-throughput sequencing[J].Journal of Food Safety &Quality,2015,6(5):1776-1782.
[17] LU P H,YU M C,WEI M J,et al.The therapeutic strategies for uremic toxins control in chronic kidney disease[J].Toxins,2021,13(8):573.
[18] DO M H,LEE H B,LEE E,et al.The effects of gelatinized wheat starch and high salt diet on gut microbiota and metabolic disorder[J].Nutrients,2020,12(2):301.
[19] WILLEBRAND R,HAMAD I,VAN ZEEBROECK L,et al.High salt inhibits tumor growth by enhancing anti-tumor immunity[J].Frontiers in Immunology,2019,10:1141.
[20] BIER A,BRAUN T,KHASBAB R,et al.A high salt diet modulates the gut microbiota and short chain fatty acids production in a salt-sensitive hypertension rat model[J].Nutrients,2018,10(9):1154.
[21] 王涔宇,贾洁,沈秀华.素食对人类肠道菌群及其代谢产物作用的研究进展[J].微生物学通报,2025,52(5):1921-1928.WANG C Y,JIA J,SHEN X H.Effects of vegetarian diets on human gut microbiota and metabolites:A review[J].Microbiology China,2025,52(5):1921-1928.
[22] DENG X Q,SI J T,QU Y L,et al.Vegetarian diet duration’s influence on women’s gut environment[J].Genes &Nutrition,2021,16(1):16.
[23] ZIMMER J,LANGE B,FRICK J S,et al.A vegan or vegetarian diet substantially alters the human colonic faecal microbiota[J].European Journal of Clinical Nutrition,2012,66(1):53-60.
[24] SIDHU S R K,KOK C W,KUNASEGARAN T,et al.Effect of plant-based diets on gut microbiota:A systematic review of interventional studies[J].Nutrients,2023,15(6):1510.
[25] 杜婷,尹萍萍,汪姝敏,等.膳食对肠道菌群影响的研究进展[J].食品研究与开发,2022,43(24):1-6.DU T,YIN P P,WANG S M,et al.Research progress on the effect of diet on gut microbiota[J].Food Research and Development,2022,43(24):1-6.
[26] 梁金丽,方建红,蔡晓洁.地中海饮食干预对妊娠期焦虑和肠道菌群的影响研究[J].中国食物与营养,2020,26(9):9-11.LIANG J L,FANG J H,CAI X J.Effect of Mediterranean diet intervention on pregnancy anxiety and intestinal microbial flora[J].Food and Nutrition in China,2020,26(9):9-11.
[27] MESLIER V,LAIOLA M,ROAGER H M,et al.Mediterranean diet intervention in overweight and obese subjects lowers plasma cholesterol and causes changes in the gut microbiome and metabolome independently of energy intake[J].Gut,2020,69(7):1258-1268.
[28] 吴慧丹,黄峥,阳丽君,等.基于高通量测序的营养不良儿童肠道菌群多样性研究[J].中国现代药物应用,2024,18(1):175-180.WU H D,HUANG Z,YANG L J,et al.Intestinal flora diversity of malnourished children based on high-throughput sequencing[J].Chinese Journal of Modern Drug Application,2024,18(1):175-180.
[29] COLEY E J L,HSIAO E Y.Malnutrition and the microbiome as modifiers of early neurodevelopment[J].Trends in Neurosciences,2021,44(9):753-764.
[30] GHOSH T S,GUPTA S S,BHATTACHARYA T,et al.Gut microbiomes of Indian children of varying nutritional status[J].PLoS One,2014,9(4):e95547.
[31] CHRISTENSEN L,SØRENSEN C V,WØHLK F U,et al.Microbial enterotypes beyond genus level:Bacteroides species as a predictive biomarker for weight change upon controlled intervention with Arabinoxylan oligosaccharides in overweight subjects[J].Gut Microbes,2020,12(1):1847627.
[32] CHENG W,LU J,LIN W,et al.Effects of a galacto-oligosaccharide-rich diet on fecal microbiota and metabolite profiles in mice[J].Food &Function,2018,9(3):1612-1620.
[33] 高仁.低聚半乳糖对脂多糖攻毒哺乳仔猪大肠形态、肠道微生物区系、炎症反应及屏障功能的影响[D].南京:南京农业大学,2021.GAO R.Effects of galacto-oligosaccharides on intestinal morphology,intestinal microbiota composition,intestinal inflammation,and barrier function in lipopolysaccharides challenged suckling piglets[D].Nanjing:Nanjing Agricultural University,2021.
[34] 李茜,吴涛,刘锐,等.植物多糖与肠道菌群互作及其对代谢综合征的影响[J].食品安全质量检测学报,2020,11(21):7649-7655.LI Q,WU T,LIU R,et al.Interaction between plant polysaccharide-intestinal microbiota interaction and its effect on metabolic syndrome[J].Journal of Food Safety &Quality,2020,11(21):7649-7655.
[35] 蒋文浩.紫锥菊多糖对小鼠肠道微生物及酒精性肝损伤的干预作用研究[D].无锡:江南大学,2022.JIANG W H.Intervention of Echinacea purpurea polysaccharide on gut microbes andalcoholic liver injury in mice[D].Wuxi:Jiangnan University,2022.
[36] JING Y P,LI A P,LIU Z R,et al.Absorption of Codonopsis pilosula saponins by coexisting polysaccharides alleviates gut microbial dysbiosis with dextran sulfate sodium-induced colitis in model mice[J].BioMed Research International,2018,2018:1781036.
[37] TANG S,LIU W,ZHAO Q Q,et al.Combination of polysaccharides from Astragalus membranaceus and Codonopsis pilosula ameliorated mice colitis and underlying mechanisms[J].Journal of Ethnopharmacology,2021,264:113280.
[38] WANG M X,XIE Z Y,LI L,et al.Supplementation with compound polysaccharides contributes to the development and metabolic activity of young rat intestinal microbiota[J].Food &Function,2019,10(5):2658-2675.
[39] GUO W L,DENG J C,PAN Y Y,et al.Hypoglycemic and hypolipidemic activities of Grifola frondosa polysaccharides and their relationships with the modulation of intestinal microflora in diabetic mice induced by high-fat diet and streptozotocin[J].International Journal of Biological Macromolecules,2020,153:1231-1240.
[40] SU A X,MA G X,XIE M H,et al.Characteristic of polysaccharides from Flammulina velutipes in vitro digestion under salivary,simulated gastric and small intestinal conditions and fermentation by human gut microbiota[J].International Journal of Food Science &Technology,2019,54(6):2277-2287.
[41] BIESALSKI H K.Nutrition meets the microbiome:Micronutrients and the microbiota[J].Annals of the New York Academy of Sciences,2016,1372(1):53-64.
[42] 张春善,蒋燕侠,王博,等.铜、维生素A及互作效应对肉仔鸡肠壁组织结构、肠道微生物和血清生长激素的影响[J].中国农业科学,2009,42(4):1485-1493.ZHANG C S,JIANG Y X,WANG B,et al.Influence of various dietary copper and vitamin a levels on intestinal wall structure,cecal gut flora and GH in serum in broilers[J].Scientia Agricultura Sinica,2009,42(4):1485-1493.
[43] ELLIS J L,KARL J P,OLIVERIO A M,et al.Dietary vitamin K is remodeled by gut microbiota and influences community composition[J].Gut Microbes,2021,13(1):1887721.
[44] CLADIS D P,SIMPSON A M R,COOPER K J,et al.Blueberry polyphenols alter gut microbiota &phenolic metabolism in rats[J].Food &Function,2021,12(6):2442-2456.
[45] LI J,CHEN C F,YANG H,et al.Tea polyphenols regulate gut microbiota dysbiosis induced by antibiotic in mice[J].Food Research International,2021,141:110153.
[46] 沈鑫婷,姜秀杰,许庆鹏,等.发芽绿豆多酚的降血糖作用及对糖尿病小鼠肠道菌群的影响[J].中国食品学报,2023,23(7):197-206.SHEN X T,JIANG X J,XU Q P,et al.Hypoglycemic effect of germinated mung bean polyphenols and its effect on intestinal flora in diabetic mice[J].Journal of Chinese Institute of Food Science and Technology,2023,23(7):197-206.
[47] HUANG L L,ZHENG T,HUI H Y,et al.Soybean isoflavones modulate gut microbiota to benefit the health weight and metabolism[J].Frontiers in Cellular and Infection Microbiology,2022,12:1004765.
[48] LIU Y,LUO Y K,WANG X H,et al.Gut microbiome and metabolome response of Pu-erh tea on metabolism disorder induced by chronic alcohol consumption[J].Journal of Agricultural and Food Chemistry,2020,68(24):6615-6627.
[49] SUO H,SHISHIR M R I,XIAO J B,et al.Red wine high-molecular-weight polyphenolic complex:An emerging modulator of human metabolic disease risk and gut microbiota[J].Journal of Agricultural and Food Chemistry,2021,69(37):10907-10919.
[50] AHIRE J J,JAKKAMSETTY C,KASHIKAR M S,et al.In vitro evaluation of probiotic properties of Lactobacillus plantarum UBLP40 isolated from traditional indigenous fermented food[J].Probiotics and Antimicrobial Proteins,2021,13(5):1413-1424.
[51] 郑雪松,孙建伟,董碟,等.食品中的益生元和益生菌对肠道微生物的作用和影响研究[J].现代食品,2023,29(20):139-141.ZHENG X S,SUN J W,DONG D,et al.Study on the effects of prebiotics and probiotics in foods on gut microorganisms[J].Modern Food,2023,29(20):139-141.
[52] 燕阳,张宇,吴琪,等.不同益生菌对猪流行性腹泻病毒-德尔塔冠状病毒二联灭活疫苗小鼠免疫及肠道微生物的影响[J].江西农业大学学报,2022,44(6):1498-1509.YAN Y,ZHANG Y,WU Q,et al.Influence of different probiotics on the immunization and gut microbiota of mice vaccinated with porcine epidemic diarrhea virus and porcine deltacoronavirus inactivated vaccine[J].Acta Agriculturae Universitatis Jiangxiensis,2022,44(6):1498-1509.
[53] DE WOLFE T J,EGGERS S,BARKER A K,et al.Oral probiotic combination of Lactobacillus and Bifidobacterium alters the gastrointestinal microbiota during antibiotic treatment for Clostridium difficile infection[J].PLoS One,2018,13(9):e0204253.
[54] S NCHEZ M C,HERR
NCHEZ M C,HERR IZ A,TIGRE S,et al.Evidence of the beneficial impact of three probiotic-based food supplements on the composition and metabolic activity of the intestinal microbiota in healthy individuals:An ex vivo study[J].Nutrients,2023,15(24):5077.
IZ A,TIGRE S,et al.Evidence of the beneficial impact of three probiotic-based food supplements on the composition and metabolic activity of the intestinal microbiota in healthy individuals:An ex vivo study[J].Nutrients,2023,15(24):5077.