食品安全是关系国民健康和生命安全的重大战略问题。为保障食品安全,研究人员建立了气相色谱法、液相色谱法、液质联用法和亲和分析法等来检测食品样品中的危害物。其中,基于抗原-抗体特异性相互作用的亲和分析方法是最常用的方法之一,具有灵敏度高、特异性强、重现性好和分析速度快等优点,但其所用生物源抗体稳定性差,保存时间短且易失活,限制了该方法的应用和发展[1]。因此,研究和开发简便、灵敏、特异、快速和经济的仿生抗体已成为亲和分析方法的新方向。
分子印迹技术(molecular imprinting technology,MIT)是采用人工方法制备的能够特异性识别目标分子的聚合物制备技术,所得聚合物,即分子印迹聚合物(molecularly imprinted polymer,MIP),也称为仿生印迹抗体。基于MIPs识别元件建立的分析方法为仿生印迹亲和分析方法(biomimetic imprinting affinity analysis,BIA),该方法利用靶标与标记探针竞争结合MIPs界面的特异性识别位点,根据检测前后的信号变化实现目标分子的定性和定量检测。BIA具有适应性广、制备简便、稳定性高、成本低、特异性强等优点,近年来在食品安全检测领域上有广泛研究,有望实现复杂食品基质中危害物的快速、灵敏、便携和低成本检测。本文介绍了BIA识别元件的制备和表征方法,总结了近年来基于MIPs的BIA在食品危害物分析中的应用进展以及目前面临的挑战,旨在充实仿生印迹技术的理论内涵,推动食品安全检测技术的发展和应用。
1 仿生印迹识别元件制备与表征
1.1 仿生印迹识别元件制备
MIPs是一种稳定且低成本的抗体替代物,与传统生物源抗体相比,其表面具有多个结合位点,可以选择性地识别目标分子。作为BIA的识别元件,其界面的结构和性能是影响检测分析的重要因素,构建性能良好的MIPs印迹界面是BIA的关键。MIPs主要由模板、功能单体和交联剂通过自由基聚合反应,MIP制备的技术流程见图1,具体制备方法有本体聚合、溶胶-凝胶聚合、溶液聚合和乳液聚合等[2]。
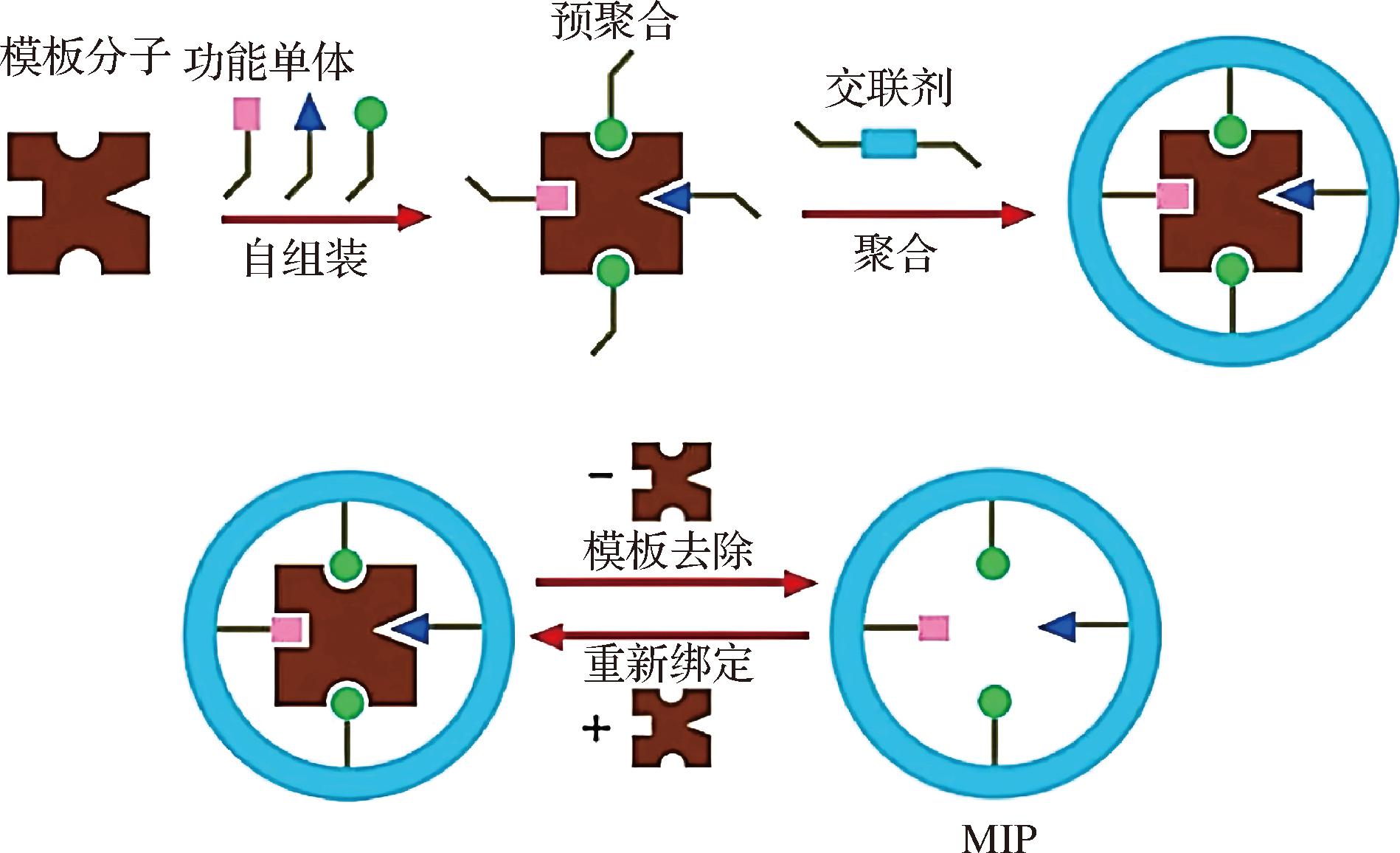
图1 MIP制备示意图[3]
Fig.1 Schematic diagram of MIP preparation[3]
其中本体聚合是制备MIPs最简单的方法[4],该方法具有操作简便、直接等优势。El HARERY等[5]以啶虫脒为模板,4-乙烯基吡啶为单体,采用本体聚合制备MIPs,用于测定水果中的杀虫剂啶虫脒,所制备的印迹界面结构稳定,识别性能良好。检测限和定量限分别为7.35×10-3、0.022 ng/L。但该方法制备MIPs时,存在聚合物内部结合位点不够均匀、识别位点少以及模板分子包埋过深等问题,从而导致MIPs对模板分子的结合能力较差。因此,有研究者开发了溶胶-凝胶聚合等方法,溶胶-凝胶合成可以在室温下完成,具有制备条件温和、反应体系均一性高且所制备的MIPs粒径均一等优点。BHOGAL等[6]通过溶胶-凝胶工艺成功地在SiO2上制备了一种介孔分子印迹聚合物(mesoporous molecularly imprinted polymers,MMIP),用于选择性吸附和检测水中抗生素左氧氟沙星。介孔SiO2材料具有高孔体积和薄的纳米级孔壁厚度,可以在其表面构建精细的识别位点,利用该方法制备的MMIPs对目标物表现出更高的吸附容量,检测限为0.07 ng/mL,回收率高达90.76%~108.17%。但该方法仍未解决识别位点包埋过深和印迹效率低等问题。
表面印迹技术(surface molecular imprinting technique,SIT)的出现和发展为上述问题的解决提供了新思路。在SIT中,高亲和力识别位点在底物表面形成,有效解决了识别位点包埋过深等问题,具有选择性高、传质速度快和识别性能好等优点,大幅提高了对目标物的识别效率[7]。WANG等[8]开发了一种新颖的设计,在血红素-石墨烯纳米片(heme-graphene nanosheets,H-GNs)表面制备MIPs以识别甲状腺球蛋白。H-GNs可以有效地将蛋白质模板固定在其表面,然后直接引发自由基聚合合成MIPs,提高了单位表面积上印迹位点的数量。结果表明,利用SIT在H-GNs表面所制备的MIPs薄膜具有较高的吸附容量(400 mg/g)。该研究在优化合成方法的同时,将MIT与纳米材料相结合,可获得与目标物结合力更强、传质速度更快的识别元件,为蛋白质表面印迹材料的制备提供了新的思路。仿生印迹识别元件制备的构建方法、优点、局限性以及所得聚合物的尺寸如表1所示。
表1 MIPs常用制备方法
Table 1 Common preparation methods of MIPs

合成方法粒径优点缺点参考文献本体聚合1μm~1mm操作简便、直接聚合物颗粒较大 聚合物内部结合位点不够均匀 印迹效率不高 9-10 沉淀聚合100nm~10μm无需额外的稳定剂 易于操作 产率高产物的粒径大小和分散性较难控制 11-12 悬浮聚合50μm~1mm反应温度易控制 分离较容易聚合产物颗粒会包藏少量单体 不易彻底清除 影响聚合物性能 13-14 乳液聚合10~100nm聚合物尺寸均一 粒径可控结合容量低 聚合体系不稳定 干扰因素多 15-16 电聚合-制备的MIPs为纳米级别且比表面积大 有良好的分散性和稳定性通常需要较长的反应时间和更复杂的工艺 适用单体种类较少 17-18 溶胶-凝胶聚合-反应条件温和 反应体系均一性高原料昂贵 反应时间较长 19-20
注:-,未注明。
随着MIT研究不断深入,MIPs的合成方法也在进步,但目前该技术仍存在一些问题,例如交联剂和引发剂种类较少,高亲和力与高特异性的MIPs制备困难等。在未来的研究中,应开发更多的新型单体、交联剂和引发剂,并且与纳米颗粒等功能性辅助材料相结合,以增加印迹界面的亲和性,提高印迹识别效率和分析检测性能。
1.2 仿生印迹识别元件表征
为保证MIPs成功合成并应用,采用了各种设备和技术对其进行严格表征。表2总结了MIPs的物理、化学和识别特性表征。其中物理表征主要集中在MIPs的几何形状、尺寸和孔径等;化学表征主要表征MIPs的化学结构;MIPs的识别特性表征涉及多组分析物,常结合荧光或光谱,并使用固相萃取或高效液相色谱进行动态结合分析,再利用液相色谱-质谱联用仪或基质辅助激光解析电离串联飞行时间质谱仪进行分析物检测和相关性能评估[21]。
表2 MIPs理化性质和识别特性表征
Table 2 Characterization of physicochemical properties and identification properties of MIPs

MIPs表征表征设备表征内容理化性质表征傅里叶红外光谱仪确定模板分子在溶液或固态中的结构变化核磁共振仪分析模板分子和功能单体之间的非共价键相互作用扫描电子显微镜分析MIPs的表面形态和孔隙特性 22 原子力显微镜表征MIPs薄膜 23 透射电子显微镜观察通过表面压印技术合成的聚合物壳层的厚度 24 X射线衍射仪确定无机载体中是否存在晶体学变化热重分析仪分析MIPs的热稳定性和接枝量 25-26 振动样品磁力计绘制磁滞线来分析磁性MIPs材料的磁性能 27 激光衍射粒度分析仪MIPs粒度测定静态角度测量计评估MIPs表面亲水性识别特性表征高效液相色谱仪分离和定量分析MIPs的不同组分液相色谱-质谱联用仪测定MIPs的分子质量、纯度、特定官能团、残留单体和交联剂 对MIPs中的目标化合物定量分析基质辅助激光解析电离串联飞行时间质谱仪确定MIPs分子质量及结构 从复杂混合物中检测目标分子
上述方法均可有效表征MIPs,不同表征技术之间可以互补,不只是依赖于单一的表征方法,但某种表征技术的成功使用和适用性高度依赖于特定的模板、MIPs的组成和MIPs的预期用途。综上所述,MIPs在不同的应用领域可以利用不同的表征方法。
2 BIA法的建立及其在食品安全检测中的应用
近年来BIA不断改进和发展,建立了多种不同标记的仿生亲和分析模式,主要包括放射标记BIA法、荧光标记BIA法、酶标记BIA法、电化学BIA法和仿生印迹化学发光亲和分析法等,这些方法已用于食品安全危害物品检测。
2.1 放射标记BIA
放射标记BIA技术使用放射性同位素作为标记物,具有特异性好、稳健性高、干扰少、探针制备简便和易被检测等特点。VLATAKIS等[28]于1993年首次报道了放射标记BIA方法,以甲基丙烯酸(methacrylic acid,MAA)为功能单体,二甲基丙烯酸乙二醇酯为交联剂合成了MIPs,用于测定人血浆样品中的茶碱或地西泮药物。结果与基于生物源抗体的测定结果相当,证实了MIPs作为抗体模拟物用于BIA的可行性。放射标记BIA也被用于其他化合物的分析,但这种方法存在辐射安全、废物处理和放射性污染等问题[29]。已逐渐发展基于其他标记和检测方法来替代,例如荧光标记BIA和酶标记BIA等。
2.2 荧光标记BIA
与放射标记BIA相比,荧光标记BIA无放射性污染、操作简便,并且可以通过荧光信号对目标物进行检测和量化。荧光标记BIA通过将荧光材料引入MIPs合成系统中,构建仿生印迹荧光传感器(molecular imprinted fluorescence sensor,MIF),实现靶标的特异性识别和荧光检测(图2)。根据样品的不同特性,构建MIF有直接荧光检测和间接荧光检测两种方向。
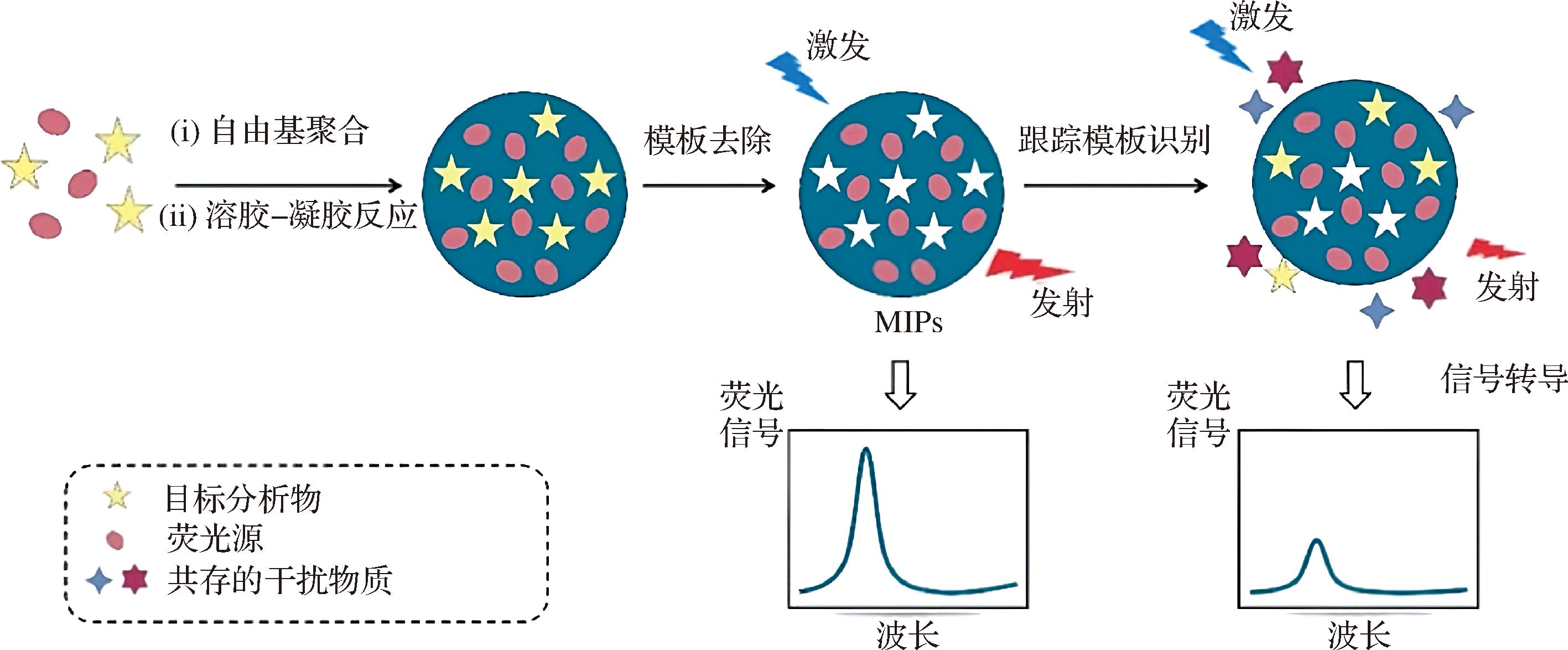
图2 荧光材料掺入MIPs的制备及MIF的构建流程[30]
Fig.2 Preparation of fluorescent materials doped with MIPs and construction process of MIF[30]
靶标被识别后可以产生荧光信号,荧光检测器可直接检测荧光强度。KIMANI等[31]使用荧光MIPs对水中农药草甘膦进行直接荧光检测,将草甘膦-荧光染料复合物印迹到亚微米级SiO2颗粒表面,制备荧光印迹聚合物(fluorescent molecularly imprinted polymer,FIP),通过样品悬浮液中的荧光吸收值定量分析目标分子,检测限为1.45 μmol/L,线性范围为5~55 μmol/L。该方法无需进一步衍生化,相关技术流程为农药残留的快速检测提供了新思路。
直接荧光检测具有简便、快速等优点,但很少有分析物具有强荧光吸收,对于非荧光分析物通常采用间接荧光法检测。MIF的间接荧光检测首先使用荧光材料制备FIPs,并在靶标印迹后检测荧光信号;其次再制备目标分子荧光标记物,通过竞争结合MIPs特异性位点来定量分析。
根据荧光信号来源的不同,间接MIF的标记材料可分有机荧光染料型、量子点(quantum dots,QDs)型、稀土材料型等。其中常见的有机染料包括异硫氰酸荧光素(fluorescein isothiocyanate,FITC)[32]、5-(4,6-二氯三嗪)氨基荧光素[33]、罗丹明[34]等。WU等[32]以FITC为发光材料,在FITC修饰的SiO2表面合成FIPs,用于快速检测水样中的抗生素环丙沙星。当目标分子存在时,MIPs@SiO2-FITC能够产生荧光猝灭,所制备的FIPs具有良好的稳定性和选择性,方法的检测限低至4.04 nmol/L。该研究所制备的亲水性印迹聚合物有助于检测水中的环丙沙星,FIPs能高效识别极性环境中的目标分子,但有机荧光染料存在一定局限性,如背景信号高、易光漂白和稳定性差等,从而降低MIF的灵敏度和选择性。
与有机荧光探针相比,QDs常用作荧光信号标记物,在其表面印迹聚合合成的QDs印迹聚合物具有优异的荧光特性、较高的发光效率和良好的抗光漂白性能。GUO等[35]采用Stöber法在CdTe QDs表面成功构建FIPs,用于快速特异性识别小麦种子中黄曲霉毒素B1。加入靶标分子黄曲霉毒素后,靶标与QDs之间存在相互作用,两者之间发生荧光共振能量转移,导致QDs的荧光猝灭。QDs的荧光猝灭程度与黄曲霉毒素B1的浓度成正比,该方法的检测限为3 ng/g。该研究基于荧光共振能量转移机制,建立了一种简单可靠的QDs标记的BIA法,QDs可以在没有背景干扰的情况下获得荧光信号,基于QDs的FIPs极大地促进了高灵敏MIF的发展,为复杂样品中黄曲霉毒素B1残留的高效分析提供了新思路。
上述检测用的荧光QDs具有较高的灵敏度,但它们的性能很容易受到基质效应的干扰,对于同时分析多个目标分子仍然困难。LUO等[36]利用Mn掺杂ZnS QDs的光致发光特性,结合MIT制备了室温磷光-比率荧光磁性介孔分子印迹聚合物(room temperature phosphorescence-ratiometric fluorescence magnetic mesoporous molecularly imprinted polymers,PFMM-MIPs),用于检测食品中的违禁添加剂孔雀石绿(malachite green,MG)和酒石黄(tartrazine,TZ)(图3)。该PFMM-MIPs具有特异性识别MG和TZ的印迹空腔位点,以Mn-ZnS QDs为唯一信号源,基于上述MIPs可以实现室温磷光(room temperature phosphorescence,RTP)和比率荧光(ratiometric fluorescence,RF)的同时分析,MG和TZ具有良好的线性响应范围(0.01~150、0.05~80 μmol/L),检出限分别为4.3、23.7 nmol/L。该研究通过双通道同时检测2个不同的靶标,RTP可以避免背景荧光和散射光的干扰,有效地降低基质效应,RF可以有效校准外部干扰因素,使分析更准确,仅单一识别元件就可以实现RTP和RF双模光学传感分析,为多靶标光学传感MIPs的建立提供新思路。

图3 PFMM-MIPs构建流程图[36]
Fig.3 Construction flowchart of PFMM MIPs[36]
注:APTES-3-氨基丙基三乙氧基硅烷;CTAB-十六烷基三甲基溴化铵;PRET-磷光共振能量转移;FRET-荧光共振能量转移。
将荧光标记物的高灵敏度与MIPs的高选择性相结合,适用于高效分析农产品、畜禽水产品等不同食品基质中的痕量危害物并消除结构类似物的干扰。具体研究集中在农兽药残留、药物残留、违禁添加剂、重金属和其他危害因素的荧光检测。PAN等[37]基于分子印迹仿生识别,开发了便携式荧光水凝胶试纸,用于快速识别和检测果蔬中杀虫剂吡虫啉(imidacloprid,IMI)。该研究将具有显著荧光的氮掺杂碳点(carbon dots,CDs)集成到高孔隙率反蛋白石光子晶体(inverse opal photonic crystals,IOPCs)结构中,IOPCs的有序和分层结构为IMI提供了有效的传质通道。所开发的荧光传感条特异性识别IMI后,荧光信号淬灭,从而快速灵敏地识别和定量分析IMI,在0.1~50 μg/mL的范围内对IMI表现良好的线性,检测限为0.065 μg/mL。该荧光传感条表现出优异的选择性、稳定性和可重复使用性,为准确监测IMI污染提供了一种新的策略。LI等[38]采用非共价印迹策略合成了一种灵敏的绿色分子印迹荧光传感器用于检测猪肉中四环素(tetracyclines,TCs)残留。该传感器在紫外光照射下呈现强烈的蓝绿色荧光,随着TCs的吸附,荧光逐渐淬灭,从而实现对TCs的检测,线性范围为0.02~50 mg/L,检测限为0.18 μg/L。该传感器使用廉价且绿色环保的原料,具有可循环性、低检测限和宽线性范围,为检测TCs残留物提供了一种绿色便捷策略。
如表3所示,用于检测食品安全危害物的新型荧光材料(如QDs、上转换纳米颗粒等)具有小尺寸、强吸附能力和高表面反应性等特性,使它们能够与各种检测目标物相结合,具体包括氯霉素、磺胺、阿维菌素、酪胺等,从而具有较高的荧光强度。
表3 荧光标记BIA在食品分析中的应用
Table 3 Application of fluorescence labeling BIA in food analysis

标记物功能单体目标物样品检出限回收率/%参考文献异硫氰酸MAA、AM柚皮苷柚子、葡萄柚、酸橙0.1mg/L81.3 39 CDsCDs氯霉素牛奶1μg/L99.01~108.80 40 Mn2+ ZnSQDsMAA磺胺水3.23nmol/L96.80~104.33 41 UCNPsMAA阿维菌素苹果和草莓8.3ng/mL89.6~97.9 42 UCNPsMAA酪胺红葡萄酒和成熟醋0.2mg/L84.9~99.9 43
注:UCNPs,稀土上转换纳米颗粒(upconversion nanoparticles);AM,丙烯酰胺(acrylamide)。
MIF在食品安全分析等领域应用过程中需要严格控制合成条件和检测环境,适用于在室内普通光照或暗室条件下进行检测。但在实际样品检测过程中也存在一些限制因素,如传感器的重复使用性、长期稳定性以及温度、溶剂、pH值、散射光和高浓度样品等外部因素,影响分子结构和立体构像,从而影响荧光强度。MIF还存在如探针发光不稳定、现有合成方法制备的FIPs相互作用位点不均匀、印迹材料的传质速率和吸附能力不高以及对于同一样品中的不同危害物检测困难等问题。设计开发新的绿色纳米材料改善探针发光不稳定等问题;开发更多功能化的单体-模板相互作用体系,深入研究可控聚合方法,制备具有更高选择性、更薄聚合物层和更高灵敏度的FIPs;将智能手机、平板电脑和云数据库相结合,构建新型智能荧光快速检测平台。
2.3 酶标记BIA
对于需要信号放大以及对多种生物分子的检测,常用酶标记BIA法,与荧光标记相比其优势在于非特异性背景较少,这对食品安全的高特异性检测起重要作用。酶联免疫吸附测定(enzyme-linked immunosorbent assay,ELISA)是目前应用最广泛的一种快速检测技术,基于MIPs的仿生印迹ELISA,具有稳定性好、成本低、易于制备等优良特性[44]。TAN等[45]利用万古霉素共价结合在玻璃微珠上作为模板,在特殊反应器中采用固相合成方法合成了万古霉素MIPs纳米颗粒。将制备的纳米颗粒包被在微孔板上,建立了基于MIPs的直接竞争仿生印迹酶联免疫亲和分析方法(biomimetic imprinting enzyme-linked immunoaffinity analysis,EBIA)。能准确检测饮料中的万古霉素,检出限低至2.5 pmol/L,该方法灵敏度是传统ELISA的3倍,且不需要包被、竞争和孵育步骤,缩短了检测时间。
EBIA仍存在一定的局限性,其所使用的天然酶存在稳定性差、成本高和易出现假阳性等缺点,为此研究人员引入纳米酶对EBIA进行了改进。WANG等[46]采用水溶性羧基QDs作为纳米酶进行标记,直接在微孔板表面合成亲水MIPs作为仿生印迹抗体,用于食用油中的邻苯二甲酸二丁酯的测定。QDs-半抗原偶联物与靶标竞争结合印迹位点后,根据荧光值实现对目标分子的定量检测,检出限为0.011 mg/L。该研究克服了天然酶稳定性差和易失活等缺点,有效解决了天然酶所导致的EBIA的灵敏度和稳定性不足等问题,开发的基于QDs的直接竞争EBIA可以用于实际样品的高效分析。
为提高EBIA的选择性和灵敏度,在纳米酶表面制备MIPs已成为新的思路,并且所合成的印迹纳米酶表现出良好的底物选择性和催化活性。PENG等[47]通过双配体与Cu的配位,合成了具有类漆酶活性的2-甲基咪唑-铜-鸟苷单磷酸纳米酶(methylimidazole-cup-guanosine monophosphate nanase,MI-Cu-GMP NPs)。在其表面被覆MIPs膜后,其表面含有丰富的印迹空腔通道,在特异性识别组胺后,底物难以通过,从而阻碍其催化显色反应,所开发的直接竞争EBIA能够灵敏快速检测食品中组胺(图4),检测限和定量限分别为0.05、1.22 mg/L,回收率为90.00%~116.00%。该研究中2-甲基咪唑(methylimidazole,MI)使纳米酶的结构更接近天然漆酶,增加了电子转移速率,提高了类漆酶活性。所制备的MI-Cu-GMP NPs对底物的催化速率明显高于天然酶漆酶,Vmax值是天然漆酶的7.96倍,与天然漆酶相比(Km=0.4 mmol/L),该印迹纳米酶(Km=0.37 mmol/L)对底物具有更好的亲和力。

图4 基于EBIA法的组胺检测流程图[47]
Fig.4 Flow chart of histamine detection based on EBIA method[47]
ELISA通过与MIPs的结合,建立了不同EBIA,可广泛适用于检测包括农产品、肉制品以及食品加工制品中的残留危害物,如真菌毒素(如玉米赤霉烯酮和黄曲霉毒素)和有害化学物质残留检测(如农药、兽药残留)等,具有快速、灵敏、易于标准化等优点。ZHANG等[48]将具有过氧化物模拟酶活性的多色荧光硫锡铜Cu2SnS3QDs与MIPs相结合,实现谷物中玉米赤霉烯酮(zearalenone,ZEN)的特异性催化降解、紫外定量和视觉检测。MIPs特异性吸附ZEN后,红色荧光Cu2SnS3QDs催化ZEN的降解,采用3,3′,5,5′-四甲基联苯胺(3,3′,5,5′-tetramethylbenzidine,TMB)对其进行催化氧化。当更多的ZEN被MIPs特异性吸附,Cu2SnS3QDs随之减少,TMB颜色从黄色变为绿色,最后变为深蓝色,检测限为0.029 μmol/L。该方法已成功应用于玉米、啤酒实际样品中ZEN的检测,为有害物质的特定催化降解、定量和视觉检测以及多色发射Cu2SnS3QDs在降解和食品检测领域的新应用提供了新思路。
表4总结了具有内在酶活性的多种标记纳米酶,包括氧化铜纳米颗粒、金纳米颗粒、Co3O4纳米颗粒和铂纳米颗粒之间复合而成的复合纳米酶等,以及它们在组胺危害物、海洋食品中石房蛤毒素以及磺胺嘧啶抗生素残留等检测中的应用,纳米酶作为天然酶的替代品,具有固有的稳定性,并且易于通过简单的放大进行大规模生产,已广泛应用于食品分析中。
表4 酶标记BIA在食品分析中的应用
Table 4 Application of BIA with enzyme labeling in food analysis

标记酶功能单体目标物样品检出限回收率/%参考文献HRPMAA氯硝柳胺鱼肉0.004~0.03ng/mL70.6~95.5 49 CuO@AuMAA组胺和色胺鱼、酱油和米醋0.04、0.14mg/L89.90~115.00 50 SA-AuNP/Co3O4@Mg/AlcLDH乙烯基膦酸、丙烯酸石房蛤毒素贝类3.17ng/mL98.60~116.90 51 Au@SiO2MAA磺胺嘧啶鸡肉0.2mg/L78.00~90.96 52 Au@Pt@AuMAA组胺黄米酒0.069mg/L84.28~108.82 53
注:HRP,辣根过氧化物酶(horseradish peroxidase);SA-AuNP/Co3O4@Mg/Al cLDH,链霉亲和素-AuNP/Co3O4@Mg/Al 煅烧层状双氢氧化物(streptavidin-AuNP/Co3O4@Mg/Al calcined layered double hydroxide)。
在食品危害物检测中,EBIA传感器需要具有稳定性和耐受性,并且适用于在温和的反应条件下进行,以保持酶的活性和特异性。但其仍存在一些限制因素,如MIPs主要在有机溶液中制备,这会导致酶和使用的其他蛋白质变性;目前主要集中在检测动植物性食品、油脂以及乳制品等食品中的单个小分子化合物,应开发设计多信号多通道传感策略,实现多靶标同时检测;对于检测食品中病原微生物或过敏蛋白的EBIA方法仍然稀缺,因此应开发用于印迹细菌或蛋白质的新方法。此外,相对于生物抗体,基于MIPs的EBIA识别特异性和灵敏度有待进一步提高,未来可结合原位表征技术和人工智能预测纳米酶结构-活性关系,制备催化性能高、稳定性更好的纳米酶;研究和开发小型化轻量化快检设备,满足现场食品快检需求。
2.4 电化学仿生印迹传感分析
食品分析领域需要准确定量各种分析物,同时要满足现场实时快速响应和操作简单的检测需求。电化学技术与MIT结合后所构建的仿生印迹电化学传感器具有制备简便、高选择性和灵敏度、低检测限、可重复使用和成本低廉等优点,在食品中具有广泛应用[54]。AYANKOJO等[55]使用丝网印刷电极(screen printing electrode,SPE)制备了一种基于MIPs的电化学传感器,用于自来水中抗生素红霉素(erythromycin,Ery)的定量检测。通过间苯二胺的电化学聚合直接在SPE上生成Ery-MIPs,该传感器的检测限达到1.0×10-10 mol/L,并成功应用于自来水。该研究成功开发了一种灵敏、经济高效且高选择性的电化学SPE传感器,该传感器将MIPs和SPE相结合,为测定多种食品危害物提供了新的思路。
纳米结构涂层和基于MIPs的纳米材料的预组装被进一步用于开发改性电极,进而提高传感检测方法的性能、MIPs膜的比表面积和导电性,增强传感器的灵敏度和响应速度。YAO等[56]通过沉淀聚合在ZnWO4@Co-磁性纳米多孔碳(ZnWO4@Co-magnetic nanoporous carbon,ZnWO4@Co-MNPC)表面涂覆MIPs外壳,构建了以ZnWO4@Co-MNPC@MIP为核心的新型抗生素氯霉素(chloramphenicol,CAP)电化学传感器(图5)。ZnWO4能够提高电导率,Co-MNPC具有较高的比表面积和大孔体积,Co纳米颗粒具有强磁性,容易吸附功能单体,促进聚合反应,基于此构建的传感器具有较高的灵敏度,检测限为0.002 7 μmol/L。该研究首次将MMIPs用于牛奶中CAP的检测,为制备磁性分子印迹提供了有效的磁性材料选择策略,也为Co-MNPC磁性纳米材料的应用拓宽了思路。
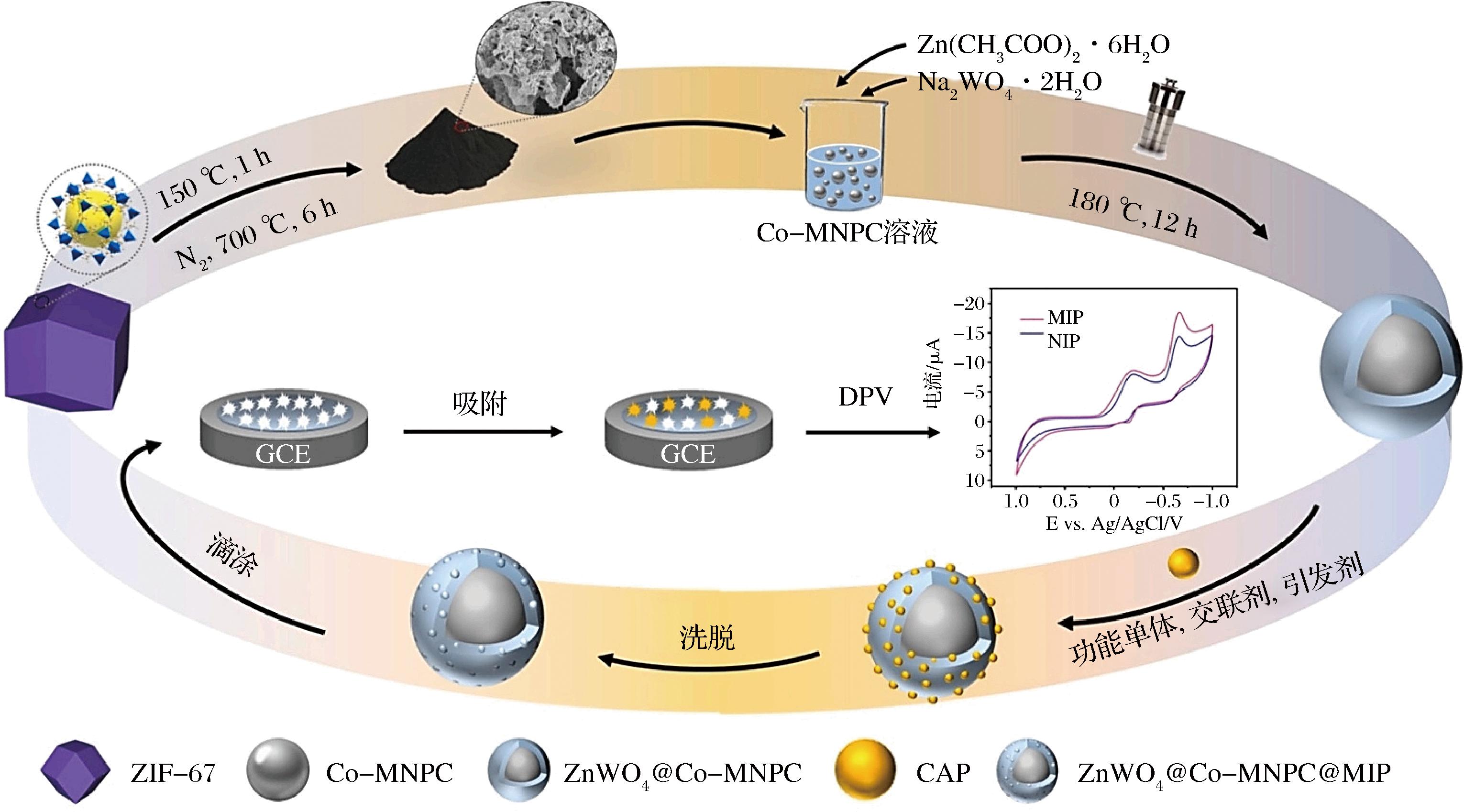
图5 氯霉素仿生印迹电化学传感器构建技术流程[56]
Fig.5 Construction technology of chloramphenicol biomimetic blotting electrochemical sensor[56]
迄今为止开发的电化学传感器中的MIPs通常使用单一功能单体制备,致使功能基团多样性减少,进而导致MIPs对靶标的亲和力相对较低,检测灵敏度较低。WANG等[57]开发了一种新型的多功能MIPs电位传感器用于检测水中双酚A。通过使用2种功能单体MAA和具有识别和传导双重功能的单体3-乙烯基苯胺制备MIPs。该传感器的检测限为0.23 μmol/L,回收率在98%~104%。在该研究中3-乙烯基苯胺中的聚苯胺基团不仅用作选择性识别,而且具有导电性。因此,所获得的MIPs具有较高亲和性识别能力和优异的电子转移性能,基于此所建立的电化学分析方法表现出更强的特异性和更高的灵敏度。
电化学仿生印迹传感分析因其易于调控、便携式和微型化,使得它在实际应用中更加便捷,所构建的仿生印迹电化学传感器适用于检测多种食品危害物:药物残留、农药残留和食品添加剂等。MAHMOUD等[58]采用间接差分脉冲伏安法(differential pulse voltammetry,DPV)的电化学分析技术用于检测农用抗生素药物卡苏加霉素。卡苏加霉素可与Cu2+配位,在电化学氧化过程中形成稳定的配位单体络合物,Cu2+的存在有助于通过产生Cu2+-Cu+的氧化还原信号来检测药物,在药物存在的情况下,Cu2+-Cu+的信号响应增加,促进了Cu2+在印迹空腔内的积累。Cu2+-Cu+的阳极峰信号在0.15~140 mmol/L范围内与卡苏加霉素的浓度成正比,检测限为0.046 mmol/L。所提出的传感器可有效检测包括肉类、牛奶和黄瓜等复杂基质中的卡苏加霉素。TANG等[59]构建了MIP-电化学-表面增强拉曼光谱(surface enhanced-Raman spectroscopy,SERS)传感器用于检测蔬菜中农药啶虫脒(acetamiprid,AAP)残留,它是在SERS活性基板上涂覆AuNPs掺杂的聚多巴胺层上来实现的。使用MIP/AuNPs/氧化铟锡(MIP/AuNPs/indium tin oxide,MIP/AuNPs/ITO) 用作原位拉曼电池中的工作电极和SERS基板,AAP分子被MIPs层的识别后,施加电势促使AAP分子靠近底物表面,以促进分析物与表面的相互作用,进一步放大SERS信号。该传感器的检测限低至3.2 nmol/L,是未施加电势(43.5 nmol/L)的13.6倍。该传感策略能够通用,可以通过使用不同的模板分子制备聚多巴胺层来轻松扩展到检测多种农药,其实用性在食品安全监测方面有巨大潜力。
根据检测物质的性质,表5中总结了DPV和循环伏安法(cyclic voltammetry,CV)电化学技术对牛奶和水中氯唑西林等抗生素、水果中马拉硫磷农药残留和谷物中脱氧雪腐镰刀菌烯醇等真菌毒素目标分析物定量分析,DPV适用于对低浓度样品的精确测定,以及对复杂体系中的目标分子进行分离和富集,而CV具有操作简单等优点,结合使用这2种方法可获得更全面的电化学信息。
表5 电化学仿生传感器在食品分析中的应用
Table 5 Application of electrochemical biomimetic sensor in food analysis
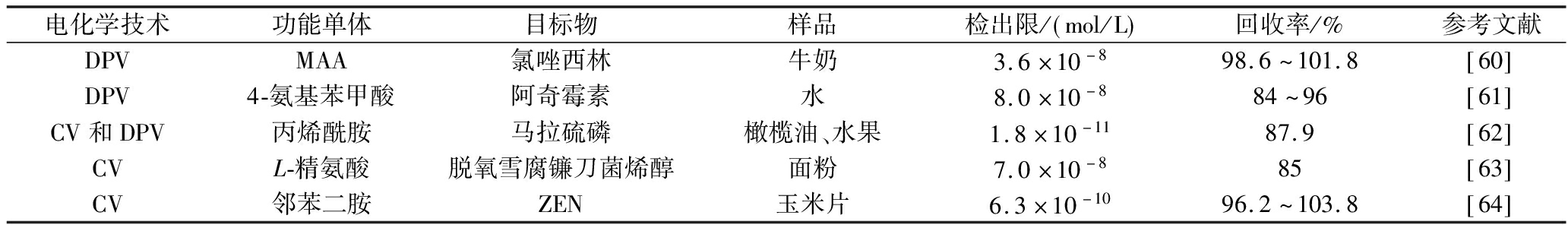
电化学技术功能单体目标物样品检出限/ mol/L 回收率/%参考文献DPVMAA氯唑西林牛奶3.6×10-898.6~101.8 60 DPV4-氨基苯甲酸阿奇霉素水8.0×10-884~96 61 CV和DPV丙烯酰胺马拉硫磷橄榄油、水果1.8×10-1187.9 62 CVL-精氨酸脱氧雪腐镰刀菌烯醇面粉7.0×10-885 63 CV邻苯二胺ZEN玉米片6.3×10-1096.2~103.8 64
用于食品危害物检测的电化学仿生印迹传感分析近年来取得了越来越多进展,适用于无外部电磁干扰等环境下的现场快速检测和实时动态监测。但在实际检测中仍存在一些限制因素,包括复杂的操作步骤和计算过程、循环使用能力低以及稳定性不足;实际应用中的基质效应高的影响,导致分析结果误差大;电极材料的选择以及对电极改性时纳米材料的选择等都会影响检测准确度;同时,随着仿生印迹电化学传感器技术的不断发展,其相关的识别与增敏材料仍需深入研究。未来的研究可集中于提高传感器选择性、灵敏度和实用性,同时开发更多的纳米复合增敏材料;发展便携式设备和多路传感平台,与机器学习和人工智能相结合,以更好地进行数据分析和现场检测;结合MIPs特异性识别元件构建新型多响应仿生印迹电化学传感器,用于食品中痕量危害物的定性和定量检测。
2.5 仿生印迹化学发光亲和分析
仿生印迹化学发光亲和分析(biomimetic imprinting chemiluminescence affinity analysis,CBIA)法与荧光标记BIA法不同,CBIA不需要外部激发光源,装置简单且易于实现微型化,将化学发光的高灵敏度与MIPs的高特异性相结合,更适用于复杂样品中痕量物质的测定。化学发光传感常通过鲁米诺-H2O2体系和纳米材料来开发基于MIPs的化学发光传感器[65],部分目标物与鲁米诺-H2O2体系存在相互作用,可以增强化学发光信号。PAN等[66]在96孔微孔板上制备了基于MIPs的微量滴定化学发光传感器,使用鲁米诺-H2O2体系刺激产生化学发光信号,根据发光信号值定量分析牛奶中有机磷,检出限为1~3 pg/mL,回收率为86.1%~86.5%。该传感器结合MIPs、ELISA和化学发光的优势,可重复使用,为食品中有机磷检测提供了新思路。
与传统化学发光法相比,集MIPs和纳米增敏材料于一体的仿生电化学发光(molecular imprinted electrochemiluminescence,MIECL)传感器具有反应可控性强、样品用量少、检测速度快和灵敏度高等优势。XU等[67]用多壁碳纳米管(multi-walled carbon nanotube,MWCNT)-Nafion/MIP-CdSe-QDs修饰了玻碳电极(glassy carbon electrode,GCE),用于检测鱼肉中的杀虫剂氟氯氰菊酯。当氟氯氰菊酯存在时,可以与MIPs上特定的印迹空腔相互作用,阻断GCE和QDs/H2O2之间的电荷转移,诱导电化学发光(electrochemical luminescence,ECL)信号猝灭。基于MWCNT-Nafion/MIP-QDs的MIECL传感器具有较高的灵敏度,检测限为0.05 μg/L。该研究中将纳米材料与MIECL相结合,CdSe-QDs具有良好的导电性,多壁碳纳米管具有优异的电催化活性,可以放大ECL信号,所开发的MIECL传感器对目标分子具有高猝灭效率、高选择性和良好的稳定性,该方法为食品中痕量物质残留的分析提供了新的理论依据和技术途径。
ECL传感器存在发光信号单一、系统误差大和现场分析能力较低等问题。基于双信号的比率测量策略与智能手机相结合有效地解决了这些问题。LU等[68]首次构建了一种新型便携式机器学习辅助智能手机视觉分子印迹比率电化学发光(molecularly imprinted ratiometric electrochemiluminescence,MIRECL)传感平台,用于高选择性检测蔬菜水果中2,4-二氯苯氧乙酸(2,4-dichlorophenoxyacetic acid,2,4-D)。以Te-CdS@Mn3O4修饰的MIPs为识别元件,通过阴极电聚合改性后进行靶标检测,在驱动电压和H2O2的作用下,鲁米诺的阳极氧化和Te-CdS@Mn3O4的阴极还原同时发生,产生具有2种特征的ECL发射信号。当MIPs特异性识别2,4-D后,双ECL信号随着2,4-D浓度的增加而降低,借助智能手机收集和处理数据,实现对2,4-D定量检测,检测限为0.63×10-3 μmol/L(图6)。该研究将比率电化学发光策略与MIT相结合,可通过2个发光体的内部自校准来降低误差;将人工智能与ECL分析相结合,可用于ECL视觉分析,进而实现可视化和便携式检测性能,为2,4-D的即时检测提供了一种新颖、便携、可视和高效的方法。
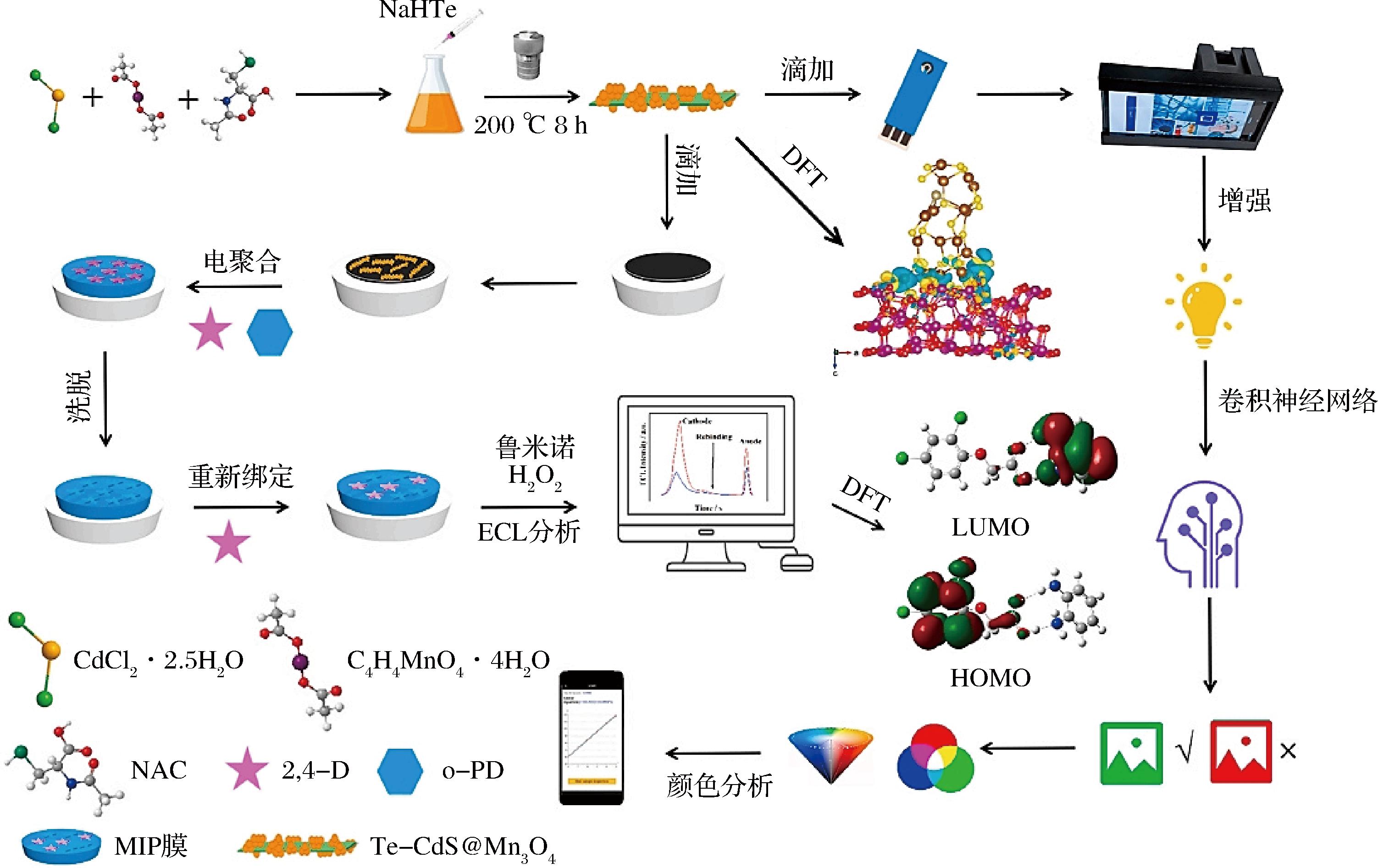
图6 MIPs/Te-CdS@Mn3O4/GCE的制备方法、MIRECL传感平台的机器学习辅助可视化和基于便携式智能手机的传感过程[68]
Fig.6 Preparation of MIPs/Te-CdS@Mn3O4/GCE,machine learning-assisted visualization of MIRECL sensing platform,and sensing process based on portable smartphone[68]
CBIA和MIECL传感器已用于测定许多食品基质中的危害物,如动物性食品中抗生素残留、农产品中农药残留和食品加工过程中添加剂残留等低丰度成分。WANG等[69]构建了磁性固定双功能单体ECL传感器,用于选择性检测农产品中农药噻菌灵(thiabendazole,TBZ)。该研究采用邻苯二胺和间苯二酚为双功能单体制备的MIPs含有更多的印迹位点,提高了吸附性能,TBZ含量与ECL信号强度成反比,线性范围为1×10-9~5×10-5 mol/L,检测限为3.77×10-10 mol/L。该研究利用Fe3O4的超顺磁性,将磁性金属有机框架@g-C3N4(magnetic metal-organic framework@g-C3N4,MMOF@g-C3N4)固定在磁性玻碳电极表面,增强了ECL体系的稳定性和重复使用性,抗坏血酸钠作为共反应物加速剂进一步增强ECL强度,为建立食品中危害物的检测方法提供了新的研究思路。
CBIA对其他食品危害物的检出限和回收率如表6所示。CBIA常用的发光材料主要有鲁米诺及其衍生物和过氧草酸盐类,具有发光效率高、适用范围广和稳定性好等优点,这类试剂在CBIA中应用广泛,可满足包括肉类食品中苯并咪唑、拟除虫菊酯等农药残留以及氯霉素、硝基呋喃等抗生素残留等食品常规和超灵敏检测需求。
表6 仿生印迹化学发光亲和分析在食品分析中的应用
Table 6 Application of chemiluminescence biomimetic imprinting affinity analysis in food analysis

发光材料功能单体目标物样品检出限回收率/%参考文献鲁米诺-H2O2MAA苯并咪唑肉类1.5~21pg/mL65.8~91.2 70 鲁米诺-H2O2-4- 咪唑-1-基 苯酚MAA氯霉素肉类2.0pg/g69.5~97.3 71 TCPO-H2O2-IMZMAA硝基呋喃饲料5~12pg/mL74.8~97.4 72 4- 咪唑-1-基 苯酚-鲁米诺-H2O2MAA磺胺类药物鸡肉和猪肉1.0~12pg/mL72.7~99 73 TCPO-H2O2-IMZMAA拟除虫菊酯鸡肉0.3~6.0pg/ml70.5~99.7 74
注:TCPO-H2O2-IMZ:双(2,4,6-三氯苯基)草酸盐-H2O2-咪唑[Bis(2,4,6-trichlorophenyl)oxalate-H2O2-imidazole]。
CBIA和MIECL传感器适用于无外界光干扰和电磁干扰等环境,可对食品样本进行快速筛查,来确保食品的安全性。但在检测过程中也存在化学发光体系的选择、需要配备相应的化学发光检测仪器以及对复杂的样品需要经过适当的前处理等限制因素。因此,实际检测中可以与高效液相色谱和微量固相萃取等分离方法对分析物进行预处理和分离,以提高检测灵敏度和准确度。虽然采用新型纳米材料可有效增强传感器的化学发光信号,CBIA的效率也得到提高。但化学发光试剂存在发光不稳定且具有间歇性的问题,在反应过程中容易裂变,导致结果不稳定。未来应探索新的发光体系或增敏材料,提高发光量子产率,增强发光稳定性;另外针对不同食品中危害物设计多通道CBIA传感平台,进一步提高传感器的适用性。
2.6 其他BIA
2.6.1 微流控纸基BIA
在食品安全检测领域,对于有机污染物、杀虫剂、重金属离子和其他掺假化学品污染的食品的低成本快速检测,微流控纸基BIA法无需复杂且昂贵的仪器即可实现结果的视觉信号读出。纸基分析设备(paper analysis equipment,PAD)是BIA的新型载体,其最大的特点是低成本、易用性和便携性。MIPs作为识别元件与PADs的集成具有优异的分析性能和广阔的应用前景,为灵敏、高效的食品安全检测提供了新的思路。FANG等[75]合成了CDs过滤纸和MIPs膜,以从酱油中检测致癌物3-氯-1,2-丙二醇(3-chloro-1,2-propanediol,3-MCPD)。纸芯片表面的MIPs层特异性识别3-MCPD后,CDs发生电子转移导致荧光猝灭。该接枝纸基传感器具有高吸附容量(68.97 mg/g)和低检测限(0.6 ng/mL),且印迹因子为4.5,印迹因子的大小直接影响MIPs的性能,印迹因子越大,表明MIPs对目标分子的选择性和灵敏度越高,进而可提高检测的准确性。该研究将高灵敏荧光传感与MIP-PAD技术相结合,开发了一种灵敏、特异性高和便携的检测平台,有助于更可靠和准确地分析目标物。
纸基板是整个微流控芯片的核心部件,纸的类型对分析检测有重要影响,普通纸张重复利用率低且存在与荧光材料结合后背景荧光高等问题。玻璃纤维纸具有较好的机械耐久性,在水相中无明显变形和崩解,能够形成清晰的检测区域,还可以避免过度分散,减少传统方法中容易产生的干扰效应等。YAN等[76]以绿色方式合成了油溶性CdSe QDs作为荧光材料,在静态猝灭和光致电子转移机理的基础上选择性检测大豆中的杀虫剂乐果(图7),检测限为80.0 μmol/L,回收率为97.6%~104.1%。本研究将玻璃纤维纸和MIPs-荧光复合材料融合在一起,所用的玻璃纤维纸因其荧光背景低、与CdSe QDs相容性较好而广泛用于新型检测载体。上述方法对靶标的选择性高,基质干扰低,相关思路为建立便携、快速和灵敏的检测方法提供了技术支持。
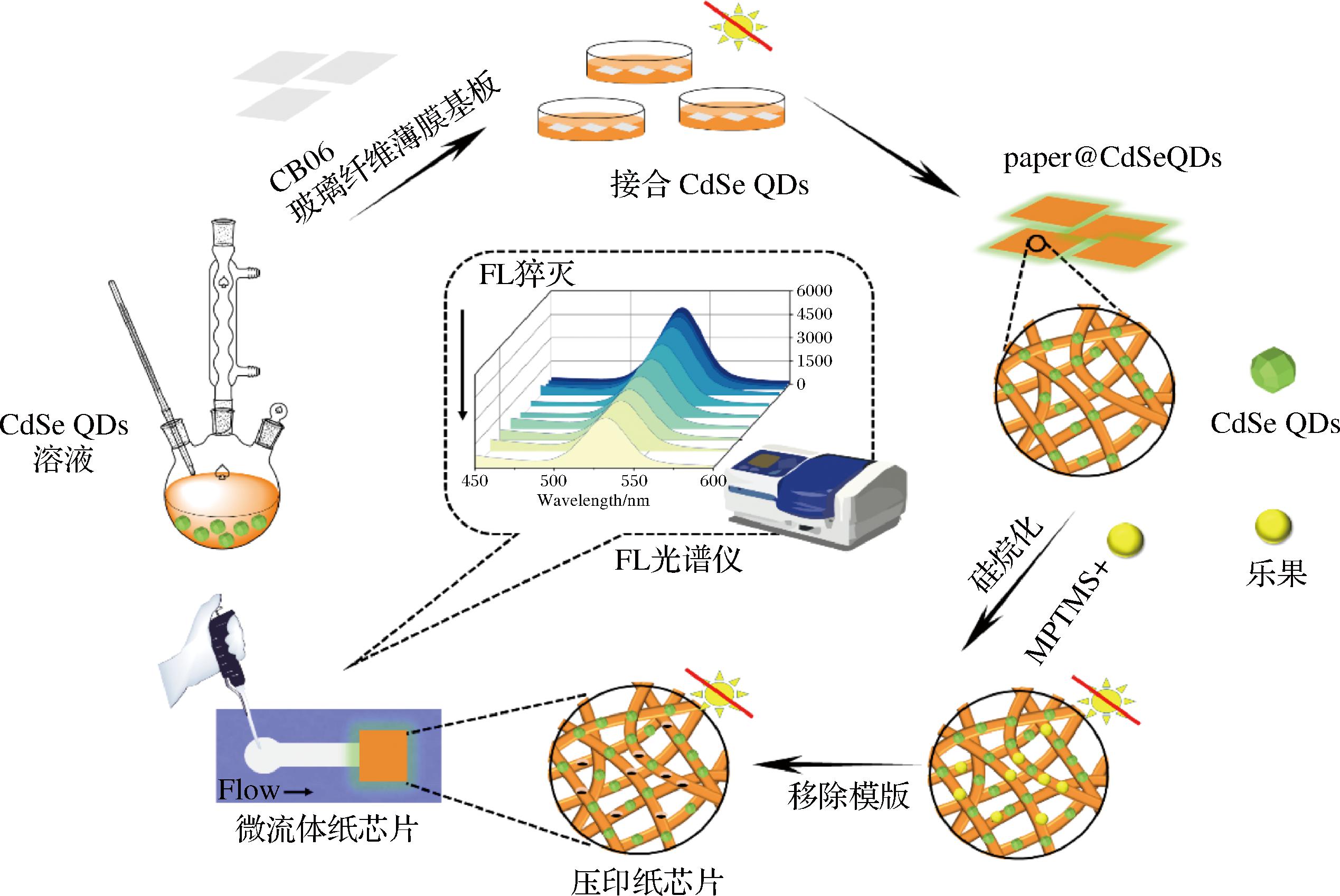
图7 微流控纸芯片构建流程图[76]
Fig.7 Flow chart of the construction of microfluidic paper chips[76]
虽然PAD的纸质载体成本较低,但由于纸上均匀分布有荧光材料和MIPs,使得纸质载体的机械稳定性较差,导致基于纸基的仿生印迹传感器可重复性降低。三维微流体纸张分析装置(three-dimensional microfluidic paper base,3D-μPAD)简单易用、可重复性好且适用广泛,为上述问题的解决提供了新的思路。SAWETWONG等[77]报告了一种具有比色检测功能的3D-μPAD,使用Mn-ZnS QDs嵌入MIPs,用于全谷物样品中的农药草甘膦的选择性分析。当样品中的草甘膦与纸基MIPs识别位点特异性结合后,抑制了2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐氧化,使体系颜色发生变化。该传感器可高效、快速地测定样品,检测限为0.002 μg/mL。该研究采用纯环氧底漆这种新型的多功能材料构建3D-μPAD,用于在纸张的疏水区,可以形成防漏屏障,无需复杂的仪器,可以实现高效、特异的灵敏检测。
上述研究通过将MIT与微流控纸芯片相结合,实现了对食品中致癌物和农药残留的便携式检测,适用于无强光直射和湿度为30%~70%的环境下进行检测。但在实际检测中存在现有的MIP-PAD选择性低,以及大部分仍处于检测合成样品的实验室阶段等限制因素,可应用于实际样品的MIP-PAD仍需要进一步开发。PADs作为MIPs的优良衬底,可用于构建特异性检测新模式。该技术目前仍处于早期阶段,存在一些局限性,如纸张的刚度和结构稳定性低,多步聚合和洗脱过程可能会造成损坏;MIPs的亲和力仍然低于天然受体,许多MIPs材料在水相中的选择性较差;目前尚不能同时进行多靶标分析。未来在设计和制备MIP-PAD时需考虑纸张类型和性质,提高其耐用率;合成具有较高亲和力和良好亲水性的MIPs材料;制备基于多模板的MIPs,实现同时捕获或识别多种目标物。
2.6.2 基于智能手机的BIA
在食品痕量危害物检测中,智能手机的出现带来了更高的便携性,并且具有开源的操作系统、强大的图像处理和计算能力,取代了对笨重的传统实验室设备的需求,尤其为食品中抗生素和添加剂的实时检测提供新思路。HU等[78]将Mg、N-CDs@MIL-101@MIP与基于智能手机的自制光学设备耦合,设计并制造了一个智能检测平台用于检测牛奶中抗生素土霉素(oxytetracycline,OTC)。所合成的高发光Mg,N-CDs对OTC能产生显著的荧光反应,具有较宽的线性范围(0.09~40 μmol/L)和较低的检测限(27.3 ng/mL)。该研究中智能手机既是信号读取器又是分析仪,可以即时捕获图像信息并对其进行数字化,从彩色图像中提取的RGB值,可实现样品中OTC的超灵敏和高选择性测定。
智能手机已成为必不可少的平台,尤其是协助比色感应技术的发展,使用智能手机进行数字颜色分析进而可以准确、便捷对目标分子定性定量分析。JACINTO等[79]采用自由基沉淀法合成MIPs,用于检测饮料中着色剂柠檬黄。将MIPs负载表面浸入待测溶液中,发生有色化合物的选择性吸附,使用智能手机获取彩色图像信息并提取不同颜色空间中的RGB值和HSV值等,利用Image-J软件进行色彩量化,从而实现柠檬黄定量分析,检测限为1.2 mg/L。该研究使用基于智能手机的MIPs比色装置,并采用特定的图像处理软件Image-J,使用多变量校准模型建立图像数据与目标物浓度之间的关系。上述方法有助于减少检测的时间,降低成本,相关思路为食品中其他危害物的高效分析提供了新路径。
为进一步提高可视化检测的精确度,将电致发光分析与人工神经网络相结合并使用自主设计软件进行图像处理和数据分析,引入机器学习提高了工作效率,所开发的基于智能手机的BIA在食品安全等领域具有广泛应用前景。LIU等[80]基于智能手机即时检测系统,研制了一种高效、便携和灵敏的CsPbBr3钙钛矿MIECL传感器,用于动物性食品中抗生素硝基呋喃酮(nitrofurazone,NFZ)的检测。MIPs复合材料吸附NFZ后,产生自由基离子并释放能量发光,采用Ag+@UiO-66-NH2/CsPbBr3作为ECL发射极,通过智能手机读取ECL信号并定量分析(图8),ECL信号在0.5 nmol/L~100 μmol/L范围内对NFZ呈线性响应,检测限为0.09 nmol/L。该研究使用智能手机摄像头采集发光图像,利用神经网络进行图像处理,并使用自行设计的软件对颜色进行结果分析,综合利用机器学习、智能手机摄影、ECL和MIT技术,所开发的基于智能手机的ECL-MIP传感器为食品安全即时监测提供了新的技术手段。
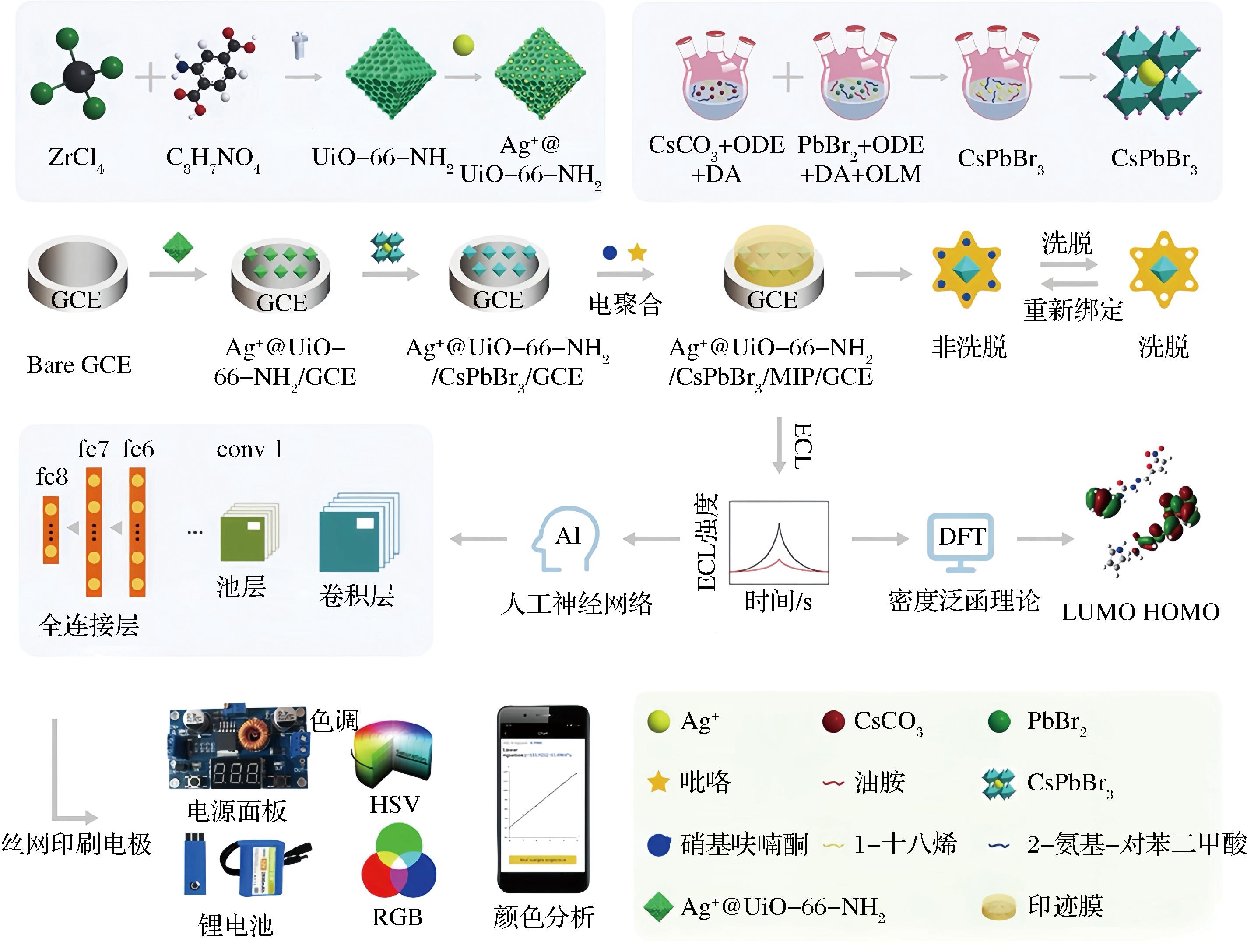
图8 基于便携式智能手机ECL-MIP系统的Ag+@UiO-66-NH2/CsPbBr3/MIP/GCE构建方法、机器学习优化与传感识别过程[80]
Fig.8 Ag+@UiO-66-NH2/CsPbBr3/MIP/GCE construction method,machine learning optimization and sensing recognition process based on portable smartphone ECL-MIP system[80]
基于智能手机的BIA在食品分析中应用较少,目前主要对农药、添加剂和病原菌等危害物检测,适用于温度、湿度和光照强度适中以及无剧烈振动的物理环境下进行检测。但在实际检测过程中存在一些限制因素,如实验条件和场所的改变、移动设备的变化,包括不同的手机品牌、软件选择和集成传感器硬件等都会导致检测性能差异,因此有必要对印迹材料的合成工艺和实验条件进行优化。基于智能手机的BIA减少了对大型检测设备的依赖,具有良好的检测性能和重现性,但目前仍处于发展阶段,存在兼容性差、自动化程度低以及捕获图像时有背景信号的干扰等问题。未来应开发多元检测技术,增强设备成像处理和数据分析能力,构建智能监测技术体系和标准。
3 总结与讨论
本文综述了近几年来几种基于MIPs的BIA系统在食品危害物检测中的应用。放射标记BIA法由于存在辐射安全和放射性污染,目前已较少应用;荧光标记BIA法不需要复杂的放射性防护设施,仅使用荧光检测仪器即可快速得到检测结果,但该方法易受荧光淬灭、背景荧光干扰等影响;EBIA采用酶作为标记物,与放射性或荧光标记物不同,其成本相对较低且具有较好的稳定性;电化学仿生印迹传感分析法所需的电化学检测仪器相对简单、便携,易于实现现场检测,但其检测灵敏度容易受到电极性能和溶液组成等因素的影响;CBIA不需要外部光源激发,避免了背景光的干扰,从而具有较高的灵敏度,可检测复杂基质中痕量目标物;与上述BIA方法相比,微流控纸基和基于智能手机的BIA法可实现分析过程的微型化和自动化,具有便携性与现场检测能力,并且智能手机还可通过网络实现检测数据的共享和远程监控。不同BIA方法各有优劣,在检测时可根据分析目的、目标分子特性、样品基质、检测要求、成本和时间等多个因素来选择。
基于MIPs的仿生印迹亲和分析具有选择性好、灵敏度高、稳定性好等特点,但目前的实际应用中仍有一些挑战需要解决:待测样品中通常存在多种危害物;与抗体相比,MIPs的亲和力和灵敏度和特异性有待提高;制备MIPs所用的功能单体和交联剂的种类较少,无法满足靶标高效识别的需要还存在模板分子洗脱不完全引起的测量误差等问题。为解决以上问题,未来可从以下几方面开展研究:一方面要研发多通道BIA技术;开发基于MIPs和适配体的混合识别技术进行协同识别;结合可控自由基聚合、点击化学环加成技术和多模板印迹等新技术来获得更好性能的MIPs。另一方面需要设计和制备新的单体和交联剂以及绿色反应介质提高聚合物的亲和力;开发水相中小分子靶标高性能的MIPs,结合智能传感平台实现多场景、多靶标即时在线监测;研发具有高亲和力和高选择性的分子印迹材料,以更好地适应商业化。总之,随着分子印迹和亲和分析技术的发展,BIA的灵敏度和准确性得到提高,将在食品安全检测中得到更广泛的应用。
[1] KUMAR V,VAID K,BANSAL S A,et al.Nanomaterial-based immunosensors for ultrasensitive detection of pesticides/herbicides:Current status and perspectives[J].Biosensors and Bioelectronics,2020,165:112382.
[2] SHEN Y S,MIAO P P,LIU S C,et al.Preparation and application progress of imprinted polymers[J].Polymers,2023,15(10):2344.
[3] KAYA S I,CETINKAYA A,OZKAN S A.Molecularly imprinted polymers as highly selective sorbents in sample preparation techniques and their applications in environmental water analysis[J].Trends in Environmental Analytical Chemistry,2023,37:e00193.
[4] YANG Y R,SHEN X T.Preparation and application of molecularly imprinted polymers for flavonoids:Review and perspective[J].Molecules,2022,27(21):7355.
[5] EL HARERY A H,ABDEL GHANI N T,EL NASHAR R M.Application of molecularly imprinted electrochemical sensor for selective non-labelled detection of acetamiprid insecticide in fruits[J].Journal of the Electrochemical Society,2023,170(2):027505.
[6] BHOGAL S,MOHIUDDIN I,KAUR K,et al.Mesoporous silica imprinted nanocomposites for selective adsorption and detection of levofloxacin[J].Journal of Water Process Engineering,2024,57:104693.
[7] TRAN H N,YOU S J,HOSSEINI-BANDEGHARAEI A,et al.Mistakes and inconsistencies regarding adsorption of contaminants from aqueous solutions:A critical review[J].Water Research,2017,120:88-116.
[8] WANG X,HUANG K,ZHANG H X,et al.Preparation of molecularly imprinted polymers on hemin-graphene surface for recognition of high molecular weight protein[J].Materials Science and Engineering:C,2019,105:110141.
[9] ATEF ABDEL FATAH M,ABD EL-MOGHNY M G,EL-DEAB M S,et al.Application of molecularly imprinted electrochemical sensor for trace analysis of Metribuzin herbicide in food samples[J].Food Chemistry,2023,404:134708.
[10] GAO Q,ZANG Y,ZHANG Y,et al.Composite polymerized molecular imprinting membrane-based electrochemical sensor for sensitive determination of curcumin by using 4-pentenoyl-aminoacyl-chitosan oligosaccharide as functional monomer oligomer[J].Journal of Electroanalytical Chemistry,2020,879:114793.
[11] SHAO Y M,ZHENG R,WANG P,et al.A novel surface molecularly imprinted polymer electrochemical sensor based on porous magnetic TiO2 for highly sensitive and selective detection of tetracycline[J].Environmental Science:Nano,2023,10(6):1614-1628.
[12] WANG J,DU X D,WANG Z F,et al.Optimization and verification of selective removal of organophosphate esters from wastewater by molecularly imprinted adsorbent[J].Chemosphere,2024,350:141082.
[13] LI Z Z,CHEN X J,ZHANG X W,et al.Selective solid-phase extraction of four phenylarsonic compounds from feeds,edible chicken and pork with tailoring imprinted polymer[J].Food Chemistry,2021,347:129054.
[14] ROLAND R M,AHMAD BHAWANI S,IBRAHIM M N M.Synthesis of molecularly imprinted polymer by precipitation polymerization for the removal of ametryn[J].BMC Chemistry,2023,17(1):165.
[15] ÇIMEN D,BERELI N,DENIZLI A.Patulin imprinted nanoparticles decorated surface plasmon resonance chips for patulin detection[J].Photonic Sensors,2022,12(2):117-129.
[16] OZGUR F O,ÇIMEN D,DENIZLI A,et al.Surface plasmon resonance based sensor for amaranth detection with molecularly imprinted nanoparticles[J].Photonic Sensors,2023,13(2):230201.
[17] LU Z W,QIN J,WU C,et al.Dual-channel MIRECL portable devices with impedance effect coupled smartphone and machine learning system for tyramine identification and quantification[J].Food Chemistry,2023,429:136920.
[18] MUTLU E, ENOCAK A,DEMIRBA
ENOCAK A,DEMIRBA E,et al.Electrochromic molecular imprinted polymer sensor for detection of selective acetamiprid[J].Microchemical Journal,2024,196:109626.
E,et al.Electrochromic molecular imprinted polymer sensor for detection of selective acetamiprid[J].Microchemical Journal,2024,196:109626.
[19] CHU B Q,YU Z P,MENG L,et al.A magnetic molecular imprinting-based fluorescence probe for sensitive and selective detection of 2,4-D herbicide[J].Luminescence,2024,39(2):e4662.
[20] YAN C Y,MO H B,WAN Y,et al.Design and controlled synthesis of molecularly imprinted fluorescence sensor supported by multifunctional magnetic covalent organic framework:Efficient detection of clofibric acid in the environment[J].Sensors and Actuators B:Chemical,2025,423:136725.
[21] BOYSEN R I.Advances in the development of molecularly imprinted polymers for the separation and analysis of proteins with liquid chromatography[J].Journal of Separation Science,2019,42(1):51-71.
[22] ARIAS P G,MART NEZ-PÉREZ-CEJUELA H,COMB
NEZ-PÉREZ-CEJUELA H,COMB S A,et al.Selective solid-phase extraction of organophosphorus pesticides and their oxon-derivatives from water samples using molecularly imprinted polymer followed by high-performance liquid chromatography with UV detection[J].Journal of Chromatography A,2020,1626:461346.
S A,et al.Selective solid-phase extraction of organophosphorus pesticides and their oxon-derivatives from water samples using molecularly imprinted polymer followed by high-performance liquid chromatography with UV detection[J].Journal of Chromatography A,2020,1626:461346.
[23] SURYA S G,KHATOON S,AIT LAHCEN A,et al.A chitosan gold nanoparticles molecularly imprinted polymer based ciprofloxacin sensor[J].RSC Advances,2020,10(22):12823-12832.
[24] TIAN L X,GUO H Q,LI J,et al.Fabrication of a near-infrared excitation surface molecular imprinting ratiometric fluorescent probe for sensitive and rapid detecting perfluorooctane sulfonate in complex matrix[J].Journal of Hazardous Materials,2021,413:125353.
[25] LI L L,ZHENG X Y,CHI Y H,et al.Molecularly imprinted carbon nanosheets supported TiO2:Strong selectivity and synergic adsorption-photocatalysis for antibiotics removal[J].Journal of Hazardous Materials,2020,383:121211.
[26] YANG Z T,WANG J Q,SHAH T,et al.Development of surface imprinted heterogeneous nitrogen-doped magnetic carbon nanotubes as promising materials for protein separation and purification[J].Talanta,2021,224:121760.
[27] ZHANG K Y,WANG Y F,WEN Q Y,et al.Preparation and characterization of magnetic molecularly imprinted polymer for specific adsorption of wheat gliadin[J].Journal of Molecular Structure,2022,1265:133227.
[28] VLATAKIS G,ANDERSSON L I,MÜLLER R,et al.Drug assay using antibody mimics made by molecular imprinting[J].Nature,1993,361(6413):645-647.
[29] RAMSTRÖM O,YE L,MOSBACH K.Artificial antibodies to corticosteroids prepared by molecular imprinting[J].Chemistry &Biology,1996,3(6):471-477.
[30] YANG Q,LI J H,WANG X Y,et al.Strategies of molecular imprinting-based fluorescence sensors for chemical and biological analysis[J].Biosensors and Bioelectronics,2018,112:54-71.
[31] KIMANI M,KISLENKO E,GAWLITZA K,et al.Fluorescent molecularly imprinted polymer particles for glyphosate detection using phase transfer agents[J].Scientific Reports,2022,12:14151.
[32] WU C X,CHENG R J,WANG J X,et al.Fluorescent molecularly imprinted nanoparticles for selective and rapid detection of ciprofloxacin in aquaculture water[J].Journal of Separation Science,2018,41(19):3782-3790.
[33] ANSARI S,KARIMI M.Novel developments and trends of analytical methods for drug analysis in biological and environmental samples by molecularly imprinted polymers[J].TrAC Trends in Analytical Chemistry,2017,89:146-162.
[34] SU X M,LI X Y,LI J J,et al.Synthesis and characterization of core-shell magnetic molecularly imprinted polymers for solid-phase extraction and determination of Rhodamine B in food[J].Food Chemistry,2015,171:292-297.
[35] GUO P Q,YANG W,HU H,et al.Rapid detection of aflatoxin B1 by dummy template molecularly imprinted polymer capped CdTe quantum dots[J].Analytical and Bioanalytical Chemistry,2019,411(12):2607-2617.
[36] LUO S Q,SUN X J,ZHANG L F,et al.Preparation of room-temperature phosphorescence-ratiometric fluorescence magnetic mesoporous imprinted microspheres and its application in detection of malachite green and tartrazine in multimatrix[J].Food Chemistry,2024,430:137096.
[37] PAN M F,GAO M M,CUI J J,et al.Fluorescent molecularly imprinted hydrogel sensing strip based on nitrogen-doped carbon dots and inverse opal photonic crystals applying for effective detection for imidacloprid in fruits and vegetables[J].Food Chemistry,2025,477:143497.
[38] LI C,MA Y M,FAN C,et al.A highly efficient molecularly imprinted fluorescence sensor for selective and sensitive detection of tetracycline antibiotic residues in pork[J].Journal of Food Composition and Analysis,2024,133:106367.
[39] ZHAO C,REN Y M,LI G.Detection of naringin by fluorescent polarization molecularly imprinted polymer[J].Polymer Bulletin,2023,80(2):1411-1424.
[40] LIU H,YANG J,SUN X Y,et al.An advanced molecularly imprinted photochemical sensor based carbon quantum dots for highly sensitive detection of chloramphenicol in food[J].Journal of Fluorescence,2024,34(3):1007-1014.
[41] ZHANG X,JIAO P F,MA Y H,et al.Molecular imprinted ZnS quantum dots-based sensor for selective sulfanilamide detection[J].Polymers,2022,14(17):3540.
[42] YU Q R,HE C X,LI Q,et al.Fluorometric determination of acetamiprid using molecularly imprinted upconversion nanoparticles[J].Microchimica Acta,2020,187(4):222.
[43] CHEN Y L,FAN F F,FANG G Z,et al.Fluorometric determination of tyramine by molecularly imprinted upconversion fluorescence test strip[J].Microchimica Acta,2020,187(10):573.
[44] CHEN G N,GUO P Q,WANG Y,et al.Preparation of molecularly imprinted polymers and application in a biomimetic biotin-avidin-ELISA for the detection of bovine serum albumin[J].Talanta,2019,198:55-62.
[45] TAN F,ZHAI M Y,MENG X J,et al.Hybrid peptide-molecularly imprinted polymer interface for electrochemical detection of vancomycin in complex matrices[J].Biosensors and Bioelectronics,2021,184:113220.
[46] WANG X M,CHEN C,XU L H,et al.Development of molecularly imprinted biomimetic immunoassay method based on quantum dot marker for detection of phthalates[J].Food and Agricultural Immunology,2019,30(1):1007-1019.
[47] PENG X L,WANG S Q,SU K Y,et al.Direct competitive immunoassay method for sensitive detection of the histamine in foods based on a MI-Cu-GMP nanozyme marker and molecularly imprinted biomimetic antibody[J].Journal of the Science of Food and Agriculture,2025,105(2):791-797.
[48] ZHANG L L,ZHU J S,LI K.Peroxidase activity based on Cu2SnS3 quantum dots for the degradation and visual detection of Zearalenone[J].Materials Today Communications,2023,35:105871.
[49] HOU H Z,SU Y,LIU G L,et al.Determination of niclosamide and its two metabolites in fish by molecularly imprinted microsphere-based pseudo-ELISA[J].Food Additives &Contaminants.Part A,Chemistry,Analysis,Control,Exposure &Risk Assessment,2023,40(11):1450-1458.
[50] PENG X L,CHEN Y F,GAO C H,et al.Development of an immunoassay method for the sensitive detection of histamine and tryptamine in foods based on a CuO@Au nanoenzyme label and molecularly imprinted biomimetic antibody[J].Polymers,2022,15(1):21.
[51] CHO C H,KIM J H,PADALKAR N S,et al.Nanozyme-assisted molecularly imprinted polymer-based indirect competitive ELISA for the detection of marine biotoxin[J].Biosensors and Bioelectronics,2024,255:116269.
[52] HE J B,LIU G Y,JIANG M D,et al.Development of novel biomimetic enzyme-linked immunosorbent assay method based on Au@SiO2 nanozyme labelling for the detection of sulfadiazine[J].Food and Agricultural Immunology,2020,31(1):341-351.
[53] WANG X F,CHEN Y F,YU R Z,et al.A sensitive biomimetic enzyme-linked immunoassay method based on Au@Pt@Au composite nanozyme label and molecularly imprinted biomimetic antibody for histamine detection[J].Food and Agricultural Immunology,2021,32(1):592-605.
[54] 刘志航,宦双燕,浣石,等.基于分子印迹的电化学传感器研究进展[J].化学传感器,2005,25(4):1-8.LIU Z H,HUAN S Y,HUAN S,et al.Progress of electrochemical sensor based on molecular imprinting[J].Chemical Sensors,2005,25(4):1-8.
[55] AYANKOJO A G,REUT J,CIOCAN V,et al.Molecularly imprinted polymer-based sensor for electrochemical detection of erythromycin[J].Talanta,2020,209:120502.
[56] YAO M C,DONG L,FU Y H,et al.A sensitive enzyme-free electrochemical sensor based on ZnWO4@co-MNPC@MIP for specific recognition and determination of chloramphenicol in milk sample[J].Food Chemistry,2024,460(Pt 3):140711.
[57] WANG C,QI L B,LIANG R N,et al.Multifunctional molecularly imprinted receptor-based polymeric membrane potentiometric sensor for sensitive detection of bisphenol A[J].Analytical Chemistry,2022,94(22):7795-7803.
[58] MAHMOUD A M,ALQAHTANI Y S,AL-QARNI A O,et al.Molecular imprinting technology for electrochemical sensing of kasugamycin in food products based on Cu2+/Cu+ stripping current[J].Analytical Methods,2024,16(47):8194-8203.
[59] TANG X M,WU T,WANG C Y,et al.A three-in-one strategy of molecularly imprinted polymers-based electrochemical SERS for sensitive detection of acetamiprid in vegetables[J].Food Chemistry,2025,476:143439.
[60] JAFARI S,DEHGHANI M,NASIRIZADEH N,et al.Label-free electrochemical detection of Cloxacillin antibiotic in milk samples based on molecularly imprinted polymer and graphene oxide-gold nanocomposite[J].Measurement,2019,145:22-29.
[61] REBELO P,PACHECO J G,CORDEIRO M N D S,et al.Azithromycin electrochemical detection using a molecularly imprinted polymer prepared on a disposable screen-printed electrode[J].Analytical Methods,2020,12(11):1486-1494.
[62] AGHOUTANE Y,DIOUF A,ÖSTERLUND L,et al.Development of a molecularly imprinted polymer electrochemical sensor and its application for sensitive detection and determination of malathion in olive fruits and oils[J].Bioelectrochemistry,2020,132:107404.
[63] LI W Q,DIAO K S,QIU D Y,et al.A highly-sensitive and selective antibody-like sensor based on molecularly imprinted poly(L-arginine) on COOH-MWCNTs for electrochemical recognition and detection of deoxynivalenol[J].Food Chemistry,2021,350:129229.
[64] RADI A E,EISSA A,WAHDAN T.Molecularly imprinted impedimetric sensor for determination of mycotoxin Zearalenone[J].Electroanalysis,2020,32(8):1788-1794.
[65] CHEN G,JIN M J,DU P F,et al.A sensitive chemiluminescence enzyme immunoassay based on molecularly imprinted polymers solid-phase extraction of parathion[J].Analytical Biochemistry,2017,530:87-93.
[66] PAN Y C,LIU X,LIU J,et al.Chemiluminescence sensors based on molecularly imprinted polymers for the determination of organophosphorus in milk[J].Journal of Dairy Science,2022,105(4):3019-3031.
[67] XU J J,ZHANG R R,LIU C X,et al.Highly selective electrochemiluminescence sensor based on molecularly imprinted-quantum dots for the sensitive detection of cyfluthrin[J].Sensors,2020,20(3):884.
[68] LU Z W,DAI S J,LIU T,et al.Machine learning-assisted Te-CdS@Mn3O4 nano-enzyme induced self-enhanced molecularly imprinted ratiometric electrochemiluminescence sensor with smartphone for portable and visual monitoring of 2,4-D[J].Biosensors and Bioelectronics,2023,222:114996.
[69] WANG H Y,CAI L,HAO W,et al.A magnetically fixed bifunctional monomer molecularly imprinted electrochemiluminescence sensor for specifically identifying thiabendazole in food[J].Sensors and Actuators B:Chemical,2024,413:135915.
[70] CAI Y,HE X,CUI P L,et al.Preparation of a chemiluminescence sensor for multi-detection of benzimidazoles in meat based on molecularly imprinted polymer[J].Food Chemistry,2019,280:103-109.
[71] JIA B J,HE X,CUI P L,et al.Detection of chloramphenicol in meat with a chemiluminescence resonance energy transfer platform based on molecularly imprinted graphene[J].Analytica Chimica Acta,2019,1063:136-143.
[72] ZHANG X Y,LIU J X,JIANG Z Q,et al.Molecularly imprinted polymer based chemiluminescence method for detection of nitrofurans[J].Australian Journal of Chemistry,2019,72(5):375.
[73] LI Z B,LIU J,LIU J X,et al.Determination of sulfonamides in meat with dummy-template molecularly imprinted polymer-based chemiluminescence sensor[J].Analytical and Bioanalytical Chemistry,2019,411(14):3179-3189.
[74] HUANG J J,LIU J,LIU J X,et al.A microtitre chemiluminescence sensor for detection of pyrethroids based on dual-dummy-template molecularly imprinted polymer and computational simulation[J].Luminescence,2020,35(1):120-128.
[75] FANG M,ZHOU L,ZHANG H,et al.A molecularly imprinted polymers/carbon dots-grafted paper sensor for 3-monochloropropane-1,2-diol determination[J].Food Chemistry,2019,274:156-161.
[76] YAN X P,ZHANG Z,ZHANG R G,et al.Rapid detection of dimethoate in soybean samples by microfluidic paper chips based on oil-soluble CdSe quantum dots[J].Foods,2021,10(11):2810.
[77] SAWETWONG P,CHAIRAM S,JARUJAMRUS P,et al.Enhanced selectivity and sensitivity for colorimetric determination of glyphosate using Mn-ZnS quantum dot embedded molecularly imprinted polymers combined with a 3D-microfluidic paper-based analytical device[J].Talanta,2021,225:122077.
[78] HU X L,CAO Y C,CAI L,et al.A smartphone-assisted optosensing platform based on chromium-based metal-organic framework signal amplification for ultrasensitive and real-time determination of oxytetracycline[J].Journal of Hazardous Materials,2023,444(Pt A):130395.
[79] JACINTO C,MAZA MEJ A I,KHAN S,et al.Using a smartphone-based colorimetric device with molecularly imprinted polymer for the quantification of tartrazine in soda drinks[J].Biosensors,2023,13(6):639.
A I,KHAN S,et al.Using a smartphone-based colorimetric device with molecularly imprinted polymer for the quantification of tartrazine in soda drinks[J].Biosensors,2023,13(6):639.
[80] LIU T,HE J,LU Z W,et al.A visual electrochemiluminescence molecularly imprinted sensor with Ag+@UiO-66-NH2 decorated CsPbBr3 perovskite based on smartphone for point-of-care detection of nitrofurazone[J].Chemical Engineering Journal,2022,429:132462.