米曲霉(Aspergillus oryzae),属于半知菌亚门、曲霉属,在豆类发酵产品如豆瓣酱、酱油中发挥着重要的作用[1]。与曲霉属的黄曲霉相比,因米曲霉在生长过程中不产黄曲霉毒素,也被美国食品药品监督管理局和世界卫生组织认定为普遍安全微生物[2]。米曲霉是东亚国家传统发酵制品的重要菌种,如中国的豆瓣酱、酱油、黄豆酱及日本的清酒、味噌[3]。在豆类发酵食品生产过程中,米曲霉用于制曲阶段,其主要作用是产各种酶类,包括蛋白酶、碳水化合物酶、谷氨酰胺酶等,这些酶会将原料中的大分子物质(如蛋白质和淀粉)等分解为小分子物质。例如,蛋白酶将蛋白质降解成为小分子的含氮化合物,如氨基酸和寡肽等。得到的小分子化合物既可作为营养被发酵过程中的微生物群落用于生长,又可作为前体物质被转化为次级代谢产物;此外,剩余的小分子物质也更易被人体消化吸收。由此可见,米曲霉中的蛋白酶及其他酶类有利于提升豆类发酵食品的品质。
蛋白酶是米曲霉在豆类发酵食品中分泌的最重要的酶,可催化蛋白质、多肽类物质水解。各国科学家对于米曲霉蛋白酶的研究源于上世纪50年代,CREWTHER等[4]和NAKADAI等[5]开始探究酶学性质,他们从米曲霉提取出了部分蛋白酶,并研究了其酶学性质。MACHIDA等[6]通过生物信息学手段在2005年通过全基因组测序获得了米曲霉RIB40的全基因组信息,发现米曲霉RIB40含有8条染色体,基因组大小为37.6 Mb,同时也预测了蛋白编码基因12 090个。KOBAYASHI等[7]针对GATA因子进行了预测,发现米曲霉RIB40基因组的有6个;同样的,JIANG等[8]也针对于GATA因子进行了研究,发现米曲霉沪酿3.042有7种GATA蛋白,功能表征后,发现他们有抗环境胁迫的作用。2017年,THAMMARONGTHAM等[9]通过米曲霉BCC7051的基因组,发现了11 456个编码的蛋白基因,其中304个基因参与了脂质的代谢和运输。KUSUMOTO[10]对米曲霉基因组进行了分析,发掘出DapA,DapA与啤酒酵母天冬氨酰氨肽酶属于同源物,鉴定DapA为米曲霉的新型肽酶。ZHANG等[11]通过对比3个工业米曲霉菌株的转录组以及基因组,发现了58个候选潜在重要蛋白酶。然而,米曲霉的蛋白酶分泌体系较为复杂且存在一定的遗传不稳定性。目前对于米曲霉中蛋白酶分泌特性、制曲过程中关键蛋白酶在蛋白质降解过程中的作用、蛋白酶的催化特性等问题仍未完全清楚。这严重影响了对米曲霉蛋白酶的研究,同时限制了米曲霉在发酵中的进一步应用。
在前期研究中,NIU等[12]从豆瓣酱酱醅中分离得一株具较强蛋白酶生产能力的Aspergillus oryzae BL18,验证了其用于豆类发酵品中发酵的安全性。在制曲过程中,A.oryzae BL18比常用发酵剂A.oryzae 3.042有更快的孢子产率和更强的蛋白酶产率,在酱油等传统发酵食品中具有潜在应用价值。在此基础上,通过A.oryzae BL18在制曲过程中的转录组学分析,发现GME238_g基因在制曲过程中具有较高的表达情况,说明该酶可能是米曲霉分泌的关键蛋白酶。因此,本研究对A.oryzae BL18来源具有较高表达量的蛋白酶GME238_g基因在毕赤酵母GS115菌株中进行了异源表达,并表征了其酶学性质。最后,将所得蛋白酶应用于酱油发酵过程。本论文结果将有助于进一步挖掘米曲霉蛋白酶资源,拓展其在传统发酵食品中的应用。
1 材料与方法
1.1 材料与试剂
Escherichia coli JM109、A.oryzae BL18、Komagataella phaffii GS115和质粒pPIC9k均保藏于本实验室。感受态细胞制备试剂盒,SDS-PAGE loading buffer等分子试剂,中国大连TaKaRa公司;硫酸卡那霉素,德国Sigma-Aldrich公司;质粒提取试剂盒、Cycle Pure试剂盒,美国OMEGA Bio-tek公司;Ni-NTA纯化柱及其他生化试剂,中国国药集团;总RNA抽提纯化试剂盒、Bradford蛋白浓度测定试剂盒,上海生工生物工程有限公司;Hifair® Ⅲ 1 st Strand cDNA Synthesis SuperMix,上海翌圣生物科技有限公司;2×Phanta Max Master Mix (Dye Plus),南京诺唯赞生物科技有限公司;Ni-NTA磁珠,普睿迈格(厦门);蛋白超滤管,美国PALL公司;PD-10脱盐柱,美国GE healthcare医疗公司;水性过滤膜,浙江欧尔赛斯科技有限公司;PDA固体培养基,上海源叶生物公司。
LB培养基(g/L):蛋白胨10,酵母膏5,氯化钠10,氨苄青霉素100 μg/mL,固体则再加琼脂20;
YPD培养基(g/L):酵母膏10,蛋白胨20,葡萄糖20,氨苄青霉素100 μg/mL,固体则再加琼脂20;
缓冲甲醇复合(buffered methanol-complex medium,BMMY)培养基(g/L):蛋白胨20.0,酵母浸粉10.0,磷酸盐缓冲液(pH 6.0)100 mmol/mL,YNB(无氨基酵母氮源)13.4,甘油10.0,生物素100 μg/mL,氨苄青霉素100 μg/mL;
蚕豆的球蛋白以及清蛋白的提取[13]:称取蚕豆,研磨后,提取水溶蛋白(清蛋白)以及盐溶蛋白(球蛋白)。
1.2 仪器与设备
PL2002电子天平,梅特勒-托利多仪器有限公司;SPX-250生化培养箱,上海博讯实业有限公司医疗设备厂;5430R高速冷冻离心机和移液枪,艾本德公司;SW-CJ-2FD超净工作台,苏州空气设备净化厂;SD20精密数显pH计,德国梅特勒-托利多公司;TRACE1300气相色谱-质谱联用,赛默飞科技有限公司;Primaide PLUS高效液相色谱仪,日本日立公司;PrimePlus AKTA蛋白纯化系统,美国通用电气公司;UV-1200紫外-可见光分光光度计,上海美谱达仪器有限公司;Waters 2695 HPLC 系统,沃特世科技(上海)有限公司,Agilent 100高效液相色谱,安捷伦科技有限公司。
1.3 实验方法
1.3.1 蛋白酶的异源表达
1.3.1.1 米曲霉BL18的cDNA文库构建
通过提取米曲霉BL18的RNA再通过逆转录从而获取米曲霉的cDNA文库。为了获取米曲霉BL18的RNA,将米曲霉BL18接种至PDA固体培养基中,于30 ℃培养72 h,此时菌丝呈绿色。为了提取米曲霉BL18的RNA,使用柱式真菌总RNA抽提纯化试剂盒。使用Hifair® Ⅲ 1 st Strand cDNA Synthesis SuperMix合成第一链cDNA,以第一链cDNA作为模板,并通过PCR获取cDNA,使用2×Phanta Max Master Mix (Dye Plus)进行PCR得到米曲霉BL18的cDNA文库。
1.3.1.2 蛋白酶异源表达载体及重组毕赤酵母菌株的构建
以上述cDNA为模板,设计GME238_g的引物,在N端插入His标签,并进行PCR以获得相应的目的基因。使用基因重组酶将GME238_g插入pPIC9k载体中,转化大肠杆菌JM109感受态细胞。取重组质粒均匀涂布于含50 μg/mL氨苄青霉素的LB琼脂板,随后置于37 ℃条件下培育12 h。接着,把获得的阳性转化子转至装有50 μg/mL氨苄青霉素的LB液体培养基内,在37 ℃、200 r/min的环境中振荡培养12 h。通过质粒提取试剂盒从重组大肠杆菌细胞中提取重组质粒,并用Sal I限制性内切酶进行线性化,线性化后的产物通过Cycle Pure试剂盒进行回收,线性化质粒通过电转化法转化进入毕赤酵母GS115中,将200 μL菌液涂布在YPD(含G418以及氨苄青霉素)琼脂板上,在30 ℃孵育3~7 d。上述阳性菌落经菌落PCR以及Sanger测序(金唯智,苏州)验证。
1.3.1.3 重组蛋白酶的表达及纯化
从琼脂板上挑选阳性菌落,接种于BMMY培养基中,在30 ℃、200×g孵育。当OD600值达到2.0~6.0时,将溶液转移到50 mL无菌离心管中,在2 000×g、4 ℃下离心5 min。移去上清液后用5 mL无菌生理盐水重悬菌体进行洗涤,重复2次,2 000×g、4 ℃下离心5 min后去除上清液,收集菌体;将酵母重悬于BMMY培养基中并使OD600值为1,在30 ℃、200×g培养5 d,每隔24 h加入10 g/L的甲醇,以诱导蛋白酶的表达。
重组蛋白酶通过同源重组插入了His标签,因此选用Ni-NTA预载重力柱或Ni-NTA磁珠,通过20~500 mmol/L咪唑溶液进行线性梯度纯化。在上料前将粗酶溶液用0.45 μm滤膜过滤,以防止重量柱堵塞。用不同浓度的咪唑溶液洗脱蛋白酶。洗脱获得的溶液采用截留分子质量为10 kDa的蛋白超滤管来进行浓缩,并借助PD-10脱盐柱完成脱盐步骤。然后,使用SDS-PAGE技术对所得样品的纯度展开分析,同时采用Bradford蛋白浓度测定试剂盒来测定蛋白浓度。
1.3.2 蛋白酶酶活力及催化动力学的测定
蛋白酶活性通过福林酚试剂法测定。参考SB/T 10317—1999《蛋白酶活力测定法》以0.5~25 mg/mL的酪蛋白为底物,测定蛋白酶的活性,以研究蛋白酶的催化性能。采用Lineweaver-Burke双反曲线法,利用GraphPad Prism 8分析了蛋白酶的动力学参数Km和Vmax。
1.3.3 酶学性质测定
其他参数保持不变,测定了蛋白酶不同温度(20~80 ℃)或不同pH值(3~12)条件下得出蛋白酶的最佳温度或最佳pH曲线。最高的蛋白酶活性被记录为100%,其他的以酶活性的相对百分比表示。
将金属离子(Co2+、Fe3+、Na+、Zn2+、Mn2+、K+、Ca2+、Li+、Cu2+、Mg2+、Ba2+)溶液与蛋白酶混合,以探寻金属离子对蛋白酶活力的影响,并在37 ℃孵育1 h后测定酶活力。将不同浓度NaCl(100、140、180 g/L)溶液与酶混合,测定盐度对蛋白酶活性的影响,在室温下,每隔24 h进行测定。最高的蛋白酶活性被记录为100%,其他的以酶活性的相对百分比表示。
1.3.4 蛋白酶对球蛋白和清蛋白的降解作用
通过将蛋白酶溶液与底物溶液(球蛋白和球蛋白)以100∶1(U/g)的比例混合,在50 ℃,pH 7下处理120 min,评估蛋白酶对球蛋白和白蛋白的降解能力。等量样品在0、15、30、45、60、120 min的间隔中取出,并立即在90 ℃下加热10 min以停止酶反应。用3-硝基苯磺酸(3-nitrobenzenesulfonic acid,TNBS)[14]法测定游离氨基的浓度,用等量蒸馏水与球蛋白或白蛋白溶液混合处理,作为对照。用6 mol/L HCl在110 ℃下处理样品,测定总氨基的浓度。通过游离氨基浓度除以总氨基浓度来计算蛋白水解酶对球蛋白或白蛋白的降解程度。
为了确定酶解结果,采用凝胶过滤色谱法(gel filtration chromatography,GFC)测定酶解后不同分子质量肽的比例。将蛋白酶溶液与球蛋白或白蛋白溶液按100∶1(U/g)混合。50 ℃处理60 min后,立即加热至90 ℃,10 min停止酶促反应。水解后的100 μL溶液用蒸馏水固定至10 mL,在25 ℃下超声5 min。在4 ℃下8 000×g离心5 min后,上清液通过0.22 μm水性过滤膜过滤。采用Waters 2695 HPLC 系统,配以2487紫外检测器分析多肽的组成。色谱柱为TSKgel2000 SWXL (300 mm×7.8 mm);柱温30 ℃;检测波长220 nm;流速0.5 mL/min。制备分子质量校准曲线的标准品包括甘氨酸-甘氨酸-甘氨酸(Mw=189)、甘氨酸-甘氨酸-酪氨酸-精氨酸(Mw=451)、杆菌肽(Mw=1 422)、丙氨酸蛋白(Mw=6 500)和细胞色素C(Mw=12 384)。
1.3.5 蛋白酶在酱油中的应用
1.3.5.1 酱油发酵样品的准备
豆粕与麦麸按质量比3∶2混合,100%湿润,121 ℃灭菌20 min。冷却至40 ℃以下,接种107/g米曲霉BL18孢子,在30 ℃、95%湿度条件下培养72 h,制得成熟曲。然后将成熟曲与盐水(220 g/L)按质量比1∶2混合,在恒温恒湿培养箱中30 ℃发酵80 d。发酵开始时,在发酵体系中按0.1%的比例加入蛋白酶。在发酵系统中加入等量蒸馏水作为对照。分别在发酵第1、7、14、21、28、35、50、65、80天取样。每个样品发酵3批次,每桶发酵量为3 kg。
1.3.5.2 酱油理化指标的测定
酱油的pH、总酸、氨基酸态氮、还原糖的测定参考GB 2717—2018《食品安全国家标准 酱油》。
1.3.5.3 酱油中游离氨基酸的测定
参考邢先雷等[15]的方法。取发酵第80天样品,称取1.0 g酱油样品,首先加入0.3 mol/L的三氯乙酸溶液,将其溶解后定容至25 mL。接着,将该溶液置于超声波清洗仪内,在常温下进行20 min的超声波处理。超声波处理结束后,使其静置2 h。随后,通过双层滤纸进行过滤操作,取1 mL经过滤后的澄清滤液置于1.5 mL离心管中,以8 000×g离心10 min,再取400 μL上清液,经0.45 μm的水相滤膜过滤后,运用Agilent 100高效液相色谱仪展开测定。其液相条件设定如下:色谱柱选用ODS柱(250 mm×4.6 mm,5 μm),进样量10 μL,柱温40 ℃,紫外检测波长338 nm(脯氨酸262 nm),流动相A为醋酸钠溶液(20 mmol/L),流动相B为V(醋酸钠溶液)∶V(甲醇)∶V(乙腈)=1∶2∶2,洗脱方式为等量洗脱,流速1.0 mL/min。
1.3.5.4 酱油中有机酸的测定
酱油中有机酸的标曲以及有机酸的测定均参考邢先雷等[15]的方法,5.0 g研磨好的酱油样品准确称重,加热至微沸。冷却后,依次加入0.5 mL,0.46 mol/L铁氰化钾溶液和0.5 mL、1.86 mol/L硫酸锌溶液,使用流动相补至50 mL。静置30 min,依次用滤纸和0.45 μm有机过滤膜过滤,最终使Waters Atlantis T3色谱柱(250 mm×4.6 mm,5 μm),利用HPLC测定有机酸含量。进样量10 μL;柱温55 ℃;紫外检测波长210 nm;流动相为V(H2O)∶V(2.5 mmol/L H2SO4)=3∶1(pH 2.7);采用等密度洗脱,流速0.6 mL/min。
1.3.5.5 酱油中挥发性风味化合物的分析
使用顶空固相微萃取-气相色谱-质谱(headspace-solid phase micro extraction-gas chromatography-mass spectrometry,HS-SPME-GC-MS)分析酱油的香气组分。样品处理及分析条件参考文献[16]方法,发酵80 d后采集样品,将酱油样品(2.0 g)与2.0 g的NaCl、6 mL的ddH2O混合于15 mL气相瓶中,加入5 μL 的2-辛醇(102.8 mg/L)作为内标。采用OV-1701毛细管柱(30 mm×0.25 mm,0.25 μm),HS-SPME GC-MS分析挥发性风味物质。样品进样温度250 ℃,气相色谱柱温度32 ℃,以5 ℃/min的速度升至180 ℃,再以12 ℃/min的速度升至240 ℃,保持5 min。载气(He)以0.8 mL/min的流速使用,不分流。在70 eV的EI电离源下获得了挥发性风味化合物的GC-MS图谱,结果与NSIT光谱库和Willey光谱库相匹配。只使用匹配值大于700的识别。以2-辛醇为内标,定量测定样品中各VFC的相对含量。
1.3.5.6 酱油的感官评价
按照GB/T 5009.39—2003《酱油卫生标准的分析方法》中对于感官检查的标准对酱油样品进行感官评价,包括颜色、外观、香气、味道和典型性。由20名经验丰富的感官评估员组成的小组(10名男性和10名女性)来评估酱油样品的风味特征。感官评价在20~25 ℃进行,采用双盲试验设计。采用十度法,10点和0点分别代表最佳和最差强度。
1.4 数据处理与分析
通过Alphafold2[17]在线服务器(https://swissmodel.expasy.org/)对蛋白酶三维结构进行同源建模,并用Procheck软件对构建的蛋白酶三维结构进行验证。采用Pymol软件对蛋白酶结构进行可视化和分析[18]。通过ExPASy Prot Param (http://www.expasy.org/tools/protparam.html)和SignalP4.0在线服务器[19]预测理论蛋白酶的分子质量(Mw)、理论等电点(isoelectric point,pI)和信号肽,采用Origin软件进行统计ANOVA分析。用NeturfP软件预测蛋白酶的二级结构,用Interpro软件预测蛋白酶的功能。所有实验数据均使用独立平行实验的平均值及标准差表示。
2 结果与分析
2.1 GME238_g蛋白酶基因在毕赤酵母中的异源表达及纯化
毕赤酵母表达系统具有高表达水平、易于遗传操作、具备糖基化、蛋白磷酸化等翻译后修饰的能力,而pPIC9K是蛋白酶表达常用质粒,其AOX1启动子具有能够高表达外源基因的优点[20]。因此,在RT-PCR过程中通过引物设计在GME238_g基因的N端引入his-tag标签,搭建了pPIC9K-GME238_g的重组质粒,并先后转化至E.coli JM109和K.phaffii GS115。通过菌落PCR和基因测序,成功构建了K.phaffii GS115/pPIC9K-GME238_g的重组菌株。将上述重组毕赤酵母菌株在BMGY培养基进行诱导产酶,期间每隔24 h加10 g/L甲醇进行诱导培养5 d后,发现含GME238_g基因重组菌株发酵液中的粗酶活力为(91.14±10.01) U/mL,说明上述4种蛋白酶已经成功表达。在此基础上,为了获得较纯的蛋白酶,通过Ni2+亲和层析对蛋白酶进行纯化,再用超滤管进行多次脱盐处理取,最后将纯化后的酶液进行了SDS-PAGE分析。如图1-a所示,GME238_g蛋白酶在SDS-PAGE上为单一条带,且其分子质量大小与蛋白酶理论分子质量(52.4 kDa)相符。上述结果说明GME238_g蛋白酶已得到纯化。
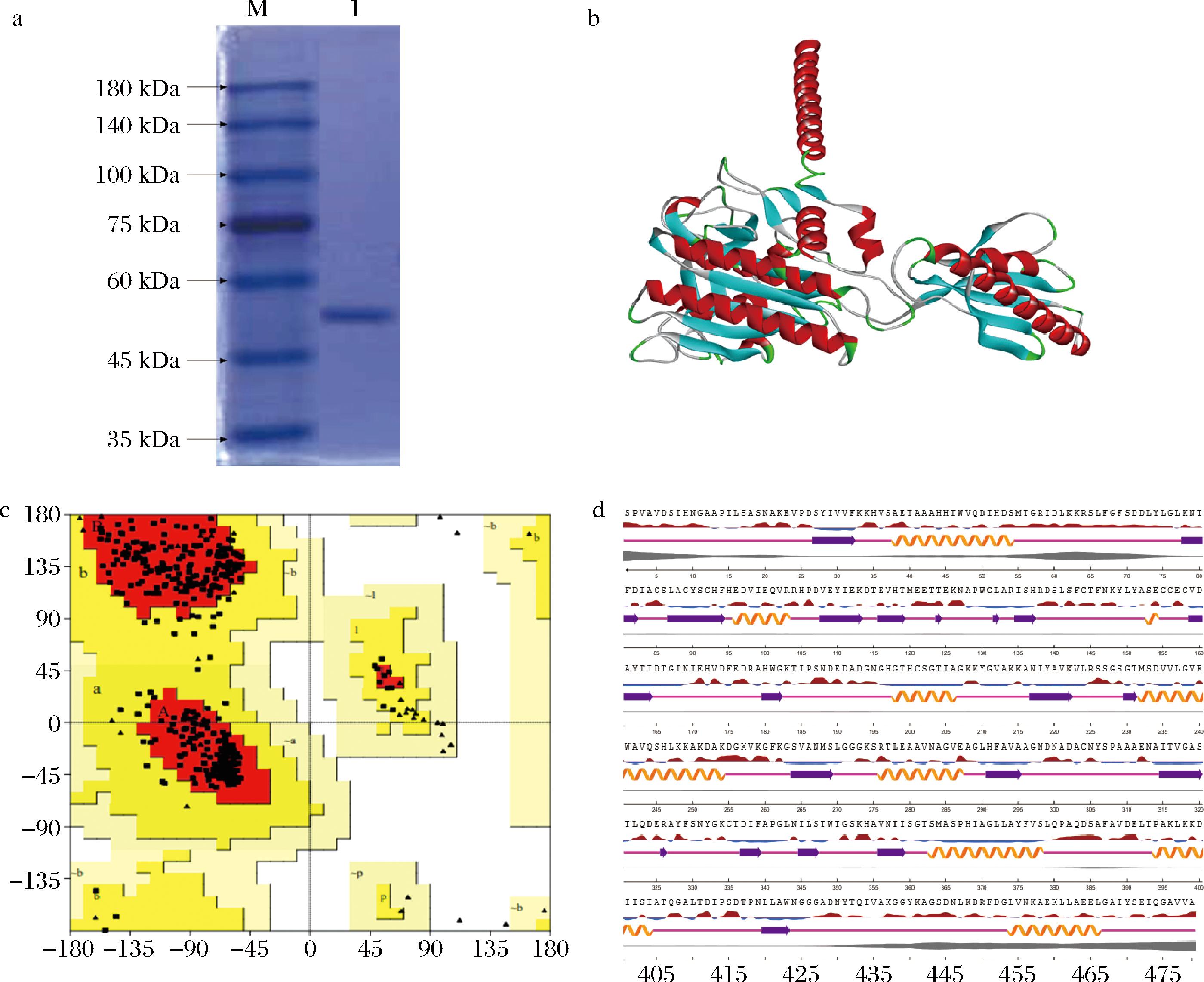
a-SDS-PAGE图(M-marker,1-纯化后GME238_g蛋白酶);b-GME238_g蛋白酶的三维结构图;c-GME238_g蛋白酶的拉式图;d-GME238_g蛋白酶的二维结构图
图1 GME238_g蛋白酶的纯化及结构分析
Fig.1 Purification result and the tertiary/secondary structure of GME238_g
通过Alphafold2软件构建GME238_g蛋白酶的三维结构(图1-b),并通过ProCheck软件验证其可行性(图1-c)。此外,还通过NeturfP软件预测了其二级结构(图1-d)。如图1-b和图1-d所示,GME238_g蛋白酶的三维结构有2个由短连接体连接的结构域,由9个α-螺旋和20个β-折叠组成,且有3个活性位点分别位于181D、213H、379S位。通过Interpro软件预测该蛋白酶对蛋白质水解具有广泛的特异性,且水解Bz-Arg-OEt的能力比Ac-Tyr-Oet强,同时该蛋白酶无肽酰胺和丝氨酸型内肽酶活性。
2.2 GME238_g蛋白酶酶学性质分析
测定了GME238_g蛋白酶的催化性质。GME238_g蛋白酶的比酶活力为(2 455.53±30.26) U/mg。在此基础上,以酪蛋白为底物测定了蛋白酶的动力学参数。GME238_g的Km值为0.30 mmol/L;Vmax为0.94 mmol/min;kcat值为1.57 min-1,从而计算出kcat/Km值为5.23 L/(min·mmol)。
为进一步探究GME238_g蛋白酶的酶学性质,测定了其最适温度、最适pH以及pH稳定性。如图2-a所示,GME238_g的最适温度为45 ℃,其在50 ℃时剩余酶活力为99%,而超过50 ℃,剩余酶活急剧降低至28%,且在75 ℃失活。如图2-b所示,GME238_g蛋白酶的最适pH值为8,且在pH 5~9有酶活性;当在不同pH处理1 h后,该蛋白酶在pH 8时剩余酶活力接近100%,而在pH 7时剩余酶活力>60%,在pH 5~6 和pH 9时剩余酶活力>20%(图2-c)。在此基础上,测定了金属离子对GME238_g蛋白酶酶活力的影响。将蛋白酶在含5 mmol/L不同金属离子的溶液中放置1 h并测定其剩余酶活力,以酶在水中放置的数据为对照。由图2-d可知,Co+、Li+、Ba2+、Mn2+和Ca2+对GME238_g蛋白酶具有强抑制作用,处理后剩余酶活力均低于20%,其中经过Mn2+以及Ca2+处理后蛋白酶完全失活;Na+和Cu2+对蛋白酶有一定的抑制作用;Fe3+和K+对GME238_g蛋白酶有强促进作用,其处理后的酶活力超过140%;Zn2+以及Mg2+对GME238_g蛋白酶同样具有一定促进作用。
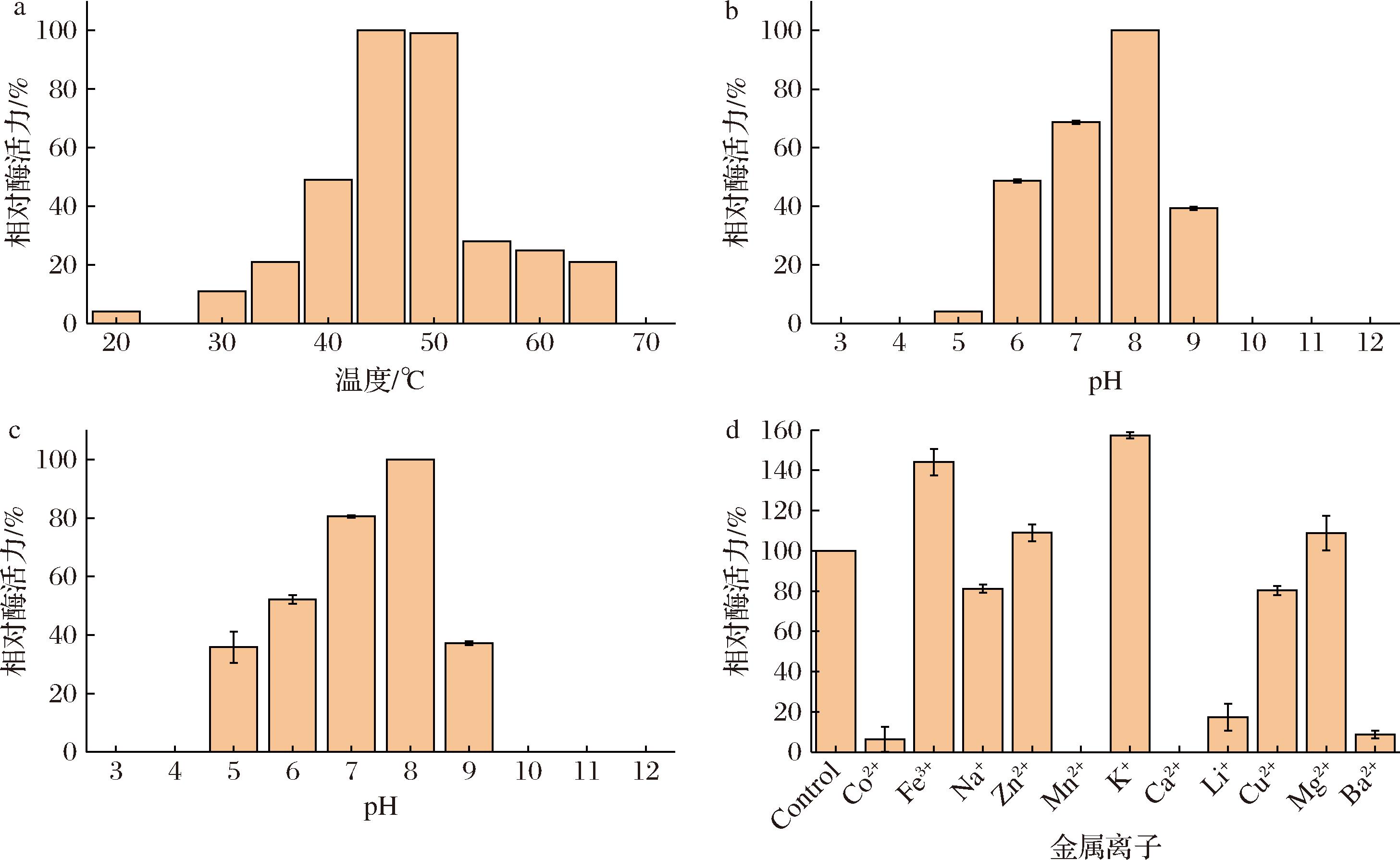
a-最适温度;b-最适pH值;c-pH稳定性;d-金属离子处理后的剩余酶活力
图2 GME238_g蛋白酶的酶学性质
Fig.2 Enzymatic properties of GME238_g enzyme
由于豆类发酵食品发酵过程中通常涉及较高的盐度[21],因此进一步考察了GME238_g蛋白酶在100、140、180 g/L的盐度下,即100、140、180 g/L的NaCl溶液中的稳定性。如图3所示,在10%盐度下,GME238_g在处理第7天后仍有酶活力,其剩余酶活力为28.57%;当盐度提升至140 g/L,GME238_g蛋白酶在处理7 d后仍保有14.30%的剩余活性;在180 g/L盐度条件下,GME238_g在第6天剩余酶活力为11.86%,而在第7天完全失活。由此可见,GME238_g蛋白酶具有一定的耐盐性。
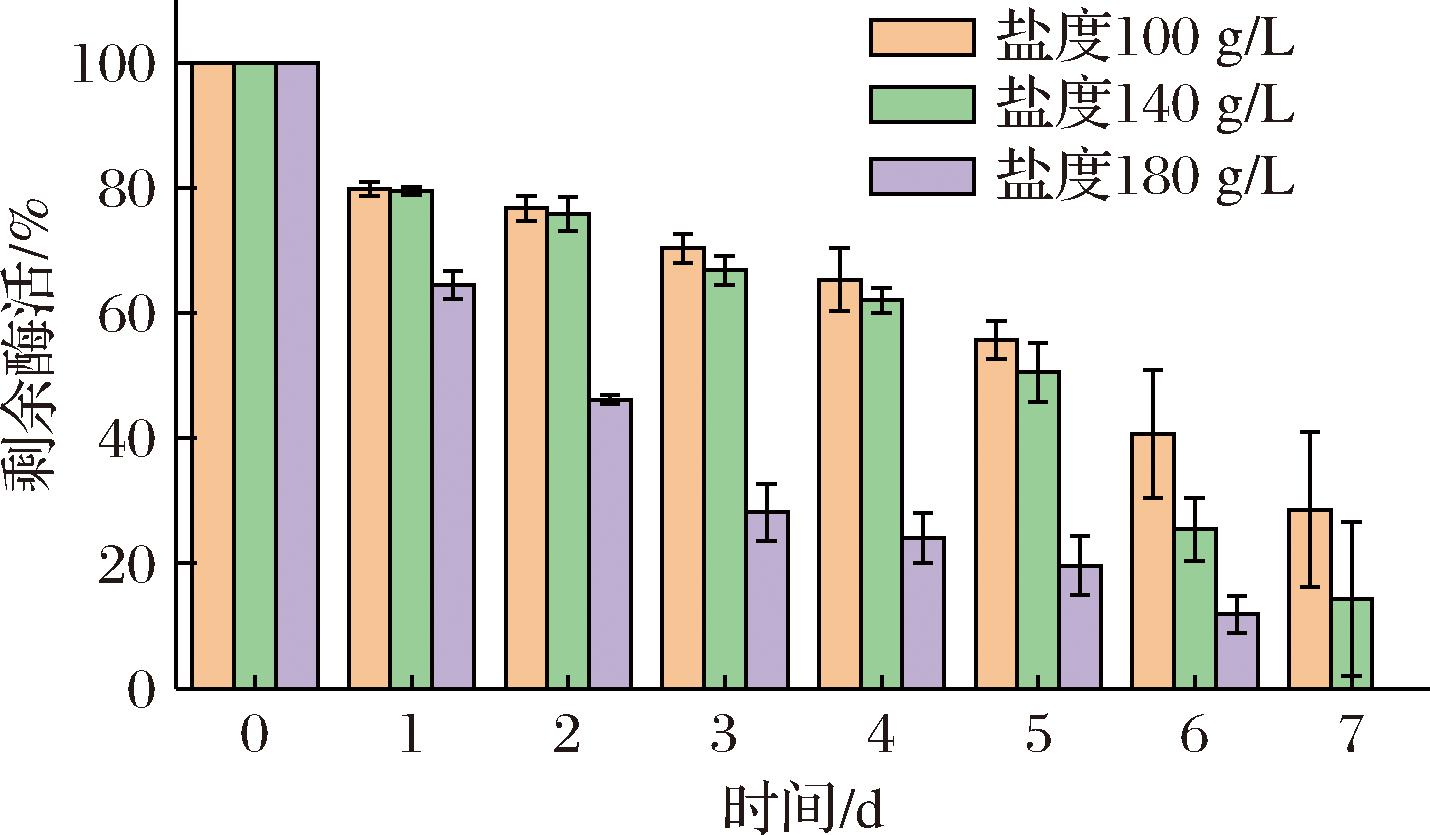
图3 GME238_g蛋白酶的耐盐性
Fig.3 Salt tolerance of GME238_g protease
2.3 GME238_g蛋白酶对球蛋白和清蛋白的降解情况分析
大豆和蚕豆等豆类的蛋白质主要为球蛋白和清蛋白[22]。因此,将GME238_g蛋白酶加入制备的清蛋白以及球蛋白溶液中,并通过TNBS显色反应测定其对蛋白质的水解度,以考察蛋白酶对球蛋白和清蛋白的降解能力。如图4-a所示,GME238_g对球蛋白和清蛋白在处理前期具有较快的降解速率,而在后期其降解速率均趋于平缓。当处理120 min时,GME238_g蛋白酶对清蛋白和球蛋白的降解率分别为28.17%和35.2%。与此同时,通过凝胶色谱测定了用酶解前后清蛋白以及球蛋白的肽段分布情况。如图4-b所示,GME238_g蛋白酶的加入使清蛋白大分子(Mw>10 000)肽段减少了42.26%,小分子肽段(Mw<500)增加了49.91%,其中Mw 500~180的肽段增加了25.37%,而Mw<180的肽段则增加了24.54%。如图4-c所示,在加入蛋白酶后球蛋白大分子(Mw>10 000)肽段减少了33.67%,小分子肽段(Mw<500)增加了44.32%,含量达97.74%。因此,GME238_g蛋白酶对清蛋白及球蛋白均有较强的水解能力,而其对球蛋白的水解能力高于清蛋白。
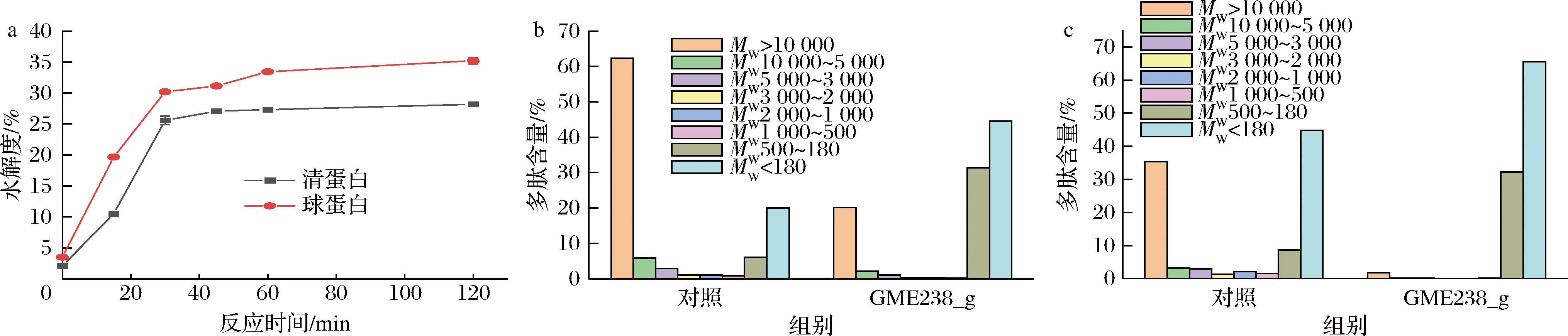
a-蛋白酶对球蛋白以及清蛋白的水解度;b-清蛋白降解前后的肽段分布;c-球蛋白降解前后的肽段分布
图4 GME238_g对球蛋白和清蛋白的降解能力分析
Fig.4 Evaluation of the degradation ability of GME238_g towards globulin and albumin
2.4 GME238_g蛋白酶在酱油发酵中的应用
基于上述实验结果,GME238_g蛋白酶具有一定的高盐度耐受能力,且对清蛋白和球蛋白具有较强的降解能力,因此其在以大豆或蚕豆为原料,发酵过程盐度较高的环境中可能具有一定的应用价值。因此,将该蛋白酶应用于酱油发酵初期阶段,考察了其对酱油发酵过程及其品质的影响。
2.4.1 酱油基础理化指标分析
表1为蛋白酶添加组和对照组酱油发酵过程中的理化指标变化情况。酱油的pH值在发酵前中期(0~30 d)快速下降,而在发酵后期(30~80 d)逐渐趋于平缓,这说明随着酱油发酵的进行酱醪的总酸含量也在不断提高。GME238_g蛋白酶的加入会推动酱油中酸性物质的积累,从而加快pH值的降低。加入GME238_g蛋白酶的酱油pH值为pH 5.5左右,略低于对照组(pH 5.6)。发酵结束后,加入蛋白酶的酱油样品中的总酸为3.56 g/100 g,显著高于对照样品(3.39 g/100 g)。酱油的pH值变化通常与有机酸的形成与消耗密切相关。适当的有机酸对于酱油的风味有一定的协调作用。氨基酸态氮是衡量酱油品质的重要标准,而氨基酸和短肽是氨基酸态氮的主要贡献者。酱油的氨基酸态氮含量在发酵前中期(0~30 d)快速升高,而在发酵中后期(30~80 d)逐渐趋于平缓。蛋白酶的加入使酱油在发酵前中期的氨基酸态氮含量明显的提高,但是在发酵中后期又逐渐趋于一致。这或许与在发酵的中后期,氨基酸生成、微生物代谢以及美拉德反应三者之间所形成的动态平衡相关。发酵结束后,添加蛋白酶的酱油样品的氨基酸态氮含量达到了0.52 g/100 g,略高于对照样品(0.51 g/100 g)。酱油中还原糖主要来源于微生物及其碳水化合物酶将淀粉降解成的小分子糖类,其会赋予酱油一定的甜味和厚味。酱油还原糖含量在发酵前期均呈现上升趋势,而在发酵中后期趋于稳定。加入蛋白酶后,酱油中的还原糖含量低于对照组。原因一方面可能是与酱油pH有关,蛋白酶添加带来的更低的pH环境使碳水化合物酶的活性更低甚至失活导致其无法充分分解形成糖类物质;另一方面可能是由于更多氨基酸促进了微生物的生长,从而消耗了更多的糖类物质。
表1 酱油发酵过程中理化指标变化趋势
Table 1 Physicochemical index of soy sauce during fermentation

时间/dpH总酸/ g/100g 氨基酸态氮/ g/100g 还原糖/ g/100g 对照GME238_g对照GME238_g对照GME238_g对照GME238_g07.23±0.027.23±0.020.26±0.010.26±0.010.030.030.13±0.010.23±0.0377.10±0.076.66±0.011.82±0.022.18±0.130.180.22±0.011.37±0.011.55±0.04146.77±0.076.47±0.042.25±0.162.77±0.090.23±0.010.28±0.011.89±0.011.86±0.01216.53±0.036.41±0.062.52±0.073.00±0.100.25±0.010.30±0.012.11±0.051.96±0.01286.29±0.026.19±0.023.07±0.013.35±0.030.310.342.22±0.012.16±0.02355.79±0.035.72±0.013.21±0.023.44±0.030.350.442.45±0.032.26±0.01505.66±0.025.55±0.023.22±0.023.52±0.070.460.482.44±0.012.35±0.05655.53±0.045.41±0.073.35±0.013.55±0.050.500.51±0.012.40±0.032.35±0.01805.47±0.045.39±0.063.393.56±0.080.51±0.010.52±0.012.47±0.102.37±0.04
2.4.2 酱油中氨基酸和有机酸含量分析
氨基酸与有机酸是酱油滋味的重要贡献者。按照氨基酸呈现出的滋味特性,可将其归类为鲜味氨基酸(天冬氨酸与谷氨酸)、甜味氨基酸(丝氨酸、组氨酸、甘氨酸、苏氨酸、丙氨酸以及脯氨酸)和苦味氨基酸(精氨酸、缬氨酸、蛋氨酸、亮氨酸、异亮氨酸)。此外,依据氨基酸能否被人体自身所合成,赖氨酸、色氨酸、苯丙氨酸、甲硫氨酸、苏氨酸、异亮氨酸、亮氨酸、缬氨酸这8种氨基酸被界定为必需氨基酸[23]。如图5-a所示,GME238_g蛋白酶的加入显著提高了酱油中的氨基酸含量。添加蛋白酶的酱油样品的总氨基酸含量为94.79 mg/100 mL,显著高于对照组(78.43 mg/100 mL,P<0.05)。进一步统计了样品中的鲜味、苦味、甜味氨基酸以及必需氨基酸的含量。结果表明蛋白酶的加入能够提升酱油中滋味氨基酸和必需氨基酸的含量。在加入GME238_g得到的酱油中,其鲜味、甜味和苦味氨基酸含量和对照组相比分别提高了53.23%、29.06%和17.51%,而必需氨基酸含量提高了1.68%。如图5-b所示,GME238_g蛋白酶的添加显著提高了酱油的有机酸浓度,尤其是乙酸和琥珀酸。除乳酸外,添加蛋白酶酱油中的草酸、甲酸、苹果酸和琥珀酸浓度分别为2.45、7.96、13.64、1 015.34 mg/100 g,显著高于对照组样品(0.86、1.82、4.02、4.46 mg/100 g,P<0.05)。由此可见,GME238_g蛋白酶的加入能够提升酱油中游离氨基酸和有机酸的含量,赋予酱油更愉悦的滋味。
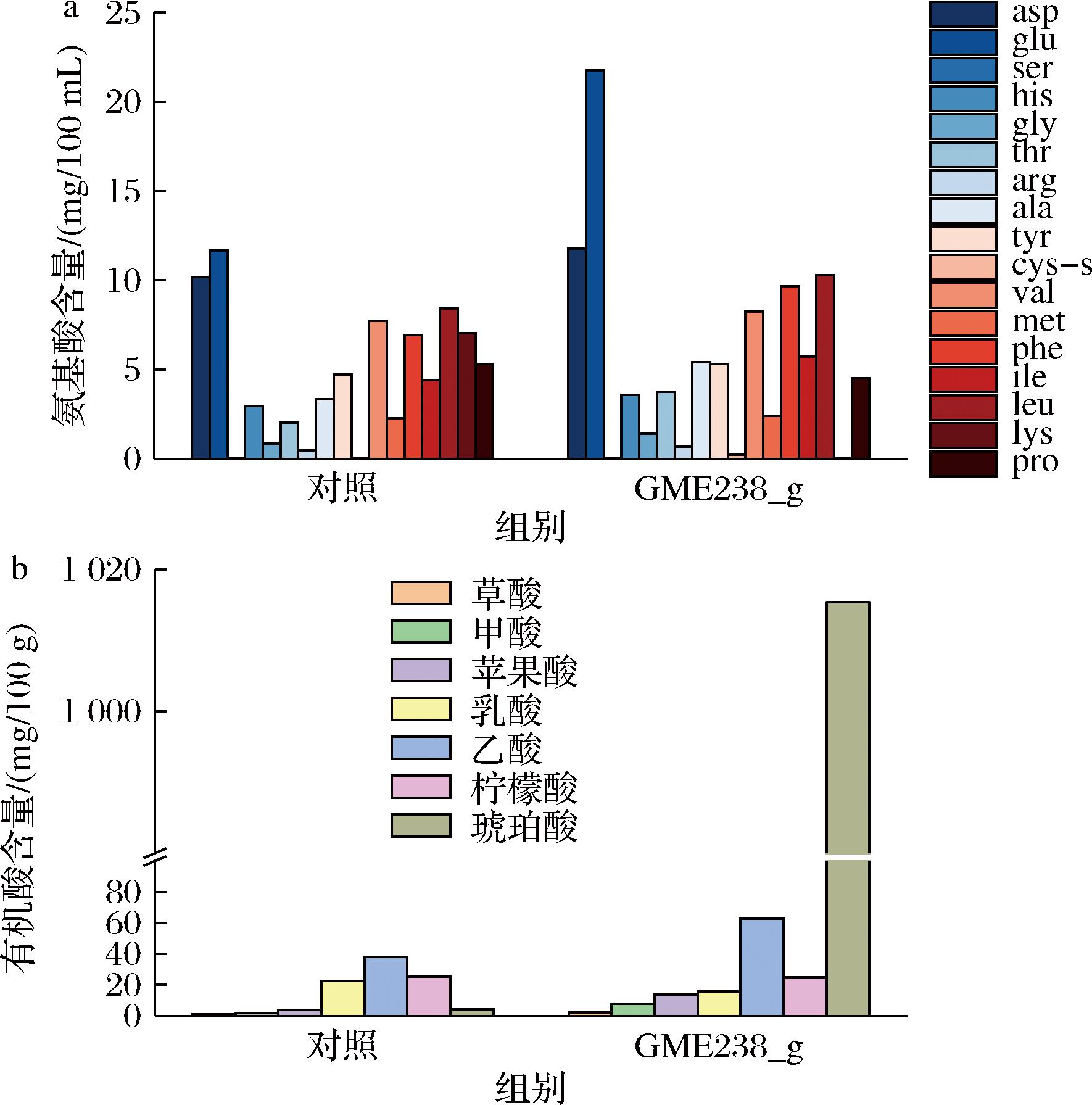
a-游离氨基酸含量;b-有机酸含量
图5 酱油中游离氨基酸以及有机酸含量
Fig.5 Concentrations of free amino acids and organic acids in soy sauce
2.4.3 酱油中挥发性风味物质分析
采用HS-SPEM-GC-MS对酱油中的挥发性风味物质种类和含量进行了半定量分析。如表2所示,结果表明,对照组酱油共鉴定出123种风味物质,而添加了蛋白酶酱油样品中检测得到132种风味物质。添加GME238_g蛋白酶的酱油中风味物质的总含量为1 642.20 μg/kg,显著高于对照组(1 152.61 μg/kg,P<0.05)。这说明蛋白酶的添加促进了酱油发酵过程中风味物质的产生。
表2 酱油中风味物质的种类及含量
Table 2 Quantities and concentrations of flavor substances in soy sauce
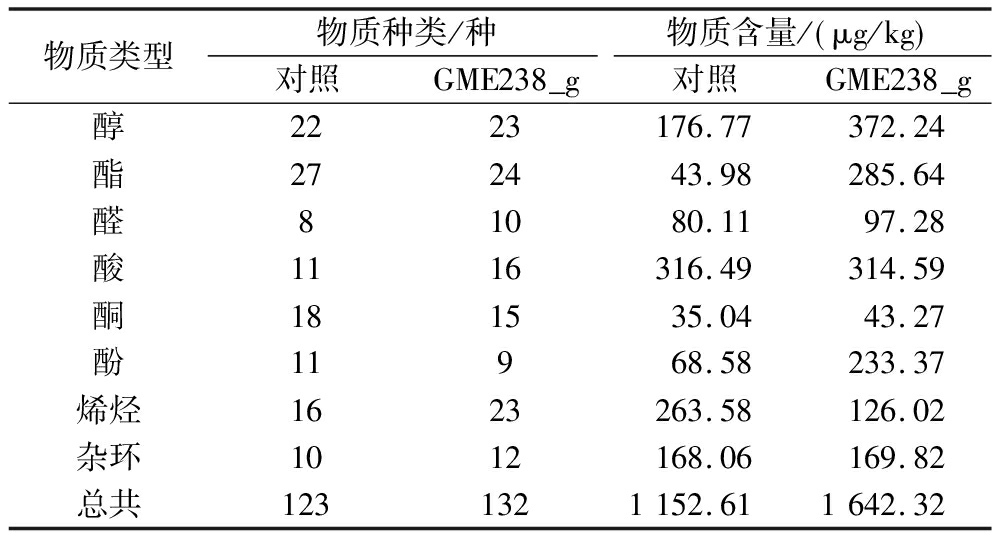
物质类型物质种类/种物质含量/ μg/kg 对照GME238_g对照GME238_g醇2223176.77372.24酯272443.98285.64醛81080.1197.28酸1116316.49314.59酮181535.0443.27酚11968.58233.37烯烃1623263.58126.02杂环1012168.06169.82总共1231321152.611642.32
进一步分析2种酱油样品中风味物质的组成,并通过热图进行分析。如图6所示,添加蛋白酶后,对照组与实验组的差异化合物有异戊酸、1-辛烯醇、2-甲氧基-4-乙烯基酚、4-乙愈创木酚、乙酸、苯乙酸甲酯、亚油酸甲酯等。异戊酸被认为是奶酪和纳豆中的特色调味物质,但它也被用作酵母提取物、发酵沙棘汁和发酵绿豆中的关键脱味成分。异戊酸在高浓度时表现出刺激性腐臭气味,而在低质量浓度(5~10 mg/L)时表现出汗臭和微甜的香气。辛烷醇具有蘑菇香气,2-甲氧基-4-乙烯基酚具有典型的烟熏、丁香和香草香气;4-乙基愈创木酚具有甜味、烟熏味和药用味,而苯乙酸甲酯[24]具有蜂蜜般的甜味和玫瑰色香气[25]。
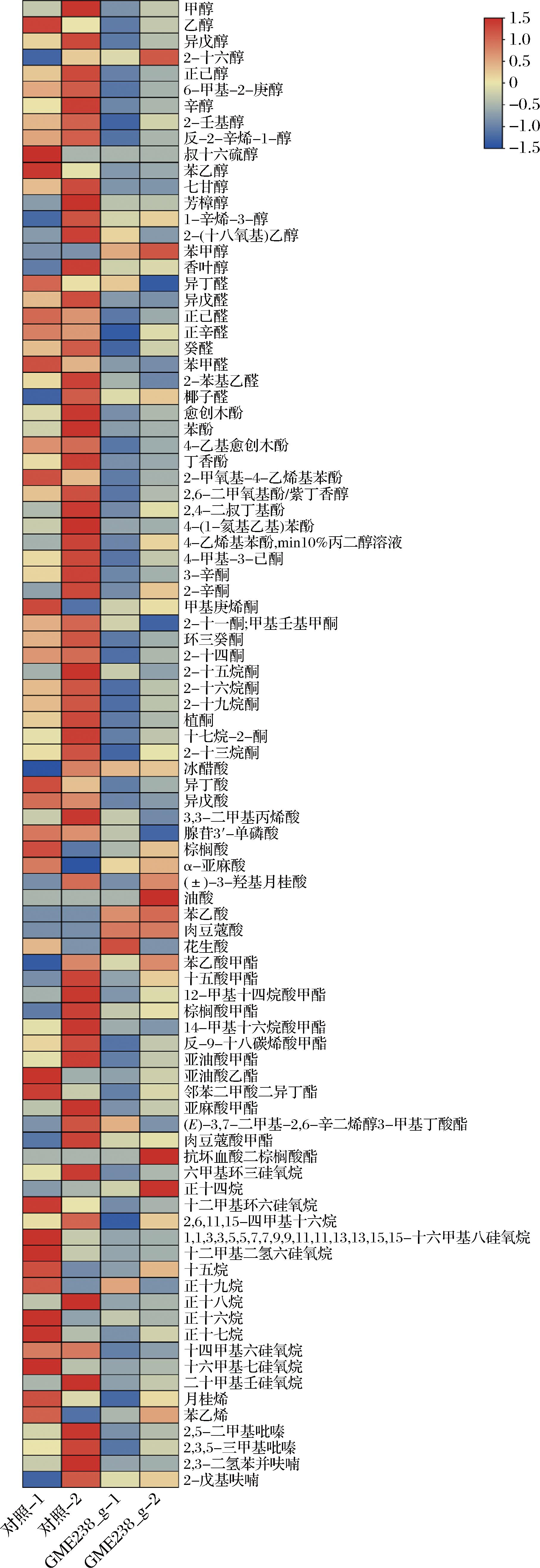
图6 酱油样品的风味热图
Fig.6 Heatmap of volatile flavor compounds in soy sauce
2.4.4 酱油感官分析
由训练过的感官评估员对发酵后得到的生酱油样品的感官特性进行评价。结果发现添加GME238_g蛋白酶的酱油样品的感官特性优于对照组。如图7所示,添加蛋白酶酱油的色、香、味评分均高于未加酶组。此外,与对照组相比,加入蛋白酶后酱油的感官特征是色泽更亮,颜色较深,其典型性更强。这说明GME238_g蛋白酶的应用,显著提高了酱油的品质。
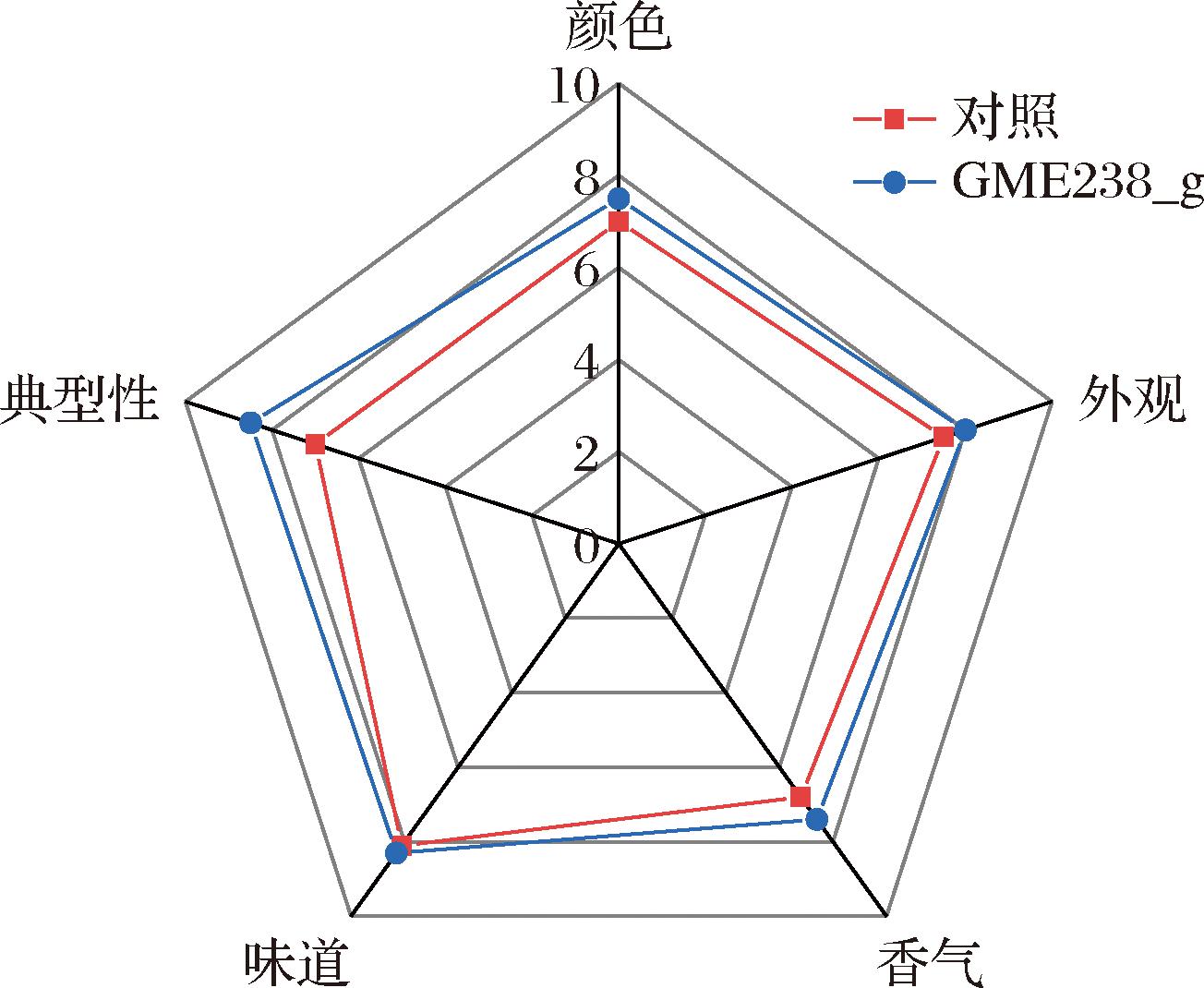
图7 酱油感官品评雷达图
Fig.7 Radar image of the sensory evaluation results of soy sauce
3 结论
在K. phaffii GS115中成功实现了米曲霉BL18来源GME238_g基因的异源表达。通过测定其酶学性质,发现该蛋白酶的最适温度和最适pH值分别为45~50 ℃和8,且在pH 5~6环境具有一定的稳定性。此外,该蛋白酶具有较好的高盐度耐受性,且具有较强水解球蛋白和清蛋白的能力。将该蛋白酶应用于酱油发酵,发现其有助于酱油中游离氨基酸和氨基酸态氮的积累,同时提升了酱油中挥发性风味物质的含量和种类,改善了酱油的感官特性。上述结果表明GME238_g蛋白酶具有优良的酶学性质,具有在酱油等豆类发酵食品生产过程中应用的潜力。
[1] PAPAGIANNI M.Fungal morphology and metabolite production in submerged mycelial processes[J].Biotechnology Advances,2004,22(3):189-259.
[2] KJ☞RBØLLING I,VESTH T,FRISVAD J C,et al.A comparative genomics study of 23 Aspergillus species from section Flavi[J].Nature Communications,2020,11:1106.
[3] HE B,TU Y Y,JIANG C M,et al.Functional genomics of Aspergillus oryzae:Strategies and progress[J].Microorganisms,2019,7(4):103.
[4] CREWTHER W G,LENNOX F G.Preparation of crystals containing protease from Aspergillus oryzae[J].Nature,1950,165(4200):680.
[5] NAKADAI T,NASUNO S,IGUCHI N.Purification and properties of neutral proteinase I from Aspergillus oryzae[J].Agricultural and Biological Chemistry,1973,37(12):2695-2701.
[6] MACHIDA M,ASAI K,SANO M,et al.Genome sequencing and analysis of Aspergillus oryzae[J].Nature,2005,438(7071):1157-1161.
[7] KOBAYASHI T,ABE K,ASAI K,et al.Genomics of Aspergillus oryzae[J].Bioscience,Biotechnology,and Biochemistry,2007,71(3):646-670.
[8] JIANG C M,LV G B,GE J X,et al.Genome-wide identification of the GATA transcription factor family and their expression patterns under temperature and salt stress in Aspergillus oryzae[J].AMB Express,2021,11(1):56.
[9] THAMMARONGTHAM C,NOOKAEW I,VORAPREEDA T,et al.Genome characterization of oleaginous Aspergillus oryzae BCC7051:A potential fungal-based platform for lipid production[J].Current Microbiology,2018,75(1):57-70.
[10] KUSUMOTO K I.Genomic analysis of koji mold Aspergillus oryzae and investigation of novel peptidases by post-genomic approach[J].Japan Agricultural Research Quarterly:JARQ,2012,46(1):1-6.
[11] ZHANG L J,KANG L,XU Y.Phenotypic,genomic,and transcriptomic comparison of industrial Aspergillus oryzae used in Chinese and Japanese soy sauce:Analysis of key proteolytic enzymes produced by koji molds[J].Microbiology Spectrum,2023,11(2):e0083622.
[12] NIU C T,XING X L,YANG X H,et al.Isolation,identification and application of Aspergillus oryzae BL18 with high protease activity as starter culture in doubanjiang (broad bean paste) fermentation[J].Food Bioscience,2023,51:102225.
[13] SNYDER H.The proteins of the wheat kernel[J].American Association for the Advancement of Science,1907,26:865.
[14] BARBANA C,BOYE J I.Angiotensin I-converting enzyme inhibitory properties of lentil protein hydrolysates:Determination of the kinetics of inhibition[J].Food Chemistry,2011,127(1):94-101.
[15] 邢先雷,左汶骏,汪溢恒,等.耐盐产香埃切假丝酵母的筛选、特性分析及其在豆瓣酱的应用[J].食品与发酵工业,2025,51(2):68-76.XING X L,ZUO W J,WANG Y H,et al.Screening and characterization of salt-tolerant and aroma-producing Starmerella etchellsii and its application in broad bean paste[J].Food and Fermentation Industries,2025,51(2):68-76.
[16] LI J Y,ZHANG M L,FENG X J,et al.Characterization of fragrant compounds in different types of high-salt liquid-state fermentation soy sauce from China[J].LWT,2022,169:113993.
[17] JUMPER J,EVANS R,PRITZEL A,et al.Highly accurate protein structure prediction with AlphaFold[J].Nature,2021,596(7873):583-589.
[18] COLOVOS C,YEATES T O.Verification of protein structures:Patterns of nonbonded atomic interactions[J].Protein Science,1993,2(9):1511-1519.
[19] NIELSEN H,TSIRIGOS K D,BRUNAK S,et al.A brief history of protein sorting prediction[J].The Protein Journal,2019,38(3):200-216.
[20] WANG F,WU J,CHEN S.Preparation of gentiooligosaccharides using Trichoderma viride β-glucosidase[J].Food Chemistry,2018,248:340-345.
[21] 张伟,杨俊文,余冰艳,等.耐盐植物乳杆菌的选育及其对高盐稀态发酵酱油品质的影响[J].食品与发酵工业,2023,49(1):86-94.ZHANG W,YANG J W,YU B Y,et al.Breeding of salt-tolerant Lactobacillus plantarum and their effects on the quality of high-salt liquid-state fermented soy sauce[J].Food and Fermentation Industries,2023,49(1):86-94.
[22] 宋晓敏,李素芬,刘建福,等.20种蚕豆样品蛋白质含量与其蛋白组分的分子质量[J].中国粮油学报,2013,28(12):42-46.SONG X M,LI S F,LIU J F,et al.Protein content and relative molecular mass of their subunit from twenty broad bean varieties grown in China[J].Journal of the Chinese Cereals and Oils Association,2013,28(12):42-46.
[23] LIU A Q,YANG X,GUO Q Y,et al.Microbial communities and flavor compounds during the fermentation of traditional Hong Qu glutinous rice wine[J].Foods,2022,11(8):1097.
[24] ZHANG Z Q,ZANG M W,ZHANG K H,et al.Changes in volatile profiles of a refrigerated-reheated xylose-cysteine-lecithin reaction model analyzed by GC×GC-MS and E-nose[J].Journal of Food Science,2022,87(3):1069-1081.
[25] YAO L Y,MO Y F,CHEN D,et al.Characterization of key aroma compounds in Xinjiang dried figs (Ficus carica L.) by GC-MS,GC-olfactometry,odor activity values,and sensory analyses[J].LWT,2021,150:111982.