碱性蛋白酶是一类在中性至碱性环境中高效催化蛋白质水解的酶,其在洗涤剂、食品加工、医药及生物催化等领域具有广泛应用[1-3]。相较于动植物源蛋白酶,微生物源蛋白酶因生产工艺简便、成本低廉且酶活性稳定等优势,逐渐成为工业酶制剂的主要来源[4-6]。其中,芽孢杆菌属因其高产蛋白酶能力及环境适应性,被广泛用于碱性蛋白酶的工业化生产[7-8]。然而,当前商品化蛋白酶制剂仍面临两大瓶颈问题:其一,酶种类单一(以枯草杆菌蛋白酶为主),导致底物水解效率偏低,多肽转化率难以满足功能性肽生产需求[9-10];其二,现有蛋白酶制剂的肽键选择性高度同质化,限制了其在复杂底物中的协同水解能力[11-12]。因此,开发具有新型肽键选择性的蛋白酶资源,成为提升工业酶应用效能的关键方向。
短小芽孢杆菌(Bacillus pumilus)作为芽孢杆菌属的重要成员,已被证实可分泌多种高活性胞外蛋白酶[13-15]。其分泌的蛋白酶在耐碱性、热稳定性及底物广谱性方面具有显著优势[16-17]。然而,目前针对短小芽孢杆菌蛋白酶的深入研究仍较为有限,尤其是对其不同酶组分的分离纯化及特性解析尚不充分。这些研究空白限制了该菌株蛋白酶在工业中的应用。
基于此,本研究以短小芽孢杆菌为对象,通过超滤浓缩、离子交换层析及凝胶层析等多步纯化技术,分离其胞外蛋白酶组分,并系统解析其酶学特性及肽键选择性,研究结果可为该蛋白酶的开发与应用提供理论指导。
1 材料与方法
1.1 材料与试剂
短小芽孢杆菌(Bacillus pumilus)为岭南师范学院酶工程实验室保藏菌种;二乙氨基乙基Capto凝胶(Capto diethylaminoethyl,Capto-DEAE),混合模式阳离子交换capto凝胶(Capto multimodal cation exchange,Capto-MMC),GE公司;葡聚糖G75凝胶(Sephadex G75),Pharmacia公司;Vivaflow200超滤膜包,赛多利斯科学仪器(北京)有限公司;Alcalase 3.0 T碱性蛋白酶(15.6万U/g),Novo Nordisk公司;胰蛋白酶(18.2万U/g)、枯草杆菌蛋白酶(21.4万U/g)、木瓜蛋白酶(12.6万U/g),国药集团。
1.2 仪器与设备
T6新世纪紫外-可见分光光度计,北京普析通用仪器有限责任公司;BSA124S电子分析天平,赛多利斯科学仪器(北京)有限公司;FE28台式pH计,梅特勒-托利多仪器(上海)有限公司;HYQ-60全恒温摇床,武汉汇诚生物科技有限公司;3-18K高速冷冻离心机,Sigma公司;AKTApure蛋白纯化系统,GE公司;ScientZ-10N冷冻干燥机,宁波新芝生物科技有限公司。
1.3 培养基
种子培养基:胰蛋白胨10 g/L,酵母粉5 g/L,NaCl 10 g/L,用NaOH调pH至7.5,每只250 mL三角瓶分装50 mL,封口后在121 ℃高压灭菌20 min。
发酵培养基:黄豆粉30 g/L,蔗糖30 g/L,KH2PO4 3 g/L,Na2HPO41.0 g/L,用NaOH调pH至7.5,每只250 mL三角瓶分装50 mL,封口后在121 ℃高压灭菌20 min。
1.4 实验方法
1.4.1 菌种活化和种子液的制备
将保藏的短小芽孢杆菌菌株接入装有50 mL液体种子培养基的250 mL三角瓶中,置于恒温摇床,35 ℃,200 r/min培养24 h。
以2%的接种量将活化后的短小芽孢杆菌菌液接入装有50 mL种子培养基的250 mL三角瓶中,置于恒温摇床,35 ℃、200 r/min培养18 h,得到种子液。
1.4.2 粗酶液的制备
将种子液以4%的接种量接入发酵培养基中,置于恒温摇床,32 ℃、200 r/min培养72 h;将发酵液在4 ℃、8 000 r/min离心10 min,收集上清液,即为粗酶液。
1.4.3 蛋白酶的纯化
1.4.3.1 粗酶液的超滤浓缩
选用截留分子质量为100 kDa的切向流超滤膜包对粗酶液进行超滤,收集透过液;然后采用截留分子质量为10 kDa的切向流超滤膜包对透过液进行超滤,收集浓缩液,即得到浓缩酶液。使用Sephadex G25脱盐柱,pH 9.0,0.05 mol/L Tris-HCl缓冲液平衡柱子后对浓缩酶液进行脱盐处理,并调整酶液的pH值。
1.4.3.2 阴离子交换层析
采用Capto-DEAE阴离子交换柱,用pH 9.0,0.05 mol/L Tris-HCl缓冲液以2 mL/min的流速平衡柱床;取一定量脱盐后的浓缩酶液上样到阴离子交换柱,用上述缓冲溶液充分冲洗层析柱,将未挂柱的蛋白洗脱下来;然后以1.5 mL/min的流速进行梯度洗脱(A液:pH 9.0,0.05 mol/L Tris-HCl缓冲溶液;B液:1 mol/L NaCl+pH 9.0,0.05 mol/L Tris-HCl缓冲溶液),分部收集洗脱液,测定酶活力。合并收集活性峰,然后进行冷冻浓缩。使用Sephadex G25脱盐柱,pH 5.5,0.05 mol/L乙酸缓冲溶平衡柱子后对浓缩酶液进行脱盐处理,并调整酶液的pH值。
1.4.3.3 阳离子交换层析
采用DEAE-MMC复合阳离子交换柱,用pH 5.5,0.05 mol/L乙酸缓冲液平衡柱子,取一定量阴离子交换后的浓缩酶液上样到阳离子交换柱,用上述缓冲溶液充分冲洗层析柱,将未挂上柱的蛋白充分洗脱下来;采用梯度洗脱(A液:pH 5.5,0.05 mol/L乙酸缓冲液;B液:1 mol/L NaCl+pH 5.5,0.05 mol/L乙酸缓冲液),分部收集洗脱液,测定酶活力。合并收集活性峰,冷冻浓缩后收集浓缩酶液。
1.4.3.4 Sephadex G-75凝胶层析
用0.02 mol/L,pH 7.0的Tris-HCl缓冲溶液平衡Sephadex G75凝胶柱,取一定量阳离子交换后的浓缩酶液上样到凝胶柱,用上述缓冲液洗脱,分部收集洗脱液,测定酶活力。合并收集活性峰,然后进行冷冻浓缩,得到纯化酶液。
1.4.4 蛋白酶的SDS-PAGE分析
利用SDS-PAGE检测蛋白质纯度及其分子质量大小。分离胶的质量分数为14%,浓缩胶为5%。
1.4.5 蛋白质浓度和蛋白酶活力测定
蛋白质浓度采用考马斯亮蓝比色法测定;蛋白酶活力采用Folin试剂显色法测定[18]。
1.4.6 蛋白酶性质的研究
1.4.6.1 蛋白酶的最适作用温度
分别在35~70 ℃,每隔5 ℃为一组测定蛋白酶的活力,比较不同温度下酶活力高低,考察温度对短小芽孢杆菌蛋白酶的影响,确定蛋白酶的最适作用温度。
1.4.6.2 蛋白酶的最适作用pH
分别在pH为4、5、6、7、8、9、10下测定短小芽孢杆菌蛋白酶活力,比较不同pH下酶活力高低。
1.4.6.3 蛋白酶的热稳定性
取一定量蛋白酶分散于pH 9.0的缓冲溶液中,分别置于35~70 ℃(每隔5 ℃为一组)恒温水浴下准确保温60 min。测定保温前后蛋白酶的活力,计算不同温度下的酶活力残留率。
1.4.6.4 蛋白酶的pH稳定性
取一定量蛋白酶分散于pH为3、4、5、6、7、8、9、10的缓冲液,于35 ℃水浴下保温60 min。测定保温前后短小芽孢杆菌蛋白酶的活力,计算不同温度下酶活力残留率。
1.4.6.5 金属离子对蛋白酶活力的影响
在纯化后的酶液中分别添加Zn2+、Ca2+、Fe3+、Mg2+、Cu2+、Mn2+,使其终浓度达到5 mmol/L,混匀后于4 ℃静置60 min,测定蛋白酶的活力。
1.4.6.6 抑制剂与表面活性剂对蛋白酶活力的影响
在纯化后的酶液中分别添加EDTA、苯甲基磺酰氟(phenylmethylsulfonyl fluoride,PMSF)、SDS等,混匀后置于4 ℃静置60 min,测定蛋白酶的活力。
1.4.7 蛋白酶肽键选择性分析
参照文献[19]的方法,以牛胰岛素氧化β链为底物,经短小芽孢杆菌蛋白酶水解,采用质谱法分析水解液中肽片段组成,以此确定短小芽孢杆菌蛋白酶在胰岛素B链上的酶切位点。
1.4.8 蛋白酶对大豆蛋白水解能力的分析
用pH 8.5,0.5 mol/L 的Tris-HCl缓冲液配制浓度为20 mg/mL的大豆蛋白溶液,按照4 000 U/g(蛋白)的加酶量分别加入不同的蛋白酶(纯化的蛋白酶P0组分,胰蛋白酶、枯草杆菌蛋白酶、Alcalase 3.0 T),充分混匀后置于45 ℃水浴中保温酶解6 h,取样于10 000 r/min离心10 min,取上清液分析。
1.4.8.1 水解液中多肽的电泳分析
采用Tricine-SDS-PAGE系统[20],165 g/L分离胶(添加体积分数10%的甘油),100 g/L夹层胶,40 g/L浓缩胶。将水解液与电泳上样缓冲液混合后煮沸3 min,各取6 μL点样到上样孔,然后于30 V跑1 h,待指示剂前沿到达分离胶上沿时,把电压调至90 V,恒压至电泳结束。取电泳后的胶片用考马斯亮蓝染色液染色1 h,然后脱色。观察电泳胶片各泳道上多肽条带的分布情况。
1.4.8.2 水解液中多肽的凝胶层析分析
采用Sephadex G25凝胶柱(φ1.6×80 cm),用pH 8.5,0.05 mol/L Tris-HCl缓冲液平衡柱子;上样2.5 mL大豆蛋白水解液。用上述缓冲液洗脱,流速为1.5 mL/min。检测洗脱液在280 nm吸光值的变化。将洗脱图谱与肽标样的洗脱图谱进行比较,分析大豆蛋白水解液中肽段的分布情况。
1.5 数据处理
实验均独立重复3次,结果以“平均值±标准差”呈现。采用WPS Office软件进行数据处理以及统计数据的可视化。
2 结果与分析
2.1 短小芽孢杆菌蛋白酶的纯化及电泳分析
采用多种层析技术对超滤浓缩后的酶液进行了纯化分离,由图1可知,在pH 9.0的条件下进行阴离子交换层析,原酶液中可分离出2种蛋白酶组分,其中之一(命名为P0组分)在穿透峰中收集得到,说明其等电点相对较高,在pH 9.0的条件下该蛋白酶不带负电荷,不能被树脂所吸附;另一种组分(命名为P1组分)在梯度洗脱过程中被分离出来,该组分的等电点相对较低,在pH 9.0的条件下可以带负电荷。此结果初步说明,短小芽孢杆菌分泌到细胞外的蛋白酶有2种不同的蛋白酶。
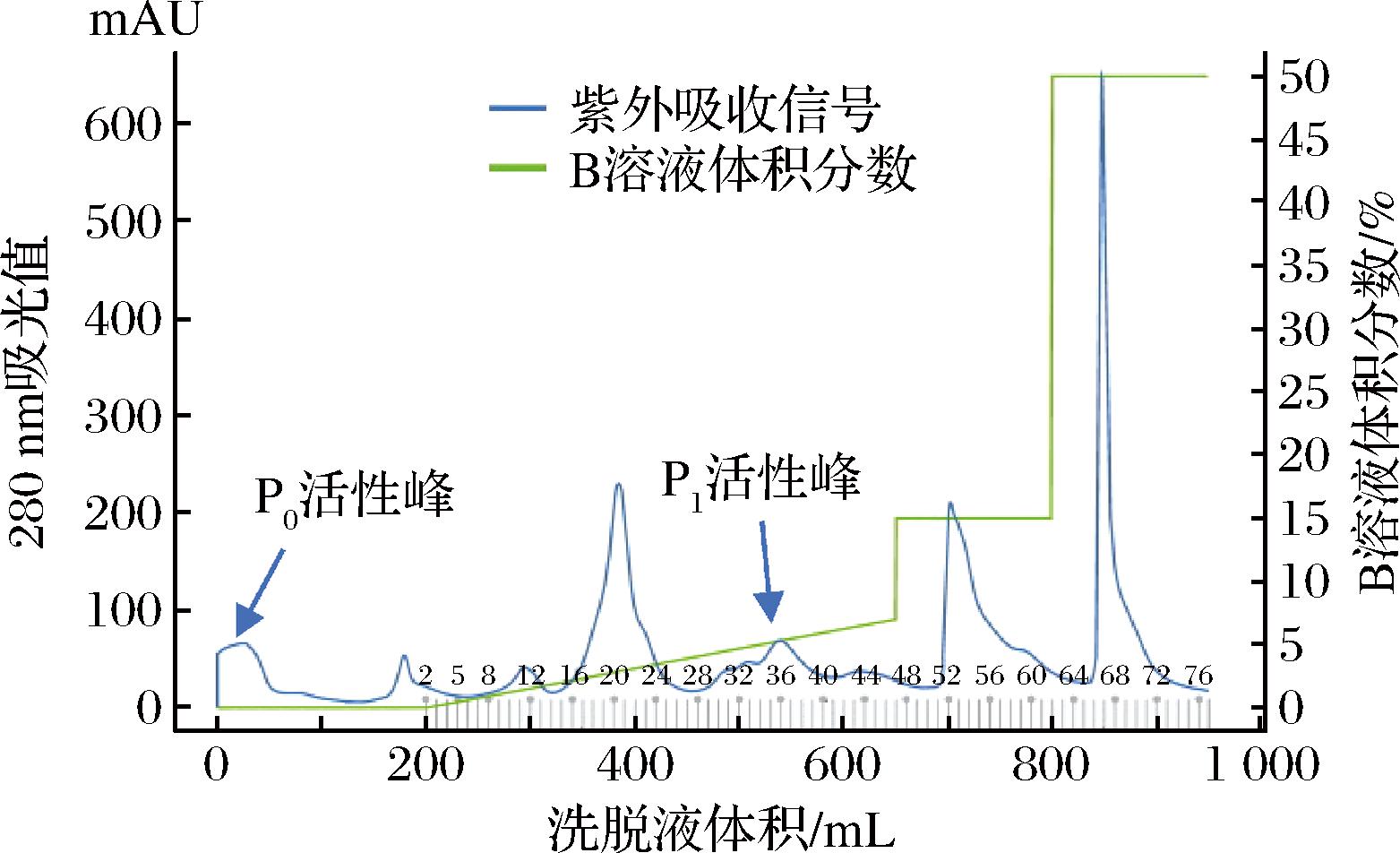
图1 短小芽孢杆菌蛋白酶Capto-DEAE阴离子交换洗脱图
Fig.1 Anion exchange elution profile of protease from B.pumilus on Capto-DEAE column
随后,利用阳离子交换层析对P0和P1组分进行了纯化,在pH 5.5的条件下2种组分均可以被树脂吸附(图2),通过优化洗脱条件实现了蛋白酶组分与杂蛋白的分离;最后采用G75凝胶层析进一步纯化2种蛋白酶组分。
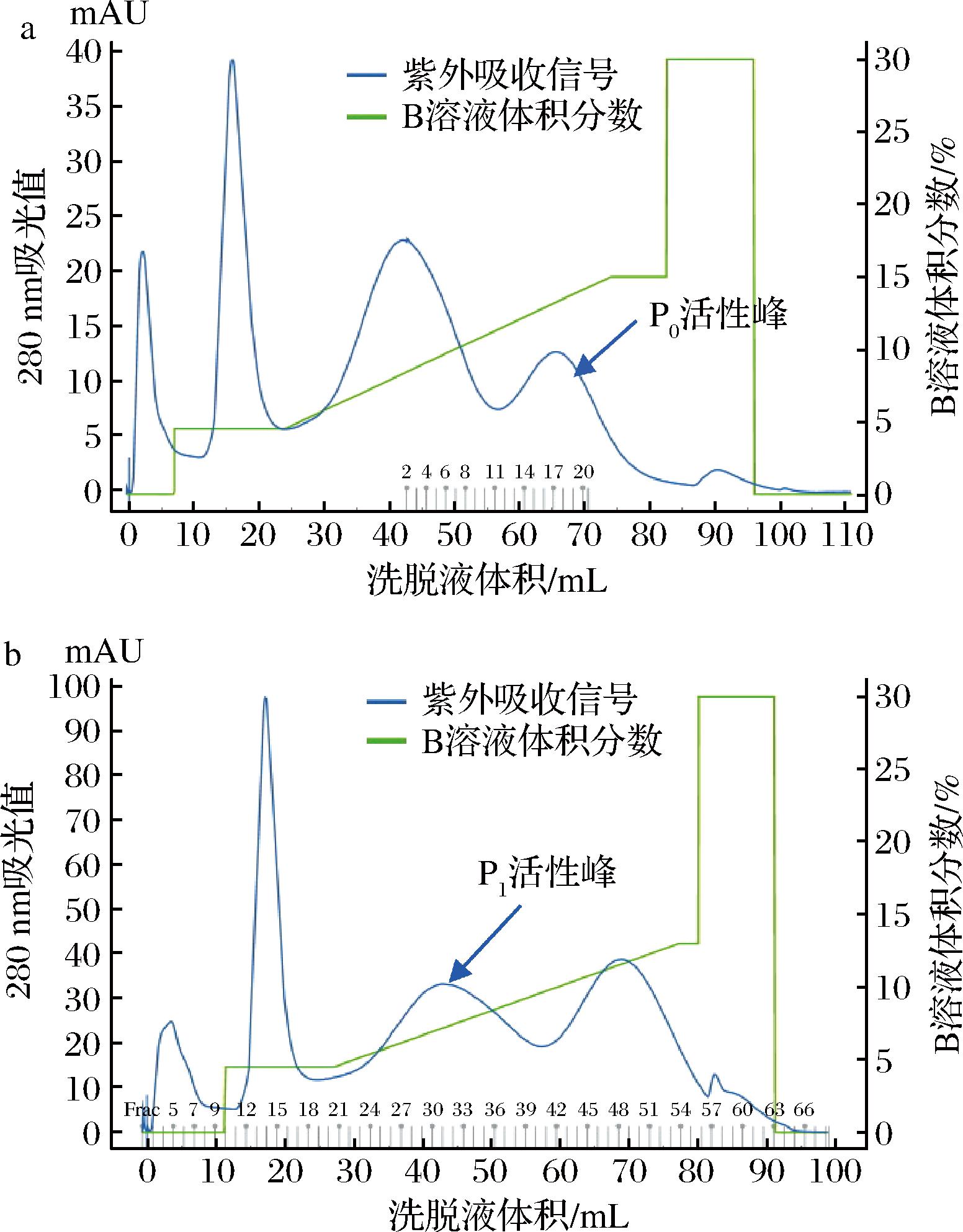
a-P0;b-P1
图2 蛋白酶P0、P1的Capto-MMC阳离子交换洗脱图
Fig.2 Cation exchange elution profile of protease P0 and P1on Capto-MMC column
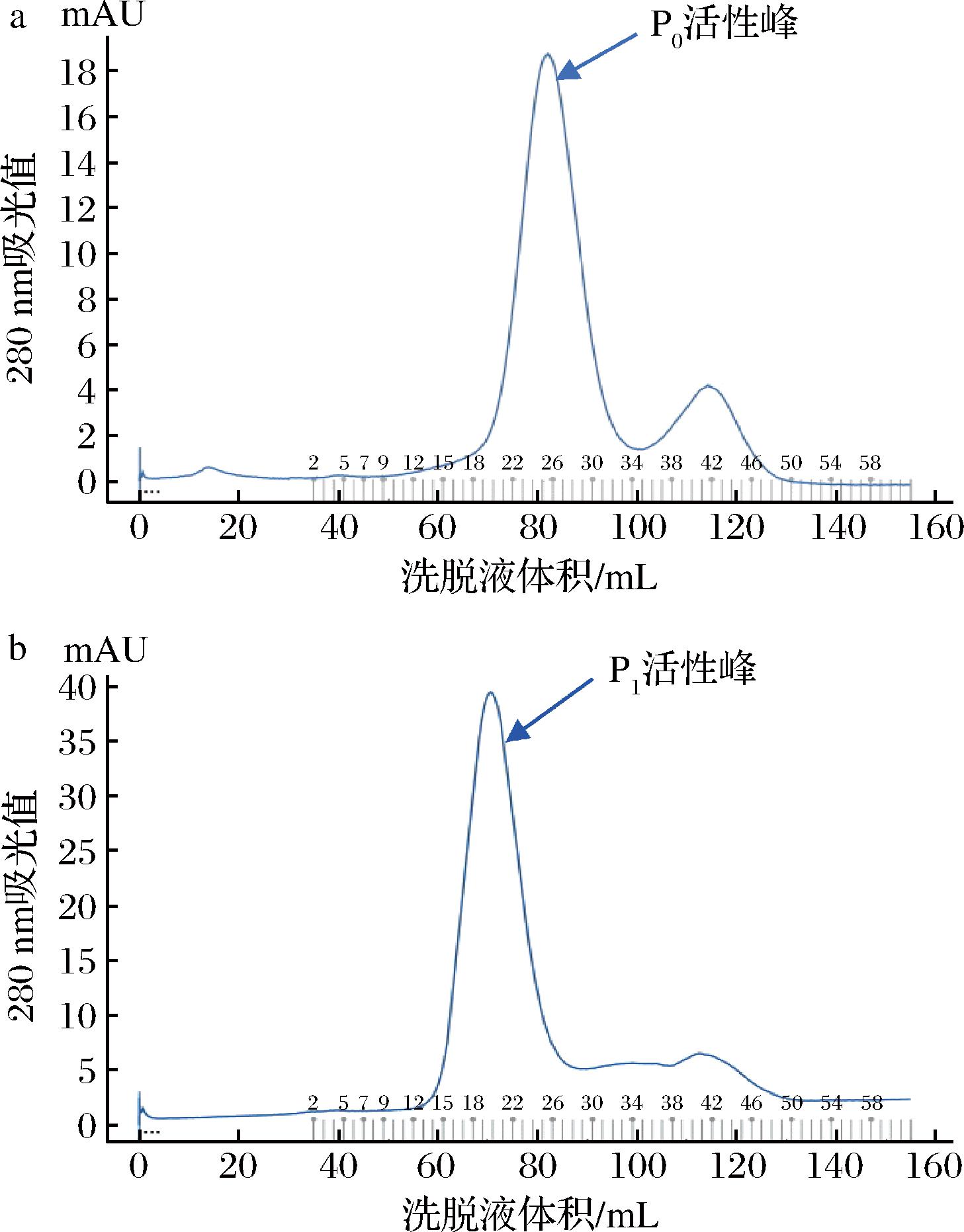
a-P0;b-P1
图3 蛋白酶P0、P1的Sephadex G75凝胶层析洗脱图
Fig.3 Gel filtration elution profile of protease P0 and P1 on Sephadex G75 column
如图3所示,经2次离子交换得到的蛋白酶组分有较高的纯度,凝胶层析的蛋白酶峰型显著,杂蛋白峰较小且基本可以与蛋白酶完全分离。比较两图可以看出,P0组分的保留体积(约73 mL)明显比P1组分的保留体积(约85 mL)小,这进一步说明P0和P1是不同的2种蛋白酶组分,P0的分子质量比P1大。
电泳分析(图4)结果显示,经纯化得到的2种蛋白酶样品在电泳胶上均呈现单一条带,说明2种组分均已达到电泳纯;从条带所处位置初步确定蛋白酶P0组分的分子质量约为20.3 kDa,比以往文献报道的短小芽孢杆菌蛋白酶分子质量小;蛋白酶P1组分的分子质量约为34 kDa,与文献结果基本一致[21]。纯化得到的2种蛋白酶组分的比酶活力分别为5 768 U/mg 和6 873 U/mg。
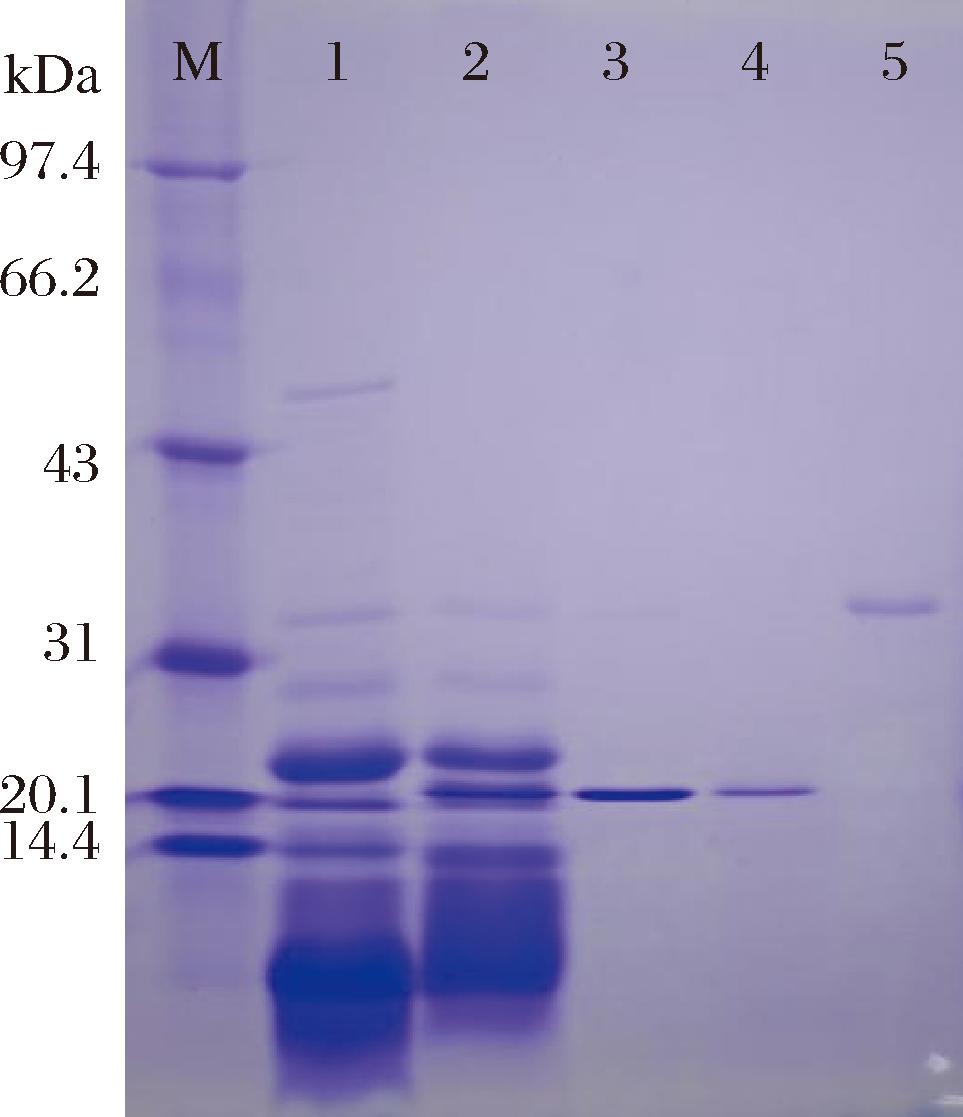
M-Marker;1-粗酶液;2-超滤后的浓缩酶液;3,4-纯化的蛋白酶P0组分;5-纯化的蛋白酶P1组分。
图4 纯化蛋白酶的分析
Fig.4 SDS-PAGE analysis of purified proteases
2.2 短小芽孢杆菌蛋白酶的性质分析
2.2.1 最适作用温度及热稳定性
由图5-a可知,短小芽孢杆菌蛋白酶是一种中温型蛋白酶;纯化得到的2种蛋白酶组分的最适作用温度基本相同,均在50~55 ℃范围,与大多数微生物源蛋白酶的最适作用温度相近,实验结果与已有文献报道结果基本一致[22]。

图5 温度对短小芽孢杆菌蛋白酶活力(a)与稳定性(b)的影响
Fig.5 Effect of temperature on activity (a) and stability (b) of proteases from B.pumilus
图5-b的结果显示,在0.05 mol/L,pH 9.0的缓冲溶液中,该蛋白酶在40 ℃以下有较好的稳定性,保温60 min仍有86 %以上的相对活性;当温度超过45 ℃,2种蛋白酶组分均表现出变性失活,在50 ℃下保温60 min,酶活力损失达到40%以上;在60 ℃下保温60 min,酶活力几乎完全丧失。从实验结果可以得出该酶在中温条件下具有良好的稳定性,对高温的耐受性相对较差。
2.2.2 最适作用pH及稳定性
由图6-a可知,短小芽孢杆菌蛋白酶属于碱性蛋白酶,在偏碱性条件下有最大催化活性;2种蛋白酶组分的最适作用pH有所不同,P0组分的最适作用pH在8.5附近,P1组分的最适作用pH在9.6附近;从曲线的走势来看,短小芽孢杆菌蛋白酶对环境酸碱性的适用性较强,即便是在弱酸性的条件下该蛋白酶也有较强的催化活性,比如在pH 6.0的条件下,也有60%的催化活性。说明该酶在较宽的pH范围内均能保持较高的催化效率。
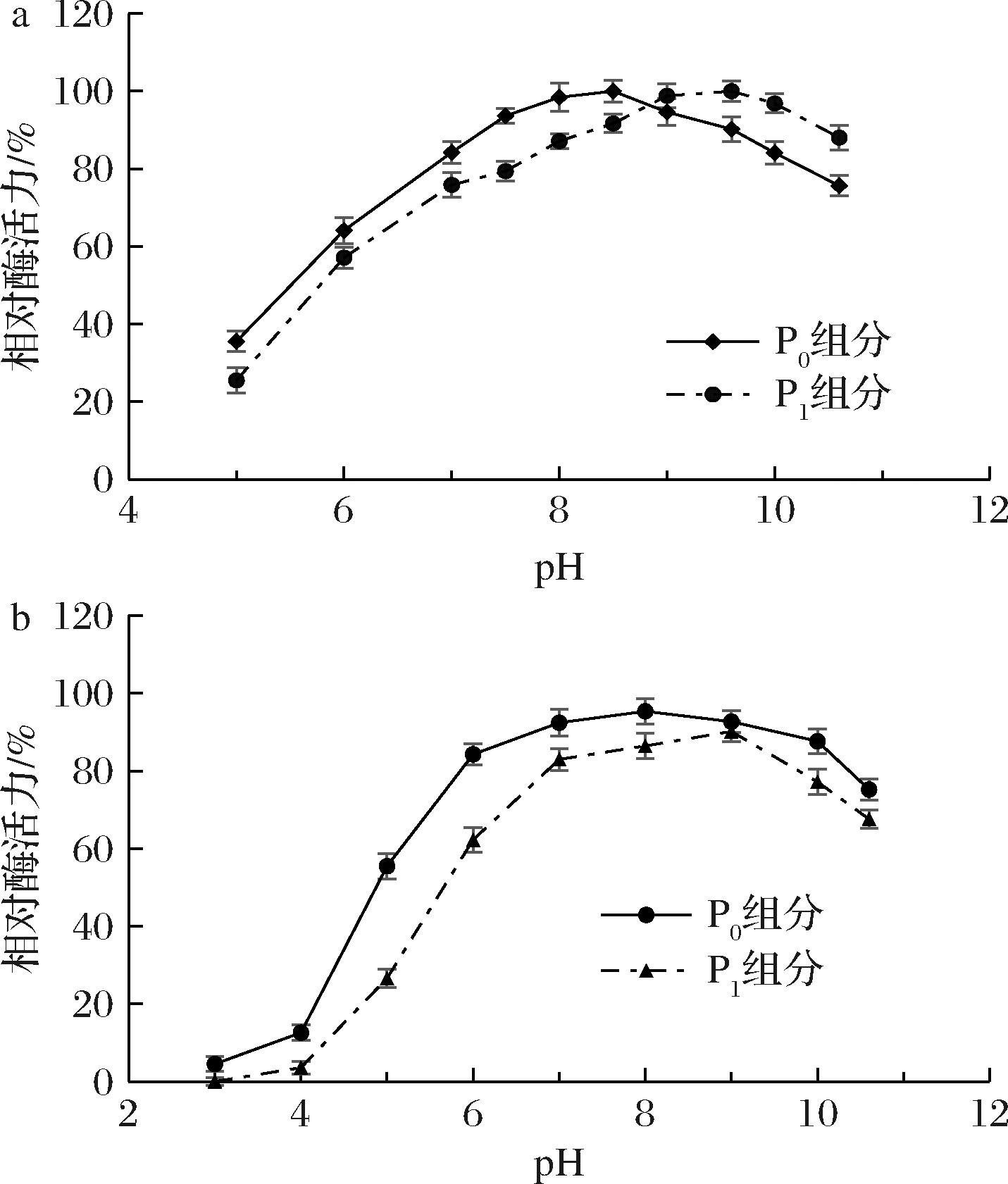
图6 pH对短小芽孢杆菌蛋白酶活力(a)与稳定性(b)的影响
Fig.6 Effect of pH value on activity(a) and stability(b) of proteases from B. pumilus
图6-b的结果显示,短小芽孢杆菌蛋白酶P0组分在pH 6~10的范围有较好的稳定性,P1组分在pH 7~10范围内有相对较好的稳定性;在酸性条件下,尤其是当pH<5.0时,2种蛋白酶组分均会变性失活;相比而言,蛋白酶P0组分的稳定性要略优于P1组分,在酸性环境中其相对酶活力均高P1组分。
2.2.3 抑制剂及金属离子对蛋白酶活力的影响
由表1可知,PMSF可以完全抑制短小芽孢杆菌蛋白酶,说明这2种蛋白酶组分均属于丝氨酸蛋白酶家族。对比2种组分的实验结果可以看出它们存在某些性质上的差异:P0组分的催化活性不受金属离子及EDTA的影响,对表面活性剂SDS有较强的耐受性,在浓度为1%的SDS溶液中依然有86%以上的酶活力,此结果与文献[23]的报道结果相一致。与P0不同,P1组分的催化活性受金属离子影响,Zn2+、Mn2+、Fe2+和EDTA可显著抑制其活性,而Co2+、Ca2+、Cu2+对其有激活作用;P1组分对SDS比较敏感,1%SDS可以使其酶活力降低到22.31%,这一结果与文献[24]报道的相似。
表1 抑制剂及金属离子对短小芽孢杆菌蛋白酶活力的影响
Table 1 Effects of inhibitors and metal ions on the activity of protease from B.pumilus
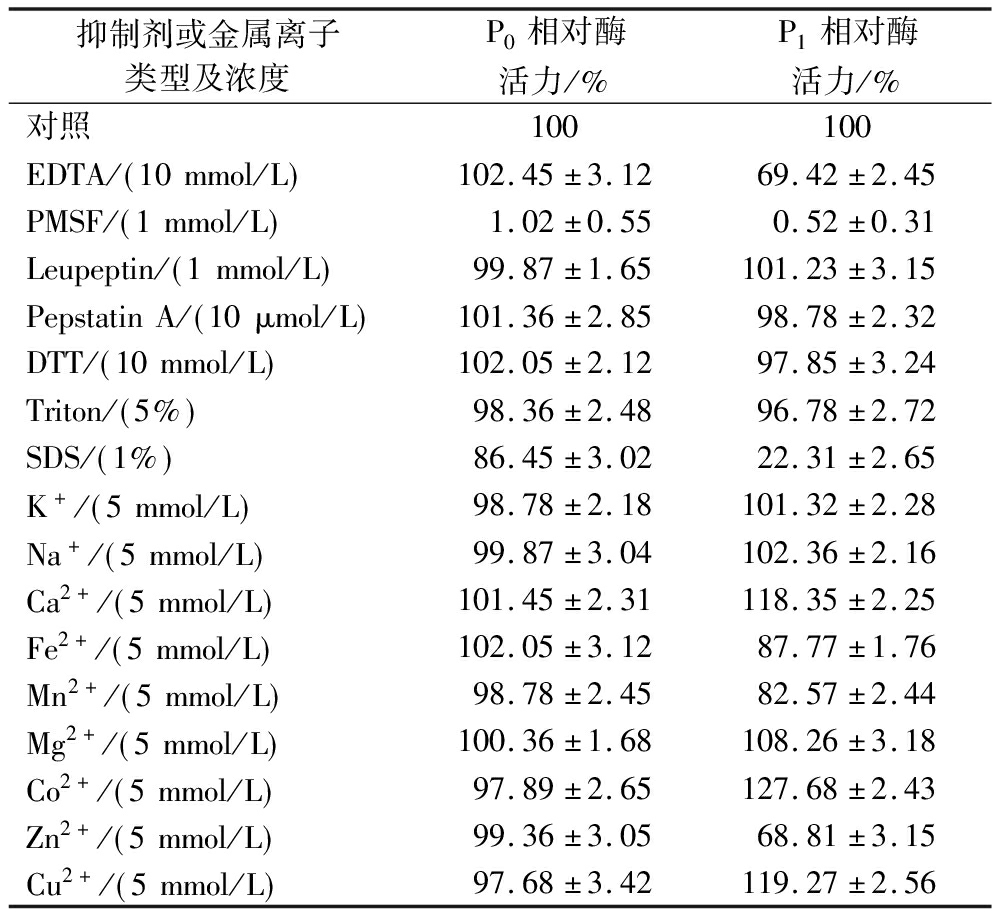
抑制剂或金属离子类型及浓度P0相对酶活力/%P1相对酶活力/%对照100100EDTA/ 10mmol/L 102.45±3.1269.42±2.45PMSF/ 1mmol/L 1.02±0.550.52±0.31Leupeptin/ 1mmol/L 99.87±1.65101.23±3.15PepstatinA/ 10μmol/L 101.36±2.8598.78±2.32DTT/ 10mmol/L 102.05±2.1297.85±3.24Triton/ 5% 98.36±2.4896.78±2.72SDS/ 1% 86.45±3.0222.31±2.65K+/ 5mmol/L 98.78±2.18101.32±2.28Na+/ 5mmol/L 99.87±3.04102.36±2.16Ca2+/ 5mmol/L 101.45±2.31118.35±2.25Fe2+/ 5mmol/L 102.05±3.1287.77±1.76Mn2+/ 5mmol/L 98.78±2.4582.57±2.44Mg2+/ 5mmol/L 100.36±1.68108.26±3.18Co2+/ 5mmol/L 97.89±2.65127.68±2.43Zn2+/ 5mmol/L 99.36±3.0568.81±3.15Cu2+/ 5mmol/L 97.68±3.42119.27±2.56
2.2.4 蛋白酶肽键选择性分析
以胰岛素β链为底物考察了短小芽孢杆菌蛋白酶的肽键选择性(表2),结果显示蛋白酶P0和P1在胰岛素β链上具有相似的酶切位点分布,说明它们的肽键选择性相同,可能是一组同工酶;从酶切位点的分布来看,短小芽孢杆菌蛋白酶对肽键5-His-|-Leu-6、11-Leu-|-Val-12、15-Leu-|-Tyr-16、25-Phe-|-Tyr-26有非常强的水解活性,显示该蛋白酶对于由Leu、Val、Phe构成的肽键有较好的选择性;对比表中几种蛋白酶的酶切位点可以看出,短小芽孢杆菌蛋白酶在胰岛素β链上有更多的酶切位点,显示短小芽孢杆菌蛋白酶有较宽泛的肽键选择性;对比可以看出,短小芽孢杆菌蛋白酶与胃蛋白酶及Alcalase碱性蛋白酶的酶切位点相似度较高,但与胰蛋白酶、木瓜蛋白酶的酶切位点有显著差异。
表2 不同蛋白酶在胰岛素β链上的酶切位点
Table 2 The cleavage sites of different proteases on insulin β-chain
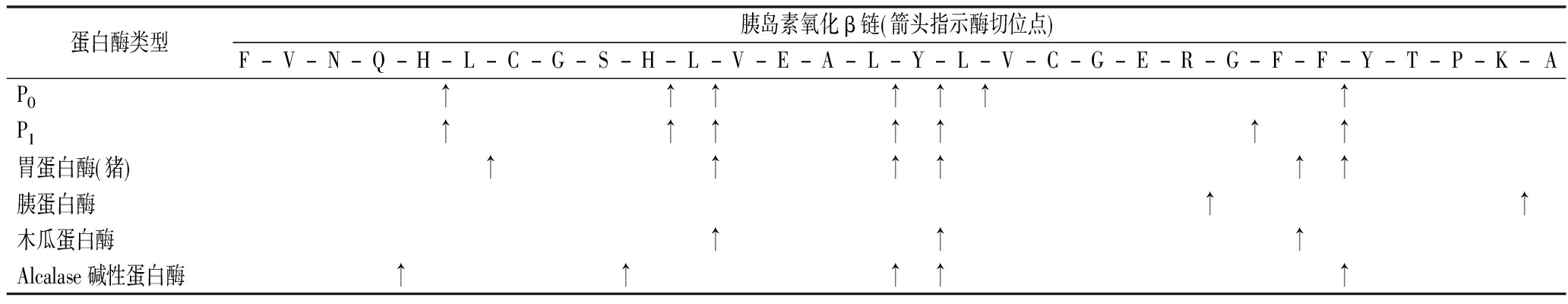
蛋白酶类型胰岛素氧化β链 箭头指示酶切位点 F-V-N-Q-H-L-C-G-S-H-L-V-E-A-L-Y-L-V-C-G-E-R-G-F-F-Y-T-P-K-AP0↑↑↑↑↑↑↑P1↑↑↑↑↑↑↑胃蛋白酶 猪 ↑↑↑↑↑↑胰蛋白酶↑↑木瓜蛋白酶↑↑↑Alcalase碱性蛋白酶↑↑↑↑↑
2.2.5 蛋白酶对大豆蛋白水解能力的分析
以大豆蛋白为底物,考察了短小芽孢杆菌蛋白酶的蛋白水解能力。由图7可知,4种蛋白酶所制备的大豆蛋白水解液,其多肽组成有显著差异:其中,枯草芽孢杆菌蛋白酶制备的水解液中依然含有极少量分子质量在20.0 kDa以上的肽片段,部分多肽产物的分子质量在10.0~20.0 kDa;胰蛋白酶制备的大豆蛋白水解液中,多肽产物的分子质量都在20.0 kDa以下,水解液中仍有部分肽片段的分子质量在10.0~20.0 kDa范围;Alcalase碱性蛋白酶制备的大豆蛋白水解液,其多肽产物的分子质量基本都在7.8 kDa以下;短小芽孢杆菌蛋白酶制备的大豆蛋白水解液,其多肽产物的分子质量基本都在10.0 kDa以下,仅有少部分多肽产物的分子质量在7.8~10.0 kDa。4种蛋白酶水解效果的差异间接说明它们在大豆蛋白肽链上的酶切位点不相同,肽键选择性存在显著差异。相比而言,短小芽孢杆菌蛋白酶与Alcalase碱性蛋白酶对大豆蛋白的水解程度较高,其水解液中主要是小分子肽(分子质量<3.3 kDa)。小肽在电泳及染色过程中会跑出丙烯酰胺凝胶,从而导致电泳胶片上残留的多肽条带明显偏少,颜色偏浅。因此,从电泳条带区呈现的条带多少及颜色深浅可以看出,短小芽孢杆菌蛋白酶对大豆蛋白有较强的水解能力,其水解效果仅次于Alcalase碱性蛋白酶,显著优于胰蛋白酶和枯草杆菌蛋白酶,这进一步验证了该蛋白酶较宽泛的肽键选择性。
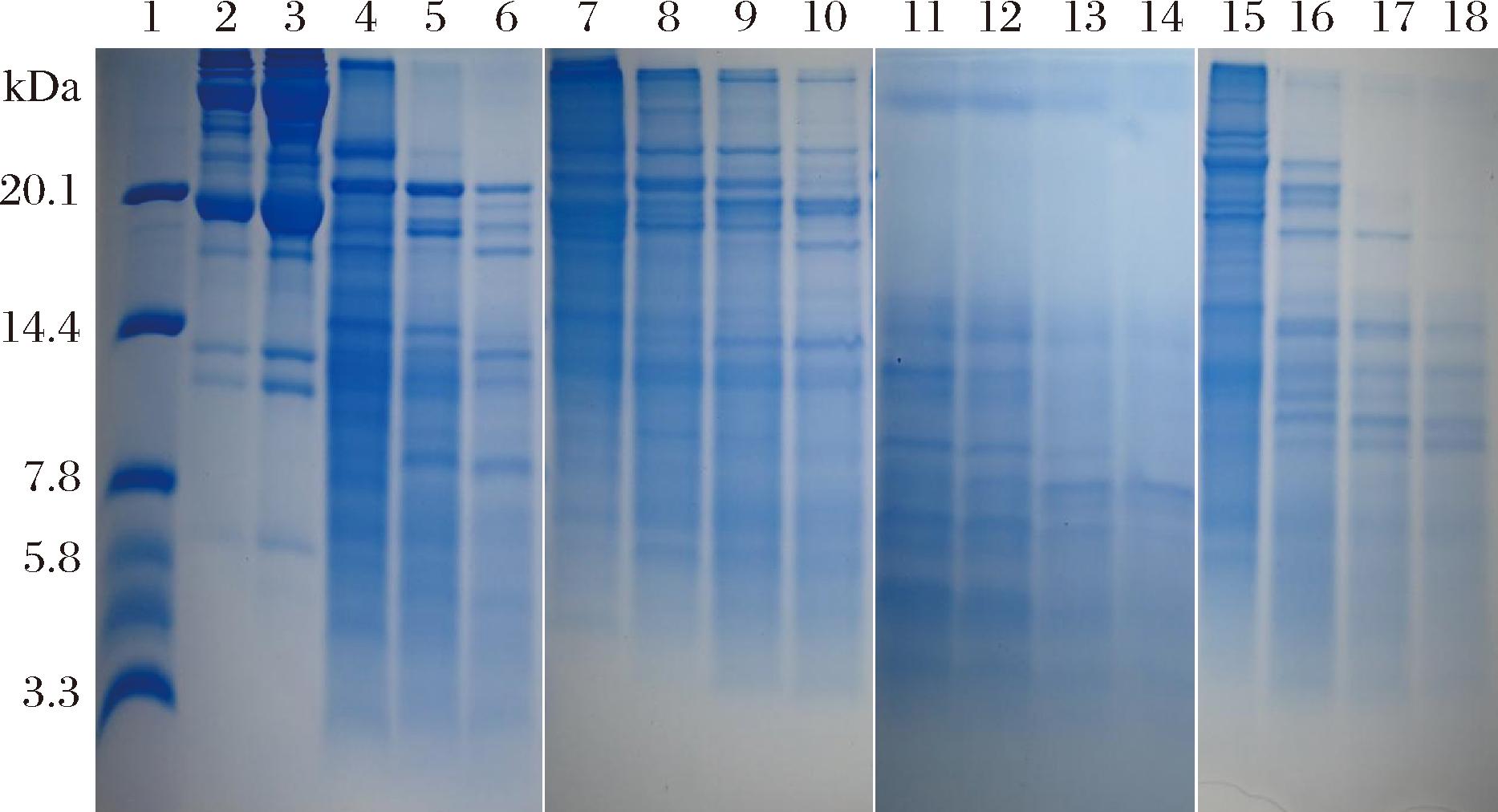
1-Marker;2、3-大豆分离蛋白;4~6-大豆蛋白胰蛋白酶水解液;7~10-大豆蛋白枯草杆菌蛋白酶水解液;11~14-大豆蛋白alcalase水解液;15~18-大豆蛋白短小芽孢杆菌蛋白酶P0水解液;水解时间分别为10 min,1 h,3 h,6 h。
图7 大豆蛋白水解液的电泳分析
Fig.7 Electrophoretic analysis of soybean protein hydrolysate
由图8可知,短小芽孢杆菌蛋白酶对大豆蛋白有很强的水解能力。在实验条件下,短小芽孢杆菌蛋白酶水解大豆蛋白6 h,水解产物中约80%以上是分子质量<5 kDa的肽片段,其中60%以上的产物是分子质量<1 kDa的小肽,仅剩约17%的肽片段分子质量>5 kDa。这一结果与上述电泳分析结果基本吻合,进一步说明短小芽孢杆菌蛋白酶具有宽泛的肽键选择性,可以实现底物蛋白的深度水解。
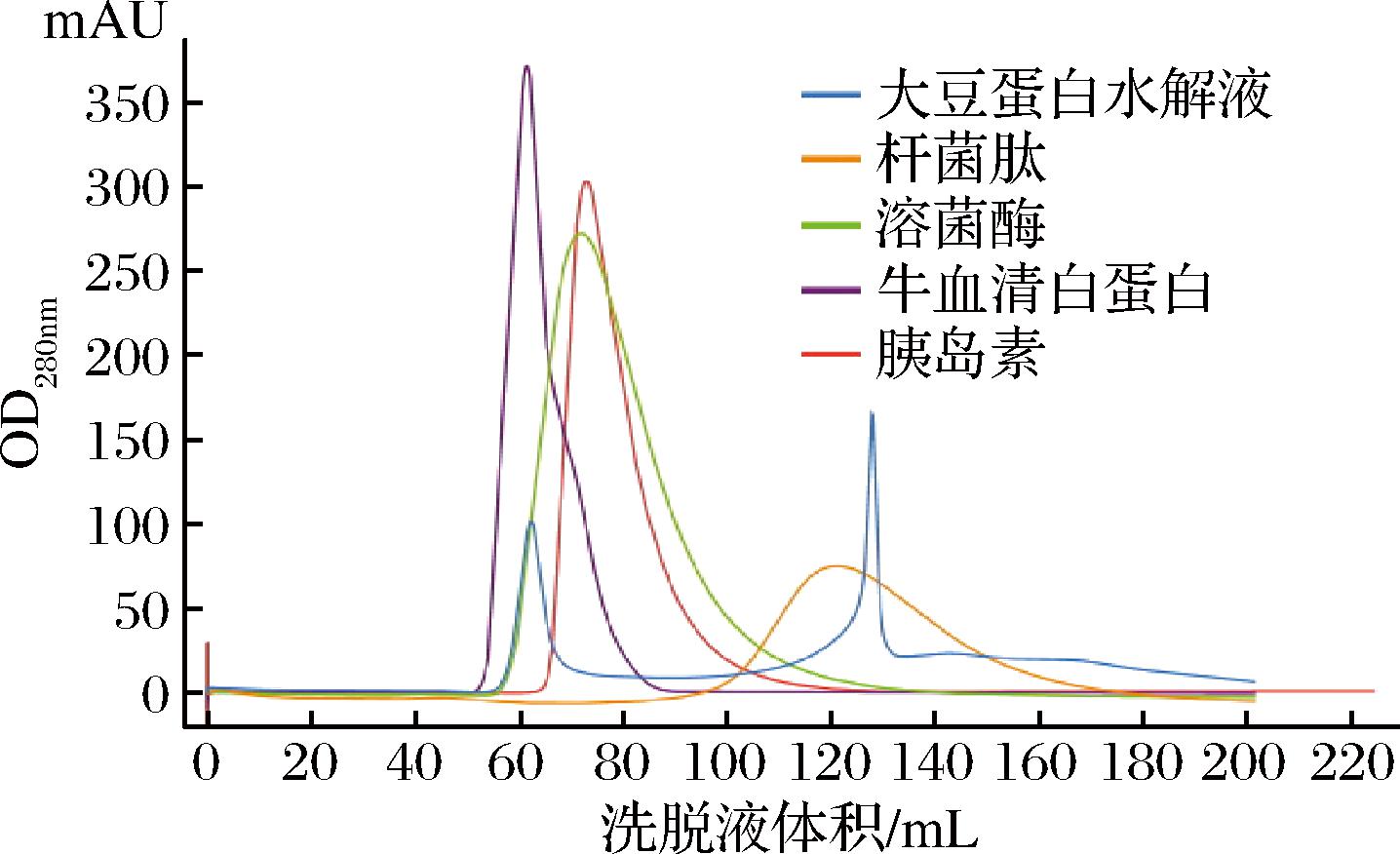
图8 短小芽孢杆菌蛋白酶制备的大豆蛋白水解液凝胶层析图
Fig.8 Gel chromatogram of soybean protein hydrolysate prepared by protease P0 from B.pumilus
3 结论
本研究通过超滤浓缩、Capto-DEAE阴离子交换层析、Capto-MMC阳离子交换层析及Sephadex G-75凝胶层析等多步纯化工艺,成功从短小芽孢杆菌(Bacillus pumilus)发酵液中分离出2种碱性蛋白酶组分P0和P1。SDS-PAGE分析表明,P0和P1的分子质量分别为20.3 kDa和34 kDa,且均达到电泳纯。酶学特性研究发现,2种组分的最适作用温度均为50~55 ℃,但最适pH存在差异(P0为8.5,P1为9.6),在碱性条件(pH 7~10)及中温环境(≤45 ℃)2种蛋白酶有良好的稳定性;PMSF可完全抑制2种蛋白酶的活力,P0组分的活性不受金属离子影响,对SDS有较强的耐受性;P1组分对金属离子有显著依赖性,EDTA、Zn2+、Mn2+、Fe2+可显著抑制其活力,Co2+、Ca2+、Cu2+对其有激活作用,SDS可显著抑制P1组分的活力,结果揭示2种蛋白酶组分是属于不同亚类的丝氨酸蛋白酶,催化特性上有较大差异。
肽键选择性分析显示,2种蛋白酶在胰岛素β链上的酶切位点相似,显示为一组同工酶;该蛋白酶的肽键选择性与胰蛋白酶和木瓜蛋白酶有显著差异,展现出独特的催化特异性。以大豆蛋白为底物时,短小芽孢杆菌蛋白酶表现出较强的水解能力:酶解6 h后,水解液中80%以上产物为分子质量<5 kDa的肽段(其中60%为分子质量<1 kDa的小肽),水解效率显著高于枯草杆菌蛋白酶和胰蛋白酶,验证了该蛋白酶较宽泛的肽键选择性。
[1] 艾雨晴,陈松骏,秦娟,等.微生物产蛋白酶的研究进展[J].食品工业科技,2021,42(19):451-458.AI Y Q,CHEN S J,QIN J,et al.Advances in proteases producted by microorganisms[J].Science and Technology of Food Industry,2021,42(19):451-458.
[2] DUAN Y J,KATROLIA P,ZHONG A L,et al.Production,purification and characterization of a novel antithrombotic and anticoagulant serine protease from food grade microorganism Neurospora crassa[J].Preparative Biochemistry &Biotechnology,2022,52(9):1008-1018.
[3] MAHAKHAN P,APISO P,SRISUNTHORN K,et al.Alkaline protease production from Bacillus gibsonii 6BS15-4 using dairy effluent and its characterization as a laundry detergent additive[J].Journal of Microbiology and Biotechnology,2023,33(2):195-202.
[4] JIANG C,YE C W,LIU Y F,et al.Genetic engineering for enhanced production of a novel alkaline protease BSP-1 in Bacillus amyloliquefaciens[J].Frontiers in Bioengineering and Biotechnology,2022,10:977215.
[5] SUN B,ZOU K,ZHAO Y Q,et al.The fermentation optimization for alkaline protease production by Bacillus subtilis BS-QR-052[J].Frontiers in Microbiology,2023,14:1301065.
[6] MRUDULA S.A review on microbial alkaline proteases:Optimization of submerged fermentative production,properties,and industrial applications[J].Applied Biochemistry and Microbiology,2024,60(3):383-401.
[7] SEON Y K,PARK J S,YANG E J.Isolation of microorganism with high protease activity from Doenjang and production of Doenjang with isolated strain[J].Journal of the Korean Society of Food Science and Nutrition,2021,50(1):79-87.
[8] HAMMAMI A,BAYOUDH A,HADRICH B,et al.Response-surface methodology for the production and the purification of a new H2O2-tolerant alkaline protease from Bacillus invictae AH1 strain[J].Biotechnology Progress,2020,36(3):e2965.
[9] 祝素莹,朱瑜,张银志,等.复合蛋白酶水解核桃粕制备血管紧张素转化酶抑制肽工艺优化[J].食品研究与开发,2020,41(17):56-63.ZHU S Y,ZHU Y,ZHANG Y Z,et al.Optimization of complex protease hydrolysis for preparation of angiotensin converting enzyme inhibitory peptides from walnut dregs[J].Food Research and Development,2020,41(17):56-63.
[10] 胡学佳,戴志远,金仁耀,等.不同蛋白酶对红娘鱼蛋白水解物的结构特性和生物活性的影响[J].中国食品学报,2023,23(10):81-89.HU X J,DAI Z Y,JIN R Y,et al.Effect of different proteases on structural characteristics and biological activity of Lepidotrigla microptera protein hydrolysates[J].Journal of Chinese Institute of Food Science and Technology,2023,23(10):81-89.
[11] 周宇朦,孙洪浩,孙小涵,等.多种碱性蛋白酶酶学性质的比较研究[J].现代畜牧兽医,2021(9):9-13.ZHOU Y M,SUN H H,SUN X H,et al.Comparative study on the characteristics of various alkaline proteases[J].Modern Journal of Animal Husbandry and Veterinary Medicine,2021(9):9-13.
[12] 李希宇,林伟玲,杨怀谷,等.不同蛋白酶水解牛肉蛋白产物的ACE抑制活力比较[J].现代食品科技,2021,37(10):197-204; 161.LI X Y,LIN W L,YANG H G,et al.Comparative study on ACE inhibitor activity of beef protein hydrolyzed by different proteases[J].Modern Food Science and Technology,2021,37(10):197-204;161.
[13] LIU Y C,HAN L L,CHEN T Y,et al.Characterization of a protease hyper-productive mutant of Bacillus pumilus by comparative genomic and transcriptomic analysis[J].Current Microbiology,2020,77(11):3612-3622.
[14] DUMAN Y A,TEKIN N.Kinetic and thermodynamic properties of purified alkaline protease from Bacillus pumilus Y7 and non-covalent immobilization to poly(vinylimidazole)/clay hydrogel[J].Engineering in Life Sciences,2020,20(1-2):36-49.
[15] NIRMALA D,CAHYANTO D,VALEN F S,et al.Effect of temperature on the activity of crude protease enzymes of Bacillus pumilus from anchovy isolates (Stolephorus sp.)[J].Ecology,Environment and Conservation,2021,27:58-61.
[16] PREETHI K,BERYL G P.Alkaline protease from Bacillus pumilus:A study on their biodegradative,dehairing and destaining activity[J].International Journal of Pharma and Bio Sciences,2017,8(2):15-21.
[17] PUDOVA D S,VASILYEVA Y A,SHARIPOVA M R.Heterologous expression of Bacillus pumilus 3-19 protease in Pichia pastoris and its potential use as a feed additive in poultry farming[J].BioNanoScience,2021,11(4):989-997.
[18] HYSENI B,FERATI F,REXHEPI F,et al.Isolation and characterization of microorganisms for protease production from soil samples from Kosovo and testing the enzymes in food industry application[J].Journal of Environmental Treatment Techniques,2020,8(2):687-693.
[19] BEYNON R,BOND J S.Proteolytic Enzymes:A Practical Approach[M].Oxford:Oxford University Press,2001.
[20] 吴红洋.Tricine-SDS-PAGE测定花椒籽蛋白降血压肽的分子量分布[J].现代食品,2021(9):172-175.WU H Y.Determination of molecular weight distribution of angiotensin converting enzyme inhibitor peptides from Zanthoxylum bungeanum seed protein by tricine-SDS-PAGE[J].Modern Food,2021(9):172-175.
[21] SANGEETHA R,ARULPANDI I.Anti-inflammatory activity of a serine protease produced from Bacillus pumilus SG2[J].Biocatalysis and Agricultural Biotechnology,2019,19:101162.
[22] ARABAC N,KARAYTU
N,KARAYTU T.Alkaline thermo-and oxidant-stable protease from Bacillus pumilus strain TNP93:Laundry detergent formulations[J].Indian Journal of Microbiology,2023,63(4):575-587.
T.Alkaline thermo-and oxidant-stable protease from Bacillus pumilus strain TNP93:Laundry detergent formulations[J].Indian Journal of Microbiology,2023,63(4):575-587.
[23] BAWEJA M,SINGH P K,SADAF A,et al.Cost effective characterization process and molecular dynamic simulation of detergent compatible alkaline protease from Bacillus pumilus strain MP27[J].Process Biochemistry,2017,58:199-203.
[24] EBRU Ö G,ARZU G.Determination of protease enzyme activity of Bacillus pumilus NK14 isolate and detection of the stain removal effect of the enzyme[J].International Journal of Multidisciplinary Studies and Innovative Technologies,2018,2(2):7-12.