外阴阴道念珠菌性阴道炎(vulvovaginal candidiasis,VVC)是一种常见的下生殖道黏膜感染疾病,大约75%的女性一生中至少感染过一次[1]。该病症以白色念珠菌(Candida albicans)异常增殖为典型特征,具体表现为菌丝相转化以及毒力因子激活[2-3],同时伴随着阴道微环境失衡,乳杆菌丰度显著下降。临床症状包括阴道瘙痒、产生灼热感、出现白色或者乳酪样分泌物以及外阴红肿等[4]。反复感染引发的上皮屏障损伤可能导致继发性感染风险增加,严重影响女性生殖健康。
C.albicans的双相转化特性(酵母与菌丝)是其致病机制的核心。通常,女性阴道上皮细胞不会受到酵母形态的C.albicans的影响。在宿主免疫力低下或菌群失衡时,酵母转变成菌丝,侵袭能力显著增强,能够引起浅表黏膜真菌感染。此时,C.albicans通过分泌黏附素Als3、Hwp1p实现黏膜定植,随后通过主动渗透侵入细胞或穿过细胞间连接,或借助菌丝诱导内吞进入更深的上皮层[5-6],同时分泌的天冬氨酸蛋白酶(secreted aspartyl proteinase,SAP)可以降解细胞间紧密连接成分E-钙黏蛋白(E-cadherin,E-CAD)和黏蛋白(mucin,MUC),破坏阴道上皮完整性和屏障功能[7-8]。其中,E-CAD的水解产物可溶性E-CAD(soluble E-cadherin,sE-CAD)通常被认为是阴道上皮黏附连接和阴道上皮完整性降低的生物标志物[9]。同时,C.albicans分泌的毒力因子SAP、念珠菌溶血素可以强烈激活NLRP3炎症小体,诱导IL-1β介导的过度炎症反应和阴道上皮细胞焦亡,形成“感染-损伤-再感染”的恶性循环,进一步破坏阴道上皮屏障[10-11]。
目前临床治疗VVC主要使用唑类药物,然而,这类药物仅能抑制真菌增殖,无法修复受损的上皮屏障,且其广谱抗菌作用可能加剧菌群失衡,导致复发或其他病症。近年来的研究揭示,通过调节宿主上皮屏障功能可能是突破现有治疗局限性的新策略,如ZO-1、Claudin-1的表达提升可以降低细胞通透性,从而防止微生物及其他化学物质在上皮细胞间易位失控[12-13]。基于此,具有黏膜修复功能的益生菌干预策略受到广泛关注。
德氏乳杆菌(Lactobacillus delbrueckii)是传统发酵食品中的优势菌株,本实验室前期研究发现,L.delbrueckii CCFM1337在细胞实验中可以显著改善阴道上皮细胞屏障功能[14]。因此本研究探讨口服CCFM1337对VVC模型小鼠的干预效果,重点关注其对阴道上皮屏障的修复机制以及对阴道代谢物的改变情况,为开发基于食品源益生菌的黏膜保护剂提供理论依据。
1 材料与方法
1.1 材料与试剂
L.delbrueckii CCFM1337,江南大学食品微生物菌种保藏中心,于MRS培养基中培养至对数生长期,收集菌悬液,使用PBS清洗后调节浓度为1×1010 CFU/mL;C.albicans ATCC 10231,广东省微生物保藏中心,于YPD培养基中培养至对数生长期,收集使用PBS清洗并调节浓度为1×108 CFU/mL。
sE-CAD、Occludin-1、ZO-1、Claudin-1、IL-1β ELISA试剂盒,南京森贝伽生物技术公司;BCA检测试剂盒,上海碧云天生物技术有限公司;RNA提取试剂盒、逆转录试剂盒、实时荧光定量PCR试剂盒,南京诺唯赞公司;PCR引物,生物生工工程(上海)有限公司;异氟烷,默克公司;40 g/L多聚甲醛固定液,上海塞维尔生物科技有限公司。
1.2 仪器与设备
SW-CJ-1 CV超净工作台,安泰空气技术有限公司;HWS-150恒温恒湿培养箱,上海森信有限公司;MLS-3750高温高压灭菌锅,日本SANYO公司;542R高速离心机,德国Eppendorf公司;Multiscan Go全波长酶标仪、Orbitrap Exploris 120 LC-MS,美国Thermo公司;高通量组织研磨仪,宁波新芝生物科技股份有限公司;切片电子扫描仪,匈牙利3DHISTECH公司;Nano Photometer超微量分光光度计,德国Implen公司;PCR仪、实时荧光定量PCR仪,美国Bio-Rad公司。
1.3 实验方法
1.3.1 小鼠真菌性阴道炎模型构建
雌性SPF级BALB/c小鼠,8周龄,均重18~21 g,北京维通利华公司,饲养于恒温20~22 ℃、相对湿度(50±10)%、日照与黑暗循环12 h的恒定环境中。整个实验过程中正常进食进水。本研究由江苏省寄生虫研究所机构动物护理与使用委员会监督(伦理号:IACUC-JIPD-2024-117)。
VVC模型的构建参考WEI等[15]的方法。小鼠适应性喂养1周(0~7 d)后,随机均分为4组(空白组、模型组、氟康唑组、CCFM1337组)。除空白组外,模型组和干预组小鼠在适应期后连续3 d(8~10 d)皮下注射雌二醇(0.03 g雌二醇溶于100 μL芝麻油)进行诱导发情,并在后续实验过程中每4 d注射1次,接着连续4 d(11~14 d)阴道接种C.albicans进行感染。感染的具体方式为:使用移液枪吸取20 μL C.albicans菌悬液缓慢注入小鼠阴道组织内,将小鼠倒立悬挂1~2 min后放回笼中,空白组注入等量的无菌PBS。干预组连续干预12 d(15~26 d),具体干预方式为:CCFM1337组灌胃200 μL菌悬液;氟康唑组以20 mg/kg的剂量灌胃;空白组使用移液枪每天灌胃200 μL无菌PBS。在第27天对小鼠实施异氟烷麻醉后处死并取样。时间安排见图1。
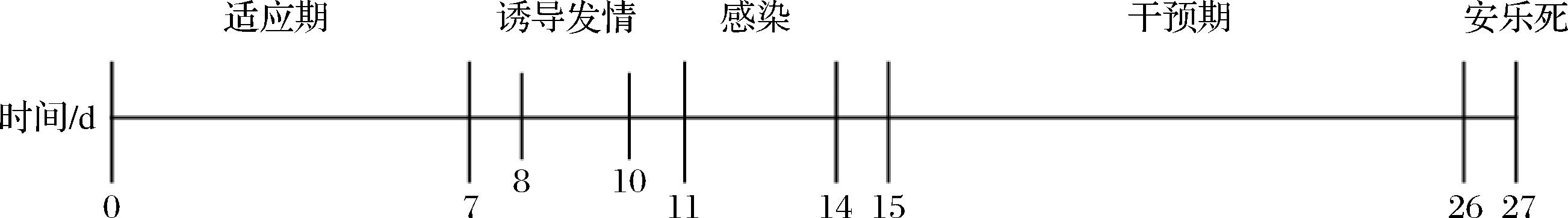
图1 动物实验设计流程图
Fig.1 Animal experiment schedule
1.3.2 组织病理学观察
小鼠阴道组织放置于多聚甲醛固定液中避光保存,固定完成后取出使用石蜡包埋并切片,之后进行苏木精和伊红(hematoxylin-eosin,HE)染色、脱水封片等步骤制成切片,最后使用切片电子扫描仪对染色组织进行图像采集。
1.3.3 小鼠阴道组织蛋白浓度测定
称取20 mg小鼠阴道组织样品放置于预冷的无菌PBS缓冲液中,使用高通量组织研磨仪以65 Hz的频率进行匀浆处理,收集组织匀浆液以4 ℃、3 000×g,离心15 min,离心结束后小心吸取上清液,按照试剂盒说明书对小鼠阴道组织中sE-CAD、Occludin-1、ZO-1、Claudin-1、IL-1β等指标进行检测。
1.3.4 小鼠阴道组织基因表达水平测定
使用RNA提取试剂盒提取小鼠阴道组织的总RNA,使用超微量分光光度计检测所回收RNA的浓度,并使用逆转录试剂盒将总RNA转化为cDNA,随后以GAPDH为内参基因,使用qPCR试剂盒对NF-κB、NLRP3、IL-17等目标基因的相对表达水平进行测定,所得结果以2-ΔΔCt方法对目的基因的表达水平进行分析。序列信息见表1[16-18]:
表1 引物序列信息
Table 1 Primer sequence information

基因上游引物 5′-3′ 下游引物 5′-3′ GAPDHTGAGTGGCAAAGTGGAGATTTTGCCGTGAGTGGAGTCATNF-κBCCGTGTATCCATAGCAAGCAATAGGGATGTGAGACCTCAGIL-17TTTAACTCCCTTGGCGCAAAACTTTCCCTCCGCATTGACACNLRP3CGTGACTCCCATTAAGATCGAGTCCCGACAGTGGATAGAACAGA
1.3.5 小鼠阴道组织代谢物差异分析
低温称取25 mg小鼠阴道组织样本加入500 μL提取溶剂[甲醇∶乙腈∶水=2∶2∶1(体积比),含同位素标记内标],涡旋混匀30 s后,以35 Hz匀浆4 min后冰水浴超声5 min(重复3次),-40 ℃静置1 h后,以13 800×g在4 ℃下离心15 min,取上清液至进样瓶中上机检测,所有样品另取等量上清液合成质控样本上机检测。下机数据使用Metaboanalyst网站(https://www.metaboanalyst.ca/)进行分析。
1.4 数据统计与分析
所得数据使用GraphPad Prism 9.0软件进行分析,并使用ANOVA单因素方差分析或重复方差分析比较多组间的差异,以“平均值±标准差”表示数据,当P<0.05时具有统计学意义。
2 结果与分析
2.1 CCFM1337改善小鼠阴道组织表观病理症状
本研究首先通过HE染色直观观察小鼠阴道组织的炎症情况及上皮完整性。由图2-a可知,空白组小鼠阴道上皮角质层比较光滑、连续,并且完整,无坏死脱落现象,棘层细胞紧密连接;而模型组小鼠角质层细胞变性,棘层受到C.albicans侵染,中性粒细胞浸润形成微脓肿,并可见炎性细胞浸润(图2-b),这可能与C.albicans通过β-葡聚糖激活Dectin-1受体介导的Th17型免疫反应密切相关[19];而CCFM1337干预后,小鼠阴道角质层连续完整性提升,棘层细胞微脓肿消失,炎性细胞浸润现象消失(图2-d),其效果优于氟康唑(图2-c),这可能与其分泌的短链脂肪酸表现出的抗炎作用及其对紧密连接蛋白表达的恢复有关[20]。

a-空白组;b-模型组;c-氟康唑组;d-CCFM1337组
图2 小鼠阴道组织HE染色结果
Fig.2 HE staining of mouse vaginal tissue
注:蓝色箭头:角质层;绿色箭头:棘层;黑色箭头:炎性细胞浸润;红色箭头:微脓肿。
2.2 CCFM1337调节小鼠阴道上皮屏障紧密连接蛋白表达
本研究进一步从分子水平检测了CCFM1337对小鼠阴道上皮紧密连接的改善情况。在本研究中,C.albicans的侵袭导致sE-CAD分泌水平显著提升(P<0.001),表明C.albicans对阴道上皮屏障造成了严重破坏(图3-a),氟康唑的使用未能改善这一情况,而CCFM1337则使得其分泌水平由9.82 pg/g降低至6.33 pg/g,表明CCFM1337可能通过抑制SAP活性或者抑制E-CAD水解发挥作用。
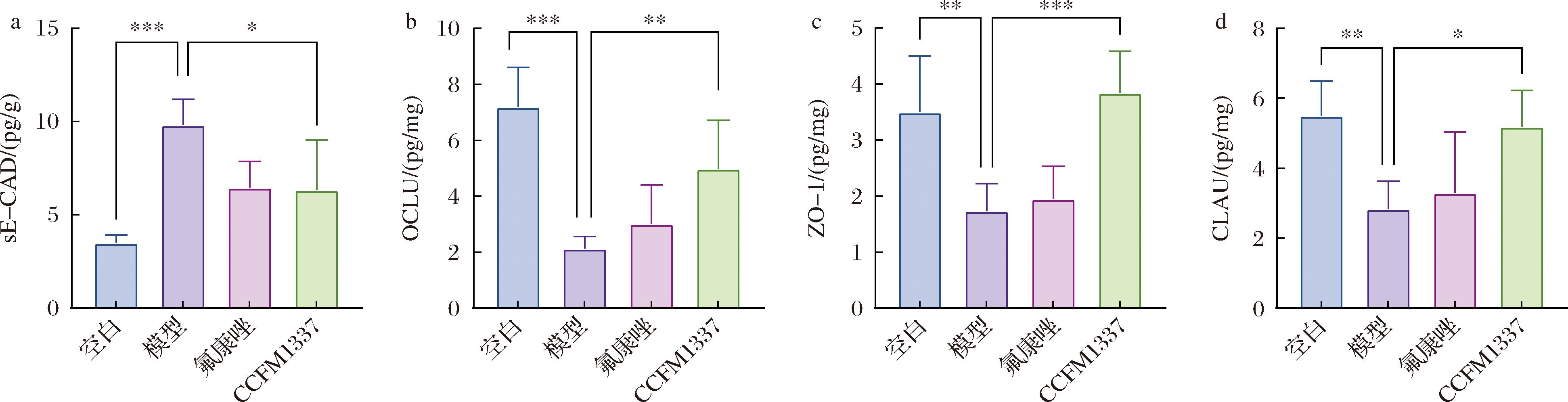
a-sE-CAD;b-Occludin;c-ZO-1;d-Claudin-1
图3 小鼠阴道紧密连接蛋白表达情况
Fig.3 Expression of tight junction proteins in the mouse vaginal epithelium
注:*表示P<0.05;**表示P<0.01;***表示P<0.001(下同)。
在紧密连接蛋白层面,模型组显示,C.albicans显著抑制了Occludin、ZO-1以及Claudin-1的表达,这可能是因为C.albicans入侵激活了NF-κB信号通路,从而抑制了紧密连接蛋白表达[3,21],CCFM1337的使用则能提升3种蛋白的表达,其中Occludin由2.14 pg/mg提升至4.99 pg/mg(2.33倍,P<0.01),ZO-1由1.74 pg/mg提升至3.85 pg/mg(2.21倍,P<0.001),Claudin-1由2.84 pg/mg提升至5.19 pg/mg(1.83倍,P<0.05);氟康唑的使用对于这3种蛋白的表达情况均无显著调节作用,进一步印证了传统抗真菌药物对于阴道上皮屏障修复的局限性。
2.3 CCFM1337缓解小鼠阴道组织炎症
NLRP3炎症小体在机体抵御念珠菌感染中有着重要作用,能够被C.albicans分泌的SAP激活,进而促进pro-IL-1β裂解释放IL-1β,并激活Th17细胞释放IL-17,其中IL-17能够诱导抗菌肽分泌促进阴道黏膜对C.albicans的防御;同时IL-1β、IL-17以及构成真菌细胞壁的β-葡聚糖、几丁质等成分均能激活机体内的关键转录因子NF-κB,这一转录因子能够调控多种基因,同时介导内皮屏障破坏[3,22-24]。如图4所示,模型组小鼠阴道组织中NLRP3 mRNA表达上调2.75倍(P<0.05),下游IL-1β(P<0.001)、IL-17(P<0.05)、NF-κB(P<0.05)mRNA表达同步提高;经过CCFM1337的干预,NLRP3(P<0.05)、IL-1β(P<0.01)、IL-17(P<0.05)分别下降了2.37倍、1.39倍和1.79倍,推测这可能是CCFM1337的代谢产物对于SAP的抑制作用;同时NF-κB虽然表现出下降趋势,但是无统计学差异,这可能是由于NF-κB受到多种通路调控,而其他通路的激活抵消了上述抑制作用。有研究表明,念珠菌溶血素能够以剂量依赖式诱导IL-1β的分泌,加剧组织炎症损伤[4,25],炎症因子的表达水平与阴道微生态的平衡密切相关,阴道微生态的破坏会进一步破坏阴道上皮屏障的完整性及其功能性[26],而CCFM1337能够调节炎症相关指标的表达水平,修复被C.albicans破坏的阴道上皮屏障,增强对病原菌的抵抗能力。
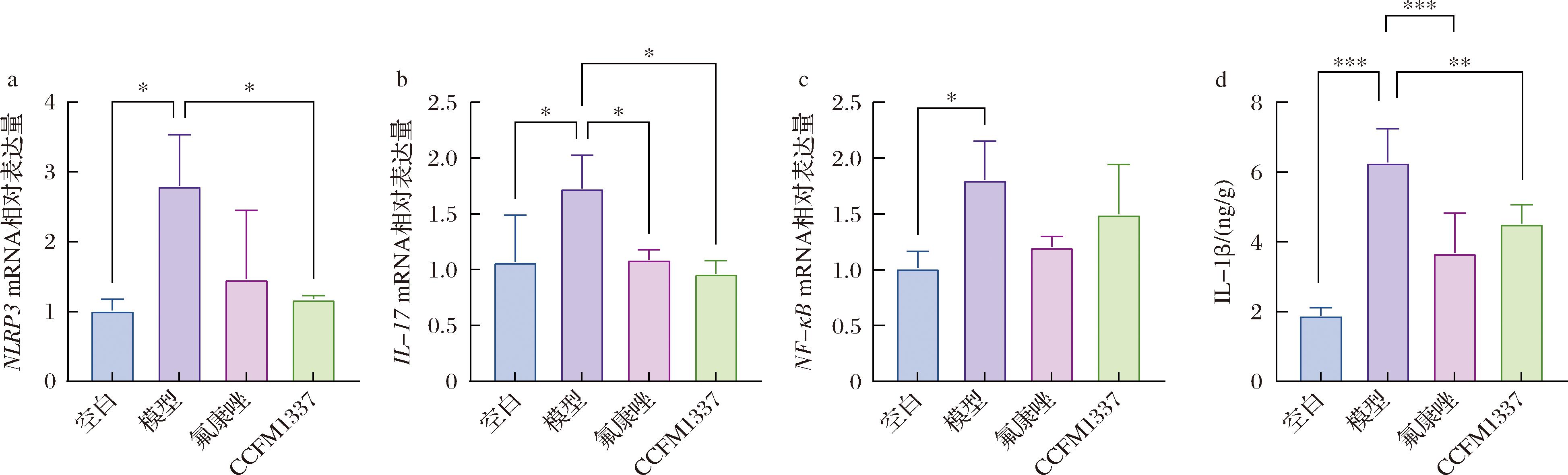
a-NLRP3 mRNA相对表达量;b-IL-17 mRNA相对表达量;c-NF-κB mRNA相对表达量;d-IL-1β
图4 小鼠阴道炎症因子表达情况
Fig.4 Expression of inflammatory factor in the mouse vaginal epithelium
2.4 CCFM1337干预后小鼠阴道组织代谢差异物分析
为了进一步探究口服CCFM1337对于小鼠阴道组织代谢物的影响,本研究基于LC-MS非靶代谢组学,测定了小鼠阴道组织的代谢物变化情况。将下机结果正负离子的特征峰与数据库进行比对、鉴定,所得代谢物使用Metaboanalyst网站进行主成分分析(principal component analysis,PCA),结果显示使用C.albicans造模使得小鼠阴道代谢物组成与空白组小鼠发生了明显分离,说明C.albicans感染导致小鼠阴道代谢紊乱(图5-a),CCFM1337干预组与模型组的代谢轨迹差异较大(图5-c),而氟康唑相对较小(图5-b),说明了CCFM1337干预具有更显著的代谢重塑能力。
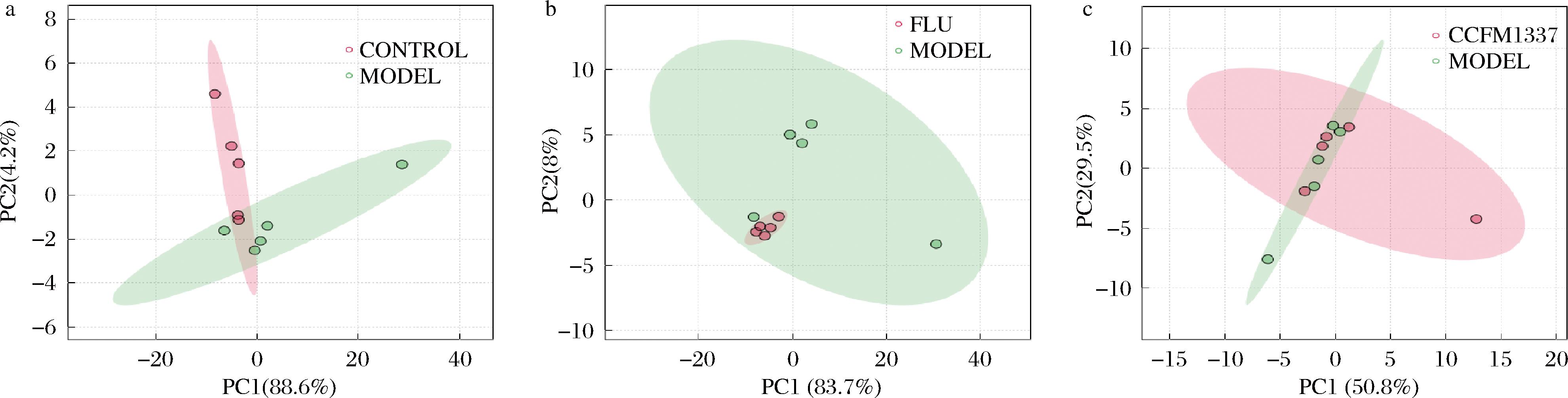
a-空白组;b-氟康唑组;c-CCFM1337组
图5 小鼠阴道代谢物vs模型组PCA结果
Fig.5 PCA result of vaginal metabolites vs model group in mice
注:CONTROL表示空白组,MODEL表示模型组,FLU表示氟康唑组(下同)。
同时,本研究借助P值和差异倍数(fold change,FC)绘制火山图来观察发生显著变化的差异代谢物数量。如图6-a所示,C.albicans感染能够引起56种代谢物水平提升,244种下降;而CCFM1337干预后,35种代谢物水平显著升高,108种降低(图6-c),氟康唑的干预表现为34种上升,276种下降(图6-b)。
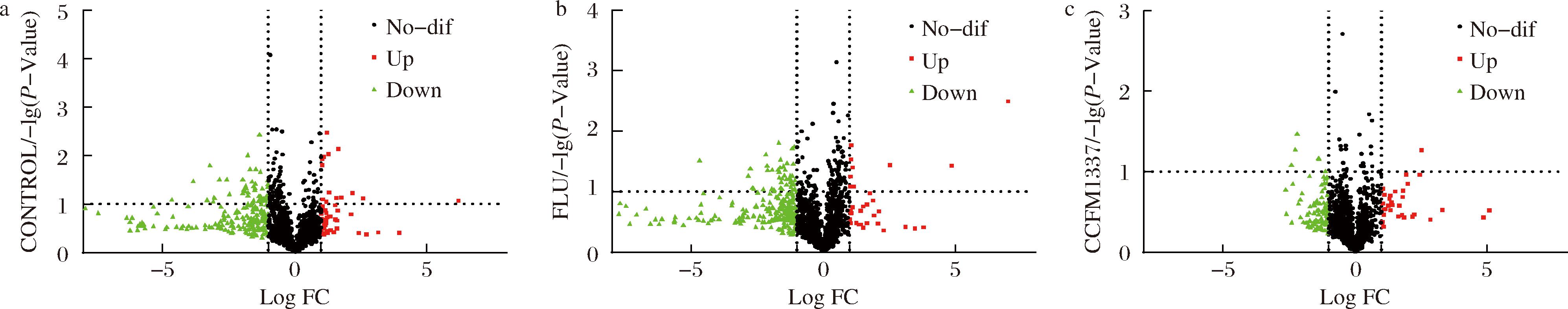
a-空白组;b-氟康唑组;c-CCFM1337组
图6 小鼠阴道差异代谢物vs模型组数量分析
Fig.6 Analysis of the number of differential metabolites vs model group in the vagina of mice
注:Up表示log FC>1,Down表示log FC<-1,No-dif表示无显著性差异。
为了分析CCFM1337干预后与模型组小鼠阴道组织代谢物组成的具体差异,本研究进行了正交偏最小二乘法判别分析(orthogonal partial least squares discriminant analysis,OPLS-DA)建模以及VIP值分析。本文将FC<0.5或FC>2作为条件筛选并展示前15种代谢差异物。图7-a显示,模型组正亮氨酸、苯乙酮、谷氨酸水平显著提升,其中氨基酸水平的提升可能归因于C.albicans分泌的水解酶对宿主蛋白的水解机制[27];而苯乙酮作为酚类化合物,其异常积累可能反映了宿主对真菌感染的防御反应[28]。图7-c显示,CCFM1337干预显著降低了苯乙酮(0.47倍)、酪胺(0.47倍)浓度,后者作为生物胺类毒素,可以引起阴道组织异味并抑制乳杆菌的生长[29],这可能得益于CCFM1337分泌乳酸降低小鼠阴道pH值,从而抑制酪胺生成菌的代谢活性;同时N-环丙基-2-哌嗪-1-基乙酰胺(2.45倍)浓度显著提升,这种物质被归类于羧酸及其衍生物,羧酸能够释放氢离子,促使阴道pH值降低,这一情况也有益于形成促进乳杆菌增殖的环境,进而改善小鼠阴道上皮屏障[30]。图7-b显示,氟康唑干预后,氟康唑浓度显著提升,N,N-二甲基赖氨酸浓度降低,其中N,N-二甲基赖氨酸可能是一种与炎症相关的代谢物[31]。这个结果说明,氟康唑在炎症调控过程中具有一定作用,但CCFM1337能够调节阴道上皮屏障,恢复小鼠阴道微生态,缓解阴道炎症。然而本研究中样本量较少,结果可能不具备代表性,并且未做相关通路验证分析,后续实验中需要改进。
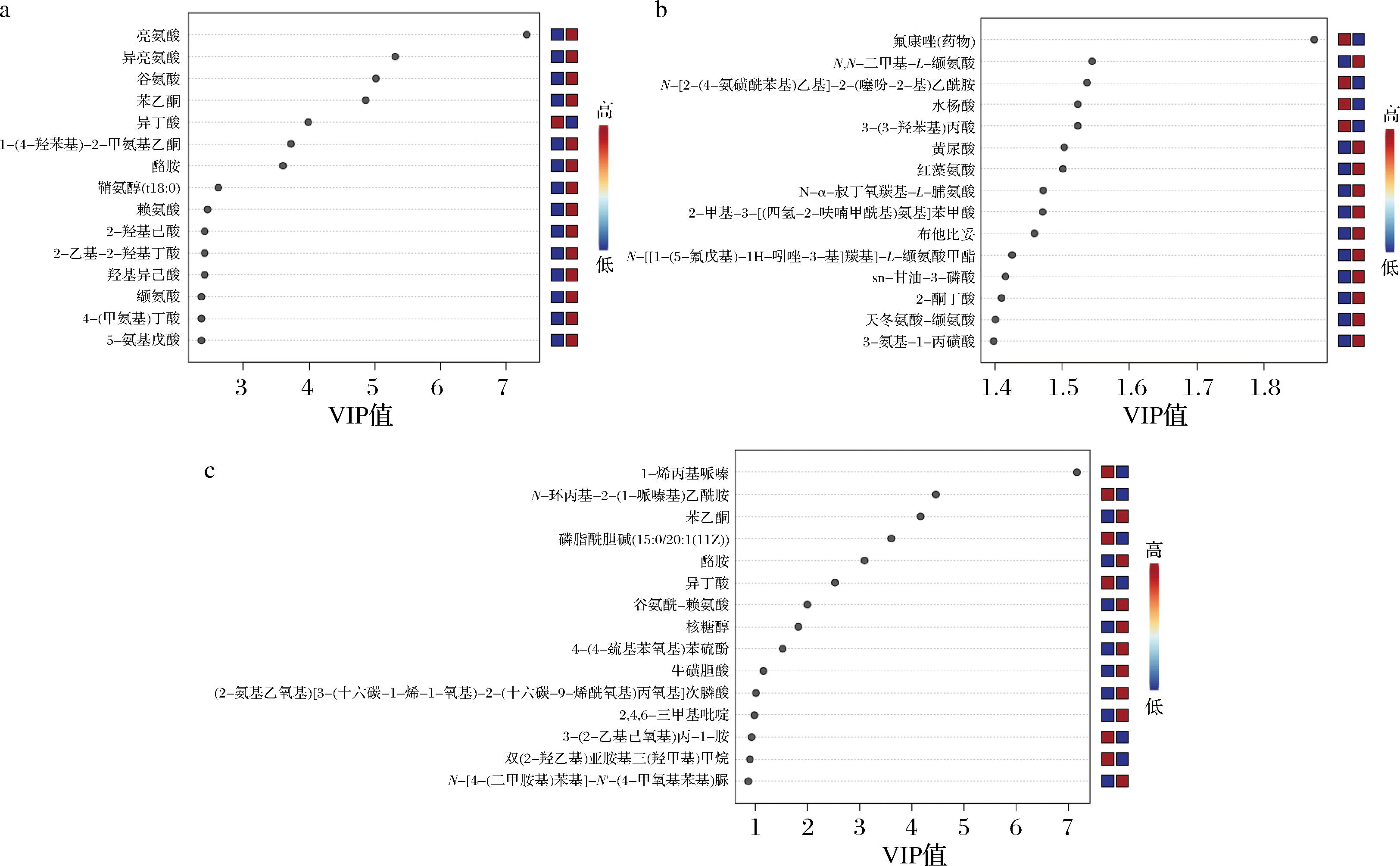
a-空白组;b-氟康唑组;c-CCFM1337组
图7 小鼠阴道代谢物vs模型组VIP值分析
Fig.7 Analysis of vaginal metabolite VIP values vs model group in mice
3 结论
本文主要探究了口服CCFM1337对于改善小鼠阴道上皮屏障,缓解念珠菌性阴道炎的效果,并分析了小鼠阴道组织差异代谢物。结果表明,口服L.delbrueckii CCFM1337能够通过调节sE-CAD、Occludin-1、ZO-1等阴道上皮紧密连接蛋白的表达,恢复阴道上皮屏障的完整性以及功能性,并有效降低了炎症相关的NLRP3、IL-1β、IL-17的表达,最终缓解了由于C.albicans侵袭导致的小鼠阴道组织炎症状况;同时,通过代谢物差异分析初步发现,CCFM1337的干预降低了与阴道异味相关的酪胺浓度,以及与阴道防御相关的苯乙酮,并提升了N-环丙基-2-哌嗪-1-基乙酰胺的浓度,这提示阴道组织的防御水平得到了一定的恢复。
[1] HEARPS A C,TYSSEN D,SRBINOVSKI D,et al.Vaginal lactic acid elicits an anti-inflammatory response from human cervicovaginal epithelial cells and inhibits production of pro-inflammatory mediators associated with HIV acquisition[J].Mucosal Immunology,2017,10(6):1480-1490.
[2] WILLEMS H M E,AHMED S S,LIU J Y,et al.Vulvovaginal candidiasis:A current understanding and burning questions[J].Journal of Fungi,2020,6(1):27.
[3] MOYES D L,RUNGLALL M,MURCIANO C,et al.A biphasic innate immune MAPK response discriminates between the yeast and hyphal forms of Candida albicans in epithelial cells[J].Cell Host &Microbe,2010,8(3):225-235.
[4] RICHARDSON J P,WILLEMS H M E,MOYES D L,et al.Candidalysin drives epithelial signaling,neutrophil recruitment,and immunopathology at the vaginal mucosa[J].Infection and Immunity,2018,86(2):e00645-17.
[5] W CHTLER B,CITIULO F,JABLONOWSKI N,et al.Candida albicans-epithelial interactions:Dissecting the roles of active penetration,induced endocytosis and host factors on the infection process[J].PLoS One,2012,7(5):e36952.
CHTLER B,CITIULO F,JABLONOWSKI N,et al.Candida albicans-epithelial interactions:Dissecting the roles of active penetration,induced endocytosis and host factors on the infection process[J].PLoS One,2012,7(5):e36952.
[6] GAZIANO R,SABBATINI S,MONARI C.The interplay between Candida albicans,vaginal mucosa,host immunity and resident microbiota in health and disease:An overview and future perspectives[J].Microorganisms,2023,11(5):1211.
[7] ARDIZZONI A,WHEELER R T,PERICOLINI E.It takes two to tango:How a dysregulation of the innate immunity,coupled with Candida virulence,triggers VVC onset[J].Frontiers in Microbiology,2021,12:692491.
[8] FRANK C F,HOSTETTER M K.Cleavage of E-cadherin:A mechanism for disruption of the intestinal epithelial barrier by Candida albicans[J].Translational Research,2007,149(4):211-222.
[9] ANTON L,DEVINE A,SIERRA L J,et al.miR-143 and miR-145 disrupt the cervical epithelial barrier through dysregulation of cell adhesion,apoptosis and proliferation[J].Scientific Reports,2017,7:3020.
[10] NIKOU S A,KICHIK N,BROWN R,et al.Candida albicans interactions with mucosal surfaces during health and disease[J].Pathogens,2019,8(2):53.
[11] PENG Y M,XU Y N,LI S N,et al.Mechanism of vaginal epithelial cell pyroptosis induced by the NLRP3 inflammasome in vulvovaginal candidiasis[J].American Journal of Reproductive Immunology,2024,92(1):e13893.
[12] SCOTT E,DE PAEPE K,VAN DE WIELE T.Postbiotics and their health modulatory biomolecules[J].Biomolecules,2022,12(11):1640.
[13] HUANG X Y,LIN R M,MAO B Y,et al.Lactobacillus crispatus CCFM1339 inhibits vaginal epithelial barrier injury induced by Gardnerella vaginalis in mice[J].Biomolecules,2024,14(2):240.
[14] 黄小艳.调节阴道上皮屏障乳杆菌的筛选及其辅助缓解阴道感染的机制[D].无锡:江南大学,2024.HUANG X Y.Screening of Lactobacillus regulating thevaginal epithelial barrier and its adjuctive mechanism in relieving vaginal infection[D].Wuxi:Jiangnan University,2024.
[15] WEI G,LIU Q Y,WANG X Y,et al.A probiotic nanozyme hydrogel regulates vaginal microenvironment for Candida vaginitis therapy[J].Science Advances,2023,9(20):eadg0949.
[16] CHEN J Y,YANG S Z,LUO H X,et al.Polysaccharide of Atractylodes macrocephala Koidz alleviates NAFLD-induced hepatic inflammation in mice by modulating the TLR4/MyD88/NF-κB pathway[J].International Immunopharmacology,2024,141:113014.
[17] HU K F,JIANG X J,ZHANG J P,et al.Effect of Pulsatilla decoction on vulvovaginal candidiasis in mice.Evidences for its mechanisms of action[J].Phytomedicine,2024,128:155515.
[18] LI Y X,ZHU W,JIANG Y,et al.Synthetic bacterial consortia transplantation for the treatment of Gardnerella vaginalis-induced bacterial vaginosis in mice[J].Microbiome,2023,11(1):54.
[19] BALAKRISHNAN S N,YAMANG H,LORENZ M C,et al.Role of vaginal mucosa,host immunity and microbiota in vulvovaginal candidiasis[J].Pathogens,2022,11(6):618.
[20] DONG M T,DONG Y L,BAI J Y,et al.Interactions between microbiota and cervical epithelial,immune,and mucus barrier[J].Frontiers in Cellular and Infection Microbiology,2023,13:1124591.
[21] LEE J F,ZENG Q,OZAKI H,et al.Dual roles of tight junction-associated protein,zonula occludens-1,in sphingosine 1-phosphate-mediated endothelial chemotaxis and barrier integrity[J].Journal of Biological Chemistry,2006,281(39):29190-29200.
[22] YE W,CHEN Z Q,HE Z Q,et al.Lactobacillus plantarum-derived-derived postbiotics ameliorate acute alcohol-induced liver injury by protecting cells from oxidative damage,improving lipid metabolism,and regulating intestinal microbiota[J].Nutrients,2023,15(4):845.
[23] CASSONE A.Vulvovaginal Candida albicans infections:Pathogenesis,immunity and vaccine prospects[J].BJOG,2015,122(6):785-794.
[24] YANG M,CAO Y C,ZHANG Z F,et al.Low intensity ultrasound-mediated drug-loaded nanoparticles intravaginal drug delivery:An effective synergistic therapy scheme for treatment of vulvovaginal candidiasis[J].Journal of Nanobiotechnology,2023,21(1):53.
[25] LOPEZ-CASTEJON G,BROUGH D.Understanding the mechanism of IL-1β secretion[J].Cytokine &Growth Factor Reviews,2011,22(4):189-195.
[26] 巴特,刘飞飞,宋娇.妊娠晚期B族溶血性链球菌宫内感染患者血清IL-1β和IL-10表达与阴道微生态及妊娠结局的关系[J].中国病原生物学杂志,2024,19(11):1255-1259.BA T,LIU F F,SONG J.Relationship between serum IL-1β and IL-10 expression with vaginal microbiota and pregnancy outcomes in patients with intrauterine infection of Group B hemolytic streptococci in late pregnancy[J].Journal of Pathogen Biology,2024,19(11):1255-1259.
[27] ZHAO Y N,WANG P J,SUN X D,et al.Candida albicans infection disrupts the metabolism of vaginal epithelial cells and inhibits cellular glycolysis[J].Microorganisms,2024,12(2):292.
[28] AHMADPOURMIR H,ATTAR H,ASILI J,et al.Natural-derived acetophenones:Chemistry and pharmacological activities[J].Natural Products and Bioprospecting,2024,14(1):28.
[29] PUEBLA-BARRAGAN S,AKOURIS P P,AL K F,et al.The two-way interaction between the molecules that cause vaginal malodour and lactobacilli:An opportunity for probiotics[J].International Journal of Molecular Sciences,2021,22(22):12279.
[30] DELGADO-DIAZ D J,JESAVELUK B,HAYWARD J A,et al.Lactic acid from vaginal microbiota enhances cervicovaginal epithelial barrier integrity by promoting tight junction protein expression[J].Microbiome,2022,10(1):141.
[31] CUI Y,WANG H,WANG Y T.Plasma metabolites as mediators in the relationship between inflammation-related proteins and benign prostatic hyperplasia:Insights from mendelian randomization[J].Scientific Reports,2024,14(1):26152.