益生菌是指食用后可改善宿主肠道菌群生态平衡,发挥有益作用,提高宿主健康水平的制剂[1]。多项研究证实益生菌补充剂对机体免疫系统功能具有重要调节作用,可以激活固有免疫系统并调节适应性免疫系统。LEE等[2]发现每日服用含副干酪乳酪杆菌(L.CASEI 431)、乳双歧杆菌(BB-12)及热灭活的植物乳植杆菌(nF1)的牛奶,可显著升高受试者自然杀伤细胞活性,上调血清中白细胞介素-12(interleukin-12,IL-12)、干扰素-γ(interferon-γ,IFN-γ)和免疫球蛋白G1(immunoglobulin G1,Ig G1)的水平。服用乳双歧杆菌HN019被发现可显著增加粒细胞的吞噬能力以及自然杀伤细胞的杀伤能力,改善老年人的免疫能力[3]。口服长双歧杆菌长亚种BB536可通过维持受试者自然杀伤细胞活性和上调血清中的IgA水平来增强免疫反应,激活CD86和HLA-DR阳性的树突状细胞,还可显著增加IFN-β、IFN-γ等的表达水平[4]。在免疫低下的动物模型中,多种益生菌均展现了保护作用和免疫增强效果,包括干酪乳酪杆菌NCU011054[5]、植物乳植杆菌200655、嗜酸乳杆菌LA85[6]、鼠李糖乳酪杆菌CRL1506[7]、罗伊氏粘液乳杆菌PSC102、动物双歧杆菌乳亚种XLTG11[8]等。
随着研究的不断深入,益生菌的灭活菌体及其代谢产物被发现同样具有多种益生活性,热灭活植物乳植杆菌KCTC 13314BP可显著促进RAW264.7巨噬细胞释放肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、IL-6,并通过激活MAPK和STAT3信号通路增强巨噬细胞的吞噬活性和发挥免疫调节作用[9]。热灭活双歧杆菌 MG731可诱导人胃癌细胞的凋亡,并在小鼠移植癌模型中展示出抗肿瘤活性[10]。口服热灭活双歧杆菌BR-108可显著升高小鼠回肠派尔集合淋巴结及回肠组织IL-4、IL-10等细胞因子mRNA的相对表达水平,激活肠道黏膜免疫[11]。国际益生菌和益生元科学协会(International Scientific Association for Probiotics and Prebiotics,ISAPP)指出益生元是“被宿主微生物选择性利用的底物,赋予健康益处”;合生元是“由活微生物和底物组成的混合物,被宿主微生物选择性地利用,赋予宿主健康益处”;后生元是“为宿主带来健康益处的无生命微生物和/或其成分的制剂”[12]。与益生菌相比,后生元具有安全性更高、活性成分释放更容易、稳定性更好的特点[13],使得后生元制剂成为微生态制剂的新方向。然而相对益生菌活菌制剂,目前后生元的研究和开发较少。实验室前期研究中发现动物双歧杆菌乳亚种IOB LO7后生元能够改善AD大鼠的认知障碍[14],为了探究动物双歧杆菌乳亚种IOB LO7后生元是否具有免疫调节作用,本研究以小鼠单核巨噬细胞和小鼠脾淋巴细胞为体外模型,以环磷酰胺(cyclophosphamide,CTX)诱导的免疫低下小鼠为体内模型,探索动物双歧杆菌乳亚种IOB LO7后生元(包括灭活菌及其代谢产物)对免疫功能的影响及机制,以期为后生元的深入研究和产业化开发利用提供科学借鉴。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株来源
本试验中使用的动物双歧杆菌乳亚种IOB LO7分离自天津地区30周岁育龄健康女性的母乳,保藏于中国微生物菌种保藏管理委员会普通微生物中心,编号CGMCC No.24185。
1.1.2 药品与试剂
高糖型DMEM培养基、RPMI 1640培养基,美国Gibco公司;特优级胎牛血清,浙江天杭生物科技股份有限公司;TPY液体培养基,青岛高科技工业园海博生物技术有限公司;3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐[3-(4,5-dimethyl-2-thiazolyl)-2,5-diphenyl-2-H-tetrazolium bromide,MTT]、脂多糖(lipopolysaccharides,LPS)、刀豆蛋白A(concanavalin A,ConA),北京索莱宝生物科技有限公司;CTX、盐酸左旋咪唑(levamisole hydrochloride,LH),上海麦克林生化科技股份有限公司;PE anti-mouse CD4、PE/Cyanine5 anti-mouse CD8α、FITC anti-mouse CD3,美国Biolegend公司;一氧化氮检测试剂盒(Cat:S0021S),碧云天生物技术有限公司;IL-6(Cat:CME0006)、TNF-α(Cat:CME0004)酶联免疫吸附(enzyme-linked immunosorbent assay,ELISA)测定试剂盒,北京四正柏生物技术有限公司。
1.2 仪器与设备
SpectraMax iD3多功能酶标仪,美国Molecular Devices公司;SW-CJ-1FD净化工作台,上海沪净医疗器械有限公司;CytoFLEX流式细胞仪,美国Beckman coulter公司;细胞培养箱,美国Thermo fisher公司;HistoCore Arcadia H+C全自动包埋机、HistoCore MULTICUT半自动轮转式切片机,德国Leica公司;BX53正置显微镜,日本Olympus公司。
1.3 实验方法
1.3.1 IOB LO7后生元的制备
IOB LO7后生元的制备参考肖灵等[14]的方法,将活化后的动物双歧杆菌乳亚种IOB LO7按照3%的接种量接种至TPY液体培养基中进行发酵,达到稳定期后,将发酵液在6 000 r/min,4 ℃条件下离心20 min,离心后的沉淀在95 ℃下灭菌25 min,之后放置于-80 ℃预冻2~3 h,然后进行冷冻干燥,干燥温度设置为-80~-60 ℃,干燥时间为24~48 h,水分含量控制在10%以下,即可获得双歧杆菌后生元菌粉,菌数为4.50×1011 CFU/g,菌落计数采用GB 4789.35—2023《食品安全国家标准 食品微生物学检验 乳酸菌检验》的方法进行检测。
1.3.2 巨噬细胞存活率、NO与细胞因子含量的测定
小鼠巨噬细胞RAW264.7培养于体积分数为10%胎牛血清的高糖型DMEM培养基,置于5% CO2、湿度为95%、37 ℃的恒温细胞培养箱。将细胞接种(1×104 细胞/孔)于96孔板中,过夜培养,分别加入终质量浓度为0.1 μg/mL LPS及1×105、1×106、1×107 CFU/mL的IOB LO7后生元孵育24 h,加入0.5 mg/mL的MTT溶液孵育4 h后,加入二甲亚砜(dimethyl sulfoxide,DMSO)溶解,使用酶标仪测量490 nm处吸光度。Gress法检测细胞上清液培养基中NO的含量,ELISA试剂盒检测细胞上清液培养基中IL-6、TNF-α的含量。
1.3.3 小鼠脾淋巴细胞增殖检测
取6周雄性SPF级的BALB/c小鼠购自斯贝福(北京)生物技术有限公司(许可证号:SCXK(京)2022-0002),安乐处死,无菌解剖并研磨脾脏,200目细胞筛网过滤收集单细胞悬液,用红细胞裂解液去除红细胞收集脾淋巴细胞,用台盼蓝染液检测活细胞(活细胞比例>95%),将其培养于体积分数为10%胎牛血清的RPMI 1640培养基中。将脾淋巴细胞以2×106活细胞/孔接种于96孔板中,加入终浓度为1×105、1×106、1×107 CFU/mL的IOB LO7后生元孵育48 h,使用5 μg/mL ConA作为阳性对照,MTT检测细胞增殖情况。
1.3.4 动物实验的设计
6周龄[体重(20±2) g,40只]雄性SPF级BALB/c小鼠适应1周后,随机分为正常对照组(NC组)、环磷酰胺模型组(CTX组)、药物对照组(CTX+LH)、IOB LO7后生元低剂量组(CTX+BBL)和IOB LO7后生元高剂量组(CTX+BBH),每组8只。实验中遵守实验动物福利伦理原则和要求,由天津科技大学学术委员会审批(No.SWXY-20231012103)。参照张艳艳等[15]的建模方法稍作修改,CTX+LH组、CTX+BBL组、CTX+BBH组小鼠每天分别灌胃100 μL的40 mg/kg的盐酸左旋咪唑及2×108、1×109 CFU/mL的IOB LO7后生元,NC组和CTX组小鼠每天灌胃等量的生理盐水,连续14 d。期间第8天开始,各组小鼠每日腹腔注射80 mg/kg的环磷酰胺(NC组除外),连续3 d,以诱导免疫抑制。每日记录小鼠体重,14 d后安乐处死小鼠,取脾脏称重,脾脏指数计算如公式(1)所示。
脾脏指数/%=脾脏重量(g)/体重(g)×100
(1)
1.3.5 脾脏组织、结肠组织的切片染色
取脾脏组织、结肠组织固定在40 g/L的多聚甲醛溶液中,48 h后,依次进行脱水、包埋、切片,小鼠的脾脏组织进行苏木精-伊红(hematoxylin-eosin,HE)染色,小鼠的结肠组织进行阿利新蓝-过碘酸-雪夫(Alcian blue periodic acid schiff,AB-PAS)染色,并在显微镜下观察组织形态变化。
1.3.6 脾淋巴细胞增殖检测
各组实验小鼠脾淋巴细胞获取方式同1.3.3节,将脾淋巴细胞以2×106个活细胞/孔接种于96孔板中,在含有或不含有终质量浓度为5 μg/mL的ConA中,37 ℃、5% CO2培养48 h,利用MTT方法检测各组脾淋巴细胞数目。
1.3.7 脾T淋巴细胞亚群含量测定
取脾淋巴细胞,用抗体FITC anti-mouse CD3、PE anti-mouse CD4、PE/Cyanine5 anti-mouse CD8α进行多重荧光标记,使用CytoFLEX流式细胞仪进行检测,数据使用Flow Jo进行分析,计算CD3+CD4+/CD3+CD8+ T淋巴细胞的比例。
1.3.8 脾脏组织与结肠组织的mRNA检测
采用Trizol法提取小鼠脾脏和结肠的总RNA,按照HiScript III All-in-one RT SuperMix Perfect for qPCR反转录说明书将RNA反转录成cDNA,以cDNA为模板按照Bestar® SybrGreen qPCR Mastermix的试剂盒配制相应反应体系溶液。以甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)为内参,采用2-ΔΔCt法分析Toll样受体2(toll-like receptors 2,TLR2)、核因子κB亚基1(nuclear factor-kappa B1,NFKB1)、核因子κB p65亚单位(p65 NF-kappa B,RELA)、黏蛋白1(mucin-1,MUC1)、黏蛋白2(mucin-2,MUC2)、黏蛋白3(mucin-3,MUC3)的mRNA相对表达量,相关基因引物的序列如表1所示。
表1 小鼠基因转录分析的特异性引物序列
Table 1 Sequence of specific primers for mouse gene transcription analysis

基因引物序列 5′-3′ TLR2F TTCCTGGTTCCCTGCTCGTTCR CATCCAACACCTCCAGCGTCTRELAF GCGAATCCAGACCAACAATAACCCR CTGGTCCCGTGAAATACACCTNFKB1F GCCCATACCTTCAAATATTAGAGCAR TAATACACGCCTCTGTCATCCGMUC1F AATGGCTCCTCGGTGCTACCTAR TGACTTGGCACTGAAGGCTGAGMUC2F TGCTGACGAGTGGTTGGTGAATGR GATGAGGTGGCAGACAGGAGACAMUC3F CACTGCTGATGTCACCACCACTACR GCACTTGTCACCTGTCCAGAACCGAPDHF CCTTCCGTGTTCCTACCCR CCCAAGATGCCCTTCAGT
1.4 数据处理
采用SPSS 21.0软件对数据进行统计与分析,正态分布的连续变量以“平均值±标准差”表示,2组之间比较采用t检验。数据可视化通过GraphPad Prism 9完成。
2 结果与分析
2.1 IOB LO7后生元对RAW264.7 NO和细胞因子释放的影响
IOB LO7后生元对细胞存活、NO和细胞因子水平的影响结果如图1所示,1×105~1×107 CFU/mL IOB LO7后生元对RAW264.7细胞的活力没有显著影响;与对照组相比,1×106 CFU/mL的IOB LO7能够显著促进RAW264.7细胞产生NO(P<0.001)和IL-6、TNF-α(P<0.01);1×107 CFU/mL的IOB LO7促进RAW264.7细胞产生NO和IL-6、TNF-α,均具有极显著性差异(P<0.001)。结果表明,IOB LO7后生元可以刺激巨噬细胞M1极化,并释放NO、IL-6、TNF-α等细胞因子,因此可能具有刺激免疫的潜能。
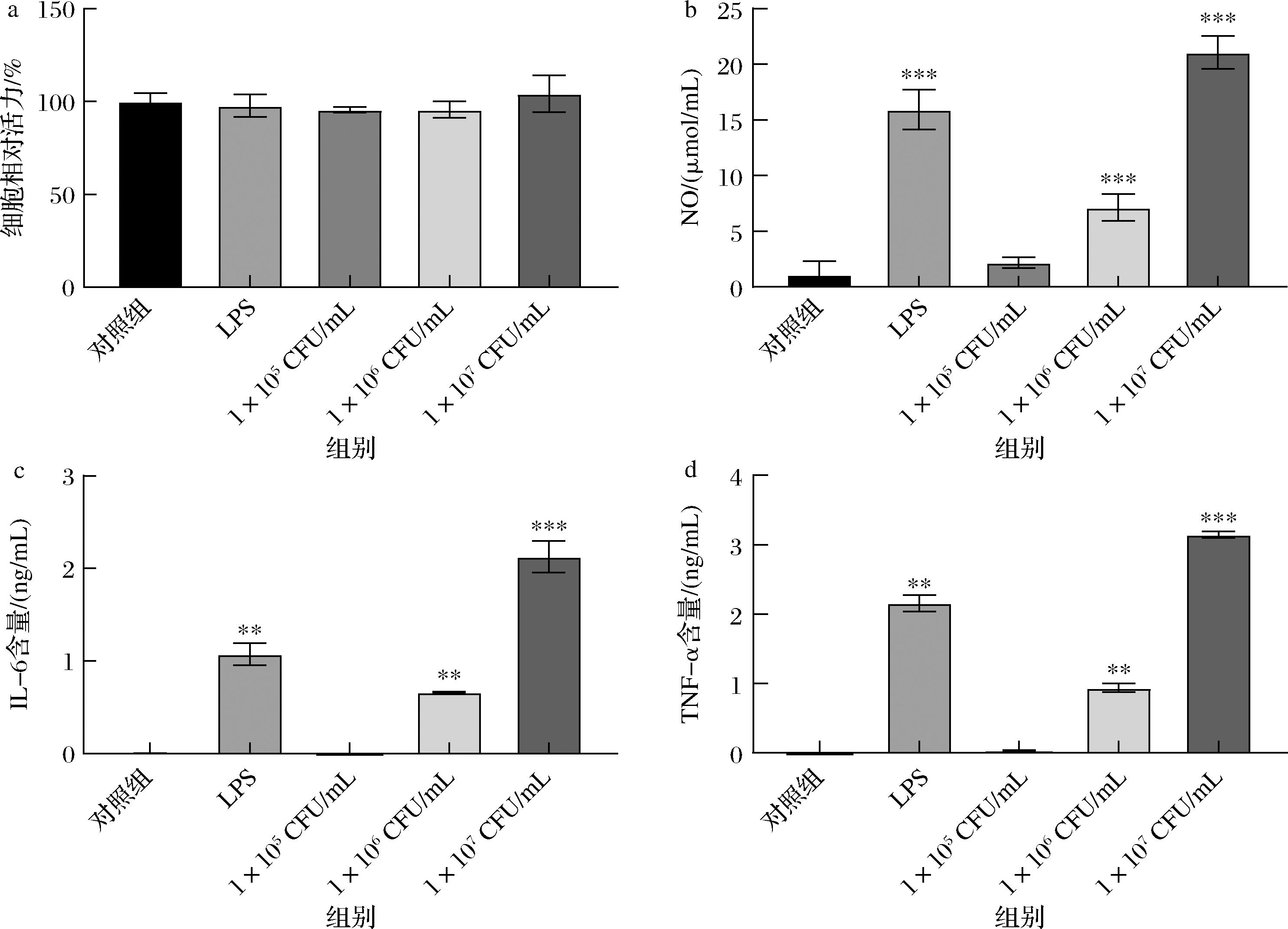
a-MTT检测RAW264.7细胞活力;b-NO的含量;c-IL-6的含量;d-TNF-α的含量
图1 IOB LO7后生元对RAW264.7细胞的影响
Fig.1 Effect of IOB LO7 postbiotic on RAW264.7 cells
注:与对照组比具有显著性差异,**,P<0.01;***,P<0.001(下同)。
2.2 IOB LO7后生元对小鼠脾淋巴细胞增殖的影响
IOB LO7后生元对小鼠脾淋巴细胞的增殖影响结果如图2所示,1×105、1×106、1×107 CFU/mL IOB LO7后生元对脾淋巴细胞的增殖均有显著地促进效果(P<0.05或P<0.001),且随着IOB LO7后生元浓度的增加,其促进增殖的作用也随之增加。这些结果表明IOB LO7后生元可能通过刺激淋巴细胞增殖,增加活跃淋巴细胞数量,发挥免疫调节作用,且具有浓度依赖性。

图2 IOB LO7后生元对小鼠脾T淋巴细胞的增殖影响
Fig.2 Effect of IOB LO7 postbiotic element on the proliferation of spleen T lymphocytes in mice
2.3 IOB LO7后生元对免疫功能低下小鼠体重与脾脏指数的影响
为了进一步评估IOB LO7后生元的免疫增强作用,建立了CTX致免疫功能低下的小鼠模型,进行IOB LO7后生元干预后检测小鼠体重和脾脏指数。结果如表2和图3所示,实验期间NC组小鼠体重稳步增长,其他各组中,CTX注射导致小鼠体重短暂性显著下降,3 d后,与CTX组相比,CTX+LH组、CTX+BBL组以及CTX+BBH组的体重均快速回升。脾脏指数可以反映脾脏红髓和淋巴细胞的增生程度,以及免疫系统的活性。由图4可知,CTX组的脾脏指数与NC组相比显著降低(P<0.001);与CTX组相比,CTX+BBL组和CTX+BBH组脾脏指数增加显著(P<0.05或P<0.01)。结果表明,IOB LO7后生元可以改善CTX诱导引起的小鼠体重丢失及脾脏指数降低。
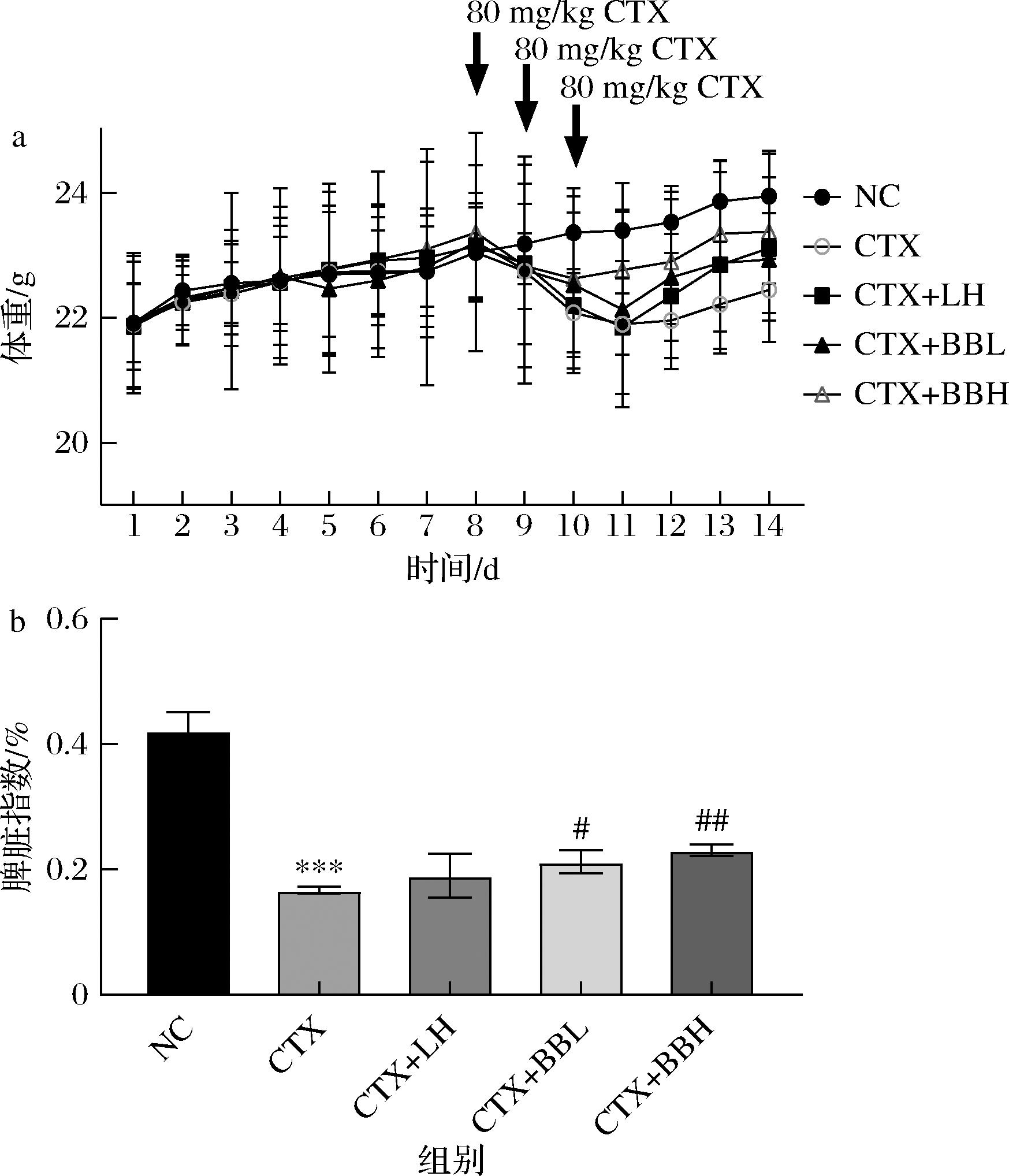
a-小鼠体重;b-脾脏指数
图3 IOB LO7后生元对免疫功能低下小鼠体重和脾脏指数的影响
Fig.3 Effect of IOB LO7 postbiotic on body weight and spleen index of immunocompromised mice
注:与NC组比具有显著性差异,*,P<0.05;**,P<0.01;***,P<0.001;与CTX组相比具有显著性差异,#,P<0.05;##,P<0.01;###,P<0.001(下同)。
表2 小鼠每日体重 单位:g
Table 2 Daily body weight of mice

时间/dNC组CTX组CTX+LH组CTX+BBL组CTX+BBH组121.92±0.6321.90±1.0121.87±0.7021.92±1.1221.93±1.07222.43±0.5522.25±0.4422.28±0.7322.25±0.6722.32±0.51322.55±0.6322.38±0.5122.48±0.7522.43±1.5722.48±0.93422.60±0.7022.58±1.0222.57±1.2122.67±1.4122.63±0.84522.70±1.0022.73±1.2922.77±1.3822.47±1.3422.78±1.37622.72±0.6922.75±0.8722.92±0.8622.60±1.2222.93±1.42722.75±0.7222.75±0.8922.97±0.7922.82±1.8923.10±1.41823.05±0.7223.05±0.7723.15±0.8523.22±1.7523.37±1.08923.18±0.6322.75±0.6122.87±1.2822.77±1.8122.83±1.621023.37±0.5822.08±0.63∗∗22.20±1.0922.53±1.1522.63±0.591123.40±0.7621.90±0.49∗∗21.85±1.0722.13±1.5622.72±1.081223.53±0.4921.96±0.33∗∗22.35±0.9922.42±1.5222.90±0.991323.87±0.6522.22±0.71∗∗22.85±1.0622.88±1.4623.35±1.181423.95±0.6822.50±0.53∗∗23.12±0.5622.93±1.3223.38±1.30
注:**表示同一天内,与NC组比具有显著性差异(P<0.01)。
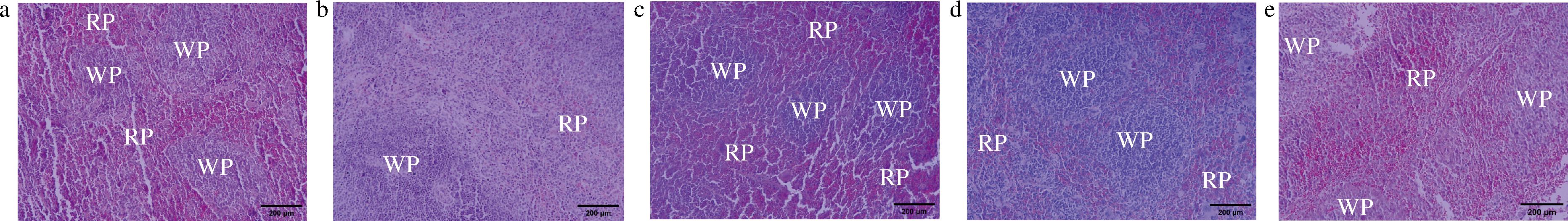
a-NC组;b-CTX组;c-CTX+LH组;d-CTX+BBL组;e-CTX+BBH组
图4 IOB LO7后生元对免疫功能低下小鼠脾脏组织形态的影响
Fig.4 Effect of IOB LO7 postbiotic on spleen morphology in immunocompromised mice
2.4 IOB LO7后生元对免疫功能低下小鼠脾脏组织形态的影响
小鼠脾脏组织HE染色结果如图4所示,与NC组相比,CTX组小鼠脾脏结构紊乱,白髓(white pulp,WP)与红髓(red pulp,RP)边界模糊。与CTX组相比,CTX+BBH组能恢复脾脏组织的结构,WP与RP边界清晰,与CTX+LH组相似。结果表明,IOB LO7后生元通过恢复脾脏结构区室来保护脾脏功能。
2.5 IOB LO7后生元对免疫功能低下小鼠脾淋巴细胞增殖能力的影响
IOB LO7后生元对免疫功能低下小鼠脾淋巴细胞增殖的影响结果如图5所示,与NC组相比,CTX组的脾淋巴增殖能力显著下降(P<0.001);与CTX组相比,CTX+LH组与CTX+BBH组的脾脏淋巴细胞增殖的能力极显著升高(P<0.01),CTX+BBL组脾脏淋巴细胞增殖的能力显著升高(P<0.05)。结果表明,IOB LO7后生元可能通过促进脾淋巴细胞增殖来改善免疫抑制。
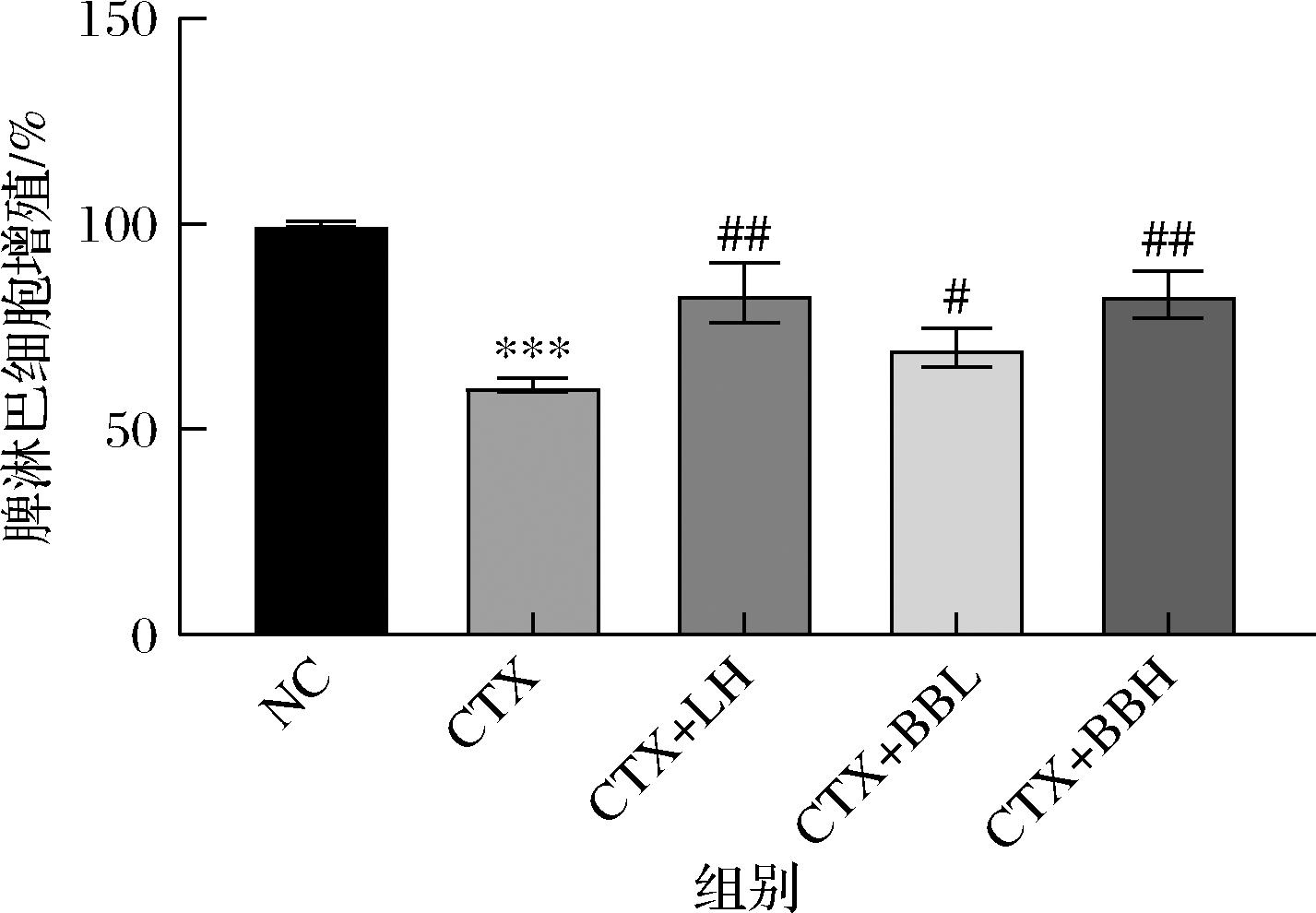
图5 IOB LO7后生元对免疫功能低下小鼠脾淋巴细胞的增殖影响
Fig.5 Effect of IOB LO7 postbiotic on splenic lymphocyte proliferation in immunocompromised mice
2.6 IOB LO7后生元对免疫功能低下小鼠CD3+CD4+/CD3+CD8+的影响
小鼠脾T淋巴细胞亚群分析结果如图6所示,与NC组相比,CTX组CD3+CD4+/CD3+CD8+ T淋巴细胞比值显著减低(P<0.01);而CTX+LH组的CD3+CD4+/CD3+CD8+的比值较CTX组极显著增加(P<0.01),CTX+BBL组以及CTX+BBH组的CD3+CD4+/CD3+CD8+的比值较CTX组显著增加(P<0.05)。结果表明,IOB LO7后生元通过增加CD3+CD4+/CD3+CD8+ T淋巴细胞比值增强免疫功能。
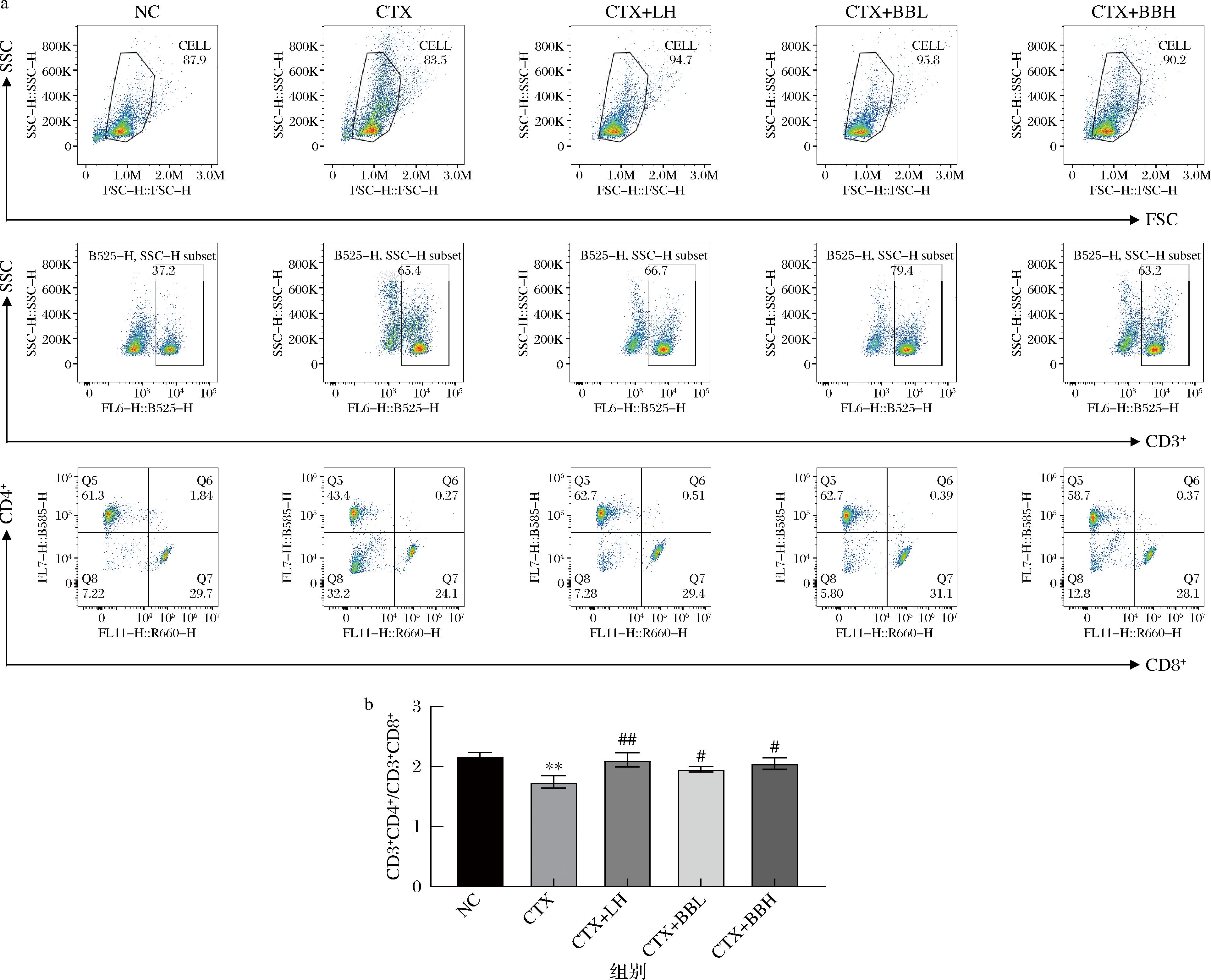
a-脾淋巴细胞圈门图;b-CD3+CD4+/CD3+CD8+T细胞的比值
图6 IOB LO7对免疫功能低下小鼠T淋巴细胞亚群的影响
Fig.6 Effect of IOB LO7 postbiotic on spleen lymphocytes in immunocompromised mice
2.7 IOB LO7后生元对免疫功能低下小鼠血常规指标的影响
血常规指标结果如表3所示,与NC组相比,CTX组的红细胞(red blood cell,RBC)数量(P<0.01)、血红蛋白(hemoglobin,HGB)含量(P<0.001)、白细胞(white blood cell,WBC)数量(P<0.01)以及淋巴细胞百分比(P<0.05)均有显著减低,与CTX组相比,CTX+BBL组的HGB(P<0.05)和WBC(P<0.001)显著增加,CTX+BBH组的HGB(P<0.01)和WBC(P<0.01)也显著增加。结果表明,IOB LO7后生元通过恢复骨髓功能,促进造血干细胞分化为不同的免疫细胞,增强免疫低下小鼠的免疫能力。
表3 各组小鼠血液参数的比较
Table 3 Comparison of hematological parameters in each group of mice

组别RBC/ ×1012/L HGB/ g/L WBC/ ×109/L PLT/ ×1011/L 淋巴细胞百分比/%NC10.28±0.99148.75±9.945.20±1.87595.33±32.0191.92±7.88CTX7.84±0.69∗∗109.33±9.50∗∗∗1.59±0.57∗∗452.00±90.3468.25±13.44∗CTX+LH8.19±0.60120.00±7.622.23±0.83642.67±146.9283.00±8.93CTX+BBL8.36±1.34132.75±9.46#6.87±1.05###426.00±70.5572.40±13.46CTX+BBH9.48±0.89138.75±14.9##6.05±1.84##663.33±136.5569.05±8.48
注:与NC组比具有显著性差异,*,P<0.05;**,P<0.01;***,P<0.001;与CTX组相比具有显著性差异,#,P<0.05;##,P<0.01;###,P<0.001。
2.8 IOB LO7后生元对免疫功能低下小鼠脾脏信号通路的影响
Toll样受体2(toll-like receptor 2,TLR2)是一种模式识别受体,能够识别脂蛋白、脂多糖、脂壁酸等,可激活NF-κB信号通路;RELA与NFKB1,分别称为p65与p50,是NF-κB家族的成员,影响炎症过程,并增强免疫细胞的活性。为评估IOB LO7后生元对TLR2/NF-κB信号通路的影响,利用RT-qPCR技术检测脾脏组织中TLR2、RELA、NFKB1的mRNA水平变化。结果如图7所示,与NC组相比,CTX组TLR2(P<0.01)、NFKB1(P<0.001)的mRNA水平显著降低;与CTX组相比,CTX+LH组TLR2(P<0.01)、RELA(P<0.01)、NFKB1(P<0.05)的mRNA水平显著升高,CTX+BBL组NFKB1(P<0.05)的mRNA水平均显著升高,CTX+BBH组TLR2(P<0.01)、NFKB1(P<0.001)的mRNA水平均有显著升高。结果表明,IOB LO7后生元可能通过结合TLR2受体,激活下游NF-κB通路,最终导致调控适应性免疫的促炎细胞因子和趋化因子的基因表达上调,增强免疫。
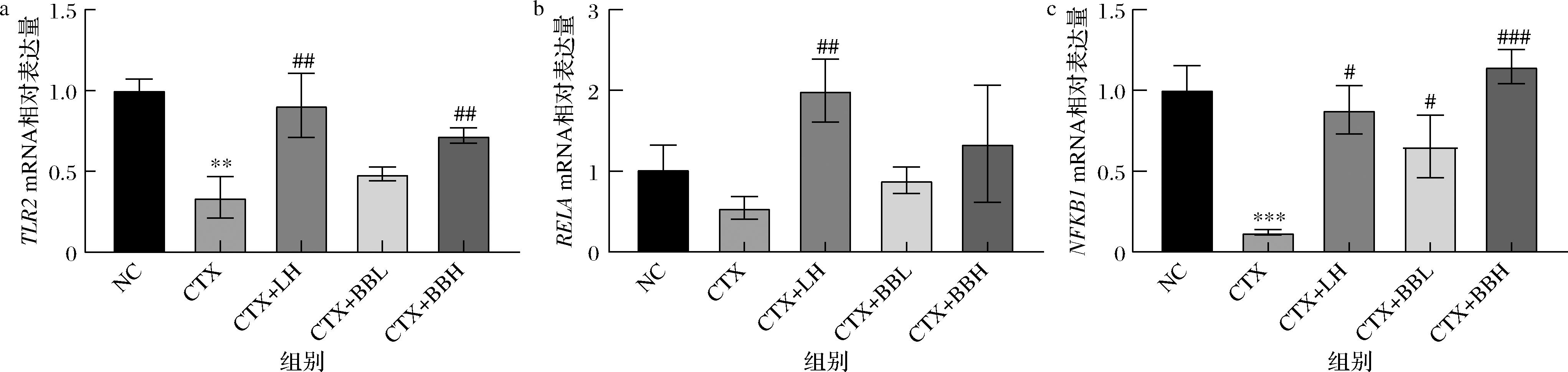
a-TLR2;b-RELA;c-NFKB1相对表达量(GAPDH)
图7 IOB LO7后生元对免疫功能低下小鼠脾脏信号通路的影响
Fig.7 Effect of IOB LO7 postbiotic on signaling pathway in the spleen tissues of immunocompromised mice
2.9 IOB LO7后生元对免疫功能低下小鼠结肠组织形态和黏膜屏障的影响
粘蛋白是由杯状细胞合成并分泌的高分子质量糖蛋白,是肠道黏膜屏障的关键组成部分,黏液形成的物理屏障,抵御外部刺激。IOB LO7后生元对免疫功能低下小鼠肠道黏膜屏障的影响结果如图8所示,与NC组相比,CTX组小鼠结肠部分有明显的炎症浸润。与CTX组相比,CTX+BBL组的结肠组织仍有少量炎症浸润,CTX+LH、CTX+BBH组的结肠组织相对完整,同时杯状细胞明显多于CTX组。与NC组相比,CTX组MUC1(P<0.01)、MUC2(P<0.01)、MUC3(P<0.05)的mRNA水平显著降低;与CTX组相比,CTX+LH组(P<0.05)和CTX+BBL组(P<0.05)MUC1、MUC2、MUC3的mRNA水平均显著升高,CTX+BBH组MUC1(P<0.05)、MUC2(P<0.01)、MUC3(P<0.05)的mRNA水平均有显著升高(图8)。结果表明,IOB LO7后生元能够维持肠道黏膜屏障,提高黏蛋白表达,减少炎症细胞浸润,维持肠道的稳态。
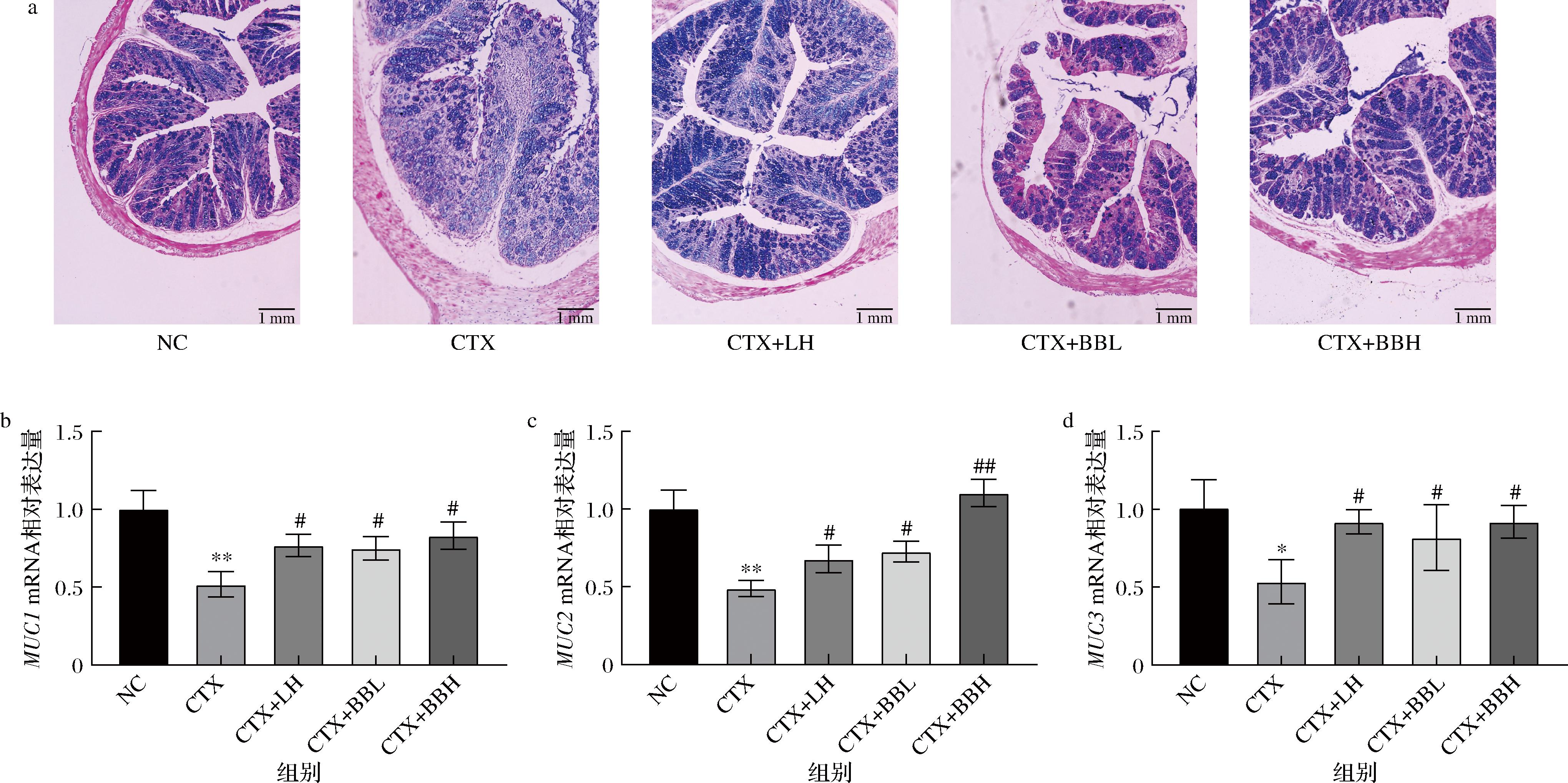
a-结肠组织AB-PAS染色;b-MUC1;c-MUC2;d-MUC3相对表达量(GAPDH)
图8 IOB LO7后生元对免疫功能低下小鼠结肠形态与黏蛋白表达的影响
Fig.8 Effect of IOB LO7 postbiotic on colon morphology and mucin expression in the colon tissues of immunocompromised mice
3 结论与讨论
环磷酰胺是构建免疫抑制动物模型的常用药物,通过产生交联来烷基化并损伤DNA,抑制免疫器官功能。田艳等[16]的研究说明含动物双歧杆菌乳亚种HN019、两歧双歧杆菌Bb06、动物双歧杆菌动物亚种BB-2等15种混合的益生菌冻干粉能够增加免疫功能低下小鼠的脾脏指数。XUE等[6]证实嗜酸乳杆菌能够增加免疫抑制小鼠的体重以及脾脏指数。本研究观察到口服IOB LO7后生元能够恢复CTX致免疫抑制小鼠的体重以及脾脏指数的降低,说明动物双歧杆菌乳亚种IOB LO7后生元具有改善免疫抑制功效。
脾脏是体内最大的次级淋巴器官,根据功能和结构分为RP、WP以及这2个区域之间的边缘区。RP中的细胞能够接受刺激,快速响应并激活适应性免疫反应。WP中存在着诸多淋巴细胞,其亚群细胞的数量和比例的变化反映机体免疫状态。T淋巴细胞特异性识别抗原后通过增殖分化成效应T细胞,发挥免疫调节能力。罗伊氏粘液乳杆菌KBL 346可以通过恢复脾脏的区室结构、诱导NK细胞活性和T、B淋巴细胞增殖,增强免疫功能[17]。李艾黎等[18]对植物乳植杆菌、罗伊氏粘液乳杆菌、约氏乳杆菌等多种乳杆菌进行了研究,发现无论是活性乳杆菌还是热灭活乳杆菌对于小鼠脾淋巴细胞增殖均有一定的促进作用。SHA等[19]证实CTX可导致脾T淋巴细胞中CD4+/CD8+降低,而给予5%的人参膳食纤维能够显著恢复CTX诱导的CD4+/CD8+ T淋巴细胞比例,并改善脾组织损伤,增强机体免疫。本研究证实IOB LO7后生元能够恢复免疫低下小鼠脾脏的形态结构、体内外均可增强淋巴细胞增殖能力,恢复CTX导致的T淋巴细胞亚群失调,增加CD3+CD4+/CD3+CD8+细胞比值。
巨噬细胞作为固有免疫细胞,在调节免疫方面起至关重要的作用,通过释放NO以及IL-6、TNF-α等炎症因子来保护宿主免受病原体的侵害。AL-NAJJAR等[20]证实嗜酸乳杆菌、动物双歧杆菌乳亚种、副干酪乳酪杆菌和鼠李糖乳酪杆菌的条件培养基能够显著增加RAW264.7细胞NO及TNF-α的释放量。本研究发现动物双歧杆菌乳亚种IOB LO7后生元显著增加了RAW264.7细胞中NO、IL-6、TNF-α的分泌,从而增强机体的免疫力。另外,RBC、WBC与机体的免疫状态密切相关,RBC识别抗原并促进巨噬细胞的吞噬,而WBC参与机体的防御反应。柳茶多糖[21]和迷迭香酸[22]均被证实能够增加免疫低下小鼠的血液中RBC、WBC、血小板计数(platelet count,PLT)的含量,增强免疫。KIM等[23]证实与CTX模型组相比,发酵黏液乳杆菌可以显著增加血液中WBC、RBC和HGB的水平。本研究发现IOB LO7后生元能够显著提高血液中WBC细胞数目及HGB水平,增强免疫低下小鼠的免疫能力。其中LH阳性药物组可以增加小鼠中HGB水平,但略低于IOB LO7后生元低、高剂量组(均无显著差异),这一结果可能是由于小鼠个体差异导致的。同时LH组血液中WBC细胞数目略有恢复但不显著,这一结果与张凤丽等[24]和石峻岭等[25]的研究结果相似。目前关于LH对于CTX处理后白细胞的恢复作用效果文献报道不一[24-26],可能与物种、造模方式、处理时间等实验条件的不同相关,也可能与血液中的免疫细胞向感染部位的迁移有关。
TLRs/NF-κB通路的激活可以上调调控适应性免疫的促炎细胞因子和趋化因子的表达。活化TLR2可以促进炎症细胞因子的产生,如TNF-α、IL-1β、IL-6等,并影响树突细胞的成熟和抗原呈递,从而调节获得性免疫应答。本研究证实IOB LO7后生元可以上调CTX处理小鼠脾脏组织中TLR2和NFKB1 mRNA的相对水平,说明IOB LO7后生元可能通过激活TLR2/NF-κB通路促进炎症因子的释放激活免疫。
肠道屏障是一个复杂而动态的系统,对于维持胃肠道健康至关重要。杯状细胞产生的黏蛋白覆盖在上皮层之上,是肠道黏膜屏障的关键组成部分。有研究表明干酪乳酪杆菌NCU011054能够显著增加免疫低下小鼠结肠组织中MUC2的mRNA表达,从而保护肠道屏障[5]。罗青等[27]发现枸杞粉能够显著增加免疫低下小鼠结肠组织中MUC2 mRNA的表达量,保护宿主免于在细菌攻击时发生暴露。本研究证实IOB LO7后生元可以促进黏蛋白基因的表达,维持肠道黏膜屏障,有助于维持肠道黏膜免疫功能。
综上所述,本研究证实动物双歧杆菌乳亚种IOB LO7后生元能够促进RAW264.7细胞释放NO及炎症因子,促进脾淋巴细胞增殖,并且能缓解CTX引起的免疫抑制现象,其机制与恢复T淋巴细胞亚群、激活TLR2/NF-κB通路及修复肠道黏膜屏障相关,其中后生元高剂量组在脾脏指数、改善黏膜免疫等部分检测指标中优于低剂量组,这些研究为开发双歧杆菌后生元为免疫调节剂提供参考。
[1] 张娟,陈坚.益生菌功能开发及其应用性能强化[J].科学通报,2019,64(3):246-259.ZHANG J,CHEN J.Functional development and performance enhancement of probiotics[J].Chinese Science Bulletin,2019,64(3):246-259.
[2] LEE A,LEE Y J,YOO H J,et al.Consumption of dairy yogurt containing Lactobacillus paracasei ssp.paracasei,Bifidobacterium animalis ssp.lactis and heat-treated Lactobacillus plantarum improves immune function including natural killer cell activity[J].Nutrients,2017,9(6):558.
[3] MILLER L E,LEHTORANTA L,LEHTINEN M J.The effect of Bifidobacterium animalis ssp.lactis HN019 on cellular immune function in healthy elderly subjects:Systematic review and Meta-analysis[J].Nutrients,2017,9(3):191.
[4] LI Y R,ARAI S,KATO K,et al.The potential immunomodulatory effect of Bifidobacterium longum subsp.longum BB536 on healthy adults through plasmacytoid dendritic cell activation in the peripheral blood[J].Nutrients,2024,16(1):42.
[5] MIN F F,HU J L,HUANG T,et al.Effects of Lactobacillus casei NCU011054 on immune response and gut microbiota of cyclophosphamide induced immunosuppression mice[J].Food and Chemical Toxicology,2023,174:113662.
[6] XUE L Y,LI Z Q,XUE J B,et al.Lactobacillus acidophilus LA85 ameliorates cyclophosphamide-induced immunosuppression by modulating Notch and TLR4/NF-κB signal pathways and remodeling the gut microbiota[J].Food &Function,2022,13(15):8107-8118.
[7] SALVA S,MARRANZINO G,VILLENA J,et al.Probiotic Lactobacillus strains protect against myelosuppression and immunosuppression in cyclophosphamide-treated mice[J].International Immunopharmacology,2014,22(1):209-221.
[8] 王增博,刘铭洋,刘飞,等.动物双歧杆菌乳亚种XLTG11对免疫抑制小鼠免疫功能及肠道菌群的影响[J].食品科学,2024,45(15):103-111.WANG Z B,LIU M Y,LIU F,et al.Effect of Bifidobacterium animalis subsp.lactis XLTG11 on immune function and intestinal flora in cyclophosphamide-immunosuppressed mice[J].Food Science,2024,45(15):103-111.
[9] JEONG M,KIM J H,YANG H E,et al.Heat-killed Lactobacillus plantarum KCTC 13314BP enhances phagocytic activity and immunomodulatory effects via activation of MAPK and STAT3 pathways[J].Journal of Microbiology and Biotechnology,2019,29(8):1248-1254.
[10] KIM S,LEE H H,CHOI W,et al.Anti-tumor effect of heat-killed Bifidobacterium bifidum on human gastric cancer through Akt-p53-dependent mitochondrial apoptosis in xenograft models[J].International Journal of Molecular Sciences,2022,23(17):9788.
[11] MAKIOKA Y,TSUKAHARA T,IJICHI T,et al.Oral supplementation of Bifidobacterium longum strain BR-108 alters cecal microbiota by stimulating gut immune system in mice irrespectively of viability[J].Bioscience,Biotechnology,and Biochemistry,2018,82(7):1180-1187.
[12] HILL C,GUARNER F,REID G,et al.The international scientific association for probiotics and prebiotics consensus statement on the scope and appropriate use of the term probiotic[J].Nature Reviews Gastroenterology &Hepatology,2014,11(8):506-514.
[13] 李杨,周湘人,郭薇丹,等.后生元的研究进展[J].食品安全质量检测学报,2021,12(16):6558-6564.LI Y,ZHOU X R,GUO W D,et al.Research progress of postbiotics[J].Journal of Food Safety &Quality,2021,12(16):6558-6564.
[14] 肖灵,唐琳琳,宋晓妍,等.后生元调节肠道微生态及减少脑内Aβ沉积改善AD大鼠的认知障碍[J/OL].食品科学,2024:1-15.(2024-11-06).https://kns.cnki.net/kcms/detail/11.2206.ts.20241105.1344.042.html.XIAO L,TANG L L,SONG X Y,et al.Postbiotics regulate intestinal microbiota and reduce Aβ deposition in the brain to improve cognitive impairment in AD rats[J/OL].Food Science,2024:1-15.(2024-11-06).https://kns.cnki.net/kcms/detail/11.2206.ts.20241105.1344.042.html.
[15] 张艳艳,孙丽丽,潘绵立,等.益神颗粒对环磷酰胺免疫抑制小鼠免疫功能及肠道菌群的影响[J].中成药,2023,45(2):603-608.ZHANG Y Y,SUN L L,PAN M L,et al.Effect of Yishen Granule on immune function and intestinal flora of cyclophosphamide immunosuppressed mice[J].Chinese Traditional Patent Medicine,2023,45(2):603-608.
[16] 田艳,刘青青,田海霞,等.益生菌缓解环磷酰胺所致小鼠免疫功能低下[J].中国免疫学杂志,2020,36(15):1805-1808.TIAN Y,LIU Q Q,TIAN H X,et al.Probiotics alleviate immunosuppression induced by cyclophosphamide in mice[J].Chinese Journal of Immunology,2020,36(15):1805-1808.
[17] PARK C,JI S Y,HWANGBO H,et al.Enhancement of immune functions by Limosilactobacillus reuteri KBL346:In vitro and in vivo studies[J].International Journal of Molecular Sciences,2024,25(1):141.
[18] 李艾黎,马冬雪,孟祥晨,等.乳杆菌对小鼠脾脏淋巴细胞增殖的影响[J].食品科学,2010,31(15):253-256.LI A L,MA D X,MENG X C,et al.Effect of seven lactobacilli strains on the proliferation of mouse spleen lymphocytes in vitro[J].Food Science,2010,31(15):253-256.
[19] SHA J Y,CHEN K C,LIU Z B,et al.Ginseng-DF ameliorates intestinal mucosal barrier injury and enhances immunity in immunosuppressed mice by regulating MAPK/NF-κB signaling pathways[J].European Journal of Nutrition,2024,63(5):1487-1500.
[20] AL-NAJJAR M A A,ABDULRAZZAQ S B,ALZAGHARI L F,et al.Evaluation of immunomodulatory potential of probiotic conditioned medium on murine macrophages[J].Scientific Reports,2024,14:7126.
[21] 杨许花,郭星晨,陈红,等.柳茶多糖对环磷酰胺诱导的免疫抑制小鼠的免疫调节及抗炎作用[J].动物营养学报,2023,35(3):2018-2029.YANG X H,GUO X C,CHEN H,et al.Immune regulation and anti-inflammatory effect of Sibiraea angustata polysaccharides on immunosuppressed mice induced by cyclophosphamide[J].Chinese Journal of Animal Nutrition,2023,35(3):2018-2029.
[22] WANG Y L,NI W.Rosmarinic acid improves cyclophosphamide-induced immunosuppression in mice by immunomodulatory and antioxidant effects[J].Food Bioscience,2023,56:103152.
[23] KIM S,LEE H H,KANG C H,et al.Immune-enhancing effects of Limosilactobacillus fermentum in BALB/c mice immunosuppressed by cyclophosphamide[J].Nutrients,2023,15(4):1038.
[24] 张凤丽,黄文琪,赵立娜.菌草灵芝醇提物对免疫损伤小鼠的改善作用[J].中国食品学报,2025,25(1):151-159.ZHANG F L,HUANG W Q,ZHAO L N.Ameliorative effect of alcoholic extracts of the Juncao Ganoderma lucidum on immunologically impaired mice[J].Journal of Chinese Institute of Food Science and Technology,2025,25(1):151-159.
[25] 石峻岭,孙宇立,郑志清,等.人参果汁浓缩液对环磷酰胺诱导免疫抑制小鼠免疫功能的影响[J].中国食品卫生杂志,2024,36(4):377-382.SHI J L,SUN Y L,ZHENG Z Q,et al.Effects of Panax ginseng fructus juice concentrate on immune injury induced by cyclophosphamide in mice[J].Chinese Journal of Food Hygiene,2024,36(4):377-382.
[26] 李月,潘月,冷玥,等.改善免疫抑制小鼠免疫功能的益生菌筛选及其效果研究[J].食品工业科技,2025,46(19):378-387.LI Y,PAN Y,LENG Y,et al.Research on the screening and effects of probiotics for improving the immune function of immunosuppressed mice[J].Science and Technology of Food Industry,2025,46(19):378-387.
[27] 罗青,禄璐,闫亚美,等.枸杞粉及其多糖对环磷酰胺致免疫低下小鼠免疫及肠道菌群的调节作用[J].食品科学,2022,43(11):137-148.LUO Q,LU L,YAN Y M,et al.Immunomodulatory effects of spray dried powder of goji (Lycium barbarum L.) and goji polysaccharides on immunosuppressive mice induced by cyclophosphamide and their regulation on gut microbiota[J].Food Science,2022,43(11):137-148.