肥胖作为全球性公共卫生问题,显著增加了糖尿病[1]、心血管疾病[2]及癌症[3]等多种慢性疾病的发病风险。最新研究成果揭示,肠道微生物群落的失衡与机体代谢稳态的破坏之间具有显著的相关性。针对肥胖人群的微生物组学分析发现,其消化道菌群呈现显著的分类单元丰度异常,具体体现为厚壁菌门(Firmicutes)与拟杆菌门(Bacteroidetes)之间的比例出现了病理性的失衡状态,这种菌群失调可通过增强膳食能量提取效率、促进脂肪储存及诱发慢性低度炎症等多途径加剧代谢紊乱[4-5]。
多酚作为一类具有生物活性的化合物,虽在人体内生物可利用性有限,却能调控肠道微生物群落结构,促使生成低分子质量的酚类代谢物,进而对宿主的免疫代谢产生作用[6]。奎宁酸(quinic acid,QA)是一种类黄酮类物质,主要存在于咖啡豆[7]、青蒿[8]、牛蒡[9]、忍冬[10]等植物中。而前期研究发现,QA也是小米等谷物中含量较高的多酚类化合物[11],其化学结构包含多个酚羟基,这些官能团赋予了QA较强的抗氧化活性。除了具备抗氧化特性之外,QA还展现出了明显的抗炎功效。研究表明,QA不仅能够抑制高脂饮食诱导的氧化应激和神经炎症,还可通过调节肠道微生物代谢产物(如吲哚-3-乙酸和犬尿酸)改善代谢紊乱[12]。值得注意的是,QA是微生物莽草酸代谢途径中的初始物质之一,它能在奎宁酸脱氢酶(quinate dehydrogenase,QDH)及莽草酸脱氢酶(shikimate dehydrogenase,SDH)等一系列酶的连续催化下,逐步转变成莽草酸。
体外模拟发酵技术为解析膳食成分-菌群互作提供了有效手段。例如,乳酸菌发酵处理显著提升小米中总酚含量,同时促进拟杆菌门等有益菌增殖[13]。值得注意的是,发酵过程中pH与OD600的动态变化可作为微生物代谢活性的重要指标[14]。然而,目前关于小米多酚中QA对肥胖相关菌群的具体作用机制仍缺乏系统性研究,特别是体外发酵模型中代谢动态与菌群响应的关联性尚未阐明。基于此,本研究计划构建肥胖人群肠道菌群的体外发酵体系,利用16S rRNA基因测序技术探究菌群结构的动态变化,结合实时监测pH、OD600等发酵动力学参数,阐明QA干预下菌群代谢活性与群落构建的关联机制。同时,采用HPLC定量分析QA代谢物莽草酸的生成动态,揭示QA代谢转化对菌群调控的作用路径。该研究可为开发靶向肠道微生态的小米功能食品提供理论依据。
1 材料与方法
1.1 材料与试剂
QA和莽草酸标准品,上海源叶生物科技有限公司;莽草酸,国药集团化学试剂有限公司;FastPure 粪便基因组DNA快速提取试剂盒,上海美吉医药科技有限公司;FastPfu 高保真聚合酶系统,北京全式金生物技术有限公司;DNA凝胶回收纯化试剂盒,中国逾华生物技术有限公司。实验样本采集自上海理工大学健康科学与工程学院招募的10名肥胖志愿者,所有参与者均签署知情同意书并完成伦理审查程序。
1.2 设备与仪器
NanoDrop 2000超微量分光光度计、Qubit 4.0荧光定量仪、冷冻高速离心机,美国Thermo Scientific公司;T100 Thermal Cycler,美国BIO-RAD公司;JY600C双稳定时电泳仪,北京君意东方电泳设备有限公司;FE20型 pH 计、ME204E 电子天平,梅特勒-托利多仪器(上海)有限公司;厌氧工作站,上海龙跃仪器设备有限公司;Milli-Q 超纯水设备,德国默克公司; Essentia LC-16液相色谱仪,日本岛津公司;SCIENTZ-10N 低温冷冻干燥机,宁波新芝生物科技股份有限公司;高压蒸汽灭菌锅,上海申安医疗器械有限公司;Synergy HTX 多功能酶标仪,美国Berten。
1.3 实验方法
1.3.1 肥胖人群粪便体外发酵
碳酸盐-磷酸盐缓冲溶液的制备参照CHEN等[15]的方法,并稍作调整。精确称量以下试剂(g/L):NaHCO3 2.00,Na2HPO4 3.542,NaCl 0.470,KCl 0.450,尿素0.400,CaCl2·2H2O 0.072 8,Na2SO4 0.227,MgCl2·6H2O 0.100,加入1 mg/L刃天青和10.0 mL/L微量元素溶液。微量元素溶液(g/L):FeSO4·7H2O 3.68,MnSO4·H2O 1.159,ZnSO4·7H2O 0.440,CoCl2·6H2O 0.12,CuSO4·5H2O 0.098,Mo7(NH4)6O2·4H2O 0.017 4。调节缓冲溶液的pH值至7.00,121 ℃高压蒸汽灭菌20 min。
样本采集与预处理:选取经伦理委员会审批的10例肥胖受试者(体质指数>30),采集新鲜粪便样本。按质量体积比1∶20(g∶mL)将样本与缓冲液混合,经4层灭菌纱布梯度过滤后,滤液转移至预充体积比为90% N2、5% CO2、5% H2混合气体的厌氧发酵装置中。
体外发酵模型构建:取预处理菌悬液4 mL与缓冲基质16 mL(碳酸盐-磷酸盐缓冲体系,pH 7.0)于50 mL发酵容器中构建混合体系。实验设置两组平行体系:对照组(C组)、奎宁酸组(Q组),其中Q组添加QA至终质量浓度2 mg/mL,C组维持等体积无菌生理盐水。分别在0、6、12、24 h测量发酵液的OD600与pH,同时在发酵24 h后取2 mL样品10 000×g离心10 min,收集沉淀进行微生物分析,收集剩余发酵液进行后续分析。
1.3.2 样品总DNA提取和PCR扩增
根据FastPure粪便基因组DNA快速提取试剂盒说明书进行微生物群落总基因组DNA抽提,采用1%琼脂糖凝胶电泳技术对纯化后的基因组DNA进行质量评价。使用超微量分光光度计测定DNA浓度和纯度。以上述提取的DNA为模板,使用携带Barcode序列的上游引物338F (5′-ACTCCTACGGGAGGCAGCAG-3′)和下游引物806R(5′-GGACTACHVGGGTWTCTAAT-3′)对16S rRNA基因V3-V4可变区进行PCR扩增,PCR反应体系为:5×TransStart FastPfu缓冲液4 μL,2.5 mmol/L 4种脱氧核苷酸混合物2 μL,上游引物(5 μmol/L)0.8 μL,下游引物(5 μmol/L)0.8 μL,TransStart FastPfu DNA聚合酶0.4 μL,模板DNA 10 ng,补足至20 μL。采用三步法热循环方案:初始变性阶段(95 ℃维持3 min)确保DNA模板充分解链,随后进行27个热循环周期,每个周期包含热变性(95 ℃持续30 s)、引物退火(55 ℃、30 s促进特异性结合)及链延伸(72 ℃、30 s完成核苷酸聚合)。终延伸阶段72 ℃持续10 min确保产物完整性,终产物4 ℃低温保存直至后续分析。整个实验过程中的扩增反应在PCR仪上进行。使用2%琼脂糖凝胶回收PCR产物,利用DNA凝胶回收纯化试剂盒进行回收产物纯化,并用荧光定量仪对回收产物进行检测定量。
1.3.3 构建PE文库及Illumina测序
使用NEXTFLEX Rapid DNA-Seq Kit对纯化后的PCR产物进行建库,实验流程包括:对纯化扩增产物进行末端修复及接头连接,通过磁珠筛选去除游离接头片段,利用引物特异性PCR扩增(12个循环)实现文库富集,最终经磁珠纯化系统回收目标片段。测序工作由上海美吉生物医药科技有限公司完成,使用Illumina NextSeq2000高通量测序平台进行双端150 bp读长测序。
1.3.4 酶活力检测
QDH活性测定:取体外发酵菌悬液经超声破碎处理后,于4 ℃条件下12 000×g离心10 min,收集上清液进行蛋白定量分析。采用牛血清白蛋白(bovine serum albumin,BSA)作为标准蛋白,通过Bradford比色法测定样本蛋白含量。0.2 mol/L甘氨酸缓冲液(pH 10)中加入底物QA 10 mmol/L,NAD+ 2 mmol/L,反应体系于30 ℃恒温水浴中进行,在340 nm特征波长下监测NAD(P)H生成量,根据蛋白浓度和摩尔消光系数εNAD(P)H=6 220 L/(mol·cm)计算酶活力。
SDH活性测定:取体外发酵菌悬液经超声破碎处理后,4 ℃、12 000×g离心10 min,收集上清液进行蛋白定量分析。采用BSA作为标准蛋白,通过Bradford比色法测定样本蛋白含量。0.2 mol/L甘氨酸缓冲液(pH 10)中加入底物莽草酸 10 mmol/L,NAD+ 2 mmol/L,反应体系于30 ℃恒温水浴中进行,在340 nm特征波长下监测NAD(P)H生成量,根据蛋白浓度和摩尔消光系数εNAD(P)H=6 220 L/(mol·cm)计算酶活力。
1.3.5 莽草酸定量分析
分别将不同发酵时间段的发酵液进行快速冷却并冷冻干燥。冻干后用V(甲醇)∶V(0.1%磷酸水溶液)=1∶9溶解并离心(12 000×g,10 min)取上清液,使用0.22 μm过滤膜对上清液进行过滤。采用液相色谱仪分析莽草酸的浓度。流动相为V(甲醇)∶V(0.1%磷酸水溶液)=1∶9,流速0.5 mL/min,检测波长217 nm。色谱柱为C18(250 mm×4.6 mm,5 μm),洗脱为等度洗脱,柱温30 ℃,进样量20 μL。用上述条件对1、5、10、50、100、200 μg/mL的标品浓度进行标曲测定。
1.3.6 统计学分析
实验所得数据借助GraphPad Prism 8.0软件进行了图形化展示及统计学分析。在评估组间差异时,采用了单因素方差分析(即One-way ANOVA方法),并将显著性水平α设定为0.05。当经过校正后的P值低于这一预设的显著性阈值时,认为组间存在具有统计学意义的显著差异。
2 结果与分析
2.1 QA对发酵过程中pH值的影响
本研究通过体外模拟发酵实验,探究了小米多酚QA对肥胖人群肠道菌群的影响。实验结果如图1所示,通过对Q组和C组在不同发酵时间点的pH变化,可以观察到QA对发酵过程中发酵液pH值的影响。在所有肥胖受试者中Q组和C组的pH变化趋势相似,且Q组在发酵初期(0~6 h)pH值下降速度明显快于C组,这表明QA可能通过促进某些特定菌群的生长,加速了发酵过程中的代谢活动。同时可以看出微生物利用碳酸盐-磷酸盐缓冲液中的成分产生有机酸,导致环境酸化。在发酵中期(6~12 h),Q组pH值继续下降,但下降速度有所减缓。在发酵后期(12~24 h),Q组pH值趋于稳定。相关文献[16]所述,肠道菌群的代谢活性可通过pH值的变化来指示。研究指出,降低pH值有利于有益菌种的增殖,同时能抑制有害菌的扩散,进而对肠道微生态的平衡状态产生积极影响。此外,多酚类化合物能够通过调节肠道pH值,促进肠道菌群的多样性,进而改善肥胖相关代谢疾病[17]。本研究的结果与上述文献报道一致,进一步证实了QA在调节肠道菌群方面的潜在作用。
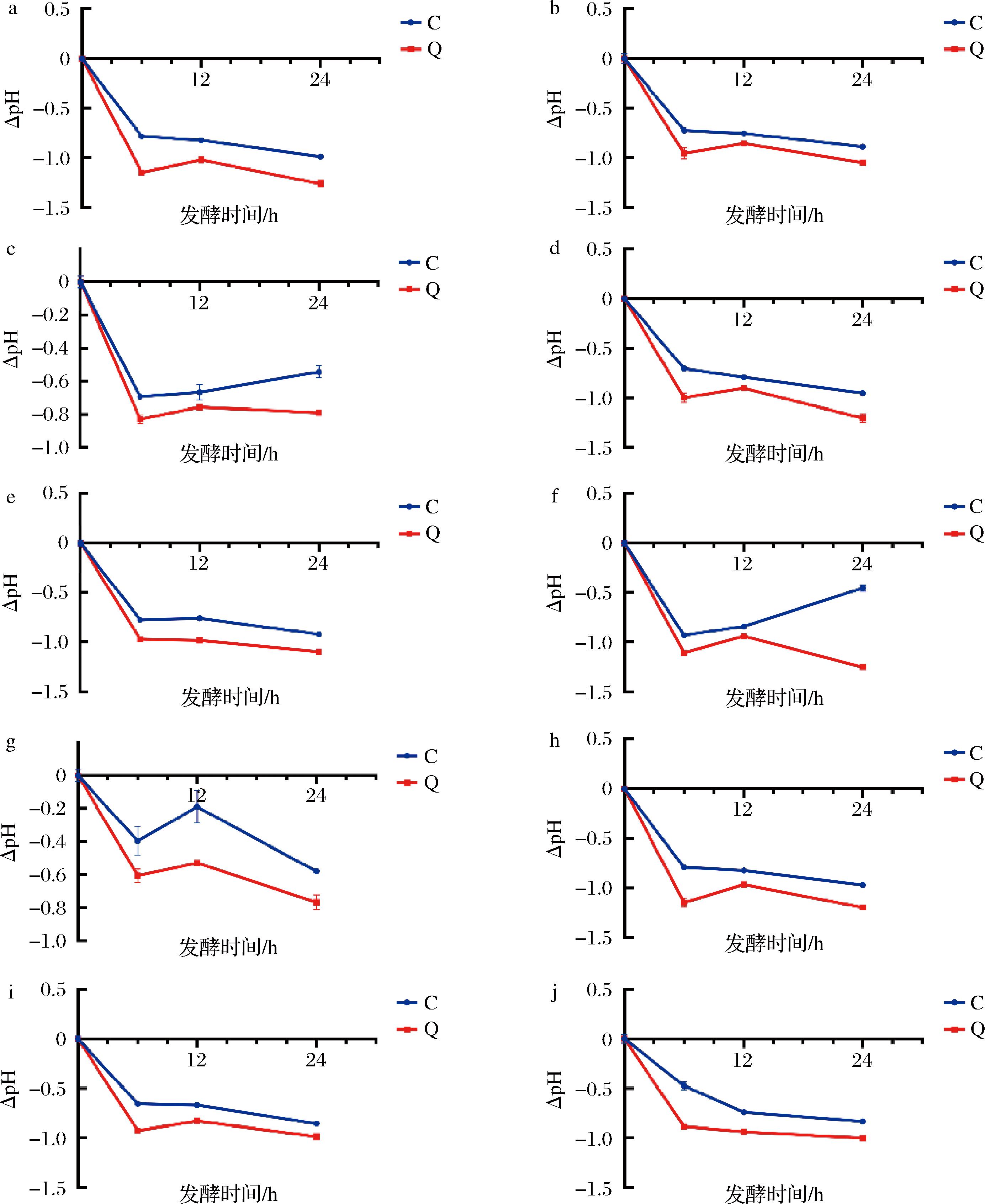
a-1号受试者;b-2号受试者;c-3号受试者;d-4号受试者;e-5号受试者;f-6号受试者;g-7号受试者;h-8号受试者;i-9号受试者;j-10号受试者
图1 pH值变化
Fig.1 Change in pH
2.2 QA对发酵过程中OD600的影响
OD600值是衡量菌群生长情况的重要指标,其变化趋势能够反映菌群在不同条件下的生长活性。如图2所示,Q组在加入QA后,OD600值的变化趋势与C组存在显著差异。在发酵初期(0~6 h),两组的OD600值显著下降,表明目前肠道菌群的生长处于抑制阶段。随着发酵时间的延长(12~24 h),Q组的OD600值逐渐上升,并在24 h时接近甚至超过C组。这表明QA在后期对肠道菌群的生长具有促进作用,可能通过调节菌群代谢途径,促进有益菌的生长。这一发现与多酚调节肠道菌群代谢产物,促进有益菌生长,从而维护肠道健康的观点相一致[18-20]。但值得注意的是不同肥胖受试者粪便发酵液OD600值的变化具有差异。
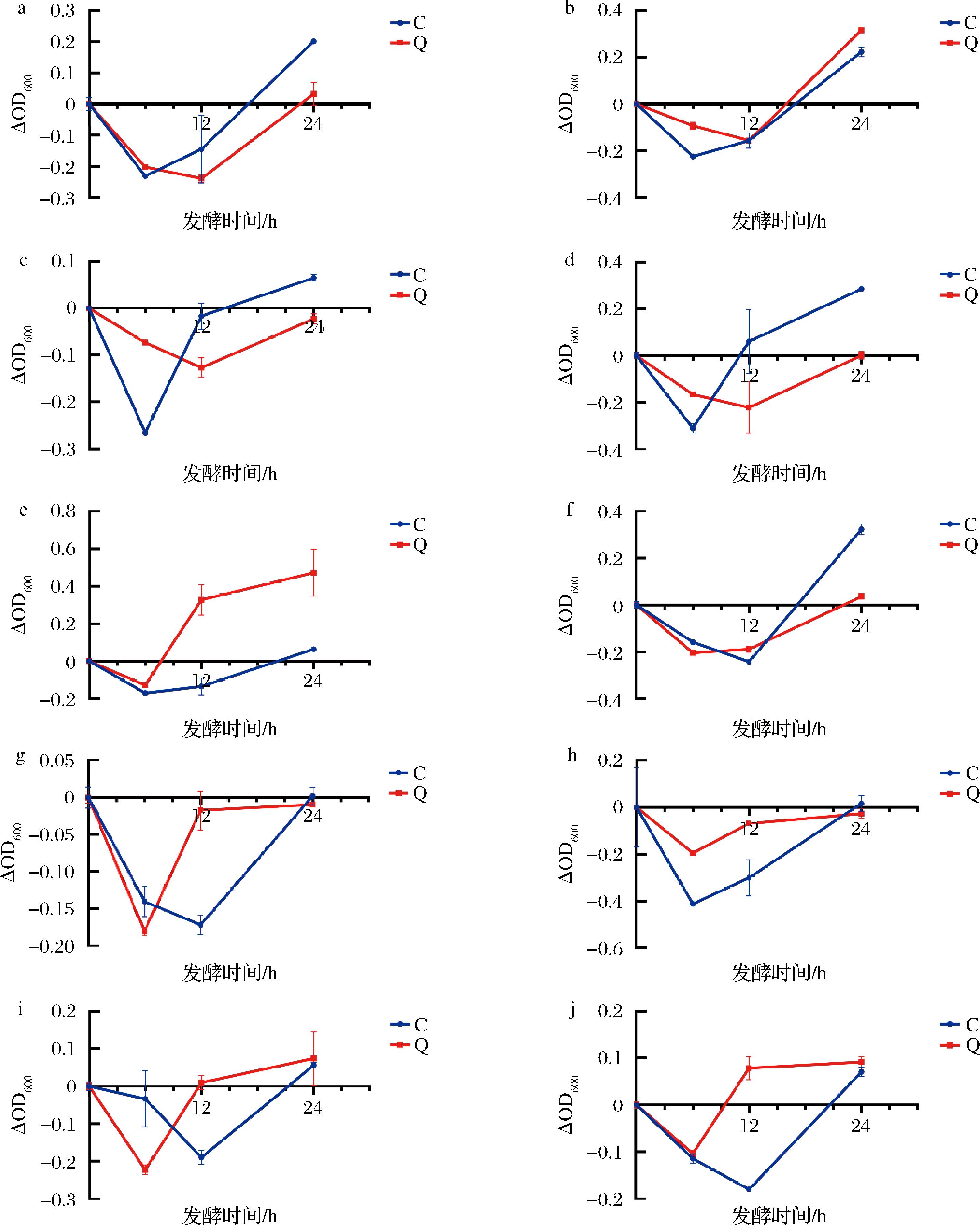
a-1号受试者;b-2号受试者;c-3号受试者;d-4号受试者;e-5号受试者;f-6号受试者;g-7号受试者;h-8号受试者;i-9号受试者;j-10号受试者
图2 OD600变化
Fig.2 Change in OD600
2.3 QA干预下肥胖人群肠道微生物生态总体组成情况
为了探讨QA干预下体外发酵后肥胖人群的肠道菌群总体组成情况,用Shannon指数、Chao指数、Ace指数和Simpson指数来比较C组和Q组肠道菌群的α多样性(图3-a~图3-d)。通过16S rRNA测序发现,在QA短期干预下,两组在物种丰富度和均匀度上没有明显区别。而图3-e~图3-f分别展示了基于扩增子序列变体(amplicon sequence variant,ASV)水平的Venn图和PCoA结果。Venn图显示,C组和Q组共有121个ASV,而各自独有的ASV数量分别为24和21,表明QA干预还是改变了肠道菌群的组成。PCoA结果进一步证实了这一点,Q组和C组在PC1和PC2上的分布明显有所分离,说明QA对肠道菌群结构产生了显著影响。

a-α多样性-Chao指数;b-α多样性-Ace指数;c-α多样性-Shannon指数;d-α多样性-Simpson指数;e-Venn图;f-PCoA结果
图3 QA干预对肠道微生物群结构和组成的变化
Fig.3 Changes in the structure and composition of the intestinal microbiota by QA intervention
图4展示了QA干预后在门水平上的肠道菌群组成变化。微生物群落结构分析表明,厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)和变形菌门(Proteobacteria)在Q组与C组中构成优势菌群,其累积相对丰度显著高于其他分类单元。其中,Firmicutes和Bacteroidetes的相对丰度变化尤为明显(图4-a),这一结果与GAO等[21]的研究一致,他们发现多酚类化合物能够显著调节肠道菌群的组成,特别是对Firmicutes和Bacteroidetes的影响。此外,Firmicutes的相对丰度在QA干预后显著降低(图4-b),且F/B比值在QA干预后也显著降低(图4-c)。而F/B值是评价肠道菌群平衡的重要指标,其降低表明肠道菌群的平衡状态得到了改善[22]。这表明QA可能通过调节肠道菌群的组成来影响肥胖人群的代谢状态。通过图4-d~图4-e发现,Proteobacteria和放线菌门(Actinobacteria)的相对丰度显著降低,由于Proteobacteria中包含多种与肠道炎症密切相关的条件致病菌(如大肠杆菌、沙门氏菌等),因此该结果表明,QA可能通过特异性降低变形菌门的相对丰度来减轻肠道炎症反应,进而改善肥胖人群的肠道微生态平衡。值得注意的是,观察到与多数体内研究普遍揭示的Firmicutes和Bacteroidetes作为主要细菌门类不同,Proteobacteria在体外发酵实验体系中占据了最高比例。推测,这一显著差异可能源于体外缺乏宿主免疫调节、肠道蠕动和胆汁酸等生理条件,改变了菌群竞争关系,且体外发酵可能诱导氧化应激,而Proteobacteria在应激条件下易过度生长[23]。
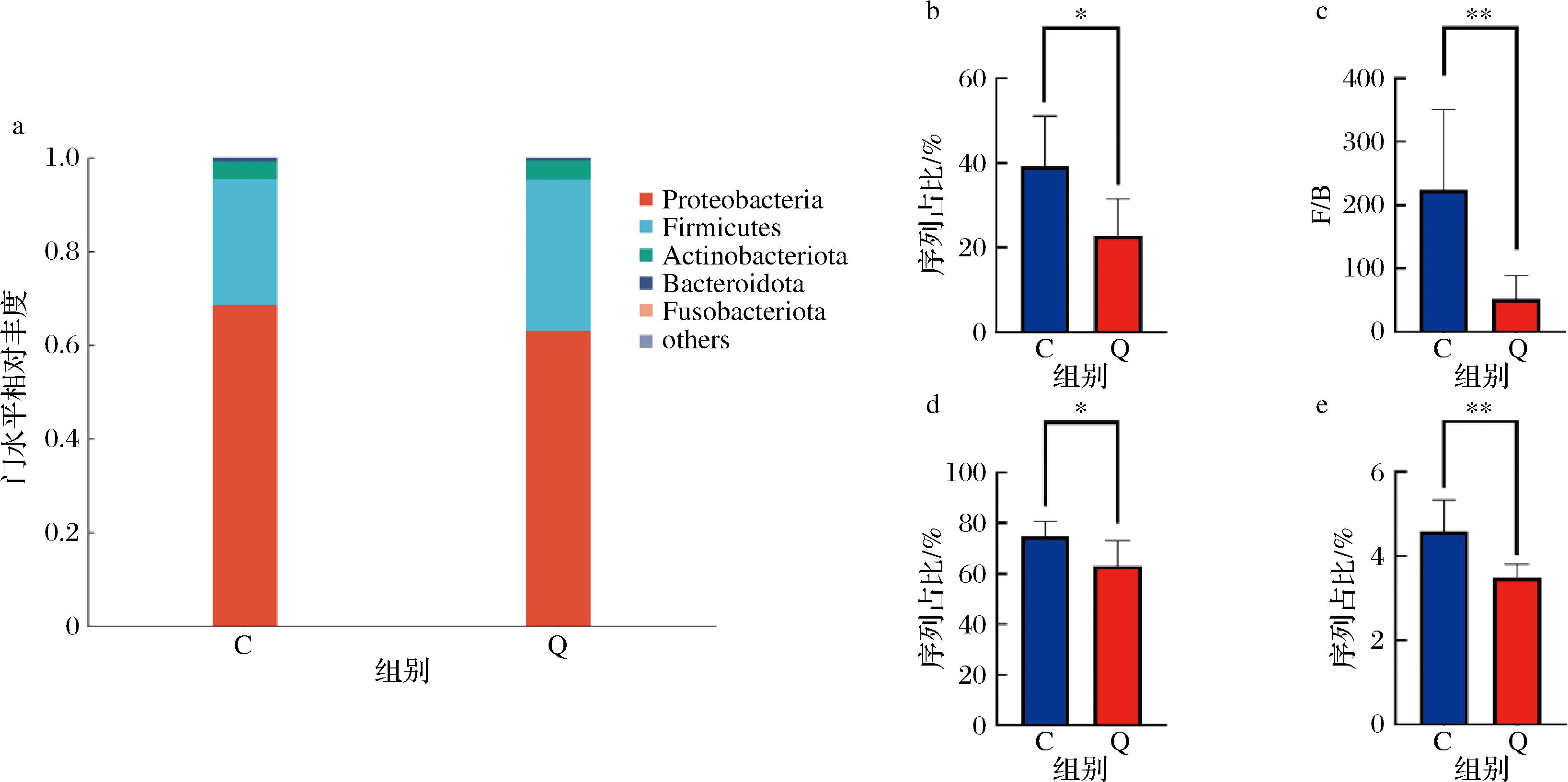
a-门水平上的群落条形图分析;b-厚壁菌门的差异;c-F/B比值 (厚壁菌门与拟杆菌门的比值);d-变形菌门的差异;e-放线菌门的差异
图4 QA干预后在门水平上的肠道菌群组成
Fig.4 Composition of intestinal flora at the phyluml level after QA intervention
注:*表示P<0.05,**表示P<0.01,***表示P<0.001。
2.4 差异种属筛选
通过进一步分析属水平组成变化,发现QA干预显著改变了肥胖人群肠道菌群的属水平组成(图5-a),具体改变为:赖氨酸芽胞杆菌属(Lysinibacillus)和经黏液真杆菌属(Blautia)的相对丰度显著增加,而志贺氏菌属(Shigella Castellani)的相对丰度显著降低。而在热图分析中发现,Q组中魏斯氏菌属(Weissella)、假单胞菌属(Pseudomonas)和Lysinibacillus呈现显著富集趋势(图5-b)。这些菌属的丰度变化可能与其对QA的代谢适应性及功能调控相关,由于QA在体内具有较低的生物利用度,主要依赖肠道微生物群发挥效用[24]。Weissella作为发酵食品中的常见乳酸菌,不仅能够优化发酵工艺和提升食品品质,还具有益生特性,能够通过合成葡聚糖、果聚糖等益生元,促进人体肠道中益生菌的生长和繁殖,进而增强人体消化功能[25]。Blautia作为产丁酸菌属,它的增加可强化肠道屏障功能,减少内毒素易位,抑制脂肪细胞分化[26]。因此,通过属水平差异和热图分析显示,QA干预通过调控特定菌属的丰度及其代谢功能,改善肥胖相关肠道菌群失调。此外,通过物种差异分析发现(图5-c~图5-d),棒状杆菌属[27](Corynebacterium)和芽孢杆菌属[28](Bacillus)在Q组也显著富集,而这些菌属可通过QDH和SDH介导的代谢途径合成莽草酸。
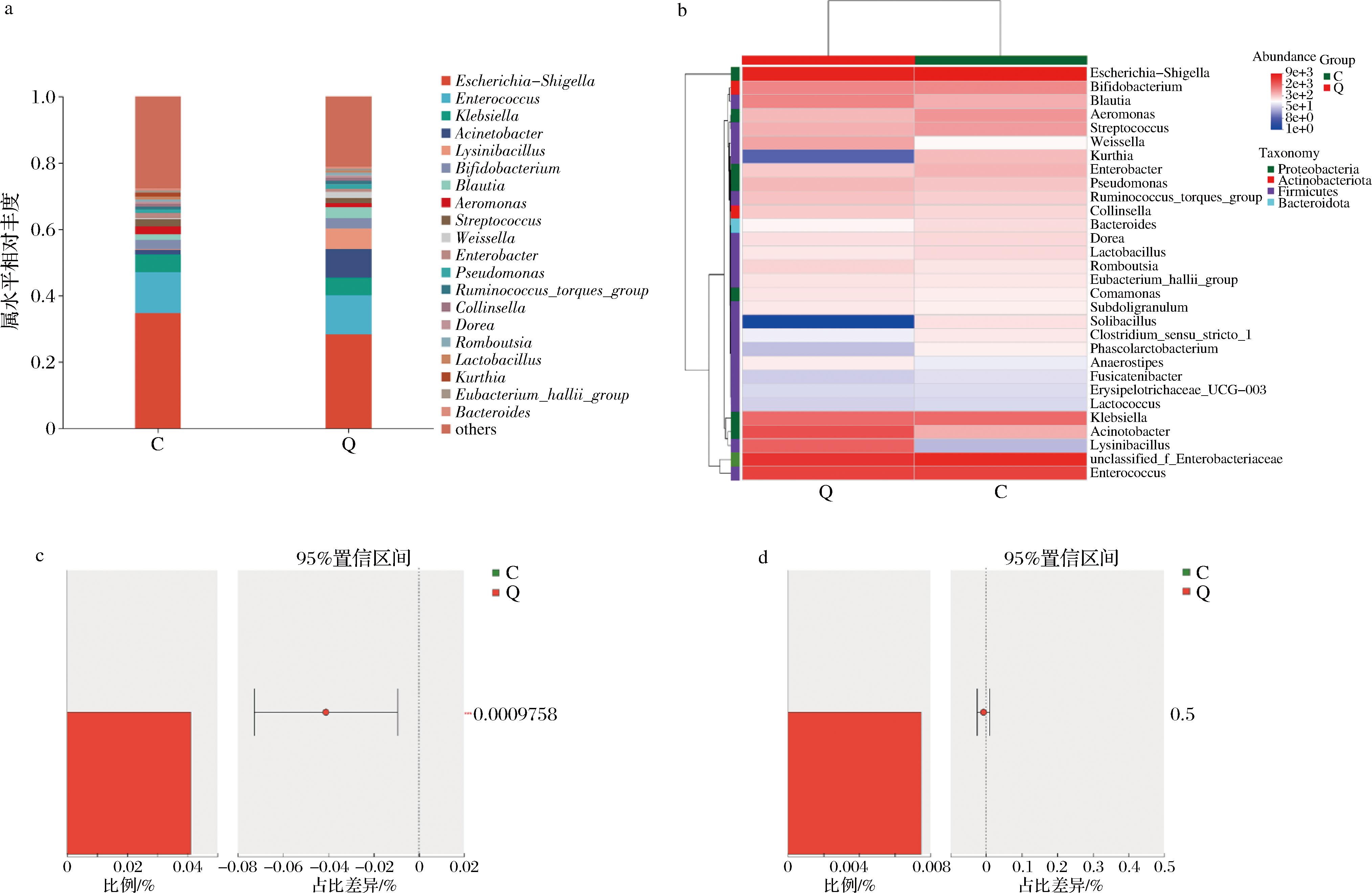
a-属水平上的群落条形图分析;b-群落热图;c-Bacillus物种差异;d-Corynebacterium物种差异
图5 QA体干预后在属水平上的肠道菌群组成
Fig.5 Intestinal flora composition at the genus level after QA intervention
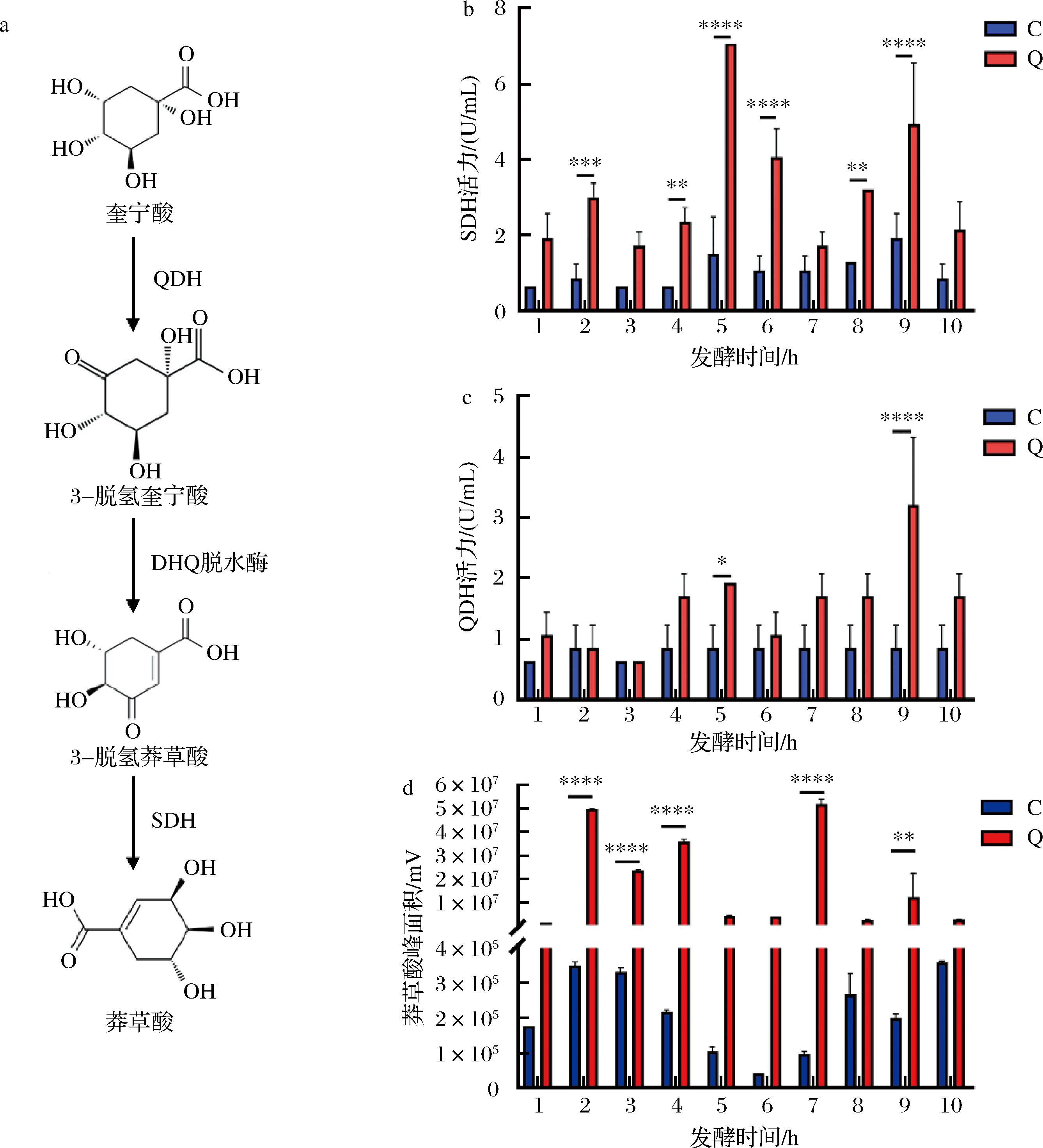
a-QA转化为莽草酸的代谢途径;b-SDH活力;c-QDH活力;d-莽草酸峰值
图6 QA体外发酵24 h后关键酶活力和莽草酸含量变化
Fig.6 Changes in key enzyme activity and shikimic acid content after 24 h in vitro fermentation of quinic acid
注:*表示P<0.05,**表示P<0.01,***表示P<0.001,****表示P<0.000 1。
2.5 QA代谢物检测
部分微生物体内存在独特的奎宁酸转化途径(图6-a):奎宁酸在QDH的催化作用下生成3-脱氢奎宁酸,后者进入莽草酸代谢途径,最终在SDH作用下生成莽草酸。因此根据以上结果,进一步检测了发酵液中的QDH和SDH酶活力以及莽草酸的含量(图6-b),结果均表明QA干预显著提高了多数肥胖受试者发酵液中QDH和SDH的酶活性,并促进了莽草酸含量的提升。基于肠道菌群相关性热图分析发现,QDH和SDH与特定菌群丰度呈现显著相关性(图7)。例如,QDH与unclassified_k__norank_d__Bacteria和unclassified_f__Lachnospiraceae呈正相关,而SDH与Weissella丰度呈负相关。这一结果表明,QA代谢相关酶可能通过改变菌群互作网络影响肠道微环境。

图7 肠道菌群相关性热图分析
Fig.7 Heat map analysis of intestinal flora correlations
3 结论
QA及其衍生物(如咖啡酰奎宁酸、二咖啡酰奎宁酸等)在调控肠道菌群结构方面显示出多方面的作用。动物实验显示,超过70%的口服酰基奎宁酸在结肠中被菌群代谢,生成咖啡酸、没食子酸等活性物质,进一步通过调节菌群功能影响宿主免疫和代谢[24]。其中,绿原酸在结肠中被代谢为咖啡酸和QA衍生物等,这些代谢物促进双歧杆菌和乳酸杆菌的生长,而双歧杆菌的增殖与宿主抗炎、抗氧化能力的增强相关。也有研究表明,QA显著提高了高脂饮食小鼠的肠道菌群Shannon指数并降低了F/B比值,提示其通过调节能量代谢相关菌群改善肥胖;同时,QA干预显著增加阿克曼氏菌属(Akkermansia)丰度,并降低柯林斯氏菌属(Colidextribacter)、罗斯氏菌属(Roseburia)、经黏液真杆菌属(Blautia)及毛螺菌科(Lachnospiraceae)等促炎或能量吸收相关菌属的丰度[12]。这些发现揭示了QA能够调控肥胖相关的菌群结构。肥胖人群粪便体外发酵结果显示,Q组在发酵初期pH值下降速率显著快于C组,表明QA加速了微生物代谢产酸过程;后期Q组OD600值回升,提示菌群增殖活性增强。QA显著降低了F/B值(P<0.05),并减少了Proteobacteria的丰度。属水平上,Lysinibacillus和Blautia丰度显著增加,而Shigella Castellani减少。Q组中QDH和SDH酶活性得到显著提升,同时促进莽草酸含量增加,且酶活性与特定菌属丰度呈显著相关性。
本研究阐明了QA调控肥胖相关肠道菌群的机制。QA加速初期酸化可能抑制有害菌(如变形菌门)增殖,同时促进产丁酸菌和益生菌的富集。F/B值降低进一步印证了QA改善肥胖人群菌群失衡的潜力。此外,QA通过激活QDH/SDH促进莽草酸生成,介导能量代谢调控,但具体分子机制需进一步验证。需指出,本研究仅基于短期体外模型,未来需结合动物实验验证QA的体内效用。
[1] PICHÉ M E,TCHERNOF A,DESPRÉS J P.Obesity phenotypes,diabetes,and cardiovascular diseases[J].Circulation Research,2020,126(11):1477-1500.
[2] POWELL-WILEY T M,POIRIER P,BURKE L E,et al.Obesity and cardiovascular disease:A scientific statement from the American heart association[J].Circulation,2021,143(21):e984-e1010.
[3] FRIEDENREICH C M,RYDER-BURBIDGE C,MCNEIL J.Physical activity,obesity and sedentary behavior in cancer etiology:Epidemiologic evidence and biologic mechanisms[J].Molecular Oncology,2021,15(3):790-800.
[4] LEY R E,B CKHED F,TURNBAUGH P,et al.Obesity alters gut microbial ecology[J].Proceedings of the National Academy of Sciences of the United States of America,2005,102(31):11070-11075.
CKHED F,TURNBAUGH P,et al.Obesity alters gut microbial ecology[J].Proceedings of the National Academy of Sciences of the United States of America,2005,102(31):11070-11075.
[5] B CKHED F,DING H,WANG T,et al.The gut microbiota as an environmental factor that regulates fat storage[J].Proceedings of the National Academy of Sciences of the United States of America,2004,101(44):15718-15723.
CKHED F,DING H,WANG T,et al.The gut microbiota as an environmental factor that regulates fat storage[J].Proceedings of the National Academy of Sciences of the United States of America,2004,101(44):15718-15723.
[6] MAN A W C,ZHOU Y W,XIA N,et al.Involvement of gut microbiota,microbial metabolites and interaction with polyphenol in host immunometabolism[J].Nutrients,2020,12(10):3054.
[7] MOON J K,SHIBAMOTO T.Formation of volatile chemicals from thermal degradation of less volatile coffee components:Quinic acid,caffeic acid,and chlorogenic acid[J].Journal of Agricultural and Food Chemistry,2010,58(9):5465-5470.
[8] EL-ASKARY H I,MOHAMED S S,EL-GOHARI H M A,et al.Quinic acid derivatives from Artemisia annua L.leaves;biological activities and seasonal variation[J].South African Journal of Botany,2020,128:200-208.
[9] CARLOTTO J,DA SILVA L M,DARTORA N,et al.Identification of a dicaffeoylquinic acid isomer from Arctium lappa with a potent anti-ulcer activity[J].Talanta,2015,135:50-57.
[10] XIONG J H,LI S C,WANG W J,et al.Screening and identification of the antibacterial bioactive compounds from Lonicera japonica Thunb.leaves[J].Food Chemistry,2013,138(1):327-333.
[11] 梁婷,陆奕成,刘彤,等.两种产地黄小米多酚的提取及其对神经细胞氧化损伤的保护作用[J].食品与发酵工业,2022,48(2):139-143.LIANG T,LU Y C,LIU T,et al.Polyphenols extraction from two kinds of origins of millet yellow and their protective effects on oxidative injury on nerve cells[J].Food and Fermentation Industries,2022,48(2):139-143.
[12] LI S,CAI Y W,GUAN T,et al.Quinic acid alleviates high-fat diet-induced neuroinflammation by inhibiting DR3/IKK/NF-κB signaling via gut microbial tryptophan metabolites[J].Gut Microbes,2024,16(1):2374608.
[13] JAN S,KUMAR K,YADAV A N,et al.Effect of diverse fermentation treatments on nutritional composition,bioactive components,and anti-nutritional factors of finger millet (Eleusine coracana L.)[J].Journal of Applied Biology &Biotechnology,2022:46-52.
[14] KUMARI D,CHANDRASEKARA A,SHAHIDI F.Bioaccessibility and antioxidant activities of finger millet food phenolics[J].Journal of Food Bioactives,2019:100-109.
[15] CHEN J D,ZHANG Y,GUAN X,et al.Characterization of saponins from differently colored quinoa cultivars and their in vitro gastrointestinal digestion and fermentation properties[J].Journal of Agricultural and Food Chemistry,2022,70(6):1810-1818.
[16] ATASOY M, LVAREZ ORD
LVAREZ ORD
 EZ A,CENIAN A,et al.Exploitation of microbial activities at low pH to enhance planetary health[J].FEMS Microbiology Reviews,2024,48(1):fuad062.
EZ A,CENIAN A,et al.Exploitation of microbial activities at low pH to enhance planetary health[J].FEMS Microbiology Reviews,2024,48(1):fuad062.
[17] RODR GUEZ-DAZA M C,DAOUST L,BOUTKRABT L,et al.Wild blueberry proanthocyanidins shape distinct gut microbiota profile and influence glucose homeostasis and intestinal phenotypes in high-fat high-sucrose fed mice[J].Scientific Reports,2020,10:2217.
GUEZ-DAZA M C,DAOUST L,BOUTKRABT L,et al.Wild blueberry proanthocyanidins shape distinct gut microbiota profile and influence glucose homeostasis and intestinal phenotypes in high-fat high-sucrose fed mice[J].Scientific Reports,2020,10:2217.
[18] KAWABATA K,YOSHIOKA Y,TERAO J.Role of intestinal microbiota in the bioavailability and physiological functions of dietary polyphenols[J].Molecules,2019,24(2):370.
[19] SARUBBO F,MORANTA D,TEJADA S,et al.Impact of gut microbiota in brain ageing:Polyphenols as beneficial modulators[J].Antioxidants,2023,12(4):812.
[20] ZHANG Y J,LI S,GAN R Y,et al.Impacts of gut bacteria on human health and diseases[J].International Journal of Molecular Sciences,2015,16(4):7493-7519.
[21] GAO N X,SHU C,WANG Y H,et al.Polyphenol components in black chokeberry (Aronia melanocarpa) as clinically proven diseases control factors:An overview[J].Food Science and Human Wellness,2024,13(3):1152-1167.
[22] OH Y J,NAM K,KIM Y,et al.Effect of a nutritionally balanced diet comprising whole grains and vegetables alone or in combination with probiotic supplementation on the gut microbiota[J].Preventive Nutrition and Food Science,2021,26(2):121-131.
[23] GUIRRO M,COSTA A,GUAL-GRAU A,et al.Effects from diet-induced gut microbiota dysbiosis and obesity can be ameliorated by fecal microbiota transplantation:A multiomics approach[J].PLoS One,2019,14(9):e0218143.
[24] CLIFFORD M,JAGANATH I B,LUDWIG I A,et al.Chlorogenic acids and the acyl-quinic acids:Discovery,biosynthesis,bioavailability and bioactivity[J].Natural Product Reports,2017,34(12):1391-1421.
[25] TEIXEIRA C G,FUSIEGER A,MILI O G L,et al.Weissella:An emerging bacterium with promising health benefits[J].Probiotics and Antimicrobial Proteins,2021,13(4):915-925.
O G L,et al.Weissella:An emerging bacterium with promising health benefits[J].Probiotics and Antimicrobial Proteins,2021,13(4):915-925.
[26] GARCIA-SERRANO A M,SKOUG C,AXLING U,et al.Butyrate-producing bacteria as probiotic supplement:Beneficial effects on metabolism and modulation of behaviour in an obesity mouse model[J].Beneficial Microbes,2024,16(1):109-124.
[27] SHENG Q,YI L X,ZHONG B,et al.Shikimic acid biosynthesis in microorganisms:Current status and future direction[J].Biotechnology Advances,2023,62:108073.
[28] 刘东风.产莽草酸枯草芽胞杆菌代谢工程改造及代谢流分析[D].合肥:中国科学技术大学,2014.LIU D F.Metabolic engineering modification and metabolic flow analysis of mangiferic acid-producing Bacillus subtilis[D].Hefei:University of Science and Technology of China,2014.