果蔬富含维生素、酚类物质和各种生物活性化合物,是人类重要的膳食营养资源[1]。植物基发酵功能饮料因其潜在的健康益处越来越受欢迎,逐渐成为饮料市场重要发展趋势。红枣中富含多种酚酸类物质,酚酸在乳酸菌发酵过程中发生的生物转化是影响果蔬发酵产品感官属性和营养功能的重要因素之一[2]。AKBARI等[3]利用混合植物乳杆菌固态发酵玉米麸皮,发现发酵后部分酚酸浓度增加,特别是阿魏酸和对香豆酸。与羟基苯甲酸衍生物相比,葡萄酒发酵过程中的羟基肉桂酸衍生物的含量变化缓慢,发酵结束后略高,且总酚酸的变化与总羟基苯甲酸衍生物的变化相似,并随发酵时间而上升[4]。在不同的果蔬基质及乳酸菌菌株发酵过程中,酚酸类化合物的变化存在明显差异。
大量研究表明,乳酸菌发酵可改善果蔬产品的风味,增加生物活性物质,从而增强其抗氧化特性[5]。WANG等[6]发现,西瓜籽汁发酵后自由基清除能力增强,并表现出典型的西瓜和葡萄酒香味。GUAN等[7]研究表明,桑葚汁发酵后保质期延长,风味和营养品质得到改善。然而,发酵过程中的一些生物和非生物转化也会影响乳酸菌的生长和代谢活动。MANTZOURANI等[8]发现,石榴汁发酵24 h后,酚类物质的含量比未发酵石榴汁增加了64.43%,其抗氧化活性增强。LI等[9]采用不同的乳酸菌发酵红枣汁,显著提高了其总酚含量和抗氧化能力。这一现象在很大程度上可归因于乳酸菌发酵促进了结合态酚酸向游离态酚酸的生物转化,提高了多酚的生物利用率[10]。然而,酚酸在发酵过程中的代谢错综复杂,不同浓度的酚酸可能会抑制或促进微生物的生长。STIVALA等[11]发现,0.4 g/L的反式咖啡酸或反式对香豆酸对Lactobacillus hilgardii 6F,Lactobacillus hilgardii X1B和Pediococcus pentosaceus 12p有更大的抑制作用。目前,报道的能介导和耐受酚酸生物转化的菌株主要有植物乳植杆菌、鼠李糖乳酪杆菌和干酪乳酪杆菌等[12]。
因此,为明确枣汁发酵过程中酚酸的变化规律及L.plantarum对酚酸的耐受性,本研究对L.plantarum发酵红枣汁过程中游离态酚酸含量进行动态分析。同时,借助体外酚酸胁迫,研究不同浓度的单一酚酸处理和协同酚酸处理对L.plantarum特性的影响,旨在为富含酚类物质的果蔬乳酸发酵功能食品的开发提供参考。
1 材料与方法
1.1 材料与试剂
灰枣,采自新疆尉犁;植物乳植杆菌(CICC 20022),中国工业微生物菌种保藏管理中心;没食子酸(gallic acid,GA)、原儿茶酸(protocatechuic acid,PA)、咖啡酸(caffeic acid,CA)、对香豆酸(p-coumaric acid,PCA)、绿原酸(chlorogenic acid,CGA)、肉桂酸(cinnamic acid,CNA)、对羟基苯甲酸(p-hydroxybenzoic acid,PHBA)和阿魏酸(ferulic acid,FA)标准品,上海源叶生物科技有限公司。
1.2 仪器与设备
1260 LC型液相色谱仪,安捷伦科技有限公司;Bioscreen C型全自动微生物生长曲线系统,芬兰Oy Growth Curves公司;Tecan Spark 20M型多功能微孔板读数仪,瑞士Tecan公司;Regulus 8100型高分辨场发射扫描电子显微镜(scanning electron microscope,SEM),日本日立公司。
1.3 实验方法
1.3.1 菌株活化
将保存在甘油中的L.plantarum(1 mL)接种到已灭菌的MRS液体培养基中(100 mL),放置恒温培养(37 ℃,48 h),活化培养2次。将混合物离心(6 000 r/min、4 ℃)15 min,收集菌种沉淀,无菌水洗涤沉淀物两次,制备成初始浓度为9.48 lg CFU/mL的悬浮液备用。
1.3.2 发酵枣汁制备
灰枣清洗后,于50 ℃烘干48 h后磨成粉,料液比为1∶4(g∶mL),按比例加入果胶酶和纤维素酶,于40 ℃恒温水浴4 h,然后灭酶(85 ℃,15 min),离心(4 ℃、3 000 r/min)10 min保留上清液即得到红枣清汁。用食品级的Na2CO3和饮用水将红枣汁的初始pH值和糖度分别调整到5.0和15 °Brix。发酵前,枣汁经高压灭菌(121 ℃,20 min)后放置室温,将L.plantarum以3%(体积分数,下同)接种量接种到已灭菌的枣汁中,37 ℃下培养48 h。所有的发酵都是以3份样本独立进行。
1.3.3 pH及生长曲线的测定
每隔0、12、24、36、48 h取样,采用pH计直接测定酸度。生长曲线采用全自动微生物生长曲线仪测定。
1.3.4 发酵枣汁中游离态酚酸的测定
将发酵0、12、24、36、48 h的枣汁样品各取10 mL于50 mL离心管中,加入30 mL体积分数为80%冰乙醇后超声波提取15 min,2 500 r/min离心10 min,留取上清液,残渣重复提取2次合并。将提取液于35 ℃旋转蒸发至50 mL,取其中25 mL置于烧杯,用6 mol/L HCl溶液调节pH值至2,然后加入等体积的乙酸乙酯溶液振荡提取后转入分液漏斗,重复提取5次。将合并的有机相旋转蒸发至干(35 ℃),注入10 mL 80%的甲醇溶液溶解,于35 ℃旋干,复溶于1 mL 80%甲醇溶液并过0.22 μm滤膜。使用HPLC系统测定红枣汁发酵过程中游离态酚酸的含量。色谱条件参考ZHANG等[13]的方法。
1.3.5 体外酚酸胁迫培养基的制备
向100 mL MRS肉汤中额外添加单一酚酸和混合酚酸分别至不同的质量浓度(0.5、1.0、1.5、2.0、2.5、5、10 g/L),以未加酚酸的MRS培养基作为对照组(CK)。单一酚酸为苯甲酸型酚酸PHBA和肉桂酸型酚酸FA,混合酚酸中PHBA和FA的质量比为1∶1。取1.3.1节的菌液1 mL添加到酚酸胁迫培养基中(100 mL),于37 ℃培养48 h。
1.3.5.1 活菌数测定
活菌数采用梯度稀释法测定,L.plantarum活菌数表示为lg CFU/mL。
1.3.5.2 细胞形态
使用SEM观察L.plantarum的形态结构。样品按照ZHANG等[13]的方法进行处理。根据细胞形态结果选取一种胁迫浓度进行后续实验。
1.3.5.3 细胞膜脂肪酸
根据细胞形态,选定2.5 g/mL的胁迫浓度收集各酚酸培养基菌体细胞。用无菌水离心洗涤菌泥(10 min,4 ℃,6 800 r/min)3次,称取菌泥0.5 g。向菌泥中加入1.5 mL甲醇钠(1 mol/L)的甲醇溶液并剧烈振荡反应1.5 min,之后置于4 ℃冰箱静置10 min。加入1 mL的正己烷溶液,振荡1 min,静置5 min,离心(5 min,4 ℃,10 000 r/min)后,吸取上层清液,用0.22 μm有机滤膜过滤至气相瓶内,进行脂肪酸含量的测定。GC-MS条件和膜脂肪酸的计算方法参考ZHANG等[14]的方法进行。
1.3.5.4 β-葡萄糖苷酶和H+-ATPase活性
β-葡萄糖苷酶和H+-ATPase的活性测定参考ZHANG等[13]的方法进行。
1.4 数据处理
使用SPSS 26.0软件进行方差分析(ANOVA),数据以“平均值±标准误差”表示;利用Origin 2021软件绘图。
2 结果与分析
2.1 pH及植物乳植杆菌在发酵枣汁中的生长曲线
如图1所示,在整个发酵过程中,红枣汁的pH值逐渐下降(P<0.05),从初始pH值4.84下降至发酵48 h时的3.63。发酵24 h后,pH值的降低速度逐渐缓慢。pH值的降低主要是由于乳酸菌发酵过程消耗糖类物质产生乳酸等酸类物质,导致酸度上升。这与蔡文超[15]研究结果一致,L.plantarum发酵红枣汁过程中pH不断下降,而发酵28 h后pH下降趋势变慢。
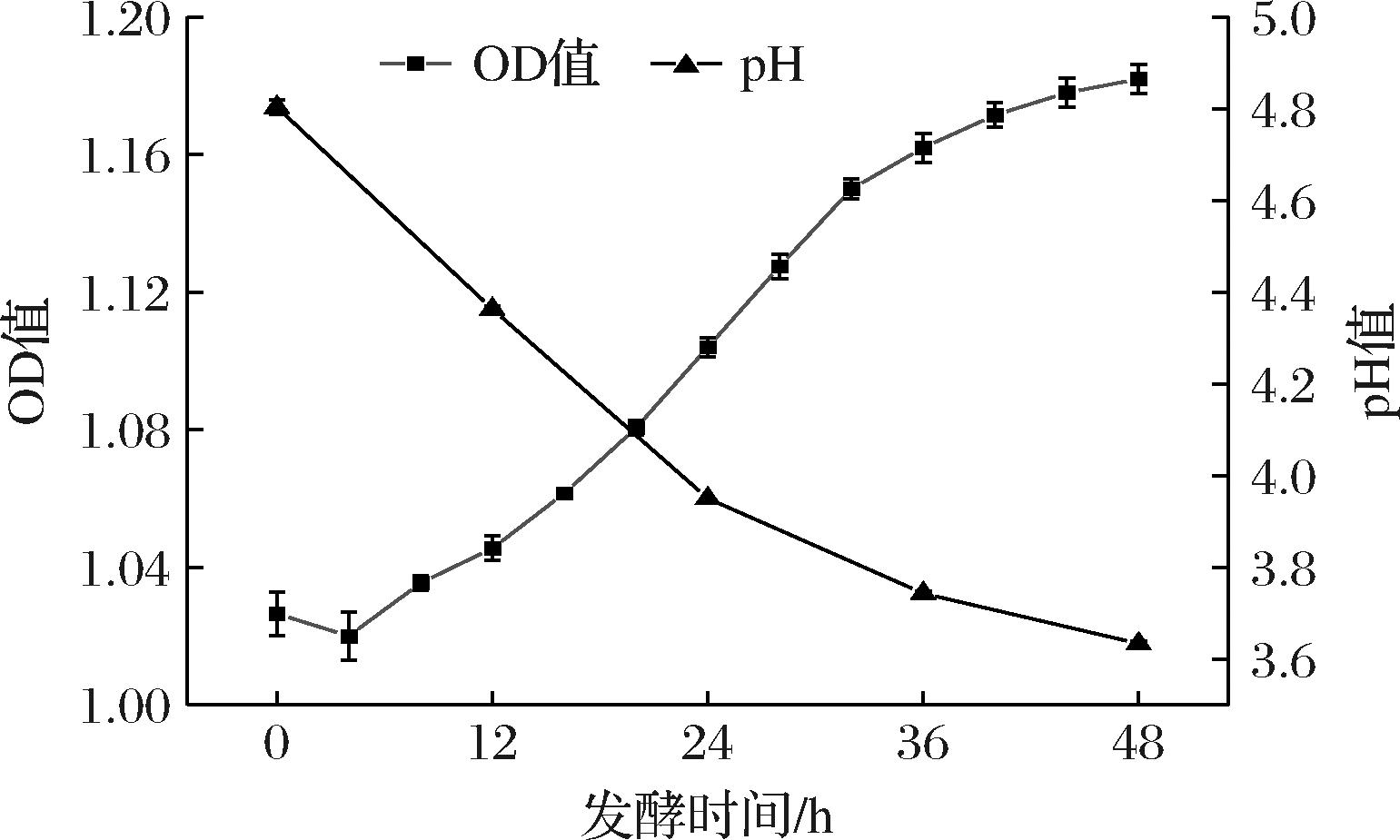
图1 红枣汁发酵过程中pH及植物乳植杆菌生长的变化
Fig.1 Changes in pH and growth of L.plantarum during fermentation of jujube juice
乳酸菌的发酵周期一般有延迟期、对数生长期、稳定期和衰老期。如图1生长曲线所示,OD值在发酵前36 h的上升趋势更明显,此后则相对平稳,可能是由于L.plantarum的繁殖从对数期逐渐进入到稳定期[15],也可能是pH的降低对L.plantarum的生长产生一定的抑制作用。ZHANG等[16]测定了L.plantarum发酵红枣汁过程中的活菌数,结果与本实验结果基本一致。
2.2 发酵过程中的游离态酚酸的变化
如表1所示,L.plantarum发酵枣汁48 h后,GA、CNA含量显著增高(P<0.05),且呈现先上升(0~36 h)后下降(36~48 h)的趋势;CGA、PA和PHBA的含量显著降低(P<0.05)。与此同时,发酵前后红枣汁中FA、PCA和CA含量无显著变化(P>0.05),其中PCA含量呈现先上升(0~36 h)后下降(36~48 h)的趋势。CGA下降的原因可能是由于其转化为CA,LIU等[17]利用益生菌发酵枸杞汁后,发现枸杞汁中CGA转化为CA;且植物乳植杆菌发酵的樱桃银莓果实中,CGA的含量也出现降低的现象[18]。而CA和PA可能会转化为二氢咖啡酸和邻苯二酚,从而造成PA含量的降低。有研究表明,红枣汁中的单宁首先通过植物乳植杆菌产生的单宁酶的水解活性转化为GA,后通过脱羧反应转化为邻苯三酚[19],GA升高的原因可能是发酵时间短,单宁大量转化为GA。因此,酚类物质会随发酵时间而发生不同程度的脱羧、氧化还原反应,从而改变发酵枣汁中酚酸含量。
表1 红枣汁发酵过程中游离态酚酸化合物的含量 单位:mg/L
Table 1 Content of free phenolic acid compounds during fermentation of jujube juice

酚酸名称发酵时间/h012243648GA29.15±0.37b28.42±0.48b29.76±0.21b28.34±0.53b36.03±1.37aPA2.88±0.18a3.14±0.10a3.20±0.13a1.02±0.08b0.84±0.19bCGA41.83±1.1a10.72±0.29d23.33±1.12c31.77±1.63b12.68±1.12dPHBA7.17±0.02ab8.16±0.49a6.43±0.57b6.73±0.28ab2.26±0.40cCA1.03±0.04a1.10±0.01a1.01±0.01a0.94±0.04a1.08±0.08aPCA1.42±0.07c1.72±0.16b2.05±0.02a2.18±0.05a1.53±0.06bcFA7.72±0.27a8.17±0.43a8.37±0.36a8.80±0.78a8.60±0.05aCNA0.29±0.04d0.30±0.01d0.70±0.01b1.07±0.02a0.56±0.01c酚酸总量91.47±1.05a61.72±0.96d74.83±1.39c80.83±2.20b63.56±0.81d
注:不同小写字母表示不同发酵时间酚酸含量的显著性差异(P<0.05)。
2.3 相关性分析
为明确枣汁发酵过程中酚酸的变化与L.plantarum生长之间的关系,对不同发酵阶段红枣汁中的酚酸含量及L.plantarum生长OD值进行了相关性分析(图2)。结果表明,从0 h发酵开始到48 h发酵结束,L.plantarum逐渐适应此发酵基质,表明红枣汁的环境适合其生长代谢。其次可以得出PA、CGA、PHBA和CA与OD值呈负相关,而GA、PCA、FA和CNA与OD值呈正相关。其中PA与OD值的相关性最强,相关系数达到-0.86。其次是PHBA、FA和CNA,相关系数依次为-0.72、0.73和0.71。由此可见,当PA和PHBA浓度过高时,OD值会随之降低,表明高浓度的PA和PHBA会抑制L.plantarum的生长,而FA和CNA与之相反,在一定范围内,FA和CNA含量增加会促进L.plantarum的生长。为进一步明晰酚酸浓度与L.plantarum生长之间的关系,将选取PHBA和FA两类酚酸进行体外酚酸胁迫实验,以明确酚酸胁迫下的L.plantarum生长状况。
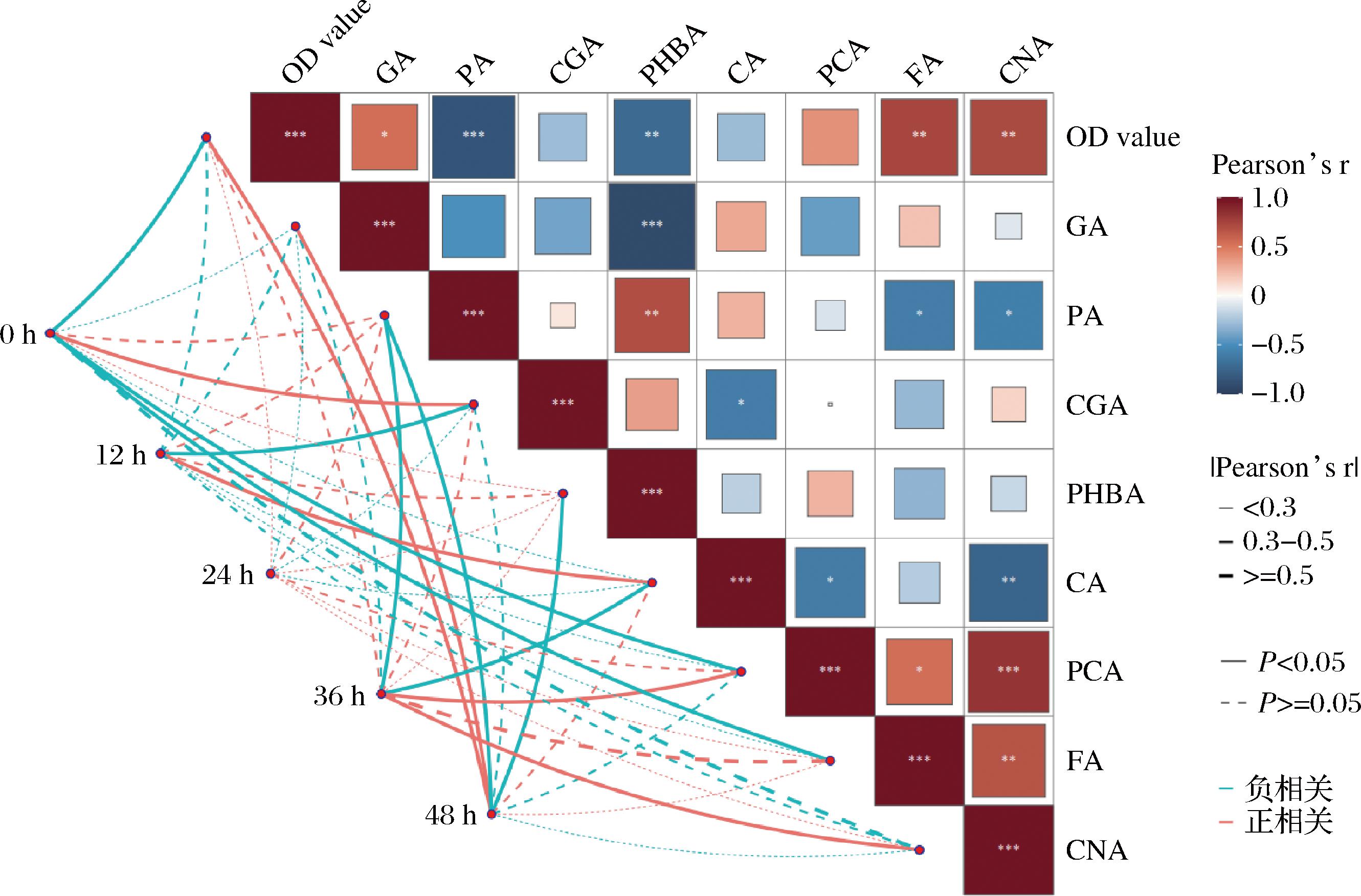
图2 红枣汁中游离态酚酸与植物乳植杆菌活菌数之间的相关性分析
Fig.2 Correlation analysis between free phenolic acid in jujube juice and viable count of L.plantarum
注:*表示P<0.05;**表示P<0.01;***表示P<0.001(下同)。
2.4 酚酸胁迫下L.plantarum在MRS中的生长状态
由图3可知,添加0.5 g/L PHBA增加了L.plantarum
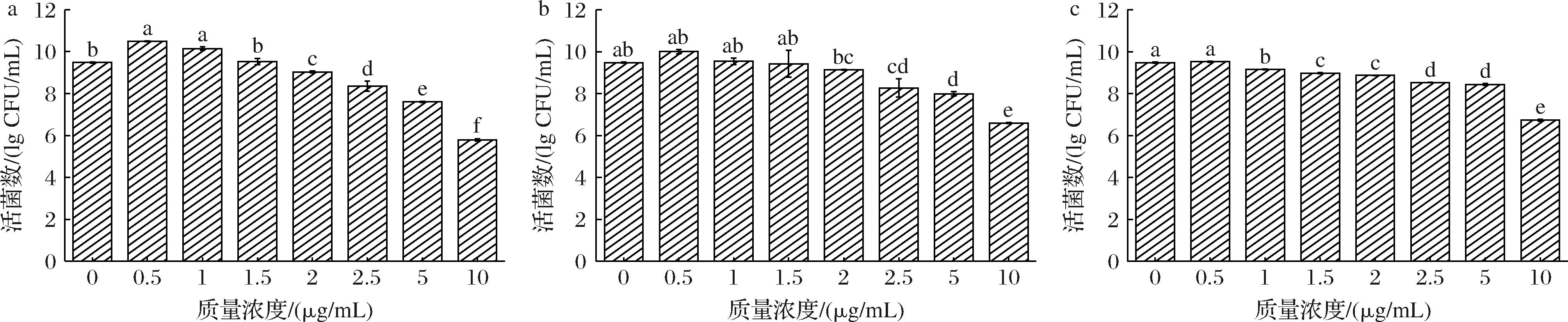
a-添加PHBA;b-添加FA;c-添加PHBA+FA
图3 不同浓度酚酸胁迫对植物乳植杆菌活菌数的影响
Fig.3 Effects of phenolic acid stress at different concentrations on viable bacteria count of L.plantarum
注:不同小写字母表示同一种酚酸不同浓度间差异显著(P<0.05)(下同)。
的存活数量,而添加FA和PHBA+FA 对该浓度下L.plantarum的存活数量没有显著影响。随着酚酸浓度的增加,活菌数呈持续下降趋势。与对照组相比,当PHBA、FA和PHBA+FA的质量浓度分别达到2.5 g/L时,存活细胞数明显减少。在PHBA胁迫下,L.plantarum数量的抑制作用更为明显。LI等[20]使用不同菌株发酵富含酚酸的蓝莓汁,发酵前,酚酸质量浓度为70.3 mg/L,其中PHBA质量浓度为26.69 mg/L。发酵后,菌株LSJ-TY-HYB-T9的存活数最高(10.40 lg CFU/mL),而发酵菌株LSJ-TY-HYB-H33的存活数最低(10.19 lg CFU/mL)。GU等[21]曾利用1.2 g/L的丁香酸、2.1 g/L的香草酸和3.5 g/L的对羟基苯甲酸探讨对酿酒酵母生长的作用,发现这些条件下分别引起15.9%、31.1%和31.4%的生长抑制率,随着酚酸浓度增加,菌体细胞膜受损导致渗透性增加及营养成分流失,从而抑制菌体生长。这表明酚酸对乳酸菌具有双向驱动作用,这种作用主要取决于酚酸的结构、酚酸的添加量和菌株的类型。
2.5 细胞形态
图4显示了L.plantarum在不同浓度的酚酸条件下培养48 h后的细胞形态。当酚酸质量浓度为0.5、1.0 g/L时,与对照组相比无明显差异。随着酚酸浓度增加,PHBA、FA、PHBA+FA胁迫下的细菌细胞膜受损,甚至出现细胞死亡。高浓度酚酸胁迫会造成细菌的破坏,加重细胞损伤程度,并导致细胞质物质释放到培养液中。这可能是因为细胞膜是PHBA、FA等酚类化合物作用于L.plantarum的靶点之一。其中,当酚酸质量浓度达到1.5 g/L以上时,添加FA的胁迫培养基中的L.plantarum都出现菌体变长的现象。菌株的形态伸长是其对胁迫环境反应的一种表现。也可能是L.plantarum在不同的应激环境中能改变菌体形态,以保证其正常的生理功能和营养摄入[22]。与FA胁迫相比,PHBA胁迫对L.plantarum细胞形态的影响更大,细胞膜造成的破坏及细胞死亡情况更为严重。高浓度酚酸胁迫下的细胞膜损伤可能导致细胞内成分大量泄漏和细菌失活。

图4 不同浓度酚酸胁迫对植物乳植杆菌外观形貌影响的扫描电镜图
Fig.4 Effects of phenolic acid stress at different concentrations on the appearance of L.plantarum by SEM
2.6 细胞膜脂肪酸
酚酸胁迫下细胞脂肪酸的变化是由于L.plantarum的形态和活力发生了显著变化导致的。由表2可知,L.plantarum的主要细胞膜脂肪酸为饱和脂肪酸棕榈酸(C16∶0)、不饱和脂肪酸油酸(C18∶1)和环丙烷脂肪酸(19CYC∶0),总含量占总脂肪酸含量的80%以上。酚酸胁迫后,脂肪酸的组分发生变化,饱和脂肪酸肉豆蔻酸(C14∶0)、环丙烷脂肪酸(19CYC∶0)的含量显著增高,而硬脂酸(C18∶0)、油酸(C18∶1)的含量均降低。PHBA胁迫会造成棕榈酸(C16∶0)含量降低,另外两组含量无显著性变化;PHBA和PHBA+FA胁迫下,棕榈油酸(C16:1)的含量显著升高,FA组无明显变化。混合酚酸胁迫会造成亚油酸(C18∶2)含量的升高,但其余两组无显著变化。酚酸胁迫导致其组分发生变化,从而改变了细胞膜中不饱和脂肪酸/饱和脂肪酸的比例(U/S)。与对照组相比,添加PHBA、FA及PHBA+FA对L.plantarum进行胁迫会造成其U/S降低,U/S分别降低了53.85%、59.07%和54.87%。有研究表明,一些乳酸菌菌株在面临酚酸胁迫时,通过上调细胞膜中不饱和脂肪酸的比例,以增加细胞膜的流动性,从而应对酚酸的存在对细胞生理功能的影响[23],这与本实验结果一致。
表2 不同浓度酚酸胁迫对植物乳植杆菌细胞膜脂肪酸组成的影响 单位:%
Table 2 Effects of phenolic acid stress at different concentrations on fatty acid composition of membrane of L.plantarum
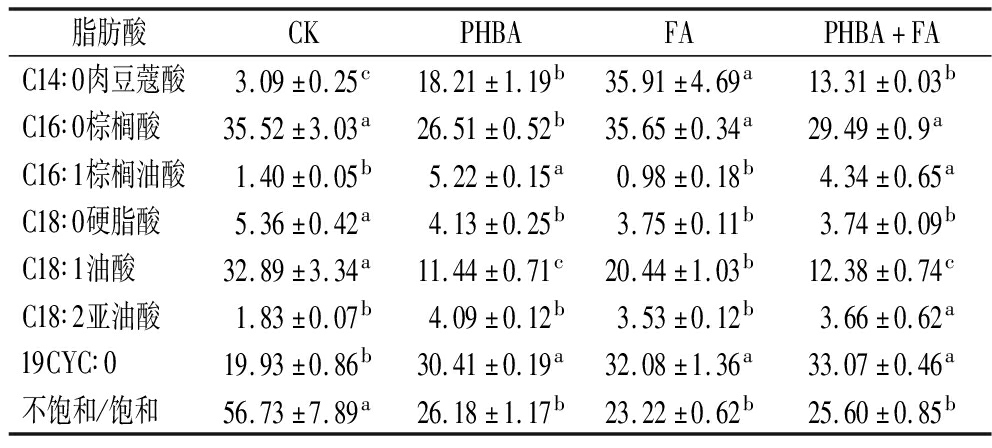
脂肪酸CKPHBAFAPHBA+FAC14∶0肉豆蔻酸3.09±0.25c18.21±1.19b35.91±4.69a13.31±0.03bC16∶0棕榈酸35.52±3.03a26.51±0.52b35.65±0.34a29.49±0.9aC16∶1棕榈油酸1.40±0.05b5.22±0.15a0.98±0.18b4.34±0.65aC18∶0硬脂酸5.36±0.42a4.13±0.25b3.75±0.11b3.74±0.09bC18∶1油酸32.89±3.34a11.44±0.71c20.44±1.03b12.38±0.74cC18∶2亚油酸1.83±0.07b4.09±0.12b3.53±0.12b3.66±0.62a19CYC∶019.93±0.86b30.41±0.19a32.08±1.36a33.07±0.46a不饱和/饱和56.73±7.89a26.18±1.17b23.22±0.62b25.60±0.85b
注:小写字母表示不同酚酸胁迫对植物乳植杆菌细胞膜脂肪酸占比的显著性差异(P<0.05)。
2.7 H+-ATPase和β-葡萄糖苷酶活性
H+-ATPase在细菌的耐酸性中起着关键作用,诱导其活性和表达与增强对低pH的抵抗力有关。如图5-a所示,与对照组相比,2.5 g/L的PHBA和PHBA+FA胁迫分别显著降低了H+-ATPase活性的35.40%和28.36%,但FA胁迫对其酶活性无显著影响。CARRETÉ等[24]发现,葡萄酒中的脂肪酸(5 mg/L)等物质对H+-ATPase有很强的抑制作用,能抑制细菌的生长发育。在本实验中,PHBA和PHBA+FA胁迫对植物酵母中的H+-ATPase有抑制作用,膜被破坏,导致细菌生长受抑制,其生理功能可能受损。

a-H+-ATPase;b-β-葡萄糖苷酶
图5 不同浓度酚酸胁迫对植物乳植杆菌H+-ATPase和β-葡萄糖苷酶活性的影响
Fig.5 Effects of phenolic acid stress at different concentrations on H+-ATPase and β-glucosidase activities of L.plantarum
β-葡萄糖苷酶是一种纤维素酶,能水解烷基糖苷、芳基糖苷、纤维素低聚糖等,释放出芳香糖苷配体和β-葡萄糖。如图5-b所示,与对照组相比,在2.5 g/L 的PHBA、FA和PHBA+FA的胁迫下,β-葡萄糖苷酶的酶活性分别显著提高了9.83%、404.85%和196.14%。在酚酸胁迫下,L.plantarum中β-葡萄糖苷酶的活性明显提高,说明酚酸可激活L.plantarum中β-葡萄糖苷酶的活性,从而促进酚酸的转化和芳香物质的合成。TIAN等[25]发现,添加0.83 mg/mL的阿魏酸、对香豆酸和0.67 mg/mL的水杨酸可使纤维素酶活性分别提高28.32%、15.17%和10.15%,与本研究结果相似。因此,对富含酚类物质的果蔬进行发酵可以通过改变菌体的相关内源酶活性,进而改善加工制品的生物活性功能。
3 结论
L.plantarum发酵提高了红枣汁中FA、GA和CNA的含量,分别提高了11.4%、23.60%和93.10%,同时显著降低了CGA、PA和PHBA的含量,依次降低了69.69%、70.83%、68.48%(P<0.05)。当体外PHBA、FA和PHBA+FA酚酸质量浓度达到2.5 g/L时,植物乳植杆菌的活菌数明显减少,其中PHBA胁迫对菌体的抑制作用最大。当酚酸质量浓度达到2.5 g/L时,PHBA、FA和PHBA+FA胁迫后植物乳杆菌的U/S分别下降了53.85%、59.07%和54.87%,β-葡萄糖苷酶的活性明显提高,表明酚酸可激活L.plantarum中β-葡萄糖苷酶的活性。由本实验结果可推测,对于酚酸质量浓度<2.5 g/L的发酵基质而言,采用乳酸菌发酵时,可促进菌体与酚酸类物质的生物转化,而酚酸含量较高的发酵基质,采用乳酸菌发酵时,高浓度酚酸条件可能会抑制乳酸菌的生长代谢。本研究揭示了L.plantarum在不同酚酸浓度下适应性和耐受性的差异性,为富含高酚酸的果蔬乳酸菌发酵产品的开发提供了技术参考。
[1] SEPTEMBRE-MALATERRE A,REMIZE F,POUCHERET P.Fruits and vegetables,as a source of nutritional compounds and phytochemicals:Changes in bioactive compounds during lactic fermentation[J].Food Research International,2018,104:86-99.
[2] ZHOU Q,LAN W Q,XIE J.Phenolic acid-chitosan derivatives:An effective strategy to cope with food preservation problems[J].International Journal of Biological Macromolecules,2024,254:127917.
[3] AKBARI M,RAZAVI S H,KHODAIYAN F,et al.Fermented corn bran:A by-product with improved total phenolic content and antioxidant activity[J].LWT,2023,184:115090.
[4] TIAN R R,PAN Q H,ZHAN J C,et al.Comparison of phenolic acids and flavan-3-ols during wine fermentation of grapes with different harvest times[J].Molecules,2009,14(2):827-838.
[5] SAUD S,TANG X J,FAHAD S.The consequences of fermentation metabolism on the qualitative qualities and biological activity of fermented fruit and vegetable juices[J].Food Chemistry:X,2024,21:101209.
[6] WANG J,SHI Y,ZHANG H J,et al.Characterization and comparison of unfermented and fermented seed-watermelon juice[J].Journal of Food Quality,2018,2018:4083903.
[7] GUAN X F,ZHAO D Z,YU T,et al.Phytochemical and flavor characteristics of mulberry juice fermented with Lactiplantibacillus plantarum BXM2[J].Foods,2024,13(17):2648.
[8] MANTZOURANI I,KAZAKOS S,TERPOU A,et al.Potential of the probiotic Lactobacillus plantarum ATCC 14917 strain to produce functional fermented pomegranate juice[J].Foods,2018,8(1):4.
[9] LI T L,JIANG T,LIU N,et al.Biotransformation of phenolic profiles and improvement of antioxidant capacities in jujube juice by select lactic acid bacteria[J].Food Chemistry,2021,339:127859.
[10] EUN H,CHEOL K,HYUN K,et al.Enhancement of isoflavone aglycone,amino acid,and CLA contents in fermented soybean yogurts using different strains:Screening of antioxidant and digestive enzyme inhibition properties[J].Food Chemistry,2021,340:128199.
[11] STIVALA M G,VILLECCO M B,ENRIZ D,et al.Effect of phenolic compounds on viability of wine spoilage lactic acid bacteria.a structure-activity relationship study[J].American Journal of Enology and Viticulture,2017,68(2):228-233.
[12] YANG H,HE M W,WU C D.Cross protection of lactic acid bacteria during environmental stresses:Stress responses and underlying mechanisms[J].LWT,2021,144:111203.
[13] ZHANG L H,CHEN Y L,LAN X Y,et al.Application of ultrasonic pretreatment on fermentation of jujube juice by Lactobacillus plantarum:Investigation on physicochemical and volatile aroma components[J].Journal of Food Measurement and Characterization,2025,19(1):753-767.
[14] ZHANG Q L,MA L L,E J J,et al.Effects of initial pH on heat resistance of Lactobacillus plantarum LIP-1[J].LWT,2021,138:110748.
[15] 蔡文超.植物源乳酸菌的筛选及其在红枣汁发酵中代谢产物的研究[D].石河子:石河子大学,2023.CAI W C.Screening of plant-derived lactic acid bacteria and their metabolites during the fermentation of jujube juice[D].Shihezi:Shihezi University,2023.
[16] ZHANG L H,ZHA M M,LI S F,et al.Investigation on the effect of thermal sterilization versus non-thermal sterilization on the quality parameters of jujube juice fermented by Lactobacillus plantarum[J].Journal of Food Science and Technology,2022,59(10):3765-3774.
[17] LIU Y X,CHENG H,LIU H Y,et al.Fermentation by multiple bacterial strains improves the production of bioactive compounds and antioxidant activity of goji juice[J].Molecules,2019,24(19):3519.
[18] LIZARDO R C M,CHO H D,WON Y S,et al.Fermentation with mono-and mixed cultures of Lactobacillus plantarum and L.casei enhances the phytochemical content and biological activities of cherry silverberry (Elaeagnus multiflora Thunb.) fruit[J].Journal of the Science of Food and Agriculture,2020,100(9):3687-3696.
[19] 吴彩云,张晓荣,徐怀德,等.益生菌发酵果蔬汁生物活性成分及功能特性研究进展[J].中国食品学报,2021,21(12):323-334.WU C Y,ZHANG X R,XU H D,et al.Research progress on bioactive components and functional properties of fruit and vegetable juice fermented by probiotics[J].Journal of Chinese Institute of Food Science and Technology,2021,21(12):323-334.
[20] LI S J,TAO Y,LI D D,et al.Fermentation of blueberry juices using autochthonous lactic acid bacteria isolated from fruit environment:Fermentation characteristics and evolution of phenolic profiles[J].Chemosphere,2021,276:130090.
[21] GU H Q,ZHU Y Y,PENG Y F,et al.Physiological mechanism of improved tolerance of Saccharomyces cerevisiae to lignin-derived phenolic acids in lignocellulosic ethanol fermentation by short-term adaptation[J].Biotechnology for Biofuels,2019,12:268.
[22] 张丽华,冯路瑶,唐培鑫,等.杜仲叶水提取物对植物乳杆菌体外益生特性影响[J].包装与食品机械,2024,42(1):19-26.ZHANG L H,FENG L Y,TANG P X,et al.Effect of Eucommia ulmoides leaf water extract on the probiotic properties in vitro of Lactobacillus plantarum[J].Packaging and Food Machinery,2024,42(1):19-26.
[23] ROZ S N,PERES C.Effects of phenolic compounds on the growth and the fatty acid composition of Lactobacillus plantarum[J].Applied Microbiology and Biotechnology,1998,49(1):108-111.
S N,PERES C.Effects of phenolic compounds on the growth and the fatty acid composition of Lactobacillus plantarum[J].Applied Microbiology and Biotechnology,1998,49(1):108-111.
[24] CARRETÉ R,VIDAL M T,BORDONS A,et al.Inhibitory effect of sulfur dioxide and other stress compounds in wine on the ATPase activity of Oenococcus oeni[J].FEMS Microbiology Letters,2002,211(2):155-159.
[25] TIAN Y,JIANG Y,OU S Y.Interaction of cellulase with three phenolic acids[J].Food Chemistry,2013,138(2-3):1022-1027.