溶菌酶(lysozyme, EC:3.2.1.17)是一种天然的抗菌酶,广泛存在于生物体的体液中 [1-2]。其主要功能是通过裂解细菌细胞壁中的糖胺聚糖成分,破坏细胞壁的完整性,从而发挥抗菌作用。溶菌酶作为一种具有杀菌作用的天然抗感染物质,已广泛用于食品防腐保鲜、抗菌消炎以及农业生产等行业当中。在食品保鲜与防腐方面,可作为一种天然防腐剂用于延长食品的保质期[3]。在医疗行业可作为抗生素替代品,由于其不同于抗生素的作用机制,不容易导致耐药性[4]。溶菌酶作为一种绿色、安全的天然抗菌剂,其商业化应用前景广阔。
目前商业溶菌酶主要依赖蛋清提取[5],传统的从自然来源中提取溶菌酶的方法通常工艺复杂且成本高,会造成环境污染问题,逐渐难以满足市场需求。随着技术的发展,溶菌酶的生产可能会更加依赖于基因工程和合成生物学提供的更加高效、可持续的生产方式。已有研究尝试在大肠杆菌[6]、酵母等异源表达系统中生产溶菌酶[7]。大肠杆菌虽具有生长速度快、成本低的优势,但常因蛋白错误折叠形成无活性的包涵体[8],需复杂的复性步骤。酵母系统虽能实现较高产量,如毕赤酵母可达3 g/L[9],但其发酵过程中副产物的积累可能影响酶的纯度和活性。此外,植物和哺乳动物细胞系统[10]成本高、周期长,难以满足工业化生产需求。
谷氨酸棒杆菌(Corynebacterium glutamicum)是典型的GRAS(generally recognized as safe)菌株[11],无内毒素,具有高效的分泌能力和出色的发酵鲁棒性, 已经广泛应用于工业生产[12],是理想的重组蛋白表达宿主。C.glutamicum与典型的革兰氏阳性细菌不同,具有特殊的分层结构,C.glutamicum的细胞壁由肽聚糖层、阿拉伯半乳聚糖层和分枝菌酸层组成[13],这种外层结构赋予其一定的保护性,尤其是外膜部分,能够减少溶菌酶对肽聚糖的接触与破坏[14],此外C.glutamicum胞外蛋白酶较少,利于下游分离纯化,因此选用C.glutamicum来表达生产重组溶菌酶。
本研究首次利用C.glutamicum分泌表达重组溶菌酶,并选择对重组蛋白分泌影响较大的转录、翻译、转运多水平进行改造,通过优化表达信号肽、启动子和核糖体结合位点(ribosome binding site,RBS)以及过表达转运系统等操作来提高重组溶菌酶的分泌表达量,实现了溶菌酶在C.glutamicum中高效表达,为溶菌酶生产提供新的方法参考。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株和质粒
质粒构建所用的大肠杆菌DH5α购自上海生工,实验室保藏的C.glutamicum CGMCC1.15647作为表达宿主。所用质粒见表1,所用引物见表2。
表1 本研究所用质粒
Table 1 Plasmids in this study

质粒描述来源pGX19双顺反子tac表达载体,氯霉素抗性本研究pGX19-CspB-rlyzPgx19,带有rlyz基因,CspB信号肽本研究pGX19-CspB-T4lyzpGX19,带有T4lyz基因本研究pGX19-CspB-OElyzpGX19,带有OElyz基因本研究pGX19-CgR0949-lyzpGX19,信号肽为CgR0949本研究pGX19-porB-rlyzpGX19,信号肽为porB本研究pGX19-CgR1514-rlyzpGX19,信号肽为CgR1514本研究pGX19-CspA-rlyzpGX19,信号肽为CspA本研究pjr-CgR0949-lyz双顺反子j2,SD1序列为R760本研究pja-CgR0949-lyz双顺反子j2,SD1序列为A16本研究pjy-CgR0949-lyz双顺反子j2,SD1序列为Y15本研究pjh-CgR0949-lyz双顺反子j2,SD1序列为H11本研究ptr-CgR0949-lyz双顺反子tac,SD1序列为R760本研究pta-CgR0949-lyz双顺反子tac,SD1序列为A16本研究pty-CgR0949-lyz双顺反子tac,SD1序列为Y15本研究pth-CgR0949-lyz双顺反子tac,SD1序列为H11本研究pmr-CgR0949-lyz双顺反子m1,SD1序列为R760本研究pma-CgR0949-lyz双顺反子m1,SD1序列为A16本研究pmy-CgR0949-lyz双顺反子m1,SD1序列为Y15本研究pmh-CgR0949-lyz双顺反子m1,SD1序列为H11本研究pdr-CgR0949-lyz双顺反子dap,SD1序列为R760本研究pda-CgR0949-lyz双顺反子dap,SD1序列为A16本研究pdy-CgR0949-lyz双顺反子dap,SD1序列为Y15本研究pdh-CgR0949-lyz双顺反子dap,SD1序列为H11本研究pja-CgR0949-lyz-tatABC带有TatABC基因的pja-CgR0949-lyz质粒本研究
表2 本研究所用引物
Table 2 Primers in this study

引物名称引物序列RLYZ-S-FAAGCTTATGAAGACCTCCGATGCCGRLYZ-S-RAGCTCGGTACCCGGGGATCCTTAGTGGTGATGGTGATGGTGTGT4LYZ-S-FAAGCTTATGAACATCTTCGAAATGCTGCT4LYZ-S-RCTCGGTACCCGGGGATCCTTAGTGGTGATGGTGATGGTGGATOELYZ-S-FAAGCTTATGTCCGCAGTGCTGGTGOELYZ-S-RGGATCCTTAGTGGTGATGGTGATGGTGGGAGCSPA-FTGCGGTGTCGCGCATCTCGAGCATTAGTTGTCCTCCTTTCSPA-RTGGTCAGCTGCTCAAGCTTGTTGCTGGACTGAGCCGAAGPORB-FAAAAAGGAGGACAACTAATGATGAAGCTTTCACACCGCATCPORB-RAAAAAGGAGGACAACTAATGATGAAGCTTTCACACCGCATCCGR0949-FAAAAAGGAGGACAACTAATGCTCGAGATGCAAATAAACCGCCGAGGCGR0949-RCCGGCATCGGAGGTCTTCATTGCTCCAAGGGCGTTGGCCGR1514-FAAAAAGGAGGACAACTAATGATGTTAAACAGAGTCAGTCGTATTGCACGR1514-RCCGGCATCGGAGGTCTTCACTGTTCGAGGCTTTGTGCAGTJ2-FTTTTTTAGTTTTGAGTTACAATGGTTGTTGTGAGCGGATAACAATTCTAAGGJ2-RTGTAACTCAAAACTAAAAAAATGTCAATTTCAGAATATTTGCCAGAACCGM1-FCGTGTGCTATAATGGGTGGAATTGTGAGCGGATAACAM1-RTTCCACCCATTATAGCACACGATTTCAGAATATTTGCCAGAACCGDAP-FCCAAATGAGGGAATGTGGTAGAGTGGAACTCTTGTGAGCGGATAACAATTCTAAGGDAP-RTACCACATTCCCTCATTTGGTGTCAAAACAATTTCAGAATATTTGCCAGAACCGR760-FCAATTTTCGTACTGAAACATCTTAATCATGCAAGTAATTCTTCCAAATCGAGAGGAGAAAAATTTTCGTAATGCAAATAAACCGCCGAGA16-FCAATTTTCGTACTGAAACATCTTAATCATGCGAAAGGATTTCGCTAATGCAAATAAACCGCCGAGY15-FCAATTTTCGTACTGAAACATCTTAATCATGCCGCCAAGGTTTCGTAATGCAAATAAACCGCCGAGH11-FCAATTTTCGTACTGAAACATCTTAATCATGCAGAAAGGGTTTCTAATGCAAATAAACCGCCGAGRBS-RTGTTTCAGTACGAAAATTGCTTTCATTATAC-S-FGTGGTTTGTCAGCGTATGATATAC-S-RTTTAGCCACTGAAAGGTGGGTGCCCTTTTATB-S-FCACCTTTCAGTGGCTAAAGTTGAGTCCGTTATB-S-RAGGTATCGCTGGTGGGTAAAAV-FCATACGCTGACAAACCACAGTTTACTTTGCAGGGCTTCCV-RTACCCACCAGCGATACCTGGACCAAAATCCCTTAACGTGA
1.1.2 引物和基因合成
本实验所用的基因和引物均由苏州金唯智生物科技有限公司合成构建,T4噬菌体来源溶菌酶和无脊椎动物来源的oelyz[15]以及人工预测的编号L070的重组溶菌酶rlyz[16]在不同来源的溶菌酶C端加上6His-tag标签方便后续纯化和分析,目的基因两端分别添加HindⅢ、BamHⅠ用来与载体连接。
1.1.3 主要培养基
本实验培养基所用到的蛋白胨、脑心浸出液、酵母浸粉、酪蛋白水解物均购自OXOID公司;其他实验室常用试剂包括盐离子、金属离子、有机试剂均购自于国药集团化学试剂有限公司。培养基和缓冲液的配方分别如表3、表4所示。
表3 培养基配方
Table 3 Composition of media

液体名称配置方法LBB培养基NaCl 10.0 g/L,酵母浸粉10.0 g/L,脑心浸出液5.0 g/L,蛋白胨10.0 g/LBHI培养基脑心浸出液37.5 g/LLBHIS培养基山梨醇91.0 g/L, NaCl 5.0 g/L,脑心浸出液18.5 g/L,蛋白胨5.0 g/L,酵母浸粉10.0 g/LNCM培养基1 g/L 酵母浸粉,0.3 g/L 柠檬酸三钠,17.4 g/L K2HPO4, 91.1 g/L 山梨醇,11.6 g/L NaCl,0.05 g/L MgSO4·7H2O,30.0 g/L 甘氨酸,5.0 g/L 蛋白胨,4.0 g/L异烟肼,0.1%(体积分数)吐温80,1.0 g/L苏氨酸LBHIS培养基山梨醇91.0 g/L,脑心浸出液18.5 g/L,NaCl 5.0 g/L,蛋白胨5.0 g/L,酵母浸粉10.0 g/L5 L发酵罐培养基BSA脑心浸出液37.0 g/L,葡萄糖20.0 g/L, KH2PO4 1.0 g/L,K2HPO4 3.0 g/L, (NH4)2SO4 10.0 g/L,MgSO4 2.0 g/L, NaCl 10 g/L补料培养基葡萄糖50.0 g/L
表4 缓冲液配方
Table 4 Composition of buffer solutions

液体名称 配置方法PBS bufferKH2PO4 0.24 g/L,NaCl 8.0 g/L,Na2HPO4 1.44 g/L,称取0.2 g/L, pH 7.5Binding Buffer20 mmol/L NaH2PO4·2H2O,20 mmol/L Na2HPO4·7H2O,20 mmol/L咪唑,0.5 mol/L NaCl, pH 7.5Elution Buffer20 mmol/L NaH2PO4·2H2O,20 mmol/L Na2HPO4·7H2O,500 mmol/L咪唑,0.5 mol/L NaCl, pH 7.550 mmol/L Tris-HCl Buffer50 mmol/L Tris,50 mmol/L NaCl,使用HCl调pH值至7.550×TAE242.0 g/L三羟甲基氨基甲烷,37.2 g/L Na2EDTA·2H2O5×蛋白电泳buffer十二烷基硫酸钠5.0 g/L,甘氨酸94.0 g/L,三羟甲基氨基甲烷15.1 g/L
1.1.4 试剂
PCR所用到的DNA聚合酶(2×Phanta Flash Master Mix、2×EsTaq Master Mix等),南京诺唯赞生物科技公司;同源重组酶2×MultiF Seamless Assembly Mix,武汉ABclonal公司;酶切所用到的酶(BbsI、HindⅢ、BamHⅠ等),赛默飞世尔科技公司;6his-tag HRP抗体,武汉三鹰生物技术有限公司;Western blot使用的聚偏二氟乙烯(polyvinylidene fluoride,PVDF)膜,Millipore公司;本实验所用到的抗生素(氯霉素、卡那霉素),麦克林公司。其他常用试剂如盐离子、金属离子、无机试剂、有机试剂除特殊说明外均购自于国药集团化学试剂有限公司。实验中主要使用的试剂盒见表5。
表5本研究使用的主要试剂盒
Table 5 The main reagents and kits used in this study

试剂盒厂家FastPure Plasmid Mini Kit质粒提取试剂盒南京诺唯赞FastPure Gel DNA Extraction Mini Kit纯化试剂盒南京诺唯赞细菌基因组提取试剂盒康为世纪EnzChekTM溶菌酶检测试剂盒赛默飞世尔科技公司BCA试剂盒碧云天Western Blotting显色液上海天能FuturePAGE 蛋白预制胶常州伯仪生物科技PAGE Gel Quick Preparation Kit(10%)PAGE试剂盒翌圣生物
1.2 仪器与设备
主要仪器和设备见表6。
表6 本研究所用实验仪器
Table 6 Experimental instruments used in this study
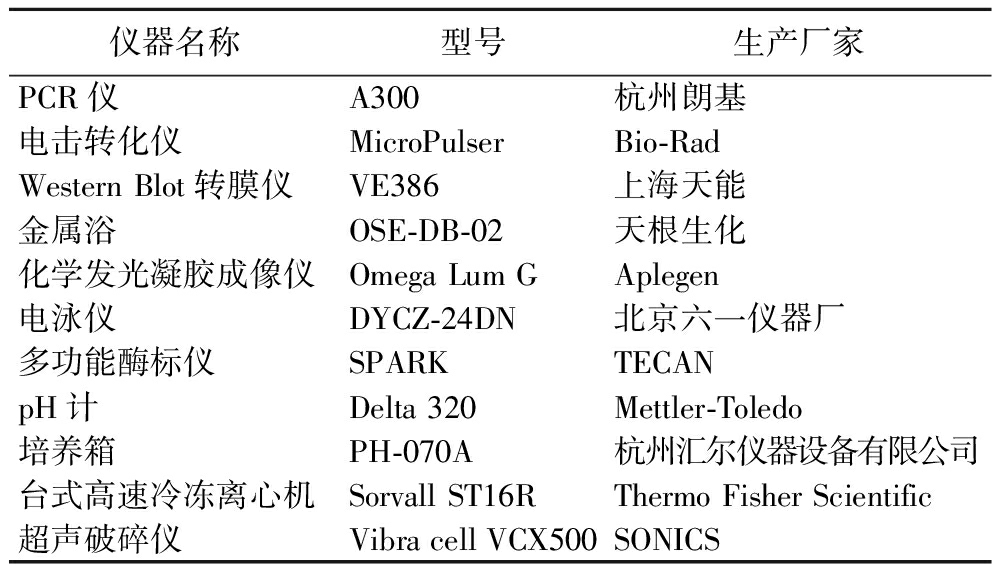
仪器名称型号生产厂家PCR仪A300杭州朗基电击转化仪MicroPulserBio-RadWestern Blot转膜仪VE386上海天能金属浴OSE-DB-02天根生化化学发光凝胶成像仪Omega Lum GAplegen电泳仪DYCZ-24DN北京六一仪器厂多功能酶标仪SPARKTECAN pH计Delta 320Mettler-Toledo培养箱PH-070A杭州汇尔仪器设备有限公司台式高速冷冻离心机Sorvall ST16RThermo Fisher Scientific超声破碎仪Vibra cell VCX500SONICS
1.3 实验方法
1.3.1 表达载体构建
重组溶菌酶表达载体的构建:选取了不同来源的3种溶菌酶,首先进行密码子优化,在它们的C端加上6 his标签方便后续检测和纯化,在其两端分别加上HindⅢ和BamHⅠ酶切位点,之后由苏州金唯智公司合成。重组溶菌酶载体pGX19-rlyz的构建:使用HindⅢ和BamHⅠ分别酶切rlyz基因和双顺反子pXMJ19[17]载体,随后通过T4 DNA连接酶进行连接。T4噬菌体来源溶菌酶和无脊椎动物来源的oelyz的表达质粒构建方式同pXMJ19-rlyz一样。
信号肽优化载体构建:以pGX19-CspB-rlyz为模板,分别使用引物CSPA-F和CSPA-R、PORB-F和PORB-R、CGR0949-F和CGR0949-R、CGR1514-F和CGR1514-R去PCR扩增,同源重组50 ℃,1 h,即可达到更换不同信号肽的RLYZ表达质粒。
启动子和RBS组合优化质粒构建:以RLYZ的组合优化为例,选择pGX19-CgR0949-rlyz为模板,分使用引物R760-F和RBS-R、A16-F和RBS-R、Y15-F和RBS-R、H11-F和RBS-R来PCR扩增,之后同源重组50 ℃,1 h,即可得到启动子为tac,而前顺反子不同的质粒ptr-CgR0949-rlyz、pta-CgR0949-rlyz、pty-CgR0949-rlyz、pth-CgR0949-rlyz,在此基础上,分别使用引物J2-F和J2-R、M1-F和M1-R、DAP-F和DAP-R进行PCR扩增,得到不同启动子和RBS组合的质粒。
过表达Tat ABC转运系统质粒构建:以C.glutamicum CGMCC1.15647基因组为模板,分别使用引物TATAC-S-F和TATAC-S-R、TATB-S-F和TATB-S-R进行PCR扩增得到片段Tat AC和Tat B,以质粒pja-CgR0949-rlyz为模板,使用引物V-F和V-R进行PCR扩增,得到质粒载体,将3个片段进行同源重组50 ℃,1 h得到质粒pja-CgR0949-rlyz-TatABC。
以上质粒均由苏州金唯智生物科技有限公司测序验证正确。
1.3.2 质粒转化
将上述构建好的质粒电转电击法[18]转入C.glutamicum CGMCC1.15647感受态细胞中。
1.3.3 溶菌酶活性检测方法
本研究使用试剂盒EnzChek® Lysozyme Assay Kit (E-22013)来测量溶菌酶活性,该试剂盒以被荧光标记的溶壁微球菌细胞壁为底物,当与检测样品反应时,可以产生与溶菌酶活性成正比的荧光,结合高通量筛选工具可以快速筛选到活性高的样品。200 μL反应体系如下:检测样品50 μL(使用反应缓冲液稀释),反应底物50 μL,反应缓冲液补至200 μL。酶标仪荧光测定条件为:将反应体系放置在96孔酶标板中,测反应动力学3 h,每30 s测1次,激发波长485 nm,发射波长530 nm,增益调为50;用测定的荧光强度/对应样品的OD600来表示单位荧光强度,每组实验做3个平行。
1.3.4 菌株培养和感受态制备
大肠杆菌和C.glutamicum的培养温度分别为37 ℃和30 ℃,氯霉素工作质量浓度分别为30 μg/mL和10 μg/mL,正常培养条件:初始接种OD600值为0.2,培养到OD600值为1时添加终浓度1 mmol/L IPTG诱导24 h,转速220 r/min,最终发酵培养基使用BHN培养基。
C.glutamicum感受态制备采用NCM培养基培养,将培养至对数期的谷棒按5%接种量至NCM培养基中,37 ℃培养5 h,冰浴15 min,5 000 r/min离心10 min,使用提前冰浴好的10%(体积分数)甘油离心清洗3次,最终使用10%(体积分数)甘油重悬每管90 μL分装到1.5 mL EP管中[19]。
1.3.5 蛋白样品制备及WB分析
C.glutamicum在发酵培养结束后,4 ℃,10 000 r/min离心10 min收集上清液,一部分用反应缓冲液稀释至合适倍数用于溶菌酶活性检测,另一部分变性制样用于SDS-PAGE分析,对于胞内样品制备采用超声破碎法:收集的菌体使用PBS洗涤3遍,最终加入2 mL PBS重悬置于冰水混合物上,超声破碎8 min(25%功率,破碎2 s,停3 s)后10 000 r/min离心1 min,上清液为胞内可溶样品,沉淀则为包涵体。
蛋白电泳结束后,将盛有蛋白胶与PVDF的电泳槽放在冰水浴上,300 mA恒流,2 h,转膜结束后使用含吐温-20三羟甲基氨基甲烷缓冲盐水(Tris-buffered saline with Tween-20,TBST)缓冲液清洗PVDF膜3次,加入含有50 g/L脱脂奶粉的TBST封闭1 h,更换HRP-6 his抗体液孵育1 h,最后使用TBST洗涤3次,加入ECL显色液使用成像仪拍照分析。
1.3.6 重组溶菌酶纯化及酶学性质分析
发酵结束后,10 000 r/min离心30 min收集100 mL发酵上清液,使用0.45 μm滤膜过滤样品,接着使用AKAT系统和His-Tag镍柱对样品进行了纯化,使用的A液20 mmol/L磷酸盐缓冲液(phosphate buffer,PB),10 mmol/L咪唑,0.5 mol/L NaCl,pH 7.4,B液20 mmol/L PB,500 mmol/L咪唑,0.5 mol/L NaCl,pH 7.4,洗脱浓度为300 mmol/L咪唑,最终使用50 mmol/L Tris-HCl缓冲液进行超滤替换。使用BSA定量法测重组溶菌酶产量。
通过在Tris-HCl缓冲液中添加不同浓度的Na+来检测不同浓度离子对重组溶菌酶活性的影响;将纯化后的蛋白提前加入到Tris-HCl缓冲液中,放入提前设置好温度的PCR仪中,测不同温度对溶菌酶活性的影响;根据缓冲液有效pH范围配制不同pH缓冲液,选择50 mmol/L PB缓冲液配制pH 5.5~7.5的反应液,选择50 mmol/L Tris-HCl缓冲液配制pH 7~9的反应液,选择50 mmol/L Gly-NaOH缓冲液配制pH 9~11的反应液;在Tris-HCl缓冲液中添加不同离子,终浓度50 mmol/L,以此探究不同离子对重组溶菌酶活性的影响。
2 结果与分析
2.1 高通量溶菌酶检测方法
传统的溶菌酶检测方法如比浊法、扩散法等,当同时处理较多样品时,时间消耗较长,方法繁琐,且灵敏度低、准确性差,而基于荧光法的溶菌酶检测方法,以被荧光标记的溶壁微球菌细胞壁为底物,提供了更高的灵敏度、更好的定量精度、更快的检测速度和更少的背景干扰。尤其适合需要高通量、实时监测或低浓度溶菌酶检测的场景。使用不同活性的标品与底物在37 ℃反应1 h,使用酶标仪测其在485 nm激发和530 nm发射下的荧光,可以明显观察到溶菌酶活性与荧光成正比,并显示随时间延长样品产生了稳定的荧光(图1-a、图1-b),通过此种荧光与表达量偶联的检测方法,可以快速地通过高通量筛选到表达量高的菌株。
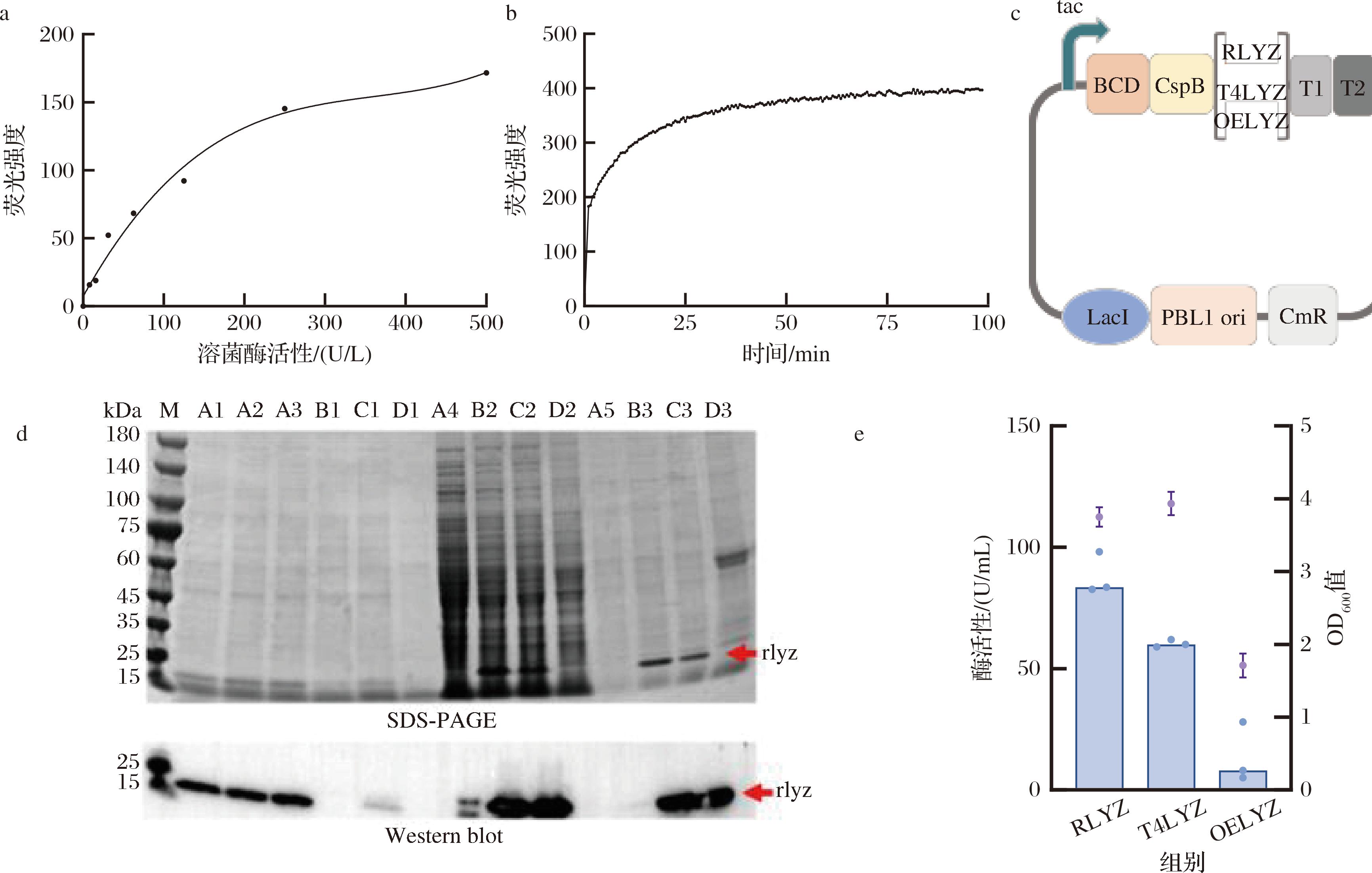
a-荧光强度与酶活性相关性;b-随时间延长底物与样品反应的荧光变化;c-不同来源溶菌酶质粒构建示意图;d- SDS-PAGE和Western blot分析;e-不同来源溶菌酶胞外活性比较
图1 溶菌酶检测方法及不同来源溶菌酶的表达情况
Fig.1 Detection methods of lysozyme and expression profiles of lysozymes from different sources
注:BCD为双顺反子结构,T1、T2为终止子,LacI为乳糖操纵子,PBL1ori为乳酸短杆菌来源复制子,CmR为氯霉素抗性(下同);M为marker,A1~A3为rlyz发酵上清液,B1为OElyz发酵上清液,C1为T4lyz发酵上清液,D1为对照组,A4、B2、C2、D2为别为rlyz、OElyz、T4lyz、对照组破碎上清液。
2.2 不同来源溶菌酶的表达情况
将构建好的pGX19-CspB-rlyz、pGX19-CspB-T4lyz、pGX19-CspB-OElyz质粒电转到C.glutamicum CGMCC1.15647中,发酵结束离心后取上清液进行酶活性测定和Western blot分析表达情况,结果显示只有编号L070人工预测来源的rlyz被成功分泌到胞外,且在发酵上清液中被成功检测到活性,另外2种来源的溶菌酶未被成功分泌到胞外,从SDS-PAGE图观察到胞内以及包涵体有大量积累(图1-d~图1-e),因此选用被成功分泌表达的rlyz作为目标蛋白用于后续研究,还可以从图1-d看出,使用C.glutamicum表达重组溶菌酶,胞外杂蛋白较少,这有利于下游纯化。
2.3 信号肽筛选
信号肽在蛋白质分泌过程中起着关键作用,为进一步提高重组溶菌酶的分泌水平,本研究更换了常用的Sec途径和Tat途径的不同信号肽CspB、CspA、CgR0949、porB、Cg1514[20],结果显示当选择Tat途径的CgR0949信号肽时,相较于初始Sec途径信号肽CspB重组溶菌酶表达量提高了2.4倍,而其他信号肽对重组溶菌酶的分泌均未起到促进作用(图2)。
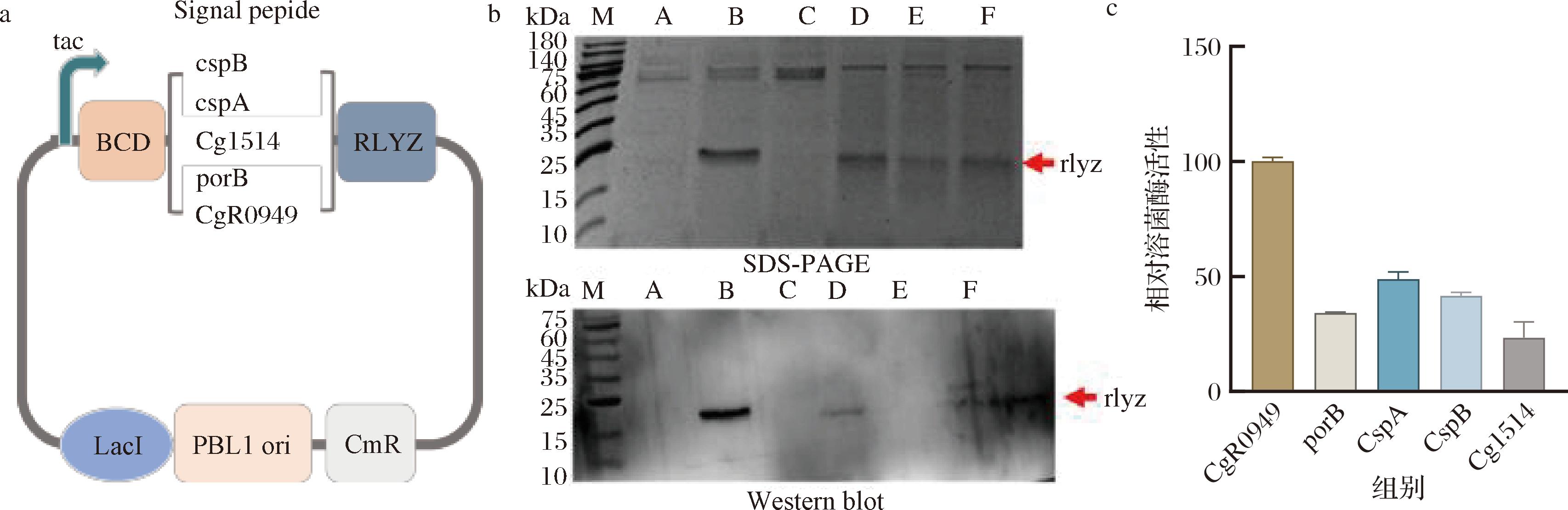
a-更换不同信号肽质粒示意图;b-更换不同信号肽的表达情况(A、B、C、D、E、F分别为对照组、CgR0949、PorB、CspA、CspB、Cg1514);c-更换不同信号肽的胞外酶活性
图2 不同信号肽对溶菌酶表达的影响
Fig.2 The effect of different signal peptides on lysozyme expression
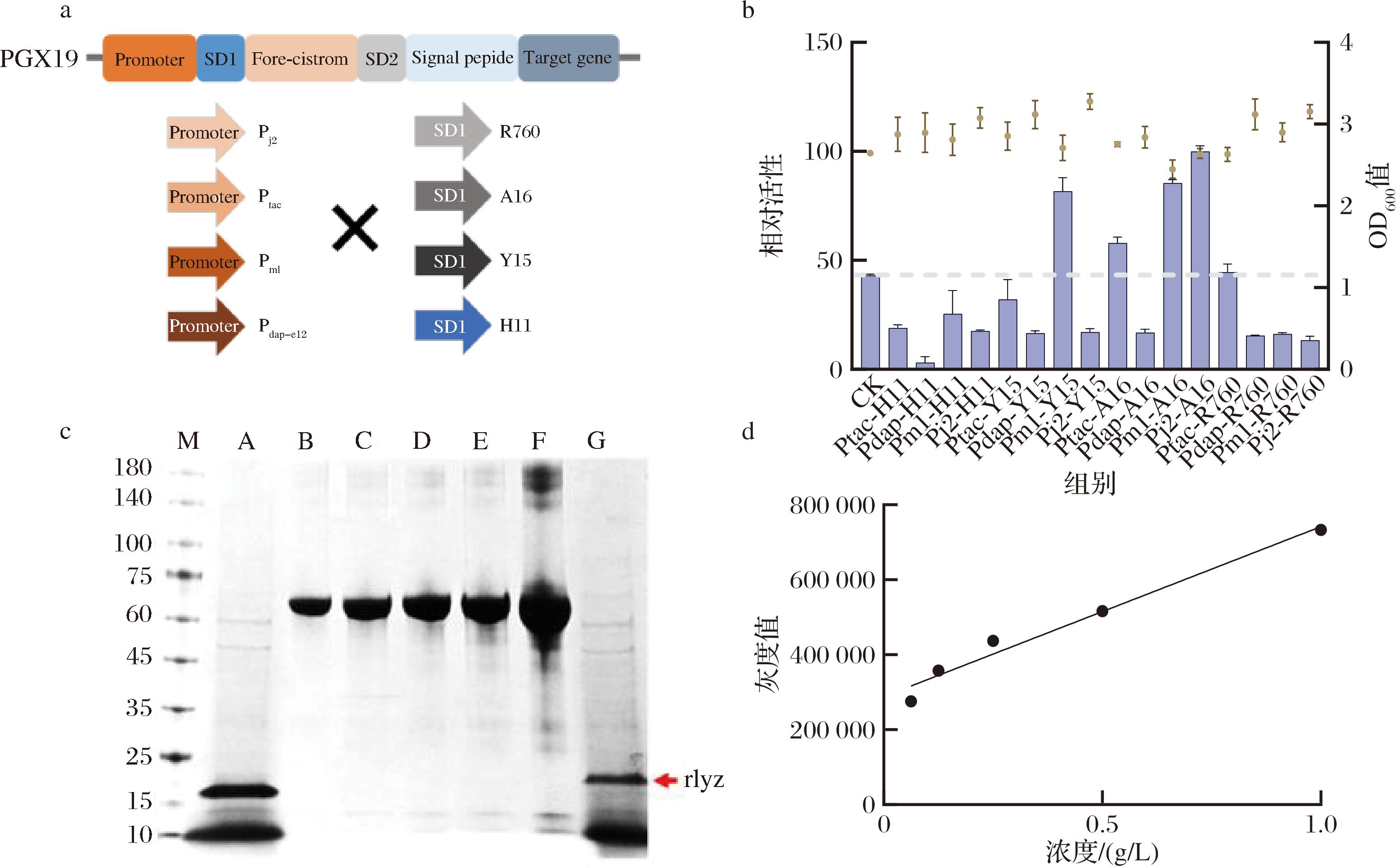
a-启动子和RBS组合优化示意图;b-启动子和RBS组合优化对重组溶菌酶分泌量的影响;c-BSA定量分析和过表达TatABC转运系统对蛋白分泌影响的SDS-PAGE;d-BSA灰度分析标准曲线
图3 启动子和RBS组合优化及过表达TatABC转运系统对蛋白分泌的影响
Fig.3 The effect of optimizing promoter and RBS combinations and overexpressing the TatABC transport system on protein secretion
注:图c中A、G分别为过表达TatABC转运系统后和未表达的菌株,B、C、D、E、F分别为不同浓度BSA标品:0.062 5、0.125、0.25、0.5、1 mg/mL。
2.4 启动子和RBS组合优化
为进一步提高分泌效率,本研究进一步优化了启动子与RBS的组合优化,因为它们在转录和翻译的过程中发挥着至关重要的作用。优化启动子和RBS组合能够有效提高目标基因的表达量,从而提高溶菌酶的生产效率。选取4个不同强度的启动子和4个不同强度的RBS进行组合优化[21],结果(图3)显示Pm1-Y15、Ptac-A16、Pm1-A16、Pj2-A16对于重组溶菌酶分泌均有积极作用,其中启动子为PJ2,RBS为A16时,相较于初始菌株,重组溶菌酶的表达量提高了2.3倍。
2.5 过表达TatABC系统
通过过表达转运系统,不仅可以增强细胞的分泌能力,还能帮助蛋白保持稳定的结构和功能,避免在细胞内积累过程中发生折叠不良或降解[22],在前面研究中发现Tat途径的CgR0949信号肽对于重组蛋白分泌有很大积极作用,因此选择过表达TatABC转运系统来进一步增强宿主的分泌能力,提高重组溶菌酶的分泌量,SDS-PAGE结果显示,此措施对于重组溶菌酶分泌有明显促进作用,通过BSA定量分析,过表达转运系统产量提高1.5倍,摇瓶产量可达0.2 g/L。
2.6 重组溶菌酶酶学性质
2.6.1 Na+浓度对重组溶菌酶活性影响
Na+浓度为50 mmol/L时溶菌酶活性最高,随着离子浓度的升高溶菌酶活性快速下降。低浓度Na+对重组溶菌酶活性有促进作用,而高浓度对重组溶菌酶有明显抑制作用(图4-a)。
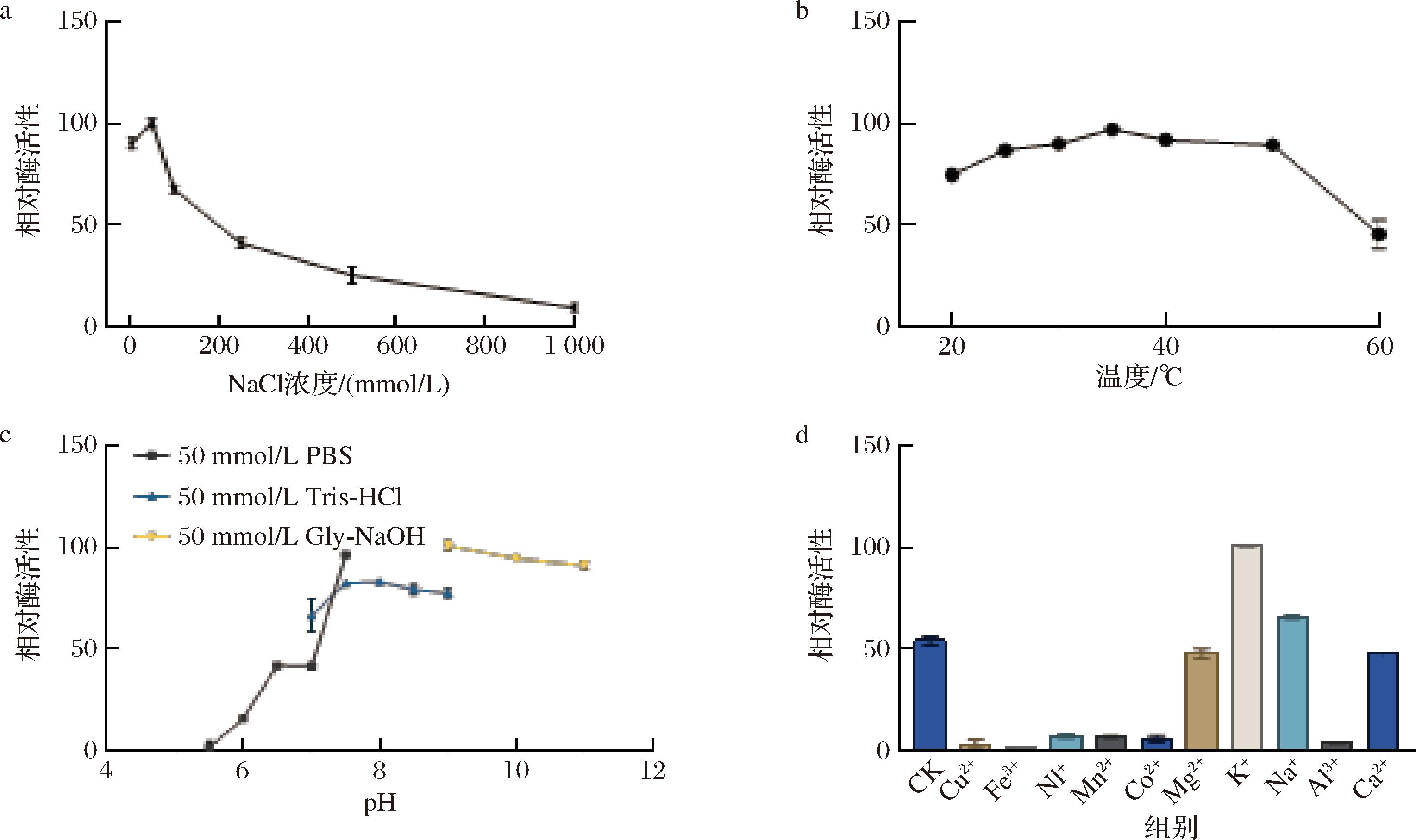
a-Na+浓度对酶活性影响;b-温度对酶活性影响;c-pH值对酶活性影响;d-不同金属离子对酶活性影响
图4 重组溶菌酶酶学性质
Fig.4 Enzymatic properties of recombinant lysozyme
2.6.2 温度对重组溶菌酶活性影响
重组溶菌酶在温度为35 ℃时活性最高,在20~50 ℃下具有较高的热稳定性,在此温度下处理1 h仍保留80%的酶活性,当温度大于50 ℃后,对酶活性损失明显(图4-b),因此重组溶菌酶的最适温度为35 ℃。
2.6.3 pH值对重组溶菌酶活性影响
重组溶菌酶在pH值为7.5时活性最高,在pH 7.5~11下处理1 h仍保留80%的酶活性,当pH值小于7.5后,酶活性快速丧失(图4-c),说明此重组溶菌酶在碱性环境中具有较好的稳定性,因此重组溶菌酶的最适pH值为7.5。
2.6.4 不同金属离子对重组溶菌酶活性影响
接着又对不同金属离子对重组溶菌酶活性的影响进行了探究,在不额外添加离子的Tris-HCl中分别添加50 mmol/L不同金属离子,结果如图4-d所示,K+和Na+对重组溶菌酶有激活作用,其中K+效果最明显,Mg2+和Ca2+对重组溶菌酶活性影响较小,而其他离子对重组溶菌酶有明显抑制作用。
3 结论与讨论
本研究成功实现了重组溶菌酶在原核生物C.glutamicum中的分泌表达。C.glutamicum的非典型细胞壁结构使其对溶菌酶具有较高的耐受性,这为重组溶菌酶的高效表达提供了有利条件,通过信号肽筛选、启动子和RBS组合优化以及转运系统的过表达,重组溶菌酶的分泌量显著提高。相较于初始菌株,产量提高了8.3倍,其中Tat途径的CgR0949信号肽相较于其他信号肽,显著提高了重组溶菌酶的分泌表达量,说明为目标蛋白进行信号肽筛选的必要性;接着又进行启动子和RBS组合优化策略,实现重组溶菌酶表达最大化,最后过表达转运系统,进一步增强细胞的分泌能力,实现了以C.glutamicum为细胞工厂生产分泌重组溶菌酶,本研究中C.glutamicum的溶菌酶产量(0.2 g/L)虽低于毕赤酵母系统(2 g/L),但其分泌能力强、胞外杂蛋白少,显著降低了纯化成本,且未来可通过细胞壁膜修饰,敲除C.glutamicum的细胞壁合成相关基因,增强其对溶菌酶的分泌能力和耐受性[23],从而进一步提高溶菌酶产量,本研究展现了原核系统在溶菌酶高效生产中的潜力,为溶菌酶的生产方法提高新的参考。
[1] WEI Z X, WU S H, XIA J J, et al.Enhanced antibacterial activity of hen egg-white lysozyme against Staphylococcus aureus and Escherichia coli due to protein fibrillation[J].Biomacromolecules, 2021, 22(2):890-897.
[2] WANG S W, WANG T Y.Study on antibacterial activity and structure of chemically modified lysozyme[J].Molecules, 2023, 28(1):95.
[3] ZHANG W L, RHIM J W.Functional edible films/coatings integrated with lactoperoxidase and lysozyme and their application in food preservation[J].Food Control, 2022, 133:108670.
[4] FERRABOSCHI P, CICERI S, GRISENTI P.Applications of lysozyme, an innate immune defense factor, as an alternative antibiotic[J].Antibiotics, 2021, 10(12):1534.
[5] SHAHMOHAMMADI A.Lysozyme separation from chicken egg white:A review[J].European Food Research and Technology, 2018, 244(4):577-593.
[6] NAVEED M, WEN S, CHAN M W H, et al.Expression of BSN314 lysozyme genes in Escherichia coli BL21:A study to demonstrate microbicidal and disintegarting potential of the cloned lysozyme[J].Brazilian Journal of Microbiology, 2024, 55(1):215-233.
[7] LAMPPA J W, TANYOS S A, GRISWOLD K E.Engineering Escherichia coli for soluble expression and single step purification of active human lysozyme[J].Journal of Biotechnology, 2013, 164(1):1-8.
[8] CALLEWAERT L, MASSCHALCK B, DECKERS D, et al.Purification of Ivy, a lysozyme inhibitor from Escherichia coli, and characterisation of its specificity for various lysozymes[J].Enzyme and Microbial Technology, 2005, 37(2):205-211.
[9] 王亚森. 人源溶菌酶在毕赤酵母中的表达优化[D].无锡:江南大学, 2021.Wang Y S.Optimization of human lysozyme expression in Pichia pastoris[D].Wuxi:Jiangnan University, 2021.
[10] 于政权, 樊宝良, 戴蕴平, 等. 转基因小鼠乳腺表达重组人溶菌酶[J]. 科学通报, 2003, 48(20):2149-2153.YU Z Q, FAN B L, DAI Y P, et al. Expression of recombinant human lysozyme in mammary gland of transgenic mice[J]. Chinese Science Bulletin, 2003, 48(20):2149-2153.
[11] WANG M M, SHI Z, GAO N, et al.Sustainable and high-level microbial production of plant hemoglobin in Corynebacterium glutamicum[J].Biotechnology for Biofuels and Bioproducts, 2023, 16(1):80.
[12] LIU X X, ZHANG W, ZHAO Z H, et al.Protein secretion in Corynebacterium glutamicum[J].Critical Reviews in Biotechnology, 2017, 37(4):541-551.
[13] CALABRETTA P, HODGES H L, KRAFT M B, et al.Bacterial cell wall modification with a glycolipid substrate[J].Journal of the American Chemical Society, 2019, 141(23):9262-9272.
[14] HO T D, HASTIE J L, INTILE P J, et al.The Bacillus subtilis extracytoplasmic function σ factor σ(V) is induced by lysozyme and provides resistance to lysozyme[J].Journal of Bacteriology, 2011, 193(22):6215-6222.
[15] GREEN D S.Effects of microplastics on European flat oysters, Ostrea edulis and their associated benthic communities[J].Environmental Pollution, 2016, 216:95-103.
[16] MADANI A, KRAUSE B, GREENE E R, et al.Large language models generate functional protein sequences across diverse families[J].Nature Biotechnology, 2023, 41(8):1099-1106.
[17] SUN M M, GAO A X, LI A, et al.Bicistronic design as recombinant expression enhancer:Characteristics, applications, and structural optimization[J].Applied Microbiology and Biotechnology, 2021, 105(20):7709-7720.
[18] JIANG Y, QIAN F H, YANG J J, et al.CRISPR-Cpf1 assisted genome editing of Corynebacterium glutamicum [J].Nature Communications, 2017, 8:15179.
[19] 余心宇. 基于CRISPR—微流控筛选系统鉴定谷氨酸棒杆菌高效分泌蛋白的关联基因 [D], 无锡:江南大学,2022.YU X Y.Identification of genes associated with efficient protein secretion in C.glutamicum using a CRISPR-microfluidic screening system[D].Wuxi:Jiangnan University,2022.
[20] SUN M M, GAO A X, LEDESMA-AMARO R, et al.Hypersecretion of OmlA antigen in Corynebacterium glutamicum through high-throughput based development process[J].Applied Microbiology and Biotechnology, 2022, 106(8):2953-2967.
[21] DUAN Y T, ZHAI W J, LIU W J, et al.Fine-tuning multi-gene clusters via well-characterized gene expression regulatory elements:Case study of the arginine synthesis pathway in C.glutamicum[J].ACS Synthetic Biology, 2021, 10(1):38-48.
[22] KIKUCHI Y, ITAYA H, DATE M, et al.TatABC overexpression improves Corynebacterium glutamicum Tat-dependent protein secretion[J].Applied and Environmental Microbiology, 2009, 75(3):603-607.
[23] YU X Y, LI S, FENG H B, et al.CRISPRi-microfluidics screening enables genome-scale target identification for high-titer protein production and secretion[J].Metabolic Engineering, 2023, 75:192-204.