白酒风味与微生物菌群结构组成及演变息息相关[1]。韩国强等[2]利用高通量测序技术,研究了重庆糯高粱复配小曲白酒的细菌群落结构,发现厚壁菌门、变形菌门和拟杆菌门是其优势菌门;发酵前2 d、后3 d优势细菌分别为不明立克次体菌属、乳杆菌属。HU等[3]利用宏基因组和宏转录组,分析了传统和新机械技术所生产小曲白酒的细菌菌群变化规律,发现瑞士乳杆菌是发酵过程的核心细菌,新机械技术发酵过程中的瑞士乳杆菌丰度显著高于传统技术。TANG等[4]发现四川大竹市和湖北房县小曲中的细菌种类与组成相似,主要为片球菌属、魏斯氏菌属和肠杆菌属;而江西鹰潭小曲的细菌则主要由芽孢杆菌属和肠杆菌属组成。综上可知,不同来源小曲白酒发酵过程中的细菌组成不同。科学、正确地认识小曲白酒发酵过程中细菌菌群多样性,对小曲白酒品质调控至关重要。
岭南小曲白酒历史悠久,是以大米、糯米等为主要原料,以小曲为发酵剂,经边糖化边发酵,蒸馏得到的酿造酒[5],其发酵周期短、出酒率高、用曲量少[6]。但目前其细菌组成尚未被明确解析。鉴此,本研究拟利用高通量测序技术结合生物信息学手段,分析岭南小曲白酒主要生产企业广东某酒厂的同一批次不同发酵阶段小曲白酒的细菌群落组成及演替规律,以期为优化小曲白酒生产工艺、筛选优质微生物菌种、提升小曲白酒品质提供理论参考。
1 材料与方法
1.1 材料与试剂
岭南小曲白酒发酵醪样品:来自广东省佛山市顺德区某酒厂,岭南小曲白酒发酵醪制备流程如下所示:大米→润米→蒸煮→摊凉→接种(破碎酒饼)→投料入罐(酿造水)→糖化发酵→蒸馏。
在同一批岭南小曲白酒酿造的不同阶段进行取样,即0 h、15 h、30 h、2 d、7 d、12 d、14 d各取约450 mL(每个时间点取3瓶)的岭南小曲白酒发酵醪样品,分别标记为H0、H15、H30、D2、D7、D12、D14,用于后续实验。
建库试剂盒、缓冲液(Phusion® High-Fidelity PCR Master Mix with GC Buffer),New England Biolabs, Inc;异戊醇(分析纯),上海麦克林生化科技股份有限公司;CTAB裂解液,北京兰杰柯科技有限公司;DNA纯化回收试剂盒,北京索莱宝科技有限公司。
1.2 仪器与设备
DDY-6C电泳仪,中国北京市六一仪器厂;Illumina Novaseq6000,美国Illumina公司;Bio-rad T100梯度PCR仪,美国Bio-Rad公司。
1.3 实验方法
1.3.1 基因组DNA提取
用试剂盒提取岭南小曲白酒发酵醪样品中的总DNA,按照试剂盒说明书操作流程进行。
1.3.2 PCR扩增及测序
以岭南小曲白酒发酵醪样品总DNA为模板,用引物341F(5′-CCTAYGGGRBGCASCAG-3′)和806R(5′-GGACTACNNGGGTATCTAAT-3′)对细菌16S rDNA基因V3~V4区进行PCR扩增。PCR扩增程序:98 ℃ 预变性1 min,30个循环(98 ℃变性10 s,50 ℃退火30 s,72 ℃延伸30 s),72 ℃稳定延伸5 min。PCR扩增体系(30 μL):Phusion Master Mix (2x) 15 μL,0.2 μmol/L上游引物0.2 μL,0.2 μmol/L下游引物0.2 μL,10 ng基因组DNA模板,补足ddH2O至30 μL。PCR产物的建库与测序在北京诺禾致源科技股份有限公司完成,使用NovaSeq6000进行PE250上机测序。
1.4 数据处理与统计分析
根据所扩增区域的特点构建小片段文库,利用测序平台进行双末端测序。经过Flash、Cutadapt和Fastp软件进行Reads拼接、过滤以及嵌合体的去除[7-9],得到有效数据,然后运用QIIME2软件进行降噪分析[10]、物种注释,细菌比对Silva 138.1数据库,以进行丰度分析,揭示样本物种构成、样本间群落结构的差异。以上分析在北京诺禾致源科技股份有限公司的云平台完成(https:// magic.novogene.com/)。
2 结果与分析
2.1 细菌菌群Alpha多样性分析
Alpha多样性指数可以反映出不同样本间物种的多样性差异[11]。通过对7个岭南小曲白酒发酵醪样品进行16S rDNA高通量测序,共获得649 951条有效优化序列,平均长度为427 bp。Goods指数反映了测序的覆盖度,测序覆盖度越高,指数越大[12]。由表1可知样本测序覆盖率均在99%以上,即该结果具有足够的测序深度和可靠的数据质量,测序水平可以确定样品中大多数细菌的菌群多样性。
表1 岭南小曲白酒不同生产阶段细菌群落Alpha多样性指数变化
Table 1 Changes of Alpha diversity index of bacterial community in different production stages of Xiaoqu liquor from Lingnan region
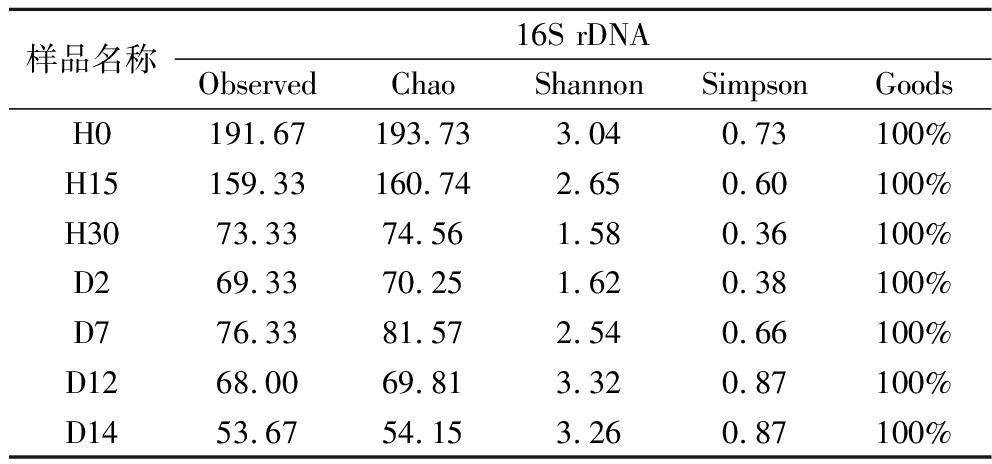
样品名称16S rDNAObservedChaoShannonSimpsonGoodsH0191.67193.733.040.73100%H15159.33160.742.650.60100%H3073.3374.561.580.36100%D269.3370.251.620.38100%D776.3381.572.540.66100%D1268.0069.813.320.87100%D1453.6754.153.260.87100%
Observed指数和Chao指数反映了样品中包含的物种总数,2种指数均与物种丰富度呈正相关[13-14]。由表1可知,在岭南小曲白酒酿造过程中,随着发酵进程的推进,Observed指数和Chao指数呈递减趋势并伴有波动,表明岭南小曲白酒中细菌菌群的丰富度随发酵时间的延长整体呈下降趋势。Shannon指数和Simpson指数反映群落中物种多样性,群落多样性越高,2种指数越大[15]。由表1可知,随着岭南小曲白酒发酵进程的推进,Shannon和Simpson指数呈先减后增的变化趋势,表明岭南小曲白酒发酵过程中的细菌菌群多样性随着时间的延长呈先降低后升高趋势。综上,经Alpha多样性分析,推测导致上述变化的原因可能是,随着时间的推移,岭南小曲白酒中有机酸、乙醇浓度增加,使得白酒中不耐酸、不耐高浓度乙醇的细菌逐渐消亡,而其他耐受性较好的细菌继续发酵。
2.2 细菌菌群Beta多样性分析
通过样本聚类树[16]可以对岭南小曲白酒生产各阶段样品间细菌群落组成的相似性或差异性进行分析,其UPGMA聚类树如图1所示。

图1 白酒发酵样品中细菌层级聚类树
Fig.1 Bacterial hierarchical clustering trees in fermentation samples of liquor
由图1可知,岭南小曲白酒样品H0和H15聚为一支,其他样品聚为一支,形成2个簇;其中一个簇中的D12和D14聚为一类,H30、D2和D7聚为另一类,其中H30和D2聚为一小类,D7自成一小类。细菌层级聚类的结果表明:H0~H15阶段的细菌组成与其他阶段有明显差异,H30~D7与D12~D14阶段的细菌有差异,但同时存在一定的相似性。结合白酒发酵过程分析,发酵前期主要是酵母菌合成乙醇[17],随着乙醇含量的不断增加,不耐受乙醇的细菌逐渐消亡,发酵体系中细菌群落组成发生明显差异变化;当发酵体系中乙醇含量增长缓慢,此时发酵体系中耐受性强的细菌促进风味形成,因此,可以依据细菌的UPGMA聚类分析判断发酵进程,故将发酵过程H0、H15划分为岭南小曲白酒发酵前期,H30、D2、D7划分为岭南小曲白酒发酵中期,D12、D14划分为岭南小曲白酒发酵后期。
2.3 细菌群落分布
在属分类水平下,除没有准确注释信息序列的物种外,从7个岭南小曲白酒发酵醪样品中共检测到209个细菌属。采用花瓣图和韦恩图统计岭南小曲白酒生产各阶段样品中共有和独有的细菌属,结果如图2所示。岭南小曲白酒生产各阶段共有细菌属14个,分别占H0、H15、H30、D2、D7、D12、D14酒醪样品的9.40%、10.69%、45.16%、38.89%、31.82%、30.43%、48.28%(图2-a),这说明7个生产阶段酒醪样品中,细菌物种组成差异较大;除未分类菌属外,共有菌属为13个,分别为粘液乳杆菌属(Limosilactobacillus)、魏斯氏菌属(Weissella)、乳球菌属(Lactococcus)、乳杆菌属(Lactobacillus)、醋酸杆菌属(Acetobacter)、明串珠菌属(Leuconostoc)、片球菌属(Pediococcus)、乳酪杆菌属(Lacticaseibacillus)、植物乳植杆菌属(Lactiplantibacillus)、假交替单胞菌属(Pseudoalteromonas)、气单孢菌属(Aeromonas)、Loigolactobacillus和Liquorilactobacillus,综上可知,在白酒发酵过程中,酸度和乙醇浓度升高,氧气含量逐渐减少,大部分细菌因不能适应该环境而逐渐衰亡,乳酸菌最终成为绝对优势的细菌[18],且14个共有细菌菌属贯穿岭南小曲白酒的整个发酵过程,对岭南小曲白酒的发酵具有重要意义。如图2-b~图2-d所示,就特有细菌属而言,发酵前期酒醪H0的特有细菌属种类最多,为55个,随着发酵时间的延长,酒醪中特有菌属种类逐渐减少(图2-b);发酵中期酒醪样品特有细菌属种类呈递增的趋势,但相较于发酵前期,总体特有细菌属依旧呈递减趋势(图2-c);发酵后期特有细菌属种类呈递减趋势(图2-d)。发酵前期H0与H15共有细菌属为94,发酵中期H30、D2、D7共有细菌属为18;发酵后期D12与D14共有细菌属为19。以上结果表明随着发酵进程的推进,发酵体系中乙醇等代谢产物不断累积,导致岭南小曲酒醪中细菌遭受乙醇等环境胁迫,发酵体系中细菌群落丰富度逐渐降低。
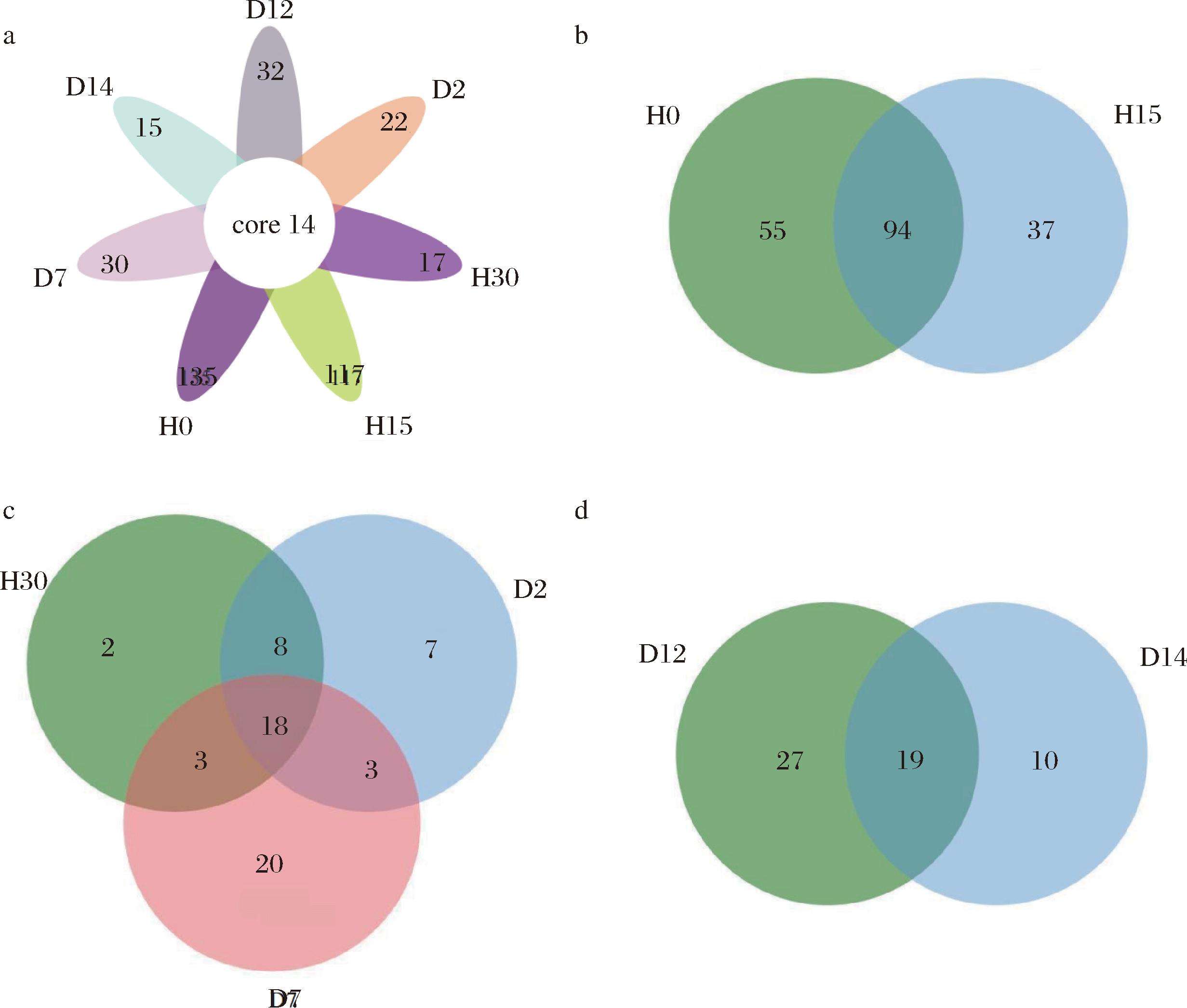
a-细菌花瓣图;b-发酵前期细菌韦恩图;c-发酵中期细菌韦恩图;d-发酵后期细菌韦恩图
图2 岭南小曲白酒不同生产阶段细菌群落属水平分布花瓣图和韦恩图
Fig.2 The distribution of bacterial community genera in different production stages of Xiaoqu liquor from Lingnan region:Petal diagram and Wayne diagram
2.4 细菌群落组成
将相对丰度<1%合并为others,绘制成柱状图如图3所示,显示了岭南小曲白酒不同发酵时期,细菌在门水平上的相对丰度堆叠图。在门水平上,7个发酵阶段白酒样品中,细菌群落组成较为简单,在相对丰度≥1.0%的阈值下,共检出4个细菌门,分别为厚壁菌门(Firmicutes)、变形菌门(Proteobacteria)、蓝菌门(Cyanobacteria)、放线菌门(Actinobacteriota)。厚壁菌门贯穿于岭南小曲白酒发酵的各个时期,为绝对优势菌门[19-20],占比均在70%以上,表明厚壁菌门更能适应白酒发酵环境[21]。变形菌门在发酵前期的相对丰度小幅度增加,后随着发酵时间的延长,其相对丰度大幅降低,稳定在1%以下;蓝菌门、放线菌门在发酵开始时相对丰度均不及1%,而后在发酵15 h 时均有所提升,分别达11.92%、3%,随后两者相对丰度均下降至不足1%。综上可知岭南小曲白酒发酵过程中,变形菌门、蓝菌门和放线菌门相对丰度的变化趋势与厚壁菌门相反,推测变形菌门、蓝菌门、放线菌门主要在发酵前期发挥作用,这与高俊杰[22]的研究结果较为相似。
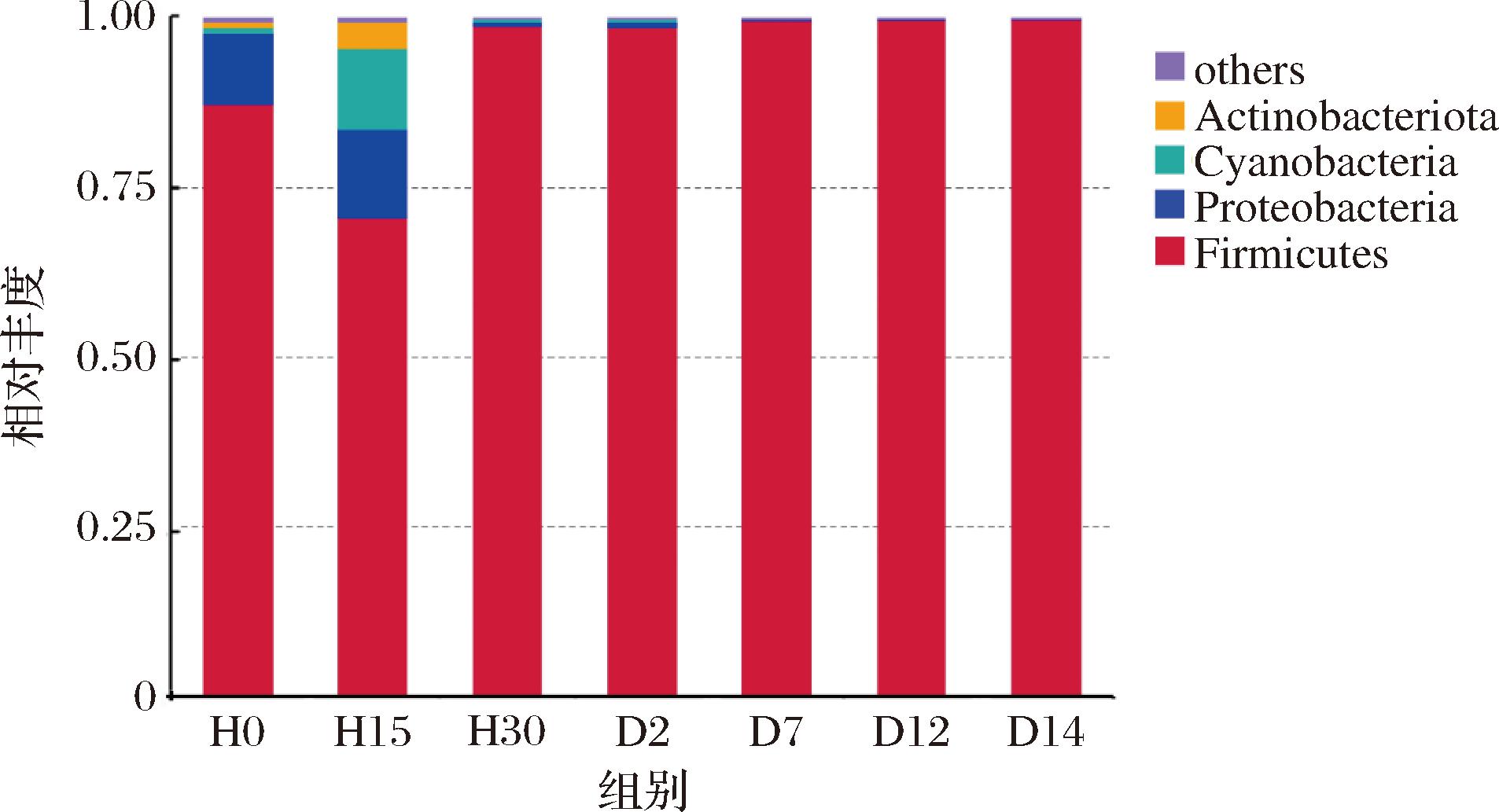
图3 岭南小曲白酒不同生产阶段细菌门水平群落组成
Fig.3 Community composition of bacterial phylum at different production stages of Xiaoqu liquor from Lingnan region
图4显示了岭南小曲白酒不同发酵时期,细菌在属水平上的相对丰度堆叠图。在属水平上,在相对丰度≥1%的阈值下,共得到9个已分类细菌属,分别为粘液乳杆菌属(Limosilactobacillus)、魏斯氏菌属(Weissella)、乳球菌属(Lactococcus)、乳杆菌属(Lactobacillus)、醋酸杆菌属(Acetobacter)、罗斯氏菌属(Rothia)、明串球菌属(Leuconostoc)、片球菌属(Pediococcus)、肠杆菌属(Enterobacter)。发酵初始细菌菌群与其他发酵节点菌群有较大差异。粘液乳杆菌属在2020年从乳杆菌属中分离出来并进行了重新分类[23],其在发酵初始相对丰度仅达1.39%,在发酵15 h时迅速攀升至56.38%,而后相对丰度一直稳定在80%以上,可知其是除0 h外发酵阶段的绝对优势菌属,这与LIU等[24]的研究较为相似,该研究发现高温大曲发酵早期,即非高温发酵时期,粘液乳杆菌属相对丰度大幅增加,其代谢活动有利于释放丰富的能量驱动碳水化合物和氨基酸等多种基础代谢,推测本研究中的粘液乳杆菌属同样发挥此作用[1];魏斯氏菌属发酵初始时相对丰度最高(48.91%),在H15时急剧下降至8.11%,此后该菌属呈连续下降趋势并伴有波动[25],同样,乳球菌属在发酵初期相对丰度也较高,可达26.91%,在发酵15 h时相对丰度也突然骤降,低至1.88%,这与ZHAO等[12]的研究结果较为相似,魏斯氏菌属、乳球菌属的相对丰度与粘液乳杆菌属呈反向变化,且有研究表明发酵初始存在于发酵体系中的魏斯氏菌属对白酒酿造过程有重要影响,其能够产生有机酸,从而抑制杂菌生长,其代谢产物促进发酵形成厌氧环境[26],随着发酵的进行,白酒的酸度、乙醇浓度增加,含氧量降低,魏斯氏菌属的生长受到抑制而逐渐衰亡,继而出现更耐酸、耐高浓度乙醇、耐低含氧量的乳酸菌完成后续发酵过程[27];值得注意的是,乳杆菌属在H0~D2相对丰度呈递减趋势(4.00%→0.64%),随着发酵的进行,在发酵第7天相对丰度达7.24%,此后在7.24%~17.99%的区间呈大幅递增趋势,推测可能是因为乳杆菌属兼性厌氧,有时微好氧,在有氧时生长差,随着发酵的进行,氧压降低,生长较好,经调研发现,乳杆菌属分类下的耐酸乳杆菌在白酒发酵中后期,同样保持相对较高的丰度,其对白酒发酵过程演替速率,风味物质代谢等方面均具有重要作用[28-29],故可推知,本文中的乳杆菌属同样会对岭南小曲白酒的发酵起到重要作用。
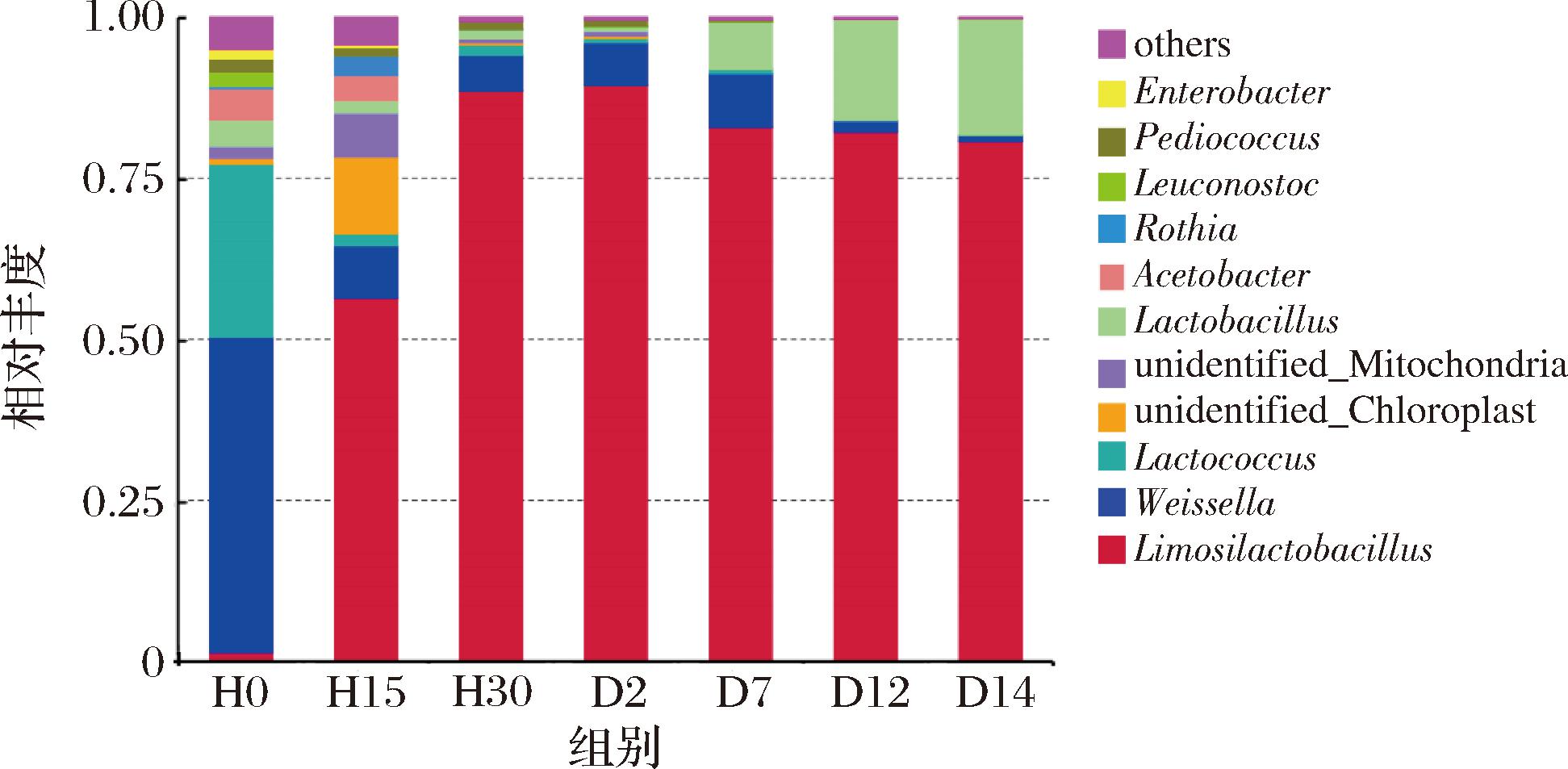
图4 岭南小曲白酒不同生产阶段细菌属水平群落组成
Fig.4 Community composition of bacterial genus at different production stages of Xiaoqu liquor from Lingnan region
3 结论与讨论
采用高通量测序,分析岭南特色小曲白酒醪的细菌群落演替规律,结果显示,本研究数据量合理,细菌丰富度整体呈下降趋势,细菌多样性呈先减后增的趋势;非加权配对算术平均法聚类树分析中,根据岭南小曲白酒7个样品间细菌群落组成的相似性和差异性,将白酒发酵过程分为发酵前期、发酵中期和发酵后期;根据韦恩图分析岭南小曲白酒的细菌群落分布可发现,属水平下的细菌物种数在逐渐减少,最终乳酸菌成为绝对优势的细菌;多样性分析中,在相对丰度≥1%的阈值下,细菌门包括厚壁菌门、变形菌门、蓝菌门、放线菌门,其中厚壁菌门为各个发酵时期的绝对优势菌门,发酵过程中变形菌门、蓝菌门和放线菌门的相对丰度变化趋势与厚壁菌门相反;细菌属包括粘液乳杆菌属、魏斯氏菌属、乳球菌属、乳杆菌属、醋酸杆菌属、罗斯氏菌属、明串球菌属、片球菌属、肠杆菌属,发酵0 h优势细菌属为魏斯氏菌,发酵初始高相对丰度的魏斯氏菌属因白酒的酸度、乙醇浓度增加,含氧量降低,生长受到抑制而逐渐衰亡;发酵15 h后的绝对优势菌属为粘液乳杆菌属直至发酵结束;乳杆菌属在发酵后期生长较好。
本文运用高通量测序技术对岭南小曲白酒醪的细菌菌群演替变化规律进行探究,阐明发酵时间对岭南小曲白酒醪细菌菌群结构的影响,为未来小曲白酒工艺优化、菌群调控以及品质提升等打下一定的理论基础。
[1] 桂江平. 江西米酒的加工工艺优化与产品风味分析[D].南昌:南昌大学, 2023.GUI J P.Processing optimization and product flavor analysis of Jiangxi rice wine[D].Nanchang:Nanchang University, 2023.
[2] 韩国强, 孙协平, 吴鹏飞, 等.基于高通量测序分析复配小曲白酒发酵过程中微生物群落结构及多样性[J].食品科学, 2021, 42(18):80-85.HAN G Q, SUN X P, WU P F, et al.High throughput sequencing-based analysis of microbial community structure and diversity during Baijiu fermentation with mixed-strain Xiaoqu[J].Food Science, 2021, 42(18):80-85.
[3] HU Y L, YANG Q, CHEN D, et al.Study on microbial communities and higher alcohol formations in the fermentation of Chinese Xiaoqu Baijiu produced by traditional and new mechanical technologies[J].Food Research International, 2021, 140:109876.
[4] TANG A X, PENG B Z.Diversifying the flavor of black rice wines through three different regional Xiaoqus in China and unraveling their core functional microorganisms[J].Foods, 2023, 12(19):3576.
[5] 李一川. 高质量小曲白酒的研究[D].武汉:湖北大学, 2014.LI Y C.The research of high quality of Xiaoqu liquor[D].Wuhan:Hubei University, 2014.
[6] 潘小卫. 加酶挤压高粱酿造小曲白酒的研究[D].无锡:江南大学, 2017.PAN X W.Study on enzymatic extrusion pretreatment of sorghum for xiaoqu liquor brewing[D].Wuxi:Jiangnan University, 2017.
[7] ![]() T, SALZBERG S L.FLASH:Fast length adjustment of short reads to improve genome assemblies[J].Bioinformatics, 2011, 27(21):2957-2963.
T, SALZBERG S L.FLASH:Fast length adjustment of short reads to improve genome assemblies[J].Bioinformatics, 2011, 27(21):2957-2963.
[8] BOKULICH N A, SUBRAMANIAN S, FAITH J J, et al.Quality-filtering vastly improves diversity estimates from Illumina amplicon sequencing[J].Nature Methods, 2013, 10(1):57-59.
[9] EDGAR R C, HAAS B J, CLEMENTE J C, et al.UCHIME improves sensitivity and speed of Chimera detection[J].Bioinformatics, 2011, 27(16):2194-2200.[10] WANG Y Y, GUO H, GAO X G, et al.The intratumor microbiota signatures associate with subtype, tumor stage, and survival status of esophageal carcinoma[J].Frontiers in Oncology, 2021, 11:754788.
[11] 王阿利, 王子谦, 魏梓晴, 等.酱油酿造中微生物群落演替及其空间异质性研究[J].中国食品学报, 2022, 22(12):257-266.WANG A L, WANG Z Q, WEI Z Q, et al.Studies on succession and spatial heterogeneity of microbial community during the soy sauce fermentation process[J].Journal of Chinese Institute of Food Science and Technology, 2022, 22(12):257-266.
[12] ZHAO W H, LIANG Z, QIAN M, et al.Evolution of microbial communities during fermentation of Chi-flavor type Baijiu as determined by high-throughput sequencing[J].LWT, 2022, 170:114102.
[13] LIANG H P, HE Z, WANG X Y, et al.Effects of salt concentration on microbial diversity and volatile compounds during Suancai fermentation[J].Food Microbiology, 2020, 91:103537.
[14] 张红霞, 徐岩, 杜海.酱香型白酒堆积发酵过程中真菌的结构及其来源分析[J].食品与发酵工业, 2024, 50(20):42-49.ZHANG H X, XU Y, DU H.Fungal community and sources of heap fermentation during Jiangxiangxing Baijiu production[J].Food and Fermentation Industries, 2024, 50(20):42-49.
[15] 崔海灏. 十里香酒产酯酵母的筛选及应用研究[D].保定:河北大学, 2020.CUI H H.A study on the screening and application of ester-producing yeast from Shilixiang[D].Baoding:Hebei University, 2020.
[16] BACKELJAU T, DE BRUYN L, DE WOLF H, et al.Multiple UPGMA and neighbor-joining trees and the performance of some computer packages[J].Molecular Biology and Evolution, 1996, 13(2):309.
[17] WU Q, XU Y, CHEN L.Diversity of yeast species during fermentative process contributing to Chinese Maotai-flavour liquor making[J].Letters in Applied Microbiology, 2012, 55(4):301-307.
[18] 林麟. 酒醅中耐酸乳杆菌的代谢特征及生物安全性系统评估[D].无锡:江南大学, 2022.LIN L.Metabolic characteristics and biosafety evaluation of Lactobacillus acetotolerans in fermented grains[D].Wuxi:Jiangnan University, 2022.
[19] 万兵. 酱香型白酒酿造过程中酿酒酵母和面包乳杆菌交互作用机制解析[D].无锡:江南大学, 2023.WAN B.Interaction mechanism analysis of Saccharomyces cerevisiae and Lactobacillus panis during the brewing process of Jiang-flavor liquor[D].Wuxi:Jiangnan University, 2023.
[20] WANG Q, WANG C Y, XIANG X Q, et al.Analysis of microbial diversity and succession during Xiaoqu Baijiu fermentation using high-throughput sequencing technology[J].Engineering in Life Sciences, 2022, 22(7):495-504.
[21] 张子洋. 酱香型白酒发酵微生物的流式分析[D].济南:齐鲁工业大学, 2023.ZHANG Z Y.Analysis of microorganisms in the fermentation process of sauce-flavor baijiu by flow cytometry[D].Jinan:Qilu University of Technology, 2023.
[22] 高俊杰. 浓香型酒醅发酵过程中挥发性风味物质及细菌菌群结构的动态变化研究[D].济南:齐鲁工业大学, 2023.GAO J J.Study on the dynamic changes of volatile flavor substances and bacterial community structure in fermented grains of Chinese strong-flavor Baijiu[D].Jinan:Qilu University of Technology, 2023.
[23] ZHENG J S, WITTOUCK S, SALVETTI E, et al.A taxonomic note on the genus Lactobacillus:Description of 23 novel genera, emended description of the genus Lactobacillus Beijerinck 1901, and union of Lactobacillaceae and Leuconostocaceae[J].International Journal of Systematic and Evolutionary Microbiology, 2020, 70(4):2782-2858.
[24] LIU W H, CHAI L J, WANG H M, et al.Bacteria and filamentous fungi running a relay race in Daqu fermentation enable macromolecular degradation and flavor substance formation[J].International Journal of Food Microbiology, 2023, 390:110118.
[25] 邱显平, 黄桥, 杨静, 等.浓香型白酒在新、老窖池发酵过程中酒醅微生物群落结构差异分析[J].中国酿造, 2024, 43(1):50-56.QIU X P, HUANG Q, YANG J, et al.Differences of microbial community structure in fermented grains during strong-flavor Baijiu fermentationin new and old pits[J].China Brewing, 2024, 43(1):50-56.
[26] 邢敏钰, 杜海, 徐岩.芝麻香型白酒发酵过程中乳酸菌多样性及其演替规律[J].微生物学通报, 2018, 45(1):19-28.XING M Y, DU H, XU Y.Diversity and succession of lactic acid bacteria during sesame-flavor liquor fermentation[J].Microbiology China, 2018, 45(1):19-28.
[27] 朱孔亮. 泡菜用乳酸菌的筛选、高密度培养及菌剂配方的研究[D].无锡:江南大学, 2014.ZHU K L.Research on screening, high cell density cultivation and mixture of lactic acid bacteria for pickle fermentation[D].Wuxi:Jiangnan University, 2014.
[28] PANG X N, HAN B Z, HUANG X N, et al.Effect of the environment microbiota on the flavour of light flavour Baijiu during spontaneous fermentation[J].Scientific Reports, 2018, 8:3396.
[29] WANG S L, WU Q, NIE Y, et al.Construction of synthetic microbiota for reproducible flavor compound metabolism in Chinese light-aroma-type liquor produced by solid-state fermentation[J].Applied and Environmental Microbiology, 2019, 85(10):e03090-18.