杂环胺(heterocyclic aromatic amines,HAAs)是一类在高蛋白质食品(如肉类和鱼类)加热过程中自然形成的潜在致癌物,其摄入与直结肠癌等疾病风险显著相关[1]。研究表明,杂环胺的生成与美拉德反应、氨基酸及肌酐等前体物质的相互作用密切相关,尤其是在油炸、烧烤等烹饪方式下,其含量可增加数倍[2]。当前,我国油炸猪肉制品(如酥肉)消费量持续攀升,但其加工过程中杂环胺的高生成量已成为食品安全领域重要隐患[3-4]。因此,探究杂环胺的生成机制并开发有效的抑制策略,对保障公众健康具有重要的现实意义。
在复杂的肉类基质中,杂环胺的形成涉及多前体、多路径的并发反应,使得关键前体的作用机制难以精准解析[5]。因此,化学模拟体系被广泛用于简化变量,通过控制单一前体(氨基酸、糖类)探究体外杂环胺的形成[6]。现有研究已经表明,2-氨基-3,4-二甲基-咪唑并[4,5-f]-喹啉(2-amino-3,4-dimethyl-imidazo[4,5-f]-quinoline,MeIQ)、2-氨基-3,4,8-三甲基-咪唑并[4,5-f]-喹喔啉(2-amino-3,4,8-trimethyl-imidazo[4,5-f]-quinoxaline,4,8-DiMeIQx)等喹(喔)啉类(IQ类)杂环胺具有相似的生成途径,肌酸/肌酸酐、糖类和氨基酸是其主要反应前体[7]。β-咔啉类杂环胺[9H-吡啶并[3,4-b]吲哚(9H-pyrido[3,4-b]indole,Norharman)和1-甲基-9H-吡啶[3,4-b]吲哚(1-methyl-9H-pyrido[3,4-b]indole,Harman)]主要通过色氨酸(tryptophan,trp)分子的热解形成,也能通过美拉德反应产生的活性羰基化合物和自由基等中间产物与其他含氮化合物反应产生[8-10]。通常建立氨基酸模拟体系研究杂环胺的生成机制,其中苏氨酸是IQ类杂环胺生成的重要前体氨基酸,在模拟体系中常用于抑制作用研究。
本课题组在前期的研究中发现,油炸温度、时间以及前体氨基酸(苏氨酸)与油炸猪里脊中杂环胺生成显著相关,并且天冬氨酸和谷氨酸在生肉里的含量最高,但经过油炸之后含量显著降低,可能与油炸猪里脊的杂环胺生成相关[4]。基于此,本研究以苏氨酸为核心前体构建氨基酸模拟模型,系统探究了温度、时间以及非前体氨基酸(天冬氨酸和谷氨酸)对苏氨酸模拟体系中杂环胺生成的调控效应。进一步通过油脂—苏氨酸模拟体系确定油脂对杂环胺的形成作用,并探究了多酚类物质在苏氨酸模拟体系中对杂环胺生成的影响,旨在为食品加工中杂环胺的调控提供理论依据。
1 材料与方法
1.1 材料与试剂
三元杂交猪里脊肉(7~9月龄,宰后排酸成熟12 h),重庆市北碚区天生丽街超市,并置于4 ℃冰箱待用。
蒸馏水;菜籽油,四川省天府好粮油有限公司;乙腈、甲醇、无水硫酸镁,阿拉丁生化科技股份有限公司;冰乙酸,上海麦克林生化科技股份有限公司;无水醋酸钠,上海贤鼎生物科技有限公司;乙酸铵、芦丁、肌酸、葡萄糖、氨基酸(天冬氨酸、苏氨酸和谷氨酸),上海源叶生物科技有限公司;肌酐,山东西亚化学有限公司;没食子酸,天津希恩斯奥普德科技有限公司;13种杂环胺混标:2-氨基二吡啶并[1,2-a:3′,2′-d]咪唑(2-aminodipyrido[1,2-a:3′,2′-d]imidazole,GIu-P-2)、2-氨基-3-甲基-咪唑并[4,5-f]-喹喔啉(2-amino-3-methyl-imidazo[4,5-f]-quinoxaline,IQx)、2-氨基-3,4-二甲基-咪唑并[4,5-f]-喹啉(2-amino-3,4-dimethyl-imidazo[4,5-f]-quinoline,MeIQ)、2-氨基-6-甲基二吡啶并[1,2-a:3′,2′-d]咪唑(2-amino-6-methyldipyrido[1,2-a:3′,2′-d]imidazole,GIu-P-1)、2-氨基-3,8-二甲基咪唑并[4,5-f]-喹喔啉(2-amino-3,8-dimethylimidazo[4,5-f]-quinoxaline,8-MeIQx)、Norharman、2-氨基-3,4,8-三甲基-咪唑并[4,5-f]-喹喔啉(2-amino-3,4,8-trimethyl-imidazo[4,5-f]-quinoxaline,4,8-DiMeIQx)、2-氨基-3,7,8-三甲基-咪唑并[4,5-f]- 喹喔啉(2-amino-3,7,8-trimethyl-imidazo[4,5-f]-quinoxaline,7,8-DiMeIQx)、Harman、2-氨基-3,4,7,8-四甲基-3H-咪唑[4,5-f]-喹喔啉(2-amino-3,4,7,8-tetramethyl-3H-imidazo[4,5-f]-quinoxaline,4,7,8-TriMeIQx)、2-氨基-1-甲基-6-苯基咪唑并[4,5-b]-吡啶(2-amino-1-methyl-6-phenylimidazo[4,5-b]-pyridine,PhIP)、2-氨基-9H-吡啶并[2,3-b]吲哚(2-amino-9H-pyrido[2,3-b]indole,AαC)、3-氨基-1,4-二甲基-5H-吡啶并[4,3-b]吲哚(3-amino-1,4-dimethyl-5H-pyrido[4,3-b]indole,Trp-P-1),天津阿尔塔科技有限公司。
1.2 仪器与设备
DF-101S集热式恒温加热磁力搅拌器,郑州科丰仪器设备有限公司;Syergy-HT多功能酶标仪,美国Bio Tek公司;LCMS-8060 NX010502超高效液相色谱-三重四极杆质谱联用仪,日本岛津公司;KQ5200D数控超声波清洗器,昆山市超声仪器有限公司;QL-901涡旋振荡器,海门市其林贝尔仪器制造有限公司。
1.3 实验方法
1.3.1 样品制备
1.3.1.1 氨基酸模拟体系的建立
模拟体系的建立参考文献[11]并适当修改,具体方法如下:分别称取葡萄糖、肌酸、肌酐、天冬氨酸、苏氨酸、谷氨酸加入含有10 mL pH值为6.8的磷酸盐缓冲溶液的耐压瓶中构建模拟体系。模拟体系中选择的氨基酸、肌酸、肌酐和葡萄糖浓度是基于其猪里脊中的实际比例,并适当放大了它们的浓度,以更好地评估最终杂环胺生成量。将耐压瓶置于170 ℃油浴锅中加热10 min后立即冰浴终止反应,将反应液置于-80 ℃保存待测,模拟体系中各类物质的组成和含量如表1所示。
表1 氨基酸模拟体系的组成 单位:mmol/L
Table 1 Composition of the amino acid model system
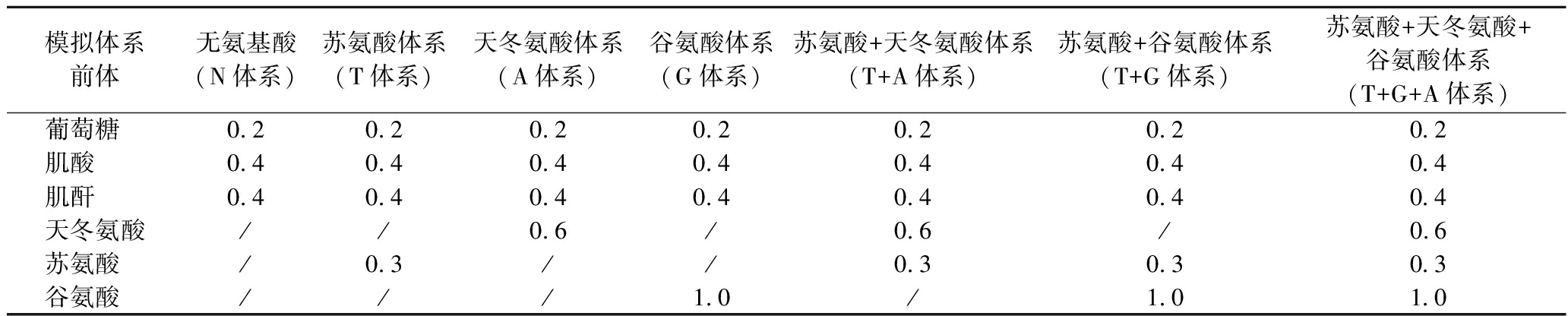
模拟体系前体无氨基酸(N体系)苏氨酸体系(T体系)天冬氨酸体系(A体系)谷氨酸体系(G体系)苏氨酸+天冬氨酸体系(T+A体系)苏氨酸+谷氨酸体系(T+G体系)苏氨酸+天冬氨酸+谷氨酸体系(T+G+A体系)葡萄糖 0.20.20.20.20.20.20.2肌酸 0.40.40.40.40.40.40.4肌酐 0.40.40.40.40.40.40.4天冬氨酸//0.6/0.6/0.6苏氨酸 /0.3//0.30.30.3谷氨酸 ///1.0/1.01.0
注:/表示添加量为0(下同)。
1.3.1.2 苏氨酸模拟体系的建立
油脂—苏氨酸模拟体系:参考1.3.1.1节,用菜籽油替换磷酸盐缓冲溶液,并添加葡萄糖、肌酸、肌酐和苏氨酸;多酚—苏氨酸模拟体系:在苏氨酸模拟体系中分别加入芦丁和没食子酸。添加量如表2所示。
表2 苏氨酸模拟体系的组成 单位:mmol/L
Table 2 Composition of the threonine analogue system
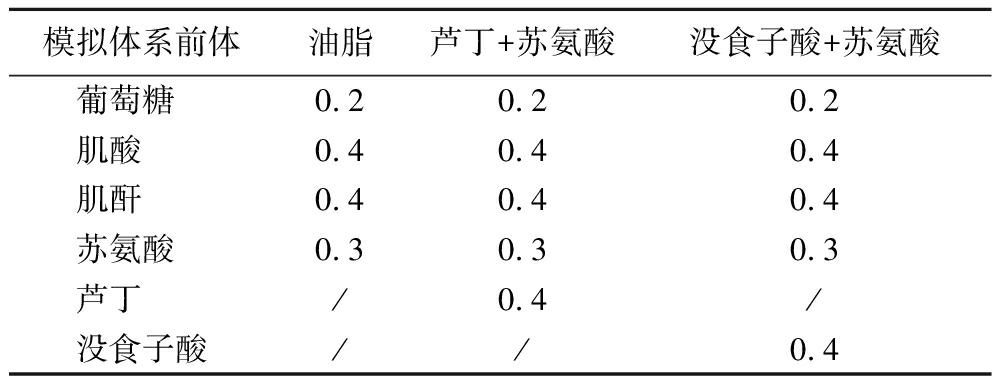
模拟体系前体油脂芦丁+苏氨酸没食子酸+苏氨酸葡萄糖 0.20.20.2肌酸 0.40.40.4肌酐 0.40.40.4苏氨酸 0.30.30.3芦丁 /0.4/没食子酸//0.4
1.3.2 杂环胺的检测
1.3.2.1 模拟体系杂环胺的提取
吸取反应液2 mL于离心管中,加入100 μL 2 mol/L NaOH溶液,混匀后加入5 mL乙酸乙酯涡旋30 s,超声20 min后吸取乙酸乙酯层,重复3次,合并提取液,加入0.3 g乙二胺-N-丙基硅烷(primary-secondary amine,PSA),0.3 g C18,涡旋后离心(1 000 r/min,5 min),取上清液5 mL于50 ℃氮吹。
1.3.2.2 杂环胺的检测
参考NY/T 3904—2021《肉及肉制品中杂环胺检测 液相色谱-串联质谱法》进行。称取试样2 g(精确到0.000 1 g)放入50 mL离心管中,加入陶瓷均质子和10 mL超纯水,立即涡旋1 min后加入10 mL 1%(体积分数)乙酸-乙腈溶液,涡旋5 min,室温下超声30 min提取。加入4 g无水硫酸镁,1 g无水醋酸钠,涡旋混合1 min。混合物在4 ℃,10 000 r/min下离心10 min,取上层有机溶液6 mL移入15 mL离心管中,加入0.9 g MgSO4、0.3 g PSA和0.3 g End Capped-C-18EC固相萃取填料后2 800 r/min均质1 min。再离心5 min(4 ℃,10 000 r/min);取上清液1 mL,30 ℃氮吹,在干物质中加入0.50 mL甲醇复溶,涡旋溶解。通过0.22 μm聚偏氟乙烯(polyvinylidene fluoride,PVDF)过滤膜过滤,得到的溶液用于UHPLC-MS/MS分析。
液相色谱条件:色谱柱,Zorbax SB-C18(2.1 mm×50 mm, 1.8 μm);流动相,A为乙酸-乙酸铵缓冲液,B为乙腈;梯度洗脱程序:0~0.5 min为95%~95% A,0.5~5 min为95%~85% A,5~7 min为85%~73% A,7~8 min为73%~45% A,8~8.5 min为45%~73% A,8.5~9 min为73%~95% A,9~10 min为95%~95% A;流速:0.4 mL/min;柱温:30 ℃;进样量:2.0 μL。质谱条件为:采用电喷雾离子源,正离子模式(ESI+)进行电离和多反应监测进行质谱数据采集。ESI+参数如下:干燥气温度,200 ℃;干燥气流量,10 L/min;雾化气压力,40 V;鞘气温度,260 ℃;鞘气流量,11 L/min;毛细管电压,正电压4 000 V,喷嘴电压,正电压0 V。
1.3.3 模拟体系褐变程度及中间体物质检测
参考QUAN等[11]的检测方法。取出一定量的模拟体系反应液并稀释,分别在420 nm和294 nm波长处测定吸光度,其中420 nm处吸光值用来表征模拟体系的褐色产物类黑精,294 nm处吸光值用于表征中间产物的量。
1.4 数据分析
数据采用SPSS 26,IBM公司,单因素方差分析(one-way analysis of variance,ANOVA)进行分析。经Tukey检验,差异有统计学意义(P<0.05)。结果以“平均值±标准差”表示。采用Origin 2021 Pro、Prism 9.0,绘图。
2 结果与分析
2.1 时间和温度对苏氨酸模拟体系的影响
2.1.1 时间对苏氨酸模拟体系杂环胺含量的影响
如图1所示,根据猪里脊样品中肌酸、肌酐和葡萄糖的比例构建的苏氨酸模拟体系中,生成的杂环胺主要是IQ类杂环胺和β-咔啉类杂环胺,且加热时间过长MeIQ和Harman会发生不同程度的降解。具体而言,IQx的生成量最大,其在1~3 min内快速生成,随后在3~5 min内生成速率减缓。Norharman 生成量次之,从2 min时开始生成,且初始生成速度就达到最大,随后逐渐放缓。MeIQ在2~3 min内开始生成,在3~4 min时发生部分降解,而在4~5 min时含量保持稳定,这表明此段时间内,MeIQ的生成反应和降解反应可能达到了动态平衡。4,8-DiMeIQx的含量经历了上升下降再上升3个阶段,但含量始终处于较低水平,与MeIQ含量相当。8-MeIQx生成速度随时间延长而加快,生成量也随之增加。Harman在2 min 时含量迅速升高,在2~3 min时达到平台期,生成和降解速率相当,在3~4 min内,Harman含量短暂上升至最大值后,在4~5 min内迅速下降,这表明Harman可能参与了其他反应[12]。
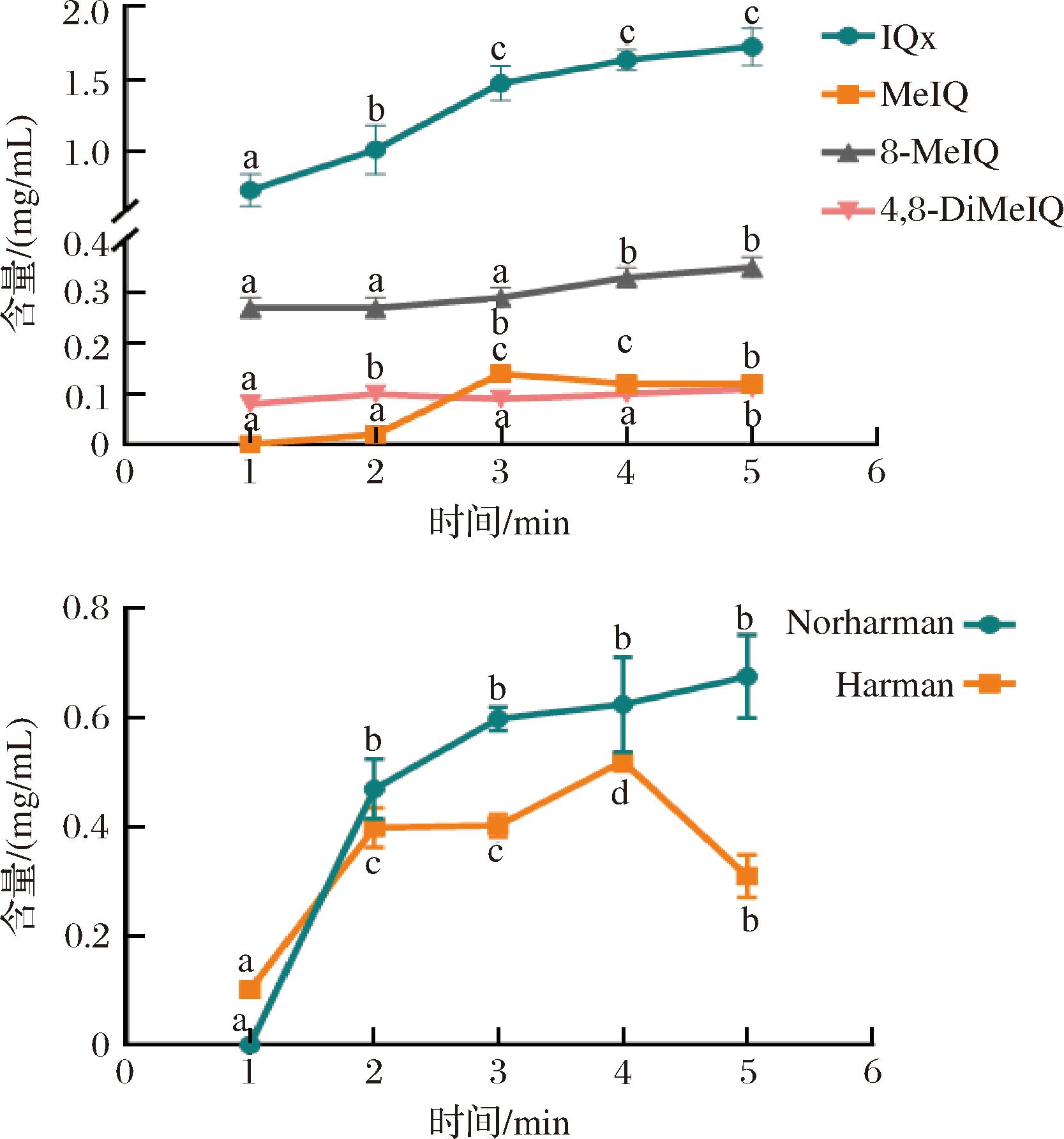
a-IQ类杂环胺含量;b-β-咔啉类杂环胺含量
图1 不同时间下苏氨酸模拟体系中IQ类和β-咔啉类杂环胺含量的变化
Fig.1 Changes in the content of IQ and β-carbaline HAAs in threonine simulation systems at different times
注:不同字母表示差异显著(P<0.05)(下同)。
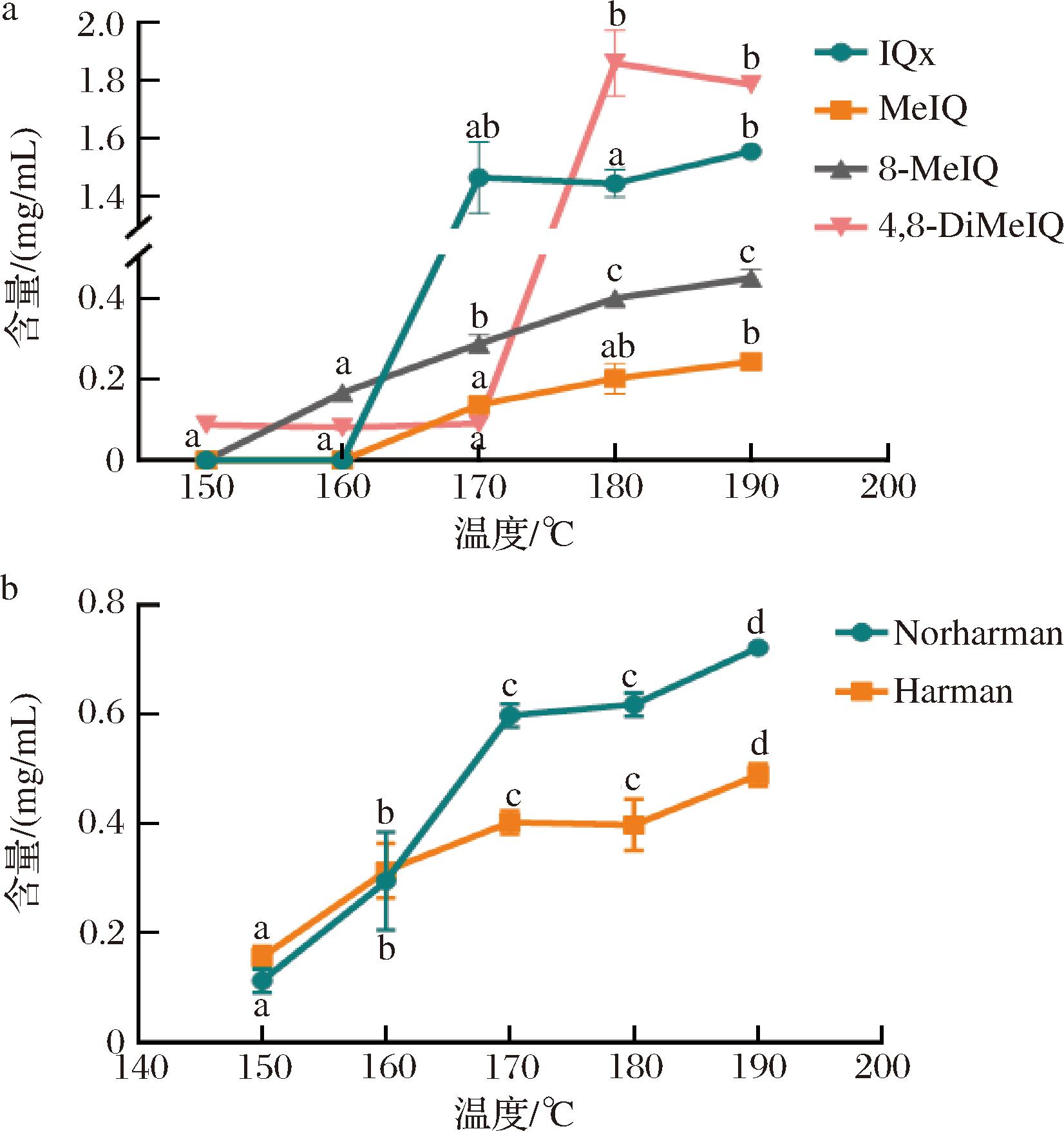
a-IQ类杂环胺含量;b-β-咔啉类杂环胺含量
图2 不同温度下苏氨酸模拟体系中IQ类和β-咔啉类杂环胺含量的变化
Fig.2 Changes in the content of IQ and β-carbaline HAAs in threonine simulation systems at different temperatures
2.1.2 温度对苏氨酸模拟体系杂环胺含量的影响
温度对模拟体系中杂环胺的生成反应影响显著大于时间,其结果如图2所示。5种杂环胺的含量均随温度升高而增加,但4,8-DiMeIQx在190 ℃时含量有所降低。其中,8-MeIQx和MeIQ对温度的敏感性不高,而IQx,4,8-DiMeIQx以及β-咔啉类杂环胺对温度的敏感性较高,在较低温度下就达到了较高的生成速率[13-14]。在170~180 ℃ IQx生成量存在一段平台期,而4,8-DiMeIQx生成量显著增加。这是因为它们同属于一类杂环胺,生成途径相似,可能存在竞争关系。此外Norharman和Harman 在160 ℃之前生成速率相同,而在160 ℃后,Harman的生成速度慢于Norharman,但未见平台期,仍保持增长趋势,进一步说明,β-咔啉类杂环胺生成途径更多,两者不易因为前体物质而产生竞争[15]。
2.1.3 温度和时间对苏氨酸模拟体系中间产物和褐变程度的变化
在模拟体系中,美拉德反应会产生无色、无荧光的中间产物(糖、醛和二羰基化合物),这些中间产物的累积量可以通过294 nm波长处的吸光度反映[16],这些中间产物不仅是美拉德反应的产物,也是杂环胺生成的前体物质和中间体物质。同样,美拉德反应产生的类黑精的累积量可通过420 nm处的吸光度表征[11]。由图3可知,在反应温度和时间影响下,苏氨酸模拟体系在294 nm波长处的吸光度呈现出升高的趋势,表明中间产物大量生成,然而,在温度的影响下,苏氨酸模拟体系在420 nm波长处虽然吸光度略微上升但褐变程度差异不显著(P<0.05)。这表明,尽管温度和时间的延长促进了中间产物的生成,进而影响了杂环胺的生成,但温度对褐变程度的影响相对较小,这可能与美拉德反应的复杂性有关[17]。
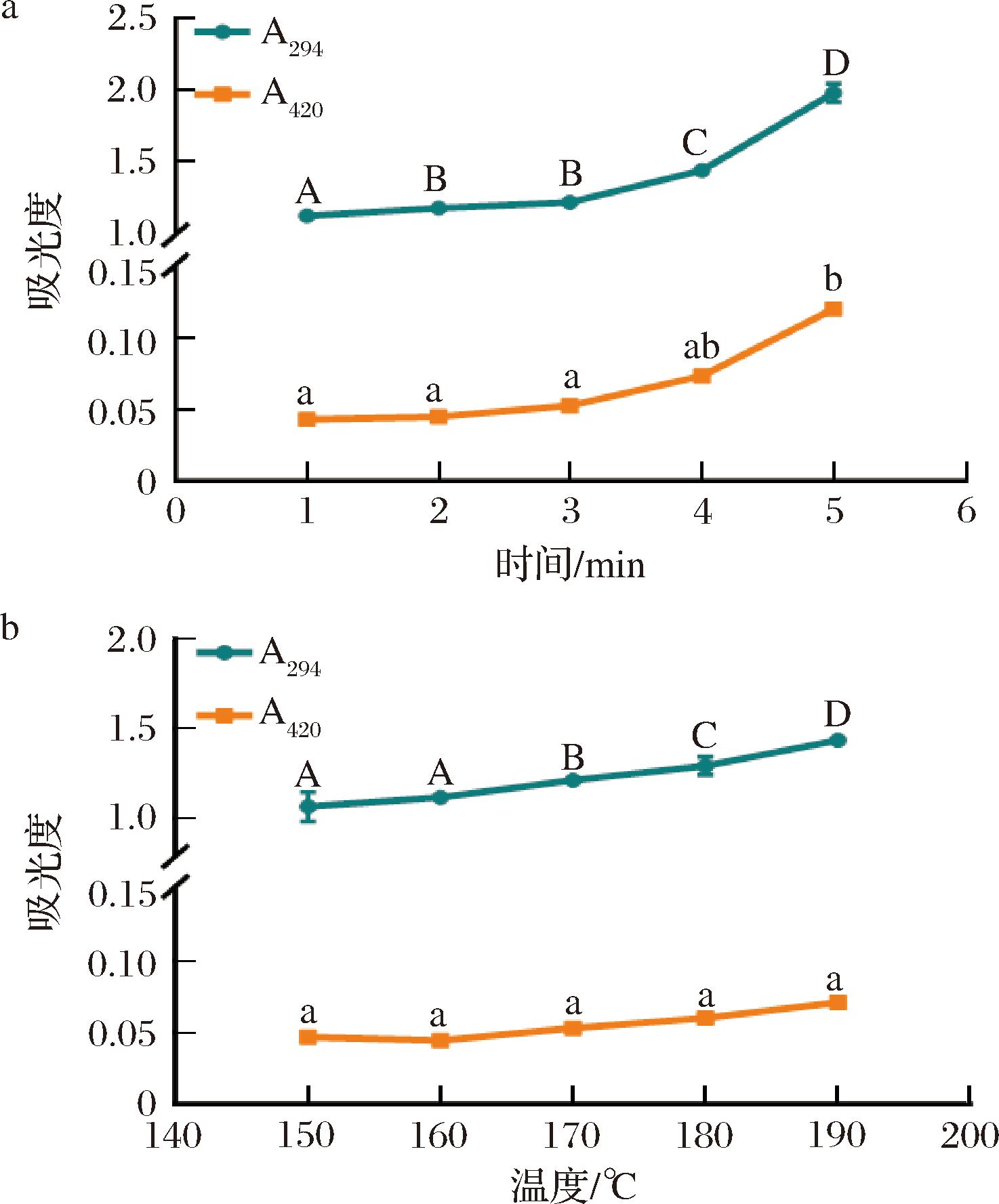
a-不同时间;b-不同温度
图3 不同时间和温度下苏氨酸模拟体系美拉德反应产物中间产物及褐变程度的变化
Fig.3 Changes in non-fluorescent intermediate products and browning degree of threonine model system at different time and temperatures
2.2 加热对非前体氨基酸模拟体系的影响
2.2.1 非前体氨基酸对模拟体系中杂环胺含量的影响
如表3所示,在170 ℃下加热10 min后,未添加氨基酸的模拟体系生成了IQx、MeIQ、Norharman、4,8-DiMeIQx和Harman 5种杂环胺;当加入苏氨酸后,其与IQx的生成反应竞争,优先产生β-咔啉类杂环胺,Norharman和Harman的生成量显著增加,分别是对照模拟体系的9.45和17倍,这可能是苏氨酸能促进美拉德反应的中间产物转变为β-咔啉类杂环胺造成的[9-10]。在缺乏其他前体氨基酸的情况下,苏氨酸还能促进新的IQx型杂环胺(4,7,8-TeiMeIQx)的生成。相比之下,加入天冬氨酸后,5种杂环胺的生成均受到抑制,仅检测到少量的4,8-DiMeIQx,谷氨酸也表现出类似的抑制能力,但对Norharman的抑制能力较弱。
表3 氨基酸模拟体系中杂环胺含量的影响
Table 3 Effect of amino acids on heterocyclic aromatic amines in model system
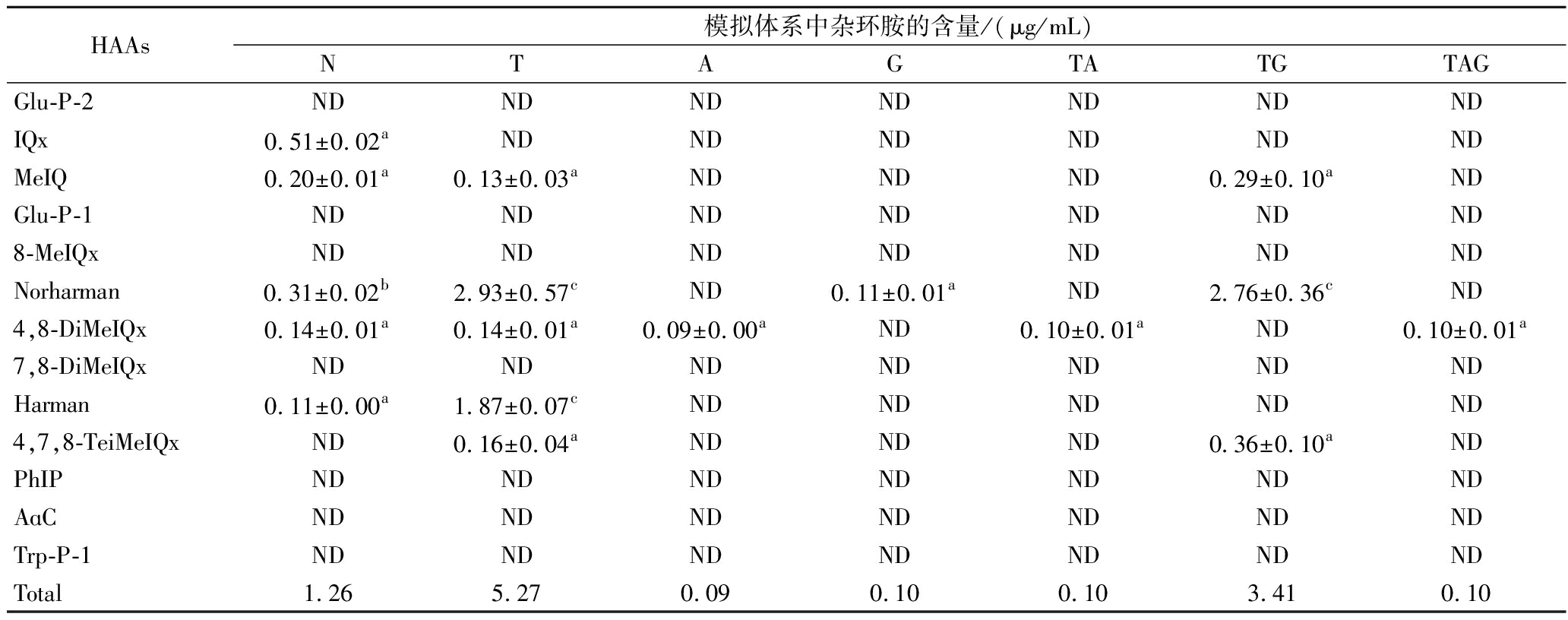
HAAs模拟体系中杂环胺的含量/(μg/mL)NTAGTATGTAGGlu-P-2NDNDNDNDNDNDNDIQx0.51±0.02aNDNDNDNDNDNDMeIQ0.20±0.01a0.13±0.03aNDNDND0.29±0.10aNDGlu-P-1NDNDNDNDNDNDND8-MeIQxNDNDNDNDNDNDNDNorharman0.31±0.02b2.93±0.57cND0.11±0.01aND2.76±0.36cND4,8-DiMeIQx0.14±0.01a0.14±0.01a0.09±0.00aND0.10±0.01aND0.10±0.01a7,8-DiMeIQxNDNDNDNDNDNDNDHarman0.11±0.00a1.87±0.07cNDNDNDNDND4,7,8-TeiMeIQxND0.16±0.04aNDNDND0.36±0.10aNDPhIPNDNDNDNDNDNDNDAɑCNDNDNDNDNDNDNDTrp-P-1NDNDNDNDNDNDNDTotal1.265.270.090.100.103.410.10
注:ND代表未检测到杂环胺含量。
将天冬氨酸加入苏氨酸模拟体系后,天冬氨酸对MeIQ、Harman、Norharman和4,7,8-TeiMeIQx的生成产生抑制效果,与单独添加天冬氨酸时的抑制效果相同。然而,将谷氨酸加入苏氨酸模拟体系后,谷氨酸对MeIQ、Norharman和4,7,8-TeiMeIQx的生成并无抑制作用,甚至可能参与了4,7,8-TeiMeIQx的生成反应。同时加入3种氨基酸后仅生成4,8-DiMeIQx。此外,DENG等[18]发现组氨酸-脯氨酸组合可以有效地抑制PhIP的形成,半胱氨酸-组氨酸-脯氨酸-脯氨酸组合对MeIQx的形成表现出优异的抑制作用,这些氨基酸组合可以通过清除这些杂环胺的中间体,从而中断它们与肌酐的反应。但总体来看,4,8-DiMeIQx的生成量没有显著变化(P<0.05),可能是4,8-DiMeIQx的生成途径与苏氨酸、天冬氨酸和谷氨酸无关。
除了已知的肌酐、葡萄糖、氨基酸参与合成IQ型杂环胺途径外[19],实验发现没有氨基酸的情况下,模拟体系中也能产生IQ型杂环胺,根据已发现的氨基酸参与的合成途径,推测在模拟体系中葡萄糖作为一种醛糖,含有一个醛基,且醛基具有反应活性(银镜反应),替代氨基酸提供醛基参与生成杂环胺,具体反应方程如图4所示。
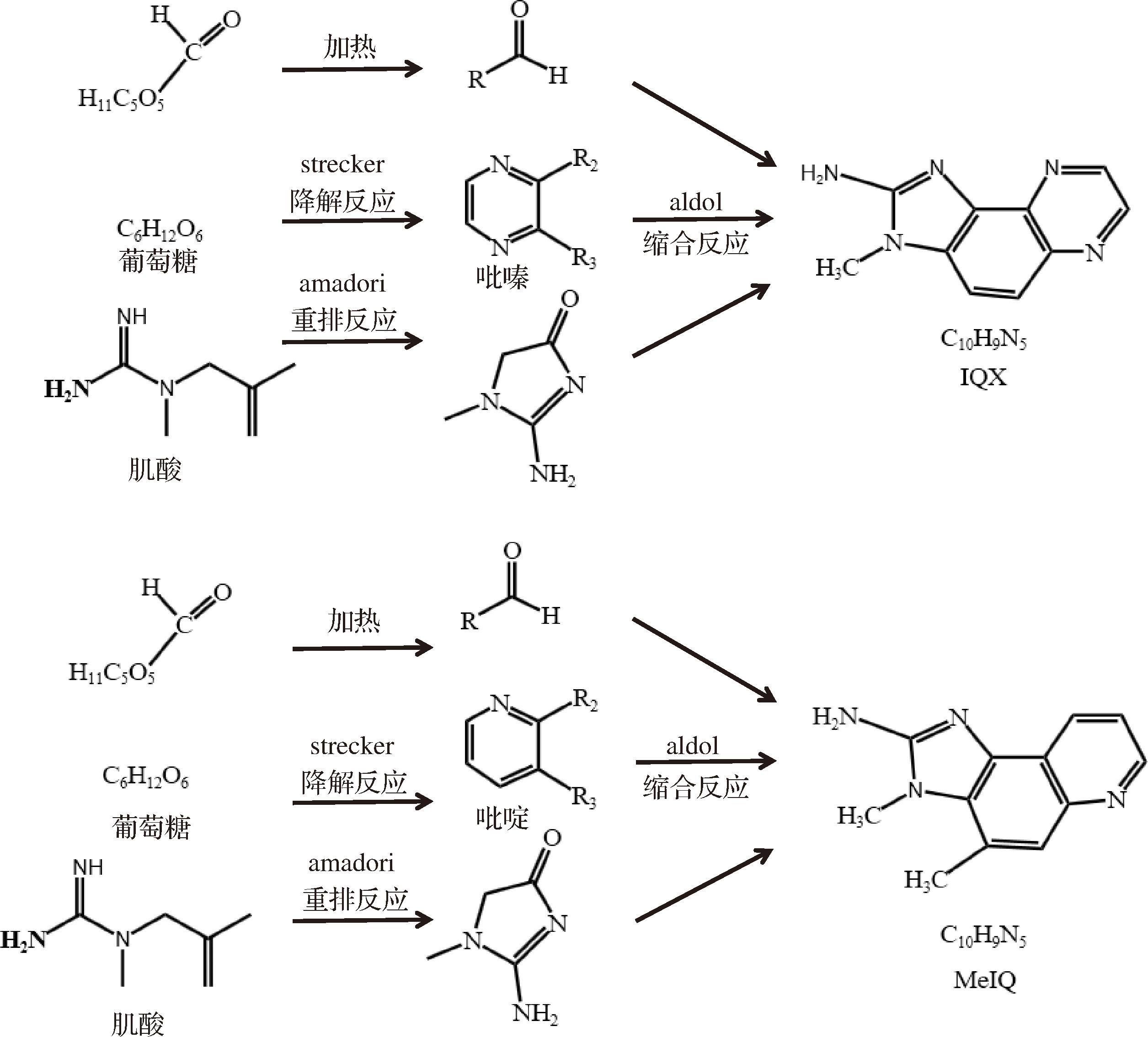
图4 IQx、MeIQ生成途径
Fig.4 Postulated pathways for the formation of HAAs
2.2.2 氨基酸种类对苏氨酸模拟体系中间产物和褐变程度的变化
由图5可知,在170 ℃下加热10 min后,TGA模拟体系(苏氨酸、天冬氨酸和谷氨酸组合)在294 nm和420 nm波长处的吸光度最高,表明该体系中中间产物和类黑精的生成量较多。然而,实验结果表明该体系生成的杂环胺较少。这可能是由于氨基酸更多地参与了风味物质的合成,从而抑制了杂环胺的生成[20]。相比之下,TA模拟体系(苏氨酸和天冬氨酸)的吸光度次之。在仅添加一种氨基酸的情况下,苏氨酸体系反应最为彻底,表明中间产物生成量最多,对应表3中杂环胺产生的量也最多。与对照相比,加入天冬氨酸后,吸光度反而减少,说明天冬氨酸在一定程度上抑制了美拉德反应,减少了中间产物的生成,同时生成的杂环胺也较少。
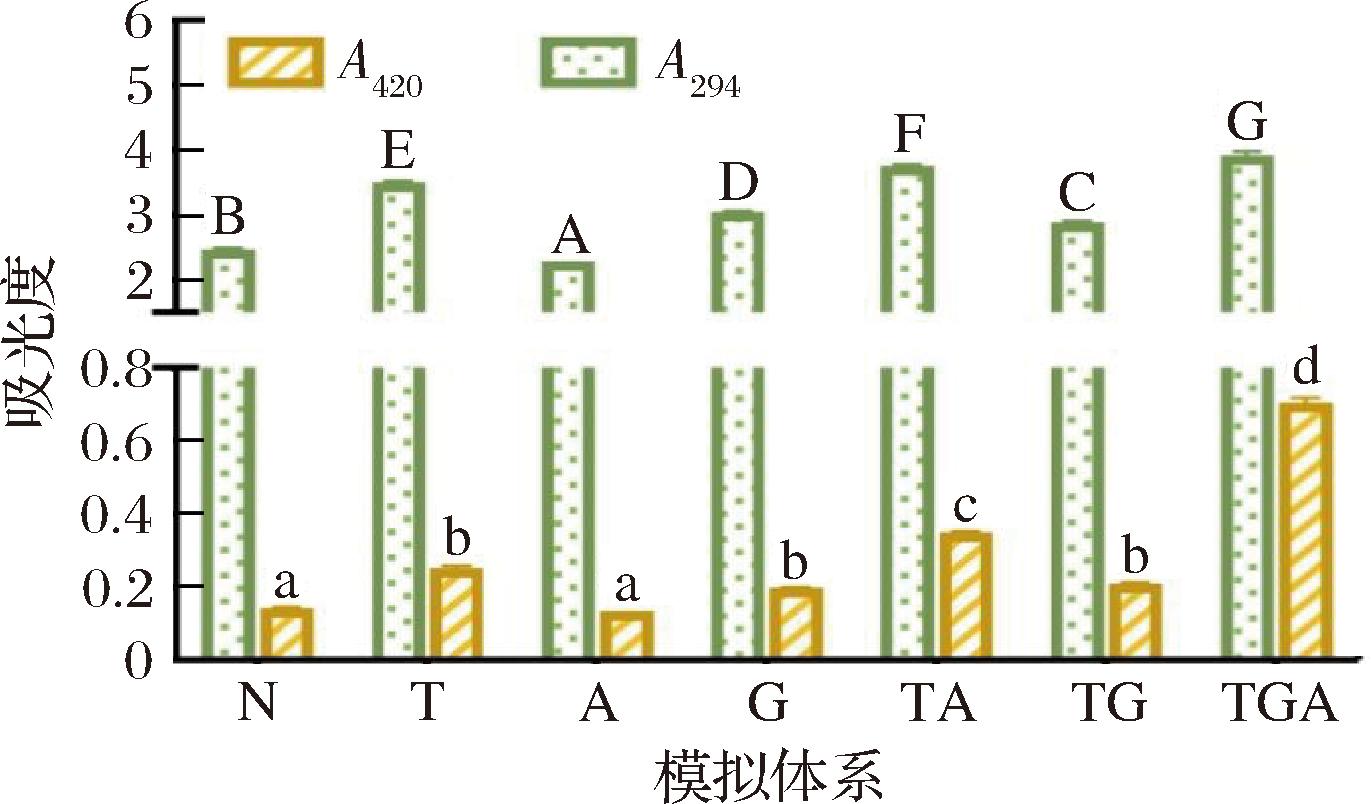
图5 不同氨基酸添加种类苏氨酸模拟体系美拉德反应产物中间产物及褐变程度的变化
Fig.5 Changes in non-fluorescent intermediate products and browning degree of model system
2.2.3 油脂对模拟体系杂环胺生成的影响
大多数学者认为脂质氧化产生的自由基能促进杂环胺的生成[21-22]。在高温油炸过程中,油脂与氧气接触,引发一系列反应,包括水解、氧化、聚合和异构化等,这些反应不仅影响油炸食品和油炸油的质量,还会导致油脂的劣变。而劣变过程产生的自由基又能催化杂环胺的形成的缩合反应,促进杂环胺的形成。为了探究菜籽油对杂环胺含量的影响,本研究建立了模拟体系。如图6所示,菜籽油显著促进了MeIQ、Norharman和Trp-p-1的生成,其中MeIQ和Norharman的形成量增加1倍,但抑制了4,8-DiMeIQx、Harman的生成。这可能是在自由基的存在下,Trp-p-1的生成反应被优先进行,且Trp-p-1的生成途径可能与4,7,8-TeiMeIQx存在竞争关系,从而导致菜籽油组的4,7,8-TeiMeIQx含量低于检测限。因此采用油炸方式烹饪食物比其他温和烹饪方式(如水煮)更能促进杂环胺的生成[23]。
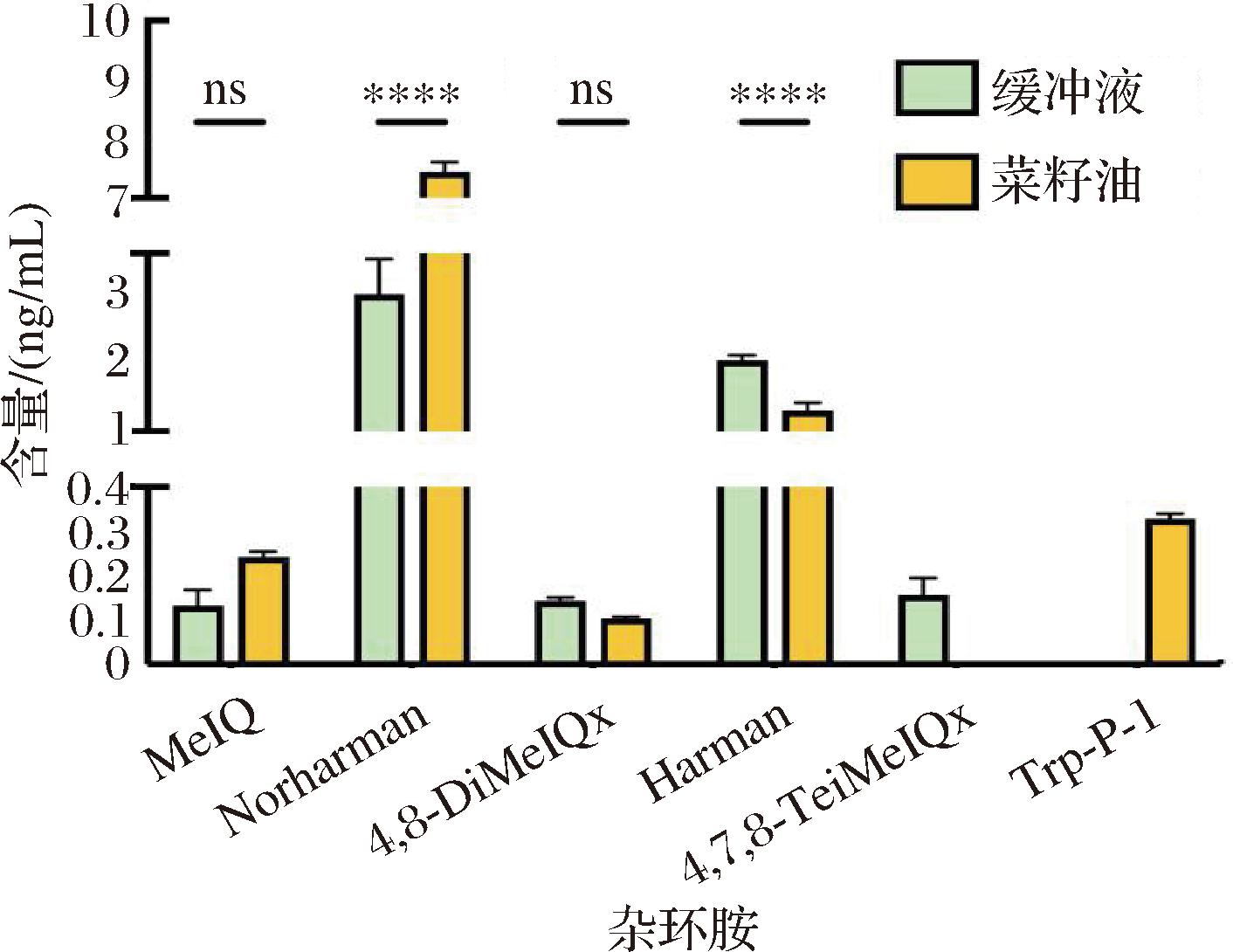
图6 油脂对模拟体系杂环胺含量的影响
Fig.6 Effect of oil on heterocyclic aromatic amines in model system
注:ns表示不显著;****表示P<0.000 1。
2.2.4 多酚对模拟体系的影响
为了探究外源活性物质对杂环胺生成的抑制效果,在模拟体系分别添加没食子酸和芦丁标准品,其中没食子酸属于多酚中的酚酸类,芦丁属于多酚中的黄酮类。探究其对杂环胺生成的影响。由图7可知,两者都展现出明显的抑制效果,其中没食子酸的抑制效果更强,仅检测到少量的MeIQ生成。但添加芦丁后仍检测到Norharman和Harman两种杂环胺的生成。这可能是多酚类物质通过清除自由基或者抑制美拉德中间体生成从而达到抑制杂环胺生成[24]。同时也表明,添加富含多酚的物质有助于抑制油炸猪里脊中杂环胺的生成。
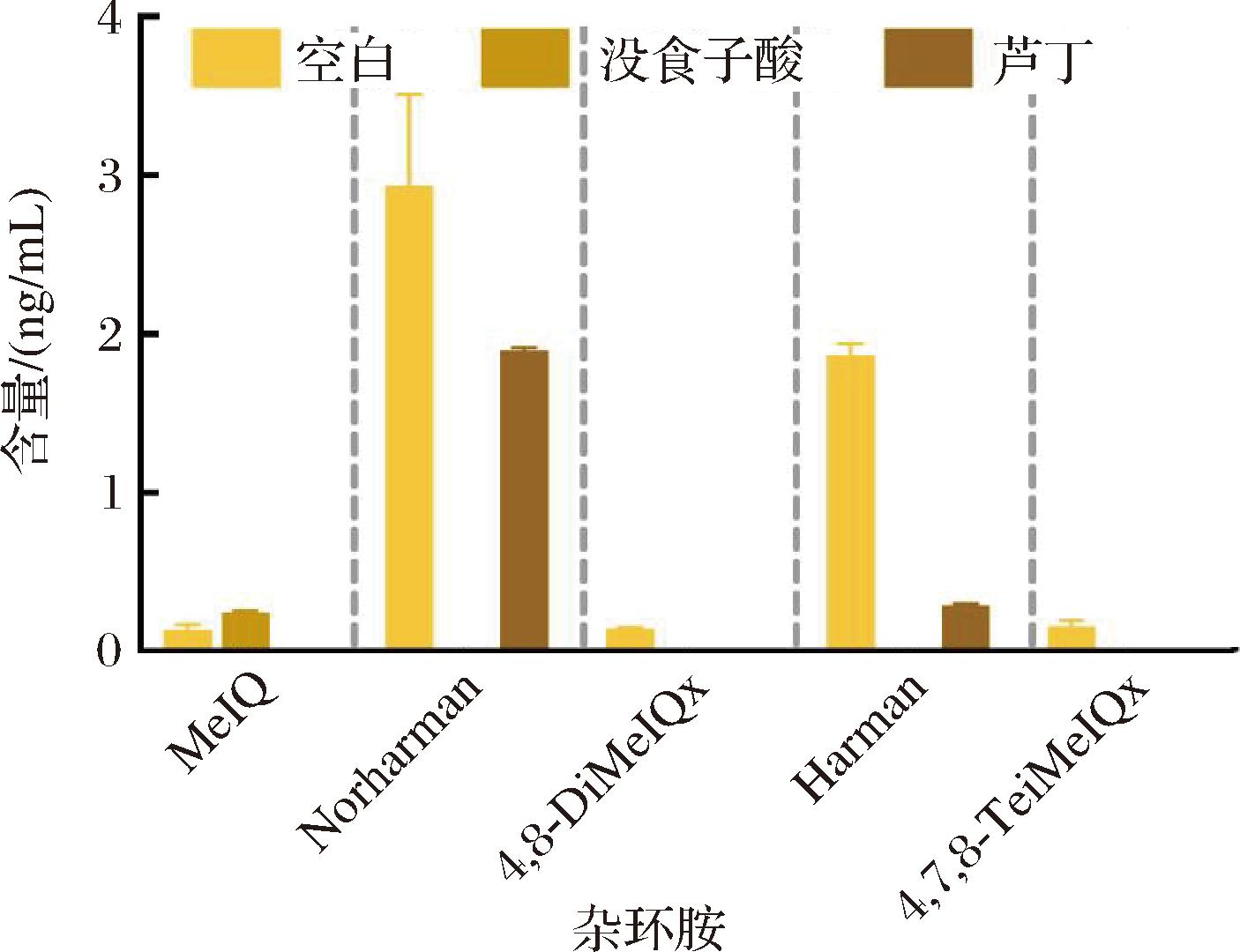
图7 没食子酸和芦丁对模拟体系杂环胺含量的影响
Fig.7 Effect of gallic acid and rutin on heterocyclic aromatic amines in model system
3 结论
本研究探讨了氨基酸模拟体系中杂环胺的生成机制及其调控。在无氨基酸添加的模拟体系中,加热产生了少量的IQx、MeIQ、Norharman、4,8-DiMeIQx和Harman,表明肌酐和肌酸在高温条件下可能发生了降解,生成的中间产物与葡萄糖形成了杂环胺。苏氨酸模拟体系主要生成IQ类杂环胺和β-咔啉类杂环胺。杂环胺含量总体随温度升高和时间延长而缓慢上升,其中温度对模拟体系中杂环胺的生成反应影响显著大于时间的影响,且加热时间的延长会导致MeIQ和Harman发生不同程度的降解。此外,温度和时间的延长均能增强苏氨酸模拟体系的褐变程度,并促进中间产物的生成,从而导致更多杂环胺的形成。
在非前体氨基酸的影响方面,天冬氨酸和谷氨酸均对IQx、MeIQ、Norharman、4,8-DiMeIQx和Harman表现出抑制作用。然而,谷氨酸在苏氨酸模拟体系中对MeIQ和Norharman的抑制效果不明显,且可能参与了4,7,8-TeiMeIQx的生成反应。此外,IQx和MeIQ可能通过葡萄糖提供醛基,在无氨基酸的情况下形成。在油脂的影响方面,菜籽油显著促进了苏氨酸模拟体系中MeIQ、Norharman和Trp-p-1的生成。而在外源抑制剂的作用下,没食子酸和芦丁均能显著抑制苏氨酸模拟体系中杂环胺的生成,且没食子酸的抑制效果强于芦丁。综上所述,本研究以关键前体氨基酸—苏氨酸为核心建立模拟体系揭示了杂环胺生成的调控机制,为食品加工中杂环胺的减控提供了理论依据。
[1] BARZEGAR F, KAMANKESH M, MOHAMMADI A.Heterocyclic aromatic amines in cooked food:A review on formation, health risk-toxicology and their analytical techniques[J].Food Chemistry, 2019, 280:240-254.
[2] CHEN X Q, JIA W, ZHU L, et al.Recent advances in heterocyclic aromatic amines:An update on food safety and hazardous control from food processing to dietary intake[J].Comprehensive Reviews in Food Science and Food Safety, 2020, 19(1):124-148.
[3] BORGEN E, SOLYAKOV A, SKOG K.Effects of precursor composition and water on the formation of heterocyclic amines in meat model systems[J].Food Chemistry, 2001, 74(1):11-19.
[4] 黄欣娅, 戴宏杰, 郭婷, 等.油炸条件对猪里脊品质和杂环胺形成的影响[J].食品与发酵工业, 2025, 51(3):171-181.HUANG X Y, DAI H J, GUO T, et al.Effects of frying conditions on quality and heterocyclic aromatic amines of pork tenderloin heterocyclic amines[J].Food and Fermentation Industries, 2025, 51(3):171-181.
[5] LI W R, YU J C, REN N J, et al.Exploration of the prediction and generation patterns of heterocyclic aromatic amines in roast beef based on genetic algorithm combined with support vector regression[J].Food Chemistry, 2025, 463(Part 1):141059.
[6] LINGHU Z Y, KARIM F, SMITH J S.Amino acids inhibitory effects and mechanism on 2-amino-1-methyl-6-phenylimidazo[4,5-b] Py ridine (PhIP) formation in the Maillard reaction model systems[J].Journal of Food Science, 2017, 82(12):3037-3045.
[7] GIBIS M.Heterocyclic aromatic amines in cooked meat products:Causes, formation, occurrence, and risk assessment:Heterocyclic amines in cooked meat products[J].Comprehensive Reviews in Food Science and Food Safety, 2016, 15(2):269-302.
[8] SKOG K I, JOHANSSON M A E, J GERSTAD M I.Carcinogenic heterocyclic amines in model systems and cooked foods:A review on formation, occurrence and intake[J].Food and Chemical Toxicology, 1998, 36(9-10):879-896.
GERSTAD M I.Carcinogenic heterocyclic amines in model systems and cooked foods:A review on formation, occurrence and intake[J].Food and Chemical Toxicology, 1998, 36(9-10):879-896.
[9] ZHANG H L, LYU X M, SU W M, et al.Exploring the roles of excess amino acids, creatine, creatinine, and glucose in the formation of heterocyclic aromatic amines by UPLC-MS/MS[J].Food Chemistry, 2024, 446:138760.[10] XI J, CHEN Y.Analysis of the relationship between heterocyclic amines and the oxidation and thermal decomposition of protein using the dry heated soy protein isolate system[J].LWT, 2021, 148:111738.
[11] QUAN W, LI Y, JIAO Y, et al.Simultaneous generation of acrylamide, β-carboline heterocyclic amines and advanced glycation ends products in an aqueous Maillard reaction model system[J].Food Chemistry, 2020, 332:127387.
[12] WANG H J, CHU X R, DU P F, et al.Unveiling heterocyclic aromatic amines (HAAs) in thermally processed meat products:Formation, toxicity, and strategies for reduction—A comprehensive review[J].Food Chemistry:X, 2023, 19:100833.
[13] GIBIS M, KRUWINNUS M, WEISS J.Impact of different pan-frying conditions on the formation of heterocyclic aromatic amines and sensory quality in fried bacon[J].Food Chemistry, 2015, 168:383-389.
[14] OZ F, ZIKIROV E.The effects of sous-vide cooking method on the formation of heterocyclic aromatic amines in beef chops[J].LWT-Food Science and Technology, 2015, 64(1):120-125.
[15] YAN Y, YOU F H, ZENG M M, et al.Evaluating the effects of temperature and time on heterocyclic aromatic amine profiles in roasted pork using combined UHPLC-MS/MS and multivariate analysis[J].Food Research International, 2021, 141:110134.
[16] SUN L B, WANG D H, HUANG Z, et al.Structure and flavor characteristics of Maillard reaction products derived from soybean meal hydrolysates-reducing sugars[J].LWT, 2023, 185:115097.
[17] SHAKOOR A, ZHANG C P, XIE J C, et al.Maillard reaction chemistry in formation of critical intermediates and flavour compounds and their antioxidant properties[J].Food Chemistry, 2022, 393:133416.
[18] DENG P, YANG T, CHAI Z P, et al.Synergistic inhibition against heterocyclic amines in beef patties:Caused by carbonyl-trapping and toxicity-reducing of amino acid combinations[J].Food Research International, 2024, 180:114057.
[19] GRIVAS S, NYHAMMAR T, OLSSON K, et al.Formation of a new mutagenic DiMeIQx compound in a model system by heating creatinine, alanine and fructose[J].Mutation Research/Fundamental and Molecular Mechanisms of Mutagenesis, 1985, 151(2):177-183.
[20] 马相杰, 赵建生, 黄启瑞, 等.热反应条件对葡萄糖-丙氨酸甜香型美拉德反应模拟体系中二羰基化合物及风味物质的影响[J].食品工业科技, 2024, 45(16):114-120.MA X J, ZHAO J S, HUANG Q R, et al.Effects of thermal reaction conditions on dicarbonyl compounds and flavor substances in glucose-alanine sweet-flavored Maillard reaction model system[J].Science and Technology of Food Industry, 2024, 45(16):114-120.
[21] ZAMORA R, HIDALGO F J.2-Amino-1-methyl-6-phenylimidazo [4, 5-b] pyridine (PhIP) formation and fate:An example of the coordinate contribution of lipid oxidation and Maillard reaction to the production and elimination of processing-related food toxicants[J].RSC Advances, 2015, 5(13):9709-9721.
[22] ZAMORA R, ALC N E, HIDALGO F J.Effect of lipid oxidation products on the formation of 2-amino-1-methyl-6-phenylimidazo [4, 5-b] pyridine (PhIP) in model systems[J].Food Chemistry, 2012, 135(4):2569-2574.
N E, HIDALGO F J.Effect of lipid oxidation products on the formation of 2-amino-1-methyl-6-phenylimidazo [4, 5-b] pyridine (PhIP) in model systems[J].Food Chemistry, 2012, 135(4):2569-2574.
[23] DENG P, YANG T, QIE X J, et al.Synergistic inhibition against heterocyclic amines by amino acid combinations:Focus on carbonyl-amine reactions of methylglyoxal and glyoxal[J].Journal of Food Composition and Analysis, 2024, 136:106813.
[24] NA Z G, LIU S Q, BI H X, et al.Inhibitory effects of polyphenols on the Maillard reaction in low-lactose milk and the underlying mechanism[J].Journal of Dairy Science, 2024, 107(12):10512-10526.