N-乙酰氨基葡萄糖(N-acetylglucosamine, GlcNAc)是一种重要的功能性糖,广泛存在于各种生物体内,是合成透明质酸和N-乙酰神经氨酸等化合物的关键前体物质。GlcNAc在生物医学领域具有重要价值。研究表明,它在缓解关节炎、治疗骨质疏松等疾病方面具有显著效果[1-2]。此外,GlcNAc还具有增强免疫力,维持肠道菌群平衡等功能[3-4]。目前,微生物发酵法已经成为GlcNAc的主要生产方法之一,而谷氨酸棒杆菌(Corynebacterium glutamicum)凭借其优越的工业发酵性能,已成为用于GlcNAc生产的理想底盘菌株之一[5-6]。LI等[7]以C.glutamicum ATCC13032为底盘菌株,利用代谢工程调控菌株代谢流,在250 mL摇瓶中将GlcNAc的产量提高至23.3 g/L。LYU等[8]和DENG等[9]的研究表明,与其他菌株相比,C.glutamicum S9114具有高效的谷氨酸合成能力,谷氨酸可进一步转化为合成GlcNAc的关键前体谷氨酰胺,进而为GlcNAc的合成提供充足的前体物质。
在微生物发酵过程中,培养基的选择对微生物生长及产物合成具有重要影响。玉米浆干粉因其成本低和营养丰富等特点,长期以来作为C.glutamicum发酵培养基的主要营养成分,广泛应用于工业大规模发酵生产[10]。但是,不同品牌或同一品牌的原料来源及加工工艺差异会导致玉米浆干粉组分存在批次差异性,这对发酵过程的稳定性造成了影响[11-12]。研究人员尝试使用气相色谱-飞行时间质谱联用仪(gas chromatography-time-of-flight mass spectrometry,GC-TOFMS)对玉米浆干粉的成分进行检测,并结合正交偏最小二乘判别分析(orthogonal partial least squares discriminant analysis,OPLS-DA),以更好地分析发酵过程[13]。然而,玉米浆干粉成分波动问题尚未得到根本解决。因此,探索无机盐培养基的组成成分,实现生产的稳定与高效,对于进一步优化GlcNAc工业化生产工艺具有重要意义。
本研究以C.glutamicum S9114为出发菌株,过表达GlcNAc合成途径的关键酶6-磷酸氨基葡萄糖合成酶(glutamine-fructose-6-phosphate aminotransferase,GlmS),氨基葡萄糖-6-磷酸乙酰转移酶(glucosamine-6-phosphate N-acetyltransferase,Gna1),果糖-1-磷酸磷酸酶(fructose-1-phosphate phosphatase, Yqab)以增强GlcNAc的合成能力;同时敲除竞争途径中编码N-乙酰氨基葡萄糖-6-磷酸脱乙酰酶的nagA基因,编码氨基葡萄糖-6-磷酸脱氨酶的nagB基因,以及编码乳酸脱氢酶的ldhA基因以阻断竞争途径;进一步通过对质粒框架的更换以及采用启动子工程策略,成功构建了高效生产GlcNAc的菌株Cg10。500 mL摇瓶发酵72 h产量达到28.8 g/L。之后,为了降低玉米浆干粉对发酵结果的影响,本研究对不同品牌的玉米浆干粉成分进行检测,为无机培养基的配方提供了基础数据。在此基础上,采用Box-Behnken法进行了6因素3水平的优化实验,对6种主要成分添加量进行优化,并结合原始玉米浆干粉培养基,确定了最佳的无机培养基配方(g/L):葡萄糖120;硫酸铵38.1;磷酸二氢钾2.0;磷酸氢二钾0.3;硫酸镁1.2;氯化钠0.4;谷氨酰胺2;碳酸钙1.4;硫酸锰230 mg/L;硫酸锌3 mg/L;硫酸铁60 mg/L;D-生物素7.5 mg/L。使用该无机培养基,GlcNAc产量达到27.5 g/L,与使用传统玉米浆干粉培养基的产量相当。本研究为C.glutamicum在GlcNAc大规模工业化生产中提供了工艺参数的支持,并为GlcNAc的高效生产奠定了基础。
1 材料与方法
1.1 材料
1.1.1 菌株和质粒
本研究使用的菌株和质粒见表1。
表1 本研究使用的菌株和质粒
Table 1 Strains and plasmids used in this study

菌株和质粒特征来源E.coli DH5α用于质粒的构建本实验室保藏C.glutamicum S9114野生型C.glutamicum S9114本实验室保藏Cg1C.glutamicum S9114中转化pXMJ19-tac-GNA1质粒本研究Cg2C.glutamicum S9114中转化pXMJ19-tac-glmS-GNA1质粒本研究Cg3C.glutamicum S9114中转化pXMJ19-tac-glmS-GNA1-yqab质粒本研究Cg4C.glutamicum S9114ΔnagAB中转化pXMJ19-tac-glmS-GNA1-yqab质粒本研究Cg5C.glutamicum S9114ΔnagABΔldhA中转化pXMJ19-tac-glmS-GNA1-yqab质粒本研究Cg6C.glutamicum S9114ΔnagABΔldhAΔpta中转化pXMJ19-tac-glmS-GNA1-yqab质粒本研究Cg7C.glutamicum S9114ΔnagABΔldhA中转化pJYW-4-tac-glmS-GNA1-yqab质粒本研究Cg8C.glutamicum S9114ΔnagABΔldhA中转化pDXW-10-tac-glmS-GNA1-yqab质粒本研究Cg9C.glutamicum S9114ΔnagABΔldhA中转化pJYW-4-Dtac-glmS-GNA1-yqab质粒本研究Cg10C.glutamicum S9114ΔnagABΔldhA中转化pJYW-4-tacM-glmS-GNA1-yqab质粒本研究Cg11C.glutamicum S9114ΔnagABΔldhA中转化pJYW-4-tacM1-glmS-GNA1-yqab质粒本研究Cg12C.glutamicum S9114ΔnagABΔldhA中转化pJYW-4-trc-glmS-GNA1-yqab质粒本研究Cg13C.glutamicum S9114ΔnagABΔldhA中转化pJYW-4-lac-glmS-GNA1-yqab质粒本研究Cg14C.glutamicum S9114ΔnagABΔldhA中转化pJYW-4-eftu-glmS-GNA1-yqab质粒本研究Cg15C.glutamicum S9114ΔnagABΔldhA中转化pJYW-4-cysk-glmS-GNA1-yqab质粒本研究Cg16C.glutamicum S9114ΔnagABΔldhA中转化pJYW-4-syn-glmS-GNA1-yqab质粒本研究Cg17C.glutamicum S9114ΔnagABΔldhA中转化pJYW-4-69-glmS-GNA1-yqab质粒本研究Cg18C.glutamicum S9114ΔnagABΔldhA中转化pJYW-4-H10-glmS-GNA1-yqab质粒本研究pK18-mob-sacBC.glutamicum基因编辑质粒,包含sacB基因本实验室保藏pXMJ19E.coli-C.glutamicum穿梭质粒,包含Ptac本实验室保藏pJYW-4E.coli-C.glutamicum穿梭质粒,包含Ptac本实验室保藏pDXW-10E.coli-C.glutamicum穿梭质粒,包含Ptac本实验室保藏pXMJ19-tac-GNA1pXMJ19衍生质粒,包含Ptac,包含基因GNA1本研究pXMJ19-tac-glmS-GNA1pXMJ19衍生质粒,包含Ptac,包含基因glmS, GNA1本研究pXMJ19-tac-glmS-GNA1-yqabpXMJ19衍生质粒,包含Ptac,包含基因glmS, GNA1, yqaB本研究pJYW-4-tac-glmS-GNA1-yqabpJYW-4衍生质粒,包含Ptac,包含基因glmS, GNA1, yqaB本研究pDXW10-tac-glmS-GNA1-yqabpDXW-10衍生质粒,包含Ptac,包含基因glmS, GNA1, yqaB本研究pJYW-4-DtacpJYW-4衍生质粒,包含PDtac,包含基因glmS, GNA1, yqaB本研究pJYW-4-tacMpJYW-4衍生质粒,包含PtacM,包含基因glmS, GNA1, yqaB本研究pJYW-4-tacM1pJYW-4衍生质粒,包含PtacM1,包含基因glmS, GNA1, yqaB本研究pJYW-4-trcpJYW-4衍生质粒,包含Ptrc,包含基因glmS, GNA1, yqaB本研究pJYW-4-lacpJYW-4衍生质粒,包含Plac,包含基因glmS, GNA1, yqaB本研究pJYW-4-eftupJYW-4衍生质粒,包含Peftu,包含基因glmS, GNA1, yqaB本研究pJYW-4-cyskpJYW-4衍生质粒,包含Pcysk,包含基因glmS, GNA1, yqaB本研究pJYW-4-synpJYW-4衍生质粒,包含Psyn,包含基因glmS, GNA1, yqaB本研究pJYW-4-69pJYW-4衍生质粒,包含P69,包含基因glmS, GNA1, yqaB本研究pJYW-4-H10pJYW-4衍生质粒,包含PH10,包含基因glmS, GNA1, yqaB本研究
1.1.2 培养基与培养条件
LB培养基(g/L):蛋白胨10,酵母提取物5,氯化钠10。固体培养基添加20 g/L的琼脂粉。卡那霉素终质量浓度为50 mg/L,氯霉素终质量浓度为20 mg/L,在37 ℃下用于大肠杆菌(Escherichia coli)的培养。
BHIS培养基(g/L):脑心浸出液肉汤37,山梨醇91。固体培养基添加20 g/L的琼脂粉。卡那霉素终质量浓度为25 mg/L,氯霉素终质量浓度为10 mg/L,在30 ℃下用于C.glutamicum的培养。
玉米浆干粉种子培养基(g/L):葡萄糖25.0,玉米浆干粉20.0,磷酸二氢钾1.0,硫酸铵0.5,尿素1.25。
玉米浆干粉发酵培养基(g/L):葡萄糖100.0,玉米浆干粉15.0,磷酸二氢钾1.0,硫酸铵20.0,硫酸镁0.5,碳酸钙20.0,硫酸铁0.18。其中,葡萄糖和硫酸镁单独配制为母液,碳酸钙单独称量灭菌后添加至培养基中。
1.1.3 试剂
PrimeSTAR® Max DNA Polymerase、Rapid Taq Master Mix,宝生物工程(大连)有限公司;质粒提取、感受态制备试剂盒及各种培养基,生工生物工程(上海)股份有限公司;一步克隆酶,上海碧云天生物技术股份有限公司;甲醇与乙腈(色谱纯),美国TEDIA公司;检测游离氨基酸使用的17种氨基酸标准品(天门冬氨酸、组氨酸、谷氨酸、丝氨酸、甘氨酸、苏氨酸、丙氨酸、精氨酸、酪氨酸、胱氨酸、氨基酸、蛋氨酸、苯丙氨酸、异亮氨酸、亮氨酸、赖氨酸、脯氨酸)、柱前衍生化试剂邻苯二甲醛(o-phthalaldehyde,OPA)、9-芴甲基氯甲酸酯(9-fluorenylmethyl chloroformate,FMOC),Sigma公司;三氯乙酸(trichloroacetic acid,TCA),上海阿拉丁生化科技股份有限公司。
1.2 仪器与设备
超低温冰箱、NANO Drop 2000分光光度计、Hypersil ODS色谱柱(5 μm,4.0 mm×250 mm),美国Thermo Fisher公司;分析天平,上海奥豪斯仪器有限公司;恒温水浴锅,上海森信实验仪器有限公司;小型离心机、低温冷冻离心机,德国Eppendorf公司;振荡培养箱,上海知楚仪器公司;立式高压蒸汽灭菌锅,上海医用核子仪器厂;超净工作台,苏州安泰空气技术公司;超纯水制备仪,保兴生物设备工程有限公司;电转仪及电转杯、核酸电泳仪、凝胶成像系统、PCR仪、Aminex® HPX-87H色谱柱(300 mm×7.8 mm,5 μm),美国Bio-Rad公司;UV mini-1240紫外分光光度计,日本Shimadzu公司;安捷伦1260高效液相色谱仪,安捷伦科技有限公司;50 L发酵罐,上海百仑生物科技有限公司。
1.3 实验方法
1.3.1 底盘菌株的构建
采用基于pK18-mob-sacB质粒的双交换系统对C.glutamicum S9114进行基因编辑,利用sacB基因编码的蔗糖果聚糖酶具有的致死原理以及同源重组技术实现靶基因的无痕敲除[14]。首先,将基因编辑质粒通过电转化导入C.glutamicum S9114感受态细胞,经过卡那霉素的选择性培养,筛选出含有重组载体菌落。随后,通过在含有蔗糖的培养基中进行反向筛选,得到发生第二次同源双交换的菌落。最后通过平板筛选以及测序验证,得到基因敲除的重组菌株。重复操作过程以进行下一轮编辑。
1.3.2 重组质粒的构建
构建质粒所使用引物见表2。质粒载体和基因片段通过PCR扩增,获得线性化片段。随后,所有片段使用一步克隆酶进行连接,得到连接产物。将所得连接产物转化至E.coli DH5α感受态细胞,并涂布于含有卡那霉素抗性的选择性平板上。次日,从选择性平板上挑取单菌落,送至金唯智公司进行测序验证。对测序正确的单菌落进一步培养以扩大规模,并提取得到重组质粒,供后续实验使用。
表2 本研究使用的引物
Table 2 Primers used in this study

引物序列(5′-3′)GNA1-FAACAATTTCACACAGGAAACAGAATGAGCCTGCCGGATGGCTGNA1-RACCTGCAGGCATGCAAGCTTAATTAATCTATTTGCGAATCTGCATTTCCACGCHP-pXMJ19-FATTAATTAAGCTTGCATGCCTGCAGGTHP-pXMJ19-RTCTGTTTCCTGTGTGAAATTGTTglmS-FAACAATTTCACACAGGAAACAGAATGTGTGGAATTGTTGGATATATTGGglmS-RAGCCATCCGGCAGGCTCATTTATTCGACGGTGACAGACTTTGHP-PXM-GNA1-FTGAGCCTGCCGGATGGCTTHP-PXM-GNA1-RTCTGTTTCCTGTGTGAAATTGTTHP-PXM-glmS-GNA1-FATTAATTAAGCTTGCATGCCTGCAGGTHP-PXM-glmS-GNA1-RCTATTTGCGAATCTGCATTTCCACGCyqab-FGCGTGGAAATGCAGATTCGCAAATAGATGTACGAGCGTTATGCAGGTTTyqab-RCCTGCAGGCATGCAAGCTTAATTAATTCACAGCAAGCGAACATCCACnagAB-FFACAATTTCACACAGGAAACAGCTATGACTGCACCCATCCTTCCTGTGCAAnagAB-FRAACCTCAGAAAGAAACAAAAAGGAAAGTACTGTGTGGGnagAB-RFTTCCTTTTTGTTTCTTTCTGAGGTTATTTGCTTCCTTCCnagAB-RRCCCTGAGTGCTTGCGGCAGGACATATGGGAGGTGTCTCCCApk18-FTGCCGCAAGCACTCAGGpk18-RGTCATAGCTGTTTCCTGTGTGAAATTGTldhA-FFACAATTTCACACAGGAAACAGCTATGACAAAACCCTGGTCACGGTGAATGldhA-FRTGGGATCGAAAATCTTTGGCGCCTAGTTGGldhA-RFGGCGCCAAAGATTTTCGATCCCACTTCCTGATTTCCldhA-RRCGCCCTGAGTGCTTGCGGCACACCCCATTTTTCATACGACCACGpk18-FTGCCGCAAGCACTCAGGpk18-RGTCATAGCTGTTTCCTGTGTGAAATTGTpk18-FTGCCGCAAGCACTCAGGpk18-RGTCATAGCTGTTTCCTGTGTGAAATTGTpta-FFACAATTTCACACAGGAAACAGCTATGACTTTTCACCAACACCAGCGGTAApta-FRGAAAGGCGATGTTGGCATTGGCACTTGTTTTpta-RFGCCAATGCCAACATCGCCTTTCTAGTTTCAGCCTGAApta-RRCCTGAGTGCTTGCGGCACTTAGCCAAGCTCTCATAGACATGlcNAc-FGAAAGAAGGAGGACCCGACAATGTGTGGAATTGTTGGATATATTGGCCAGlcNAc-RTCACAGCAAGCGAACATCCACpJYW4-FGTGGATGTTCGCTTGCTGTGAAACAGAATTTGCCTGGCGGpJYW4-RTGTCGGGTCCTCCTTCTTTCTAACATGGGlcNAc-F-pDXWCGGATAACAATTTCACACAGGAAACATGTGTGGAATTGTTGGATATATTGGCGlcNAc-R-pDXWCCGCCCATGGGAGCTCGCTAGCGAATTCTTCACAGCAAGCGAACATCCACpDXW-HP-FAGAATTCGCTAGCGAGCTCCCATGGGCpDXW-HP-RGTTTCCTGTGTGAAATTGTTATCCGD-tac-FATCATCGGCTCGTATAATGTTGACAATTAATCATCGGCTCGTATAATGTAGAAAGAAGGAGGACCCGACAD-tac-RTTAATTGTCAACATTATACGAGCCGATGATTAATTGTCAACAGCTCAAACGTCCAAAATCACCtacM-FATCATCGTGTGGTACCATGTTAGAAAGAAGGAGGACCCGACAtacM-RCTAACATGGTACCACACGATGATTAATTGTCAACAGCTCAAACGTCCAAAATCACtacM1-FATCATCGTGTGCTATAATGGTAGAAAGAAGGAGGACCCGACAAtacM1-RACCATTATAGCACACGATGATTAATTGTCAACAGCTCAAACGTCCAAAATCACCAtrc-FATCATCCGGCTCGTATAATGTAGAAAGAAGGAGGACCCGACAtrc-RCATTATACGAGCCGGATGATTAATTGTCAACAGCTCAAACGTCCAAAATCACCAlac-FATGCTTCCGGCTCGTATGTTGTAGAAAGAAGGAGGACCCGACAlac-RTACAACATACGAGCCGGAAGCATAAAGTGTAAACAGCTCAAACGTCCAAAATCACeftu-FGATTTTGGACGTTTGAGCTGGGCCGTTACCCTGCGAATGeftu-RTGTCGGGTCCTCCTTCTTTCTATGTATGTCCTCCTGGACTTCGTHP-JYW4-FTAGAAAGAAGGAGGACCCGACAHP-JYW4-RCAGCTCAAACGTCCAAAATCACCACcysk-FGTGGTGATTTTGGACGTTTGAGCTGTGACCCCGCGAGAAATATTCATTGcysk-RTGTCGGGTCCTCCTTCTTTCTATGTGGGGTGTGCTCCAATCGTTGAAsyn-FTTTGAATCTGTGTTATAATGGTTCTAGAAAGAAGGAGGACCCGACAsyn-RAGAACCATTATAACACAGATTCAAATTAATGTCAACAGCTCAAACGTCCAAAATCACCP69-FCCGTTGACAAGACAATGCGCATGAGATATAATGGCATAGTGCTAGAAAGAAGGAGGACCCGACAP69-RCATTATATCTCATGCGCATTGTCTTGTCAACGGAAAATTTAAAATAATTTTCAGCTCAAACGTCCAAAATCACCH10-FAAGCCGGCGGCGTATGGTAAGCTCTGTTATGTATAGTCCGAGCACGGCGAAAGGATACTCTAGAAAGAAGGAGGACCCGACAH10-RCAGAGCTTACCATACGCCGCCGGCTTAGAGCCGACCGGTAAGGGTTGAGCCAGCTCAAACGTCCAAAATCACC
1.3.3 菌株发酵及检测方法
将保存于甘油管中的菌株用接种环划线接种至BHIS固体培养基,并在30 ℃培养箱中培养24~36 h。挑取单个菌落接种至玉米浆干粉种子培养基中,并在30 ℃的恒温往复式摇床中以220 r/min培养20~24 h,直至细胞生长至对数生长前期。吸取1 mL种子液接种至玉米浆发酵培养基中,继续在30 ℃恒温往复式摇床上以220 r/min培养72 h。在响应面优化发酵实验中,为了提高实验效率,将发酵体系缩小至10 mL,使用50 mL离心管,发酵培养基装液量为9.9 mL,并使用BHIS培养基作为种子培养基以避免玉米浆干粉的干扰。接种0.1 mL种子培养液至发酵培养基中,发酵72 h后进行检测。
GlcNAc的浓度检测采用HPLC。流动相为5 mmol/L稀硫酸水溶液,流速设定为0.5 mL/min,柱温40 ℃,示差折光检测器温度设为35 ℃,样品进样体积为10 μL。
菌体浓度使用分光光度计进行检测,在摇瓶发酵过程中,取1 mL发酵液,并用0.2 mol/L的稀盐酸稀释至适当的吸光度范围。随后使用分光光度计在600 nm处测定OD值。
1.3.4 玉米浆干粉各元素的检测方法
玉米浆干粉中铁、铝、锰、铜、锌、硒、钙、镁、钠和钾元素的检测基于GB 5009.268—2016《食品安全国家标准 食品中多元素的测定》第一法;维生素B2检测基于GB 5009.85—2016《食品安全国家标准 食品中微生素B2的测定》第一法进行;烟酸(维生素B3)检测基于GB 5009.89—2016《食品安全国家标准 食品中烟酸和烟酰胺的测定》第二法;泛酸(维生素B5)检测基于GB 5009.210—2016《食品安全国家标准 食品中泛酸的测定》第二法。上述各元素含量的检测委托第三方公司完成。
玉米浆干粉中游离氨基酸的含量采用OPA柱前衍生的反相高效液相色谱-紫外检测法进行测定。实验使用高效液相色谱系统,配置包括在线脱气装置(G1322A)、四元泵(G1311A)、自动进样器(G1313A)和VWD检测器(G1314A)。流动相A(pH值=7.2)由27.6 mmol/L醋酸钠、三乙胺和四氢呋喃配制而成(体积比500∶0.11∶2.5);流动相B(pH值=7.2)由80.9 mmol/L醋酸钠、甲醇和乙腈配制而成(体积比1∶2∶2)。使用Agilent Hypersil ODS色谱柱(5 μm,4.0 mm×250 mm),梯度洗脱程序为:0.0 min,8% B;17.0 min,50% B;20.1 min,100% B;24.0 min,0% B。流速设定为1.0 mL/min,柱温为40 ℃。紫外检测器分别在338 nm(脯氨酸检测波长为262 nm)进行检测。氨基酸含量通过外标法进行定量。样品的处理方法如下:称取1.000 g玉米浆干粉,加入2.500 mL TCA溶液,补充超纯水至50.000 mL,充分振荡溶解后静置过夜。随后,样品以12 000 r/min离心20 min,取1 mL上清液过滤后进行检测。
2 结果与分析
2.1 C.glutamicum S9114中重构GlcNAc合成途径
C.glutamicum S9114中GlcNAc的生物合成涉及3种关键酶:GlmS,催化果糖-6-磷酸和谷氨酰胺生成6-磷酸氨基葡萄糖和谷氨酸;Gna1,将6-磷酸氨基葡萄糖乙酰化为6-磷酸乙酰氨基葡萄糖;Yqab,将6-磷酸乙酰氨基葡萄糖去磷酸化为GlcNAc(图1-a)。由于C.glutamicum S9114中不存在关键酶Gna1,引入外源Gna1对实现GlcNAc的合成至关重要[7]。本研究使用质粒pXMJ19过表达来自Saccharomyces cerevisiae S288C的GNA1基因,得到菌株Cg1。在此基础上过表达来自C.glutamicum S9114内源的glmS基因,得到菌株Cg2。之后过表达来自E.coli BL21的yqaB基因,构建GlcNAc的合成途径得到菌株Cg3。其中,Yqab的表达显著提高了GlcNAc的产量,产量由2.3 g/L提升至7.9 g/L(图1-b)。在未过表达关键酶Yqab时,观察到有一定的GlcNAc的积累,推测C.glutamicum S9114中存在相应发挥功能的脱磷酸酶。进一步过表达Yqab后增强了脱磷酸的速度,进而提升了GlcNAc的产量。
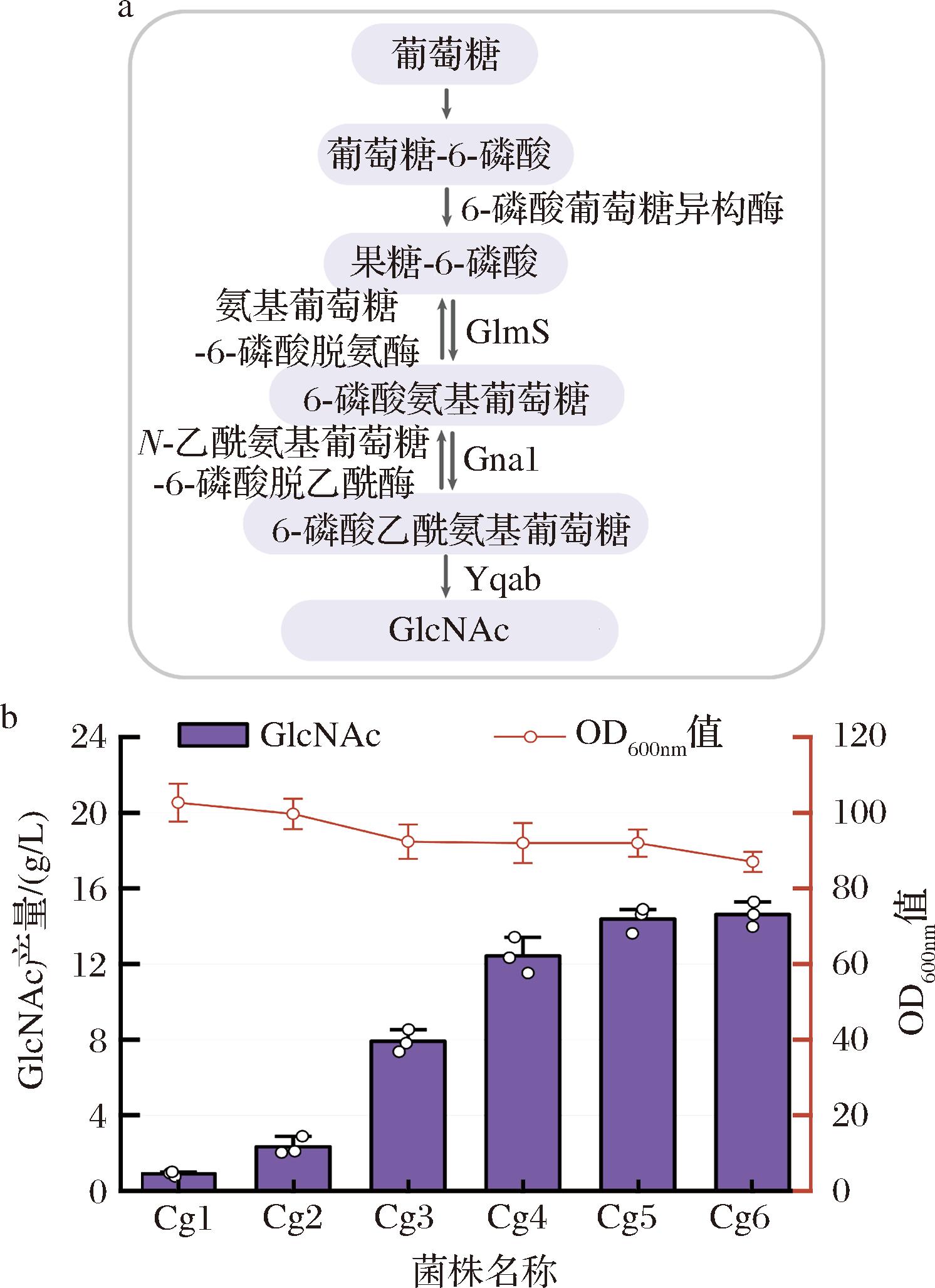
a-GlcNAc在C.glutamicum S9114中的合成途径;b-中间菌株合成GlcNAc的产量及菌体浓度
图1 C.glutamicum S9114中GlcNAc合成途径的构建
Fig.1 Construction of the GlcNAc synthesis pathway in C.glutamicum S9114
在GlcNAc代谢网络中,nagA和nagB是GlcNAc的分解代谢途径的基因[15]。因此,本研究通过敲除nagA以及nagB基因,阻断GlcNAc的降解消耗,得到菌株Cg4。同时,敲除ldhA基因,以抑制乳酸的合成,得到菌株Cg5。敲除编码磷酸乙酰转移酶的pta基因,进一步阻断乙酸的合成途径,得到菌株Cg6。发酵结果表明,敲除nagA以及nagB基因的菌株Cg4在GlcNAc的合成上取得了显著提升,产量提高至12.4 g/L。然而,敲除乙酸合成途径的pta基因对GlcNAc产量的提升并不显著。另外,有研究指出,C.glutamicum能够同时利用葡萄糖和乙酸作为碳源,因此本研究选择保留该基因以实现葡萄糖和乙酸的共利用[16]。
2.2 优化关键酶表达以增强GlcNAc合成
关键酶的表达对代谢产物的合成至关重要,因此筛选合适的质粒框架和优化关键酶的表达水平能够有效提高GlcNAc合成效率。如图2-a所示,本研究首先测试并评估了3种不同的质粒框架(pXMJ19、pJYW-4、pDXW-10)对GlcNAc产量的影响,分别构建菌株Cg7和Cg8。结果显示,不同质粒框架对GlcNAc的产量具有显著差异。其中,使用高拷贝pJYW-4质粒时,GlcNAc产量最高,达24.2 g/L,相较于pXMJ19和pDXW-10质粒,产量提升200%(图2-b)。文献报道pJYW-4的拷贝数约为316,远高于质粒pXMJ19和pDXW-10,表明质粒拷贝数在调控关键酶表达与代谢产物合成方面具有重要作用[17]。
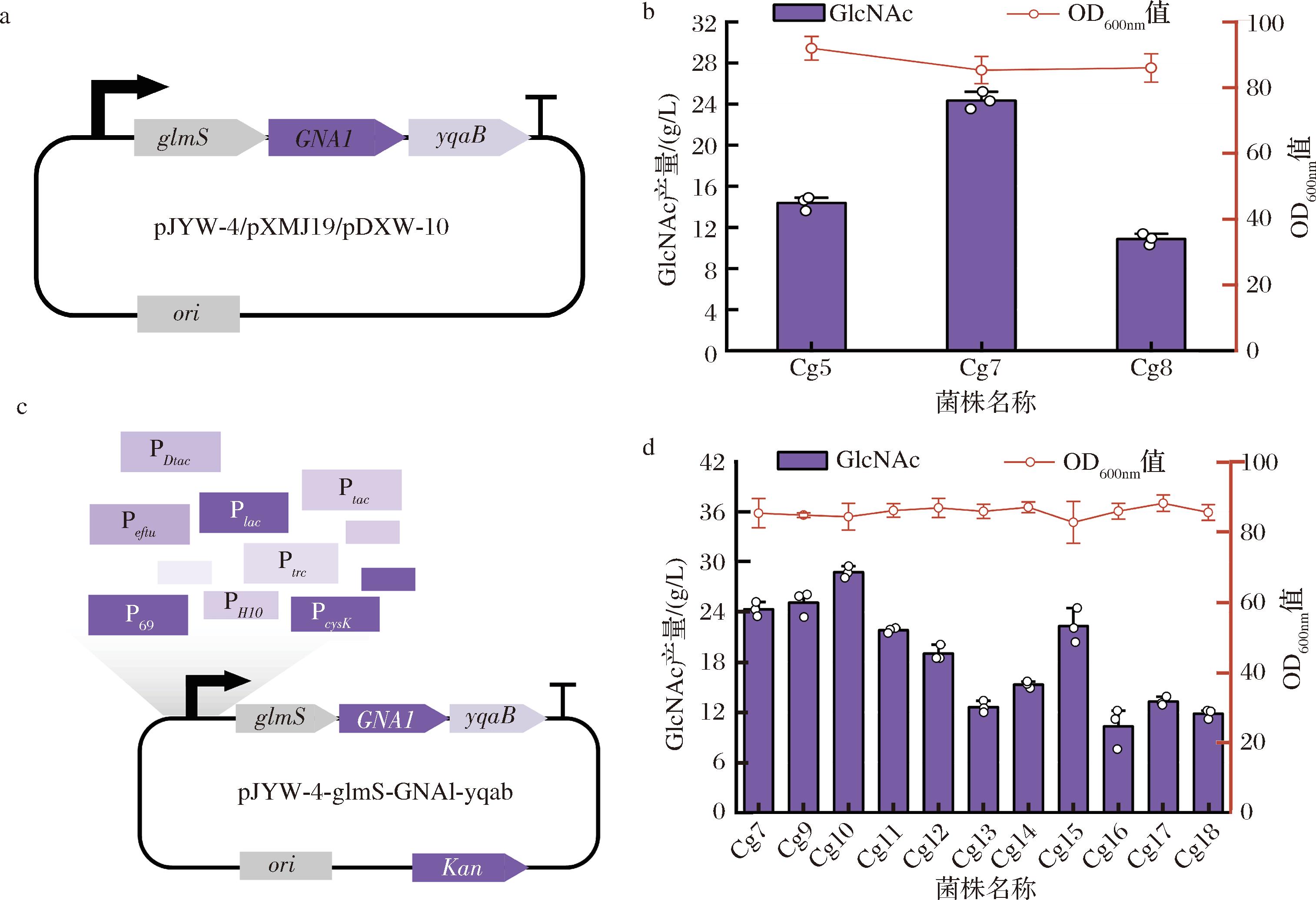
a-不同质粒框架示意图;b-不同质粒框架表达关键酶GlcNAc产量及菌体浓度;c-GlcNAc合成途径启动子文库构建的示意图;d-菌株C.glutamicum S9114中关键酶启动子优化的GlcNAc产量及菌体浓度
图2 GlcNAc合成途径质粒框架的优化及关键酶启动子的优化
Fig.2 Optimization of plasmid framework for GlcNAc synthesis pathway and key enzyme promoter optimization
为了进一步优化关键酶的表达,本研究采用启动子工程调控关键酶表达。如图2-c所示,所测试的启动子包括2个tac启动子共同表达的PDtac,以及原核生物中的常用的高效启动子PtacM、PtacM1、Ptrc、Plac和已在C.glutamicum中报道的高效启动子Peftu、Pcysk、Psyn、P69、PH10[18-23]。文库构建时统一使用含有固定核糖体结合位点的序列(TAGAAAGAAGGAGGACCCGACA),分别构建菌株Cg9~Cg18。发酵结果如图2-d所示,菌株Cg10使用tacM启动子表达关键酶时,GlcNAc的产量最高,达到了28.8 g/L,相较于对照组菌株提高18.5%。这一结果表明,pJYW-4质粒框架和tacM启动子的组合显著提高了GlcNAc的产量。值得注意的是,使用C.glutamicum中报道的Peftu、Pcysk、Psyn等启动子时,GlcNAc的产量显著降低。可能由于目前C.glutamicum报道的启动子强度相较于原核生物中常见的强启动子偏低导致[22]。
2.3 玉米浆干粉的检测及分析
玉米浆干粉以其营养成分丰富且价格低廉的优势,被广泛应用于微生物发酵生产领域。然而,玉米浆干粉批次间稳定性差,容易导致不同发酵批次间的产量重复性与稳定性低,这种不稳定性成为大规模工业化发酵中的一大挑战[10-11,24]。因此,本研究首先针对玉米浆干粉对发酵结果的影响进行了分析,使用7种不同品牌的玉米浆干粉进行发酵实验。结果如图3-a所示,不同品牌的玉米浆干粉对GlcNAc产量的影响较为显著。其中,使用品牌二的玉米浆干粉相比品牌三的玉米浆干粉发酵生产GlcNAc的产量提高了近20%。此外,即使在同一批次的发酵过程中,不同平行之间也存在一定程度的波动。
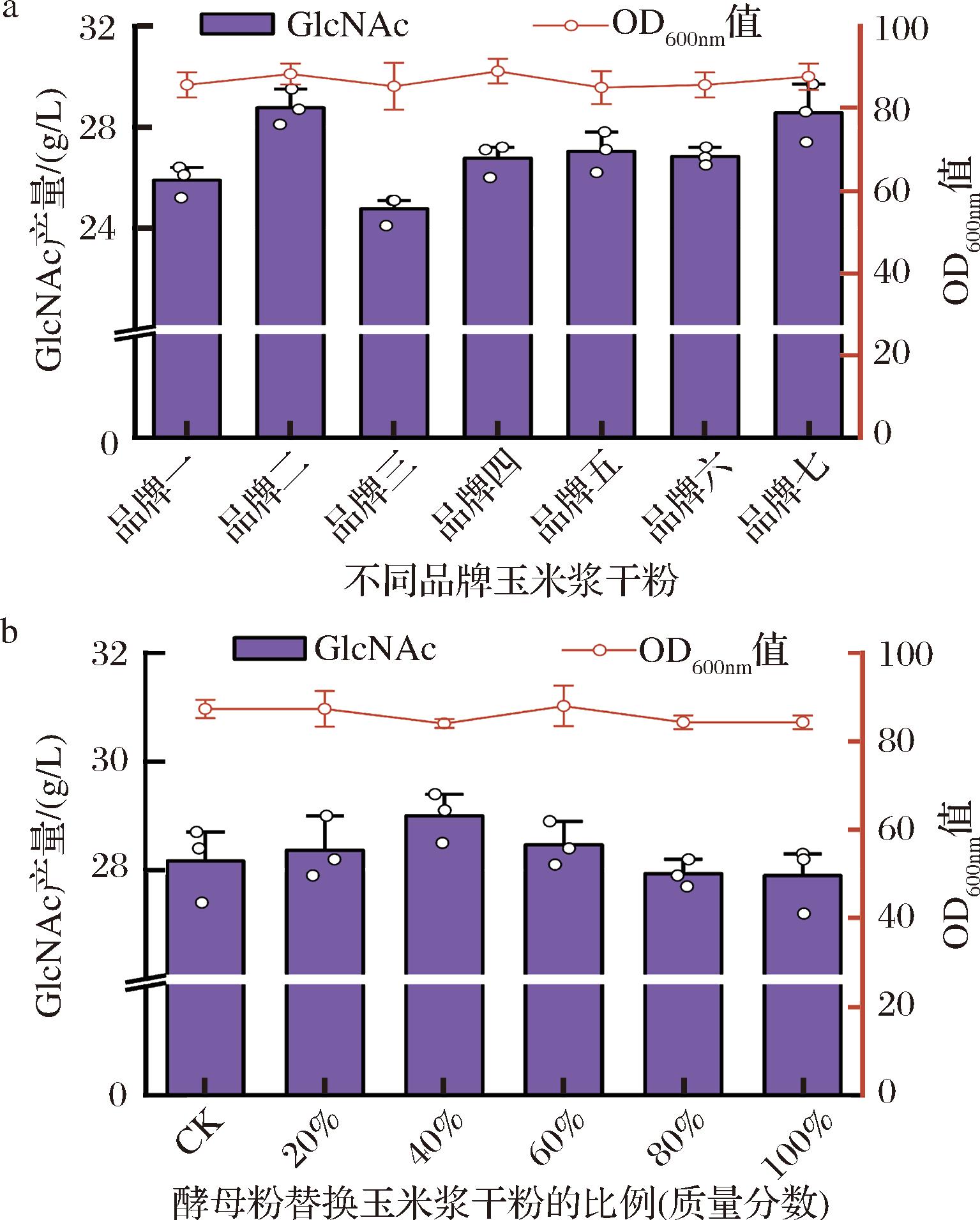
a-使用不同品牌玉米浆干粉发酵生产GlcNAc的产量及菌体浓度;b-使用酵母粉梯度替换玉米浆干粉发酵生产GlcNAc的产量及菌体浓度
图3 玉米浆干粉波动性验证及玉米浆干粉替换的可行性验证
Fig.3 Validation of corn steep liquor variability and feasibility of its replacement
为明确玉米浆干粉中是否存在对发酵结果具有关键作用的成分,本研究设计了玉米浆干粉的梯度替换的实验,将玉米浆干粉梯度替换为酵母粉,以验证替换的可行性。通过逐步增加酵母粉的比例,减少玉米浆干粉的比例,如图3-b所示,随着酵母粉比例的逐渐增加,GlcNAc的产量和菌体生长情况仅有略微变化。这一结果证实了玉米浆干粉替换的可行性。在成分差异上,玉米浆干粉受原料产地、加工季节和储存条件的影响较大,易受潮和变质。而酵母粉作为标准化的工业产品,具有稳定的氮源含量和氨基酸组成,因此在不同批次之间的稳定性优于玉米浆干粉。然而,工业酵母粉的价格相对较高,这一成本差异在大规模生产中可能会显著增加生产成本。相比之下,纯无机成分价格低廉且质量稳定,可能成为发酵培养基的更具成本效益的选择。
为了验证无机盐培养基替换玉米浆干粉的可行性,首先对7种不同品牌玉米浆干粉中的铁、铝、锰、铜、锌、硒、钙、镁、钠和钾等几种主要元素的含量进行了检测。如表3所示,不同品牌的玉米浆干粉在成分上存在显著差异。此外,针对玉米浆干粉中的B族维生素(包括B2、B3和B5)进行了检测。但维生素B3和维生素B5低于检测限并未检出。同时,如表4所示,针对发酵生产GlcNAc效果较好的3种玉米浆干粉,品牌二、品牌五和品牌七,检测了游离氨基酸的含量。
表3 七种品牌玉米浆干粉各元素及维生素含量 单位:mg/kg
Table 3 Elemental and vitamin content of corn steep liquor from seven different brands
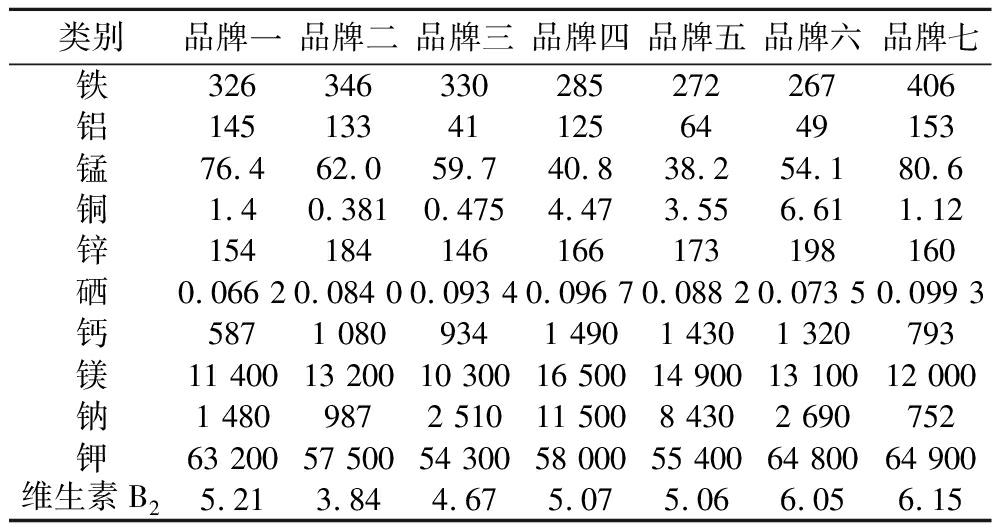
类别品牌一品牌二品牌三品牌四品牌五品牌六品牌七铁326346330285272267406铝145133411256449153锰76.462.059.740.838.254.180.6铜1.40.3810.4754.473.556.611.12锌154184146166173198160硒0.066 20.084 00.093 40.096 70.088 20.073 50.099 3钙5871 0809341 4901 4301 320793镁11 40013 20010 30016 50014 90013 10012 000钠1 4809872 51011 5008 4302 690752钾63 20057 50054 30058 00055 40064 80064 900维生素B25.213.844.675.075.066.056.15
表4 三种品牌玉米浆干粉游离氨基酸含量 单位:g/100 g
Table 4 Free amino acid content of three brands from corn steep liquor
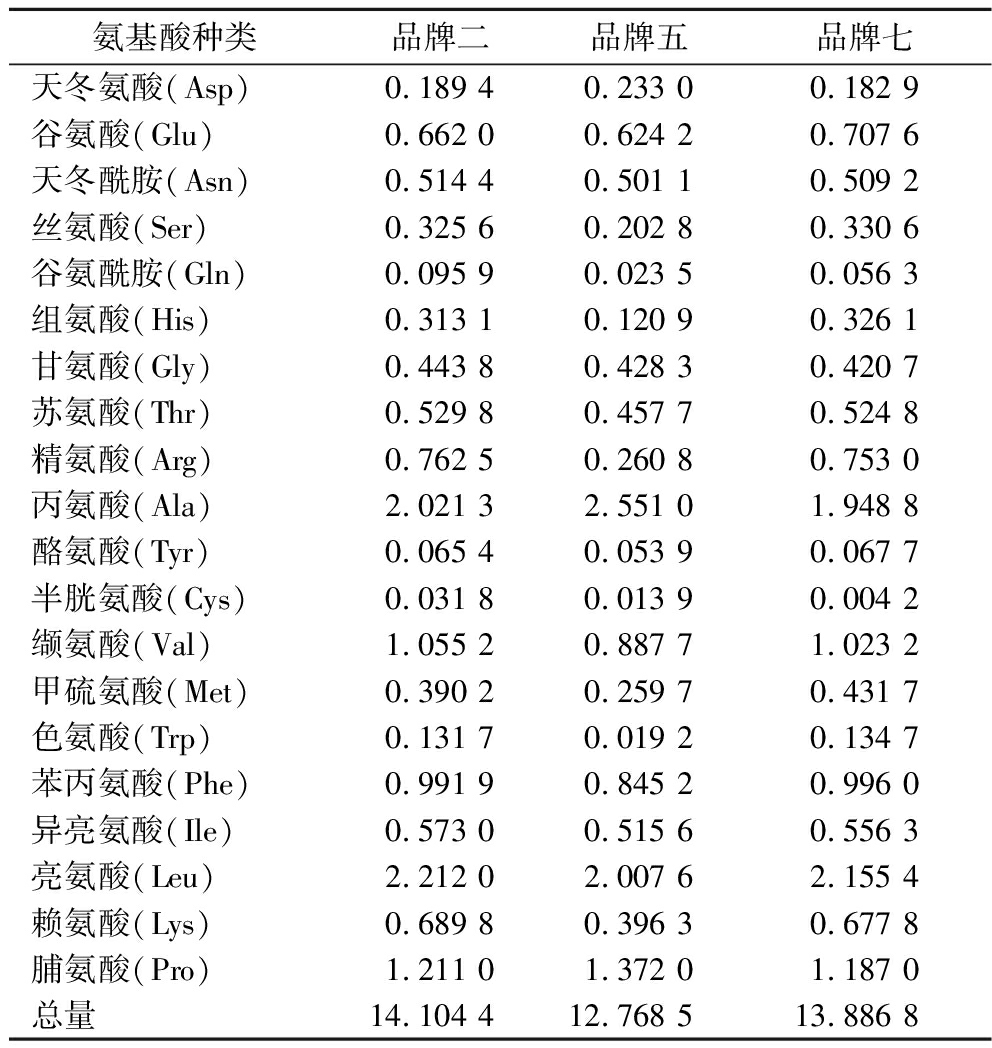
氨基酸种类品牌二品牌五品牌七天冬氨酸(Asp)0.189 40.233 00.182 9谷氨酸(Glu)0.662 00.624 20.707 6天冬酰胺(Asn)0.514 40.501 10.509 2丝氨酸(Ser)0.325 60.202 80.330 6谷氨酰胺(Gln)0.095 90.023 50.056 3组氨酸(His)0.313 10.120 90.326 1甘氨酸(Gly)0.443 80.428 30.420 7苏氨酸(Thr)0.529 80.457 70.524 8精氨酸(Arg)0.762 50.260 80.753 0丙氨酸(Ala)2.021 32.551 01.948 8酪氨酸(Tyr)0.065 40.053 90.067 7半胱氨酸(Cys)0.031 80.013 90.004 2缬氨酸(Val)1.055 20.887 71.023 2甲硫氨酸(Met)0.390 20.259 70.431 7色氨酸(Trp)0.131 70.019 20.134 7苯丙氨酸(Phe)0.991 90.845 20.996 0异亮氨酸(Ile)0.573 00.515 60.556 3亮氨酸(Leu)2.212 02.007 62.155 4赖氨酸(Lys)0.689 80.396 30.677 8脯氨酸(Pro)1.211 01.372 01.187 0总量14.104 412.768 513.886 8
2.4 无机培养基的测试及优化
综合考虑发酵成本、对仪器设备的影响等因素,基于原始玉米浆干粉培养基的配方,结合文献报道相关数据,通过计算得到初步无机培养基的配方(g/L):葡萄糖100;硫酸铵40;磷酸二氢钾1;磷酸氢二钾0.5;硫酸镁1.2;氯化钠5;氯化钾1。并适量补充了部分关键微量成分:谷氨酰胺2 g/L;碳酸钙1.4 g/L;硫酸锰230 mg/L;硫酸锌3 mg/L;硫酸铁60 mg/L[12]。由于C.glutamicum是生物素缺陷型菌株,且玉米浆干粉中天然含有较高浓度的D-生物素,因此为了保持菌株的正常生长,需要在无机培养基中补充生物素。此外,生物素能够抑制谷氨酸的分泌,而谷氨酸可以转化为谷氨酰胺,后者是GlcNAc合成的关键前体。因此,最终在培养基中添加了7.5 mg/L的生物素。上述成分构成了无机培养基的初步配方。随后通过梯度替换实验,用无机培养基梯度替换原始玉米浆干粉培养基。如图4-a所示,无机培养基发酵生产GlcNAc的产量虽然有一定的下降,但下降程度在预期范围以内,进一步验证了无机培养基的可行性。鉴于葡萄糖作为唯一碳源需要配置为母液并单独添加,因此为了简化实验操作,首先对葡萄糖的添加量进行了梯度优化。如图4-b所示,在添加120 g/L葡萄糖时,GlcNAc的产量达到最高,因此后续优化实验均添加120 g/L葡萄糖。
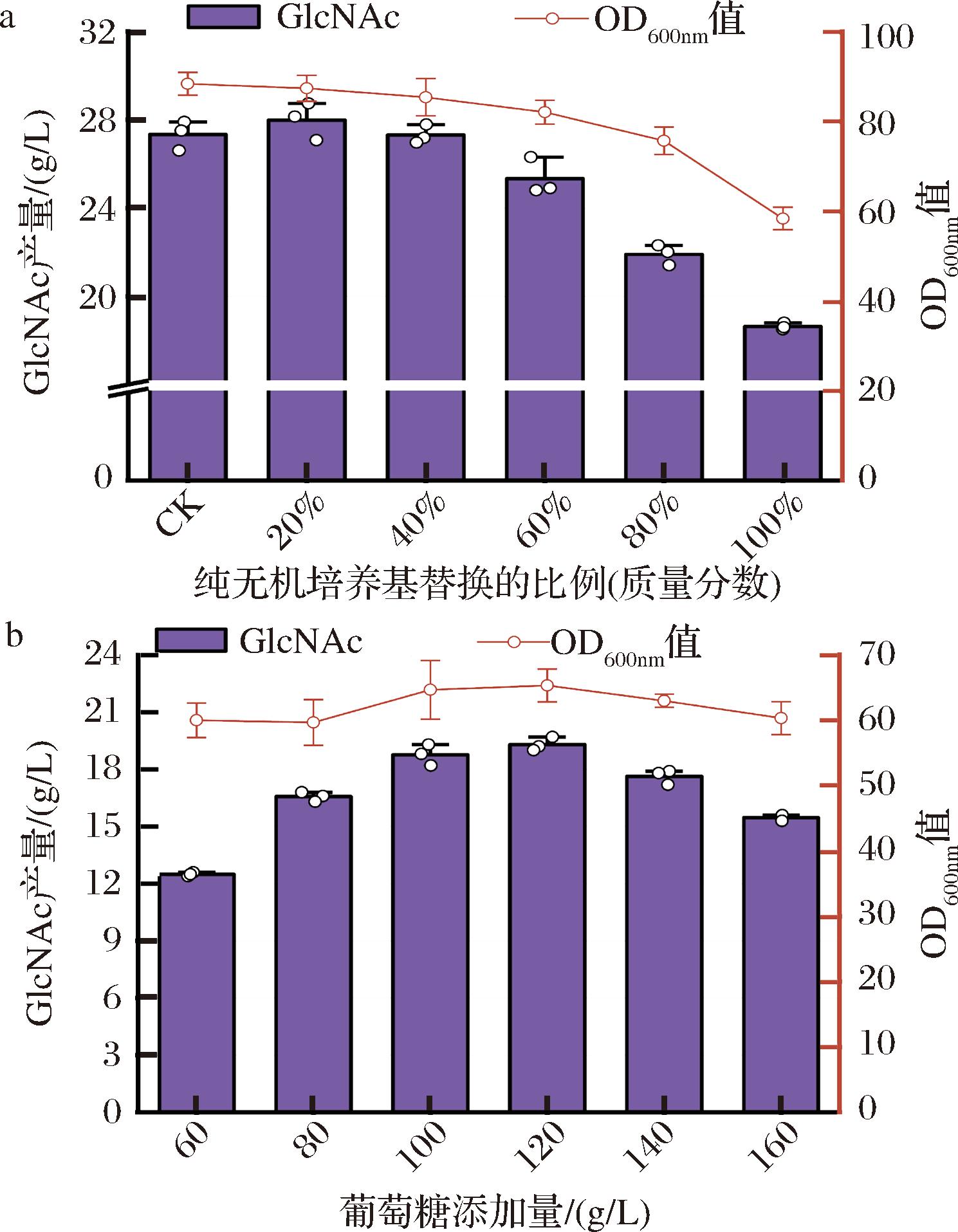
a-无机培养基梯度替换玉米浆干粉发酵生产GlcNAc的产量及菌体浓度;b-葡萄糖最适添加量的优化
图4 无机培养基应用的可行性分析及葡萄糖添加量的优化
Fig.4 Feasibility analysis of inorganic medium application and optimization of glucose addition
之后,针对无机培养基的6种主要成分,进行了响应面优化试验。如表5所示,基于Box-Behnken设计方法,以初步的无机培养基配方为中心点,设计了6因素3水平的中心组合试验,涉及的因素包括硫酸铵、磷酸二氢钾、磷酸氢二钾、硫酸镁、氯化钠和氯化钾。通过Design-Expert 10.0软件设计响应面试验,并进行方差分析。具体的中心组合试验设计及结果如表6所示。多元二次回归方程描述了GlcNAc产量(R)与硫酸铵(A)、磷酸二氢钾(B)、磷酸氢二钾(C)、硫酸镁(D)、氯化钠(E)和氯化钾(F)添加量之间的关系:R=2.23+0.012A-0.21B-0.010C+0.10D-0.090E+0.015F+0.041AB-0.033AC-0.050AD+0.19AE+0.034AF-8.75E-0.032BC-0.24BD-0.025BE-0.13BF-0.052CD+0.12CE+0.64CF+0.14DE+0.14DF+0.26EF-0.76A2-0.47B2-0.41C2-0.42D2-0.28E2+0.073F2。
表5 Box-Behnken试验设计因素与水平 单位:g/L
Table 5 Factors and levels of Box-Behnken tests
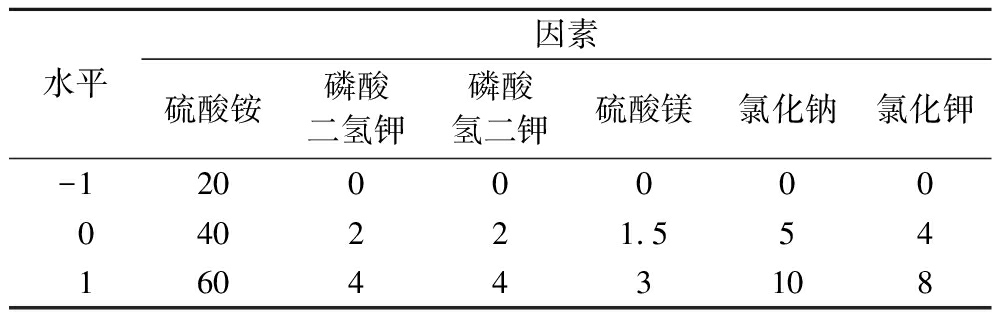
水平因素硫酸铵磷酸二氢钾磷酸氢二钾硫酸镁氯化钠氯化钾-12000000040221.554160443108
表6 Box-Behnken试验结果 单位:g/L
Table 6 Results of Box-Behnken tests
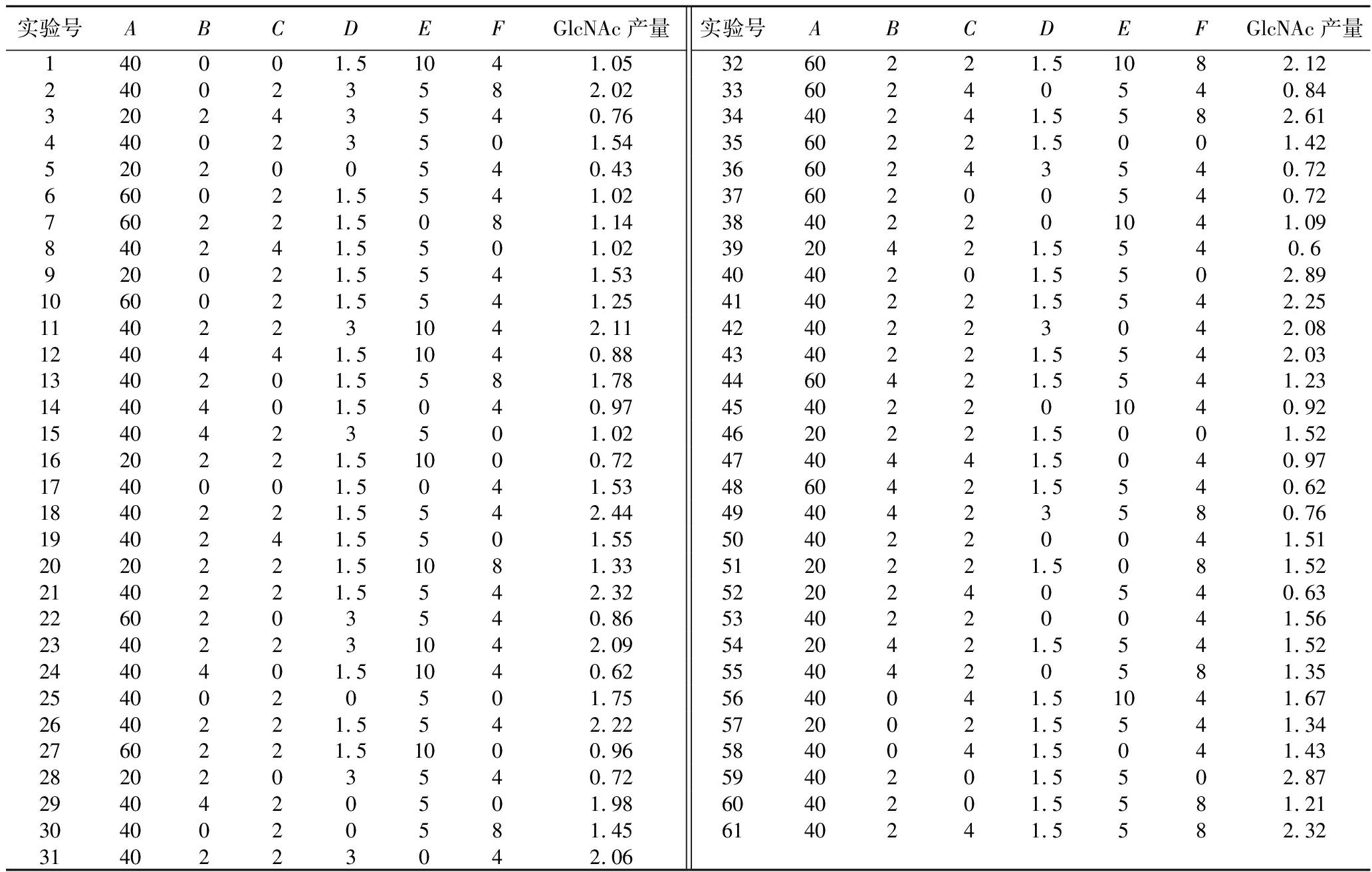
实验号ABCDEFGlcNAc产量实验号ABCDEFGlcNAc产量140001.51041.053260221.51082.12240023582.023360240540.84320243540.763440241.5582.61440023501.543560221.5001.42520200540.433660243540.72660021.5541.023760200540.72760221.5081.1438402201041.09840241.5501.023920421.5540.6920021.5541.534040201.5502.891060021.5541.254140221.5542.2511402231042.114240223042.081240441.51040.884340221.5542.031340201.5581.784460421.5541.231440401.5040.9745402201040.921540423501.024620221.5001.521620221.51000.724740441.5040.971740001.5041.534860421.5540.621840221.5542.444940423580.761940241.5501.555040220041.512020221.51081.335120221.5081.522140221.5542.325220240540.632260203540.865340220041.5623402231042.095420421.5541.522440401.51040.625540420581.352540020501.755640041.51041.672640221.5542.225720021.5541.342760221.51000.965840041.5041.432820203540.725940201.5502.872940420501.986040201.5581.213040020581.456140241.5582.323140223042.06
模型的相关系数R2=0.844 6,模型P值<0.000 1表明模型显著,且失拟项P值0.081 1(>0.05),失拟项不显著,表明该模型可用于C.glutamicum S9114无机培养基的优化。进一步针对实验结果的显著性分析,一次项B、交互项BD、CF、EF及二次项A2、B2、C2、D2、E2对GlcNAc产量有显著影响(P<0.05),其他项对结果影响不显著(P>0.05)。根据F值可知,6种因素对GlcNAc产量的影响顺序为:B>D>E>F>A>C(表7)。之后利用Design-Expert 10.0软件绘制了三维响应面图,如图5-a所示。
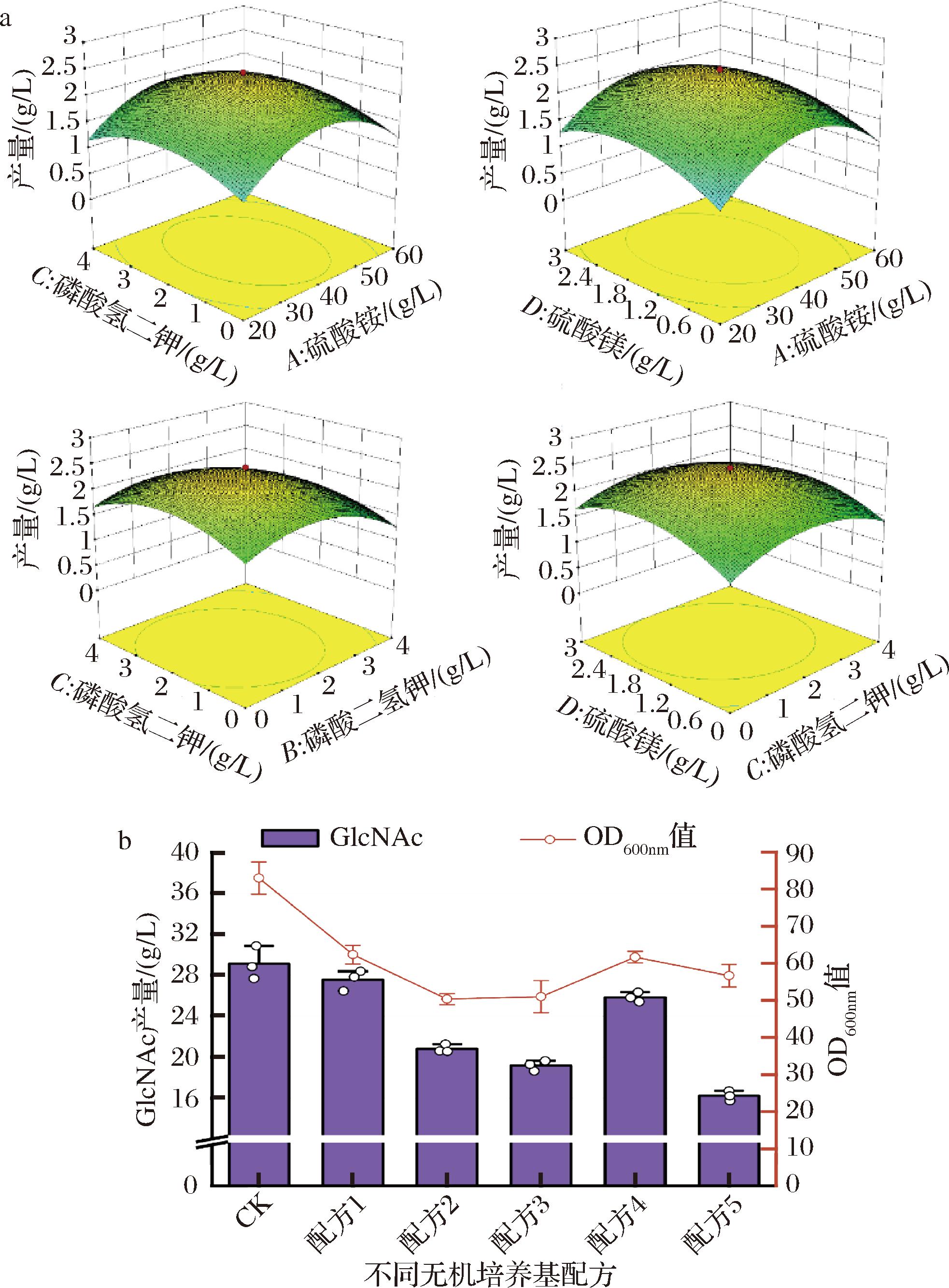
a-各因素交互作用对GlcNAc产量影响的响应曲面图;b-无机培养基发酵生产GlcNAc的产量及菌体浓度
图5 无机培养基优化的响应面图及发酵验证结果
Fig.5 Response surface plot for inorganic medium optimization and fermentation validation results
表7 回归模型的方差分析及显著性检验
Table 7 Variance analysis of regression model

方差来源平方和自由度均方F值P值模型19.010 8270.704 16.644 8<0.000 1(显著)A(硫酸铵)0.003 310.003 30.030 80.861 7B(磷酸二氢钾)1.066 811.066 810.067 80.003 3C(磷酸氢二钾)0.002 610.002 60.024 60.876 4D(硫酸镁)0.262 510.262 52.477 30.125 0E(氯化钠)0.192 610.192 61.817 70.186 8F(氯化钾)0.005 710.005 70.053 80.818 0AB0.013 610.013 60.128 50.722 3AC0.008 410.008 40.079 70.779 4AD0.020 010.020 00.188 70.666 8AE0.285 010.285 02.689 70.110 5AF0.009 110.009 10.086 00.771 2BC0.008 410.008 40.079 70.779 4BD0.456 010.456 04.303 50.045 9BE0.005 010.005 00.047 20.829 4BF0.143 110.143 11.350 60.253 5CD0.022 010.022 00.208 10.651 3CE0.120 110.120 11.132 90.294 9CF3.289 613.289 631.045 0<0.000 1DE0.156 810.156 81.479 80.232 4DF0.165 310.165 31.560 10.220 4EF0.525 310.525 34.957 50.032 9A27.717 117.717 172.828 1<0.000 1B22.996 912.996 928.282 9<0.000 1C22.292 312.292 321.633 1<0.000 1D22.348 012.348 022.158 7<0.000 1E21.013 311.013 39.562 90.004 0F20.072 210.072 20.681 50.415 0残差3.496 8330.106 0失拟项2.391 5170.140 72.036 40.081 1(不显著)纯误差1.105 3160.069 1总和22.507 660
为进一步探索最佳的无机培养基,基于优化结果选取了5种无机培养基进行发酵验证,如表8所示。实验结果表明,使用配方一的无机培养基最终产量与使用玉米浆干粉培养基的对照组效果相当,产量达到27.5 g/L(图5-b)。也即确定了最佳的无机培养基的配方(g/L):葡萄糖120;硫酸铵38.1;磷酸二氢钾2.0;磷酸氢二钾0.3;硫酸镁1.2;氯化钠0.4;谷氨酰胺2;碳酸钙1.4;硫酸锰230 mg/L;硫酸锌3 mg/L;硫酸铁60 mg/L;D-生物素7.5 mg/L。
表8 五种无机培养基配方 单位:g/L
Table 8 Five inorganic media formulations
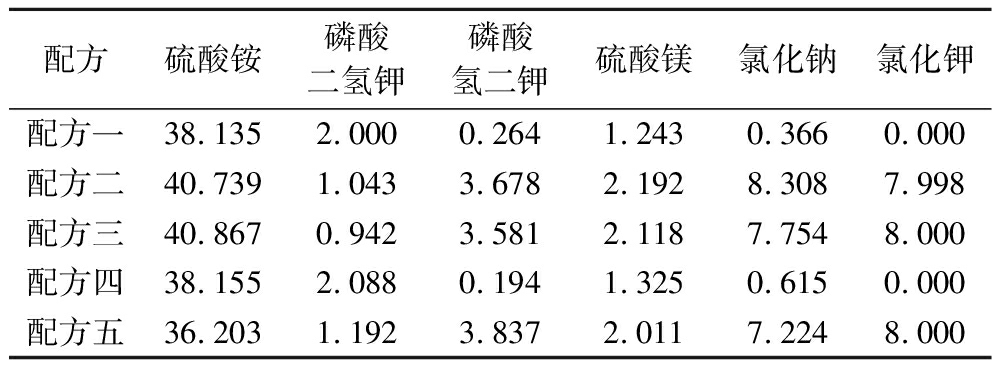
配方硫酸铵磷酸二氢钾磷酸氢二钾硫酸镁氯化钠氯化钾配方一38.1352.0000.2641.2430.3660.000配方二40.7391.0433.6782.1928.3087.998配方三40.8670.9423.5812.1187.7548.000配方四38.1552.0880.1941.3250.6150.000配方五36.2031.1923.8372.0117.2248.000
3 结论
GlcNAc作为一种重要的功能性单糖,因其在治疗关节炎和缓解骨质疏松等方面的潜在功能而受到广泛关注。随着市场需求的不断增长,工业化合成GlcNAc需要更加高效、稳定且经济的生产工艺。本研究通过代谢工程手段,优化了GlcNAc合成途径中关键酶的表达,并抑制了竞争性代谢途径,成功构建了一株高效合成GlcNAc的菌株。在此基础上,设计并优化了无机盐培养基配方,克服了传统玉米浆干粉培养基导致的发酵不稳定现象。然而,使用纯无机培养基发酵生产GlcNAc时,菌体OD值较传统玉米浆干粉培养基有所下降,未来需要进一步探索影响菌体生长的组分,进一步推动无机培养基的应用。
[1] MTEWA A G, ANNU A, WEISHEIT A, et al.Glucosamine and Chondroitin in Osteoarthritis Treatment[M].Preparation of Phytopharmaceuticals for the Management of Disorders.Amsterdam:Elsevier, 2021:373-380.
[2] MATTIUZZO E, FAGGIAN A, VENERANDO R, et al.In vitro effects of low doses of β-caryophyllene, ascorbic acid and D-glucosamine on human chondrocyte viability and inflammation[J].Pharmaceuticals, 2021, 14(3):286.
[3] WANG X S, LIU D S, LI D, et al.Combined treatment with glucosamine and chondroitin sulfate improves rheumatoid arthritis in rats by regulating the gut microbiota[J].Nutrition &Metabolism, 2023, 20(1):22.
[4] LI G W, ZHANG X H, LIU Y X, et al.Relationship between glucosamine use and the risk of lung cancer:Data from a nationwide prospective cohort study[J].The European Respiratory Journal, 2022, 59(3):DOI:10.1183/13993003.01399-2021.
[5] D’ESTE M, ALVARADO-MORALES M, ANGELIDAKI I.Amino acids production focusing on fermentation technologies—A review[J].Biotechnology Advances, 2018, 36(1):14-25.
[6] KIEFER D, TADELE L R, LILGE L, et al.High-level recombinant protein production with Corynebacterium glutamicum using acetate as carbon source[J].Microbial Biotechnology, 2022, 15(11):2744-2757.
[7] LI Z M, WANG Q T, LIU H, et al.Engineering Corynebacterium glutamicum for the efficient production of N-acetylglucosamine[J].Bioresource Technology, 2023, 390:129865.
[8] LV Y Y, WU Z H, HAN S Y, et al.Genome sequence of Corynebacterium glutamicum S9114, a strain for industrial production of glutamate[J].Journal of Bacteriology, 2011, 193(21):6096-6097.
[9] DENG C, LV X Q, LIU Y F, et al.Metabolic engineering of Corynebacterium glutamicum S9114 based on whole-genome sequencing for efficient N-acetylglucosamine synthesis[J].Synthetic and Systems Biotechnology, 2019, 4(3):120-129.[10] ZHOU K M, YU J, MA Y H, et al.Corn steep liquor:Green biological resources for bioindustry[J].Applied Biochemistry and Biotechnology, 2022, 194(7):3280-3295.
[11] WANG F, HU J H, GUO C, et al.Enhanced laccase production by Trametes versicolor using corn steep liquor as both nitrogen source and inducer[J].Bioresource Technology, 2014, 166:602-605.
[12] 刘跃芹, 赵雪松, 吴杰, 等.高效液相色谱法测定玉米浆干粉中维生素B6的含量[J].食品工业科技, 2013, 34(24):61-63.LIU Y Q, ZHAO X S, WU J, et al.Determination of content of vitamin B6 in dry powder of corn steep liquor by HPLC[J].Science and Technology of Food Industry, 2013, 34(24):61-63.
[13] GAO Y, YUAN Y J.Comprehensive quality evaluation of corn steep liquor in 2-keto-L-gulonic acid fermentation[J].Journal of Agricultural and Food Chemistry, 2011, 59(18):9845-9853.
[14] J GER W, SCH
GER W, SCH FER A, PÜHLER A, et al.Expression of the Bacillus subtilis sacB gene leads to sucrose sensitivity in the gram-positive bacterium Corynebacterium glutamicum but not in Streptomyces lividans[J].Journal of Bacteriology, 1992, 174(16):5462-5465.
FER A, PÜHLER A, et al.Expression of the Bacillus subtilis sacB gene leads to sucrose sensitivity in the gram-positive bacterium Corynebacterium glutamicum but not in Streptomyces lividans[J].Journal of Bacteriology, 1992, 174(16):5462-5465.
[15] ALVAREZ-A ORVE L I, BUSTOS-JAIMES I, CALCAGNO M L, et al.Allosteric regulation of glucosamine-6-phosphate deaminase (NagB) and growth of Escherichia coli on glucosamine[J].Journal of Bacteriology, 2009, 191(20):6401-6407.
ORVE L I, BUSTOS-JAIMES I, CALCAGNO M L, et al.Allosteric regulation of glucosamine-6-phosphate deaminase (NagB) and growth of Escherichia coli on glucosamine[J].Journal of Bacteriology, 2009, 191(20):6401-6407.
[16] CHANG Z S, DAI W, MAO Y F, et al.Engineering Corynebacterium glutamicum for the efficient production of 3-hydroxypropionic acid from a mixture of glucose and acetate via the malonyl-CoA pathway[J].Catalysts, 2020, 10(2):203.
[17] HU J Y, LI Y Y, ZHANG H L, et al.Construction of a novel expression system for use in Corynebacterium glutamicum[J].Plasmid, 2014, 75:18-26.
[18] HENKE N A, KRAHN I, WENDISCH V F.Improved plasmid-based inducible and constitutive gene expression in Corynebacterium glutamicum[J].Microorganisms, 2021, 9(1):204.
[19] ZHAO P, MA C L, XU L D, et al.Exploiting tandem repetitive promoters for high-level production of 3-hydroxypropionic acid[J].Applied Microbiology and Biotechnology, 2019, 103(10):4017-4031.
[20] ZHANG S H, LIU D Y, MAO Z T, et al.Model-based reconstruction of synthetic promoter library in Corynebacterium glutamicum[J].Biotechnology Letters, 2018, 40(5):819-827.
[21] ROHLES C M, GL SER L, KOHLSTEDT M, et al.A bio-based route to the carbon-5 chemical glutaric acid and to bionylon-6,5 using metabolically engineered Corynebacterium glutamicum[J].Green Chemistry, 2018, 20(20):4662-4674.
SER L, KOHLSTEDT M, et al.A bio-based route to the carbon-5 chemical glutaric acid and to bionylon-6,5 using metabolically engineered Corynebacterium glutamicum[J].Green Chemistry, 2018, 20(20):4662-4674.
[22] 王迎春, 刘娇, 倪晓蒙, 等.基于时间序列转录组筛选谷氨酸棒杆菌内源高效组成型启动子[J].生物工程学报, 2018, 34(11):1760-1771.WANG Y C, LIU J, NI X M, et al.Screening efficient constitutive promoters in Corynebacterium glutamicum based on time-series transcriptome analysis[J].Chinese Journal of Biotechnology.2018, 34(11):1760-1771.
[23] WEI L, XU N, WANG Y R, et al.Promoter library-based module combination (PLMC) technology for optimization of threonine biosynthesis in Corynebacterium glutamicum[J].Applied Microbiology and Biotechnology, 2018, 102(9):4117-4130.
[24] WAHJUDI S M W, PETRZIK T, OUDENNE F, et al.Unraveling the potential and constraints associated with corn steep liquor as a nutrient source for industrial fermentations[J].Biotechnology Progress, 2023, 39(6):e3386.