蛋白质是食品的重要成分,其乳化特性是影响蛋白饮料、人造奶油等乳化食品制备的关键功能性质之一。动物蛋白是目前常用的食品乳化剂,其乳化性能优异,但价格昂贵且产量低,难以满足市场需求。我国是农业生产大国,具有丰富且价格低廉的植物蛋白来源,因此植物蛋白是动物蛋白的潜在替代原料。小麦面筋蛋白(wheat gluten,WG)由谷蛋白和醇溶蛋白组成,分别以分子间二硫键形成网络结构和分子内二硫键构成球状结构,赋予WG良好的黏弹性和延展性,使其在面制品和烘焙品等领域有所应用。然而,WG紧密的分子结构和较多疏水基团导致其乳化性能较差[1],且WG的ω-5醇溶蛋白和谷蛋白是诱发免疫球蛋白(immunoglobulin E,IgE)介导过敏反应的过敏原[2],造成WG在乳化食品等领域中应用受限,对其进行结构改性是提高应用价值的常用手段之一。
蛋白质改性方法包括物理、酶和化学法。化学法因其条件可控且效率高,能实现蛋白质均一修饰而被用于工业化生产,但如酰化、磷酸化等法易残留有害物质而限制了其在食品领域的应用。化学法中,酸法脱酰胺通过修饰WG的二级结构来掩盖IgE表位结合域,降低其致敏性[3],且相较于碱法脱酰胺,对食品营养价值负面影响更小,具有更高的安全性和应用潜力。它通过酸性试剂电离出的H+催化蛋白侧链的酰胺基团(—CONH2)水解成羧基(—COOH),增强蛋白质的亲水性和结构柔顺性,改善蛋白质的溶解性和乳化特性[4]。这种改性手段可同时实现WG功能提升与致敏性调控的双重目标,但目前关于脱酰胺与致敏性消减的定量关系仍不明确。盐酸的脱酰胺效果优异,但存在肽键水解、氨基酸异构化及致癌物产生等副反应[5],这也是酸法脱酰胺存在的问题。研究发现有机酸可通过调控pH和温度等因素来代替盐酸使脱酰胺反应更加温和,有效减少副反应,使反应向有利于脱酰胺方向进行。如廖兰[6]发现0.038 mol/L柠檬酸对WG的脱酰胺效果与0.055 mol/L盐酸相近,且水解度(degree of hydrolysis,DH)更低,表明柠檬酸是兼具脱酰胺效率与致敏原消减潜力的改性试剂。
此外,WG经有机酸脱酰胺后,其乳化性能测定方法的准确性对了解脱酰胺后WG的结构变化和乳化机制具有重要意义。目前分析有机酸脱酰胺对WG乳化性能的影响主要采用浊度法,但其实验结果并不一致。如蔡玉红等[7]使用浊度法测定脱酰胺后大米蛋白的乳化稳定指数(emulsifying stability index, ESI)上升,而ZHANG等[8]的研究结果与之截然相反,这说明由浊度法测量的结果并不准确。该法由于颗粒大小、形状和颜色等因素影响会导致测量产生误差,因此被证明不是表征微米级液滴的最可靠方法[9]。激光粒度分布仪能够测定乳液粒度分布和平均粒径,已被证明是乳液表征的标准技术[9];而激光共聚焦显微镜(confocal laser scanning microscopy, CLSM)能够监测乳液滴大小和分布,提供微观图像,甚至可检测乳液界面层结构,结合这2种技术可以更准确地判断乳化剂的乳化性能,为乳液的形成和稳定机制提供合理解释。目前鲜有研究利用该法来探究脱酰胺对WG乳化性能的影响。
因此,本研究采用上述2种技术全面探究柠檬酸脱酰胺对WG乳化性能的影响,并通过Zeta电位、二级结构、表面疏水性和界面压力等测定来系统性地阐述其作用机理。为开发新型、高效、廉价的植物蛋白乳化剂提供更多的理论依据。
1 材料与方法
1.1 材料与试剂
小麦面筋蛋白,河南莲花面粉有限公司,蛋白质量含量为(82.15±0.14)%,水分质量含量为(8.02±0.10)%,灰分质量含量为(0.64±0.15)%,脂肪质量含量为(5.98±0.25)%;葵花籽油,益海嘉里金龙鱼粮油股份有限公司;无水柠檬酸,国药集团化学试剂有限公司;亚硝基铁氰化钠、福林酚和1-苯胺基-8-萘磺酸(8-anilino-1-naphthalenesulfonic acid, ANS),均购于上海麦克林生化科技有限公司;次氯酸钠(有效氯≥5.0%),上海阿拉丁生化科技股份有限公司;其他试剂均为国产分析纯。
1.2 仪器与设备
DF-101S集热式恒温加热磁力搅拌器,力辰科技有限公司;AH-NANO超高压纳米均质机,ATS工业系统有限公司;Mastersizer3000激光粒度分布仪,英国马尔文仪器有限公司;iS50R全波段研究级红外光谱工作站,美国Thermo-Filsher公司;BI-200SM zeta电位及粒度分析仪,美国布鲁克海文公司;OCA50视频光学接触角测量仪,德国Dataphysics公司;LSM 800 激光共聚焦显微镜,德国Carl Zeiss公司。
1.3 实验方法
1.3.1 脱酰胺小麦面筋蛋白(deamidated wheat gluten,DWG)的制备
将80 g/L的WG分散在100 mL 0.3 mol/L的柠檬酸溶液中,形成均匀分散的悬浮液,然后将悬浮液置于70 ℃的水浴锅中加热搅拌4、8、12、16、20、24、28 h,反应结束后冰浴冷却,并将其pH调至7.0以终止反应,然后将溶液转移至透析袋中进行透析,用去离子水透析36 h,去除铵盐,最后将样品进行冷冻干燥,得到不同处理时间下的DWG粉末(记为DWG4、DWG8、DWG12、DWG16、DWG20、DWG24和DWG28)。
1.3.2 脱酰胺度(degree of deamidation,DD)的测定
采用苯酚—次氯酸盐法进行测定[10]。样品游离氨测定:准确吸取2.50 mL苯酚-亚硝基铁氰化钠溶液于试管中,加入10 μL不同浓度的硫酸铵标准溶液(质量浓度为0.2、0.4、0.6、0.8、1.0 μg/L)或待测溶液,充分摇匀后再准确移取2.50 mL的碱性次氯酸盐溶液加入到上述混合溶液中,充分摇匀,将其置于37 ℃ 下水浴反应20 min,最后冷却至室温,测定其在625 nm处吸光值。样品总酰胺含量测定:称取5.0 g的WG,加入到丝口瓶中,然后加入20 mL 3 mol/L的硫酸,在110 ℃条件下搅拌加热水解3 h。反应结束后,用1 mol/L的NaOH溶液中和至中性,然后用去离子水稀释至一定倍数,测定其在625 nm 处的吸光值,根据标准曲线计算出样品中总酰胺含量。标准曲线公式为y=0.341 6 x+0.032 9,R2=0.999 5。DD计算公式见公式(1):
(1)
1.3.3 DH的测定
采用甲醛滴定法进行测定[11]。将待测样品在10 000 r/min下离心5 min,吸取1 mL上清液于锥形瓶中,加入10 mL去离子水,混匀后用0.1 mol/L的NaOH标准溶液滴定至pH 8.2,记为V1,然后加入5 mL 0.37 g/mL中性甲醛,混匀后用上述氢氧化钠标准溶液滴定至pH 9.2,记为V2。用去离子水代替待测样品进行上述步骤,记录加入甲醛后消耗的氢氧化钠体积,记为空白V0。样品和空白均做3次平行试验。游离氨基氮(free amino nitrogen,FAN)和DH计算公式分别见公式(2)和公式(3):
FAN/mg=CNaOH×(V2-V0)×14
(2)
(3)
式中:CNaOH,标准氢氧化钠溶液的浓度,mol/L;14,氮的相对分子质量;10-3,单位换算;M,蛋白质样品质量,g;N,总含氮量,%。
1.3.4 溶解度的测定
采用LOWRY法进行测定。用pH 7.0的PBS将蛋白样品配制成10 mg/mL的分散液,磁力搅拌1 h以上,在10 000 r/min下离心10 min,吸取上清液进行一定程度稀释。准确吸取1 mL不同浓度的牛血清白蛋白标准溶液(质量浓度为0.1、0.2、0.4、0.6、0.8、1.0 mg/mL)或稀释样品液于试管中,加入5.0 mL碱式硫酸铜溶液,摇匀后静置10 min后加入0.5 mL的福林酚试剂,再摇匀后静置30 min,测定其在500 nm处的吸光值。标准曲线公式为y=0.001x+0.032 7,R2=0.996 3。蛋白溶解度(protein solubility,PS)计算公式见公式(4):
(4)
1.3.5 Zeta电位及等电点的测定
将所有蛋白样品分别溶于pH 7.0的PBS配制成2 mg/mL溶液,并进行一定程度的稀释,然后在25 ℃下测定各个蛋白样品的Zeta电位。用pH 2.0~9.0的PBS将WG和DWG24分别配制成2 mg/mL溶液,按照上述步骤进行Zeta电位的测试。
1.3.6 乳液制备及其粒径和乳析率的测定
将一定质量浓度(WG为5~80 g/L;DWG24为2.5~40 g/L)的蛋白样品分散在去离子水(pH 7.0)中,并将这些溶液分别与质量分数为10%的葵花籽油混合,在室温下用高速均质机12 000 r/min下均质2 min,获得初乳液,初乳液再用超高压均质机经30 MPa 下均质3次得到最终的乳液样品。
使用激光粒度分布仪测定室温下不同蛋白样品制备的乳液的粒径分布和平均粒径。葵花籽油和水的折射率分别为1.468和1.330。乳液的粒度分布由仪器测得,平均粒径表示为体积加权平均粒径d4,3;每个样品重复测量3次,结果取平均值。
将制备好的乳液转移到25 mL样品瓶中,加入质量分数为0.01%的叠氮化钠以抑制微生物生长,然后将乳液样品置于4 ℃冰箱下贮藏1 d,拍照记录经1 d贮藏后的乳液的分层情况,并测定乳液经过1 d贮藏后的乳析率,计算公式见公式(5):
乳析率![]()
(5)
1.3.7 乳液微观结构的测定
乳液按照1.3.6节的方法制备。参考黄培文等[12]的测定方法。乳液微观结构采用CLSM观察。将制备好的乳液样品分别用2~3滴的尼罗红试剂(1 mg/mL,1,2-丙二醇作为溶剂)和尼罗蓝试剂(1 mg/mL,去离子水作为溶剂)对乳液中的蛋白质和油滴进行染色并孵育。最后将染色好的乳液样品滴加到载玻片上,盖上盖玻片以防止液滴流动,并将其倒置,使用2个激发光源(488、633 nm)对乳液进行激发,并测定分析。其中尼罗红对油相染色并呈绿色;尼罗蓝对蛋白质染色并呈红色。
1.3.8 表面疏水性的测定
参考DENG等[13]的方法稍作修改,采用ANS荧光探针法测定样品的表面疏水性。将样品分散在PBS中(0.01 mol/L,pH 7.0)配制成质量浓度为0.05~1.0 mg/mL的蛋白溶液,在10 000 r/min下离心5 min,吸取4.0 mL上清液,加入20 μL的ANS溶液(8 mmol/L),混合均匀,最后用酶标仪测定荧光强度。激发波长和发射波长为390 nm和470 nm,激发和发射狭缝为10 nm。以蛋白浓度对荧光强度绘图,并进行线性拟合,直线的斜率即表示蛋白样品的表面疏水性。
1.3.9 蛋白质二级结构的测定
按照1∶200的质量比分别称取冷冻干燥后的蛋白样品与干燥KBr进行混合,研磨均匀后进行压片,以干燥空气为背景,在4 000~400 cm-1的波段范围内扫描样品32次,分辨率为4 cm-1。选择图谱中酰胺I带区域(1 600~1 700 cm-1)的图谱,用PeakFit v4.12软件进行Gaussian去卷积和二阶求导拟合等处理进行分峰分析,最后根据分峰信息计算得到各个样品的二级结构组成及相对含量。其中各子峰与二级结构对应关系为:1 600~1 640 cm-1和1 680~1 700 cm-1为β-折叠;1 640~1 650 cm-1为无规则卷曲;1 650~1 660 cm-1为α-螺旋;1 660~1 680 cm-1为β-转角[14]。
1.3.10 界面压力的测定
采用悬滴法进行测定[15]。将蛋白样品分散在pH 7.0的PBS缓冲液(17.5 mmol/L)中配制成不同质量浓度(0.01~50 g/L)的溶液,并分别将这些溶液过0.22 μm水系滤膜,测定各溶液的密度,然后使用接触角测量仪测定蛋白样品在油-水界面上的吸附情况。使用平头针吸取蛋白样品溶液,通过仪器程序控制针头滴出10 μL的样品溶液液滴,用电荷耦合配件(chcorge-coupled device,CCD)连续采集液滴图像,通过Young-Laplace方程对液滴图像进行分析并计算得到界面张力值。动态界面压力表示为π=σ0-σ,其中σ0为样品溶剂在油-水界面的界面张力,σ为样品溶液在油-水界面上的界面张力。所有吸附实验均在室温下进行,测试时间为3 h。
1.4 数据处理与分析
本实验所有数据均进行3次平行测定,数据以“平均值±标准差”表示。使用IBM SPSS Statistics 26软件对数据进行显著性分析,P<0.05表示数据之间存在显著性差异。采用Origin软件对原始数据进行整理和绘图。
2 结果与分析
2.1 脱酰胺反应时间对小麦面筋蛋白DD和DH的影响
脱酰胺改性的效果与底物蛋白特性、水解用酸和DD密切相关,其中DD是指水解成羧基的酰胺基团占蛋白中酰胺基团总量的百分比。如图1所示,WG的DD随反应时间(0~28 h)的延长而逐渐增大后趋于平缓,当反应时间达到24 h时,WG的DD达到最大值32.83%。因此可以通过控制反应时间,制备出DD从小到大、彼此相差不大的一系列DWG。蛋白质在酸法脱酰胺过程中通常会伴随着肽键的水解,因此本研究还测定了WG在不同脱酰胺反应时间下的DH。结果发现DWG的DH随反应时间的延长而增大,这一结果与文献报道[16]的相似。当反应时间为24 h时,DWG的DH为6.57%。蛋白质的结构稳定性依赖于其溶液pH环境,柠檬酸会干扰WG的稳定结构,导致WG暴露出更多的肽键,使WG在热处理下肽键断裂的几率增大。
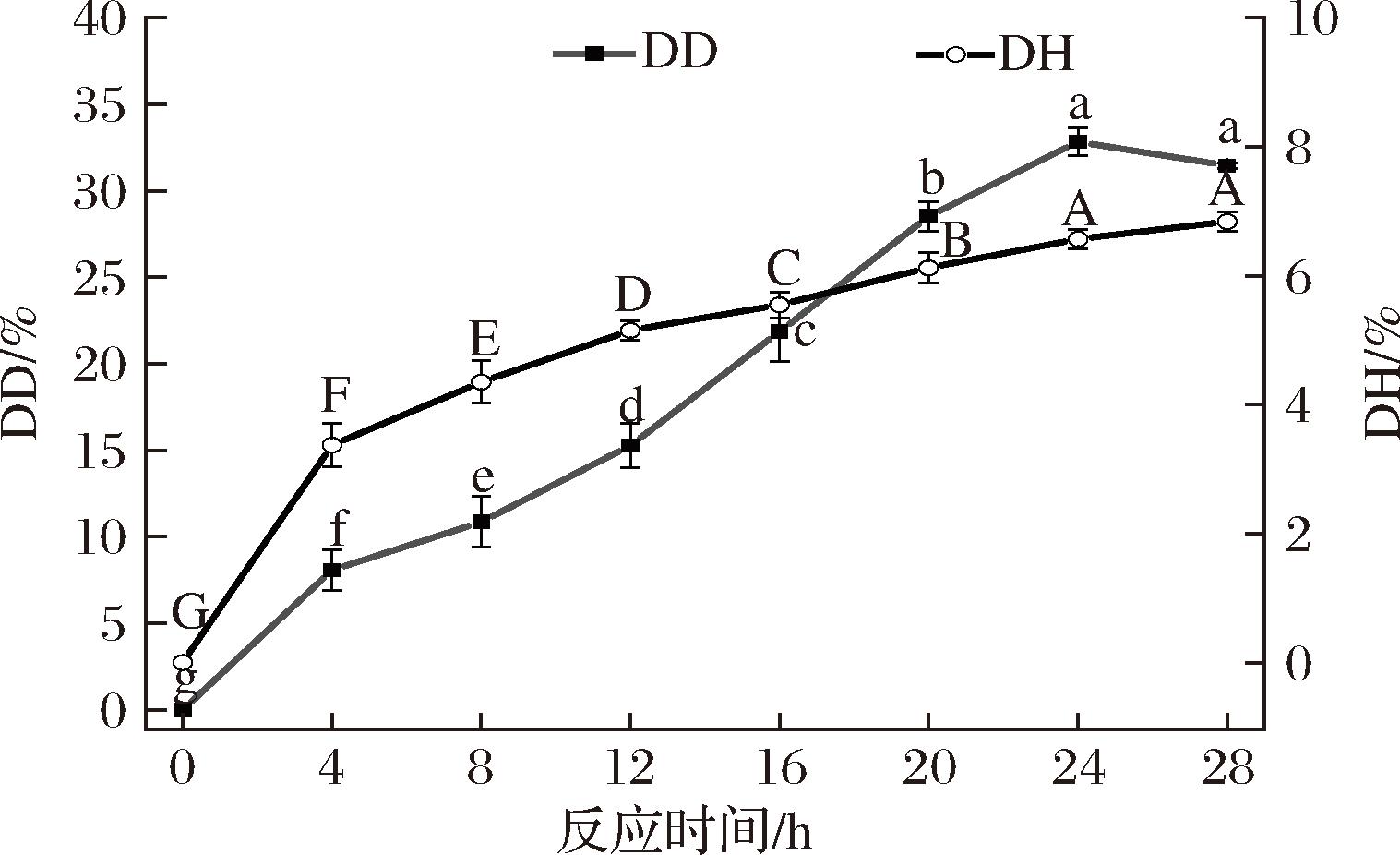
图1 反应时间对WG的DD和DH的影响
Fig.1 Effect of reaction time on DD and DH of WG
注:不同大写字母(A, B, C)之间、小写字母(a, b, c)之间均存在显著性差异(P<0.05)(下同)。
2.2 脱酰胺反应时间对小麦面筋蛋白PS的影响
图2-a显示了DWG的PS在pH 7.0中性条件下随脱酰胺反应时间的变化。对照WG的PS为7.85%,随着脱酰胺反应的进行,DWG的PS逐渐提高并在反应16 h后趋于平缓,当反应时间为24 h,DWG的PS提升至65.92%,表明柠檬酸脱酰胺改性可显著提高WG的PS。柠檬酸脱酰胺在温和条件下催化蛋白侧链中的—CONH2水解成—COOH,使蛋白亲水性增强、分子结构伸展,从而使PS提高。
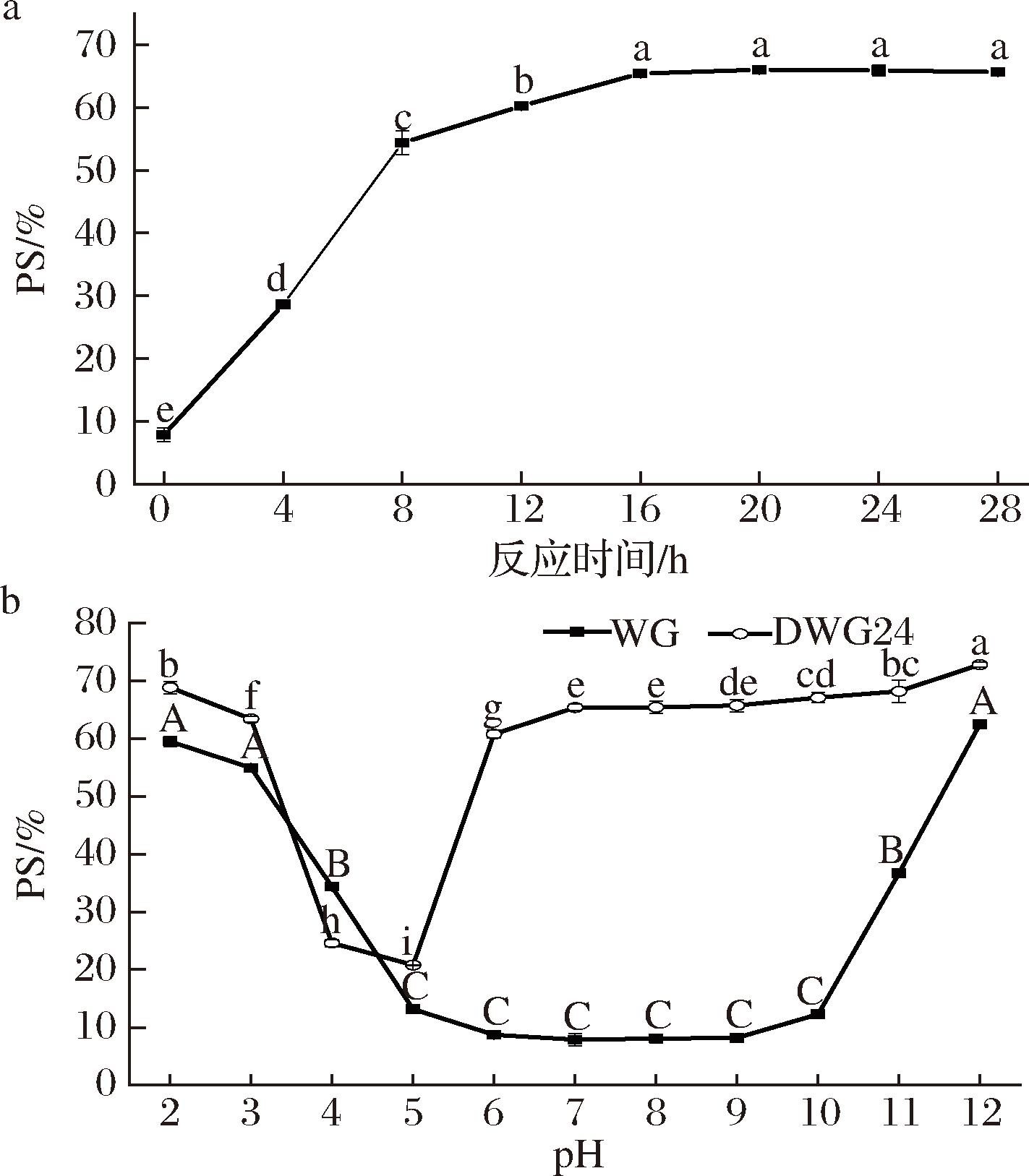
a-不同脱酰胺反应时间的WG在中性条件下的PS;b-WG与DWG24在pH 2-12下的PS
图2 反应时间对WGPS的影响及WG与DWG24在不同pH下的PS
Fig.2 Effect of reaction time on the solubility of WG and pH-dependent solubility profiles of WG and DWG24
图2-b显示了WG与DWG24在pH 2.0~12.0下的PS。对照WG的PS-pH关系类似一条U型曲线:在pH 12.0时,其PS最高为62.52%;pH 6.0~10.0是WG的等电点区域,PS最低,仅为7.85%~12.26%;在pH 2.0~5.0,WG的PS值从13.16%(pH 5.0)上升至59.50%(pH 2.0)。这可能是因为WG远离等电点后其表面电荷量增加,导致WG的静电排斥作用增强,其PS在远离等电点时增大,使WG的PS-pH关系呈现类似U型曲线。与WG相比,DWG24的PS-pH关系发生了明显变化:DWG24在pH 6.0~10.0的PS显著增大,达到60.81%~67.13%;DWG24在pH 4.0~5.0时PS最低,为20.77%~24.61%。这一结果与FU等[17]报道的结果相似,可能是因为脱酰胺使DWG24的—CONH2转变为—COOH,导致其等电点发生偏移,从而使DWG24的PS在中性pH下显著提高,而最低PS向酸性方向偏移。
2.3 脱酰胺反应时间对小麦面筋蛋白的Zeta电位及等电点的影响
蛋白溶解性与其表面电荷量密切相关[18]。图3-a显示了DWG的Zeta电位在pH 7.0下随脱酰胺反应时间的变化。WG的Zeta电位为-0.85 mV,随着脱酰胺反应的进行,DWG的Zeta电位逐渐降低,当反应时间为24 h时,DWG的Zeta电位降低至-11.72 mV。这一结果与MA等[19]的研究结果相似。脱酰胺使DWG的—CONH2转化为—COOH,这种羧化反应减少了DWG分子间的氢键,增强其静电排斥力,从而一定程度促进DWG分子结构伸展,提高其溶解性。
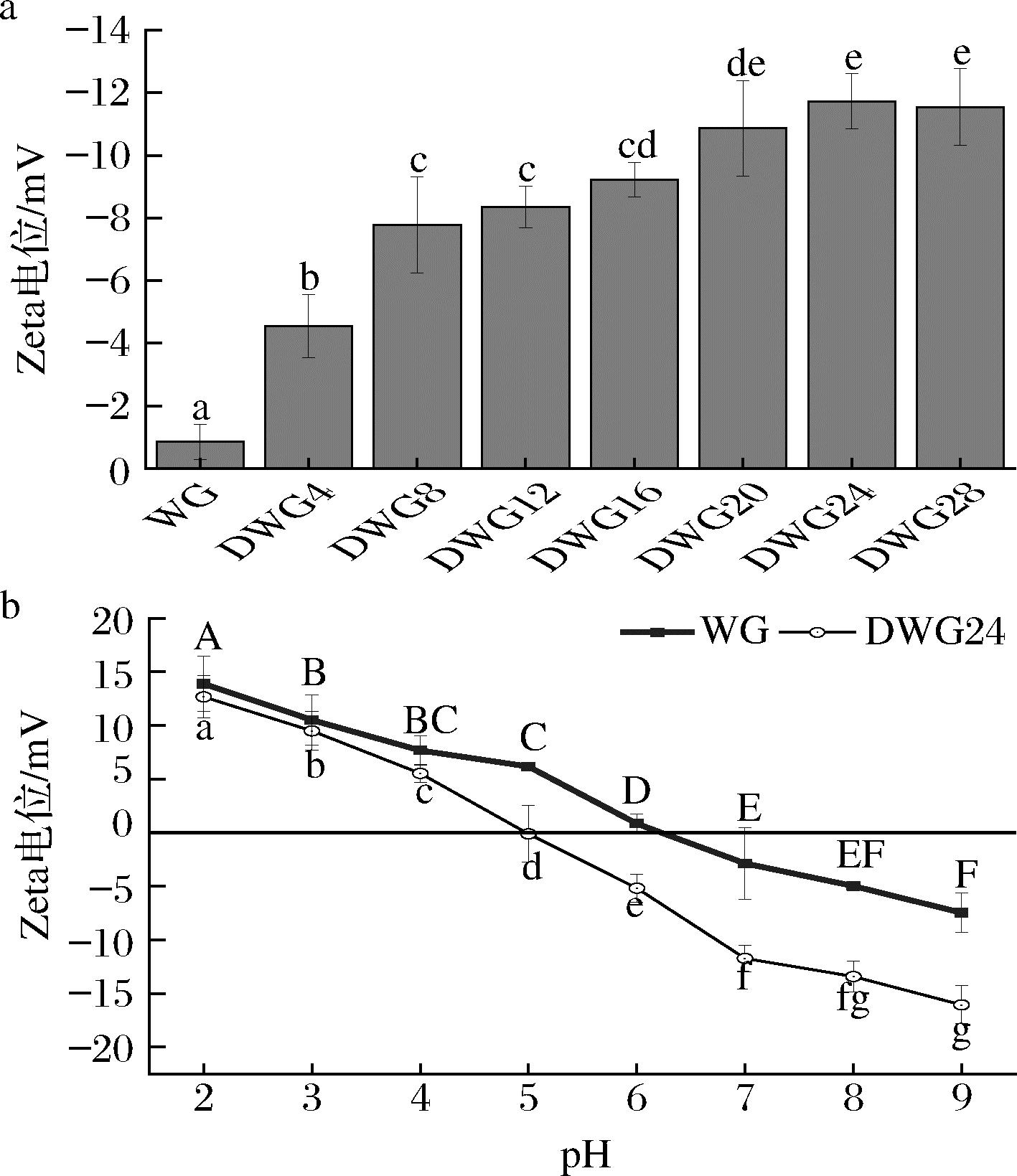
a-不同脱酰胺反应时间的WG在中性条件下的Zeta电位;b-WG与DWG24在pH 2~9下的Zeta电位
图3 不同脱酰胺程度WG的Zeta电位以及WG与DWG24的电位随pH的变化
Fig.3 Zeta potential of WG with varying deamidation degrees and pH-dependent changes in surface charge characteristics of WG and DWG24
WG和DWG24的Zeta电位与pH的关系如图3-b所示。WG的Zeta电位在pH 2.0时为13.88 mV,随着pH上升至9.0时降至-7.46 mV。在pH 6.0左右,WG的Zeta电位为零,表明此时为WG的等电点。对比图3-a与图3-b,可以发现当pH接近WG的等电点时,WG分子的表面电荷最少,静电排斥力弱,使得WG分子间易通过疏水作用发生聚集,导致溶解性较低。当pH值偏离等电点时,WG的表面电荷增加,静电排斥力增强,从而抑制了WG分子间的聚集,表现为溶解度的提高。此外,脱酰胺对DWG24的Zeta电位-pH关系也产生了显著影响。与WG相比,DWG24的Zeta电位-pH关系发生了明显变化:DWG24的Zeta电位绝对值随pH变化的幅度增大;DWG24的等电点明显向酸性方向偏移,在pH 7.0下DWG24的Zeta电位绝对值更高,静电排斥更强,表现为溶解性显著提高。
2.4 脱酰胺改性对小麦面筋蛋白乳化性能的影响
图4展示了WG和DWG24在不同浓度下制备的乳液的平均粒径d4,3和乳析稳定性。随着蛋白浓度的增加,WG和DWG24制备的乳液的d4,3值均逐渐降低,2种蛋白乳液的d4,3在分别达到一定值后,乳液的粒径d4,3不再随浓度增加而发生变化,d4,3趋于稳定。当WG质量浓度为50 g/L时,WG仍无法制备出稳定乳液(d4,3=19.56 μm,乳析率为41.92%),表明其乳化性能较差。与之相对照,当DWG24质量浓度为20 g/L时,乳液d4,3达到0.60 μm,且没有发生明显的乳析(d4,3=0.60 μm,乳析率仅为4.89%),这说明与WG相比,DWG24能在较低蛋白浓度下,成功制备出粒径较小且较为稳定的乳液,因此具有较强的乳化性能。换而言之,柠檬酸脱酰胺可显著提高DWG的乳化性能。

a-不同浓度WG制备的乳液的d4,3;b-不同浓度WG制备的乳液乳析率;c-不同浓度WG制备的乳液外观图;d-不同浓度DWG24制备的乳液的d4,3;e-不同浓度DWG24制备的乳液乳析率;f-不同浓度DWG24制备的乳液外观图
图4 不同浓度下WG和DWG24制备的乳液的平均粒径d4,3、乳析率及乳液外观图
Fig.4 The average particle size d4,3 phase separation rate, and appearance of emulsions prepared from WG and DWG24 at different concentrations
2.5 不同蛋白样品制备的乳液的微观结构
图5为WG和DWG24在不同浓度下制备乳状液的微观结构和粒径分布。随着WG质量浓度从10 g/L提高到50 g/L,其乳液粒度分布向小粒径方向迁移。然而WG制备的乳液在质量浓度10~50 g/L范围内都出现了明显的液滴絮凝现象(乳液滴聚集在一起),从而导致乳液d4,3较大。这一发现与本课题组前期研究结果一致,WG等植物蛋白产品溶解性普遍较差,含有大量不溶性蛋白颗粒,在均质乳化的湍流条件下会吸附到乳液滴表面,引起乳液滴的桥联絮凝,严重影响了蛋白产品的乳化性能[20]。

a-WG在不同浓度下制备乳液的微观结构及粒径分布;b-DWG24在不同浓度下制备乳液的微观结构及粒径分布
图5 WG和DWG24在不同浓度下制备乳状液的微观结构和粒径分布图
Fig.5 Microscopic structure and particle size distribution of emulsions prepared by WG and DWG24 at different concentrations
与之相对照,在质量浓度5~20 g/L,DWG24制备乳液没有出现明显的液滴絮凝现象,尽管在浓度较低时(如质量浓度5 g/L),其乳液中含有较多的大液滴。这说明当DWG24含量不足以乳化均质过程中产生的乳液滴时,乳液滴只会发生聚结,而不会像WG乳液一样发生桥联絮凝。从CLSM图片中可以看出,在质量浓度20 g/L时,DWG24乳液中乳液滴粒径细小且分布均匀。上述结果表明,与WG相比,DWG24不仅乳化性能提高,且其乳化机制也发生了改变。
2.6 脱酰胺对小麦面筋蛋白表面疏水性的影响
蛋白质的表面疏水性是影响其乳化性能和界面活性的关键因素之一,通常与其乳化能力呈正相关性[21]。图6显示了脱酰胺对DWG表面疏水性的影响。随着脱酰胺反应的进行,WG的表面疏水性从1 298增至9 588,而后降低至8 081。这可能是因为脱酰胺使DWG分子结构展开,原本埋藏在内部的疏水基团暴露出来,从而提高了DWG的表面疏水性。过度的反应时间可能导致蛋白质发生部分变性或聚集,导致疏水基团再次被掩埋,使表面疏水性下降。高表面疏水性提升了DWG与油相的亲和力,促进其在油-水界面上的展开与重排,进而形成了更加牢固的保护膜,改善了DWG的乳化稳定性。此外,DWG在脱酰胺过程中发生了轻微水解,肽链被切割成较小的链段,这也可能会使其暴露更多的疏水基团。总的来说,脱酰胺可通过增加表面疏水性,提高蛋白质的乳化性能。
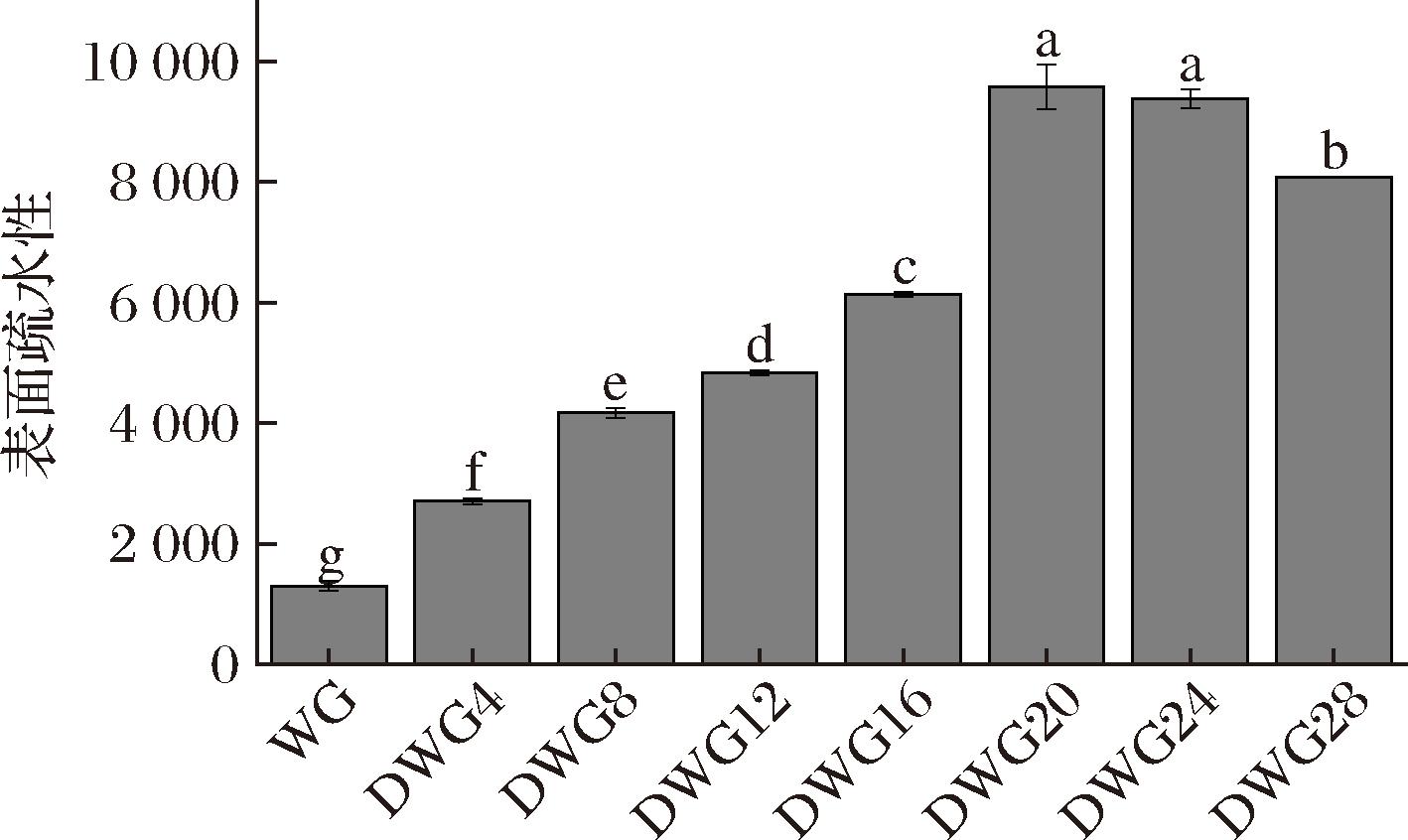
图6 不同脱酰胺程度WG的表面疏水性
Fig.6 Surface hydrophobicity of WG with different degrees of deamidation
2.7 脱酰胺对小麦面筋蛋白二级结构的影响
酰胺I带与蛋白质的二级结构有密切的相关性。如图7所示,通过对WG与DWG样品的酰胺I带进行分析得到8个子峰,分别归属于蛋白二级结构中的4种构象:α-螺旋(1 655 cm-1)、β-折叠(1 614、1 635、1 687 cm-1)、β-转角(1 675 cm-1)和无规则卷曲(1 646 cm-1)。通过计算可得出各构象在酰胺I带中的占比。由表1可知,WG的α-螺旋、β-折叠、β-转角、无规则卷曲的含量分别为27.01%、42.40%、21.11%、9.48%。经过脱酰胺后,DWG中α-螺旋的含量显著下降,而β-折叠(除DWG12外)、无规则卷曲和β-转角的含量有所上升。此外,所有DWG的α-螺旋/β-折叠均减小。在蛋白质的二级结构中,α-螺旋与β-折叠的比值可反映蛋白分子柔顺性(比值与柔顺性成反比)[22],而无规则卷曲和β-转角是较为松散的结构。本研究结果与文献报道[23]的相似,说明脱酰胺可以使DWG分子结构柔顺性提高,在乳化过程中可快速吸附到油-水界面,形成细小的乳液滴,防止乳液滴桥联絮凝的发生。值得注意的是,尽管脱酰胺对DWG的二级结构有一定影响,但影响程度与DD之间无规律性关系,这可能是因为柠檬酸脱酰胺是一个随机过程。不同脱酰胺程度WG的二级结构组成及含量见表1。
表1 不同脱酰胺程度WG的二级结构组成及含量
Table 1 Secondary structure composition and content of WG with different deamidation degrees
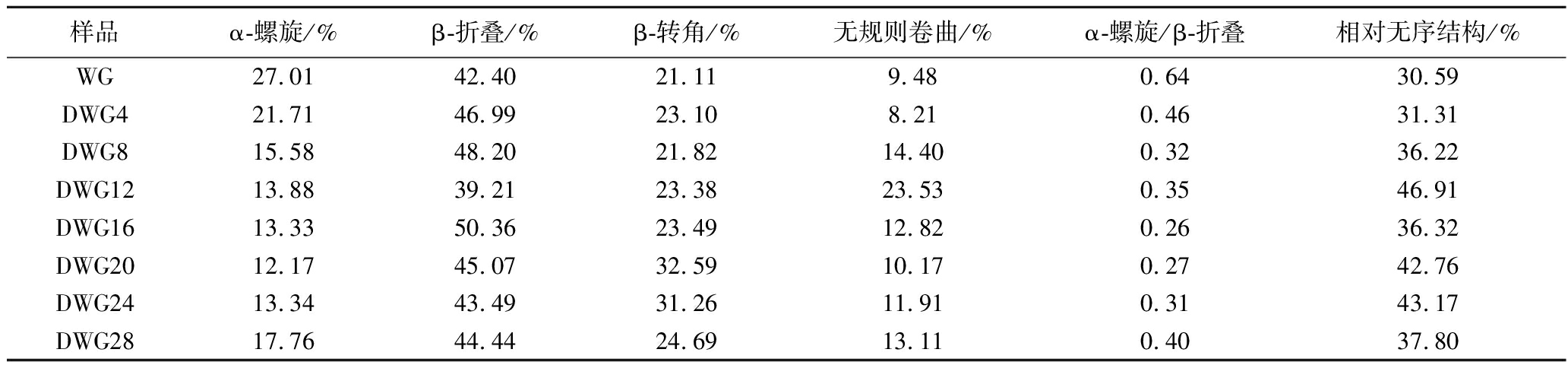
样品α-螺旋/%β-折叠/%β-转角/%无规则卷曲/%α-螺旋/β-折叠相对无序结构/%WG27.0142.4021.119.480.6430.59DWG421.7146.9923.108.210.4631.31DWG815.5848.2021.8214.400.3236.22DWG1213.8839.2123.3823.530.3546.91DWG1613.3350.3623.4912.820.2636.32DWG2012.1745.0732.5910.170.2742.76DWG2413.3443.4931.2611.910.3143.17DWG2817.7644.4424.6913.110.4037.80

a-WG的酰胺I带拟合峰;b-DWG4的酰胺I带拟合峰;c-DWG24的酰胺I带拟合峰
图7 WG与DWG的酰胺I带拟合峰图
Fig.7 Amide I-band fitting peaks plot of WG and DWG
2.8 脱酰胺改性对小麦面筋蛋白界面特性的影响
蛋白的乳化特性本质上是其界面特性在油水界面的作用,通过研究蛋白的界面特性有助于增进对蛋白乳液形成和稳定机制的了解,进一步阐明蛋白乳化特性与结构的关系[24]。随着乳化剂浓度升高,油-水界面逐渐被乳化剂饱和,界面压力逐步趋于稳定并达到饱和值(πsat)。πsat值反映了乳化剂在油-水界面上抑制热力学不稳定反应的能力。因此πsat值不仅与乳化剂的乳化能力密切相关,也直接影响乳液的整体稳定性。脱酰胺对WG结构构象变化及乳化机制影响示意图见图8。

图8 脱酰胺对WG结构构象变化及乳化机制影响示意图
Fig.8 Schematic diagram of the effect of deamidation on the conformational change of WG structure and emulsification mechanism
图9-a和图9-b显示了不同浓度WG与DWG24在油水界面上的界面压力随吸附时间的变化。低质量浓度(0.01~0.10 g/L)的WG在油-水界面上吸附180 min仍未达到平衡。这是因为WG是一种球蛋白,在吸附过程中需要经历吸附、展开和重排3个阶段,所需要时间很长,所以很难在短时间内达到平衡。与之相对照,低质量浓度(0.01~0.10 g/L)的DWG24在油-水界面上很快就达到了平衡,其原因可能是脱酰胺使DWG24的结构展开,分子柔顺性提高,形成类似于酪蛋白酸钠的线性结构[25],导致其在油水界面上展开和重排的速率加快,降低油-水界面张力能力增强,制备的乳液仅发生聚结而不发生桥联絮凝,也可能是脱酰胺伴随的水解导致DWG24产生具有高界面活性的短肽。
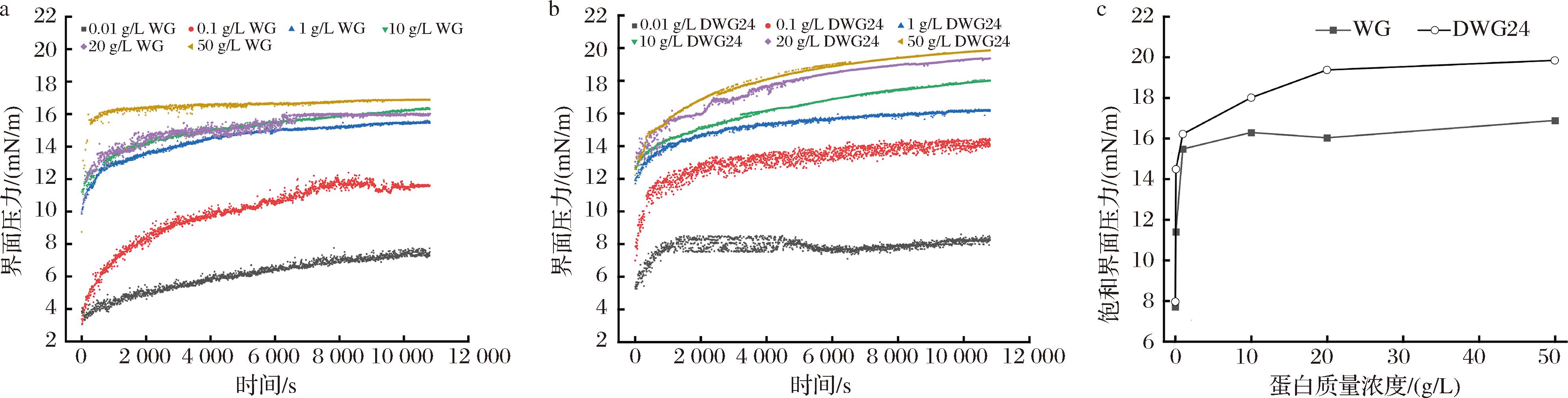
a-不同浓度WG在油-水界面的界面压力变化;b-不同浓度DWG24在油-水界面的界面压力变化;c-不同浓度WG和DWG24在油-水界面的πsat
图9 不同浓度的WG与DWG24在油-水界面上的界面压力变化
Fig.9 Changes of interfacial pressure between WG and DWG24 at oil-water interface with different concentrations
图9-c显示了WG和DWG24在不同浓度下的πsat值。蛋白质的界面活性可以通过相对浓度曲线(K=1/C1/2)来确定[26],其中K是吸附平衡常数,C1/2是1/2πsat对应的蛋白浓度,即界面饱和所需乳化剂浓度。K值越高,表明蛋白的界面活性越高,乳化能力越强。随着浓度的增加,WG和DWG24的πsat从7.70 mN/m和7.95 mN/m分别增至16.88 mN/m和19.84 mN/m。DWG24的πsat均高于WG,表明DWG24在减少油相与水相之间的热力学不利相互作用方面的效果更佳。根据图9-c可以拟合计算出WG和DWG24的C1/2分别为0.015 0%和0.003 7%,其对应的K值分别是66.67%和270.27%。以上结果表明,脱酰胺使DWG24的界面活性提高,乳化能力增强,乳化稳定性提高。
3 结论
本研究系统探究了柠檬酸脱酰胺对WG乳化性能的影响。在70 ℃下用0.3 mol/L的柠檬酸溶液对WG进行脱酰胺处理,发现随着脱酰胺反应时间的增加,WG的DD和DH逐渐提高,在反应24 h时,DWG24的DD和DH分别达到32.83%和6.57%,PS从7.85%(未处理)提升至65.92%,pH 7.0的Zeta电位绝对值变大,DWG24的等电点向酸性偏移。WG在高质量浓度(50 g/L)下制备的乳液仍不稳定(d4,3=19.56 μm),DWG24在较低质量浓度(20 g/L)下制备的乳液粒径细小且稳定(d4,3=0.60 μm)。从CLSM结果中发现,经过脱酰胺处理后,DWG24的乳化机制发生了变化。其原因可能是脱酰胺使DWG24的结构展开,表面疏水性提高,蛋白分子柔性增强,产生一部分具有高表面界面活性的可溶性蛋白使其降低油-水界面张力的能力提升,界面压力增强,界面活性提高。
综上所述,脱酰胺会使DWG24的乳化机制发生改变,乳化能力和乳化稳定性提高,是一种可以有效改善WG乳化性能的方法。研究结果将有助于拓宽WG在蛋白饮料、香肠和人造奶油等乳化食品中的应用,为WG从传统的面制品原料转型为多功能植物基乳化剂提供理论依据。
[1] CERESINO E B, KUKTAITE R, SATO H H, et al.Impact of gluten separation process and transglutaminase source on gluten based dough properties[J].Food Hydrocolloids, 2019, 87:661-669.
[2] PIBOONPOCANUN S, THONGNGARM T, WONGSA C, et al.Omega-5 and gamma gliadin are the major allergens in adult-onset IgE-mediated wheat allergy:results from thai cohort with oral food challenge[J].Journal of Asthma and Allergy, 2021, 14:907-917.
[3] LIU M X, DAI S H, YIN L J, et al.Wheat gluten deamidation:Structure, allergenicity and its application in hypoallergenic noodles[J].Journal of the Science of Food and Agriculture, 2023, 104(4):2477-2483.
[4] SHI A M, FENG X Y, WANG Q, et al.Pickering and high internal phase Pickering emulsions stabilized by protein-based particles:A review of synthesis, application and prospective[J].Food Hydrocolloids, 2020, 109:106117.
[5] LEI L, ZHAO Q, SELOMULYA C, et al.The effect of deamidation on the structural, functional, and rheological properties of glutelin prepared from Akebia trifoliata var.australis seed[J].Food Chemistry, 2015, 178:96-105.
[6] 廖兰.湿热有机酸脱酰胺改性小麦面筋蛋白及作用机理的研究[D].广州:华南理工大学, 2012.LIAO L.Study on the deamidation of wheat gluten by organic acids upon hydrothermal treatment and reaction mechanism[D].Guangzhou:South China University of Technology, 2012.
[7] 蔡玉红,刘欢,谢明勇.酸法脱酰胺改善大米蛋白的溶解性及其功能性质分析[J].食品研究与开发, 2023, 44(24):30-37.CAI Y H, LIU H, XIE M Y.Improvement of solubility of rice protein by acid deamidation and analysis of functional properties[J].Food Research and Development, 2023, 44(24):30-37.
[8] ZHANG L,YOU Y Y, ZHANG K, et al.Improving solubility of rice protein powder by modifying its physicochemical properties by ultrasound-assisted protein-glutaminase[J].Food Chemistry, 2025, 464:141627.
[9] SHI X C, QI D W, LIN C H, et al.A technical review on characterization methods for structures and properties of emulsion[J].APL Materials, 2024, 12(11):110602.
[10] 董世荣, 王丽, 高昂, 等.脱酰胺对玉米醇溶蛋白乳化特性和结构的影响[J].食品与发酵工业, 2020, 46(17):67-72.DONG S R, WANG L, GAO A, et al.The effect of deamidation on the emulsifying properties and structure of zein[J].Food and Fermentation Industries, 2020, 46(17):67-72.
[11] 王晓萱,姚梦迪,杨适春,等.基于磁性纳米粒子的两种蛋白酶固定化策略对蛋白水解效率的对比研究[J].中国食品添加剂, 2025, 36(3):92-100.WANG X X, YAO M D, YANG S C, et al.Comparative study on two immobilization strategies of protease based on magnetic nanoparticles and their proteolytic efficiency[J].China Food Additives, 2025, 36(3):92-100.
[12] 黄培文, 陈林.不同食品乳化剂不稳定性现象及发生机理探究[J].食品与发酵工业, 2022, 48(24):117-123.HUANG P W, CHEN L.Research on instability and mechanism of different food emulsifiers[J].Food and Fermentation Industries, 2022, 48(24):117-123.
[13] DENG Z Y, LIU C Y, ZHANG W J, et al.Improving water solubility of docosahexaenoic acid with chickpea protein isolates deamidated by protein-glutaminase[J].ACS Food Science &Technology, 2024, 4(11):2690-2698.
[14] 瞿佳丽. 加工过程中添加α-淀粉酶和风味蛋白酶对红小豆沙食用品质的影响[D].无锡:江南大学, 2023.QU J L.Effects of α-amylase and Flavourzyme on the edible quality of adzuki bean paste during processing[D].Wuxi:Jiangnan University, 2023.
[15] ZHU L J, LI Y Y, YU J K, et al.Interfacial behavior and emulsifying property of thermosonication-treated soy glycinin[J].LWT, 2023, 187:115368.
[16] LI Y, ZHANG Z, ABBASPOURRAD A.Improving solubility and functional properties of phycocyanin under acidic conditions by glutaminase deamidation and succinylation[J].Food Hydrocolloids, 2022, 133:107994.
[17] FU W Y, CHEN X, CHENG H, et al.Tailoring protein intrinsic charge by enzymatic deamidation for solubilizing chicken breast myofibrillar protein in water[J].Food Chemistry, 2022, 385:132512.
[18] LUO L J, DENG Y Y, LIU G, et al.Enhancing solubility and reducing thermal aggregation in pea proteins through protein glutaminase-mediated deamidation[J].Foods, 2023, 12(22):4130.
[19] MA S J, LIU X, ZHOU J W, et al.Characterization of high internal phase emulsions stabilized by protein glutaminase-deamidated wheat gluten[J].LWT, 2023, 179:114622.
[20] CHEN L, CHEN J S, YU L, et al.Emulsification performance and interfacial properties of enzymically hydrolyzed peanut protein isolate pretreated by extrusion cooking[J].Food Hydrocolloids, 2018, 77:607-616.
[21] YAN S Z, XU J W, ZHANG S, et al.Effects of flexibility and surface hydrophobicity on emulsifying properties:Ultrasound-treated soybean protein isolate[J].LWT, 2021, 142:110881.
[22] SHEN P H, ZHOU F B, ZHANG Y H, et al.Formation and characterization of soy protein nanoparticles by controlled partial enzymatic hydrolysis[J].Food Hydrocolloids, 2020, 105:105844.
[23] DAI Y J, ZHONG W, HU X H, et al.Conformational and functional changes from deamidation of wheat gluten with electrochemical treatment[J].Journal of the Science of Food and Agriculture, 2023, 103(12):5677-5686.
[24] SUN Y D, ZHONG M M, ZHAO X M, et al.Structural and interfacial characteristics of ultrasonicated lipophilic-protein-stabilized high internal phase Pickering emulsions[J].LWT, 2022, 158:113160.
[25] WONG B T, ZHAI J L, HOFFMANN S V,et al.Conformational changes to deamidated wheat gliadins and β-casein upon adsorption to oil-water emulsion interfaces[J].Food Hydrocolloids, 2012, 27(1):91-101.
[26] MCCLEMENTS D J, BAI L, CHUNG C.Recent advances in the utilization of natural emulsifiers to form and stabilize emulsions[J].Annual Review of Food Science and Technology, 2017, 8(1):205-236.