贵州省遵义市地处中国西南部,属于亚热带季风气候,以高原山地为主,是以苗族、布依族、侗族等少数民族为主体,农业与民族特色食品产业并重的省份。居民们凭借丰富的辣椒与谷物资源,运用传统发酵技艺将大米面、鲜辣椒和食盐等主要原料,密封自然发酵制成鲊广椒[1]。由于其制作环境的开放性,大量兼性厌氧和微好氧微生物参与发酵过程,形成了复杂的微生物群落结构[2]。其中鲊广椒的细菌群落结构显著影响了其酸味、鲜味和回味等滋味[3],尤其是乳酸菌作为主要发酵微生物,能够利用淀粉和糖类发酵产生大量的乳酸,抑制有害微生物的生长繁殖,赋予独特的风味和口感[4]。因而对鲊广椒中的细菌多样性进行深入分析,并分离鉴定其中的乳酸菌,对于理解其菌群多样性和提升产品品质具有重要意义。
在探索微生物多样性的众多技术手段中,PacBio 单分子实时(single molecule real-time, SMRT)测序技术能够更全面地捕捉微生物多样性,极大地提高了测序的准确性和完整性,因而该技术在发酵食品微生物多样性的研究中得到广泛使用[5]。本研究团队曾通过高通量测序技术研究了不同地区鲊广椒的细菌多样性,发现乳植杆菌属(Lactiplantibacillus)、迟缓乳杆菌属(Lentilactobacillus)、促生乳杆菌属(Levilactobacillus)、魏斯氏菌属(Weissella)等细菌属为恩施和桐梓地区鲊广椒样品中的优势菌群[3],乳杆菌属(Lactobacillus)和假单胞菌属(Pseudomonas)可作为张家界地区鲊广椒中的生物标志物,而醋酸杆菌属(Acetobacter)可作为湘西地区鲊广椒中的生物标志物[6]。此外,有研究人员在使用高通量测序技术了解鲊广椒中细菌菌群结构的同时,也通过纯培养技术获取了鲊广椒中的优势乳酸菌,包括植物乳植杆菌(Lactiplantibacillus plantarum)、短促生乳杆菌(Levilactobacillus brevis)和福莱伴生乳杆菌(Companilactobacillus futsaii)等乳酸菌菌株资源[7-8]。由此可见,运用PacBio SMRT测序技术来解析鲊广椒中的细菌多样性,并结合纯培养技术分离其中的乳酸菌资源,对于深入了解和全面剖析鲊广椒这一具有地方特色的发酵食品中的微生物群落结构是可行的。
本研究从贵州省遵义市共采集鲊广椒样品16份,使用PacBio SMRT测序技术对其细菌多样性进行了解析,进一步使用纯培养技术对其蕴含的乳酸菌进行了分离鉴定,以期深入解析不同地区鲊广椒中的细菌多样性,同时对鲊广椒中的乳酸菌菌株资源进行研究和收集,为鲊广椒等传统发酵食品的品质提升提供菌株支撑。
1 材料与方法
1.1 材料与试剂
16个鲊广椒样品采集自贵州省遵义市(N27°42′,E106°55′)的零售市场,均为农户使用当地原材料自制而成,样品编号为ZY1~ZY16。鲊广椒的制作工艺:选用新鲜并切碎的红辣椒和玉米面以2∶1的质量比混合,加入食盐、花椒、桔皮等调料,搅拌均匀后放入干净的陶坛中压实,在最上面一层塞入干燥的玉米叶,倒置于盛有清水的盆中,密封发酵20~25 d。
OMEGA DNA isolation kit 试剂盒,美国OMEGA公司;Qubit dsDNA HS 测定试剂盒、GeneJET PCR纯化试剂盒,美国赛默飞世尔公司;SMRTbell Template Prep Kit建库试剂盒,PacBio公司;德氏乳杆菌培养基(MRS培养基)、30%(质量分数)过氧化氢,国药集团化学试剂有限公司。
1.2 仪器与设备
DG250厌氧工作站,英国Don Whitley公司;Veriti FAST梯度PCR仪,美国ABI公司;164-5050基础电泳仪,美国BioRad公司;Sequel 11测序仪,PacBio公司;R930机架式服务器,美国 DELL 公司。
1.3 实验方法
1.3.1 DNA 提取、PCR 扩增和 PacBio SMRT 测序
依照崔梦君等[9]的方法对鲊广椒样品进行处理,即遵循试剂盒的操作指南提取样本中的DNA。将浓度合格的DNA样本进行PCR扩增,并使用核酸纯化试剂盒对PCR扩增产物进行纯化,PCR产物合格后进行PacBio SMRT 测序。
1.3.2 序列质控和生物信息学分析
参照DU等[10]的方法,对原始序列进行质量控制,基于QIIME(v1.9.0)平台进行生物信息学分析,根据97%相似度划分操作分类单元(operational taxonomic units,OTU),并在BLAST数据库进行比对,确定分类学地位。
1.3.3 乳酸菌的分离与鉴定
称取10 g鲊广椒,加入已灭菌的生理盐水中,室温振荡30 min后进行倍比稀释,将稀释液涂布于MRS培养基,30 ℃厌氧倒置培养48 h[11]。选取形态各异的单菌落,纯化至同一培养基上所有菌落形态一致后进行保藏,提取分离菌株DNA[12],进行PCR扩增、连接和转化,挑取阳性克隆子进行测序,返回序列进行比对后构建系统发育树。
1.4 数据处理
采用Origin 2024软件绘制百分比堆积柱状图、瀑布图和条形图,采用R 4.3.3软件绘制OTU花瓣图,采用DNAMAN 6.0软件和MEGA 7.0软件绘制系统发育树。
2 结论与分析
2.1 基于门水平鲊广椒样品细菌多样性分析
本研究首先采用PacBio SMRT测序技术解析了鲊广椒样品中的细菌多样性,16个样品测序共产出176 977条高质量序列,划分为11 803个OTU,鉴定为15个门、24个纲、47个目、104个科、251个属和395个种。其中平均相对含量大于1.00%的细菌门见图1。
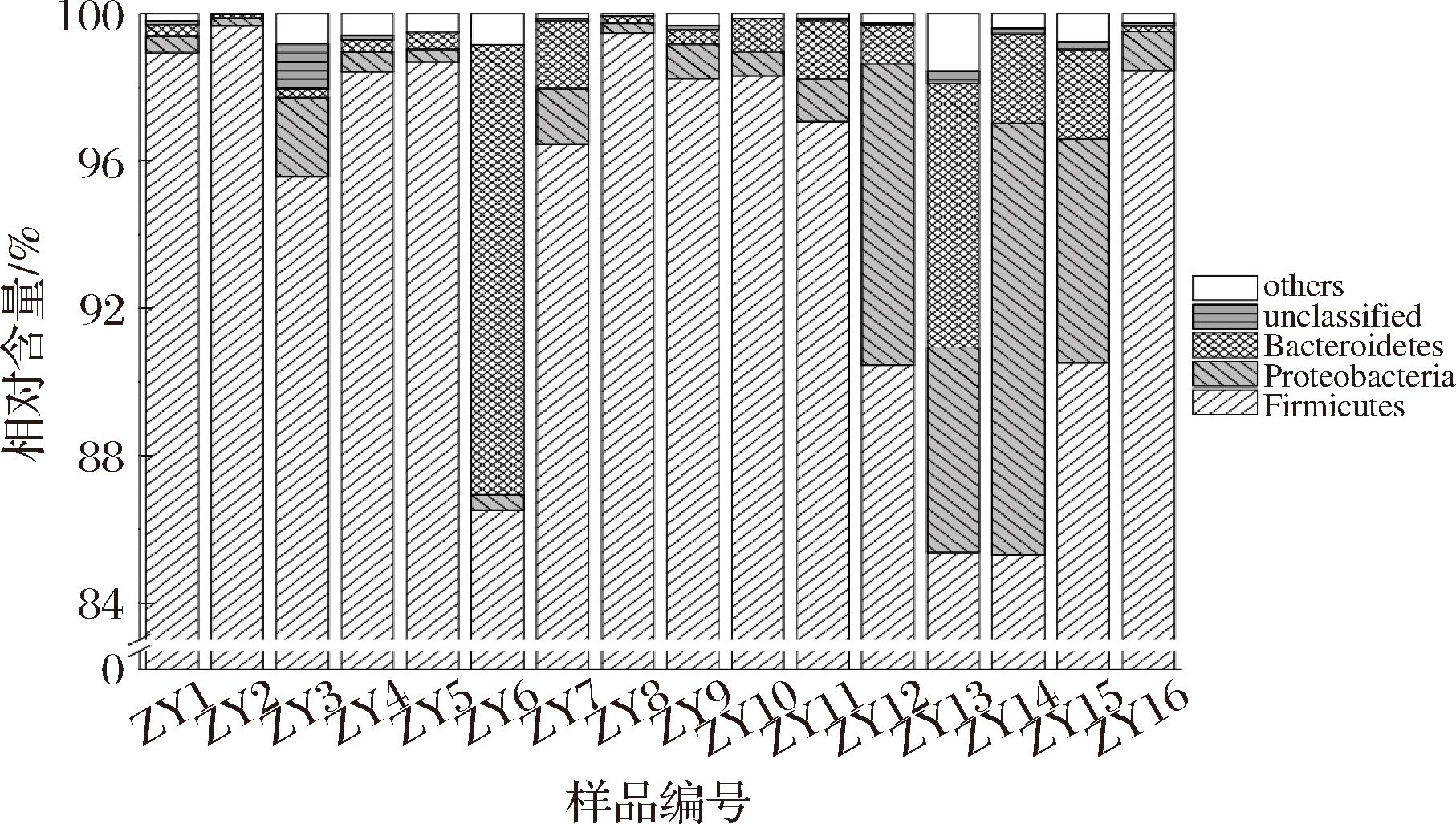
图1 遵义地区鲊广椒在门水平细菌多样性
Fig.1 Bacterial diversity in Zha-chili from Zunyi region at phylum level
平均相对含量大于1.00%的细菌门为厚壁菌门(Firmicutes)、变形菌门(Proteobacteria)和拟杆菌门(Bacteroidetes),平均相对含量分别为94.84%、2.58%和1.98%。在本研究所分析的所有细菌门中,厚壁菌门占据绝对优势地位,其在16个鲊广椒样品中相对含量均高于85.00%。
2.2 基于属水平鲊广椒样品细菌多样性分析
如图2所示平均相对含量大于1.00%的细菌属为Levilactobacillus、Lactobacillus、伴生乳杆菌属(Companilactobacillus)、Lentilactobacillus、Lactiplantibacillus、腐败乳杆菌属(Loigolactobacillus)和联合乳杆菌属(Ligilactobacillus),平均相对含量分别为33.57%、32.79%、13.30%、2.17%、2.16%、1.81%和1.26%。CAI等[13]深入探究了重庆市、湖北省及湖南省鲊广椒中的细菌种类多样性,发现Lactobacillus、Pseudomonas和片球菌属(Pediococcus)等是优势属。该研究结果并未在本研究中体现,究其原因可能与制作工艺[14]、发酵环境[15]以及发酵过程中的微生物交互作用[16]等多种因素有关。有研究表明,Levilactobacillus作为乳酸菌的重要成员之一,是鲊广椒、发酵蔬菜和虾酱等传统发酵食品的优势细菌属,有助于发酵食品特征性风味的产生和提升食品的整体气味[17],并且一些隶属于该菌属的菌株具备合成大量γ-氨基丁酸的能力,对人类胃肠道环境展现出良好的适应性,有益于维护人类胃肠环境健康和增强免疫力[18]。Lactobacillus是泡萝卜和泡菜等自然发酵食品中的优势菌群,具有较强的耐酸性,能够代谢产生乳酸,其在人体中能够分解食物中的纤维素以促进食物消化和营养吸收,进而维护肠道菌群平衡和增强机体免疫力[19]。Companilactobacillus能够利用鲊广椒中的糖类物质进行发酵产生乳酸等有机酸,不仅赋予了鲊广椒独特的酸味,还有助于抑制有害微生物的生长,延长食品的保质期[20]。
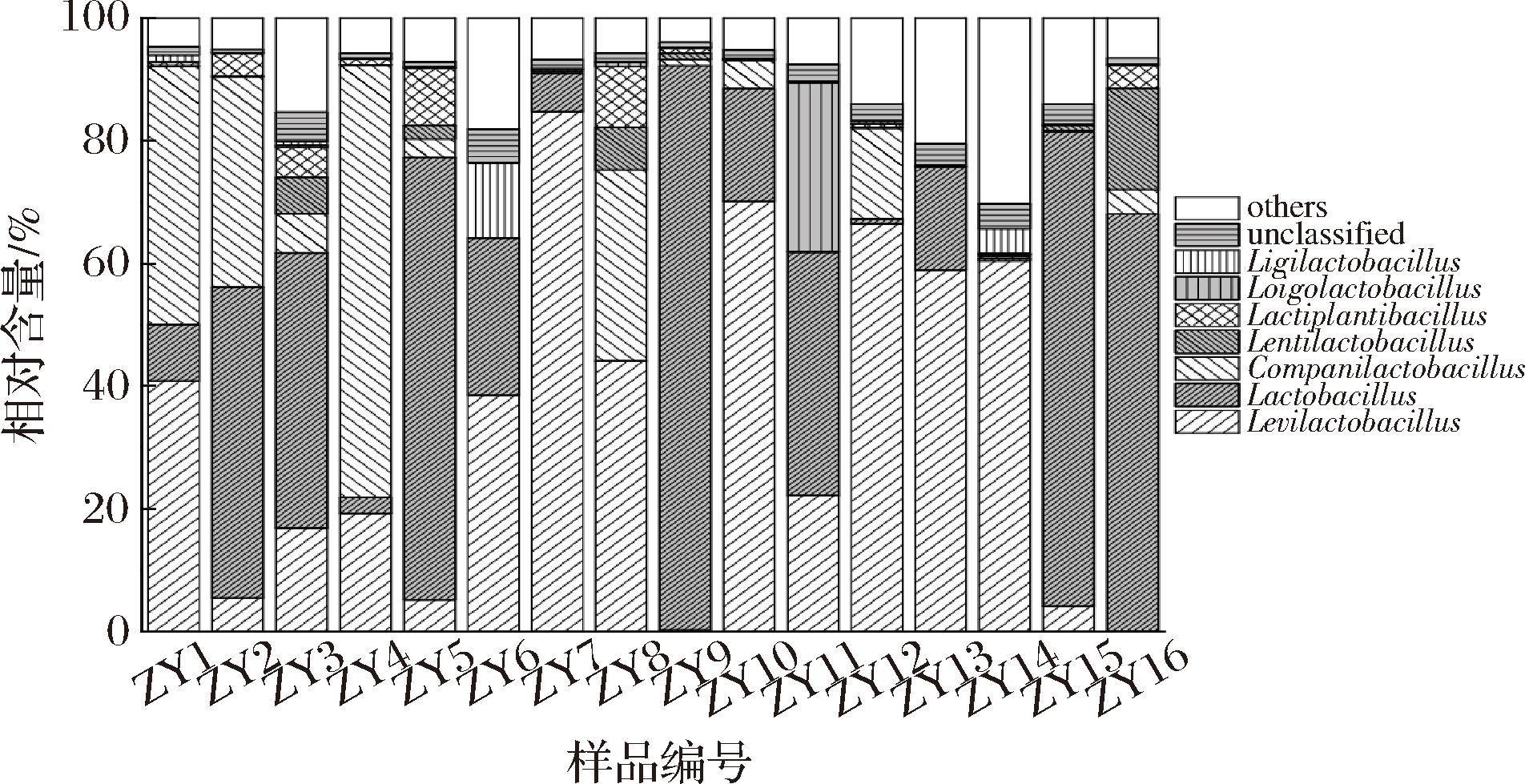
图2 遵义地区鲊广椒在属水平细菌多样性
Fig.2 Bacterial diversity in Zha-chili from Zunyi region at genus level
基于属水平分析亦发现,在16个鲊广椒样品中均存在Levilactobacillus和Lactobacillus,但其在不同样品中的含量却显现出差异。例如Lactobacillus在样品ZY5、ZY9和ZY15中含量高于70.00%,而在ZY8、ZY12和ZY14等样品中含量均低于1.00%。值得一提的是,在采集的所有鲊广椒样品中,并非所有样品都含有其他5个细菌属,这表明同一地区的鲊广椒细菌群落构成也呈现出一定的多样性。
2.3 基于种水平鲊广椒样品细菌多样性分析
如图3所示平均相对含量大于1.00%的细菌种为耐酸乳杆菌(Lactobacillus acetotolerans)、费尔斯莫尔德镇伴生乳杆菌(Companilactobacillus versmoldensis)、那慕尔促生乳杆菌(Levilactobacillus namurensis)、消化伴生乳杆菌(Companilactobacillus alimentarius)、Lactiplantibacillus plantarum、蛋白原酶腐败乳杆菌(Loigolactobacillus rennini)和约氏乳杆菌(Lactobacillus johnsonii),平均相对含量分别为30.34%、6.19%、5.78%、4.97%、2.11%、1.72%和1.32%。由图3亦可知,在本研究的16个鲊广椒样品中存在平均相对含量为19.94%的未鉴定菌种,尤其是样品ZY7、ZY10、ZY12、ZY13和ZY14中未鉴定菌种的相对含量均超过65%,表明遵义地区鲊广椒的细菌可能存在一定的特有菌群,需要进一步挖掘。
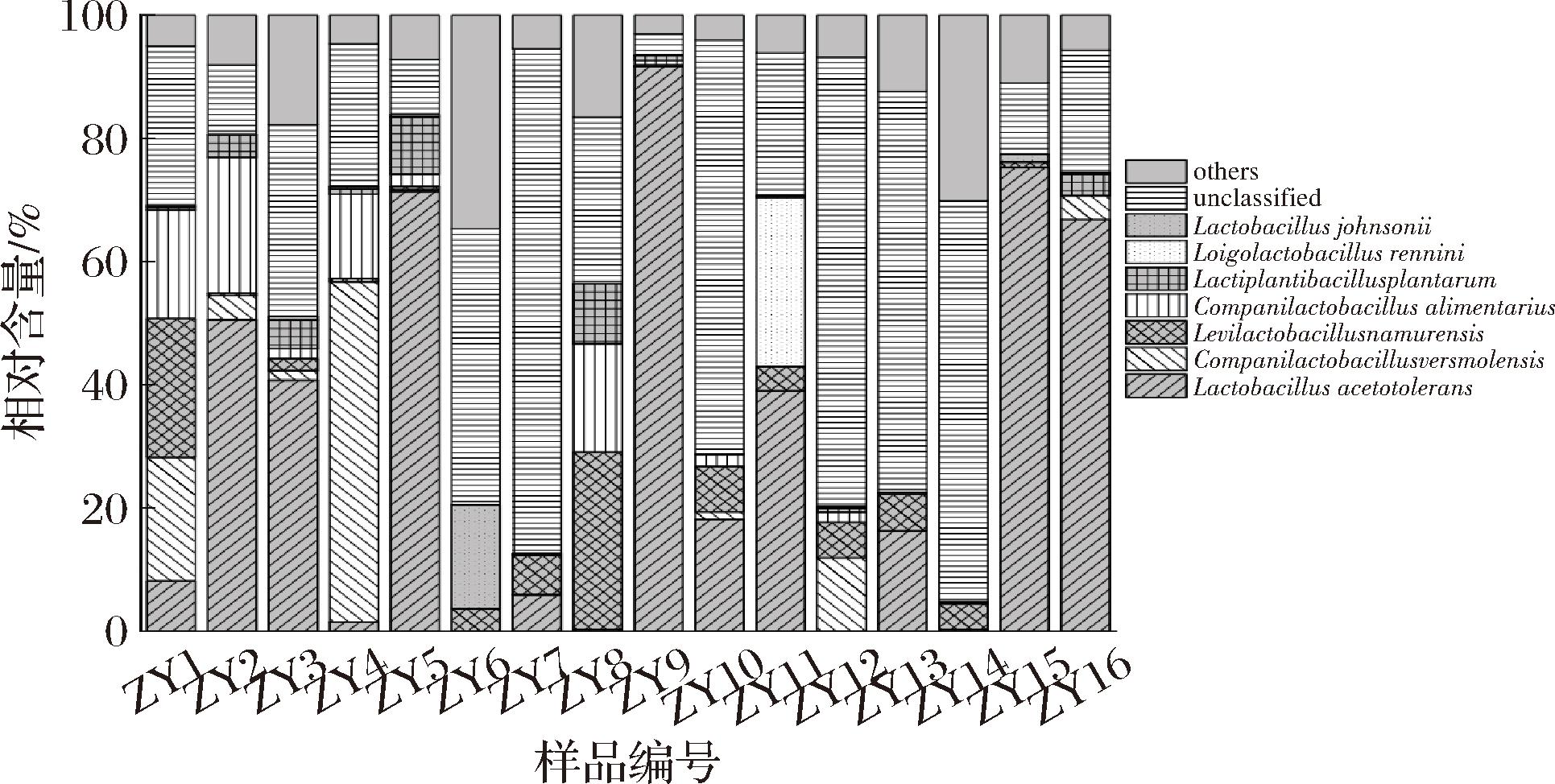
图3 遵义地区鲊广椒在种水平细菌多样性
Fig.3 Bacterial diversity in Zha-chili from Zunyi region at species level
基于PacBio SMRT 测序技术,CAI等[21]对采集自湖北省恩施州的28份鲊广椒中的细菌类群进行了解析,发现C.alimentarius和L.acetotolerans为优势细菌种,平均相对含量分别为18.91%和12.67%,与本研究结果相似。L.acetotolerans作为本研究分析的所有细菌种中的第一优势细菌种,具有良好的耐酸和产酸特性,能够利用葡萄糖等多种糖类代谢生成乳酸和乙酸等有机酸,有利于丰富发酵食品的风味品质[22]。此外,黄浩伦等[23]将其与瑞士乳杆菌(Lactobacillus helveticus)制成复合发酵剂用于液态发酵食醋中,结果表明复合发酵剂的添加有助于优化食醋的有机酸组成和提升食醋的风味品质。
2.4 基于OTU水平鲊广椒样品中核心细菌菌群分析
为进一步了解遵义地区鲊广椒各样品细菌菌群的差异,本研究在OTU水平上进行了深入分析,并对核心OTU进行了统计,结果见图4。
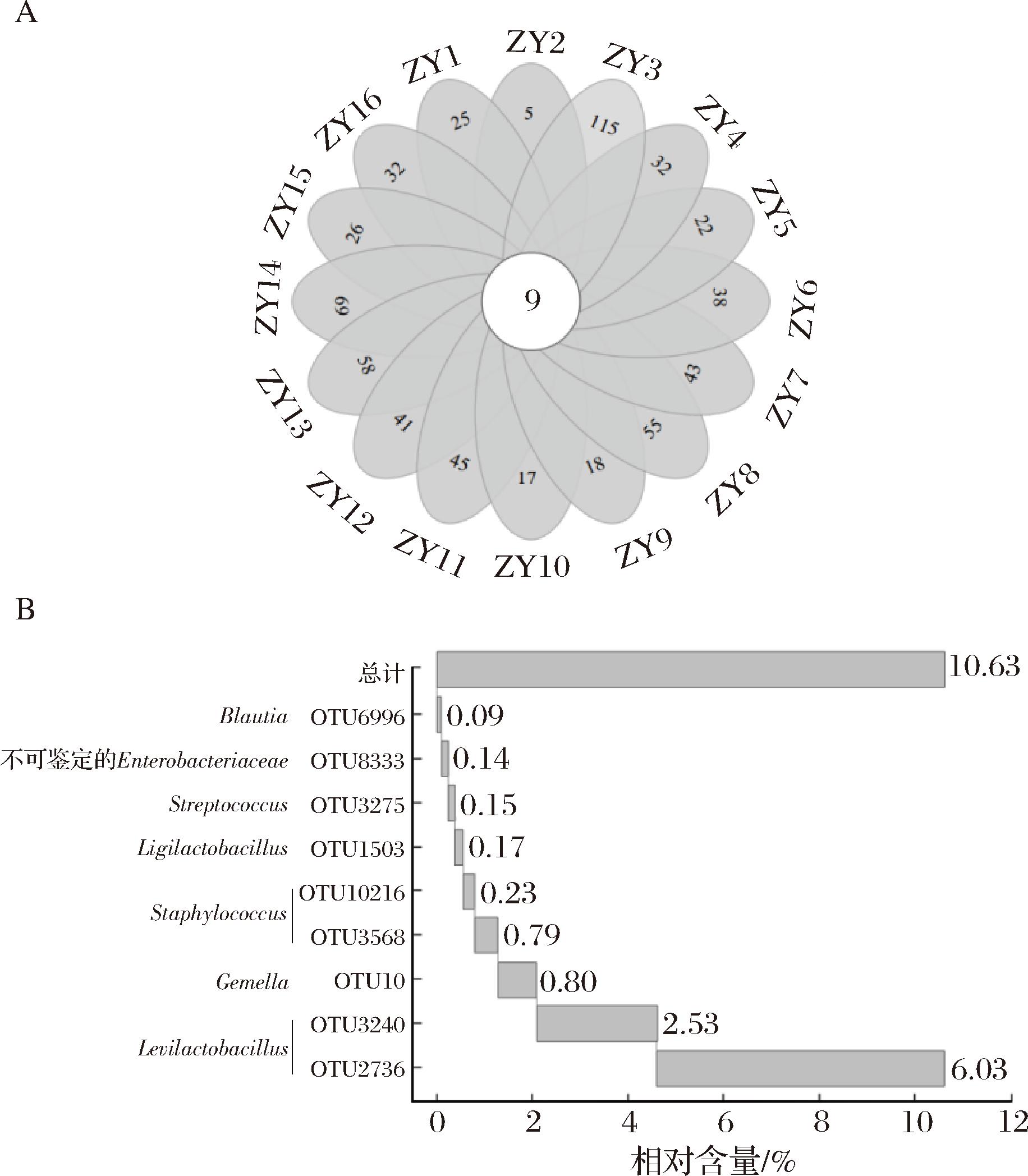
图4 遵义地区鲊广椒在OTU水平细菌多样性
Fig.4 Bacterial diversity in Zha-chili from Zunyi region at OTU level
基于OTU水平分析可知,16个鲊广椒样品中核心OTU共有9个,分别为隶属于经黏液真杆菌属(Blautia)的OTU6996、隶属于不可鉴定肠杆菌科(Enterobacteriaceae)的OTU8333、隶属于链球菌属(Streptococcus)的OTU3275、隶属于Ligilactobacillus的OTU1503、隶属于葡萄球菌属(Staphylococcus)的OTU10216和OTU3568、隶属于孪生球菌属(Gemella)的OTU10、隶属于Levilactobacillus的OTU3240和OTU2736,且核心OTU所包含序列数占总序列数的10.63%。由此可见,同一地区鲊广椒的细菌菌群构成呈现出一定的差异性,该分析结果与属水平分析结果具有相似性。
2.5 乳酸菌的分离鉴定
本研究进一步对鲊广椒中的乳酸菌进行了分离鉴定,共得到59株乳酸菌,其系统发育树见图5。
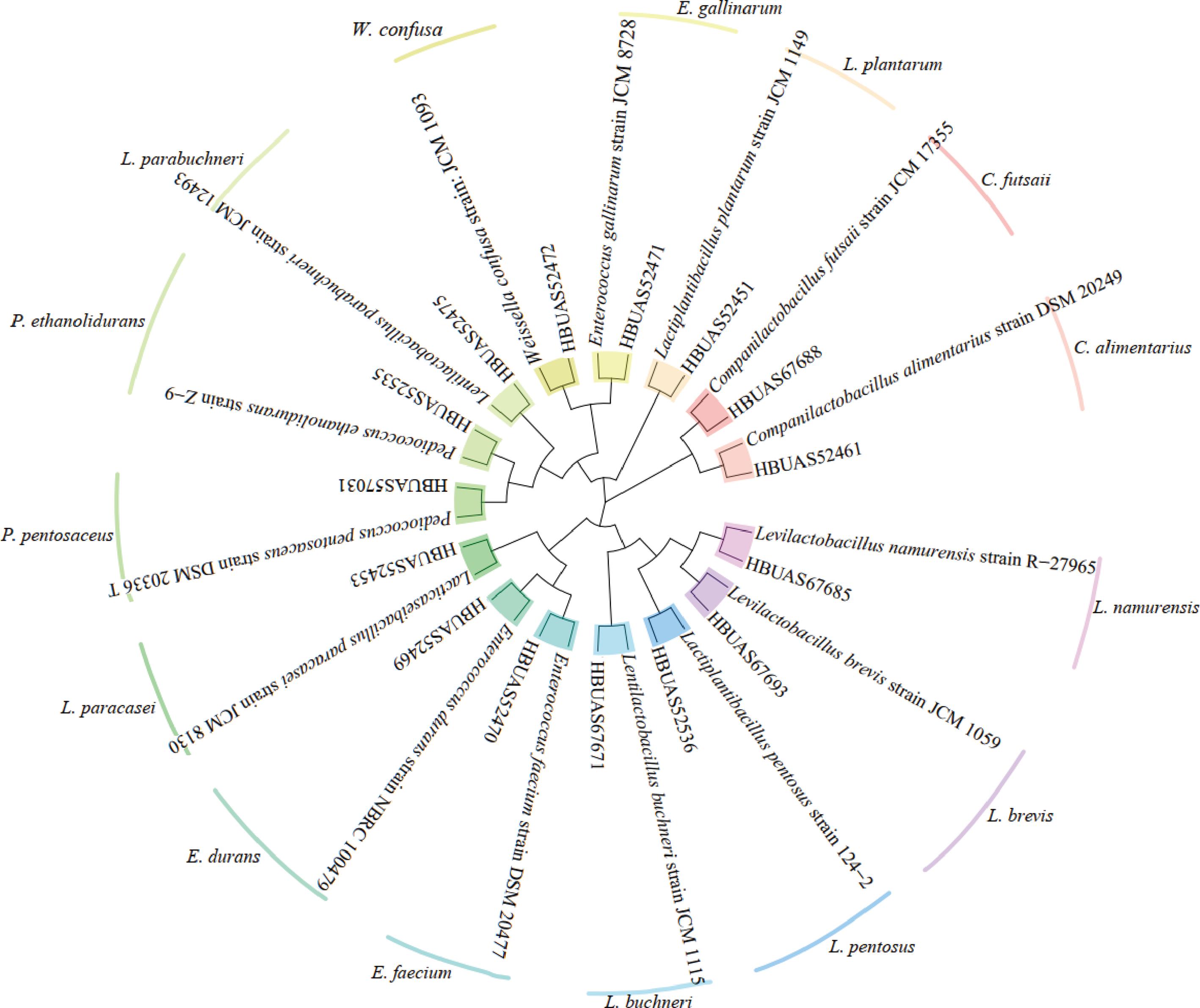
图5 遵义地区鲊广椒中分离株的系统发育树
Fig.5 Phylogenetic tree of isolated strains in Zha-chili from Zunyi region
分离得到的59株乳酸菌被鉴定为8个属,15个种。8个属为Lentilactobacillus、Companilactobacillus、Lactiplantibacillus、乳酪杆菌属(Lacticaseibacillus)、肠球菌属(Enterococcus)、Pediococcus、Levilactobacillus和Weissella。15个种及其构成情况如图6所示。
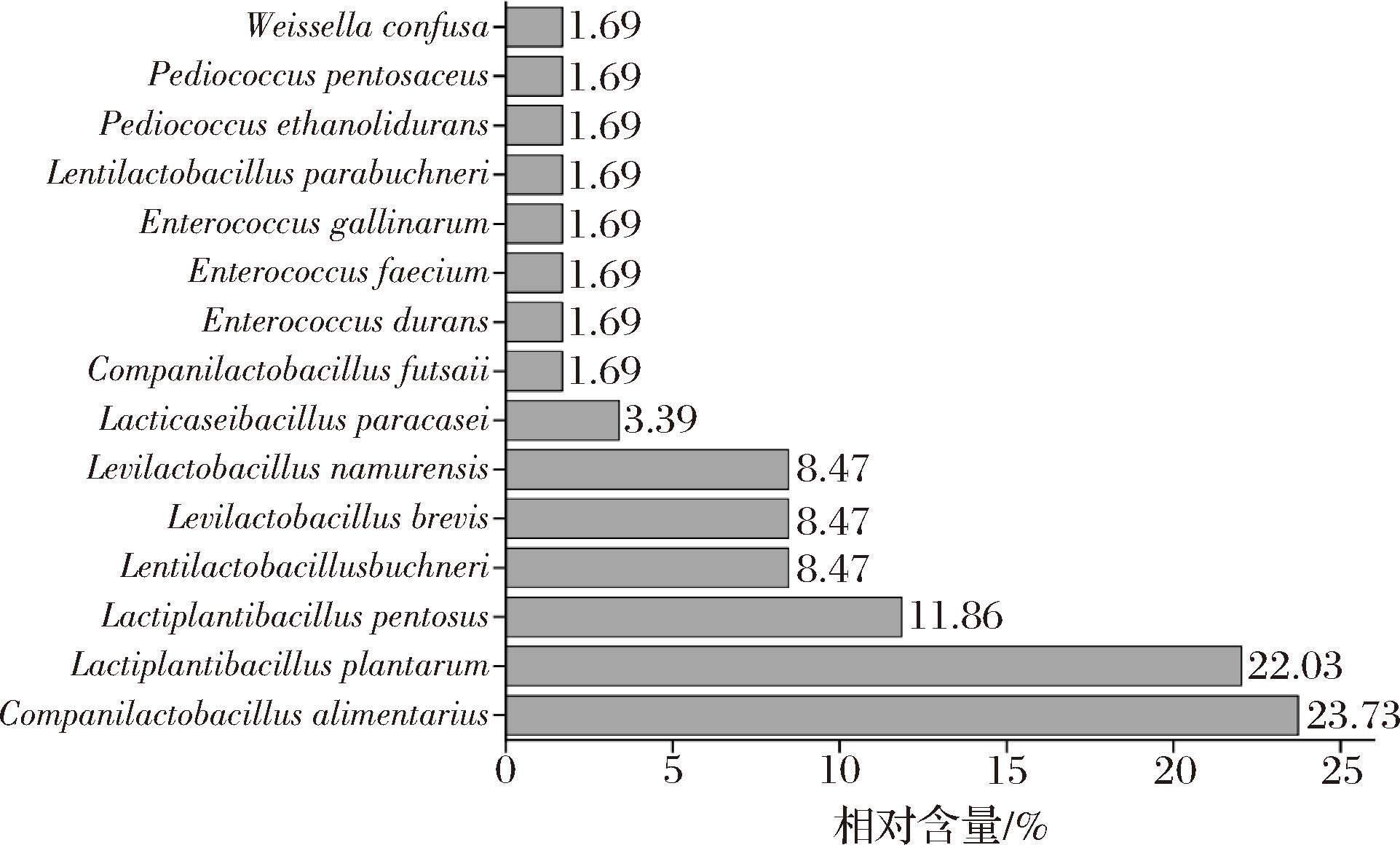
图6 遵义地区鲊广椒中分离株构成
Fig.6 Composition of isolated strains in Zha-chili from Zunyi region
在分离的乳酸菌菌株中,占比超过10.00%的分离株为戊糖乳植杆菌(Lactiplantibacillus pentosus)、L.plantarum和C.alimentarius,分别为7株、13株和14株,各占乳酸菌总分离株的11.86%、22.03%和23.73%。C.alimentarius存在于发酵蔬菜、发酵肉类和面团等传统发酵食品中,能够发酵戊糖、己糖和二糖等多种糖类产生乳酸等有机酸,降低食品的pH值,抑制有害微生物的生长,赋予发酵制品独特的风味和口感,并提高食品的品质和保存期[24]。L.plantarum作为自然界中普遍存在的一种益生菌,拥有诸多对人体健康直接有益的特质,例如发挥消炎与抑菌作用、降低人体胆固醇水平、增强免疫系统功能、降解亚硝酸盐、排除体内重金属、并展现出强大的抗氧化能力[25],已广泛应用于食品工业、饲料领域以及医疗保健等领域[26-28]。L.pentosus能够在高盐或酸性环境下生长,利用葡萄糖产生乳酸,并降低食品中亚硝酸盐的含量,提高发酵食品的安全性[29],已有研究将其用于低盐发酵鳊鱼的研究中,研究结果表明接种戊糖乳植物杆菌不仅能够有效促进乳酸菌的增殖,适度降低发酵鳊鱼pH值,而且大幅度降低了发酵鳊鱼的生物胺含量(P<0.05),提高了食用安全性[30]。由图6亦可知,L.namurensis、L.brevis和布氏迟缓乳杆菌(Lentilactobacillus buchneri),均占乳酸菌总分离株的8.47%,其他9个种相对含量均低于3.39%。由此可见,遵义地区鲊广椒样品中以C.alimentarius、L.plantarum 和L.pentosus为其主要乳酸菌类群。
3 结论
遵义地区鲊广椒样品富含乳酸菌,主要的乳酸菌类群为Levilactobacillus、Lactobacillus、Companilactobacillus,在所有细菌种中隶属于Lactobacillus的L.acetotolerans是第一优势细菌种。采用纯培养技术从鲊广椒中分离的乳酸菌菌株主要是隶属于Companilactobacillus的C.alimentarius和隶属于Lactiplantibacillus的L.plantarum和L.pentosus。由此可见,遵义地区鲊广椒中乳酸菌丰富且多样性高。
[1] ZHANG Z D, ZHAO H J, DENG Y M, et al.Bacterial diversity and its correlation with sensory quality of two types of Zha-chili from Shennongjia region, China[J].Food Research International, 2023, 168:112789.
[2] 赖茂佳, 牟燕, 范文教, 等.发酵香肠微生物多样性及风味物质相关性研究进展[J].食品科技, 2024, 49(10):127-136.LAI M J, MOU Y, FAN W J, et al.Progress on microbial diversity and flavor correlation in fermented sausage[J].Food Science and Technology, 2024, 49(10):127-136.
[3] 崔梦君, 赵慧君, 赵山山, 等.恩施和桐梓地区鲜广椒细菌群落结构及其感官品质解析[J].食品研究与开发, 2025, 46(2):201-207.CUI M J, ZHAO H J, ZHAO S S, et al.Bacterial community structure and sensory quality of Zha-chili in Enshi and Tongzi[J].Food Research and Development, 2025, 46(2):201-207.
[4] 尹小庆, 汤艳燕, 杜木英, 等.两种鲊辣椒发酵过程中香气特征及其差异分析[J].食品与发酵工业, 2019, 45(16):266-274;285.YIN X Q, TANG Y Y, DU M Y, et al.Volatile aroma components and variation of two types of Zha-chilis during fermentation[J].Food and Fermentation Industries, 2019, 45(16):266-274;285.
[5] YANG C C, ZHAO F Y, HOU Q C, et al.PacBio sequencing reveals bacterial community diversity in cheeses collected from different regions[J].Journal of Dairy Science, 2020, 103(2):1238-1249.
[6] 陈邵德罡, 柯悦, 郭壮, 等.张家界和湘西地区鲊广椒细菌菌群多样性比较分析[J].中国酿造, 2023, 42(9):68-72.CHEN S, KE Y, GUO Z, et al.Comparative analysis of bacterial community diversity in Zha-chili samples collected from Zhangjiajie and Xiangxi region[J].China Brewing, 2023, 42(9):68-72.
[7] 席啦, 向凡舒, 张彦, 等.天门地区鲊广椒中细菌群落结构及乳酸菌类群研究[J].食品与发酵工业, 2022, 48(17):122-128.XI L, XIANG F S, ZHANG Y, et al.Bacterial community structure and lactic acid bacterial taxa in Zha-chili from Tianmen region[J].Food and Fermentation Industries, 2022, 48(17):122-128.
[8] 李娜, 崔梦君, 马佳佳, 等.基于Illumina MiSeq测序和传统可培养方法的洪湖鲊广椒乳酸菌多样性研究[J].食品与发酵工业, 2021, 47(4):110-115;122.LI N, CUI M J, MA J J, et al.Lactic acid bacterial diversity of Zha-chili in Honghu county based on Illumina Miseq sequencing and traditional culture method[J].Food and Fermentation Industries, 2021, 47(4):110-115;122.
[9] 崔梦君, 王玉荣, 侯强川, 等.基于三代测序技术高温和中高温大曲真菌多样性解析及酵母菌的分离鉴定[J].食品工业科技, 2025, 46(2):175-183.CUI M J, WANG Y R, HOU Q C, et al.Analysis of fungal diversity and isolation and identification of yeast in high-temperature and Medium-high-temperature Daqu using three generation sequencing technology[J].Science and Technology of Food Industry, 2025, 46(2):175-183.[10] DU Z M, SUN L, LIN Y L, et al.Using PacBio SMRT sequencing technology and metabolomics to explore the microbiota-metabolome interaction related to silage fermentation of woody plant[J].Frontiers in Microbiology, 2022, 13:857431.
[11] PENG C, SUN W T, DONG X, et al.Isolation, identification and utilization of lactic acid bacteria from silage in a warm and humid climate area[J].Scientific Reports, 2021, 11:12586.
[12] 雷炎, 马佳佳, 雷敏, 等.恩施鲊广椒乳酸菌的分离鉴定及其对挥发性风味物质的影响[J].中国酿造, 2019, 38(7):126-130.LEI Y, MA J J, LEI M, et al.Isolation and identification of lactic acid bacteria from Zhaguangjiao of Enshi and its effect on volatile flavor substances[J].China Brewing, 2019, 38(7):126-130.
[13] CAI W C, TANG F X, WANG Y R, et al.Bacterial diversity and flavor profile of Zha-chili, a traditional fermented food in China[J].Food Research International, 2021, 141:110112.
[14] 向秀连, 赵慧君, 王玉荣, 等.食盐添加对鲊广椒感官品质及细菌类群的影响[J].食品工业科技, 2023, 44(17):108-114.XIANG X L, ZHAO H J, WANG Y R, et al.The effect of salt addition on sensory quality and bacterial structure of Zhaguangjiao[J].Science and Technology of Food Industry, 2023, 44(17):108-114.
[15] 杨晨, 柯悦, 黄锶钘, 等.不同地区鲊广椒细菌多样性比较研究[J].食品工业科技, 2023, 44(10):145-150.YANG C, KE Y, HUANG S X, et al.Comparative study on bacterial diversity of Zha-Chili in different regions[J].Science and Technology of Food Industry, 2023, 44(10):145-150.
[16] 席啦, 熊英梅, 王玉荣, 等.3类辣椒对鲊广椒细菌类群和品质的影响[J].食品工业科技, 2022, 43(19):154-159.XI L, XIONG Y M,WANG Y R, et al.Effects of three peppers varieties on bacterial taxa and quality of Zhaguangjiao[J].Science and Technology of Food Industry, 2022, 43(19):154-159.
[17] 张飞, 刘富光, 肖念念, 等.酱香型大曲发酵过程中可培养微生物演替规律的分析研究[J].酿酒科技, 2024(12):82-86.ZHANG F, LIU F G, XIAO N N, et al.Succession law of cultivable microorganisms during fermentation of Jiangxiang Daqu[J].Liquor-Making Science &Technology, 2024(12):82-86.
[18] SAFFARIONPOUR S.Off-flavors in pulses and grain legumes and processing approaches for controlling flavor-plant protein interaction:Application prospects in plant-based alternative foods[J].Food and Bioprocess Technology, 2024, 17(5):1141-1182.
[19] 陈梓琦, 汪彩云, 李紫宁, 等.乳酸菌的生长特性及其功能性质与应用综述[J].农产品加工, 2020(12):80-83.CHEN Z Q, WANG C Y, LI Z N, et al.A review of the growth characteristics, functional properties and applications of lactic acid bacteria[J].Farm Products Processing, 2020(12):80-83.
[20] ZHANG H X, LI C Y, GU C T.Lacticaseibacillus salsurivasis sp.nov.and Companilactobacillus muriivasis sp.nov., Isolated from Traditional Chinese Pickle[J].Current Microbiology, 2024, 81(7):203.
[21] CAI W C, WANG Y R, HOU Q C, et al.PacBio sequencing combined with metagenomic shotgun sequencing provides insight into the microbial diversity of Zha-chili[J].Food Bioscience, 2021, 40:100884.
[22] 赵皓静, 冯婧煕, 王晓丹, 等.一株耐酸乳杆菌Lactobacillus acetotolerans FBKL1.0204的筛选鉴定及耐酸、产酸特性[J].食品与发酵工业, 2022, 48(19):50-57.ZHAO H J, FENG J X, WANG X D, et al.Screening, identification and characterization of acid tolerant Lactobacillus acetotolerans FBKL1.0204[J].Food and Fermentation Industries, 2022, 48(19):50-57.
[23] 黄浩伦, 陆震鸣, 柴丽娟, 等.瑞士乳杆菌与耐酸乳杆菌复合强化对液态发酵食醋风味的影响[J].食品与发酵工业, 2025, 51(1):143-150.HUANG H L, LU Z M, CHAI L J, et al.Effect of bioaugmentation of Lactobacillus helveticus and Lactobacillus acetotolerans on the flavor of liquid fermented vinegar[J].Food and Fermentation Industries, 2025, 51(1):143-150.
[24] TABANELLI G, BARBIERI F, BA OS A, et al.Companilactobacillus alimentarius:An extensive characterization of strains isolated from spontaneous fermented sausages[J].International Journal of Food Microbiology, 2024, 410:110489.
OS A, et al.Companilactobacillus alimentarius:An extensive characterization of strains isolated from spontaneous fermented sausages[J].International Journal of Food Microbiology, 2024, 410:110489.
[25] 孟宪福, 卢保丽, 覃朝望.植物乳杆菌功能及其应用进展[J].轻工科技, 2023, 39(3):52-54.MENG X F, LU B L, QIN C W.Function and application progress of Lactobacillus plantarum[J]. Light Industry Science and Technology, 2023, 39(3):52-54.
[26] 李傲强, 李正钰, 田启全, 等.植物乳植杆菌促进植物基生物活性物质释放机制及其在发酵食品中的应用研究进展[J].乳业科学与技术, 2024, 47(4):47-52.LI A Q, LI Z Y, TIAN Q Q, et al.Research progress on the mechanism of action of Lactiplantibacillus plantarum in promoting the release of plant-based bioactive substances and its application in fermented foods[J].Journal of Dairy Science and Technology, 2024, 47(4):47-52.
[27] 郑越, 段涛, 宋丹, 等.植物乳杆菌在动物饲料中应用的研究进展[J].中国饲料, 2022(3):1-7.ZHENG Y, DUAN T, SONG D, et al.Review on the application of Lactobacillus plantarum in animal feed[J].China Feed, 2022(3):1-7.
[28] TIAN L, ZHAO R X, XU X Y, et al.Modulatory effects of Lactiplantibacillus plantarum on chronic metabolic diseases[J].Food Science and Human Wellness, 2023, 12(4):959-974.
[29] 孙茂成, 张岚, 刘敏, 等.戊糖乳杆菌及其在食品工业中的应用[J].中国酿造, 2015, 34(6):11-14.SUN M C, ZHANG L, LIU M, et al.Lactobacillus pentosus and its application in the food industry[J].China Brewing, 2015, 34(6):11-14.
[30] 田旭艳, 高沛, 夏文水, 等.接种戊糖乳杆菌和酿酒酵母菌对低盐发酵鳊鱼品质的影响[J].南方水产科学, 2022, 18(2):124-133.TIAN X Y, GAO P, XIA W S, et al.Effects of inoculation of Lactiplantibacillus pentosus and Saccharomyces cerevisiae on quality of low-salt fermented bream[J].South China Fisheries Science, 2022, 18(2):124-133.