肠易激综合征(irritable bowel syndrome,IBS)是一种慢性功能性肠道疾病,临床主要表现为腹痛或腹胀,并伴随有大便性状或排便频率的异常变化,症状持续或间歇发作,对患者日常生活造成严重影响。IBS相关症状包括腹泻、便秘或2种症状的组合。根据这些症状,IBS被分为4种亚型:IBS-C、IBS-D、IBS-M、IBS-U,IBS-U患者符合IBS的诊断标准,但是无法被准确地分类为上述3种亚型[1]。IBS的全球患病率约为5%~10%[2],中国目前的患病率略低于欧美国家,但呈逐年上升趋势[3]。
IBS机制复杂,病理生理学尚未完全阐明。目前研究表明,IBS机制主要包括脑肠轴异常、肠黏膜屏障破坏、肠道菌群失调以及相关因子、细胞异常等[2]。IBS的传统疗法主要分为非药物治疗和药物治疗。非药物治疗主要包括心理疗法和饮食调整。药物疗法主要是通过对腹泻或便秘对症下药,给予止泻药(如洛哌丁胺)或缓泻药,亦或针对腹痛症状给予解挛药。此外,低剂量的抗抑郁药如阿米替林,可以改善IBS症状,特别是对于那些同时患有焦虑或抑郁的患者[4-5]。阿洛司琼是一种5-羟色胺3型拮抗剂,可以改善腹泻型或混合型IBS患者的症状[6-7]。然而,传统药物治疗可能导致一系列副作用,如影响肠道功能、转运时间等[8]。
现有大量研究表明,在肠道微生物在IBS中发挥重要作用,例如,CONSTANTE等[9]发现IBS患者人源化小鼠胃肠转运会加快。基于肠道微生物在IBS发病中的重要地位,目前研究表明,益生菌可以通过促进有益菌的生长、抑制有害菌的繁殖、改善肠道菌群结构、调节肠道菌群平衡、增强肠道屏障功能和缓解炎症等方面而缓解IBS[10-11]。
因此,菌群靶向食品,尤其是益生菌、益生元等微生态制剂,逐渐成为缓解IBS的一个有前景的治疗方向。有研究发现,益生菌的干预降低了腹泻型IBS患者的症状,并且改变了主要与炎症相关的尿代谢物的水平,因此益生菌可能通过抗炎作用缓解IBS症状[12]。另一项研究发现微胶囊化丁酸钠、益生菌组合(乳杆菌菌株和双歧杆菌菌株)和益生元(短链低聚果糖)的配方有帮助恢复肠道微生物群受干扰的功能,并增加肠道丁酸盐水平[13],这有利于IBS症状的缓解。此外,作为一种新型的治疗手段,微生态制剂的安全性也备受关注。有研究表明,瑞士乳杆菌R0052和长双歧杆菌R0175联用的微生态制剂不仅可以降低焦虑和抑郁程度,同时也不会引起成瘾或学习和记忆障碍等副作用,显示出良好的安全性[14]。另有儿童相关研究表明,将番泻叶联合基于益生菌的制剂作为结肠镜检查前的肠道准备方案,未观察到重大不良反应,且该制剂的口感被所有受试者(100%)接受[15]。
既往研究表明,水苏糖具有调节肠道菌群、促进有益菌增殖的作用[16],而谷氨酰胺则被证明可以改善肠道通透性,并缓解IBS症状[17]。鉴于两者作用机制具有互补性,复配使用有望发挥协同效应,改善IBS患者的症状。因此,本研究旨在探讨水苏糖与谷氨酰胺联合干预在IBS患者中的疗效,特别是在调节肠道菌群相关物种丰度、改善IBS严重程度和患者生活质量等方面的效果。为临床治疗IBS提供一种新的策略,也为IBS的管理提供新的思路和依据。
1 材料与方法
1.1 研究对象
本研究在中国江苏省无锡市江南大学附属医院开展,所有涉及人类受试者的招募和研究程序均获得江南大学附属医院伦理委员会的批准(批准号:LS2024278)。受试者的招募主要通过门诊、传单、海报和微信朋友圈。
纳入标准:年龄18~70岁、符合罗马Ⅳ标准诊断的IBS患者,自愿提供粪便样本,配合签署知情同意书及相关问卷调查。
排除标准如下:a)近3个月内服用过抗生素;b)近2周内服用过益生元或益生菌;c)曾接受过腹部手术的患者[阑尾切除术和胆囊切除术(如在入组前超过6个月进行)以及妇科/泌尿科手术除外];d)有细菌过度生长、炎症性肠病、乳糜泻等肠道疾病;e)有其他严重全身性疾病,包括心、肺、肾等重要器官疾病;免疫调节性疾病;代谢性疾病或恶性肿瘤;f)正在参加另一项临床试验;g)对益生元产品过敏。
具体招募流程图如图1所示。
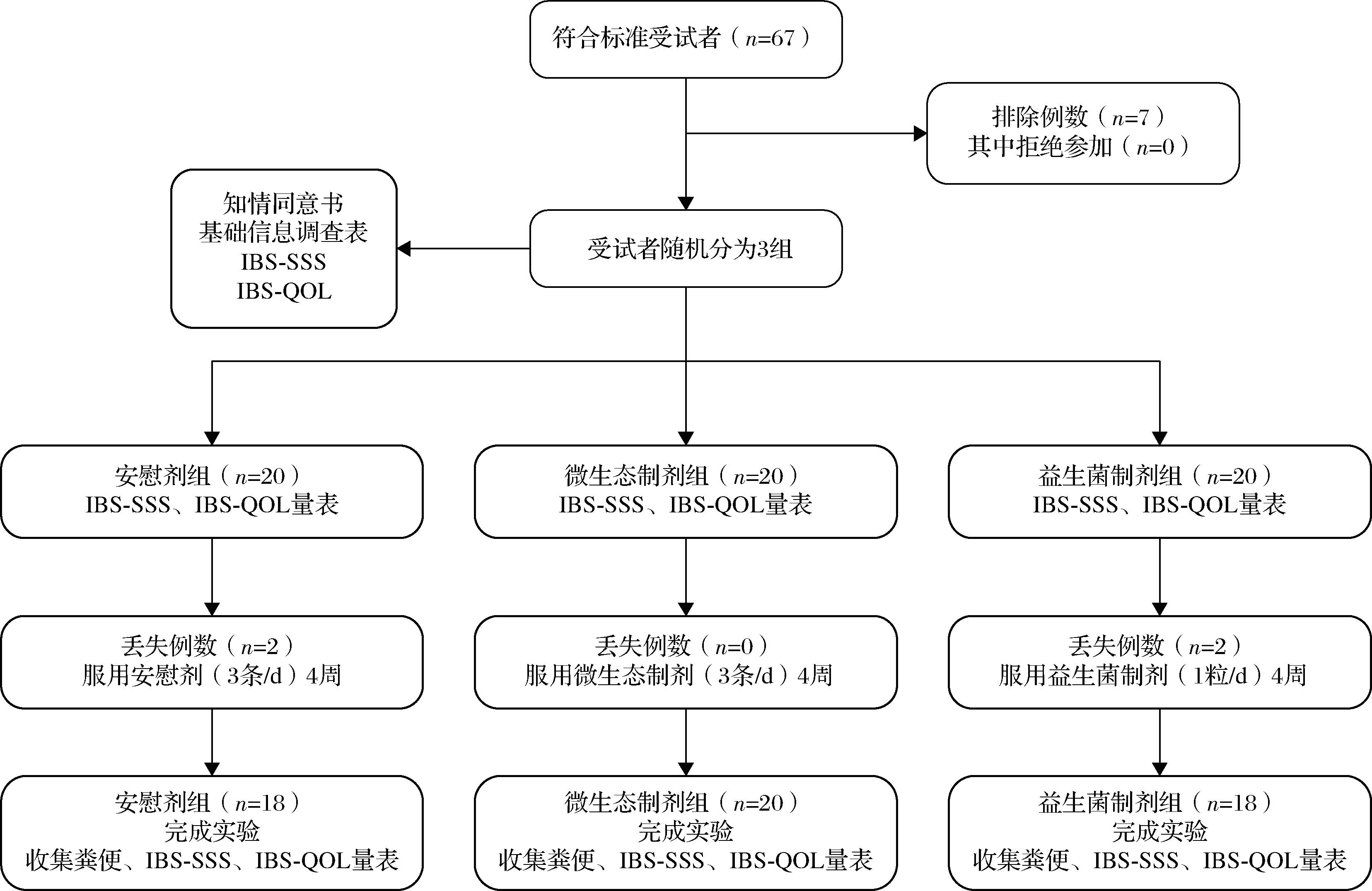
图1 临床招募情况和干预流程
Fig.1 Clinical recruitment status and intervention process
注:IBS病情严重程度量表(IBS symptom severity scale,IBS-SSS);IBS生活质量量表(IBS-quality of life measure,IBS-QOL)。
1.2 实验设计
试验设计为随机、双盲、安慰剂对照试验。
入组前访问时间为1周,进行评估资质。主要评估了纳入和排除标准,符合条件的参与者被纳入研究,并签署知情同意书,完成病例报告表。病例报告表主要记录以下指标:受试者身体基本信息(包括联系方式、住址、年龄、性别、身高和体重)、IBS-SSS、IBS-QOL访问结束后,对受试者进行随机分组,利用江南大学附属医院中央随机系统将患者随机分为3组,分别为安慰剂组、微生态制剂组和益生菌阳性对照组。分组完成后发放相应的产品,并进行4周的干预。干预期间,受试者每周需要填写IBS-SSS和IBS-QOL,以便动态评估症状变化和生活质量改善情况。干预结束后,收集所有受试者的粪便。受试者需按照流程在家中使用粪便收集管自行采集粪便样本,并将采集后的样本管置于装有冰袋的容器中,随后尽快通知研究者上门取样。研究者收到粪便样本后,立即将样本存放于实验室-80 ℃冰箱中冷冻保存。
安慰剂产品为麦芽糊精粉末,其中含有麦芽糊精3.3 g/条,每天3条;微生态制剂产品为水苏糖和谷氨酰胺粉末,其中含水苏糖、谷氨酰胺各1.65 g/条,每天3条;益生菌产品为Bio-Kult®益生菌制剂,其中每粒胶囊活菌数约为8×109 CFU,每天一粒。干预期为期4周。安慰剂和微生态制剂产品由扬州江大食生一生食品有限公司进行生产包装,益生菌产品购自网络官方旗舰店。
由于益生菌产品和安慰剂、微生态制剂的剂型不同,统一了产品的外包装,以最大程度减小对盲法实施的影响,整个试验过程中,研究者和受试者均不知各自分组情况,以确保双盲原则的实施,从而最大限度地减少主观偏倚。
1.3 肠道菌群检测
利用磁珠法试剂盒提取粪便样本的基因组DNA并分离纯化。随后,通过NEBNext® UltraTM DNA文库制备试剂盒(New England Biolabs)完成测序文库的构建。文库构建结束后,进行质量检测,确保合格后采用Illumina PE150平台开展双端测序分析。
1.4 实验设计
原始测序数据通过Trimmomatic v0.39软件进行了质量优化处理,有效剔除了低质量序列,提升数据的质量。接着,利用KneadData软件整合Bowtie2 v2.3.4.1工具,对预处理后的数据进行宿主序列去除,消除宿主污染,确保下游分析主要针对微生物来源的序列。使用FastQC v0.11.9对去除低质量序列和宿主污染后的数据进行质量检测。在数据预处理和质量控制完成后,采用MetaPhlAn v3.0.13对所有宏基因组样本进行物种丰度注释[18]。
随后,通过HUMAnN v3.0.0对宏基因组测序数据进行代谢功能推断,提取微生物群落的功能信息。具体而言,合并后的测序数据文件通过HUMAnN进行分析,将基因家族表中的标识符从UniRef 90 IDs转换为对应的特定蛋白质名称。
所有获得的功能数据表经过标准化处理后,借助GNU Parallel工具将各样本数据合并为所有样本的单一文件,以便进行后续的相关性分析和其他统计检验[19-20]。
1.5 数据分析
本部分实验采用GraphPad Prism 8统计软件,先进行正态检验及方差齐性检验,符合正态分布且方差齐性的数据采用ANOVA分析,用“平均值±标准差”表示,不符合正态分布或方差不齐的数据用Kruskal-Wallis检验,用中位数(四分位距)[M(P25, P75)]表示。
2 结果与分析
2.1 人群试验临床信息表征
67名志愿者完成了在线信息采集或现场信息采集问卷,其中7名志愿者因不符合纳入标准被排除。最终共纳入60例IBS患者,每位志愿者在入组前均签订了书面知情同意书。这些患者均来源于2024年11月~2025年1月期间江南大学附属医院消化科门诊。按照1∶1∶1的比例,利用江南大学附属医院中央随机系统将患者随机分为3组:安慰剂组、微生态制剂组和益生菌阳性对照组,各组初始均为20例。
在干预期间,部分患者因不同原因退出研究:安慰剂组有2例脱落,其中1例因依从性差退出,1例因长期出差无法按时采样而退出;益生菌阳性对照组同样有2例脱落,其中1例因服药后自述效果不佳而拒绝继续服用,1例因依从性差退出。最终,共有56例IBS患者完成干预并纳入最终统计分析,其中安慰剂组18例、微生态制剂组20例、益生菌阳性对照组18例。最终,共有56例IBS患者(28名女性和28名男性)完成干预并被纳入最终统计分析(图1)。通过功率计算,在误差α=0.05的条件下,56名志愿者的效应大小d=0.798,几乎等于事先功率分析设定的0.8[21],证明初始样本量有效。
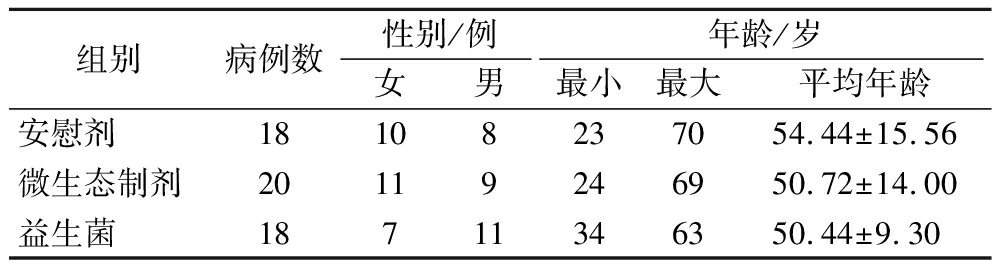
通过对受试者的性别构成与年龄分布进行统计学分析,结果显示不同组别间未呈现显著差异(P值均大于0.05),这一数据表明各组基线特征具有一致性,各组间有良好的可比性,具体数据分布情况详如表1所示。
表1 受试者基础信息
Table 1 Baseline characteristics of subjects
组别病例数性别/例年龄/岁女男最小最大平均年龄安慰剂18108237054.44±15.56微生态制剂20119246950.72±14.00益生菌18711346350.44±9.30
2.2 微生态制剂对受试者IBS症状严重程度的影响
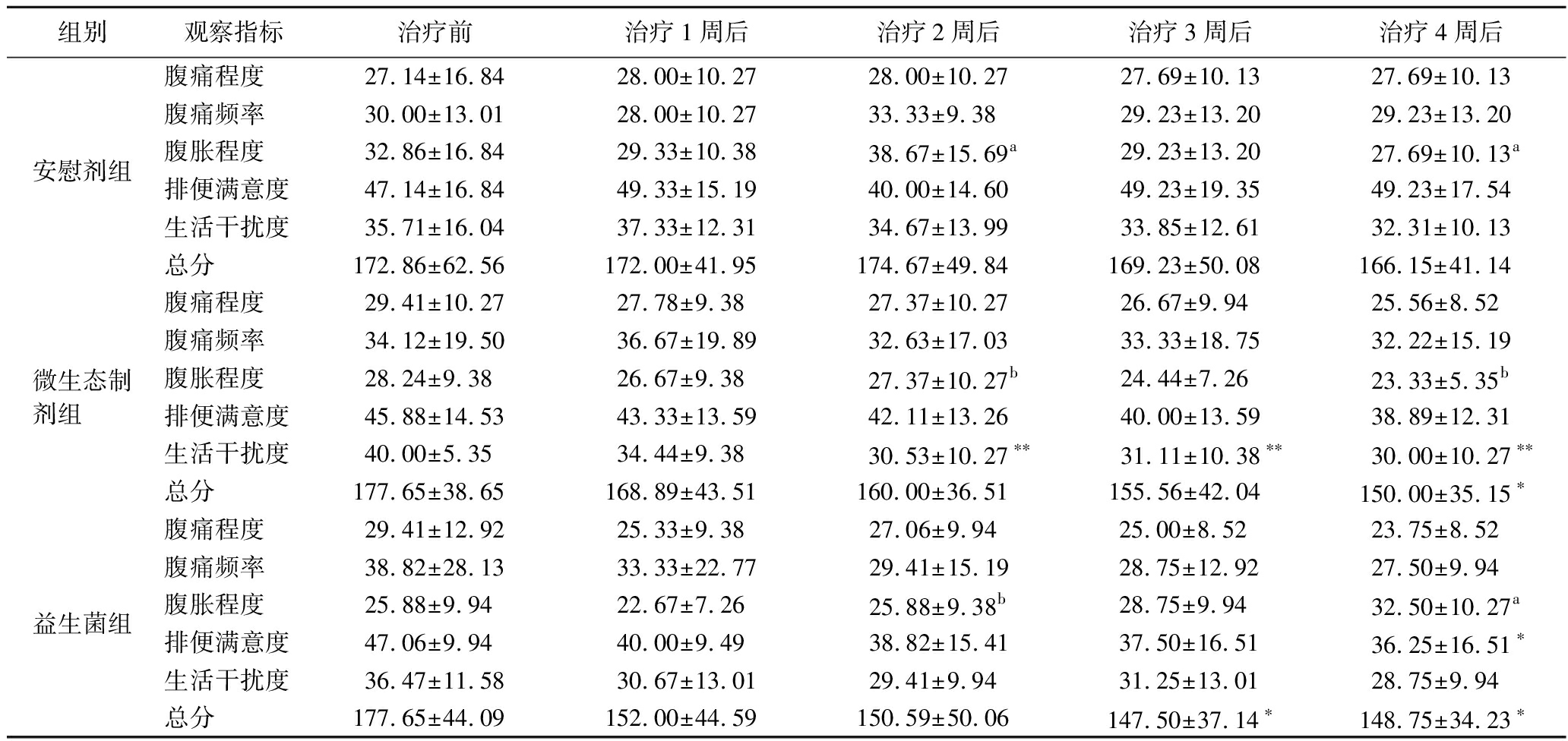
本研究中3组患者治疗前腹痛程度、腹痛频率、腹胀程度、排便满意度、生活干扰度和IBS-SSS总分比较差异均无统计学意义(P>0.05),表明各组基线特征具有可比性,为后续干预效果的评估提供了可靠基础。
如表2所示,与本组基线数据(治疗前)纵向比较,微生态制剂组在治疗4周后总分出现了显著改善(P<0.05),其中生活干扰度评分从治疗2周起即显示出明显改善(P<0.01)。益生菌组在治疗3周后出现明显改善(P<0.05),并且在第4周依然保持疗效,其中排便满意度评分在治疗4周后出现显著改善(P<0.05)。治疗周期内纵向分析结合IBS-SSS评分动态变化曲线(图2-a)表明,两类干预措施可能通过不同作用时间窗和方式产生临床效益。
表2 受试者治疗前后IBS-SSS各单项分及总积分 单位:分
Table 2 IBS-SSS individual item scores and total score before and after treatment of subjects
组别观察指标治疗前治疗1周后治疗2周后治疗3周后治疗4周后安慰剂组腹痛程度27.14±16.8428.00±10.2728.00±10.2727.69±10.1327.69±10.13腹痛频率30.00±13.0128.00±10.2733.33±9.3829.23±13.2029.23±13.20腹胀程度32.86±16.8429.33±10.3838.67±15.69a29.23±13.2027.69±10.13a排便满意度47.14±16.8449.33±15.1940.00±14.6049.23±19.3549.23±17.54生活干扰度35.71±16.0437.33±12.3134.67±13.9933.85±12.6132.31±10.13总分172.86±62.56172.00±41.95174.67±49.84169.23±50.08166.15±41.14微生态制剂组 腹痛程度29.41±10.2727.78±9.38 27.37±10.2726.67±9.94 25.56±8.52 腹痛频率34.12±19.5036.67±19.8932.63±17.0333.33±18.7532.22±15.19腹胀程度28.24±9.3826.67±9.3827.37±10.27b24.44±7.2623.33±5.35b排便满意度45.88±14.5343.33±13.5942.11±13.2640.00±13.5938.89±12.31生活干扰度40.00±5.3534.44±9.3830.53±10.27∗∗31.11±10.38∗∗30.00±10.27∗∗总分177.65±38.65168.89±43.51160.00±36.51155.56±42.04150.00±35.15∗益生菌组腹痛程度29.41±12.9225.33±9.38 27.06±9.94 25.00±8.52 23.75±8.52 腹痛频率38.82±28.1333.33±22.7729.41±15.1928.75±12.9227.50±9.94腹胀程度25.88±9.9422.67±7.2625.88±9.38b28.75±9.9432.50±10.27a排便满意度47.06±9.9440.00±9.4938.82±15.4137.50±16.5136.25±16.51∗生活干扰度36.47±11.5830.67±13.0129.41±9.9431.25±13.0128.75±9.94总分177.65±44.09152.00±44.59150.59±50.06147.50±37.14∗148.75±34.23∗
注:与同组基线数据比较时,*代表P<0.05,**代表P<0.01;与同时期其他组比较时,同一数值如果标有相同字母,说明它们之间无显著性差异;若上标字母不同,则代表各组之间存在统计学显著差异。
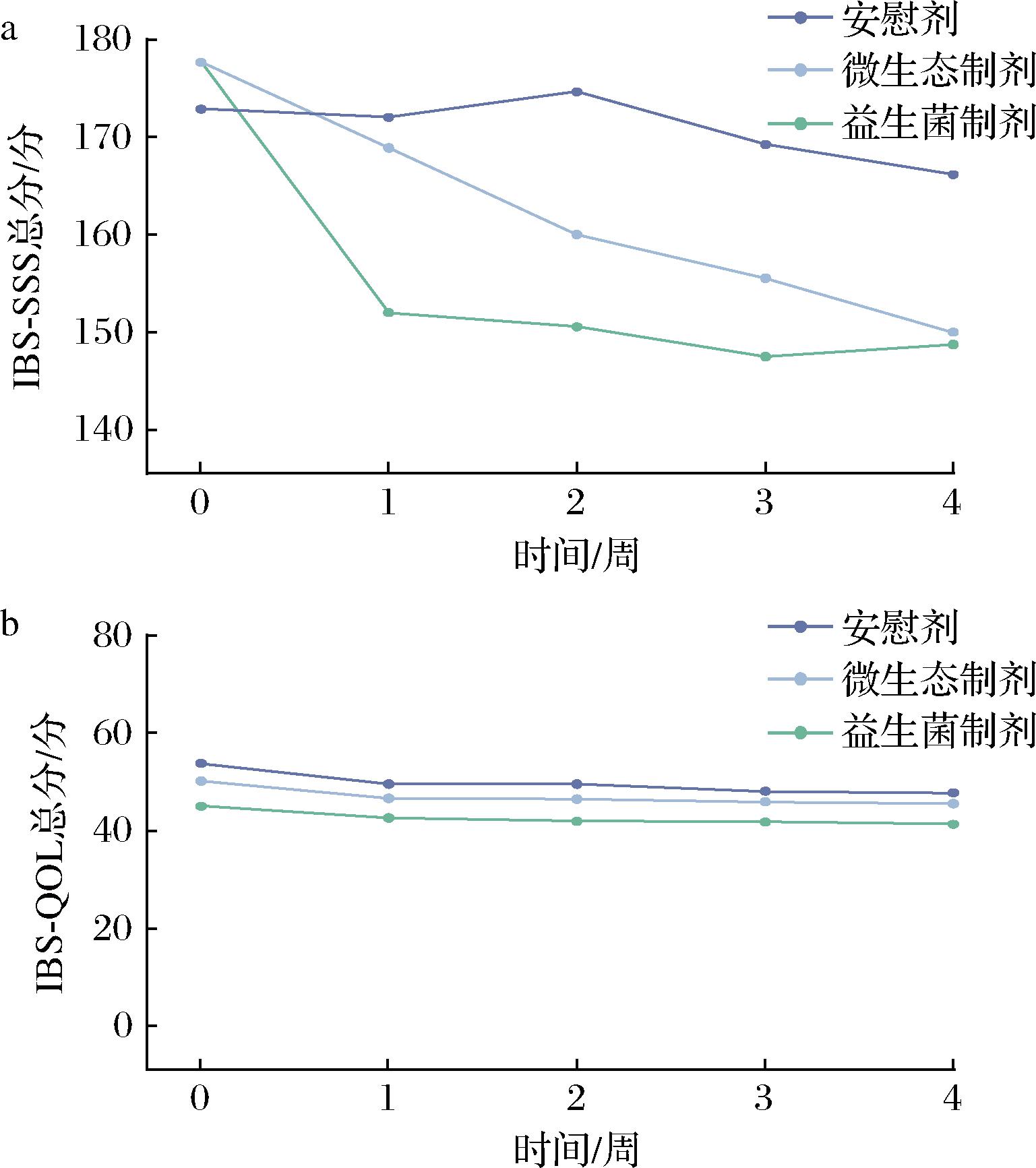
a-IBS-SSS得分;b-IBS-QOL得分
图2 临床量表动态变化曲线
Fig.2 Dynamic change curve of clinical scales
与其他组同时期横向比较,治疗2周后,微生态制剂组和益生菌组在腹胀程度评分方面比安慰剂组有了显著降低(P<0.05);治疗4周后,微生态制剂组的腹胀程度评分与其他2组有显著降低趋势(P<0.05)。
2.3 微生态制剂对受试者生活质量的影响
由表3可见,3组患者治疗前生活质量评分差异无统计学意义(P>0.05),各组基线特征具有可比性。与本组基线数据(治疗前)纵向比较,各组受试者在干预期间IBS-QOL评分均未呈现统计学显著性差异(P>0.05)。与其他组同时期横向比较,不同时间节点各组间评分差异亦未达统计学显著(P>0.05)。结合IBS-QOL评分动态变化曲线(图2-b)进一步证实治疗周期内各组评分波动幅度较小,组间差异维持相对稳定状态。
表3 受试者治疗前后IBS-QOL评分 单位:分
Table 3 IBS-QOL scores before and after treatment of subjects
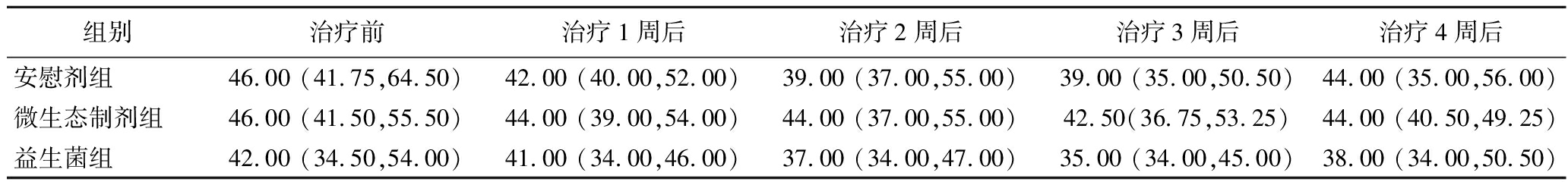
组别治疗前治疗1周后治疗2周后治疗3周后治疗4周后安慰剂组46.00 (41.75,64.50)42.00 (40.00,52.00)39.00 (37.00,55.00)39.00 (35.00,50.50)44.00 (35.00,56.00)微生态制剂组46.00 (41.50,55.50)44.00 (39.00,54.00)44.00 (37.00,55.00)42.50(36.75,53.25)44.00 (40.50,49.25)益生菌组42.00 (34.50,54.00)41.00 (34.00,46.00)37.00 (34.00,47.00)35.00 (34.00,45.00)38.00 (34.00,50.50)
2.4 微生态制剂对受试者肠道菌群的影响
肠道菌群α多样性和β多样性是反映肠道菌群结构稳态的重要指标。本文通过计算α多样性和β多样性相关指数,明确治疗后不同组IBS患者肠道菌群结构多样性变化。相较于安慰剂组,在微生态制剂组和益生菌组中Shannon指数和Simpson指数均有下降趋势(图3-a、图3-b),但无统计学显著差异(P>0.05)。而β多样性结果也显示微生态制剂组和益生菌组相较于安慰剂组有差异但不显著(R2=0.06,F=0.862,P=0.718)(图3-c)。
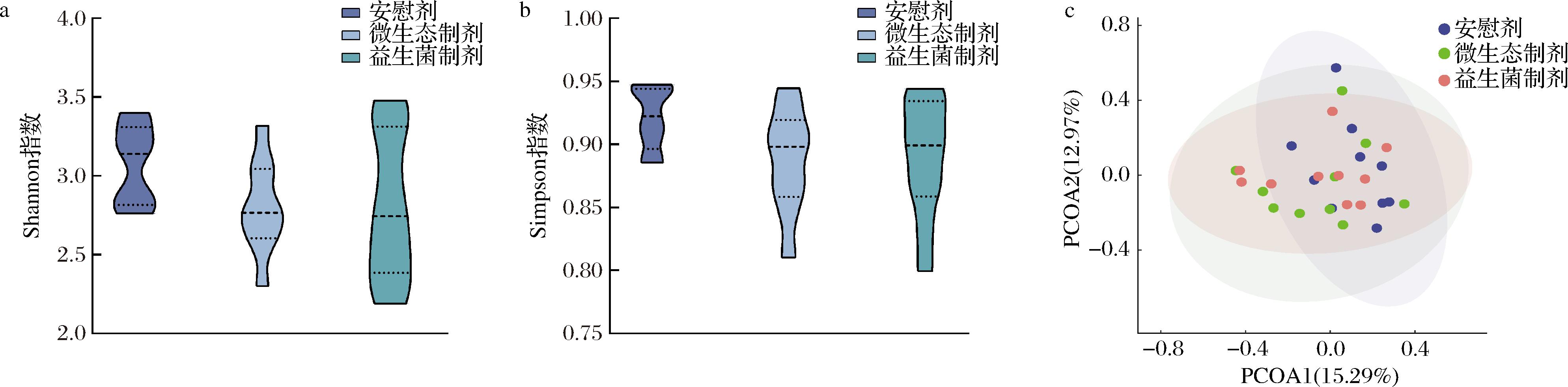
a-Shannon指数;b-Simpson指数;c-基于Bray-Curtis距离矩阵的肠道菌群群落结构主坐标分析图
图3 干预后各组患者肠道菌群α多样性和β多样性
Fig.3 α-diversity and β-diversity of intestinal flora in the post-intervention groups of patients
进一步分析发现,特定菌群的丰度在门水平、属水平和种水平发生了明显变化(图4-a、图4-b、图4-c)。普通拟杆菌(Bacteroides vulgatus)和单形拟杆菌(Bacteroides uniformis)在微生态制剂组和益生菌组中的丰度显著上升(P<0.05)。此外,在微生态制剂组中,普拉梭菌(Faecalibacterium prausnitzii)和活泼瘤胃球菌(Ruminococcus gnavus)的丰度显著下降(P<0.05),其中活泼瘤胃球菌在IBS患者中往往呈升高趋势[22]。同时,微生态制剂组中粪便拟杆菌(Bacteroides stercoris)和普雷沃氏菌(Prevotella copri)的丰度显著上升(P<0.05)。此外,如图4-d所示,微生态制剂干预后患者肠道菌群厚壁菌门和拟杆菌门比率(Firmicutes/Bacteroidetes,F/B)显著降低(P<0.05)。

a-门水平肠道菌群组成;b-属水平肠道菌群组成;c-种水平肠道菌群组成;d-厚壁菌门和拟杆菌门比率
图4 干预后各组患者肠道菌群组成
Fig.4 Dynamic change curve of clinical scales
注:*表示差异显著(P<0.05)。

a-进化分支图;b-LDA得分图
图5 肠道菌群LEfSe分析
Fig.5 LEfSe analysis of intestinal flora
因此,虽然整体菌群多样性指标未显示显著变化,但特定菌群丰度的调整提示,不同干预手段可能通过调控关键菌群的比例,对肠道微生态环境和IBS相关症状的改善产生潜在影响。
2.5 微生态制剂干预后差异菌种的筛选
使用线性判别分析效应大小(linear discriminant analysis effect size,LEfSe)确定了微生态制剂干预和安慰剂干预后2组的差异微生物。进化分支图显示(图5-a),富集于安慰剂组的差异微生物主要集中在厚壁菌门中,而富集于微生态制剂组的差异微生物主要是种水平的物种,如卵形拟杆菌(Bacteroides ovatus)、普通拟杆菌和粪球菌属(Coprococcus comes)的一个物种。以线性判别分析值(linear discriminant analysis,LDA)大于3为筛选标准,在种水平得到17个显著差异物种(图5-b),其中6个物种富集于微生态制剂组,11个物种富集于安慰剂组。结果显示,微生态制剂干预后,普通拟杆菌、卵形拟杆菌、粪球菌属物种、诺迪氏拟杆菌(Bacteroides nordii)、经黏液真杆菌属物种(Blautia hydrogenotrophica)、瘤胃球菌属物种(Ruminococcaceae bacterium_D16)的丰度显著上升。
2.6 相关性分析
将上述17个差异菌种与IBS-SSS进行Spearman相关性分析,根据rho值绘制棒棒糖图(图6)。本文发现,富集于微生态制剂组的6个物种均与IBS-SSS分值呈显著负相关。其中卵形拟杆菌负相关程度最高,rho值达到了-0.628,同属的普通拟杆菌和诺迪氏拟杆菌也有很高的相关性,rho值分别达到了-0.489 和-0.318。IBS-SSS分值越高,IBS症状越严重,那么与其呈现负相关的菌理论上就是造成IBS的关键菌,而水苏糖和谷氨酰胺复配的微生态制剂上调了这些菌的相对丰度。
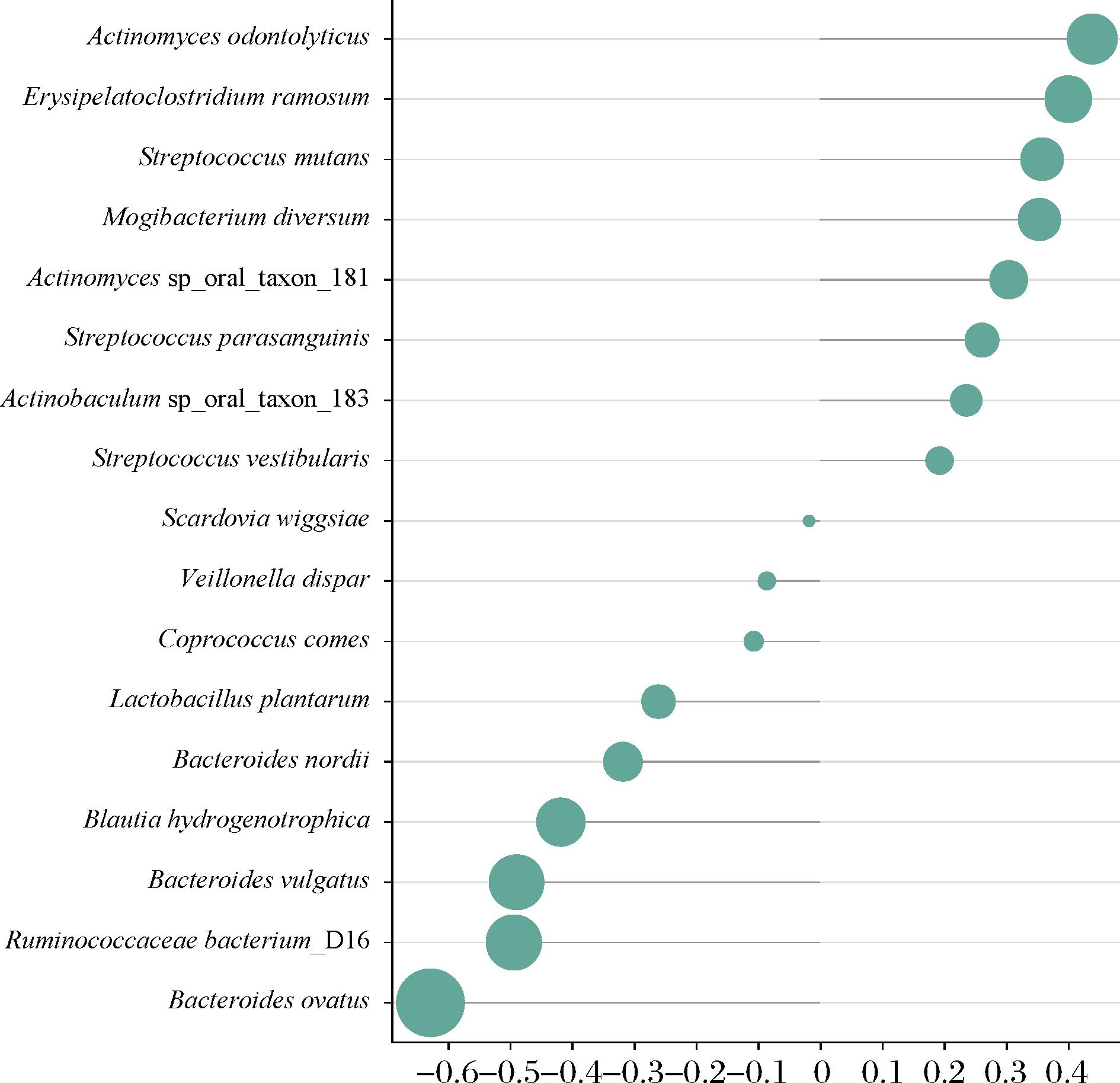
图6 IBS-SSS与差异菌种的相关性分析
Fig.6 Correlation analysis between IBS-SSS and differential bacterial species
3 讨论
本项临床试验探究了水苏糖和谷氨酰胺复配的微生态制剂对IBS患者的益处。尤其关注其对肠道微生物群落结构、IBS严重程度的影响。
研究结果表明,微生态制剂组在改善患者总体症状和日常生活干扰方面具有较快且持久的疗效,特别是在生活干扰度方面表现出显著改善。益生菌组在治疗过程中也有明显的疗效,并在治疗4周后仍保持效应,特别是在排便满意度方面。纵向分析和动态变化曲线显示,2种干预措施可能通过不同的作用时间窗和方式产生临床效益,益生菌效果更快,微生态制剂缓解作用更加温和,但最终效果相当。此外,与安慰剂组相比,微生态制剂组和益生菌组在缓解腹胀症状方面表现出显著效果,尤其是在治疗后期。类似的,著名益生菌制剂VSL#3的一项临床研究显示,其对腹胀症状有突出疗效[23]。而另一项有关丁酸梭菌制剂的临床研究则表明其可以显著降低IBS严重程度评分,但在缓解腹胀方面未显示出突出疗效[24]。因此本研究所用微生态制剂配方与其他不同研究中的干预措施在缓解IBS症状方面均有积极作用,但具体疗效表现和侧重点存在一定差异。此外,本研究发现,在治疗期间,IBS-QOL评分未出现统计学显著差异。各组评分波动幅度较小,且组间差异保持相对稳定。这可能是由于本试验招募的受试者多为中、轻症IBS患者,症状对生活质量的影响有限。此外,IBS-QOL对生活质量的评估与临床症状改善之间存在时间解耦现象,短期干预下量表的敏感性可能不足,导致评分变化与症状改善关系不明显[25]。
肠道菌群分析表明,微生态制剂组和益生菌组与安慰剂组在整体肠道菌群的α多样性和β多样性上未出现显著差异。在一项纳入24项研究的系统评价中,研究者发现IBS患者肠道菌群的多样性既有降低的情况,也有多样性差异不显著的情况,两者发生比例大致相当[26]。本研究中受试者肠道菌群多样性未显示出显著变化,这可能与中、轻症IBS患者肠道内环境尚未出现明显紊乱有关。然而,在本研究中,特定菌群的丰度上却发生了明显的变化。微生态制剂组和益生菌组中,一些有益生作用的微生物如拟杆菌属的普通拟杆菌、卵形拟杆菌丰度显著上升,而一些与IBS症状相关的有害菌种则有所下降,如活泼瘤胃球菌。有研究发现健康个体中分离出的卵形拟杆菌、普通拟杆菌等拟杆菌属物种具有抗炎活性[27]。而活泼瘤胃球菌被认为利用膳食中芳香氨基酸促进5羟色胺合成而加重腹泻型IBS[22]。进一步的LEfSe分析结果表明,微生态制剂干预组与安慰剂组在菌群构成上存在显著差异,尤其是在种水平上,微生态制剂组富集了卵形拟杆菌和普通拟杆菌等有益菌种。这表明,虽然整体菌群的多样性未发生大幅波动,但通过调节关键菌群的丰度,微生态制剂和益生菌可能在一定程度上改善了肠道菌群的结构,这些微生物的丰度变化可能与IBS患者的临床表现密切相关。此外,本研究发现微生态制剂组的F/B比率相较于安慰剂组有显著降低。一项纳入了16项研究的系统评价指出,IBS患者肠道微生物群F/B比率普遍增加,显示出一致性变化趋势[28]。而另一项针对便秘患者的研究发现,鼠李糖乳杆菌通过增加肠道菌群的多样性和调整F/B比例(主要是下调),显著改善了肠道健康和临床症状[29],进一步支持了菌群结构变化与临床改善之间的关联性,而不同研究中F/B调节的方向各异,也说明F/B并不是越高越好或越低越好,而是需要维持在一个相对平衡的比值范围内,表明肠道微生物处于平衡状态,以促进肠道的稳态和健康。
此外,通过Spearman相关性分析,发现微生态制剂组中的某些菌群与IBS-SSS评分呈显著负相关,提示这些菌群的丰度变化可能与IBS症状的缓解有密切关系。尤其是微生态制剂组中的普通拟杆菌和卵形拟杆菌等菌种与IBS症状呈负相关,表明这些菌种的上调可能在改善IBS症状方面起到了重要作用。这进一步支持了微生态制剂通过调整肠道菌群的组成来缓解IBS症状的潜力。
综上所述,本研究探讨了水苏糖和谷氨酰胺复配的微生态制剂在IBS患者中的疗效。结果表明,微生态制剂和益生菌组在改善患者症状、腹胀和生活干扰方面表现出积极作用,两者效果相当,且微生态制剂缓解作用更加缓和。尽管整体肠道菌群的多样性未显著变化,但2组的特定益生菌丰度显著上升,且在微生态制剂组中富集的显著差异菌与IBS症状的改善存在相关性。特别是普通拟杆菌和卵形拟杆菌的上调可能在缓解IBS症状方面发挥了关键作用。因此,微生态制剂通过调节肠道菌群组成,可能为IBS的治疗提供了有效的干预方案。
4 结论
本研究旨在探讨水苏糖和谷氨酰胺复配的微生态制剂在IBS人群干预实验中的作用,重点评估其对肠道微生物群落结构、IBS严重程度和生活质量的影响。结果显示水苏糖和谷氨酰胺复配的微生态制剂通过上调普通拟杆菌、卵形拟杆菌、粪球菌属物种、诺迪氏拟杆菌、经黏液真杆菌属物种、瘤胃球菌属物种的丰度,改善IBS患者的症状,减轻腹胀程度和对生活的困扰。
本研究为菌群靶向性微生态制剂在改善IBS患者肠道健康和生活质量方面的潜在应用提供了新的证据。未来的研究可进一步探讨这一机制,并评估在不同亚型IBS中的应用潜力,为IBS及相关肠道疾病的干预提供新的策略和理论依据。
[1] BENJAK HORVAT I, GOBIN I, ![]() A, et al.How can probiotic improve irritable bowel syndrome symptoms?[J].World Journal of Gastrointestinal Surgery, 2021, 13(9):923-940.
A, et al.How can probiotic improve irritable bowel syndrome symptoms?[J].World Journal of Gastrointestinal Surgery, 2021, 13(9):923-940.
[2] FORD A C, SPERBER A D, CORSETTI M, et al.Irritable bowel syndrome[J].The Lancet, 2020, 396(10263):1675-1688.
[3] 朱佳杰, 刘珊, 赵鹏程, 等.肠易激综合征的流行病学研究进展[J].国际消化病杂志, 2017, 37(5):271-273.ZHU J J, LIU S, ZHAO P C, et al.Progress in epidemiological research of irritable bowel syndrome[J].International Journal of Digestive Diseases, 2017, 37(5):271-273.
[4] MORGAN V, PICKENS D, GAUTAM S, et al.Amitriptyline reduces rectal pain related activation of the anterior cingulate cortex in patients with irritable bowel syndrome[J].Gut, 2005, 54(5):601-607.
[5] WRIGHT-HUGHES A, OW P L, ALDERSON S L, et al.Predictors of response to low-dose amitriptyline for irritable bowel syndrome and efficacy and tolerability according to subtype:Post hoc analyses from the ATLANTIS trial[J].Gut, 2025, 74(5):728-739.
[6] VIRAMONTES B E, CAMILLERI M, MCKINZIE S, et al.Gender-related differences in slowing colonic transit by a 5-HT3 antagonist in subjects with diarrhea-predominant irritable bowel syndrome[J].The American Journal of Gastroenterology, 2001, 96(9):2671-2676.
[7] OLDEN K W, CHEY W D, SHRINGARPURE R, et al.Alosetron versus traditional pharmacotherapy in clinical practice:Effects on resource use, health-related quality of life, safety and symptom improvement in women with severe diarrhea-predominant irritable bowel syndrome[J].Current Medical Research and Opinion, 2019, 35(3):461-472.
[8] GORARD D A, LIBBY G W, FARTHING M J.Influence of antidepressants on whole gut and orocaecal transit times in health and irritable bowel syndrome[J].Alimentary Pharmacology &Therapeutics, 1994, 8(2):159-166.
[9] CONSTANTE M, DE PALMA G, LU J, et al.Saccharomyces boulardii CNCM I-745 modulates the microbiota-gut-brain axis in a humanized mouse model of Irritable Bowel Syndrome[J].Neurogastroenterology and Motility, 2021, 33(3):e13985.[10] LOPES C M, DE JESUS MONTEIRO C S, DUARTE A P, et al.Probiotics and prebiotics for the treatment of irritable bowel syndrome-a narrative review[J].Journal of Clinical Medicine, 2024, 13(21):6337.
[11] ZOLL B, AHUJA N K.Nutritional therapies for irritable bowel syndrome:A focus on prebiotics and probiotics[J].Current Treatment Options in Gastroenterology, 2020, 18(4):729-739.
[12] KIM J, CHO K, KIM J S, et al.Probiotic treatment induced change of inflammation related metabolites in IBS-D patients/double-blind, randomized, placebo-controlled trial[J].Food Science and Biotechnology, 2020, 29(6):837-844.
[13] G![]() SIOROWSKA A, ROMANOWSKI M, WALECKA-KAPICA E, et al.Effects of microencapsulated sodium butyrate, probiotics and short chain fructooligosaccharides in patients with irritable bowel syndrome:A study protocol of a randomized double-blind placebo-controlled trial[J].Journal of Clinical Medicine, 2022, 11(21):6587.
SIOROWSKA A, ROMANOWSKI M, WALECKA-KAPICA E, et al.Effects of microencapsulated sodium butyrate, probiotics and short chain fructooligosaccharides in patients with irritable bowel syndrome:A study protocol of a randomized double-blind placebo-controlled trial[J].Journal of Clinical Medicine, 2022, 11(21):6587.
[14] MESSAOUDI M, VIOLLE N, BISSON J F, et al.Beneficial psychological effects of a probiotic formulation (Lactobacillus helveticus R0052 and Bifidobacterium longum R0175) in healthy human volunteers[J].Gut Microbes,2011, 2(4):256-261.
[15] KESAVELU D SR.The efficacy and safety of combined Senna and probiotic-based bowel preparation for colonoscopy in children[J].Cureus, 2020, 12(9):e10180.
[16] ZHAO Z L, LIU W, PI X E.In vitro effects of stachyose on the human gut microbiota[J].Starch-Stärke, 2021, 73(7-8):2100029.
[17] ZHOU Q Q, VERNE M L, FIELDS J Z, et al.Randomised placebo-controlled trial of dietary glutamine supplements for postinfectious irritable bowel syndrome[J].Gut, 2019, 68(6):996-1002.
[18] BAUD A, KENNEDY S P.Targeted metagenomic databases provide improved analysis of microbiota samples[J].Microorganisms, 2024, 12(1):135.
[19] ADEKOYA A E, KARGBO H A, IBBERSON C B.Defining microbial community functions in chronic human infection with metatranscriptomics[J].mSystems,2023,8(6).
[20] MANZOOR M, LESKEL J, PIETI
J, PIETI INEN M, et al.Multikingdom oral microbiome interactions in early-onset cryptogenic ischemic stroke[J].ISME Communications, 2024, 4(1):ycae088.
INEN M, et al.Multikingdom oral microbiome interactions in early-onset cryptogenic ischemic stroke[J].ISME Communications, 2024, 4(1):ycae088.
[21] TIAN P J, CHEN Y, ZHU H Y, et al.Bifidobacterium breve CCFM1025 attenuates major depression disorder via regulating gut microbiome and tryptophan metabolism:A randomized clinical trial[J].Brain, Behavior, and Immunity, 2022, 100:233-241.
[22] ZHAI L X, HUANG C H, NING Z W, et al.Ruminococcus gnavus plays a pathogenic role in diarrhea-predominant irritable bowel syndrome by increasing serotonin biosynthesis[J].Cell Host &Microbe, 2023, 31(1):33-44.e5.
[23] KIM H J, CAMILLERI M, MCKINZIE S, et al.A randomized controlled trial of a probiotic, VSL#3, on gut transit and symptoms in diarrhoea-predominant irritable bowel syndrome[J].Alimentary Pharmacology &Therapeutics, 2003, 17(7):895-904.
[24] SUN Y Y, LI M, LI Y Y, et al.The effect of Clostridium butyricum on symptoms and fecal microbiota in diarrhea-dominant irritable bowel syndrome:A randomized, double-blind, placebo-controlled trial[J].Scientific Reports, 2018, 8:2964.
[25] 卞立群, 陆芳, 李振华, 等.IBS-SSS、AR及IBS-QOL在IBS临床疗效评价中的反应度分析[J].中国中西医结合杂志, 2016, 36(10):1191-1196.BIAN L Q, LU F, LI Z H, et al.Analysis of response of IBS-SSS, AR, and IBS-QOL in IBS clinical effect evaluation[J].Chinese Journal of Integrated Traditional and Western Medicine, 2016, 36(10):1191-1196.
[26] PITTAYANON R, LAU J T, YUAN Y H, et al.Gut microbiota in patients with irritable bowel syndrome:A systematic review[J].Gastroenterology, 2019, 157(1):97-108.
[27] HIIPPALA K, KAINULAINEN V, SUUTARINEN M, et al.Isolation of anti-inflammatory and epithelium reinforcing Bacteroides and Parabacteroides spp.from a healthy fecal donor[J].Nutrients, 2020, 12(4):935.
[28] DUAN R Q, ZHU S W, WANG B, et al.Alterations of gut microbiota in patients with irritable bowel syndrome based on 16S rRNA-targeted sequencing:A systematic review[J].Clinical and Translational Gastroenterology, 2019, 10(2):e00012.
[29] 刘文续, 王嘉良, 李嘉臻, 等.鼠李糖乳酪杆菌CCFM1069缓解便秘及其对便秘患者肠道菌群影响的临床研究[J].食品与发酵工业,2025,51(19):1-8.LIU W X, WANG J L, LI J Z, et al.A clinical study on effect of Lactobacillus rhamnosus CCFM1069 in alleviating constipation and its influence on gut microbiota of constipated patients[J].Food and Fermentation Industries,2025,51(19):1-8.