作为一种传统加工水产品,腌腊鱼因其独特的咸香风味和口感深受消费者欢迎。传统腌腊鱼主要以草鱼、鲢鱼等淡水鱼为原料,经腌制后,再经日光晒制而成。然而,在加工和贮藏过程中,腌腊鱼易受微生物污染,导致品质下降,甚至产生不良风味和有害物质。因此,如何有效控制微生物污染、延长货架期成为腌腊鱼加工的关键问题。非热加工技术因其对产品品质破坏小、能有效保持产品新鲜度而备受关注。目前,高压电场处理、脉冲杀菌和辐照等非热杀菌技术已被广泛应用,但这些方法因其使用的繁琐性、对被处理产品品质的可能负面影响等原因,在腌腊鱼加工中的应用受到一定限制。
近年来,冷等离子体(cold plasma,CP)作为一种新型非热杀菌技术,在食品保鲜领域展现出巨大潜力。CP主要由气体放电产生,其中含有活性氧/氮基团(reactive oxygen species,ROS/reactive nitrogen species,RNS)、带电粒子、紫外辐射等化学和物理因子,它们协同作用能有效杀灭微生物,进而延长食品货架期[1]。已有研究表明,CP在腌腊鱼加工中也有多种有益效果。例如,我们前期研究[2]发现,利用CP处理的空气对腌腊青鱼干进行处理,可以适度提高脂质氧化水平,促进不饱和脂肪酸氧化生成特征挥发性风味物质,从而提高产品的风味特征。SHEN等[3]的研究显示,CP处理能够降低干腌鲢鱼的含水率,并通过破坏鱼肉肌纤维释放组织蛋白酶B和L,促进蛋白质降解,从而提高鱼干的嫩度。ZHAI等[4]的研究发现,CP处理能够显著提高鱼干腺苷酸(adenosine monophosphate,AMP)、肌苷酸(inosine monophosphate,IMP)、甘氨酸、谷氨酸等鲜甜滋味物质含量,减少次黄嘌呤核苷(hypoxanthine riboside,HxR)和次黄嘌呤(hypoxanthine,Hx)等苦味物质含量,进而提高鱼干的口感。
综上所述,目前相关研究均聚焦于利用CP对腌腊鱼产品进行处理,并着重探究其对产品品质特性的影响。根据CP的作用机理,若将其作为一种腌制前的处理手段,能够有效杀灭鱼肉中的微生物,减小腌腊鱼成品在贮藏初期的菌落总数,从而提高产品的贮藏稳定性。为此,本研究以草鱼块为对象,对其进行CP处理,再经腌制、干制等工艺制备腌腊草鱼。对制备的腌腊草鱼在贮藏期间的新鲜度指标进行了测定,并对其感官和理化品质进行了分析,全面探究CP作为一种腌制前处理方法对腌腊鱼贮藏品质的影响。本研究成果为CP在腌制水产品加工中的应用提供了理论依据和技术支持。
1 材料与方法
1.1 材料与试剂
草鱼,湖州市德清县长桥农贸市场;食盐,雪天盐业集团股份有限公司。
酒石酸钾钠、牛血清白蛋白、甲基红、盐酸胍、无水硫酸钠、乙二胺四乙酸二钠盐,杭州吉工生物科技有限公司(中国杭州);氯化钠、氢氧化钠、正己烷、顺丁烯二酸、无水硫酸铜、硼酸、轻质氧化镁、三氯甲烷、甲醇、盐酸、无水乙醇,国药化学试剂有限公司(中国上海);溴甲酚绿、三氯乙酸、硫代巴比妥酸、平板计数琼脂,杭州双木化工有限公司(中国杭州);2,4,6-三甲基吡啶,杭州邦易化工有限公司(中国杭州);乙酸乙酯、三羟甲基氨基甲烷、三氟化硼-甲醇溶液,上海泰坦科技股份有限公司(中国上海);1,1,3,3-四乙氧基丙烷,上海毕得医药科技股份有限公司(中国上海);37种脂肪酸甲酯混标标品,西格玛奥德里奇贸易有限公司。其中2,4,6-三甲基吡啶为色谱纯,其余均为分析纯。
1.2 仪器与设备
CTP-2000KP低温等离子体发生器,南京苏曼等离子体有限公司;Urifier普力菲尔实验室专用纯水机,上海富诗特仪器设备有限公司;BCD-539 WT冰箱,青岛海尔生物医疗股份有限公司;WKD6070C欧易隆热泵干燥设备,杭州欧易电器有限公司;PD500PRIMA高速匀浆分散机,戈普仪器(上海)有限公司;HF-A6002电子天平,达俊电器有限公司;HWCL-1集热式恒温磁力搅拌浴,郑州长城科工贸有限公司;RE-2000A旋转蒸发器,上海亚荣生化仪器厂;TU-1900双光束紫外可见分光光度计,北京普析通用仪器有限责任公司;SHZ-D(Ⅲ)循环水真空泵,上海力辰邦西仪器科技有限公司;K9840自动凯氏定氮仪,海能未来技术集团股份有限公司;Trace1300-ISQ GC-MS,赛默飞世尔科技公司;PDMS SPME 萃取头,上海安普实验科技股份有限公司;DHG-9070电热鼓风干燥箱、生化培养箱,上海一恒科学仪器有限公司;HH-4数显恒温水浴锅,常州金坛良友仪器有限公司;CHT210R大容量高速台式冷冻离心机,湖南湘仪实验室仪器开发有限公司;AQ-180E多用途磨粉机,慈溪市耐欧电器有限公司;MIULAB迷你混合仪,杭州米欧仪器有限公司;TA.XT Plus C质构仪,英国Stable Micro Systems公司;IMJ-54A高压灭菌锅,施都凯仪器设备(上海)有限公司;SHZ-B水浴恒温振荡器,上海蚁霖科学仪器有限公司;SCB-VF2A洁净工作台,西班泰克净化设备(苏州)有限公司;NR20XE精密色差仪,美国Hunter Lab公司;Spark 20M多功能酶标仪,瑞士Tecan公司。
1.3 实验方法
1.3.1 样品的制备
新鲜草鱼重约5公斤,20 min内活体运至实验室。用木棍击打头部致其昏迷后迅速宰杀,去鳞、去内脏、去头及两侧骨头,将鱼肉切成6 cm×3 cm×1.5 cm的鱼块,每块质量约25 g,实验共用鱼块225块,重约5 625 g。清水洗净后,沥干备用。以等离子体射流形式对鱼块进行CP处理,装置示意图如图1所示。以高纯氩气(99.999%)为工作气体,流速为10 L/min,输出电压为5 kV,输出频率为10 kHz。每个鱼块单独处理,处理时间为6 min。CP处理后,向鱼块添加4%(质量分数)的食用盐,均匀涂抹鱼肉表面并在4 ℃条件下腌制48 h,每隔12 h翻动1次。腌制结束后,将鱼肉进行热泵干燥(50 ℃、7 h),至鱼块水分含量降至45%~50%。鱼块经真空包装(真空时间为10 s,热封时间为2 s)后,分别置于4 ℃和25 ℃下贮藏。以未经CP处理,直接进行腌制的样品作为对照。
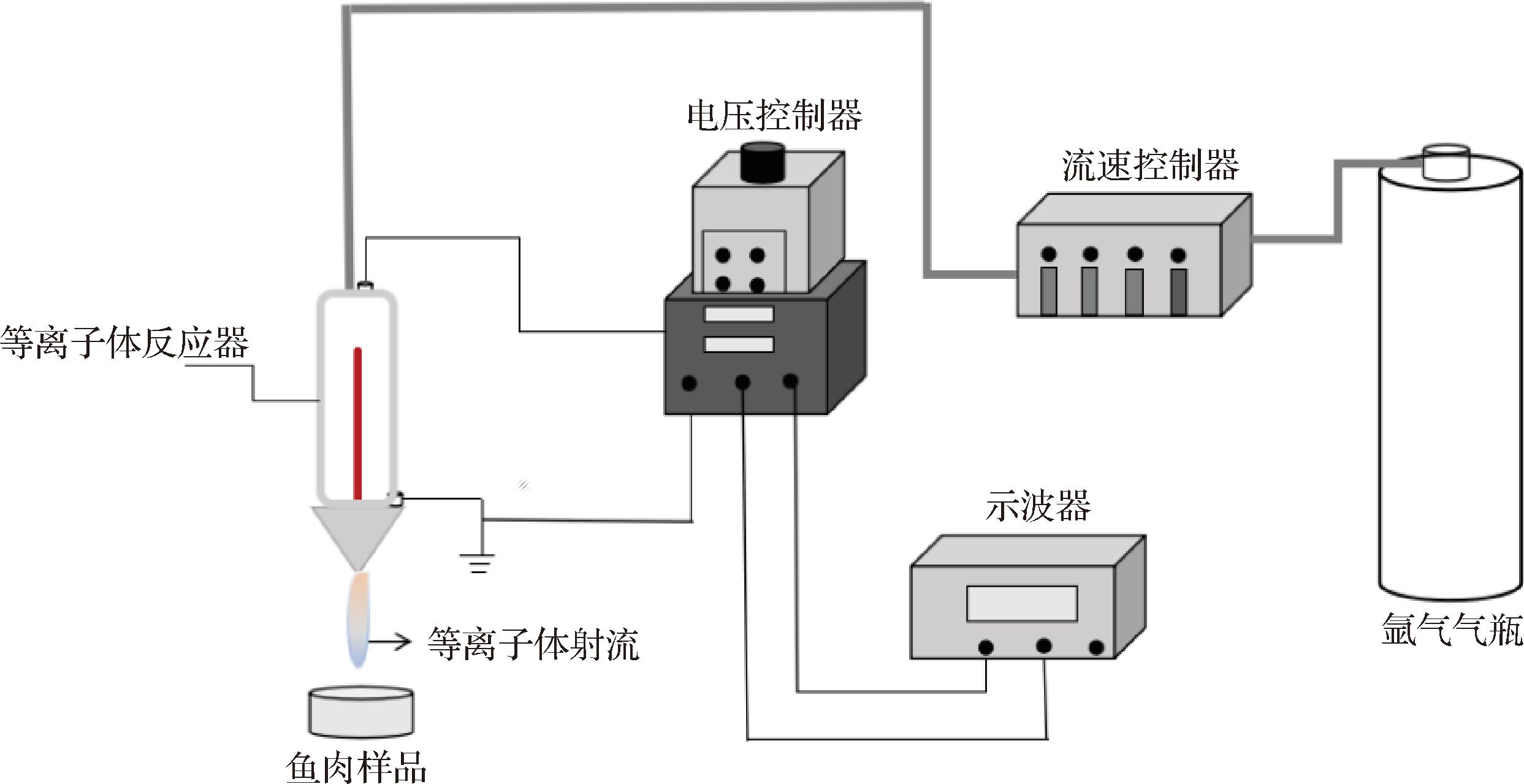
图1 冷等离子体设备原理图
Fig.1 The schematic diagram of the CP device
1.3.2 菌落总数测定
菌落总数测定参照国家标准GB 4789.2—2022《食品安全国家标准 食品微生物学检验 菌落总数测定》。取3块腌腊鱼(总质量约为75.0 g),经绞肉机绞碎处理后,称取5.0 g鱼肉,置于无菌均质袋中,加入45 mL 0.85%(质量分数)的无菌生理盐水,使用均质拍打器拍打3 min,充分混匀。取1 mL均质液,依次进行10倍梯度稀释,选择2~3个适宜稀释梯度的稀释液(100 μL),涂布于平板计数琼脂培养基中,于37 ℃培养72 h后进行菌落计数,每个样品重复测定3次。
1.3.3 挥发性盐基氮(total volatile base nitrogen,TVB-N)值的测定
称取1.3.2节绞碎混匀后鱼肉5.0 g于100 mL离心管中,加入40 mL蒸馏水,振摇,在室温下静置30 min。参考GB 5009.228—2016《食品安全国家标准 食品中挥发性盐基氮的测定》所述的凯氏定氮法测定样品的TVB-N。每组样品重复测定3次,取平均值。
1.3.4 质构的测定
从各组随机选取腌腊鱼样品,切割成1 cm×1 cm×1 cm的规格。采用TA.XT Plus C质构仪(探头型号P/36R)进行质构分析。测试参数如下:测试前速度2 mm/s,测试速度2 mm/s,测试后速度5 mm/s,测试间隔2 s,应变模式压缩比40%,触发力5 g,数据采集速率200 p/s,每组样品重复测定6次,取平均值。
1.3.5 色差的测定
使用精密色差仪测定鱼肉样品表面色差,进行颜色分析。每组样品重复测定3次,取平均值。
1.3.6 硫代巴比妥酸反应物(thiobarbituric acid reactive substances,TBARS)值的测定
称取1.3.2节绞碎混匀后鱼肉3.0 g,置于100 mL具塞试管中,加入50 mL三氯乙酸混合溶液(含0.46 mol/L三氯乙酸、3 mmol/L乙二胺四乙酸二钠),摇匀后密封。将试管置于50 ℃恒温振荡器中振荡30 min,取出冷却至室温,离心(10 000 r/min,4 ℃)10 min,取上清液待测。参照国家标准GB 5009.181—2016《食品安全国家标准 食品中丙二醛的测定》所述方法测定样品的TBARS值。每组样品重复测定3次,取平均值。
1.3.7 脂肪酸组成分析
总脂提取:参考FOLCH等[5]的方法并稍作修改。取45.0 g绞碎的鱼肉于500 mL容器中,加入450 mL V(氯仿)∶V(甲醇)=2∶1混合溶液,避光条件下磁力搅拌12 h。抽滤除去不溶性蛋白及结缔组织等杂质,加入40 mL生理盐水。静置分层后,弃去上层水-甲醇混合液,收集下层有机相,经无水硫酸钠过滤脱水,重复上述步骤2次。将脂质溶液转移至预先干燥恒重的旋蒸瓶中,于45 ℃水浴中真空旋蒸,旋蒸完成后于45 ℃水浴环境下氮吹5 min,得到浓缩脂质,并计算腌腊鱼总脂含量。
总脂肪酸测定:取100 mg提取的脂质,加入1 mL 0.5 mol/L氢氧化钠-甲醇溶液,80 ℃水浴振荡5 min,冷却至室温。随后加入1 mL三氟化硼-甲醇溶液(质量分数为14%),80 ℃水浴振荡2 min,自然冷却至室温。加入0.2 mL生理盐水,振荡10 s,再加入1 mL正己烷,振荡10 s。静置分层后,取上清液经无水Na2SO4干燥处理,随后通过0.22 μm有机微孔滤膜过滤,滤液用于GC-MS分析。分析条件为:氦气(99.999%)为载气,流速2 mL/min,用INNOWAX弹性毛细管柱(60 m×0.32 mm,0.5 μm)进行分离鉴定。程序升温条件:初始温度90 ℃,保留5 min,再以15 ℃/min升温至200 ℃,最后以1 ℃/min升温至240 ℃。进样口温度240 ℃,解析时间10 min。MS条件:电子电离源模式,在m/z 35~450的范围内扫描,间隔时间0.2 s。离子源温度250 ℃,传输线温度250 ℃。通过将获得的质谱图与标准库(Wiley 9 和NIST 2014)中的谱图进行匹配,并与脂肪酸甲酯混标标品进行比对分析,根据峰面积进行相对定量分析。
1.3.8 肌原纤维蛋白的提取
参照LI等[6]的方法并略作修改。称取1.3.2节绞碎混匀后鱼肉2.0 g,加入20 mL、4 ℃预冷的Tris-maleate缓冲液A(含0.05 mol/L NaCl、20 mmol/L Tris-Maleate,pH 7.0),在4 000 r/min条件下均质3 min,随后离心(10 000 r/min,4 ℃)10 min,弃上清液。向沉淀加入20 mL Tris-maleate缓冲液B(含0.6 mol/L NaCl、20 mmol/L Tris-Maleate,pH 7.0),再在4 000 r/min条件下均质3 min,然后在4 ℃下静置1 h,再经离心(10 000 r/min,4 ℃)10 min后取上清液,即肌原纤维蛋白溶液。采用双缩脲法测定溶液中肌原纤维蛋白浓度,并将其质量浓度稀释至2 mg/mL备用。
1.3.9 羰基含量的测定
参考岑南香等[7]的方法并稍作修改。取1 mL 2 mg/mL的肌原纤维蛋白溶液,加入1 mL 10 mmol/L的2,4-二硝基苯肼(2,4-dinitrophenylhydrazine,DNPH,溶于2 mol/L HCl),混匀后室温避光反应1 h。反应结束后,加入4 mL 20%三氯乙酸溶液,离心(10 000 r/min,4 ℃)15 min,弃上清液。用1 mL V(乙酸乙酯)∶V(乙醇)=1∶1混合溶液洗涤沉淀3次。将沉淀溶解于3 mL盐酸胍(6 mol/L)中,37 ℃下孵育15 min,使沉淀完全溶解。离心(10 000 r/min,4 ℃)15 min后,取上清液并测定其在370 nm处吸光度,依据公式(1)计算肌原纤维蛋白羰基含量。每组样品重复测定3次,取平均值。
羰基含量![]()
(1)
式中:A,370 nm波长处的吸光度;n,稀释倍数;ε,22 000 L/(mol·cm);ρ,肌原纤维蛋白质量浓度,mg/mL。
1.4 数据分析
使用SPSS 27.0统计软件对平均值和标准差进行统计分析,采用Duncan法检验多组数据间的差异显著性,P<0.05认为具有显著性差异,采用Origin 2021软件绘图。
2 结果与分析
2.1 贮藏过程中腌腊鱼菌落总数的变化
微生物增殖是导致腌腊鱼品质劣变的主要原因之一。根据国际食品微生物规格委员会规定,鱼肉的菌落总数可接受水平限量值为5.69 lg CFU/g,最高安全限量值为6.00 lg CFU/g[8]。因此,控制微生物增殖是延长腌腊鱼货架期的重要手段。由图2可知,在贮藏初期,对照组和处理组的初始菌落数分别为4.80 lg CFU/g和3.57 lg CFU/g,这表明CP前处理能有效杀灭鱼肉中的原有微生物,从而减小腌腊鱼的初始菌落数。处理组和对照组的菌落总数均随贮藏时间的延长而逐渐增加,但前者始终低于后者。在4 ℃条件下,贮藏10、20、30、40 d后,处理组菌落总数分别为4.04、5.09、5.47、5.57 lg CFU/g,而对照组则为5.17、5.61、5.89、6.15 lg CFU/g。在25 ℃条件下,样品菌落总数的变化趋势和4 ℃条件一致,但增长速度明显更快。贮藏20 d后,处理组的菌落总数为6.23 lg CFU/g,而对照组已达7.23 lg CFU/g,超过腐败变质的上限值。上述结果表明,CP前处理能显著减小腌腊鱼初始菌落数,抑制贮藏期间的微生物增殖,从而有效延缓了腌腊鱼的腐败变质。
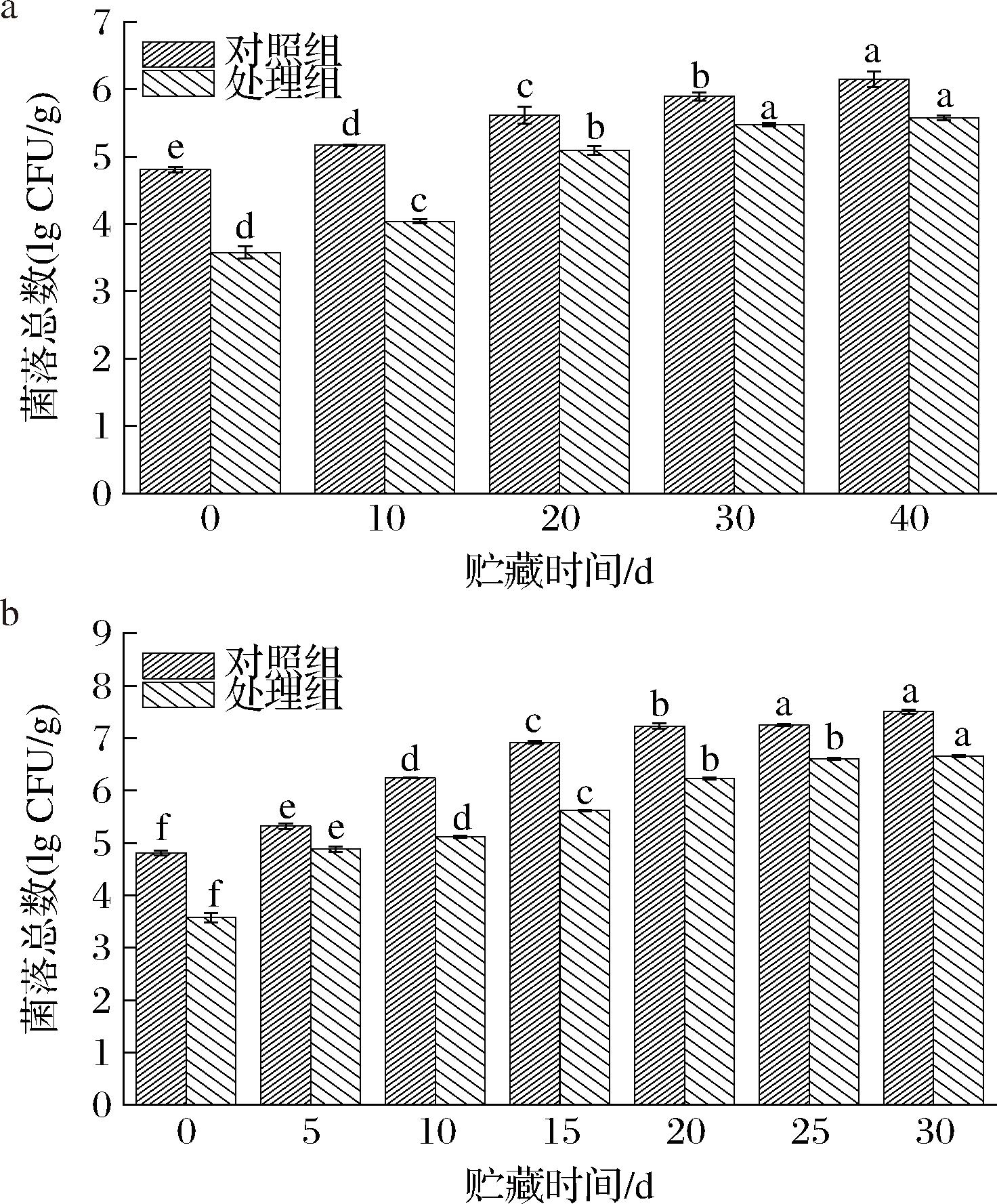
a-贮藏温度4 ℃;b-贮藏温度25 ℃
图2 腌腊草鱼贮藏期间菌落总数的变化
Fig.2 Changes of total bacterial count in dry-cured grass carp during storage
注:图中不同小写字母表示同一组样品在不同贮藏时间的差异显著性(P<0.05)(下同)。
2.2 贮藏过程中腌腊鱼TVB-N值的变化
TVB-N是蛋白质在微生物和酶作用下分解产生的碱性含氮物质的总称,被广泛用作评价水产品新鲜度。TVB-N值越高,表明腐败越严重。如图3所示,对照组与处理组的初始TVB-N值分别为16.94、14.47 mg/100 g。CP处理减小样品初始TVB-N值可能是由于冷等离子体产生的RNS与鱼肉中的水反应生成酸性含氮物质,进而与呈碱性的TVB-N反应所致[9]。在4 ℃条件下,贮藏10、20、30、40 d后,对照组的TVB-N值分别增加至23.03、24.43、28.11、32.65 mg/100 g,而处理组则增至21.12、22.10、23.47、27.20 mg/100 g。在25 ℃条件下,TVB-N值的变化趋势与4 ℃条件一致,均随贮藏时间延长而上升。贮藏20 d后,对照组的TVB-N值已达到31.10 mg/100 g,超过顾赛麒等[10]研究中提出的TVB-N值上限(25~30 mg/100 g),而处理组在第30天才达到31.08 mg/100 g。这一结果表明,CP处理能显著延缓腌腊鱼在贮藏期间TVB-N值的上升,有效延长腌腊鱼的货架期。

a-贮藏温度4 ℃;b-贮藏温度25 ℃
图3 腌腊草鱼贮藏期间TVB-N值的变化
Fig.3 Changes of TVB-N in dry-cured grass carp during storage
2.3 贮藏过程中腌腊鱼质构的变化
鱼肉的质构特性是评价其新鲜度和品质的重要指标,其中硬度、弹性、内聚性和咀嚼性是最关键的参数,直接影响消费者的感官判断。硬度作为反映鱼肉组织结构完整性的重要参数,能有效表征鱼肉的腐败变质程度。由表1可知,在贮藏初期(第0天),对照组和处理组的硬度分别为2 001.36 g和3 491.62 g,后者显著高于前者(P<0.05),这可能是由于CP处理促进了肌原纤维蛋白的交联,形成了更为致密的三维网络结构[11]。适度的硬度提升会赋予鱼肉更紧实的质地,增强咀嚼感[10]。随着贮藏时间的延长,对照组和处理组的硬度均呈现逐渐增加的趋势。然而,在25 ℃条件下,2组样品的硬度在贮藏后期均出现下降,这可能是由于高温加速了肉质腐败。在整个贮藏期间,处理组的硬度值都大于对照组,表明前者的咀嚼性优于后者。
表1 贮藏过程中腌腊草鱼的质构变化
Table 1 Changes in texture of dry-cured grass carp during storage
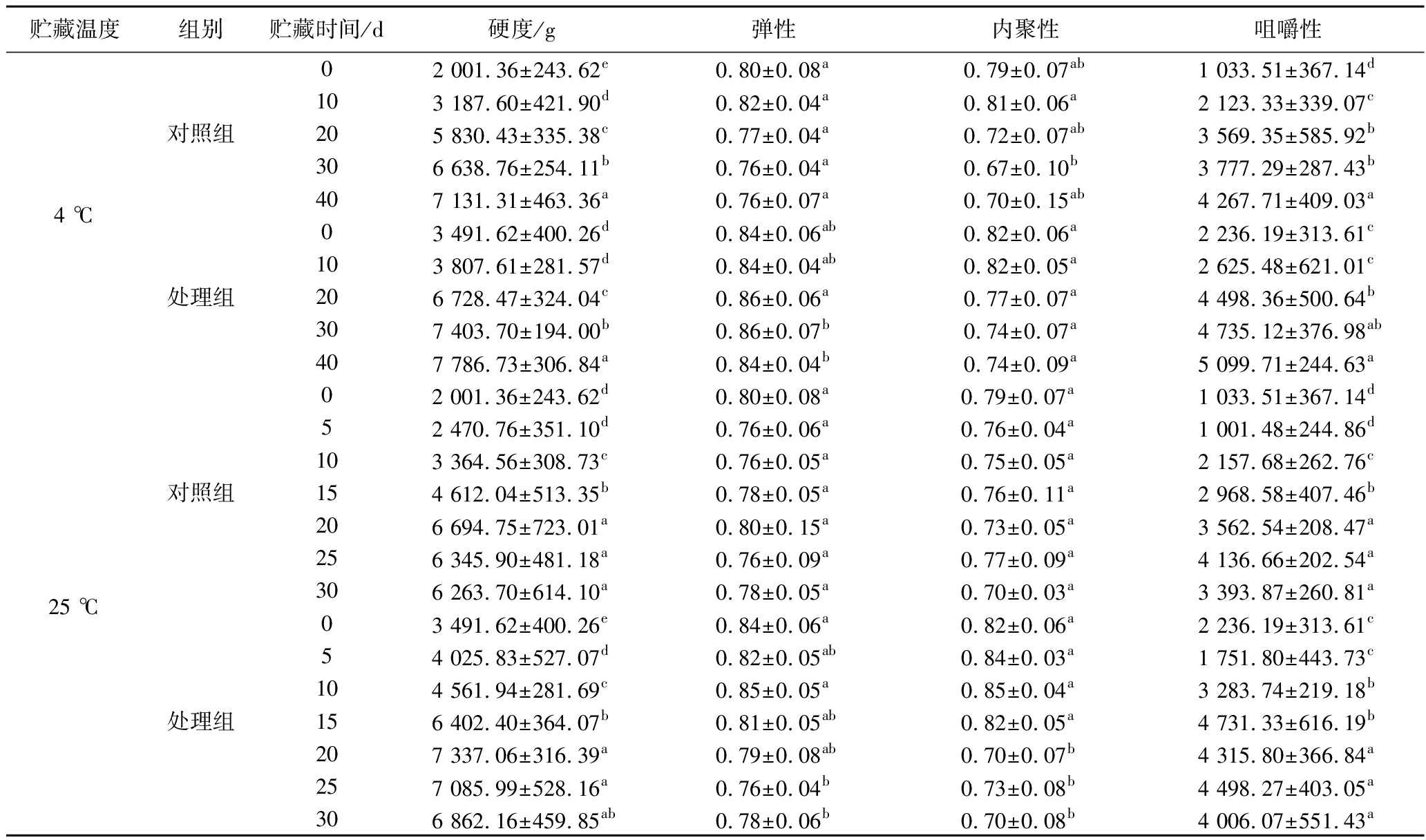
贮藏温度组别贮藏时间/d硬度/g弹性内聚性咀嚼性4 ℃对照组处理组02 001.36±243.62e0.80±0.08a0.79±0.07ab1 033.51±367.14d103 187.60±421.90d0.82±0.04a0.81±0.06a2 123.33±339.07c205 830.43±335.38c0.77±0.04a0.72±0.07ab3 569.35±585.92b306 638.76±254.11b0.76±0.04a0.67±0.10b3 777.29±287.43b407 131.31±463.36a0.76±0.07a0.70±0.15ab4 267.71±409.03a03 491.62±400.26d0.84±0.06ab0.82±0.06a2 236.19±313.61c103 807.61±281.57d0.84±0.04ab0.82±0.05a2 625.48±621.01c206 728.47±324.04c0.86±0.06a0.77±0.07a4 498.36±500.64b307 403.70±194.00b0.86±0.07b0.74±0.07a4 735.12±376.98ab407 786.73±306.84a0.84±0.04b0.74±0.09a5 099.71±244.63a25 ℃对照组处理组02 001.36±243.62d0.80±0.08a0.79±0.07a 1 033.51±367.14d52 470.76±351.10d0.76±0.06a0.76±0.04a1 001.48±244.86d103 364.56±308.73c0.76±0.05a0.75±0.05a2 157.68±262.76c154 612.04±513.35b0.78±0.05a0.76±0.11a2 968.58±407.46b206 694.75±723.01a0.80±0.15a0.73±0.05a3 562.54±208.47a256 345.90±481.18a0.76±0.09a0.77±0.09a4 136.66±202.54a306 263.70±614.10a0.78±0.05a0.70±0.03a3 393.87±260.81a03 491.62±400.26e0.84±0.06a0.82±0.06a2 236.19±313.61c54 025.83±527.07d0.82±0.05ab0.84±0.03a1 751.80±443.73c104 561.94±281.69c0.85±0.05a0.85±0.04a3 283.74±219.18b156 402.40±364.07b0.81±0.05ab0.82±0.05a4 731.33±616.19b207 337.06±316.39a0.79±0.08ab0.70±0.07b4 315.80±366.84a257 085.99±528.16a0.76±0.04b0.73±0.08b4 498.27±403.05a306 862.16±459.85ab0.78±0.06b0.70±0.08b4 006.07±551.43a
注:同行不同小写字母表示显著差异(P<0.05)(下同)。
弹性和内聚性也是评价鱼肉质构特性的重要参数,其中弹性反映了鱼肉受压后恢复原状的能力,内聚性则表征了其内部结构的紧密性[12]。在4 ℃条件下,对照组和处理组的弹性和内聚性均随贮藏时间延长而逐渐下降,但处理组却始终高于对照组。弹性和内聚性下降主要原因是贮藏过程中的蛋白质变性会使其组织结构韧性增加,蛋白质的凝胶性能降低[13],而CP处理可以通过抑制内源性蛋白酶活性在一定程度上延缓鱼肉的变质,从而使弹性和内聚性高于对照组[14]。
2.4 贮藏过程中腌腊鱼色泽的变化
色泽也是评价腌腊鱼品质的重要指标,通常通过L*(亮度)、a*(红绿值)和b*(黄蓝值)3个参数表征。由表2可知,贮藏初期,处理组的L*值、a*、b*值均高于对照组。这种差异可能由于CP处理会使腌腊鱼蛋白质结构改变,导致蛋白质内部的疏水基团暴露,疏水性增强,持水力下降,进而改变光的折射率所致[15]。随着贮藏时间延长,对照组和处理组的L*值均呈下降趋势。贮藏10、20、30、40 d后,对照组的L*值分别下降了5.17%、11.92%、13.44%、16.50%,而处理组分别下降了11.30%、12.64%、15.08%、20.52%。贮藏过程中,CP处理组鱼肉水分流失更大,造成鱼肉脱水收缩,L*值下降,同时CP处理也会促进脂质氧化,使鱼肉变黄,进一步导致色泽变暗[16],这可能是处理组L*值下降速度大于对照组的原因。尽管处理组的L*值下降幅度较大,但由于其初始亮度较高,贮藏后期仍能保持较好的色泽。在25 ℃贮藏条件下,L*值下降速度显著加快,这主要归因于高温加速了水分流失和蛋白质氧化,导致色泽劣化。这一结果与ALBERTOS等[17]的研究一致,其在常压等离子体延长鲱鱼的保质期实验中也观察到L*值随贮藏期的延长而降低的现象。
表2 腌腊草鱼在贮藏期间色泽的变化
Table 2 Changes in color of dry-cured grass carp during storage

贮藏温度组别贮藏时间/dL∗a∗b∗4 ℃对照组处理组042.18±0.92a3.05±2.27a6.08±1.56b1040.00±0.92ab3.30±0.25a6.12±0.63b2037.15±0.40b3.25±0.91a7.49±0.43ab3036.51±0.72bc2.35±1.61a8.11±1.63ab4035.22±0.34a2.04±0.87a9.09±0.23a045.41±1.93a3.72±0.12a7.31±0.15a1040.28±3.37a3.82±0.10a7.31±0.15a2039.67±0.80b2.40±0.24a9.76±2.77a3038.56±1.79b2.45±0.52a8.44±2.65a4036.09±1.66c2.37±2.01cd10.34±0.58a25 ℃对照组处理组042.18±0.92a3.05±2.27b6.08±1.56c540.67±0.72b3.31±0.35b7.59±0.07c1039.43±1.01c3.35±2.27b7.65±0.18c1538.55±0.11c3.30±1.28b10.54±1.72ab2038.43±0.88cd8.78±1.27a10.32±0.78ab2536.76±0.40de6.66±1.36a11.24±1.20b3036.29±0.88e6.99±0.08a13.40±0.13a045.41±1.93a3.72±0.12a7.31±0.15d541.65±0.25b3.74±0.46d9.21±2.31cd1040.06±0.51bc4.37±2.01cd10.41±0.20bc1539.70±0.38bc4.80±0.34cd10.48±1.64bc2038.95±0.74cd8.65±0.92a11.29±0.48abc2538.15±0.61d8.12±0.63ab12.08±2.17ab3038.00±0.39d5.85±1.20bc13.64±1.50a
除个别时间点外,处理组的a*值都略高于对照组。这主要可能是因为CP处理产生的RNS与水反应生成的硝酸和亚硝酸根能够氧化肌红蛋白形成高铁肌红蛋白,同时自身被还原为NO,NO与肌红蛋白结合生成形成稳定性较高的红色亚硝基肌红蛋白[18]。随贮藏时间的延长,对照组和处理组的a*值呈现先上升后下降的趋势。在贮藏初期,CP反应产生的NO可与肌红蛋白结合形成亚硝基肌红蛋白(nitrosomyoglobin,NOMb),从而赋予鱼肉红色。贮藏后期,肌红蛋白不断氧化导致高铁肌红蛋白的积累可能会使鱼肉颜色变暗[19]。处理组的b*值始终高于对照组,并随着贮藏时间的延长而逐渐增加。这可能是由于冷等离子体处理引起的脂质氧化所致,导致肉色泛黄,b*值升高[20]。
2.5 贮藏过程中腌腊鱼TBARS值的变化
脂质氧化是腌腊鱼在贮藏过程中发生的主要化学变化之一,通常通过TBARS值来评估。由图4可知,在贮藏初期,对照组和处理组TBARS值分别为1.07、1.89 mg/kg,处理组比对照组升高了0.81 mg/kg。这主要是由于CP处理过程中产生大量的ROS/RNS具有氧化性所致[21]。在4 ℃条件下,对照组和处理组的TBARS值均随贮藏时间延长而上升。贮藏10、20、30、40 d后,对照组的TBARS值分别增至1.10、1.95、2.24、4.07 mg/kg,而处理组则上升至2.16、2.85、2.75、4.46 mg/kg。在25 ℃条件下,脂质氧化速度显著加快。贮藏5、10、15、20、25、30 d后,对照组的TBARS值分别上升至1.32、1.49、1.93、2.11、2.16、3.83 mg/kg,而处理组则上升至2.25、2.61、3.18、3.96、4.28、5.88 mg/kg。上述结果表明,CP前处理在一定程度上加速了腌腊鱼在贮藏期间的脂质氧化。与4 ℃条件相比,25 ℃条件下处理组与对照组脂质氧化程度更显著,这可能是由于高温加速了冷等离子体产生的ROS/RNS诱导的鱼肉脂质氧化[22]。
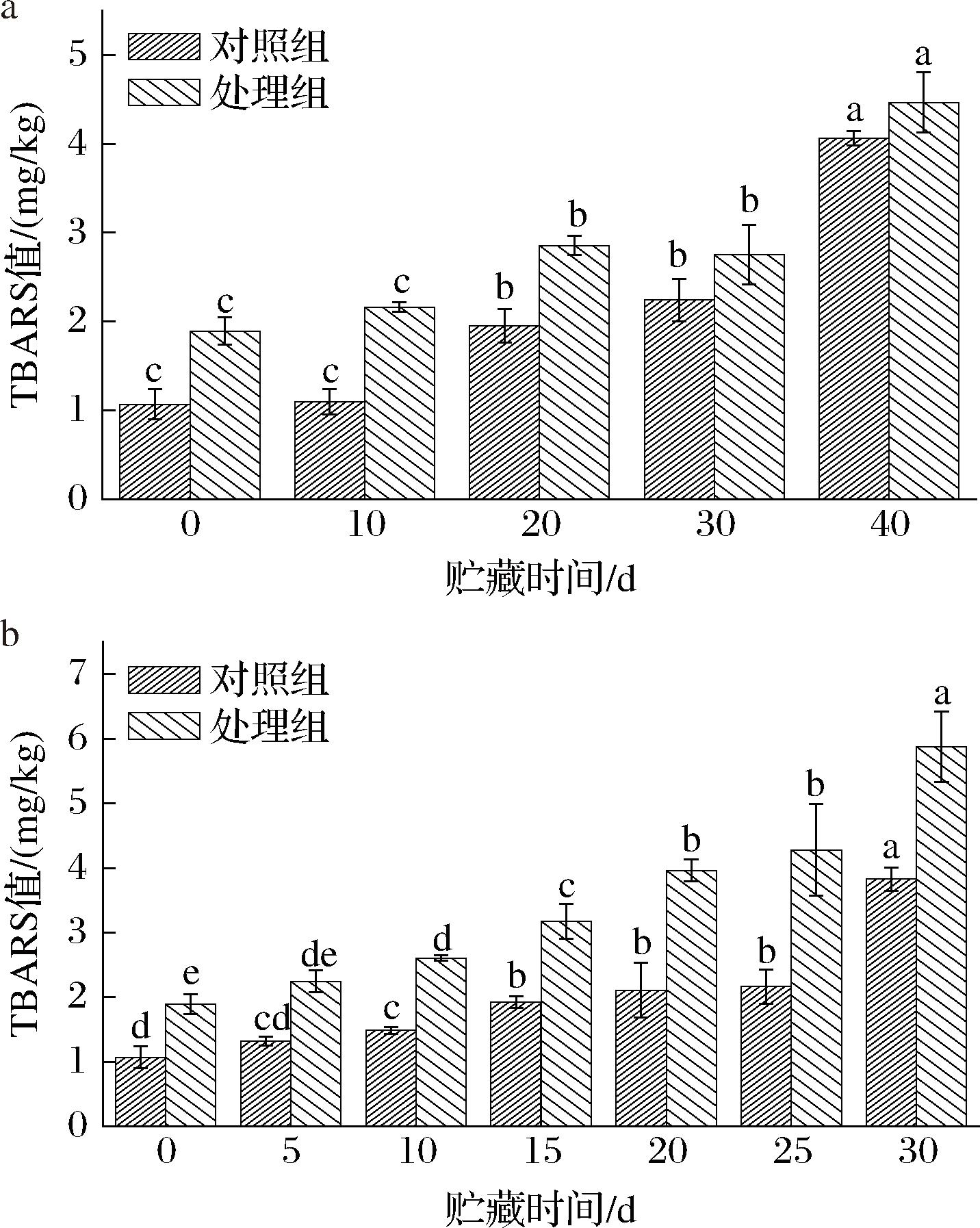
a-贮藏温度4 ℃;b-贮藏温度25 ℃
图4 腌腊草鱼贮藏期间TBARS值的变化
Fig.4 Changes of TBARS value in dry-cured grass carp during storage
2.6 贮藏过程中腌腊鱼脂肪酸相对含量的变化
为进一步探究CP处理对腌腊鱼脂质氧化的影响,对贮藏期腌腊鱼的总脂肪酸组成及相对含量进行了分析,结果如表3和表4所示。总脂的含量经重量法测得,贮藏初期对照组和处理组的总脂含量分别为11.87 g/100 g干基和11.70 g/100 g干基,在4 ℃贮藏20 d后,对照组和处理组的总脂含量分别为11.58 g/100 g干基和11.41 g/100 g干基,在25 ℃贮藏10 d后,对照组和处理组的总脂含量分别为11.60、11.40 g/100 g干基,整个贮藏期间总脂含量变化不大。贮藏期间腌腊鱼中共测得15种脂肪酸,包括6种饱和脂肪酸(saturated fatty acid,SFA)、3种单不饱和脂肪酸(monounsaturated fatty acid,MUFA)和6种多不饱和脂肪酸(polyunsaturated fatty acids,PUFA),其相对含量顺序为MUFA>PUFA>SFA。其中,棕榈酸(C16:0)、油酸(C18:1n9)和亚油酸(C18:2n6)分别是含量最高的SFA、MUFA和PUFA,这与ZHANG等[23]在干腌草鱼中测得的结果组成一致。在整个贮藏阶段,脂肪酸的种类未发生变化,但SFA、MUFA和PUFA的相对含量比例发生了变化。在初始阶段(第0天),对照组中SFA、MUFA和PUFA的相对含量分别为20.77%、42.43%、35.80%,而处理组分别为22.53%、42.18%、35.29%。这表明CP处理的确促使了腌腊鱼中的MUFA和PUFA氧化。SFA相对含量增加是由于MUFA和PUFA中双键的饱和化和裂解反应,从而生成饱和脂肪酸或短链脂肪酸[24]。
表3 4 ℃贮藏过程中腌腊草鱼脂肪酸相对含量变化
Table 3 Changes in relative content of fatty acids in dry-cured grass carp during storage at 4 ℃

贮藏温度组别脂肪酸种类4℃贮藏过程中脂肪酸相对含量/(%)0 d10 d20 d30 d40 d4 ℃对照组处理组C14:01.22±0.07b1.25±0.04a1.05±0.05c1.17±0.05ab1.08±0.03bcC15:00.18±0.01b0.33±0.02a0.33±0.02a0.31±0.01a0.32±0.04aC16:014.77±0.25d15.66±0.90b17.88±0.29a17.36±0.19a17.73±0.28aC17:00.16±0.02c0.31±0.03a0.30±0.02a0.27±0.03a0.31±0.02aC18:04.17±0.13bc4.75±0.36a3.76±0.12b4.38±0.19a4.24±0.52abC20:00.26±0.03bc0.44±0.14a0.43±0.01a0.33±0.02ab0.31±0.05ab∑SFA20.77±0.07c22.75±0.34b23.75±0.38a23.82±0.10a23.99±0.50aC16:1n76.34±0.07a5.61±0.07b3.58±0.82d5.17±0.13bc4.70±0.13cC18:1n9c35.87±0.38c35.49±0.36c37.80±0.70ab37.43±0.33b38.39±0.41aC20:11.22±0.03c1.77±0.31a1.40±0.16b1.46±0.06b1.48±0.06ab∑MUFA42.43±0.34a42.87±0.35b42.77±0.47c44.06±0.26d44.58±0.42eC18:2n6c23.21±0.11a21.42±0.31c22.53±0.18b20.68±0.07d20.04±0.26eC18:3n32.35±0.04b2.15±0.16b1.85±0.07c1.96±0.08c2.00±0.10bcC20:21.69±0.07ab1.70±0.22a1.32±0.09b1.40±0.13b1.46±0.18abC18:3n62.05±0.06bc1.86±0.22ab2.38±0.49b1.65±0.10b1.65±0.04bC20:4n63.26±0.11bc4.02±0.34b2.90±0.25a3.82±0.18b3.22±0.10bC22:6n33.24±0.40a3.22±0.18a2.49±0.37b2.61±0.27a3.06±0.20b∑PUFA35.80±0.36a34.38±0.29b33.48±0.42c32.11±0.15bc31.43±0.20abC14:01.33±0.01a1.19±0.03c1.02±0.04b1.25±0.03b1.01±0.04dC15:00.22±0.01d0.37±0.04a0.30±0.01b0.28±0.02b0.31±0.03bC16:015.80±0.22d16.27±0.06d17.63±0.27c18.26±0.31b19.75±0.24aC17:00.21±0.01c0.32±0.04a0.31±0.01a0.25±0.02b0.32±0.03aC18:04.60±0.10a4.10±0.40a4.45±0.08a4.00±0.09b4.00±0.23bC20:00.36±0.02ab0.39±0.04a0.31±0.03bc0.30±0.06bc0.27±0.06c∑SFA22.53±0.11e23.05±0.46c24.03±0.43b24.36±0.32b25.66±0.10aC16:1n76.51±0.05a5.41±0.07c4.98±0.08d5.67±0.15b4.90±0.07dC18:1n9c34.00±0.33b37.21±0.93a37.34±0.94a36.73±0.27a36.98±0.18aC20:11.68±0.08a1.61±0.12ab1.39±0.05bc1.37±0.15bc1.31±0.22c∑MUFA42.18±046e44.22±0.56a43.71±0.70de43.78±0.29ab43.20±0.31bcC18:2n6c20.74±0.07a20.47±0.46ab20.17±0.21ab20.43±0.25b19.38±0.47cC18:3n32.40±0.06a2.61±0.37a1.77±0.08b1.73±0.06b2.32±0.47bC20:21.89±0.05a1.56±0.09a1.60±0.14a1.69±0.30a1.75±0.12aC18:3n62.27±0.06a1.91±0.12a1.98±0.14a1.97±0.27a2.16±0.62aC20:4n64.54±0.11a3.62±0.33a3.61±0.14a3.46±0.09a3.44±1.05aC22:6n33.46±0.44a2.55±0.22cd4.14±0.32a2.91±0.10bc2.09±0.74d∑PUFA35.29±0.42a32.72±0.56bc33.27±0.69b31.86±0.60cd31.14±0.35d
表4 25 ℃贮藏过程中腌腊鱼脂肪酸相对含量变化
Table 4 Changes in relative content of fatty acids in dry-cured grass carp during storage at 25 ℃
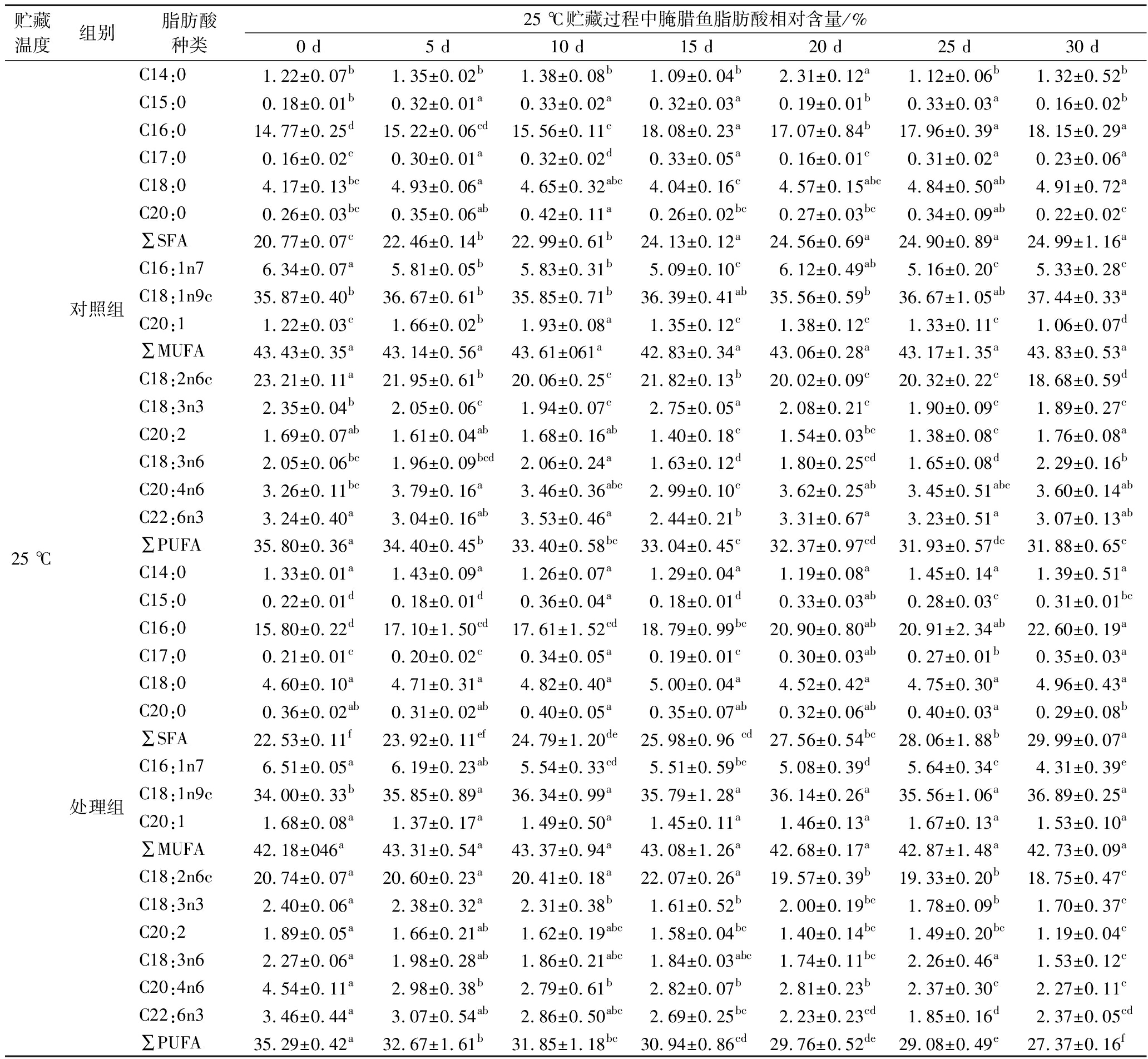
贮藏温度组别脂肪酸种类25 ℃贮藏过程中腌腊鱼脂肪酸相对含量/%0 d5 d10 d15 d20 d25 d30 d25 ℃对照组处理组C14:01.22±0.07b1.35±0.02b1.38±0.08b1.09±0.04b2.31±0.12a1.12±0.06b1.32±0.52bC15:00.18±0.01b0.32±0.01a0.33±0.02a0.32±0.03a0.19±0.01b0.33±0.03a0.16±0.02bC16:014.77±0.25d15.22±0.06cd15.56±0.11c18.08±0.23a17.07±0.84b17.96±0.39a18.15±0.29aC17:00.16±0.02c0.30±0.01a0.32±0.02d0.33±0.05a0.16±0.01c0.31±0.02a0.23±0.06aC18:04.17±0.13bc4.93±0.06a4.65±0.32abc4.04±0.16c4.57±0.15abc4.84±0.50ab4.91±0.72aC20:00.26±0.03bc0.35±0.06ab0.42±0.11a0.26±0.02bc0.27±0.03bc0.34±0.09ab0.22±0.02c∑SFA20.77±0.07c22.46±0.14b22.99±0.61b24.13±0.12a24.56±0.69a24.90±0.89a24.99±1.16aC16:1n76.34±0.07a5.81±0.05b5.83±0.31b5.09±0.10c6.12±0.49ab5.16±0.20c5.33±0.28cC18:1n9c35.87±0.40b36.67±0.61b35.85±0.71b36.39±0.41ab35.56±0.59b36.67±1.05ab37.44±0.33aC20:11.22±0.03c1.66±0.02b1.93±0.08a1.35±0.12c1.38±0.12c1.33±0.11c1.06±0.07d∑MUFA43.43±0.35a43.14±0.56a43.61±061a42.83±0.34a43.06±0.28a43.17±1.35a43.83±0.53aC18:2n6c23.21±0.11a21.95±0.61b20.06±0.25c21.82±0.13b20.02±0.09c20.32±0.22c18.68±0.59dC18:3n32.35±0.04b2.05±0.06c1.94±0.07c2.75±0.05a2.08±0.21c1.90±0.09c1.89±0.27cC20:21.69±0.07ab1.61±0.04ab1.68±0.16ab1.40±0.18c1.54±0.03bc1.38±0.08c1.76±0.08aC18:3n62.05±0.06bc1.96±0.09bcd2.06±0.24a1.63±0.12d1.80±0.25cd1.65±0.08d2.29±0.16bC20:4n63.26±0.11bc3.79±0.16a3.46±0.36abc2.99±0.10c3.62±0.25ab3.45±0.51abc3.60±0.14abC22:6n33.24±0.40a3.04±0.16ab3.53±0.46a2.44±0.21b3.31±0.67a3.23±0.51a3.07±0.13ab∑PUFA35.80±0.36a34.40±0.45b33.40±0.58bc33.04±0.45c32.37±0.97cd31.93±0.57de31.88±0.65eC14:01.33±0.01a1.43±0.09a1.26±0.07a1.29±0.04a1.19±0.08a1.45±0.14a1.39±0.51aC15:00.22±0.01d0.18±0.01d0.36±0.04a0.18±0.01d0.33±0.03ab0.28±0.03c0.31±0.01bcC16:015.80±0.22d17.10±1.50cd17.61±1.52cd18.79±0.99bc20.90±0.80ab20.91±2.34ab22.60±0.19aC17:00.21±0.01c0.20±0.02c0.34±0.05a0.19±0.01c0.30±0.03ab0.27±0.01b0.35±0.03aC18:04.60±0.10a4.71±0.31a4.82±0.40a5.00±0.04a4.52±0.42a4.75±0.30a4.96±0.43aC20:00.36±0.02ab0.31±0.02ab0.40±0.05a0.35±0.07ab0.32±0.06ab0.40±0.03a0.29±0.08b∑SFA22.53±0.11f23.92±0.11ef24.79±1.20de25.98±0.96 cd27.56±0.54bc28.06±1.88b29.99±0.07aC16:1n76.51±0.05a6.19±0.23ab5.54±0.33cd5.51±0.59bc5.08±0.39d5.64±0.34c4.31±0.39eC18:1n9c34.00±0.33b35.85±0.89a36.34±0.99a35.79±1.28a36.14±0.26a35.56±1.06a36.89±0.25aC20:11.68±0.08a1.37±0.17a1.49±0.50a1.45±0.11a1.46±0.13a1.67±0.13a1.53±0.10a∑MUFA42.18±046a43.31±0.54a43.37±0.94a43.08±1.26a42.68±0.17a42.87±1.48a42.73±0.09aC18:2n6c20.74±0.07a20.60±0.23a20.41±0.18a22.07±0.26a19.57±0.39b19.33±0.20b18.75±0.47cC18:3n32.40±0.06a2.38±0.32a2.31±0.38b1.61±0.52b2.00±0.19bc1.78±0.09b1.70±0.37cC20:21.89±0.05a1.66±0.21ab1.62±0.19abc1.58±0.04bc1.40±0.14bc1.49±0.20bc1.19±0.04cC18:3n62.27±0.06a1.98±0.28ab1.86±0.21abc1.84±0.03abc1.74±0.11bc2.26±0.46a1.53±0.12cC20:4n64.54±0.11a2.98±0.38b2.79±0.61b2.82±0.07b2.81±0.23b2.37±0.30c2.27±0.11cC22:6n33.46±0.44a3.07±0.54ab2.86±0.50abc2.69±0.25bc2.23±0.23cd1.85±0.16d2.37±0.05cd∑PUFA35.29±0.42a32.67±1.61b31.85±1.18bc30.94±0.86cd29.76±0.52de29.08±0.49e27.37±0.16f
注:同行字母不同表示差异显著(P<0.05)。
在4 ℃条件下,随着贮藏时间的延长,SFA相对含量增加,而MUFA与PUFA的相对含量逐渐降低。贮藏10、20、30、40 d后,对照组中SFA的相对含量增至22.75%、23.75%、23.82%、23.99%,而处理组分别增至23.05%、24.03%、24.36%、25.66%。同时,PUFA相对含量随着贮藏时间的延长而下降,对照组从35.80%分别降至34.38%、33.48%、32.11%和31.43%,而处理组从35.29%分别降至32.72%、33.27%、31.86%和31.14%。这些结果进一步证实了CP前处理诱导了腌腊鱼MUFA和PUFA的氧化,尤其是后者。在25 ℃贮藏条件下,SFA、MUFA和PUFA的变化趋势与4 ℃条件一致,但MUFA和PUFA的氧化速度显著加快。贮藏30 d后,处理组中SFA、MUFA和PUFA的相对含量分别为29.90%、42.73%和27.37%,而对照组分别为24.99%、43.83%和31.88%。
2.7 贮藏过程中腌腊鱼羰基含量的变化
羰基含量常被用于评价蛋白质的氧化程度,其主要通过α-酰胺化和β-断裂以及脯氨酸、精氨酸、赖氨酸和苏氨酸等氨基酸侧链的直接或间接氧化形成。如图5所示,在贮藏初期(第0天),对照组和处理组羰基含量分别为0.77、1.06 nmol/mg,处理组明显高于对照组。这一现象表明CP处理促进了蛋白质氧化,可能与CP处理过程中产生的ROS和RNS有关[25]。在4 ℃ 条件下,对照组和处理组的羰基含量均随贮藏时间延长而显著增加。贮藏10、20、30、40 d后,对照组羰基含量分别增至1.16、1.33、1.90、2.80 nmol/mg,而处理组则增至1.38、1.48、2.16、3.02 nmol/mg(P<0.05)。在25 ℃条件下,对照组和处理组的羰基含量同样呈现显著上升趋势。贮藏5、10、15、20、25、30 d后,对照组的羰基含量分别增加至1.97、2.08、2.23、3.12、3.40、4.10 nmol/mg,而处理组的羰基含量分别增加至2.46、2.56、2.87、3.17、4.14、4.73 nmol/mg(P<0.05)。

a-贮藏温度4 ℃;b-贮藏温度25 ℃
图5 腌腊草鱼贮藏期间羰基含量的变化
Fig.5 Changes of carbonyl content in dry-cured grass carp during storage
2.8 腌腊鱼贮藏过程中品质指标的相关性分析
对2种贮藏温度下样品菌落总数、TVB-N值、TBARS值、脂肪酸组成、羰基含量、质构、色泽等关键指标进行了相关性分析,结果如图6所示。在4 ℃条件下,处理组中菌落总数与TVB-N值、SFA、硬度、咀嚼性均呈显著正相关(P<0.05)(图6-b),与内聚性、L*值和a*值呈显著负相关(P<0.05);TVB-N值与L*值、SFA、羰基含量呈显著正相关,与PUFA呈显著负相关(P<0.05);TBARS值与SFA、羰基含量及菌落总数呈显著正相关(P<0.05);SFA则与羰基含量、硬度、b*值和咀嚼性呈显著正相关;PUFA与L*值呈极显著正相关(P<0.05);硬度与咀嚼性呈极显著正相关,与内聚性和a*值呈显著负相关(P<0.05)。由此可知,处理组中TVB-N值与菌落总数关联性最强,主要因为贮藏过程中鱼肉中菌落数的增加,会促进蛋白质的降解,进而引起鱼肉TVB-N值的增加。而脂肪氧化和蛋白氧化与腌腊鱼的色泽和质构有极大关系,其中脂肪氧化会促进腌腊鱼亮度、a*值和b*值的提升,而蛋白氧化会通过交联作用促进鱼肉硬度增加,进而增强咀嚼性。对照组与处理组的相关性结果基本一致。25 ℃条件下的相关性热图分析与4 ℃条件基本一致,但是各组之间相关性分析更强,说明贮藏温度对腌腊鱼各品质指标有较大影响,这主要因为高温加速了各化学反应速率。总之,贮藏期间各品质指标都与CP处理和贮藏温度紧密相关。
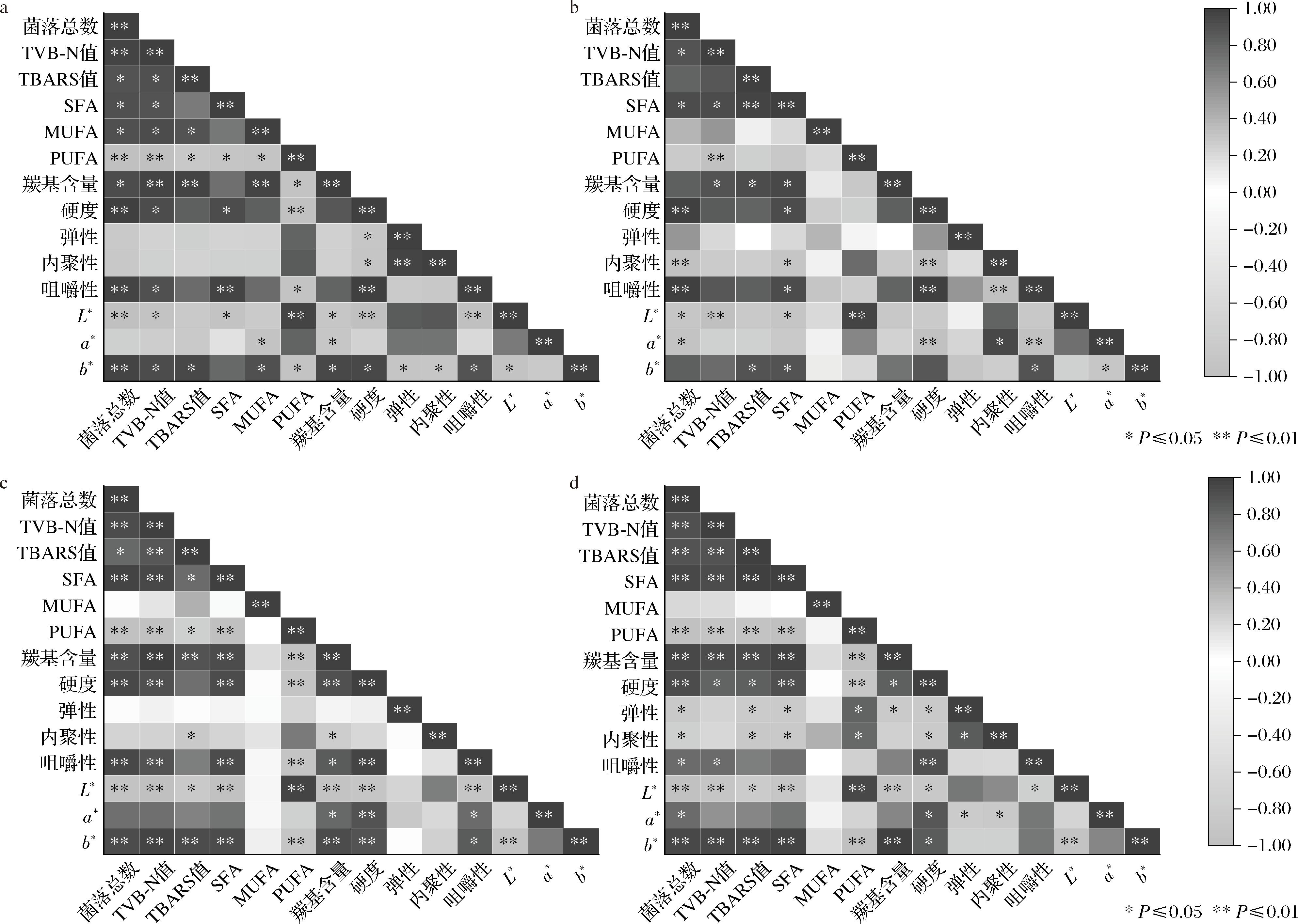
a-4 ℃对照组;b-4 ℃处理组;c-25 ℃对照组;d-25 ℃处理组
图6 不同贮藏条件下腌腊草鱼品质指标间的相关性分析热图
Fig.6 Heat map analysis of quality indices in dry-cured grass carp under different storage conditions
注:*,差异显著(P<0.05);**,差异极显著(P<0.01)。
3 结论与讨论
本研究通过将未经CP前处理(对照组)和经CP前处理(处理组)的腌腊鱼真空密封后分别置于4 ℃和25 ℃条件下贮藏40 d和30 d,通过对比研究2组样品在贮藏期间微生物、质构、色泽、脂质氧化及蛋白质氧化等指标的差异,探索CP前处理在腌腊鱼加工中的可能应用。结果表明,与对照组相比,CP处理显著抑制了微生物的生长。在4 ℃贮藏条件下,处理组在30 d内的菌落总数和TVB-N值均保持在可接受范围内,表明CP前处理有效延缓了腌腊鱼的品质劣化。此外,CP前处理能显著提高了鱼肉的亮度,同时维持了良好的硬度和弹性,从而保持了鱼肉的贮藏稳定性。此外,通过对不同贮藏温度下腌腊鱼各品质指标之间的相关性分析可知,贮藏期间各品质指标之间呈显著相关。与4 ℃相比,25 ℃条件下贮藏的腌腊鱼感官品质下降更快,脂质和蛋白质氧化加剧,微生物增殖速度加快。特别是在贮藏后期,样品出现了硬度下降和酸败的现象。综上所述,CP前处理可作为一种腌腊鱼腌制前的处理方法,能在一定程度上延长腌腊鱼的货架期并维持其品质。该结果为CP在水产品和其他肌肉类食品腌制加工中的应用提供了理论依据和实践指导。
[1] VAN NGUYEN M, THORARINSDOTTIR K A, GUDMUNDSDOTTIR A, et al.The effects of salt concentration on conformational changes in cod (Gadus morhua) proteins during brine salting[J].Food Chemistry, 2011, 125(3):1013-1019.
[2] KE Z G, BAI Y, BAI Y W, et al.Cold plasma treated air improves the characteristic flavor of dry-cured black carp through facilitating lipid oxidation[J].Food Chemistry, 2022, 377:131932.
[3] SHEN Z W, LUAN A N, YI S X, et al.Moderate protein degradation and lipid oxidation induced by cold plasma and its effect on the quality of dried fish products[J].Journal of Food Composition and Analysis, 2023, 123:105636.
[4] ZHAI Y Y, LUAN A N, YANG Z M, et al.The impacts of cold plasma on the taste and odor formation of dried silver carp products[J].Food Chemistry, 2024, 454:139775.
[5] FOLCH J, LEES M, STANLEY G H S.A simple method for the isolation and purification of total lipides from animal tissues[J].Journal of Agricultural and Food Chemistry, 1957, 226(1):497-509.
[6] LI P Y, MEI J, XIE J.Chitosan-sodium alginate bioactive coatings containing ε-polylysine combined with high CO2 modified atmosphere packaging inhibit myofibril oxidation and degradation of farmed pufferfish (Takifugu obscurus) during cold storage[J].LWT, 2021, 140:110652.
[7] 岑南香, 刘宸成, 陈姑, 等.低温等离子体处理对羊肉脂质与蛋白质氧化性质的影响[J].食品工业科技, 2022, 43(14):85-93.CEN N X, LIU C C, CHEN G, et al.Effects of cold plasma treatments on lipids and protein oxidation properties of mutton[J].Science and Technology of Food Industry, 2022, 43(14):85-93.
[8] 国际食品微生物标准委员会. 微生物检验与食品安全控制[M].北京:中国轻工业出版社, 2012.International Committee on Microbiological Standards in Food.Microorganisms in Foods and Microbial Testing in Food Safety Management[M].Beijing:China Light Industry Press, 2012.
[9] IKAWA S, KITANO K, HAMAGUCHI S.Effects of pH on bacterial inactivation in aqueous solutions due to low-temperature atmospheric pressure plasma application[J].Plasma Processes and Polymers, 2010, 7(1):33-42.
[10] 顾赛麒, 唐锦晶, 周绪霞, 等.腌腊鱼传统日晒干制过程中品质变化与香气形成[J].食品科学, 2019, 40(17):36-44.GU S Q, TANG J J, ZHOU X X, et al.Quality change and aroma formation in cured fish during traditional sun drying processing[J].Food Science, 2019, 40(17):36-44.
[11] MIAO W H, NYAISABA B M, KODDY J K, et al.Effect of cold atmospheric plasma on the physicochemical and functional properties of myofibrillar protein from Alaska pollock (Theragra chalcogramma)[J].International Journal of Food Science and Technology, 2020, 55(2):517-525.
[12] 张婷, 吴燕燕, 李来好, 等.咸鱼品质的质构与感官相关性分析[J].水产学报, 2013, 37(2):303-310.ZHANG T, WU Y Y, LI L H, et al.Correlation analysis of sensory with instrumental texture measurement of salted fish[J].Journal of Fisheries of China, 2013, 37(2):303-310.
[13] 朱士臣, 储雨姗, 柯志刚, 等.腌腊鱼贮藏过程品质变化及其多维度控制技术研究进展[J].食品与发酵工业, 2020, 46(10):284-289.ZHU S C, CHU Y S, KE Z G, et al.Advances in quality change and multi-dimensional control technology of salt-cured fish during storage[J].Food and Fermentation Industries, 2020, 46(10):284-289.
[14] XU H Q, MIAO W H, ZHENG B, et al.Assessment of the effect of cold atmospheric plasma (CAP) on the hairtail (Trichiurus lepturus) quality under cold storage conditions[J].Foods, 2022, 11(22):3683.
[15] 邱月, 王旭骅, 谢雪华, 等.低温等离子体杀菌对肉品食用品质的影响规律与机制研究进展[J].食品与发酵工业, 2024, 50(6):332-340.QIU Y, WANG X H, XIE X H, et al.Overview on changes and mechanism of low-temperature plasma sterilization on edible quality of meat products[J].Food and Fermentation Industries, 2024, 50(6):332-340.
[16] 章建浩, 乔维维, 黄明明, 等.低温等离子体处理对牛肉品质的影响[J].现代食品科技, 2018, 34(11):194-199;150.ZHANG J H, QIAO W W, HUANG M M, et al.Effects of cold plasma treatment on quality of beef[J].Modern Food Science and Technology, 2018, 34(11):194-199;150.
[17] ALBERTOS I, MARTIN-DIANA A B, CULLEN P J, et al.Shelf-life extension of herring (Clupea harengus) using in-package atmospheric plasma technology[J].Innovative Food Science &Emerging Technologies, 2019, 53:85-91.
[18] HERIANTO S, HOU C Y, LIN C M, et al.Nonthermal plasma-activated water:A comprehensive review of this new tool for enhanced food safety and quality[J].Comprehensive Reviews in Food Science and Food Safety, 2021, 20(1):583-626.
[19] 黄卉, 孙申宇, 魏涯, 等.红色肉贮藏期间肌红蛋白与肉色变化研究进展[J].南方水产科学, 2020, 16(3):119-124.HUANG H, SUN S Y, WEI Y, et al.Research progress on color transformation of red meat during storage[J].South China Fisheries Science, 2020, 16(3):119-124.
[20] 王兆明, 贺稚非, 李洪军.脂质和蛋白质氧化对肉品品质影响及交互氧化机制研究进展[J].食品科学, 2018, 39(11):295-301.WANG Z M, HE Z F, LI H J.A review of the effect of lipid and protein oxidation on meat quality and their interrelationship[J].Food Science, 2018, 39(11):295-301.
[21] 王艺月, 姜竹茂, 钱婧, 等.等离子体处理对生鲜鱼肉杀菌效能及贮藏品质的影响[J].食品与发酵工业, 2022, 48(8):166-172. WANG Y Y, JIANG Z M, QIAN J, et al.Effect of cold plasma on microbial decontamination and storage quality of fish fillets[J].Food and Fermentation Industries, 2022, 48(8):166-172.
[22] SUENAGA Y, TAKAMATSU T, AIZAWA T, et al.Influence of controlling plasma gas species and temperature on reactive species and bactericidal effect of the plasma[J].Applied Sciences, 2021, 11(24):11674.
[23] ZHANG J J, XU D L, ZHAO X H, et al.Effect of Zanthoxylum bungeanum maxim on the lipid oxidation and fatty acid composition of dry-cured fish during processing[J].Journal of Food Processing and Preservation, 2017, 41(3):e12894.
[24] PÉREZ-ANDRÉS J M, DE ALBA M, HARRISON S M, et al.Effects of cold atmospheric plasma on mackerel lipid and protein oxidation during storage[J].LWT, 2020, 118:108697.
[25] 陈姑, 姜竹茂, 位正鹏, 等.低温等离子体处理加速罗非鱼肌原纤维蛋白的氧化及结构改变[J].食品工业科技, 2023, 44(4):88-95.CHEN G, JIANG Z M, WEI Z P, et al.Cold plasma treatment accelerated the oxidation and structural changes of myofibrillar in tilapia[J].Science and Technology of Food Industry, 2023, 44(4):88-95.