随着人们生活水平的提高和健康意识的增强,功能性食品因其具有调节人体生理功能、预防疾病等功效而受到广泛关注[1]。作为功能性食品的重要成分,食源性低聚肽由于其分子质量小,易吸收,具有很强的生物活性,在近几年的研究中成为热点[2]。低聚肽是由2~10个氨基酸组成的短肽,分子质量小于1 000 Da,具有比蛋白质更易消化吸收、比游离氨基酸更能高效利用的优势[3],在营养补充、疾病预防和康复等方面展现出巨大潜力[4-6]。
在功能性食品开发中,新型蛋白源的筛选及其高值化利用是关键研究方向之一。畜禽副产物因其来源广泛、营养价值高而备受关注,其中麻黄鸡作为我国优良的地方特色鸡种,具有重要的开发价值[7]。麻黄鸡属于黄羽肉鸡,主要集中在广东、广西等地区,肉质鲜美,皮薄骨细,营养价值丰富,供港黄鸡深受消费者青睐。近年来,关于麻黄鸡的研究主要集中在遗传选育、养殖调控和食用品质等方面,而对其蛋白质资源,尤其是低聚肽的开发利用研究相对较少。研究表明,鸡肉蛋白酶解后可产生具有抗氧化、抗疲劳、增强免疫等多种生物活性的低聚肽,具有较高的开发价值[8-9]。然而,目前关于麻黄鸡低聚肽的研究仍处于起步阶段,其消化吸收特性及体内利用率尚不明确。消化吸收是低聚肽发挥生物活性的前提,而体内利用率则直接反映了其营养价值。因此,深入研究麻黄鸡低聚肽的消化吸收机制及体内利用率,对于评价其营养价值、开发功能性食品具有重要意义。
本研究通过测定黄鸡低聚肽的氨基酸组成和分子质量分布,结合氨基酸评分、化学评分及氨基酸比值系数评分等多维度指标,系统评价其营养价值;同时采用体外模拟胃肠消化模型和大鼠粪代谢平衡实验,评估其消化吸收利用率。研究结果不仅为黄鸡低聚肽的开发利用提供了理论依据,也为新型功能性食品的开发提供了重要参考。
1 材料与方法
1.1 材料
1.1.1 实验样品
黄鸡低聚肽粉,实验室自制;黄鸡低聚肽海参松茸饮(50 mL/瓶,每瓶添加4.5 g黄鸡低聚肽粉),市售。
1.1.2 实验动物
健康的雄性ICR大鼠(许可证 SCXK(京)2019-0010),SPF级,15~18月龄(220~250 g),斯贝福(北京)生物技术有限公司。大鼠粪代谢平衡实验在北京中食海氏生物技术有限公司开展(编号:ZSHS20250210)。
1.2 仪器与设备
AB104.N电子天平,瑞士METTLER TOLEDO公司;TZL-5003恒温振荡水浴锅,苏州珀西瓦尔实验设备有限公司;L-8900全自动日立氨基酸分析仪,天美(中国)科学仪器有限公司;UDK159全自动凯氏定氮仪,意大利Velp Scientifica公司;EVC小鼠饲养系统,上海玉研科学仪器有限公司;LC-20AD高效液相色谱仪,日本岛津公司。
1.3 实验方法
1.3.1 麻黄鸡汤的制备工艺
麻黄鸡(整鸡)质量为1 000.22 g,其蛋白质含量约为15%,冷藏保存。冷藏整鸡解冻后,切块,料水比1∶1.5(g∶mL),鸡肉块冷水下锅,大火(2 000 W)煮沸,开锅后中小火(600 W)慢炖2 h[10-12],最后采用80目筛网过滤即为麻黄鸡汤(简称鸡汤)。
1.3.2 饲料加工
麻黄鸡(含骨)绞碎后冷冻干燥、黄鸡低聚肽海参松茸饮和鸡汤浓缩后再冻干成粉,按照表1所示,混合制备大鼠饲料(蛋白含量17.7%),用于体内消化吸收试验。
表1 大鼠饲料配方 单位:g/1 000 g
Table 1 Rat feed formula

成分无氮饲料组黄鸡低聚肽麻黄鸡鸡肉黄鸡低聚肽海参松茸饮鸡汤蛋白样品0203.4589.9553.0595玉米淀粉600.5397.110.647.55.5麦芽糊精132132132132132蔗糖100100100100100纤维素5050505050大豆油7070707070混合维生素1010101010混合矿物质3535353535酒石酸氨胆碱2.52.52.52.52.5
1.3.3 蛋白质营养特征分析与评价
1.3.3.1 一般营养成分测定
按照GB 5009.5—2016 《食品安全国家标准 食品中蛋白质的测定》测定蛋白含量;按照GB/T 22729—2008 《海洋鱼低聚肽粉》测定分子质量分布;按照GB 5009.124—2016 《食品安全国家标准 食品中氨基酸的测定》测定氨基酸含量。
1.3.3.2 蛋白质的化学评分计算
采用鸡蛋蛋白评分标准模式[13],即化学评分(chemical score,CS)。计算如公式(1)所示:
(1)
1.3.3.3 黄鸡低聚肽的氨基酸评分计算方法
氨基酸组成是评价蛋白质品质的关键因素。氨基酸评分(amino acid score,AAS)反映了样品蛋白质必需氨基酸含量与世界卫生组织(World Health Organization,WHO)/联合国粮食及农业组织(Food and Agriculture Organization of the United Nations,FAO)推荐值的接近程度,计算如公式(2)所示:
AAS/%
(2)
式中:EAA(essential amino acids)含量为必需氨基酸含量,%。
1.3.4 体外消化模拟实验
通过模拟胃液与肠液对样品的消化作用,参考建立双酶体外消化模型[14-15]。
1)样品的胃液消化率(protein digestibility in gastric fluid,PDG)
称取0.5 g与15 mL模拟胃液(0.1 g胃蛋白酶溶于1 L 0.1 mol/L HCl,pH 1.5)在锥形瓶内混合均匀后,保持37 ℃恒温振荡消化3 h。即胃消化样品液,样品胃液消化率按照公式(3)计算:
(3)
式中:P0为样品的蛋白质含量,g/100 g;P1为模拟胃液消化后样品蛋白质含量,g/100 g。
2)样品的肠液消化率(protein digestibility in intestinal fluid,PDI)
胃消化样品液用NaOH调节pH值至8.0,加入7.5 mL模拟肠液(0.533 g胰酶溶于1 L pH 8.0的磷酸盐缓冲液,含0.005 mol/L NaN3),继续37 ℃消化24 h。最后,加入200 g/L的三氯乙酸10 mL终止反应。PDI计算如公式(4)所示:
(4)
式中:P1为模拟胃液消化后样品蛋白质含量,g/100 g;P2为模拟肠液消化后样品蛋白质含量,g/100 g。
3)样品的总消化率(total protein digestibility,PDT)
样品的总消化率是指蛋白质经“胃液-肠液”两步水解后,样品被消化酶分解的程度。消化率越高说明被机体吸收利用的可能性越大,即样品的营养价值就越高。PDT计算如公式(5)所示:
(5)
式中:P0为样品的蛋白质含量,g/100 g;P2为模拟肠液消化后蛋白质含量,g/100 g。
1.3.5 大鼠体内消化与吸收
1.3.5.1 实验动物的饲养
通过建立大鼠粪氮代谢平衡实验模型进行样品体内消化吸收研究。实验室饲养大鼠平衡2 d后,25只大鼠随机分为5组,每只大鼠在代谢笼中单笼饲养,每组饲喂不同的定制饲料,即无氮组、黄鸡低聚肽组、麻黄鸡鸡肉组、黄鸡低聚肽海参松茸饮组、鸡汤组。
实验饲养分为4 d的预备期和5 d的平衡期。其中预备期按照逐步取代方式配制饲料,即第1天(20%定制饲料+基础饲料)、第3天(40%定制饲料+基础饲料)、第4天(60%定制饲料+基础饲料)。随后,进行5 d的代谢平衡期(第5~9天),实验组大鼠统一采用定制配方饲料进行饲喂,其日摄食量严格控制在15 g/d。每日定时收集饲料残渣,并同步采集实验动物的排泄物样本。其中,粪便和尿液样本经分离后分别置于4 ℃预冷的无菌EP管中保存。实验全程采用自由饮水模式,以确保实验动物的正常代谢需求[14]。
1.3.5.2 评价指标计算
饲料残渣及大鼠粪便收集后,采用60 ℃风干2 d,称重记录质量。测定大鼠粪便及尿液中蛋白质含量。
评价蛋白质的营养价值,计算真实消化率(true digestibility,TD)、生物学价值(biological value,BV)及净利用率(net protein utilization,NPU)[16]分别如公式(6)~公式(8)所示:
(6)
(7)
NPU/%=BV×TD
(8)
式中:Ni为摄入氮含量,g/d;Fn为粪氮含量,g/d;Fk为粪代谢氮含量,g/d;Un为尿氮含量,g/d;Uk为尿内源氮含量,g/d。
1.4 数据统计设计
消化吸收实验均重复3次,数据利用平均值的形式表示。采用WPS Office Excel进行数据收集整理以及单因素方差分析,P>0.05为差异不显著。
2 结果与分析
2.1 黄鸡低聚肽的营养组成分析
2.1.1 黄鸡低聚肽氨基酸成分
测定黄鸡低聚肽样品中18种氨基酸含量,如表2所示,黄鸡低聚肽总氨基酸(total amino acid,TAA)含量为80.609 g/100 g,其中EAA占比为32.13%。其中,含量最高的是谷氨酸13.104 g/100 g,占总氨基酸的16.26%,其次是甘氨酸和天冬氨酸,分别占总量的9.98%、9.37%。根据FAO/WHO的建议,EAA/TAA的理想值应接近40%,EAA/非必需氨基酸(non-essential amino acid,NEAA)的理想值应接近60%以上[17]。黄鸡低聚肽的EAA/TAA为32.13%,EAA/NEAA为47.34%。黄鸡低聚肽是富含所有必需氨基酸的优质蛋白,其组成接近人体需求,可作为理想蛋白质补充来源。
表2 黄鸡低聚肽的氨基酸成分
Table 2 Amino acid components of yellow chicken oligopeptide
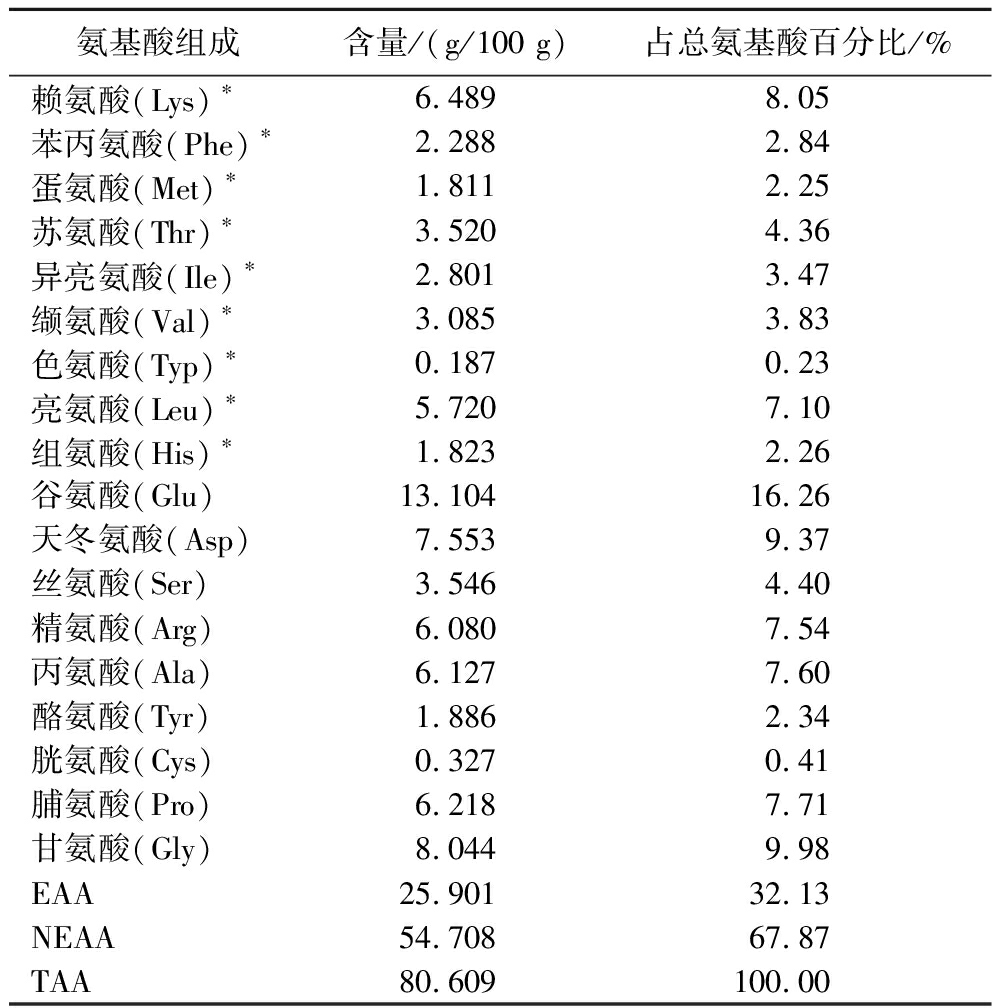
氨基酸组成含量/(g/100 g)占总氨基酸百分比/%赖氨酸(Lys)∗6.4898.05苯丙氨酸(Phe)∗2.2882.84蛋氨酸(Met)∗1.8112.25苏氨酸(Thr)∗3.5204.36异亮氨酸(Ile)∗2.8013.47缬氨酸(Val)∗3.0853.83色氨酸(Typ)∗0.1870.23亮氨酸(Leu)∗5.7207.10组氨酸(His)∗1.8232.26谷氨酸(Glu)13.10416.26天冬氨酸(Asp)7.5539.37丝氨酸(Ser)3.5464.40精氨酸(Arg)6.0807.54丙氨酸(Ala)6.1277.60酪氨酸(Tyr)1.8862.34胱氨酸(Cys)0.3270.41脯氨酸(Pro)6.2187.71甘氨酸(Gly)8.0449.98EAA25.90132.13NEAA54.70867.87TAA80.609100.00
注:“*”为必需氨基酸。
2.1.2 黄鸡低聚肽氨基酸水平评价
黄鸡低聚肽氨基酸评价,包括氨基酸评分与化学评分如表3所示,根据AAS分析,黄鸡低聚肽中色氨酸为第一限制性氨基酸(33.8%),其次是缬氨酸,氨基酸评分为85.7%,其他氨基酸均大于100.0%,高于WHO/FAO/联合国大学(United Nations University,UNU)(2013版)[18]成人评分标准模式,满足氨基酸需求,蛋白质营养价值高。根据CS分析,与标准鸡蛋模式比较可快速评价样品蛋白质的营养价值,黄鸡低聚肽中赖氨酸化学评分为100.4%,该氨基酸含量与人体需求高度匹配。第一限制性氨基酸为色氨酸(11.9%)。采用氨基酸评分与化学评分评价蛋白的营养价值时,通过WHO/FAO/UNU模式与鸡蛋模式计算来确定黄鸡低聚肽缺乏的氨基酸。为了更好地分析蛋白质的营养价值,可以从蛋白质的氨基酸平衡性角度去评价黄鸡低聚肽蛋白质量。
表3 黄鸡低聚肽氨基酸水平评价
Table 3 Evaluation of amino acid levels of oligopeptides in yellow chicken
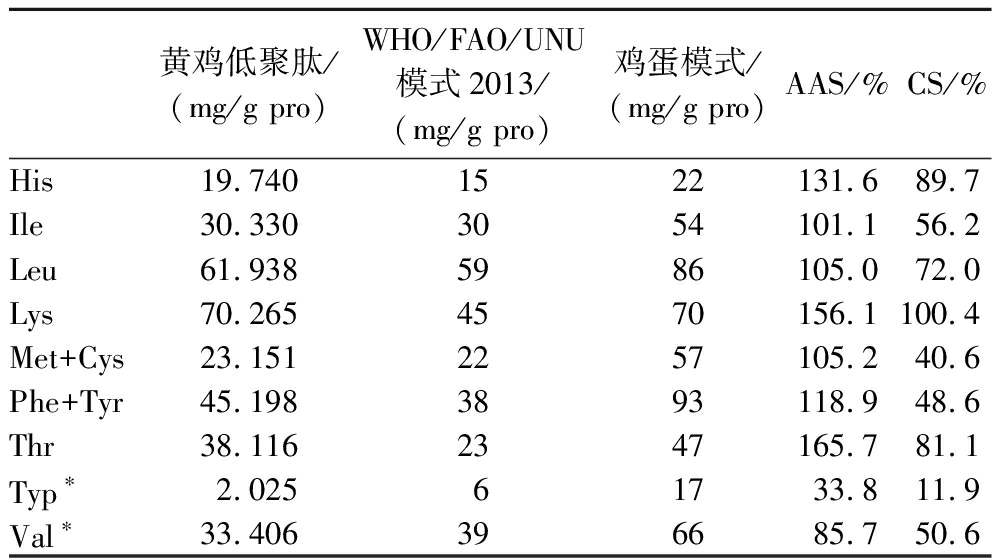
黄鸡低聚肽/(mg/g pro)WHO/FAO/UNU模式2013/(mg/g pro)鸡蛋模式/(mg/g pro)AAS/%CS/%His19.740 1522131.689.7Ile30.3303054101.156.2Leu61.9385986105.072.0Lys70.2654570156.1100.4Met+Cys23.1512257105.240.6Phe+Tyr45.1983893118.948.6Thr38.1162347165.781.1Typ∗2.02561733.811.9Val∗33.406396685.750.6
注:“*”为第一限制性氨基酸(表4同)。
2.1.3 氨基酸比值(ratio of amino acid,RAA)、比值系数(ratio coefficient,RC)、比值系数分(score of ratio coefficient,SRC)分析
黄鸡低聚肽的必需氨基酸组成如表4所示,其中RAA是评价蛋白质营养价值的重要指标,即样品中某类必需氨基酸含量与WHO/FAO/UNU推荐的理想蛋白质模式中相应氨基酸含量的比值。该指标能够有效反映样品氨基酸组成与理想模式的接近程度,当RAA值趋近于1时,即该氨基酸的含量达到理想蛋白质的标准[13,19]。根据RAA分析,除色氨酸外,氨基酸评分均为0.86~1.66,接近理想模式。
表4 黄鸡低聚肽中必需氨基酸的分析
Table 4 Analysis of essential amino acids in yellow chicken oligopeptide
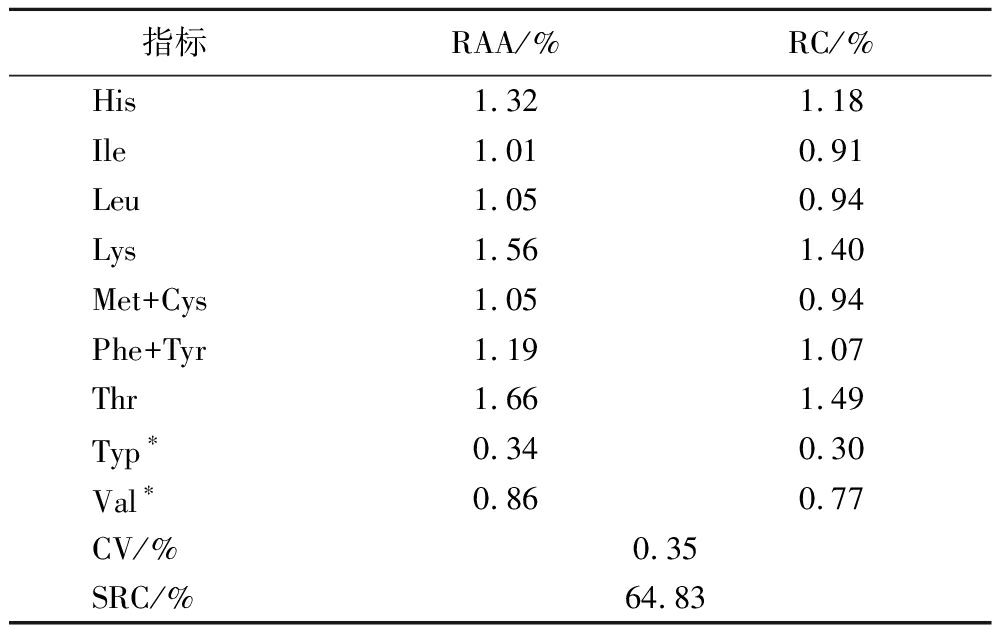
指标RAA/%RC/%His1.321.18 Ile1.010.91 Leu1.050.94 Lys1.561.40 Met+Cys1.050.94 Phe+Tyr1.191.07 Thr1.661.49 Typ∗0.340.30 Val∗0.860.77 CV/%0.35SRC/%64.83
RC反映了氨基酸在整体中比例是否合适,RC越接近1,代表该氨基酸与理想模式越一致[19-20]。根据RC分析,除色氨酸及缬氨酸为限制性氨基酸,含量不足以外,其他氨基酸评分均为0.91~1.49,接近WHO/FAO理想模式。
通过RC计算变异系数(coefficient of variation,CV)后可得到SRC,SRC用于综合评价食物蛋白质必需氨基酸的平衡性[19-20],SRC越接近100%代表该氨基酸组成越接近理想模式,黄鸡低聚肽SRC为64.83%,大于50%,故黄鸡低聚肽具有较高的营养价值。
2.2 黄鸡低聚肽的蛋白质特性表征
鸡肉煲汤为最常见的传统烹饪方式,具有滋补作用,更适宜体质较弱者服用。鸡汤中富含胶原蛋白、氨基酸、肌酐和肌肽等营养物质,且容易被人体消化吸收和利用[21]。麻黄鸡蛋白含量为15%,熬制2 h鸡汤后,鸡汤共溶出1 080 mL,其蛋白含量为2.06%,该汤煲工艺下鸡汤蛋白质的总溶出率为14.83%。研究显示,长时间炖煮或切块炖煮鸡汤比整鸡炖煮的鸡汤溶出率更高,一般鸡汤蛋白质溶出率为15%~20%[22]。动物蛋白中鸡肉和鱼肉的可溶性蛋白比例较高,尤其是鱼肉,诸永志等[23]采用95 ℃加热2 h的工艺条件下,制备鲫鱼汤蛋白溶出率可达16.42%,不同动物蛋白相似汤煲工艺条件下的蛋白溶出率结果差异不大。
分子质量是影响蛋白肽消化吸收的关键因素。通常,小分子肽更易被消化吸收:小分子肽(如二肽、三肽)能通过肠上皮细胞直接吸收,而大分子肽需先分解为小肽或氨基酸。分子质量在200~500 Da左右,能通过肠上皮细胞的肽转运蛋白(如PepT1)直接吸收,效率较高。分子质量在500~2 000 Da,虽然需要部分酶解,但仍能较快吸收;分子质量大于2 000 Da的肽或完整蛋白质需先被消化酶分解为小肽或氨基酸,吸收较慢[24-26]。
如表5所示,鸡汤与黄鸡低聚肽的蛋白分子质量分布对比显示,分子质量在2 000 Da以下的占比中,黄鸡低聚肽(95.39%)是鸡汤(44.50%)的2倍。黄鸡低聚肽的重均分子质量为648.64 Da,显著低于鸡汤中蛋白的重均分子质量11 850.12 Da。由于黄鸡低聚肽中小分子质量蛋白肽占比较高,其在消化吸收方面可能比鸡汤蛋白更易于被机体利用。
表5 黄鸡低聚肽与鸡汤蛋白分子质量分布情况
Table 5 Molecular weight distribution of yellow chicken
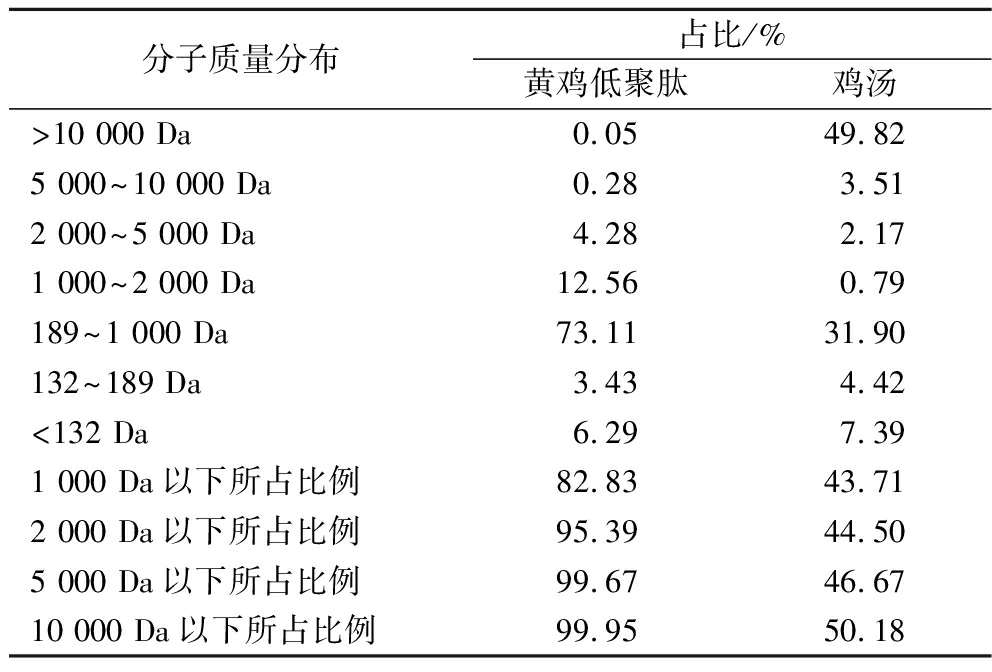
分子质量分布占比/%黄鸡低聚肽鸡汤>10 000 Da0.05 49.82 5 000~10 000 Da0.28 3.51 2 000~5 000 Da4.28 2.17 1 000~2 000 Da12.56 0.79 189~1 000 Da73.11 31.90 132~189 Da3.43 4.42 <132 Da6.29 7.39 1 000 Da以下所占比例82.8343.71 2 000 Da以下所占比例95.3944.50 5 000 Da以下所占比例99.6746.67 10 000 Da以下所占比例99.9550.18
2.3 黄鸡低聚肽体外消化情况
通过胃蛋白酶-胰酶双酶复合处理法以蛋白含量为指标,模拟黄鸡低聚肽、麻黄鸡鸡肉、黄鸡低聚肽海参松茸饮、鸡汤共4种样品的蛋白质体外消化率,每组样品重复3次实验取平均值,如表6所示,根据PDG分析,模拟蛋白质在胃液中的初步分解能力,黄鸡低聚肽与黄鸡低聚肽海参松茸饮PDG分别为(83.52±4.65)%和(78.13±3.13)%,在P<0.05水平下,PDG无显著性差异,但与鸡肉和鸡汤比较PDG显著更高,即更易被胃液分解消化,有利于营养物质的快速吸收。根据PDI分析,模拟蛋白质在小肠中进一步分解能力,黄鸡低聚肽PDI最高为(72.22±11.71)%,其次是黄鸡低聚肽海参松茸饮,麻黄鸡鸡肉与鸡汤PDI无显著性差异,即黄鸡低聚肽更易被分解,促进营养物质高效吸收。根据PDT分析,4种样品的PDT比较为黄鸡低聚肽>黄鸡低聚肽海参松茸饮>鸡汤>鸡肉(P<0.05)。黄鸡低聚肽、黄鸡低聚肽海参松茸饮样品总消化率均大于90%,说明该组蛋白质在整体消化系统中更容易被消化吸收。所有样品的胃液消化率均大于肠液消化率,麻黄鸡中提取制备的低聚肽不仅没有降低蛋白质的吸收,而且更有利于其吸收。体外实验无法模拟人体消化环境的复杂性,比如肠道微生物、激素调节等,故继续通过结合体内实验,验证体外结果的可靠性。
表6 各样品蛋白质体外消化情况 单位:%
Table 6 In vitro digestion of proteins of each sample
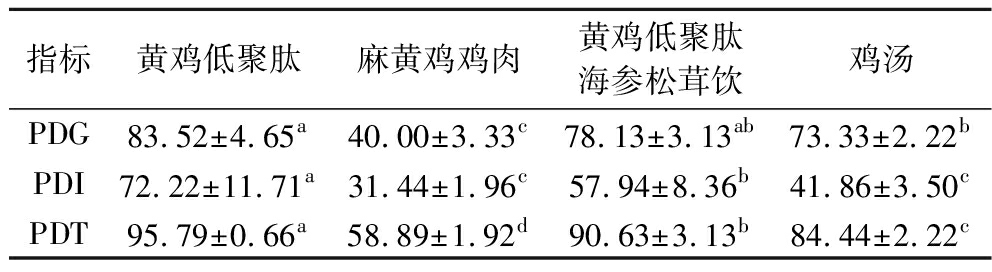
指标黄鸡低聚肽麻黄鸡鸡肉黄鸡低聚肽海参松茸饮鸡汤PDG83.52±4.65a40.00±3.33c78.13±3.13ab73.33±2.22bPDI72.22±11.71a31.44±1.96c57.94±8.36b41.86±3.50cPDT95.79±0.66a58.89±1.92d90.63±3.13b84.44±2.22c
注:不同小写字母表示在0.05水平上差异显著(P<0.05)。
2.4 黄鸡低聚肽肽体内消化与吸收
如表7所示,根据BV分析,黄鸡低聚肽组与黄鸡低聚肽海参松茸饮组BV分别为(98.01±1.98)%和(95.86±3.42)%,在P<0.05水平下,BV无显著性差异,但与麻黄鸡鸡肉和鸡汤比较BV显著更高,即黄鸡低聚肽与黄鸡低聚肽海参松茸饮消化吸收后被机体利用的程度高于鸡肉和鸡汤,黄鸡低聚肽BV是鸡肉的1.9倍,是鸡汤的1.1倍。根据NPU分析,鸡肉生物价较低,所以蛋白质净利用率也较低,而黄鸡低聚肽组与黄鸡低聚肽海参松茸饮均大于90%,分别为(97.85±1.53)%和(93.79±5.06)%,显著大于鸡汤与麻黄鸡鸡肉,即食用营养价值更高,黄鸡低聚肽NPU是鸡肉的2.6倍,是鸡汤的1.2倍。
表7 各样品蛋白质体内消化情况及评价
Table 7 In vivo digestion and evaluation of each sample protein
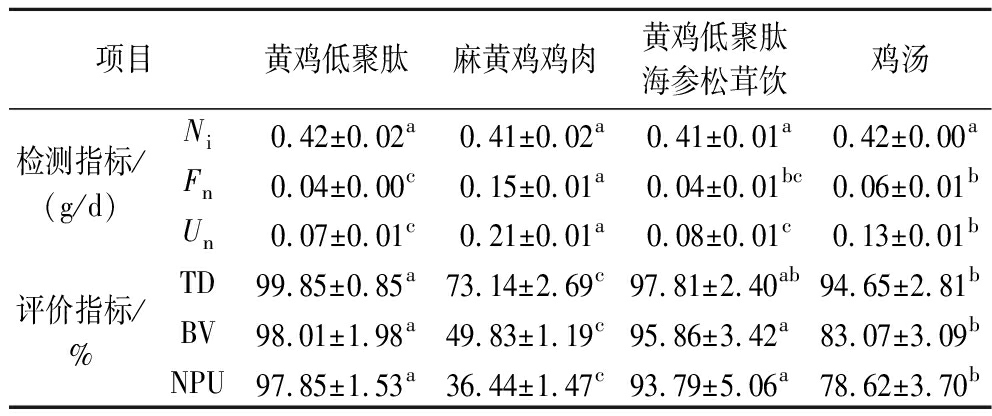
项目黄鸡低聚肽麻黄鸡鸡肉黄鸡低聚肽海参松茸饮鸡汤检测指标/(g/d)Ni 0.42±0.02a 0.41±0.02a 0.41±0.01a 0.42±0.00aFn0.04±0.00c0.15±0.01a0.04±0.01bc0.06±0.01bUn0.07±0.01c0.21±0.01a0.08±0.01c0.13±0.01b评价指标/%TD99.85±0.85a73.14±2.69c97.81±2.40ab94.65±2.81bBV98.01±1.98a49.83±1.19c95.86±3.42a83.07±3.09bNPU97.85±1.53a36.44±1.47c93.79±5.06a78.62±3.70b
注:Ni为摄入氮含量;Fn为粪氮含量;Un为尿氮含量。
鸡汤与黄鸡低聚肽海参松茸饮对比,从蛋白含量分析,口服液产品按每瓶添加4.5 g/50 mL黄鸡低聚肽,黄鸡低聚肽的蛋白含量约为92%计,鸡汤蛋白含量为2.06%,从氮源营养被机体消化利用下考虑,蛋白总量相同情况下饮用黄鸡低聚肽海参松茸饮产品体积相当于饮用5.02倍体积的传统鸡汤,即饮用4瓶黄鸡低聚肽海参松茸饮相当于饮用1 kg黄鸡熬出的1 L鸡汤。
3 结论
本研究系统评价了黄鸡低聚肽的消化吸收特性、氨基酸组成及营养价值,并与传统鸡汤进行了对比分析。结果表明,黄鸡低聚肽在分子质量分布、氨基酸平衡性及生物利用率方面均表现出显著优势。其小分子特性使其更易被胃肠道分解吸收,体外消化率显著高于传统鸡汤和鸡肉,体内实验进一步证实其生物学价值与蛋白质净利用率均优于鸡汤,表明其代谢利用率更高。氨基酸分析显示,黄鸡低聚肽总氨基酸含量为80.609 g/100 g,必需氨基酸占比32.13%,接近WHO/FAO推荐的理想模式(40%),且氨基酸SRC达64.83%,黄鸡低聚肽的氨基酸组成较为均衡。尽管缬氨酸与色氨酸为限制性氨基酸,但其余必需氨基酸评分均达到100%以上,可充分满足人体理想的营养补充需求。
在考虑消化吸收蛋白含量相同的情况下,饮用1瓶黄鸡低聚肽海参松茸饮(50 mL/瓶)相当于饮用浓缩5倍的鸡汤,即等同于传统鸡汤250 mL,可减少80%的液体摄入量,且其分子特性与高生物活性更符合现代功能性食品的开发需求。本研究结果不仅为黄鸡蛋白资源的高值化利用提供了科学支撑,也为开发针对体质虚弱人群的精准营养补充剂奠定了技术基础。未来研究可进一步优化酶解工艺以提高限制性氨基酸比例,或通过复配其他蛋白源完善氨基酸平衡性,从而提升其综合营养价值。大鼠的消化系统在结构和功能上具有独特特点,例如其小肠相对较短,食物通过肠道的速度较快,可能导致某些物质的吸收不完全或过快,这与人类的正常消化吸收过程存在一定差异。因此,若要准确测定人体对黄鸡低聚肽的消化吸收利用率,需结合临床试验进一步验证。
[1] 陈卫. 功能食品与膳食健康[J].食品与生物技术学报, 2024, 43(4):1-7.CHEN W.Functional foods and dietary health[J].Journal of Food Science and Biotechnology, 2024, 43(4):1-7.
[2] 蔡木易. 食源性肽研究进展[J].北京工商大学学报(自然科学版), 2012, 30(5):1-10.CAI M Y.Progress of research on food-derived peptide[J].Journal of Beijing Technology and Business University(Natural Science Edition), 2012, 30(5):1-10.
[3] DANIEL H.Molecular and integrative physiology of intestinal peptide transport[J].Annual Review of Physiology, 2004, 66:361-384.
[4] 周贤敏, 区灿盛, 邓森荣, 等.采用计算机模拟技术评估花生蛋白作为新冠疫情期间营养补充剂的潜力[J].现代食品科技, 2021, 37(12):104-111.ZHOU X M, OU C S, DENG S R, et al.Computer evaluation of the potential of protein from Arachis hypogaea as a nutritional supplement during COVID-19 pandemic[J].Modern Food Science and Technology, 2021, 37(12):104-111.
[5] 刘泽鑫, 刘畅, 钱和.芦荟多糖复方体外抗氧化及预防小鼠酒精性肝损伤作用[J].食品科技, 2020, 45(2):211-218.LIU Z X, LIU C, QIAN H.Antioxidation and prevention of alcoholic liver injury in mice by Aloe polysaccharide combined with corn oligopeptide in vitro[J].Food Science and Technology, 2020, 45(2):211-218.
[6] 刘刚, 沈旸.低聚肽强化麦芽糊精果糖液对胃癌患者临床效果的影响[J].肿瘤代谢与营养电子杂志, 2020, 7(4):433-437.LIU G, SHEN Y.The effect of oligopeptide-enhanced maltodextrin fructose solution on accelerated rehabilitation surgery in gastric cancer patients[J].Electronic Journal of Metabolism and Nutrition of Cancer, 2020, 7(4):433-437.
[7] 李淼, 冯洁芳, 马钰荣, 等.黄鸡低聚肽抗疲劳及肽段结构序列研究[J].食品工业科技, 2025, 46(17):411-419.LI M, FENG J F, MA Y R, et al.Antifatigue effect and peptide sequence of oligopeptides derived from yellow chicken[J].Science and Technology of Food Industry, 2025, 46(17):411-419.
[8] 闫昌誉, 丁肇俊, 李晓敏, 等.鸡源性活性肽的研究进展[J].今日药学, 2022, 32(1):4-16.YAN C Y, DING Z J, LI X M, et al.Research progress of chicken-derived active peptides[J].Pharmacy Today, 2022, 32(1):4-16.
[9] 俞媛瑞, 王雪峰, 王桂瑛, 等.鸡肉中生物活性肽的研究进展[J].食品研究与开发, 2019, 40(22):220-224.YU Y R, WANG X F, WANG G Y, et al.Review of bioactive peptides derived from chicken muscle[J].Food Research and Development, 2019, 40(22):220-224.[10] GUAN H N, XU X J, FENG C M, et al.Effects of stewing modes on physicochemical quality and formation of flavour compounds of Chinese Dagu chicken soup[J].Polish Journal of Food and Nutrition Sciences, 2024:26-40.
[11] 李春保, 李霄, 井庆楠.炖鸡肉及鸡汤的品质研究[J].肉类研究, 2012,26(6):1-8.LI C B, LI X, JING Q N.Quality characteristics of stewed chicken meat and chicken soup[J].Meat Research, 2012,26(6):1-8.
[12] 王虎虎, 黄明远, 李潇, 等.黄羽肉鸡汤煲炖煮工艺优化[J].中国食品学报, 2021, 21(5):272-277.WANG H H, HUANG M Y, LI X, et al.Optimization of stew parameters of yellow-feather broiler soup[J].Journal of Chinese Institute of Food Science and Technology, 2021, 21(5):272-277.
[13] 中国预防医学科学院营养与食品卫生研究所. 食物成分表(全国代表值)[M].北京:人民卫生出版社, 1991:30-82.The Institute of Nutrition and Food Hygiene, Chinese Academy of Preventive Medical Sciences.Food Composition Table (National Representative Value) [M].Beijing:People’s Health Publishing House, 1991:30-82.
[14] 张丹, 王锡昌.中华鳖腿肉蛋白质体内外消化研究[J].食品科学, 2014, 35(21):113-117.ZHANG D, WANG X C.Digestibility in vitro and in vivo of Chinese soft-shelled turtle protein[J].Food Science, 2014,35(21):113-117.
[15] 王亚彬, 黎志伟, 李长江, 等.不同表面修饰纳米硒在模拟胃肠消化中稳定性及抗氧化活性变化[J].食品与发酵工业, 2023, 49(1):53-59.WANG Y B, LI Z W, LI C J, et al.Changes of stability and antioxidant activity of different surface-modified selenium nanoparticles in simulated gastrointestinal digestion[J].Food and Fermentation Industries, 2023, 49(1):53-59.
[16] 张丹. 中华鳖营养特征分析及评价[D].上海:上海海洋大学, 2015.ZHANG D.Analysis and evaluation of nutritional composition in Chinese soft-shelled turtle (Trionyx sinensis)[D].Shanghai:Shanghai Ocean University, 2015.
[17] 姜绍通, 程元珍, 郑志, 等.红芽芋营养成分分析及评价[J].食品科学, 2012, 33(11):269-272.JIANG S T, CHENG Y Z, ZHENG Z, et al.Analysis and evaluation of nutritional components of red bud taro(Colocasia esulenla L.Schott)[J].Food Science, 2012, 33(11):269-272.
[18] 杨月欣, 葛可佑.中国营养科学全书[M].2版.北京:人民卫生出版社, 2019:1575.YANG Y X, GE K Y.The Chinese Complete Book of Nutrition Science[M].(2nd edition) Beijing:People’s Health Publishing House, 2019:1575.
[19] 段杰仁, 石伟, 邱小琮, 等.蓖齿眼子菜与狐尾藻营养价值评价[J].中南农业科技, 2023(5):39-44.DUAN J R, SHI W, QIU X C, et al.Evaluation of nutritional value of Potamogeon pectinatus L.and Myriophyllum verticillatum L.[J].South-Central Agricultural Science and Technology, 2023(5):39-44.
[20] 吴雅茹, 陈贵茹, 雷建都, 等.桑叶蛋白超声提取联合超滤纯化工艺优化及其营养评价[J].食品工业科技, 2023, 44(16):236-245.WU Y R, CHEN G R, LEI J D, et al.Optimization of ultrasonic extraction combined with ultrafiltration for purification of mulberry leaf protein and its nutritional evaluation[J].Science and Technology of Food Industry, 2023, 44(16):236-245.
[21] 贾晓攀, 唐万婷, 吴宝珠, 等.四川传统清鸡汤与市售鸡汤风味成分的比较分析[J].中国调味品, 2024, 49(10):161-171.JIA X P, TANG W T, WU B Z, et al.Comparative analysis of flavor components in traditional Sichuan clear chicken soup and commercially available chicken soup[J].China Condiment, 2024, 49(10):161-171.
[22] 张姗. 烹饪方式对鸡汤纳米颗粒抗氧化活性的影响[D].杭州:浙江工商大学, 2023.ZHANG S.Effect of cooking method on the antioxidant activity of chicken broth nanoparticles[D].杭州:Zhejiang Gongshang University, 2023.
[23] 诸永志, 卞欢, 吴海虹, 等.提高鲫鱼汤原料蛋白溶出率的工艺优化[J].江苏农业科学, 2018, 46(8):189-192.ZHU Y Z, BIAN H, WU H H, et al.Improvement of protein dissolution rate by optimization of crucian carp soup processing technology[J].Jiangsu Agricultural Sciences, 2018, 46(8):189-192.
[24] 徐雯, 王振南, 蒲仕文, 等.体外消化模型研究进展及其在食品中的应用[J].食品与发酵工业, 2022, 48(10):321-327.XU W, WANG Z N, PU S W, et al.Research progress of in vitro digestion model and its application in food[J].Food and Fermentation Industries, 2022, 48(10):321-327.
[25] GRIMBLE G K.The significance of peptides in clinical nutrition[J].Annual Review of Nutrition, 1994, 14:419-447.
[26] SHIMIZU M, SON D O.Food-derived peptides and intestinal functions[J].Current Pharmaceutical Design, 2007,13(9):885-895.