在食品工业酶制剂开发和发酵工程菌株改良领域,高通量筛选技术已成为提升生产效率的关键手段[1-3]。传统筛选方法依赖宏观培养体系,通过检测生物量或代谢产物浓度等指标评估菌株性能,通量通常低于103株/d,即使是在自动化机械臂的帮助下,其通量也不超过105株/d[4-5]。液滴微流体技术将细胞封装于皮升级独立体系(液滴)中,每个液滴可作为一个微型生物反应器,物理隔离细胞间的代谢干扰,同时允许并行化操作,通量可达到106株/d,为高通量筛选提供了独特优势[6-9]。
然而,现有筛选体系面临毒性产物(如抗菌肽、溶菌酶等产物)的诱导合成与细胞生长存在冲突的问题[10-12]。传统诱导表达方法一般在摇瓶中完成菌株培养后,直接将诱导剂与菌悬液混合进行单细胞封装,同步进行液滴中细胞的生长和产物的诱导合成[13]。这种方法导致单细胞的生长受到毒性产物合成的抑制。近年来,已有研究尝试在液滴内进行动态调控,例如,STEPHENSON等[14]提出一种基于微流体的磁性颗粒高效清洗方法,利用磁场辅助实现纳升级液滴中磁性微粒的缓冲液置换。实验结果显示,该装置处理通量为50 Hz,单级稀释倍数为92.9,洗涤后液滴体积保持在2.2 nL。尽管该方法的清洗效率较高,但通量较低且仅适用于磁珠颗粒。SIEDLIK等[15]开发了“pico-washer”技术用于液滴的连续洗涤,实验表明该装置通量大于1.0 kHz,单级稀释倍数为3倍,两级总体稀释倍数达到8.6倍。该方法的通量较高,但清洗效率低,且对压力与电压参数的控制有较高要求。另外,上述2项研究均未充分验证其方法在生物样本中的应用效果。CHAN等[16]进行了水包油包水双乳液滴制作,在外部水相添加IPTG,利用IPTG跨油壳自由扩散进入液滴激活基因表达。通过优化IPTG浓度,发现低浓度IPTG(0.5~2 mmol/L)有效激活绿色荧光蛋白表达,且细胞生长未受显著抑制;高浓度IPTG(>5 mmol/L)抑制细胞生长,导致荧光信号较低。该方法有效实现了双乳液滴中基因表达与细胞生长的平衡。但相比于油包水液滴,该方法中双乳液滴的稳定性较差,且制备时对实验操作和设备要求高[17-20]。
本研究建立了一种油包水液滴体系中的扩散诱导方法进行单细胞尺度动态调控,实现细胞生长与产物合成解偶联,并应用于大肠杆菌(Escherichia coli)异源表达毒性蛋白Phi29 DNA聚合酶(Phi29 DNA polymerase,Phi29 Pol)。首先进行了液滴中Phi29 pol-超折叠绿色荧光蛋白(super-fold green fluorescent protein,sfGFP)融合蛋白异源表达菌株的生长培养;随后,加入封装了IPTG的诱导液滴,外部油相作为选择性屏障,调节IPTG从诱导液滴扩散至细胞液滴中激活基因表达,实现了液滴中细胞的先生长后诱导表达调控。进一步优化得到诱导液滴与细胞液滴比例为1∶100、IPTG终浓度为1.2 mmol/L时,液滴中Phi29 pol-sfGFP表达水平提升至单细胞的2.37倍。该系统为诱导表达与细胞生长负相关的产物提供了可靠方法,为高通量筛选中产生高信噪比的液滴检测信号奠定基础。
1 材料与方法
1.1 实验材料
1.1.1 质粒与菌株
本研究异源表达宿主为E.coli BL21(DE3);质粒转化宿主为E.coli DH5α。所用质粒与菌株见表1。
表1 质粒与菌株
Table 1 Plasmids and strains
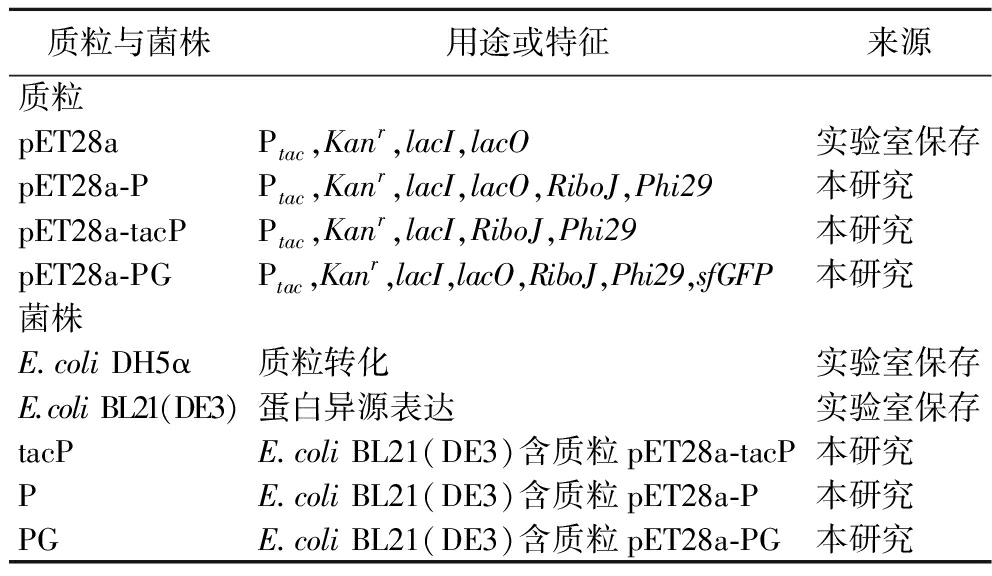
质粒与菌株用途或特征来源质粒pET28aPtac,Kanr,lacI,lacO实验室保存pET28a-PPtac,Kanr,lacI,lacO,RiboJ,Phi29本研究pET28a-tacPPtac,Kanr,lacI,RiboJ,Phi29本研究pET28a-PGPtac,Kanr,lacI,lacO,RiboJ,Phi29,sfGFP本研究菌株E.coli DH5α质粒转化实验室保存E.coli BL21(DE3)蛋白异源表达实验室保存tacPE.coli BL21(DE3)含质粒pET28a-tacP本研究PE.coli BL21(DE3)含质粒pET28a-P本研究PGE.coli BL21(DE3)含质粒pET28a-PG本研究
1.1.2 实验试剂
卡那霉素(Kanamycin,Kan)、IPTG,上海Macklin有限公司;2×PrimeSTAR Max、2×Taq PCR Master Mix,日本TaKaRa有限公司;质粒抽提试剂盒,上海Sangon有限公司;琼脂糖、PCR纯化试剂盒,美国Thermo Fisher有限公司;Seamless Cloning Kit无缝克隆试剂盒、TAE(50×),上海Beyotime有限公司;聚二甲基硅氧烷(polydimethylsiloxane,PDMS),苏州中芯启恒有限公司;NOVEC 7500,美国3M有限公司;Pico-Surf[5%(质量分数) in Novec 7500],北京久易科仪科技有限公司。
1.1.3 培养基
LB培养基(g/L):胰蛋白胨10,NaCl 10,酵母粉5,配置固体培养基时添加20琼脂,121 ℃高压蒸汽灭菌20 min。
TB培养基(g/L):胰蛋白胨12,酵母粉24,KH2PO4 2.2,K2HPO4 9.4,甘油4 mL/L(灭菌后添加),121 ℃高压蒸汽灭菌20 min,pH:7.2±0.2(25 ℃)。
1.2 仪器与设备
PCR基因扩增仪、核酸电泳仪、C1000型PCR凝胶成像仪,美国Bio-Rad;NANO Drop 2000分光光度计、超低温冰箱,美国Thermo Fisher;UV mini-1240紫外分光光度计,,日本Shimadzu;ZQZY-HC振荡培养箱,上海知楚仪器;超净工作台,苏州安泰;立式高压蒸汽灭菌锅,上海医用核子仪器厂;注射泵,Harvard Apparatus;Leica DMI8全电动倒置荧光显微镜,德国Leica;等离子表面处理仪,深圳铭恒;芯片模具,苏州汶灏;真空干燥器,浙江盐城鼎和信;超纯水制备仪,保兴生物设备。
1.3 实验方法
1.3.1 重组表达菌株的构建
对来源于枯草芽孢杆菌噬菌体Phi29的Phi29 pol(UniprotKB:P03680)基因序列进行E.coli密码子优化。使用引物PG-F/R、sfGFP-F/R和PG-RiboJ-F/R分别扩增Phi29 pol基因片段、sfGFP基因片段和人工设计的RNA绝缘子元件RiboJ基因片段。使用引物PG-arm-F/R从质粒pET-28a中扩增载体片段。通过碧云天无缝克隆试剂盒将Phi29 pol和sfGFP连接至质粒pET-28a中,再以该质粒为模板使用引物PG-RiboJ-arm-F/R扩增获得载体片段,通过无缝克隆与RiboJ基因片段连接,构建获得融合蛋白Phi29 pol-sfGFP的表达质粒pET28a-PG。其中,RiboJ基因插入于核糖体结合位点(ribosome binding site,RBS)基因前用于减少蛋白质表达水平的差异性[21-22]。以质粒pET28a-PG为模板使用引物P-F/R进行全质粒PCR,连接获得Phi29 pol的表达质粒pET28a-P。以质粒pET28a-P为模板,使用引物tacP-F/R进行全质粒PCR并连接获得Phi29 pol的组成型启动子表达质粒pET28a-tacP。将重组质粒pET28a-P、pET28a-tacP和pET28a-PG分别化学转化入E.coli BL21(DE3) 获得异源表达菌株P、tacP和PG。引物如表2所示。
表2 实验中涉及的引物
Table 2 Primers used in this study

名称 序列(5′-3′)PG-FATGAAGCATATGCCGCGTAAAATGTPG-RCTGCCGCCACCGCCGCTTCCTTTAATCGTGAAGGTATCATsfGFP-FGAAGCGGCGGTGGCGGCAGCATGAGCAAAGGAGAAGAACTsfGFP-RTGGTGGTGGTGGTGCTCGAGTTATTTGTAGAGCTCATCCAPG-arm-FACATTTTACGCGGCATATGCTTCATATGTATATCTCCTTCTTAAAGTTAAPG-arm-RCTCGAGCACCACCACCACCACCACTGAGATCCGGCTGCTAtacP-FTTGACAATTAATCATCGGCTCGTATAATGAGCTGTCACCGGATGTGCtacP-RCATTATACGAGCCGATGATTAATTGTCAAATTTCGCGGGATCGAGATCGAPG-RiboJ-FAGCTGTCACCGGATGTGCPG-RiboJ-RTTAAACAAAATTATTTGTAGAGGCTGTTTCGTCCPG-RiboJ-arm-FAAGCACATCCGGTGACAGCTGGAATTGTTATCCGCTCACAATTCCCPG-RiboJ-arm-RTACAAATAATTTTGTTTAATTTGTTTAACTTTAAGAAGGAGATATACATATGAAGCATATGCP-FATGATACCTTCACGATTAAACACCACCACCACCACCACP-RGTGGTGGTGGTGGTGGTGTTTAATCGTGAAGGTATCATCGACCAGC
1.3.2 液滴包裹
将异源表达菌株进行复苏培养,随后使用LB液体培养基稀释至OD600 = 0.05,转移入1 mL无菌注射器,作为水相。使用含2%(体积分数)Pico-Surf表面活性剂的Novec 7500作为油相,转移入1 mL无菌注射器并安装至注射泵,用导管连接液滴生成芯片和注射器,设定油相流速为5 μL/min,水相流速为2 μL/min,用1 mL无菌注射器收集液滴(直径约为25 μm),随后进行37 ℃、220 r/min振荡培养。
1.3.3 荧光强度测定
按照方法1.3.2节进行单细胞液滴包裹并完成液滴培养后,加入IPTG液滴进行诱导表达。每隔2 h吸取液滴加入液滴观察芯片,放于倒置荧光显微镜下进行拍照观察。荧光激发波长为450 nm,发射波长为490 nm。
1.4 数据处理与分析
使用软件SnapGene进行引物设计,使用软件Image J进行荧光分析,折线图、柱状图与箱线正态曲线图由软件Origin 9.0完成,流程示意图及液滴示意图由Adobe illustrator 2022软件完成。
2 结果与分析
2.1 大肠杆菌单细胞液滴封装
建立液滴微流体中单细胞调控系统的第一步是进行单细胞封装,一般通过控制菌悬液浓度实现单细胞封装,液滴中的细胞数量服从泊松分布[23]。因此,本研究首先进行了单细胞封装时E.coli菌液浓度的确定。设置E.coli菌悬液的OD600值分别为0.05、0.1和0.2。使用双通道芯片进行液滴封装,另一个水相使用LB液体培养基,设置菌液相和LB相的流速比为1∶1,因此封装时菌液最终OD600分别为0.025、0.05 和0.1。将完成封装的液滴于37 ℃恒温摇床(220 r/min)培养12 h,随后进行显微镜拍照与数据分析。实验结果如图1所示,每个照片视野中共约155个液滴,当OD600=0.05时包含菌株的液滴比例约为3.8%;当OD600=0.1时比例约为10.5%;当OD600=0.2时比例约为17.4%。根据泊松分布,液滴包裹率约为10%时可以实现单细胞封装[23]。因此,确定E.coli 单细胞封装的菌液最终OD600=0.05。

a-OD600=0.05;b-OD600=0.1;c-OD600=0.2
图1 液滴包裹中E.coli菌液浓度的优化
Fig.1 Optimization of E.coli bacteriophage concentration in droplet encapsulation
注:红圈为含菌液滴。
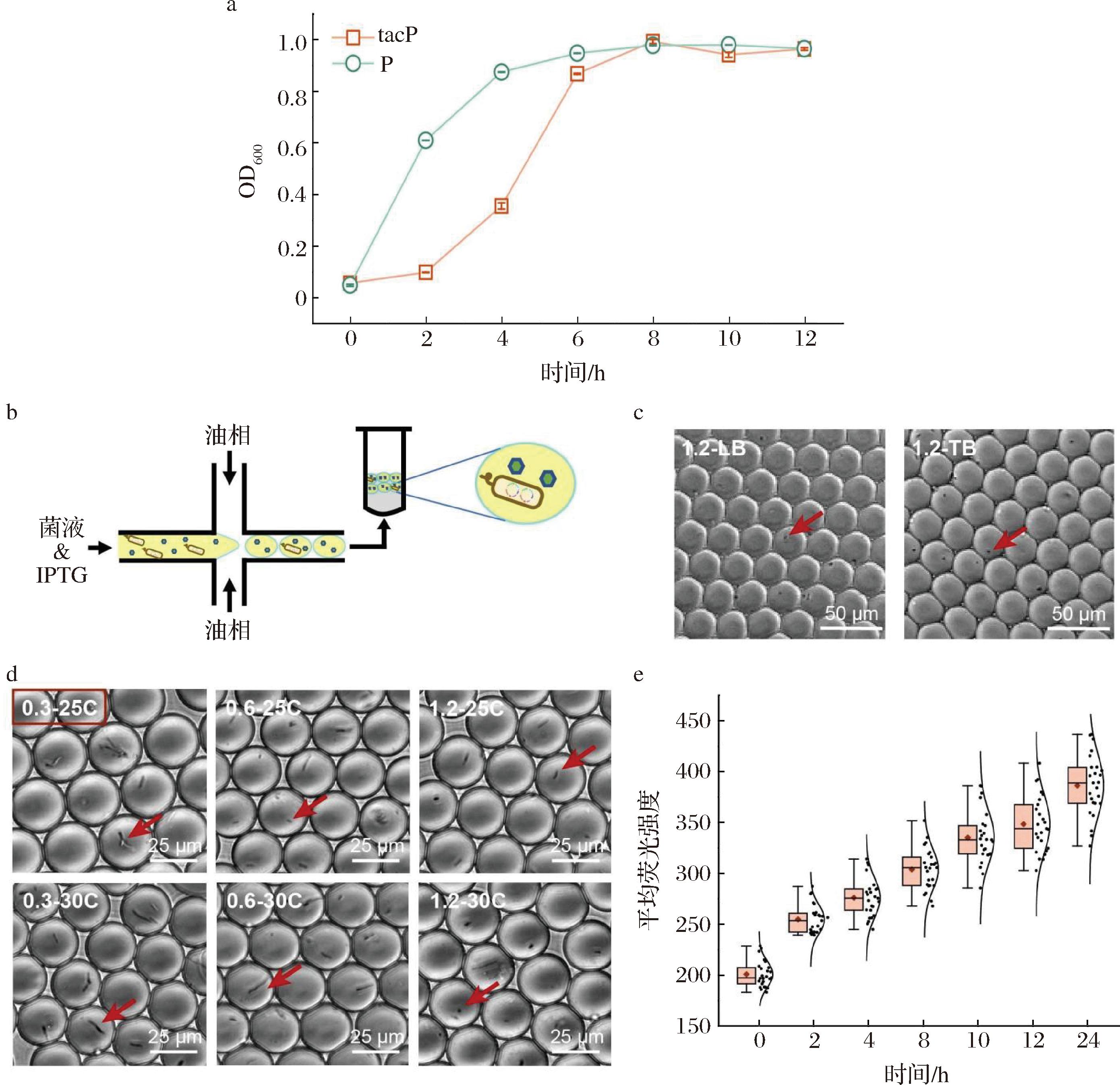
a-表达Phi29 pol时菌株tacP和菌株P的生长折线图;b-边培养边诱导方法的液滴包裹示意图;c-培养基成分优化对液滴中细胞生长的影响;d-诱导温度和诱导剂浓度优化对液滴中细胞生长的影响;e-0.3-25C组诱导表达的荧光强度箱线图
图2 边培养边诱导方法对重组融合蛋白表达的影响
Fig.2 Effect of the culture-while-inducing method on the expression of recombinant fusion proteins
2.2 液滴中传统诱导方法对重组融合蛋白表达的影响
2.2.1 边培养边诱导的表达方法对重组融合蛋白表达的影响
DNA聚合酶在细胞内异源表达时可能会与细胞竞争核酸底物,进而对细胞生长造成影响[24]。本研究首先使用组成型Ptac启动子和诱导型Ptac启动子分别在E.coli中进行Phi29 pol异源表达以验证该现象,将菌株tacP和菌株P分别进行发酵培养,转接进行二级培养,并每隔2 h测量OD600值。待菌株P的OD600=0.6时,加入1.2 mmol/L IPTG,将2种菌株同时转移于37 ℃恒温摇床(220 r/min)培养并测量OD600值。实验结果如图2-a,观察到在0~4 h菌株tacP的生长情况明显慢于菌株P。在2 h时对菌株P进行诱导后,观察到其生长变缓慢,说明Phi29 pol异源表达对细胞生长造成负担。随后,使用sfGFP作为报告蛋白,将其融合至Phi29 pol的N端,通过荧光强度表征蛋白表达量,展开了边培养边诱导的表达方法,考察培养基种类、温度以及诱导剂浓度等因素对Phi29 pol-sfGFP融合蛋白表达的影响。如示意图2-b所示,将菌株PG和诱导剂混合后进行单细胞封装,通过倒置荧光显微镜观察菌体生长情况和融合蛋白表达水平。数据显示(图2-c),当IPTG浓度为1.2 mmol/L,诱导温度为37 ℃时,在LB或TB培养基体系中均未观察到菌株PG的生长现象,说明细胞生长受到抑制,并且优化培养基成分无明显效果。进一步调整诱导条件发现,当诱导剂浓度降低至0.3 mmol/L、温度为25 ℃时,液滴内菌株出现较微弱的生长现象(图2-d)。在该条件下诱导至12 h时,单个液滴平均荧光信号强度达到349.5±23.3(图2-e)。
2.2.2 先诱导后包裹的表达方法对重组融合蛋白表达的影响
另一种常用的液滴中诱导表达方法为预先在摇瓶中完成酶的诱导表达,随后进行单细胞封装,后续可展开单细胞的信号检测。基于此,本研究首先进行了菌株PG的种子液培养,待二级种子液生物量达到对数中期(OD600=0.6)时,加入1.2 mmol/L IPTG诱导剂,于25 ℃恒温摇床(220 r/min)培养12 h完成胞内融合蛋白Phi29 pol-sfGFP的表达。随后,对完成诱导表达的菌液进行单细胞封装(图3-a)和荧光检测(图3-b)。定量分析表明,初始时单个液滴的平均荧光强度为305.1±9.5,继续在液滴中进行诱导培养,未观察到显著的荧光增长,12 h时单个液滴平均荧光强度为330±19.4。相较2.2.1节中边生长边诱导方法(12 h时为349.5±23.3),该方法蛋白表达均匀度有所提高,但蛋白表达量较低。
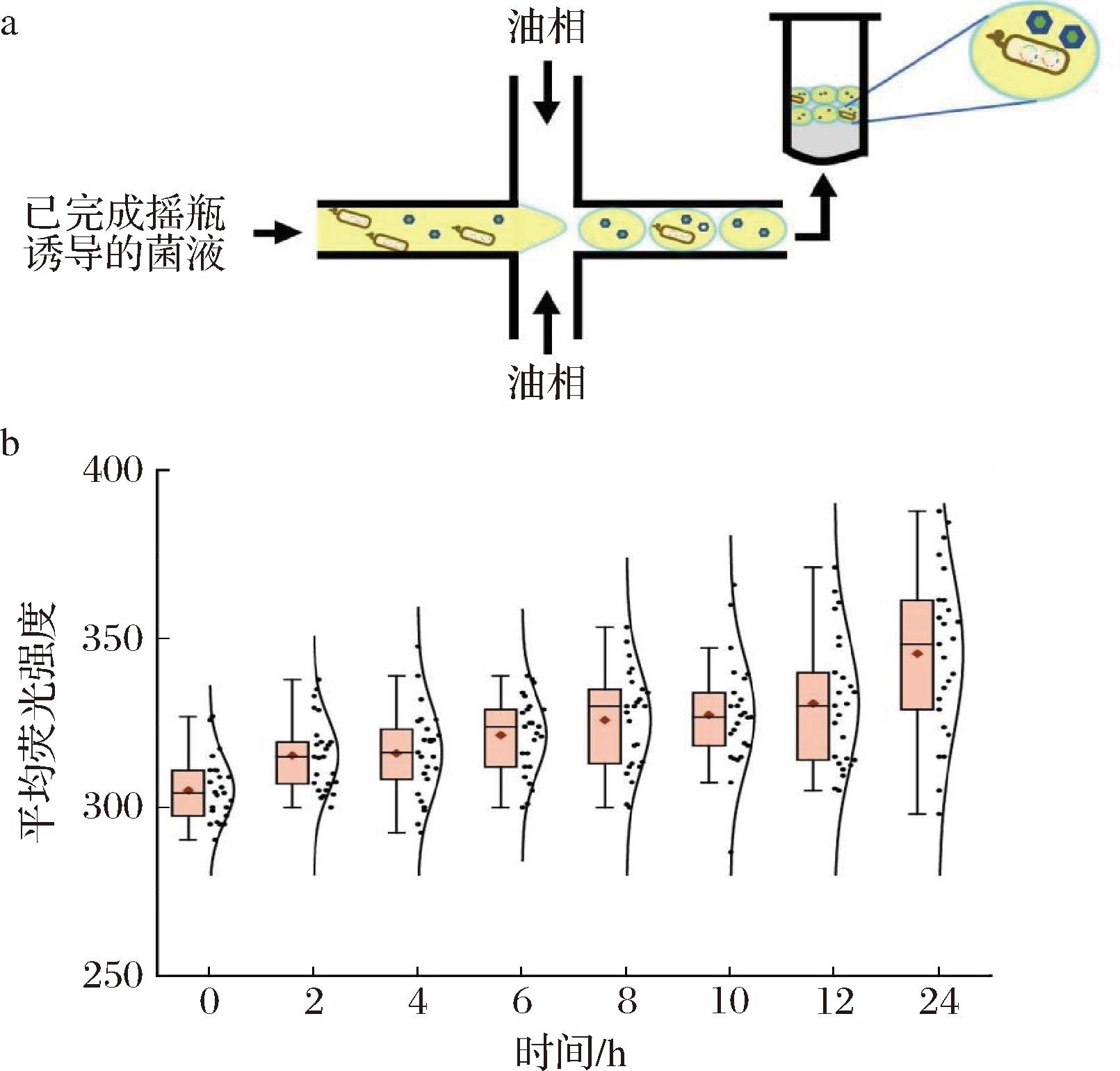
a-先诱导后包裹方法的液滴包裹示意图;b-先诱导后包裹方法的诱导表达荧光强度
图3 先诱导后包裹的表达方法对重组融合蛋白表达的影响
Fig.3 Enzyme-induced expression by induction followed by encapsulation
2.3 液滴中扩散诱导方法的初步验证
为了实现液滴中蛋白足量且均匀的诱导表达,本研究基于IPTG的独特双亲分子特性(兼具亲水基团和疏水基团)与自由扩散原理,提出了一种酶表达调控策略。其工作原理为:通过微流体芯片将单细胞与IPTG分别封装于独立液滴中,首先在适宜环境(37 ℃、220 r/min)中孵育细胞液滴,观察菌体生长至占据液滴体积约50%后,混合诱导液滴,利用分子跨相迁移特性,使IPTG从诱导液滴经油相介质逐步扩散至细胞液滴中,在tac启动子和lac操纵子的控制下,IPTG向细胞液滴的扩散可以激活目标基因表达(图4-a)。首先将菌株PG单细胞液滴分为2组,分别置于37 ℃恒温摇床培养12 h,向阳性对照组中直接添加1 μL浓度为1.2 mmol/L的IPTG,观察到在油相中形成直径为毫米级别的IPTG大液滴。经25 ℃、220 r/min培养后,1 μL大液滴破裂形成直径不均一的小液滴。空白对照组不加入IPTG,同样调整温度至25 ℃诱导12 h,并间隔2 h进行荧光拍照与定量分析。实验数据表明(图4-b、图4-c),空白对照组液滴信号无明显变化,阳性对照组液滴内荧光信号强度随诱导时间延长呈上升趋势,12 h时平均荧光值达790.5±166.3,证实了该方法可以实现Phi29 pol-sfGFP融合蛋白的有效表达。然而,荧光信号的高离散性(标准差166.3)说明蛋白表达水平差异较大。

a-扩散诱导方法的液滴包裹示意图;b-扩散诱导方法空白对照组的诱导表达荧光强度;c-扩散诱导方法阳性对照组的诱导表达荧光强度
图4 扩散诱导方法的可行性验证
Fig.4 Feasibility validation of diffusion-induced method
2.4 液滴中扩散诱导方法的诱导液滴比例优化
2.3节中结果存在较大的蛋白表达差异性,初步设想可能是由于IPTG在液滴中的扩散不均匀,造成局部饱和或局部浓度不足的现象。本研究进一步将IPTG进行液滴封装,获得具有较好的稳定性、单分散性并且直径均匀的液滴,命名为诱导液滴,将封装细菌的液滴命名为细胞液滴。随即探究了细胞液滴与诱导液滴的比例对诱导均一性的影响。通过液滴微流体精准操控,设定6组梯度比例,细胞液滴与诱导液滴的数量比例分别为1∶0(RA0)、1∶1(RA1)、5∶1(RA5)、20∶1(RA20)、100∶1(RA100)和1 000∶1(RA1000),设置扩散平衡后IPTG终浓度1.2 mmol/L。实验结果见图5,在低比例组中(如RA5组),其液滴平均荧光强度为734.2±76.5,荧光强度较低且标准差较高。这可能是由于诱导液滴过多,导致液滴堆积:部分细胞液滴被多个诱导液滴包围,而另一部分形成空白区。在高比例组中(如RA1000组),同样表现出较低的荧光强度和较高的标准差,可能是由于诱导液滴过少,随机分布导致部分细胞液滴周围缺乏诱导液滴。而当细胞液滴与诱导液滴比例为100∶1时(RA100组),液滴平均荧光强度为823±63.5,具有较高的荧光强度和较低的标准差,表现出良好的均衡性。与2.3节结果(790.5±166.3)相比,其离散度降低59%,表明了诱导均匀性的提高;荧光信号强度提升4.1%,表明更多细胞液滴处于适宜的诱导浓度范围内。综上所述,当细胞液滴与诱导液滴比例为100∶1时,诱导液滴数量适中,平衡了诱导剂供给与空间分布,避免了低比例下的局部过饱和或高比例下的随机缺失问题,最终实现Phi29 pol-sfGFP融合蛋白的均匀表达。
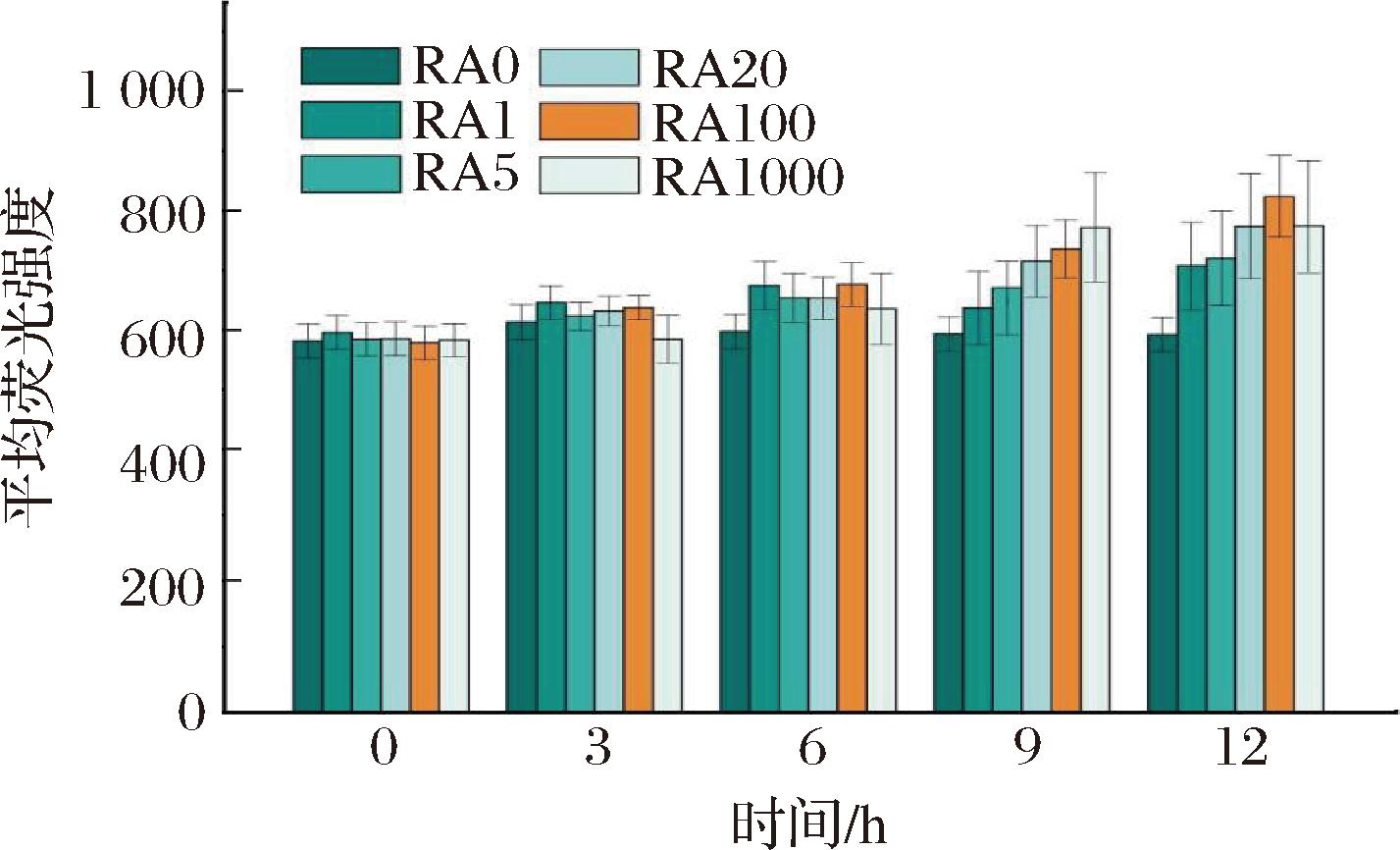
图5 扩散诱导方法中诱导剂液滴比例的优化
Fig.5 Optimization of the ratio of inducer droplets in diffusion-induced method
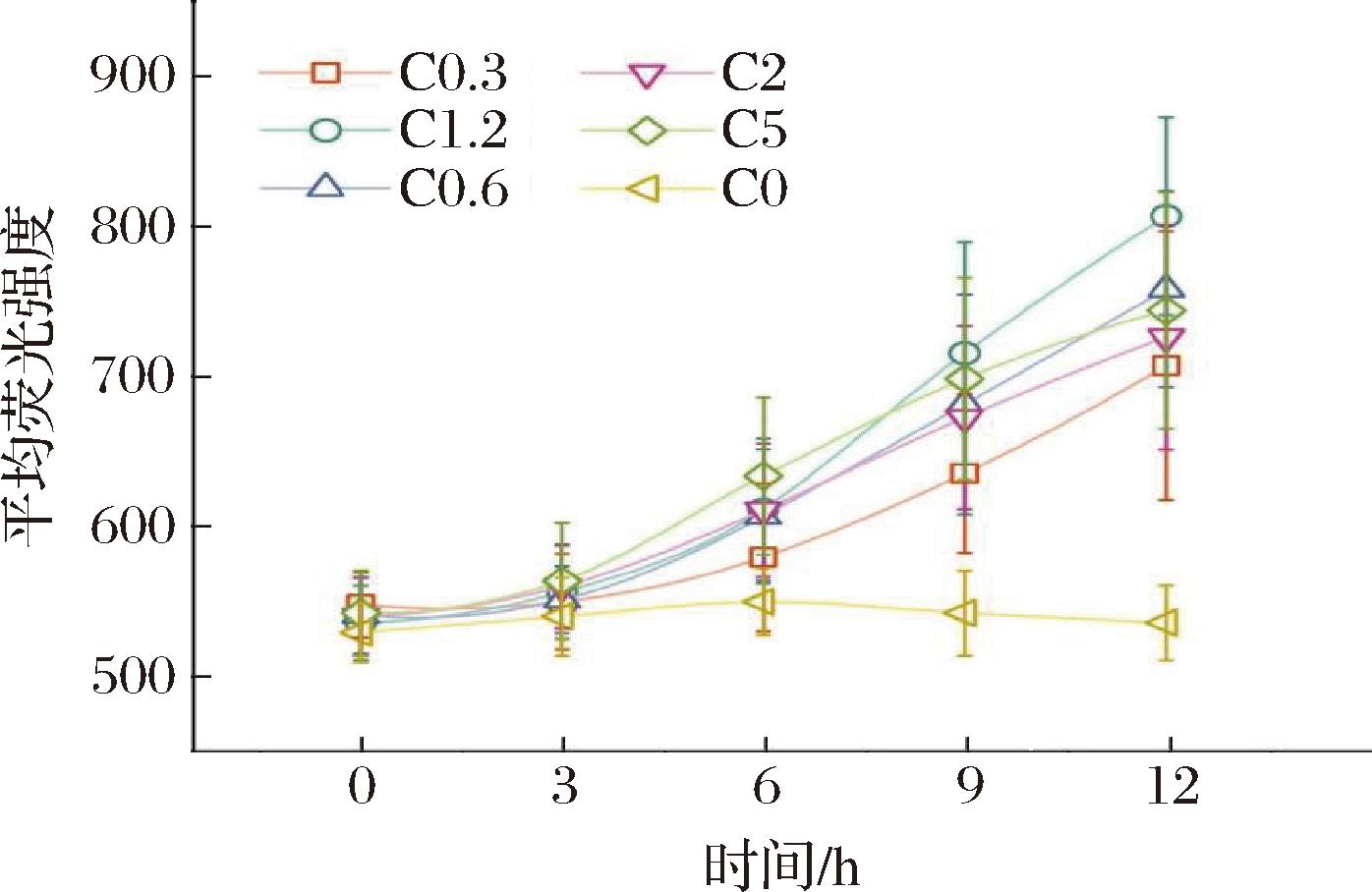
图6 扩散诱导方法中诱导剂浓度的优化
Fig.6 Optimization of inducer concentration in diffusion-induced method
2.5 液滴中扩散诱导方法的诱导剂浓度优化
进一步地,本研究对诱导液滴中IPTG的浓度进行了梯度优化,以探究IPTG浓度对蛋白诱导表达的影响,进而获得更高的蛋白表达量。在液滴比例为100∶1的基础上,设置IPTG终浓度分别为0、0.3、0.6、1.2、2、5 mmol/L(分别记为C0、C0.3、C0.6、C1.2、C2、C5组),观察到即使在0.3 mmol/L的低IPTG浓度下(C0.3组),系统仍可以诱导表达较多的蛋白(12 h时平均荧光强度为709.5±90),说明IPTG在液滴间能够进行较好的传输。在5 mmol/L的高浓度IPTG浓度下(C5组),观察到初始荧光值增加较快,12 h后增幅降低,最后平均荧光强度最低。可能是因为在初期高浓度诱导液滴中的IPTG分子扩散速度较快,诱导细胞表达大量蛋白;后期IPTG浓度过高,对细胞造成负担或液滴中营养物质消耗完毕,蛋白表达速度减缓,最终蛋白表达量不高。IPTG终浓度为1.2 mmol/L时(C1.2组),蛋白表达量于9 h后维持所有组别中的最高水平,12 h时平均荧光强度为833.5±66.1。最终,确定扩散诱导方法的IPTG终浓度为1.2 mmol/L,诱导时间为12 h。优化后的扩散诱导平均荧光强度是优化前(2.3节,平均荧光强度为790.5±166.3)的1.05倍,标准差降低了60%。与传统先诱导后包裹法(305.1±9.5)相比较,虽然其离散度增加,但处于液滴微流体误差接受范围内[25],并且其平均荧光强度较高,约为传统法的2.73倍。综上所述,该扩散诱导系统可以实现液滴中E.coli生长与Phi29 pol-sfGFP融合蛋白表达解偶联,且蛋白表达差异性较小,表达量高。
3 结论
本研究所构建的扩散诱导方法成功实现了单细胞尺度的动态调控,解决了液滴中毒性蛋白表达或高代谢负荷产物合成对细胞生长产生抑制的问题。其优势体现在:a)减缓代谢负担:菌株在无诱导压力下优先完成细胞生长,避免了毒性产物过早积累导致的生长抑制;b)动态均质化诱导:通过诱导液滴比例与诱导剂浓度优化,降低了蛋白表达的差异性,提高了蛋白表达量,为高通量筛选提供稳定的数据基础;c)通用性:该系统可适配多种两亲性诱导分子(如阿拉伯糖、四环素),为复杂代谢途径的精准操控提供了普适性平台。相关研究结果为建立定向进化Phi29 pol以改善其酶活性质的液滴微流体荧光酶活检测系统提供了方法基础。
[1] ZHANG Y, ZHANG X M, WANG M.Product-driven high-throughput screening of industrial filamentous actinomycetes[J].Trends in Biotechnology, 2023, 41(9):1109-1112.
[2] LEAVELL M D, SINGH A H, KAUFMANN-MALAGA B B.High-throughput screening for improved microbial cell factories, perspective and promise[J].Current Opinion in Biotechnology, 2020, 62:22-28.
[3] ZHANG J P, LI M L, REN D L, et al.High-throughput screening of probiotics in fermented foods and their potential application in alleviating alcohol-induced damage[J].Food &Function, 2025, 16(6):2564-2576.
[4] AUTOUR A, RYCKELYNCK M.Ultrahigh-throughput improvement and discovery of enzymes using droplet-based microfluidic screening[J].Micromachines, 2017, 8(4):128.
[5] CHRISTENSEN A S, SKOV S H, LENDAL S E, et al.Quantifying the human milk oligosaccharides 2’-fucosyllactose and 3-fucosyllactose in different food applications by high-performance liquid chromatography with refractive index detection[J].Journal of Food Science, 2020, 85(2):332-339.
[6] ZENG Z K, TIAN J J, REN Z X, et al.Digital droplet immunoassay based on a microfluidic chip with magnetic beads for the detection of prostate-specific antigen[J].Journal of Separation Science, 2023, 46(24):e2300471.
[7] NAJAH M, GRIFFITHS A D, RYCKELYNCK M.Teaching single-cell digital analysis using droplet-based microfluidics[J].Analytical Chemistry, 2012, 84(3):1202-1209.
[8] KINTSES B, HEIN C, MOHAMED M F, et al.Picoliter cell lysate assays in microfluidic droplet compartments for directed enzyme evolution[J].Chemistry &Biology, 2012, 19(8):1001-1009.
[9] 贺秀丽, 侍亚敏, 谢鑫, 等.基于液滴微流控技术选育超高浓酿造啤酒酵母菌株[J].食品与发酵工业, 2023, 49(19):105-111.HE X L, SHI Y M, XIE X, et al.Breeding of very high gravity brewing strains based on droplet microfluidic technology[J].Food and Fermentation Industries, 2023, 49(19):105-111.[10] SONG J, ZHUANG M M, FANG Y, et al.Self-regulated efficient production of L-threonine via an artificial quorum sensing system in engineered Escherichia coli[J].Microbiological Research, 2024, 284:127720.
[11] WEYERS C, DINGLE L M K, WILHELMI B S, et al.Use of a non-hepatic cell line highlights limitations associated with cell-based assessment of metabolically induced toxicity[J].Drug and Chemical Toxicology, 2020, 43(6):656-662.
[12] DRUSEIKIS M E, COVO S.Synthetic lethality between toxic amino acids, RTG-target genes and chaperones in Saccharomyces cerevisiae[J].Yeast, 2024, 41(9):549-559.
[13] YUAN H L, TU R, TONG X W, et al.Ultrahigh-throughput screening of industrial enzyme-producing strains by droplet-based microfluidic system[J].Journal of Industrial Microbiology and Biotechnology, 2022, 49(3):kuac007.
[14] STEPHENSON W.High-throughput magnetic particle washing in nanoliter droplets using serial injection and splitting[J].Micro and Nano Systems Letters, 2018, 6(1):3.
[15] SIEDLIK M J, ISSADORE D.Pico-washing:Simultaneous liquid addition and removal for continuous-flow washing of microdroplets[J].Microsystems &Nanoengineering, 2022, 8:46.
[16] CHAN H F, MA S, TIAN J, et al.High-throughput screening of microchip-synthesized genes in programmable double-emulsion droplets[J].Nanoscale, 2017, 9(10):3485-3495.
[17] AKAMATSU K, KANASUGI S, NAKAO S I, et al.Membrane-integrated glass capillary device for preparing small-sized water-in-oil-in-water emulsion droplets[J].Langmuir, 2015, 31(25):7166-7172.
[18] SEBBEN D A, MACWILLIAMS S V, YU L, et al.Influence of aqueous phase composition on double emulsion stability and colour retention of encapsulated anthocyanins[J].Foods, 2022, 11(1):34.
[19] MA S H, SHERWOOD J M, HUCK W T S, et al.The microenvironment of double emulsions in rectangular microchannels[J].Lab on a Chip, 2015, 15(10):2327-2334.
[20] ZIZZARI A, ARIMA V.Glass microdroplet generator for lipid-based double emulsion production[J].Micromachines, 2024, 15(4):500.
[21] LOU C B, STANTON B, CHEN Y J, et al.Ribozyme-based insulator parts buffer synthetic circuits from genetic context[J].Nature Biotechnology, 2012, 30(11):1137-1142.
[22] YU H B, WANG Z, XU H Y, et al.A method for absolute protein expression quantity measurement employing insulator RiboJ[J].Engineering, 2018, 4(6):881-887.
[23] MAZUTIS L, GILBERT J, UNG W L, et al.Single-cell analysis and sorting using droplet-based microfluidics[J].Nature Protocols, 2013, 8(5):870-891.
[24] LAKSMI F A, NURYANA I, VIVID C, et al.Autoinduction expression of Bst DNA polymerase using lac operon-controlled expression systems in Escherichia coli[J].IOP Conference Series:Earth and Environmental Science, 2023, 1255(1):012050.
[25] SUN G Y, WU Y K, HUANG Z Y, et al.Directed evolution of diacetylchitobiose deacetylase via high-throughput droplet sorting with a novel, bacteria-based biosensor[J].Biosensors and Bioelectronics, 2023, 219:114818.