红茶菌是经由复合微生物发酵制得的饮品,蕴含丰富的生物活性组分,涵盖有机酸、醇类化合物、糖类物质、茶多酚、生物碱以及多种维生素与矿物质元素等[1],使其在调节人体生理机能及疾病预防与治疗领域展现出良好的功效。目前红茶菌功能的研究焦点主要集中在抗氧化与抑菌两大特性上[2]。研究表明,茶叶中的多酚成分与红茶菌发酵过程中产生的抗菌蛋白及酸性物质,能够共同抑制细菌的生长[3]。茶多酚类物质及其发酵代谢产物,以及D-葡萄糖二酸-1,4-内酯、抗坏血酸、β-胡萝卜素以及B族和E族维生素等在抗氧化方面贡献显著[4-5]。
尽管目前针对红茶菌抗氧化活性的研究已颇为丰富,但大多围绕红茶菌的总酚含量、抗超氧阴离子能力、羟自由基清除率、DPPH自由基清除能力等指标展开,或提取其中的功能性物质进行抗氧化活性试验,尚未有研究在细胞层面深入探讨红茶菌的抗氧化功能[6-8]。鉴于此,本研究选取未发酵的糖茶水作为对照,对5种不同来源的红茶菌在发酵前后的变化进行探究,并对其特性进行系统比较。通过测定发酵液的pH值及绘制菌体生长曲线,综合评估不同来源红茶菌的发酵特性;同时,构建H2O2诱导的Caco-2细胞氧化应激模型,评价红茶菌缓解细胞氧化应激的能力,进而筛选出发酵性能优异且抗氧化活性显著的红茶菌,为后续红茶菌菌株的分离及红茶菌饮料发酵剂的重新构建提供科学依据和实践方向。
1 材料与方法
1.1 材料与试剂
实验所用红茶菌菌膜来源:新疆乌鲁木齐(XJ),广东湛江(GD),俄罗斯(RUS),陕西西安(SX),山东兖州(SD)。
人结直肠腺癌细胞Caco-2,来自中国海洋大学功能性乳品与益生菌工程研究室。
细胞DMEM(Dulbecco’s Modified Eagle Medium)高糖培养基、PBS,北京索莱宝科技有限公司;胎牛血清,以色列BI公司;青霉素链霉素溶液(100×)、胰蛋白酶、脂质氧化[丙二醛(malondialdehyde, MDA)]检测试剂盒、总超氧化物歧化酶(superoxide dismutase, SOD)活性检测试剂盒、BCA蛋白浓度测定试剂盒,上海碧云天技术有限公司;CCK-8试剂盒,上海爱必信生物科技有限公司;过氧化氢溶液,青岛莱博赛斯科技有限公司。
1.2 仪器与设备
-20 ℃冰箱、-80 ℃冰箱,青岛海尔特种电器有限公司;SW-CJ-JD超净工作台、BHC-1300IIA/B2生物洁净安全柜,苏州净化仪器有限公司;LDWZX-75KBS高压蒸汽灭菌锅,上海申安医疗器械有限公司;PB-10台式酸度计,北京赛多利斯仪器系统有限公司;CKX53SF倒置显微镜,日本奥林巴斯株式会社;LRH-250生化培养箱,上海一恒仪器有限公司;TGL-16M高速冷冻离心机,长沙东旺仪器有限公司;TGL-16M高速小容量离心机,上海卢湘仪离心机有限公司;Bio Tek PowerWave XS酶标仪,美国博腾仪器有限公司;MW80二氧化碳培养箱,赛默飞世尔仪器有限公司;DK-98-Ⅱ A恒温水浴锅,天津市泰斯特仪器有限公司;FA2204B电子天平,上海天美天平仪器有限公司。
1.3 实验方法
1.3.1 糖茶水的制备
将发酵罐在121 ℃下灭菌15 min;称取5 g红茶,放入烧杯,加开水(85~90 ℃)500 mL,浸泡15 min左右;用滤网将红茶水过滤到1 000 mL锥形瓶中;称取50 g白砂糖加入红茶水中,待糖完全溶解后,99 ℃水浴灭菌10 min。灭菌后冷却备用。
1.3.2 红茶菌菌膜的活化
取前期收集保存的5种红茶菌菌膜(接种量为5%)接种于500 mL已准备好的红茶糖茶水中;封口加盖:用无菌纱布及盖子封口;静置避光发酵:30 ℃静置培养,周期为3 d;菌膜连续活化3次,每次活化时,测定发酵第0天和第3天发酵液的pH,保留红茶菌菌液。
1.3.3 红茶菌发酵与生长特性
1.3.3.1 红茶菌接种发酵
取前期活化完成的红茶菌菌液,接种(接种量为1%)于500 mL已准备好的红茶糖茶水中;封口加盖:用无菌纱布及盖子封口;静置避光发酵:30 ℃静置培养,发酵周期为7 d。
1.3.3.2 pH值测定
从发酵第0天开始,检测红茶菌发酵液pH值。
1.3.3.3 菌体生长曲线的制作
红茶菌开始培养后,每天分别取1 mL样品,按200 μL/孔吸至96孔板中,每个样品做3个复孔。采用酶标仪测定红茶菌发酵过程中微生物的生长动态,以培养时间(d)为横坐标,600 nm处的吸光度值(OD600值)为纵坐标,绘制生长曲线。
1.3.4 Caco-2细胞培养及氧化应激模型的建立
1.3.4.1 Caco-2细胞来源与培养
Caco-2细胞株接种于DMEM完全培养基[10%胎牛血清(体积分数),1%(体积分数)青霉素-链霉素溶液],置于37 ℃,5%(体积分数)CO2的恒温培养箱中培养。每天观察细胞状态,当细胞密度达到80%时进行细胞传代。
1.3.4.2 Caco-2细胞氧化应激模型的建立
以DEPC水为溶剂配制200 mmol/L的H2O2母液,使用无血清细胞培养基将母液稀释至所需浓度,确保现配现用。将处于对数生长期的Caco-2细胞以1×105个/mL的密度接种至96孔板中,每孔加入100 μL细胞悬液。待细胞完全贴壁生长后,移除原培养基。实验处理分为3组:实验组每孔加入100 μL不同浓度的H2O2溶液(浓度分别为50、100、200、400、600、700、800 μmol/L);对照组和空白组每孔加入100 μL无血清DMEM培养基,其中空白组不接种细胞。每组设置4个复孔以提高实验的可靠性。培养24 h后,弃去旧培养基,并向每孔加入100 μL的10%(体积分数)CCK-8溶液。将96孔板置于37 ℃培养箱中培养2 h。使用酶标仪在450 nm处测定各孔的吸光度值,细胞存活率的计算如公式(1)所示:
细胞存活率![]()
(1)
1.3.5 红茶菌干预Caco-2细胞氧化应激效果
1.3.5.1 红茶菌干预Caco-2细胞的体积分数筛选
在发酵第4天收集不同来源的红茶菌发酵液,使用0.22 μm的无菌滤膜过滤除菌。以无血清DMEM培养基为稀释剂,将发酵液配制成6个体积分数,分别为2.5%、5%、10%、20%、40%、80%,确保每个体积分数都是现配现用。将处于对数生长期的Caco-2细胞以1×105个/mL的密度接种到96孔板中,每孔加入100 μL细胞悬液。待细胞完全贴壁生长后,移除原培养基。实验处理分为3组:实验组每孔加入100 μL不同体积分数的红茶菌发酵液;对照组(control)和空白组每孔加入100 μL无血清DMEM培养基,其中空白组不接种细胞。为确保实验的可靠性,每组设置4个复孔。培养24 h后,弃去旧的培养基,每孔加入100 μL的10% CCK-8溶液。将96孔板置于37 ℃培养箱中培养2 h。使用酶标仪在450 nm处测定各孔的吸光度值。细胞存活率计算同1.3.4.2节。
1.3.5.2 细胞存活率的测定
将处于对数生长期的Caco-2细胞以1×105个/mL的密度接种到96孔板中,每孔加入100 μL细胞悬液。将96孔板置于37 ℃、5%CO2的培养箱中进行培养至细胞完全贴壁,移除原培养基。实验处理分为3组:实验组每孔加入100 μL含有终浓度为600 μmol/L H2O2和不同来源红茶菌发酵液的混合液;对照组(control)和空白组每孔加入100 μL无血清DMEM培养基,其中空白组不接种细胞。为确保实验的可靠性,每组设置4个复孔。培养24 h后,弃去旧的培养基,每孔加入100 μL的10% CCK-8溶液。将96孔板置于37 ℃培养箱中培养2 h。使用酶标仪在450 nm波长处测定各孔的吸光度值。细胞存活率计算同1.3.4.2节。
1.3.5.3 脂质过氧化物MDA的测定
将处于对数生长期的Caco-2细胞以2×105个/mL的密度接种到6孔板,每孔2 mL,置于37 ℃、5% CO2 培养箱中培养至细胞完全贴壁。吸去原培养基分别进行处理:实验组、空白组和对照组(control)所加样品及浓度同1.3.5.2节每孔2 mL,每组各设3个复孔。按照碧云天MDA检测试剂盒说明书进行操作。用BCA蛋白浓度测定试剂盒测定各样品的蛋白浓度,用于后续计算。
1.3.5.4 SOD的测定
将Caco-2细胞按2×105个/mL的密度接种于6孔板,每孔2 mL,置于37 ℃、5%CO2培养箱中培养至细胞完全贴壁。吸去原培养基分别进行处理:实验组、空白组和对照组(control)所加样品及浓度同1.3.5.2节每孔2 mL,每组各设3个复孔。按照碧云天总SOD活性检测试剂盒(WST-8法)说明书进行操作,通过比色检测细胞样品中的SOD活性。用BCA蛋白浓度测定试剂盒测定各样品的蛋白浓度,用于后续计算。
1.4 数据分析
所有实验均进行至少3次重复,所得数据均以“平均值±标准差”的形式予以呈现。数据处理工作借助IBM SPSS Statistics 26软件完成,采用单因素方差分析(one-way ANOVA)方法对各组之间的差异进行统计比较。对于那些存在显著性差异的组别,进一步运用Duncan多重比较检验来进行两两之间的细致比较。当P<0.05时,认为差异具有统计学意义。实验结果的图表绘制全部采用Origin 2021软件完成。
2 结果与分析
2.1 不同来源红茶菌发酵过程中pH值的变化
不同来源的红茶菌在发酵7 d内pH值的变化如图1所示,未经发酵的糖茶水(tea,TEA)在发酵7 d内pH值基本保持在4.81~5.08,变化幅度很小,可能是茶叶本身含有的物质溶出所致。而其余5组不同来源的红茶菌发酵液pH值均随发酵时间的延长而下降。其中红茶菌XJ相较其余4组更加迅速,红茶菌XJ发酵至第4天时pH值就达到3.41±0.06,在发酵第7天时pH值降为3.15±0.04。红茶菌发酵过程可分为2个阶段,酵母菌发酵阶段和醋酸菌发酵阶段,其中醋酸菌发酵阶段会将酵母菌发酵阶段产生的乙醇转化为乙酸,使发酵液pH值降低,pH值在发酵后期趋于平缓是因为发酵产生的CO2溶于水产生HCO3-,HCO3-对发酵液起到了缓冲作用[9]。红茶菌pH值的变化主要与醋酸菌有关[10]。葡糖杆菌属(Gluconobacter)是产生有机酸的重要菌属,能促进醇类和酯类等芳香类物质的形成[11]。课题组对红茶菌XJ菌群组成进行分析[12],发现葡糖杆菌属是样品中丰度最高的细菌菌属,丰度占比高达56.38%。乙酸浓度还与木糖驹形氏杆菌属(Komagataeibacter)呈正相关[13],在红茶菌XJ中丰度占比为34.04%,在细菌丰度排名中居于第二。因此,较高含量的葡糖杆菌属和木糖驹形氏杆菌属可能是导致红茶菌XJ pH值较低的原因。
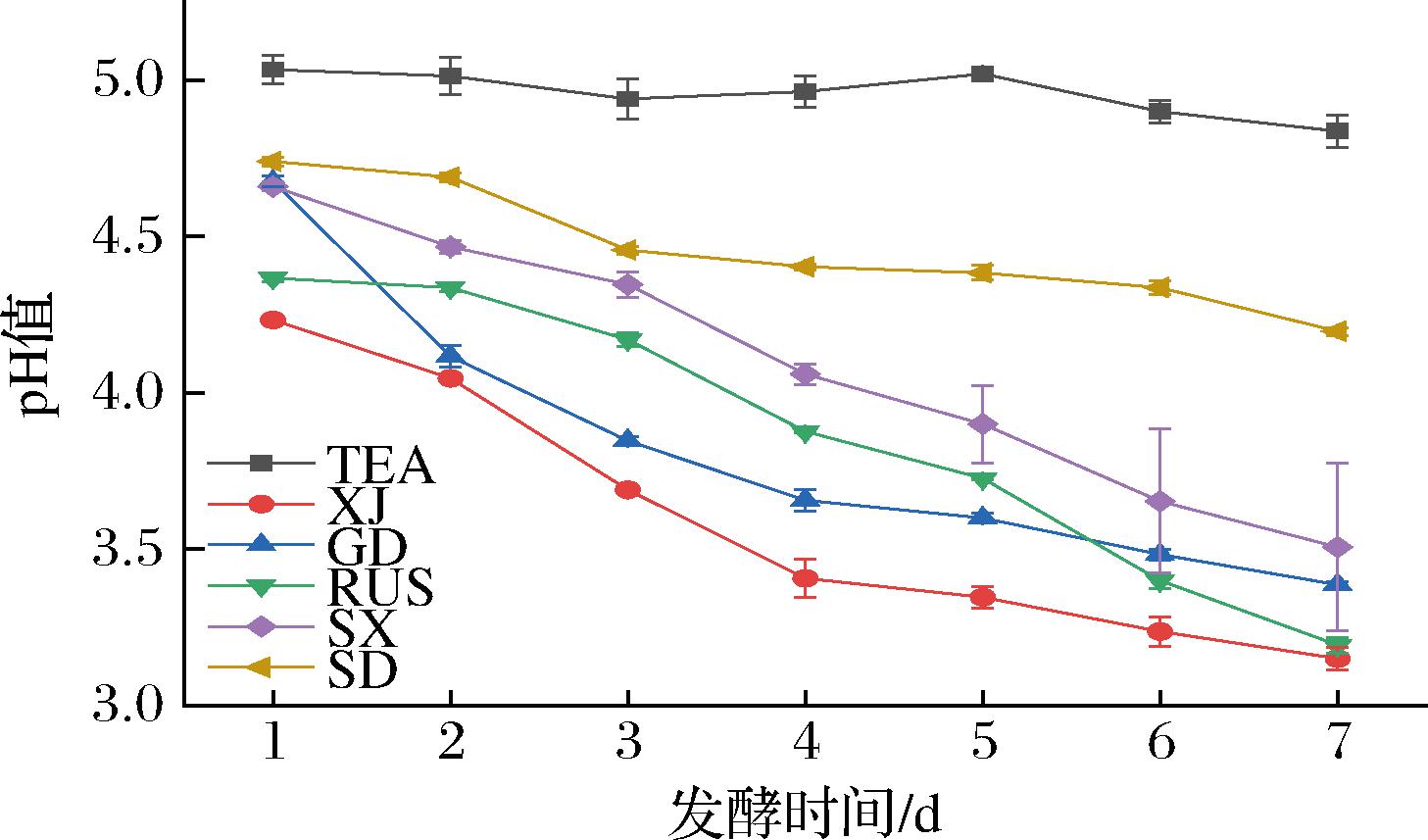
图1 不同来源红茶菌pH值随发酵时间的变化
Fig.1 Changes in pH of Kombucha in different regions with fermentation time
2.2 不同来源红茶菌发酵过程中生物量的变化
不同来源红茶菌发酵过程中生物量的变化如图2所示。TEA在发酵过程中没有微生物对其中的营养物质进行代谢消耗,因此OD600值基本不变,维持在0.068±0.00。红茶菌GD和红茶菌XJ在发酵第4天达到OD600最大值,之后菌体浓度开始下降。而红茶菌RUS、红茶菌SX和红茶菌SD在发酵第5天才达到OD600最大值。据报道,红茶菌中的细菌和酵母数量会在发酵前期迅速增加,然后逐渐减少,直到发酵结束[14-15]。这与本研究红茶菌菌体数量先上升后下降的趋势相一致。

图2 不同来源红茶菌OD600值随发酵时间的变化
Fig.2 Changes in OD600 value of Kombucha in different regions with fermentation time
红茶菌的微生物组成会随发酵阶段产生变化,这可能与菌膜来源、气候、地理位置和用于发酵过程的培养基等因素有关[16-17]。多数研究发现不同红茶菌发酵液中最丰富的细菌种类相同,但酵母种群差异最大[18]。本课题组前期研究也有相似发现[12],红茶菌GD和红茶菌XJ在细菌菌属层面有较大相似性,但在真菌菌属层面有差异。红茶菌GD中相对丰度排名第一的优势真菌属为Filobasidium,相对丰度为52.68%,在LI等[19]对腌制芥菜块茎减盐腌制过程的研究中,Filobasidium被推断为发酵过程中的核心功能菌群,且与主要风味成分的形成密切相关;第二大优势真菌属是德克酵母属(Dekkera),相对丰度为37.93%,德克酵母属具有一定的酒精发酵能力,能够耐受较高的酒精浓度,在有氧状态下有极强的产醋酸能力,而且具有一定的产膜能力[20]。而红茶菌XJ相对丰度最高的属为Starmerella。红茶菌GD和红茶菌XJ优势酵母种类差异较大,这可能是红茶菌GD与红茶菌XJ在发酵特性上存在差异的重要原因。
2.3 Caco-2细胞氧化应激模型的建立
氧化应激的模型种类较多,常以H2O2做诱导剂[21]。图3展示了不同浓度H2O2对Caco-2细胞存活率的影响。在H2O2浓度为50~200 μmol/L时,细胞存活率呈现上升趋势,且存活率数值超过100%,表明在这个浓度范围内H2O2对细胞并未产生不利影响。然而,当H2O2浓度超过200 μmol/L后,细胞存活率开始随H2O2浓度的增加而逐渐下降。特别是在H2O2浓度为600 μmol/L时,细胞存活率降低至63.3%,此浓度下的细胞存活率最接近半抑制浓度,这与蔡茜茜等[22]的研究结果相近。因此,在后续的实验中,将选择600 μmol/L的H2O2作为诱导剂,用于建立Caco-2细胞氧化应激模型。
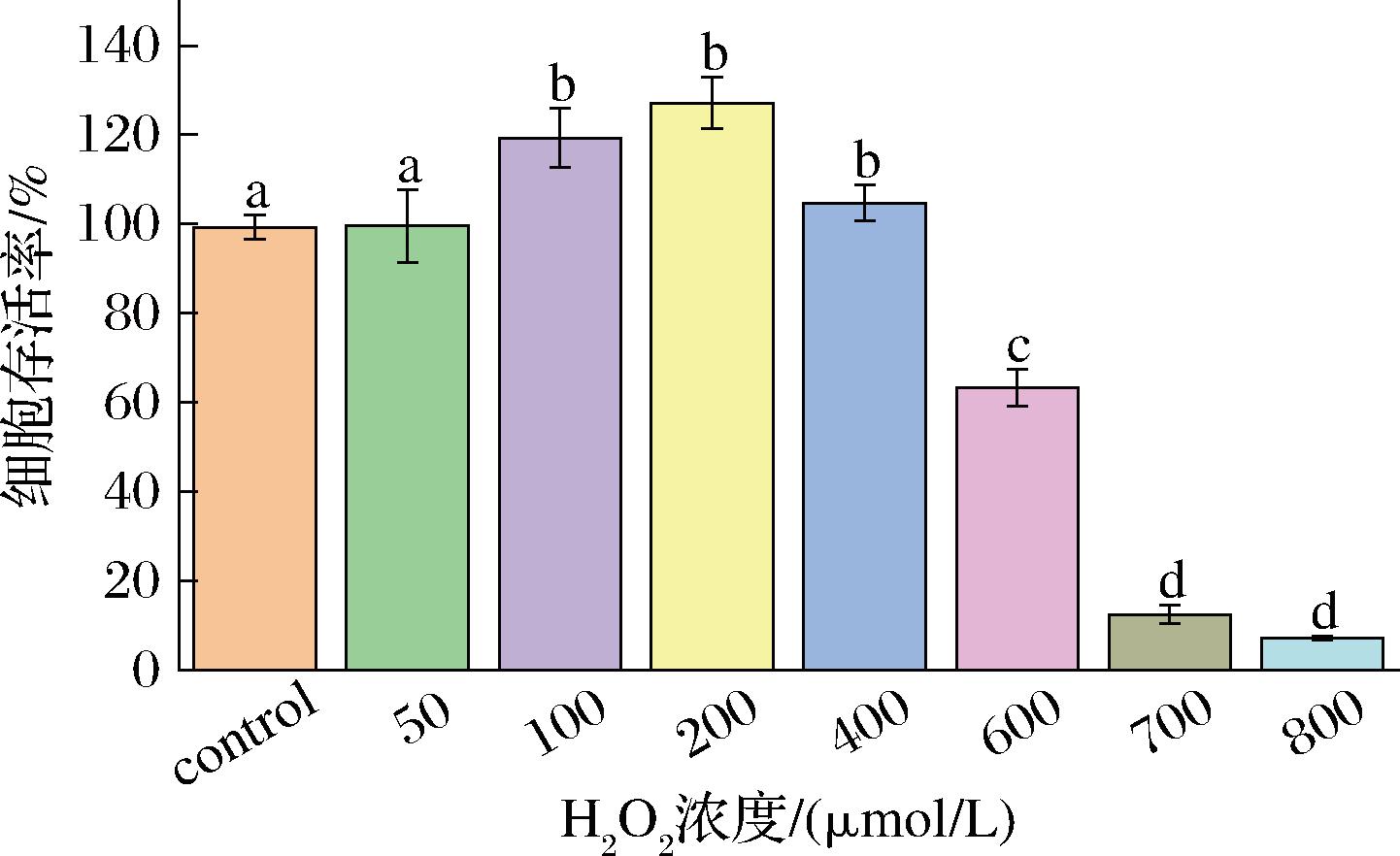
图3 不同浓度H2O2对Caco-2细胞存活率的影响
Fig.3 Effect of different concentrations of H2O2 on cell viability
注:图中不同字母表示各组之间存在显著性差异(P<0.05)(下同)。
2.4 红茶菌发酵液干预体积分数的筛选
由图1可知,红茶菌发酵液pH值较低,用发酵液直接干预细胞会导致细胞大量死亡,但研究显示红茶菌缓解氧化应激的能力可能与酸类物质有关[23]。因此本研究选择将发酵液稀释为不同体积分数,既可以稀释发酵液中的酸性物质,又能确保潜在功效物质不被破坏。红茶菌XJ和红茶菌RUS的pH值最低,用这2个样品进行干预体积分数的筛选。结果见图4,Caco-2细胞经不同来源红茶菌发酵液干预后,细胞存活率随红茶菌发酵液体积分数的增加而下降。当发酵液体积分数为2.5%时,2个来源的红茶菌发酵液干预后,细胞存活率分别为97.15%和90.33%,与对照组无显著性差异,当体积分数升高至5%~80%,细胞存活率随体积分数升高而下降,且具有显著性差异。当体积分数为2.5%时,pH值最低的2个红茶菌发酵液未对细胞产生毒性,因此其他红茶菌发酵液也不会因酸度对细胞产生毒性。因此后续实验选择2.5%为红茶菌发酵液的最终干预体积分数。
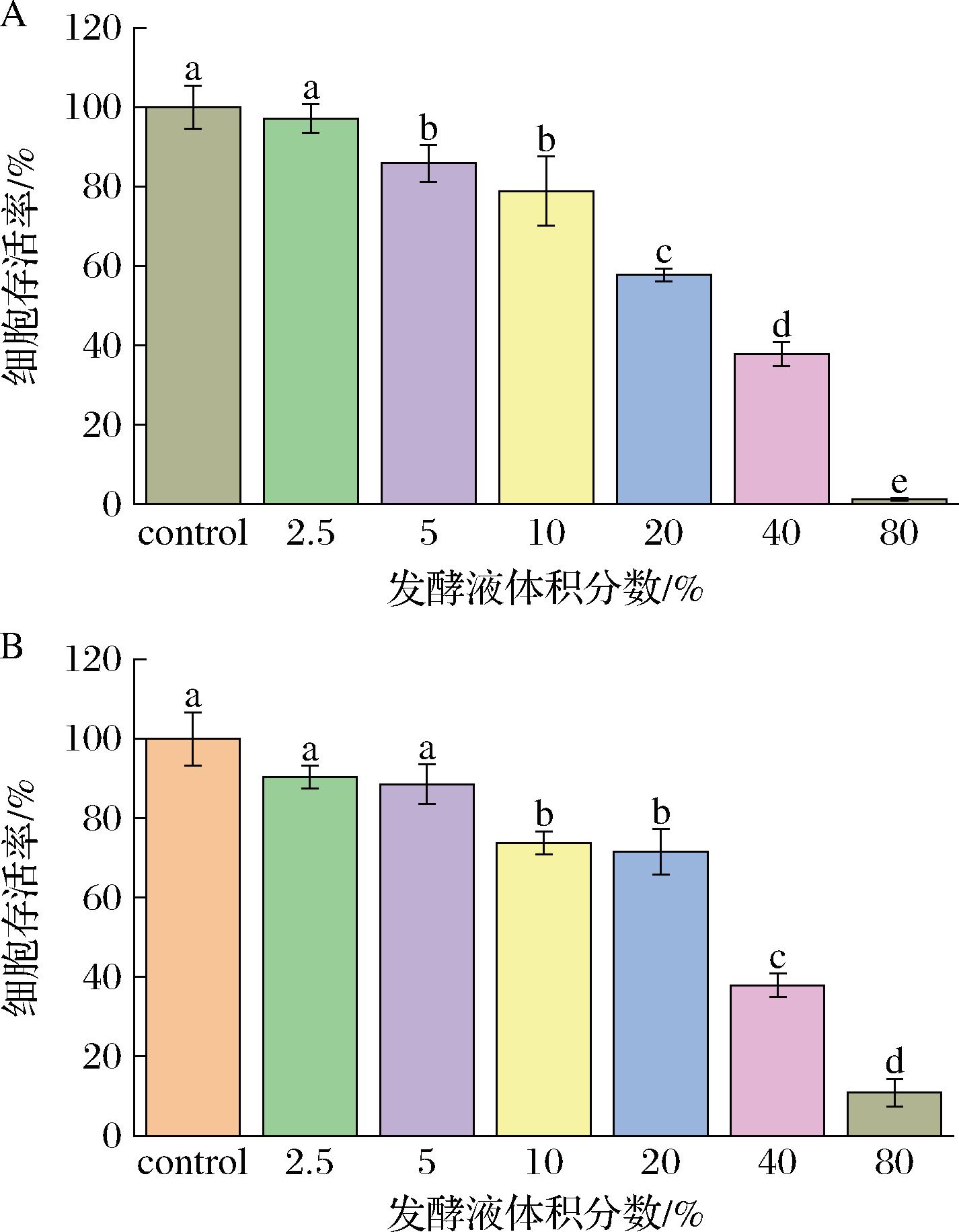
A-产地为新疆的红茶菌发酵液XJ对Caco-2细胞存活率的影响;B-产地为俄罗斯的红茶菌发酵液RUS对Caco-2细胞存活率的影响
图4 不同体积分数红茶菌发酵液对Caco-2细胞存活率的影响
Fig.4 Effect of different concentrations of Kombucha on the viability of Caco-2 cells
2.5 不同来源红茶菌发酵液对Caco-2细胞存活率的影响
不同来源红茶菌发酵液对Caco-2细胞存活率的影响结果如图5所示。模型组(H2O2)由于加入600 μmol/L的H2O2,导致Caco-2细胞产生氧化应激,存活率下降至51.97%。TEA和5个地区的红茶菌发酵液均能够缓解H2O2造成的氧化应激,其中产地广东的红茶菌GD能够将细胞存活率调整为73.1%,且与H2O2组相比有具有显著性上升(P<0.05)。
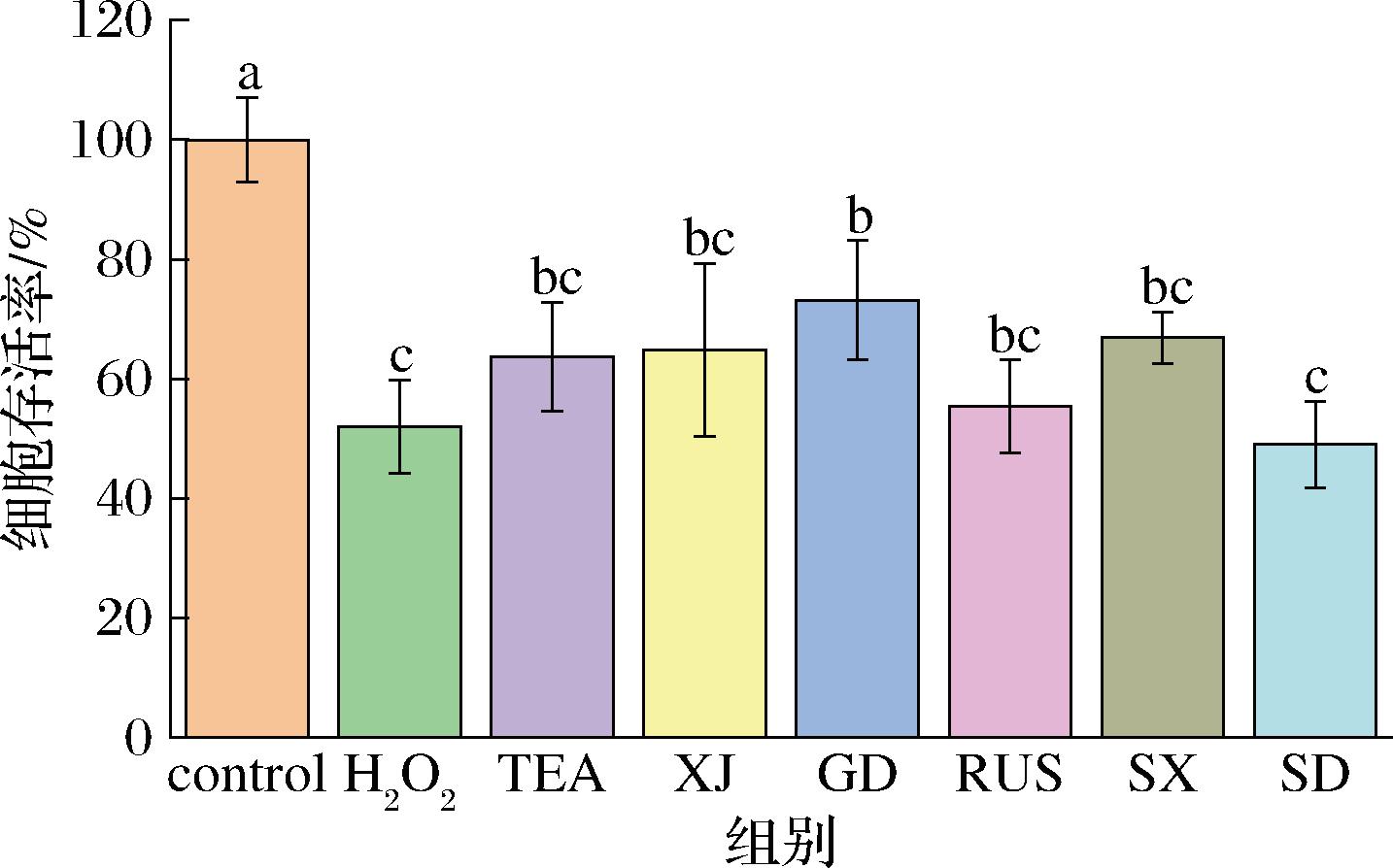
图5 不同来源红茶菌发酵液对Caco-2细胞存活率的影响
Fig.5 Effects of different Kombucha on the viability of Caco-2 cells
2.6 不同来源红茶菌发酵液对Caco-2细胞MDA含量的影响
不同产地红茶菌发酵液对Caco-2细胞中MDA含量的影响如图6所示,模型组(H2O2)产生的MDA相对含量是control组的2.24倍,这是因为H2O2的干预导致细胞产生大量自由基,细胞中过量自由基积累引起氧化反应,使细胞膜和细胞器中的多不饱和脂肪酸过氧化生成终产物MDA,MDA会与蛋白质、核酸等大分子结合影响生理功能[24-25]。经红茶菌发酵液干预后,Caco-2细胞内MDA含量出现不同程度的降低,其中红茶菌GD能够显著降低细胞中MDA含量(P<0.05)。这说明红茶菌尤其是GD可以通过降低细胞内脂质氧化的程度,进而缓解由H2O2带来的Caco-2细胞氧化损伤。
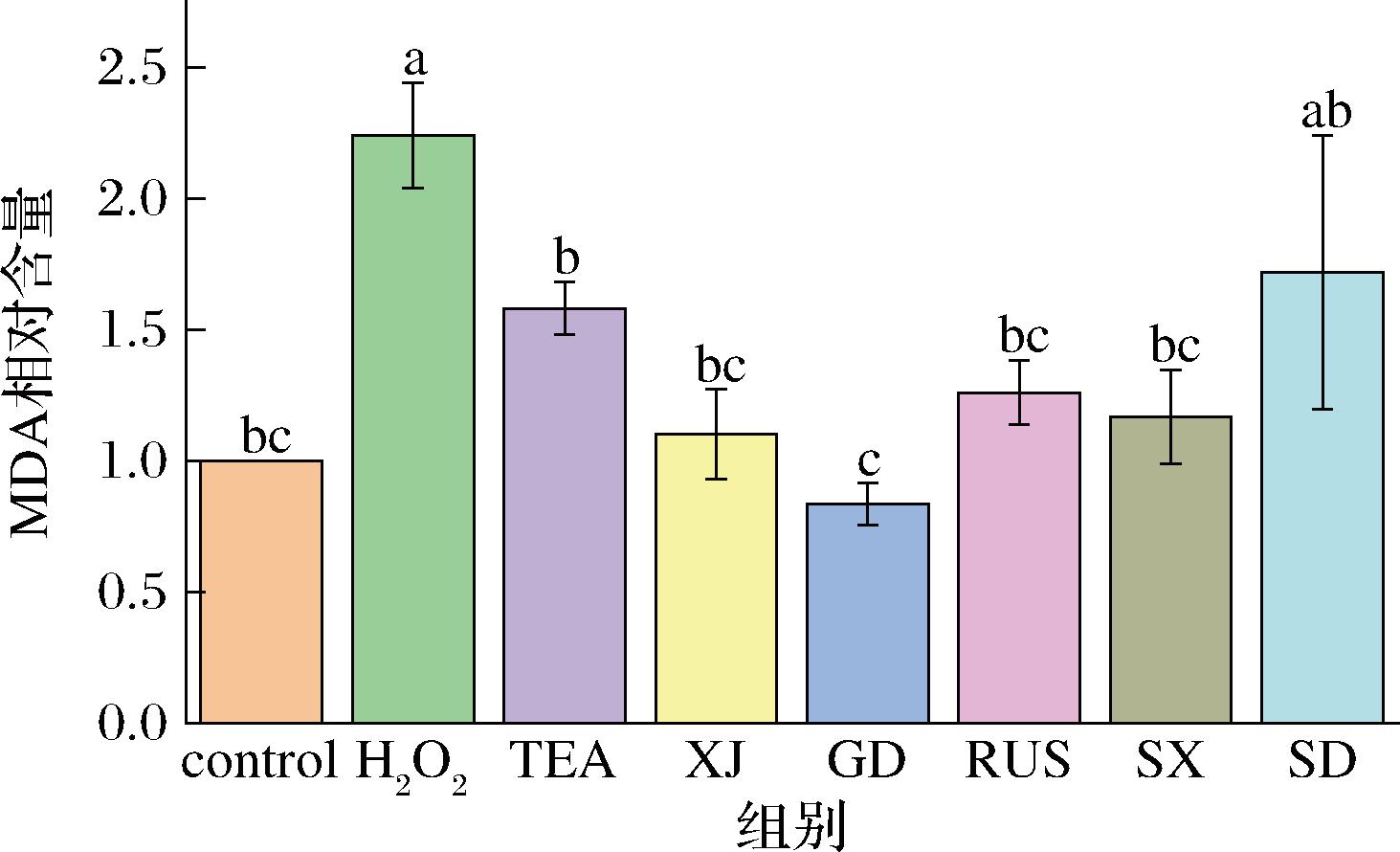
图6 不同来源红茶菌发酵液对Caco-2细胞MDA含量的影响
Fig.6 Effect of Kombucha in different regions on MDA contents of Caco-2 cells
2.7 不同来源红茶菌发酵液对Caco-2细胞SOD活性的影响
SOD是生物体内抗氧化酶系的重要组成成员,它能够催化超氧阴离子歧化生成氧和过氧化氢,在机体氧化平衡中起至关重要作用。通过测定其酶活性可以判断体内氧化应激水平[26]。不同来源红茶菌发酵液对SOD活性的影响如图7所示,模型组(H2O2)由于氧化应激,SOD活性显著低于对照组(control),而TEA和其他5组红茶菌发酵液均能够显著提高SOD活性水平,其中红茶菌XJ和红茶菌GD组SOD活性水平最高,说明这2组能够有效缓解过氧化氢造成的氧化损伤,这与2.5节和2.6节的结果相对应。
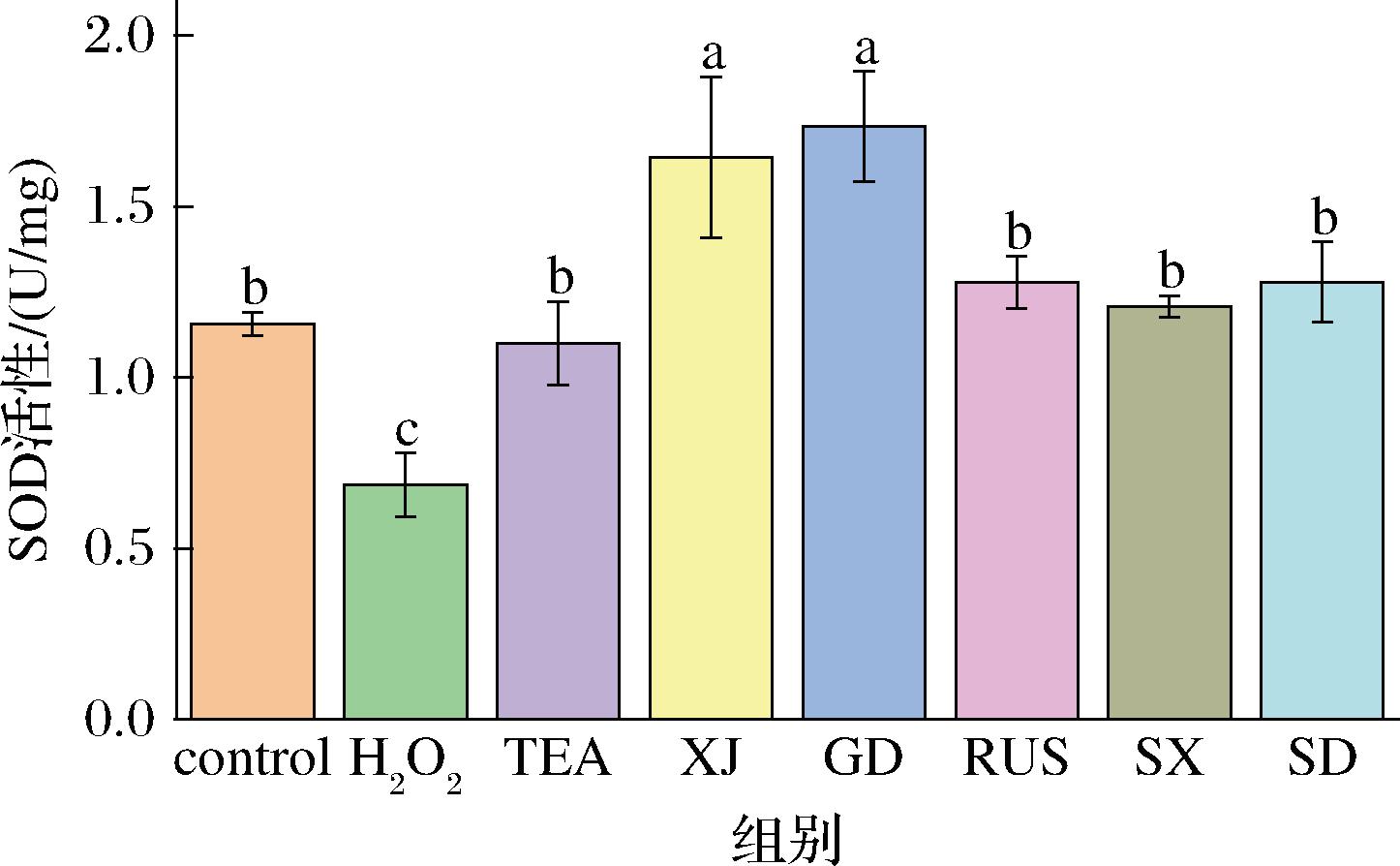
图7 不同来源红茶菌发酵液对Caco-2细胞SOD活性的影响
Fig.7 Effect of of Kombucha in different regions on SOD activity of Caco-2 cells
课题组对未发酵的TEA、红茶菌GD和红茶菌XJ进行非靶向代谢组学分析[12],比较红茶菌发酵前后差异代谢物,发现主要集中在多酚类、有机酸类、核苷酸及其衍生物、氨基酸及其衍生物、苯丙素类和生物碱类物质中。有研究提出,食用红茶菌有助于减少氧化应激和炎症,其机制归因于高含量的酚类化合物和有机酸之间的协同作用[23]。酚类化合物清除或抑制活性氧和氮物质、将电子转移到自由基以及激活抗氧化酶[27];还可以通过激活负责控制氧化应激的细胞途径(如核因子红细胞2相关因子2),SOD等抗氧化酶表达增加[28]。结合本文研究,红茶菌GD和红茶菌XJ能够激活抗氧化酶、缓解脂质氧化程度,可能是多酚类物质和有机酸类物质共同作用的结果,具体作用机制仍需进一步探究。
3 结论
本研究发现不同来源的红茶菌在发酵性能方面存在明显差异(P<0.05)。其中红茶菌XJ的pH值在发酵至第7天时降为3.15±0.04,发酵速度最快;红茶菌GD发酵速度次之,在发酵第4天时菌体浓度到达最高值。不同来源红茶菌发酵液对缓解H2O2造成的Caco-2细胞氧化应激的能力具有显著差异(P<0.05),红茶菌GD和红茶菌XJ均表现出良好的缓解能力,它们可以通过提高SOD的活性,降低细胞内脂质氧化的程度,进而缓解由H2O2带来的Caco-2细胞氧化损伤。结合课题组已有研究,推测红茶菌菌群组成及其代谢产物是其具有较优的缓解氧化损伤能力的根本原因。本研究筛选出发酵性能好且抗氧化活性强的红茶菌,为后期红茶菌菌株分离和构建可控红茶菌发酵剂提供了方向。
[1] JAYABALAN R, MALBA A R V, SATHISHKUMAR M. Kombucha tea: Metabolites[M]. Fungal Metabolites. Cham: Springer International Publishing, 2015:1-14.
A R V, SATHISHKUMAR M. Kombucha tea: Metabolites[M]. Fungal Metabolites. Cham: Springer International Publishing, 2015:1-14.
[2] 程梦琴. 枸杞酸枣仁红茶菌共发酵及其产物的生物活性研究[D]. 上海: 上海应用技术大学, 2021.CHENG M Q. Study on the biological activity of co-fermentation of Lycium barbarum jujube and kombucha[D]. Shanghai: Shanghai Institute of Technology, 2021.
[3] 王春龙. 红茶菌发酵饮料中的菌群分析与功能评价[D]. 天津: 天津科技大学, 2017.WANG C L. Microflora analysis and functionalevaluation of kombucha fermented beverage[D]. Tianjin: Tianjin University of Science and Technology. 2017.
[4] ULUSOY A, TAMER C E. Determination of suitability of black carrot (Daucus carota L. spp. sativus var. atrorubens Alef.) juice concentrate, cherry laurel (Prunus laurocerasus), blackthorn (Prunus spinosa) and red raspberry (Rubus ideaus) for kombucha beverage production[J]. Journal of Food Measurement and Characterization, 2019, 13(2):1524-1536.
[5] SALUK-JUSZCZAK J, OLAS B, NOWAK P, et al. Protective effects of D-glucaro-1, 4-lactone against oxidative modifications in blood platelets[J]. Nutrition, Metabolism, and Cardiovascular Diseases, 2008, 18(6):422-428.
[6] CARDOSO R R, DE PAULA DIAS MOREIRA L, DE CAMPOS COSTA M A, et al. Kombuchas from green and black teas reduce oxidative stress, liver steatosis and inflammation, and improve glucose metabolism in Wistar rats fed a high-fat high-fructose diet[J]. Food &Function, 2021, 12(21):10813-10827.
[7] CARDOSO R R, NETO R O, DOS SANTOS D’ALMEIDA C T, et al. Kombuchas from green and black teas have different phenolic profile, which impacts their antioxidant capacities, antibacterial and antiproliferative activities[J]. Food Research International, 2020, 128:108782.
[8] GAGG A F, BAFFONI L, GALIANO M, et al. Kombucha beverage from green, black and rooibos teas: A comparative study looking at microbiology, chemistry and antioxidant activity[J]. Nutrients, 2019, 11(1):1.
A F, BAFFONI L, GALIANO M, et al. Kombucha beverage from green, black and rooibos teas: A comparative study looking at microbiology, chemistry and antioxidant activity[J]. Nutrients, 2019, 11(1):1.
[9] JAYABALAN R, SUBATHRADEVI P, MARIMUTHU S, et al. Changes in free-radical scavenging ability of kombucha tea during fermentation[J]. Food Chemistry, 2008, 109(1):227-234.
[10] VILLARREAL-SOTO S A, BEAUFORT S, BOUAJILA J, et al. Understanding kombucha tea fermentation: A review[J]. Journal of Food Science, 2018, 83(3):580-588.
[11] WANG Z M, LU Z M, SHI J S, et al. Exploring flavour-producing core microbiota in multispecies solid-state fermentation of traditional Chinese vinegar[J]. Scientific Reports, 2016, 6:26818.
[12] MENG Y, WANG X Q, MU Y J, et al. Characterization of SCOBY-fermented kombucha from different regions and its effect on improving blood glucose[J]. Food Bioscience, 2024, 61:104946.
[13] ANDRESON M, KAZANTSEVA J, KULDJ RV R, et al. Characterisation of chemical, microbial and sensory profiles of commercial kombuchas[J]. International Journal of Food Microbiology, 2022, 373:109715.
RV R, et al. Characterisation of chemical, microbial and sensory profiles of commercial kombuchas[J]. International Journal of Food Microbiology, 2022, 373:109715.
[14] MIZZI L, MANISCALCO D, GASPARI S, et al. Assessing the individual microbial inhibitory capacity of different sugars against pathogens commonly found in food systems[J]. Letters in Applied Microbiology, 2020, 71(3):251-258.
[15] CHEN C, LIU B Y. Changes in major components of tea fungus metabolites during prolonged fermentation[J]. Journal of Applied Microbiology, 2000, 89(5):834-839.
[16] CHAKRAVORTY S, BHATTACHARYA S, CHATZINOTAS A, et al. Kombucha tea fermentation: Microbial and biochemical dynamics[J]. International Journal of Food Microbiology, 2016, 220:63-72.
[17] COTON M, PAWTOWSKI A, TAMINIAU B, et al. Unraveling microbial ecology of industrial-scale Kombucha fermentations by metabarcoding and culture-based methods[J]. FEMS Microbiology Ecology, 2017, 93(5). DOI:10.1093/femsec/fix048.
[18] VILLARREAL-SOTO S A, BOUAJILA J, PACE M, et al. Metabolome-microbiome signatures in the fermented beverage, Kombucha[J]. International Journal of Food Microbiology, 2020, 333:108778.
[19] LI J, HE Z F, YAN L X, et al. Analysis of the microbial community structure and flavor components succession during salt-reducing pickling process of Zhacai (preserved mustard Tuber)[J]. Food Science &Nutrition, 2023, 11(6):3154-3170.
[20] OELOFSE A, PRETORIUS I S, DU TOIT M. Significance of Brettanomyces and Dekkera during winemaking: A synoptic review[J]. South African Journal of Enology &Viticulture, 2016, 29(2): 128-144.
[21] GARC A-NEBOT M J, RECIO I, HERN
A-NEBOT M J, RECIO I, HERN NDEZ-LEDESMA B. Antioxidant activity and protective effects of peptide lunasin against oxidative stress in intestinal Caco-2 cells[J]. Food and Chemical Toxicology, 2014, 65:155-161.
NDEZ-LEDESMA B. Antioxidant activity and protective effects of peptide lunasin against oxidative stress in intestinal Caco-2 cells[J]. Food and Chemical Toxicology, 2014, 65:155-161.
[22] 蔡茜茜, 李晨, 陈旭, 等. 笛鲷鱼鳞源功能多肽对Caco-2细胞氧化应激损伤的保护作用[J]. 食品科学, 2023, 44(7):10-17.CAI Q Q, LI C, CHEN X, et al. Protective effect of fish scale-derived functional peptides from snapper on oxidative stress injury of Caco-2 cells[J]. Food Science, 2023, 44(7):10-17.
[23] DE CAMPOS COSTA M A, DE SOUZA VILELA D L, FRAIZ G M, et al. Effect of kombucha intake on the gut microbiota and obesity-related comorbidities: A systematic review[J]. Critical Reviews in Food Science and Nutrition, 2023, 63(19):3851-3866.
[24] CORDIANO R, DI GIOACCHINO M, MANGIFESTA R, et al. Malondialdehyde as a potential oxidative stress marker for allergy-oriented diseases: An update[J].Molecules, 2023, 28(16):5979.
[25] WANG X X, WEI Y Y, JIANG S, et al. Transcriptome analysis reveals that trehalose alleviates chilling injury of peach fruit by regulating ROS signaling pathway and enhancing antioxidant capacity[J]. Food Research International, 2024, 186:114331.
[26] JOMOVA K, ALOMAR S Y, ALWASEL S H, et al. Several lines of antioxidant defense against oxidative stress: Antioxidant enzymes, nanomaterials with multiple enzyme-mimicking activities, and low-molecular-weight antioxidants[J]. Archives of Toxicology, 2024, 98(5):1323-1367.
[27] DE ARA JO F F, DE PAULO FARIAS D, NERI-NUMA I A, et al. Polyphenols and their applications: An approach in food chemistry and innovation potential[J]. Food Chemistry, 2021, 338:127535.
JO F F, DE PAULO FARIAS D, NERI-NUMA I A, et al. Polyphenols and their applications: An approach in food chemistry and innovation potential[J]. Food Chemistry, 2021, 338:127535.
[28] BEETCH M, HARANDI-ZADEH S, SHEN K T, et al. Dietary antioxidants remodel DNA methylation patterns in chronic disease[J]. British Journal of Pharmacology, 2020, 177(6):1382-1408.