钙是人体必需的营养物质,与人体生命活动密切相关,钙的代谢平衡是机体保持健康的重要因素,因此,钙被誉为“生命之源”[1]。钙缺乏是我国居民的主要营养问题,摄入钙不足会影响人的身体健康,需要及时补钙[2]。目前,补钙制剂的发展已经经历了无机钙、有机钙、氨基酸钙的更新迭代。研究发现,多肽与金属离子的螯合更有利于微量元素生物效价的提高,肽钙螯合物以其吸收快、稳定性好、生物效价高、兼具抗氧化、免疫调节等生物活性的优点成为了新的研究热点[3]。
酪蛋白磷酸肽(casein phosphopeptide,CPP)是通过水解牛乳酪蛋白而制得的一种生物活性肽,因其具有磷酸丝氨酸簇这一结构,可以和钙、铁、锌等金属离子络合,具有促进人体矿物质元素吸收的作用[4]。其能在小肠碱性环境中与钙离子形成可溶性钙盐,防止钙离子形成磷酸钙沉淀,促进肠壁细胞对钙的吸收利用[5]。此外,CPP还具有诱导肿瘤细胞凋亡、增强机体免疫力及优良的抗氧化等营养功能[6]。CPP的制备普遍使用动植物源性蛋白酶水解牛乳酪蛋白[7],由于二者难获得,存在季节性、成本高的问题。近年来,微生物发酵法逐渐兴起,该法直接使用微生物发酵中产生的蛋白酶对酪蛋白酶解,相对降低了酶解法生产CPP的成本,具有易获得、繁殖快、产酶活性高等优点[8]。
贝莱斯芽孢杆菌(Bacillus velezensis)为革兰氏阳性菌,是芽孢杆菌属的一个新种,广泛存在于自然界中,能有效抑制病菌的生长繁殖及发育,在生物防治领域已有应用[9]。贝莱斯芽孢杆菌还具备产生蛋白酶、纤维素酶以及抗菌物质的功能,其代谢产物安全无毒[10]。已有学者报道应用贝莱斯芽孢杆菌改善白酒品质[11]及进行食醋酿造[12]等,其优良的发酵性能正在食品行业崭露头角,但目前对于贝莱斯芽孢杆菌的了解并不全面,对其所产蛋白酶的研究主要集中在分离、纯化及基础酶学性质方面,在利用其所产蛋白酶酶解制备活性肽方面鲜少涉及。
本研究以贝莱斯芽孢杆菌为发酵菌种制得蛋白酶,以酪蛋白为底物,利用贝莱斯芽孢杆菌蛋白酶酶解制备CPP。将制得的多肽与钙离子螯合制得酪蛋白磷酸肽螯合钙(calcium chelated casein phosphopeptide,CPP-Ca),进行氨基酸组分分析;以紫外光谱、傅里叶红外光谱、X射线衍射分析、扫描电镜、差示扫描量热分析、热重分析进行表征,以发泡能力、乳化能力、抗氧化能力为指标比较螯合前后的功能特性差异,以期拓宽贝莱斯芽孢杆菌在食品工业中的应用途径,并为CPP-Ca作为优良钙补充剂提供理论参考。
1 材料与方法
1.1 材料与试剂
供试菌株:贝莱斯芽孢杆菌分离于芍药叶片,16S rRNA鉴定其为贝莱斯芽孢杆菌ZYEB7(OK353816),保存于-80 ℃冰箱备用。
蛋白胨、牛肉膏,北京奥博星生物技术有限责任公司;干酪素(牛乳),北京Solarbio科技有限公司;氯化钠、可溶性淀粉、无水氯化钙、硫酸铵、磷酸氢二钠、磷酸二氢钠、聚乙二醇6000等试剂均为分析纯,上海国药集团;氨基酸混合标准品,日本合光;DPPH(纯度≥98%)、ABTS(纯度≥99.0%),美国Sigma公司。
1.2 仪器与设备
CL-32L高温高压灭菌锅,日本Tokyo公司;HZQ-X400恒温振荡培养箱,太仓市华美生化仪器;SW-CJ-2FD型双人单面净化工作台,苏州净化设备;CR21GⅡ型高速冷冻离心机,日本HitachiKoki公司;LGJ-12D台式冷冻干燥机,北京四环起航科技有限公司;BT125D型十万分之一电子天平,赛多利斯北京科学仪器有限公司;RE-52AA型旋转蒸发仪,上海亚荣生化仪器厂;L-8900全自动氨基酸分析仪,日本株式会社日立制作所;DR6000型紫外可见分光光度计,美国HACH公司;Nicolet iS50红外光谱仪,美国Thermo Scientific公司;STA-449-F3 Jupiter®型同步热分析仪,德国耐驰公司;Quanta450FEG型场发射扫描电子显微镜,捷克FEI公司;PANalytical-XPert3型粉末X射线衍射仪,荷兰PANalytical B.V.公司。
1.3 实验方法
1.3.1 贝莱斯芽孢杆菌蛋白酶的制备
种子培养基配方参考文献[13]的方法。
发酵培养基(g/L):淀粉35、大豆粕6.3、氯化钙1.6,pH值为7.0,121 ℃下灭菌20 min。
接种环挑取斜面保藏菌种于种子培养基,将种子液以4%(质量分数)接种于发酵培养基,初始pH值为7.0,温度34 ℃,180 r/min振荡培养49 h(本实验室所得该菌产蛋白酶的优化条件)。发酵液于8 000 r/min离心20 min,收集上清液以体积分数60%饱和硫酸铵沉淀蛋白酶,以分子质量3 500 Da透析袋于pH 7.5磷酸缓冲液中透析,加入BaCl2检测![]() 是否消除,聚乙二醇6000浓缩,然后将浓缩的酶液用缓冲液复溶,用于酶活力测定和后续制作CPP。
是否消除,聚乙二醇6000浓缩,然后将浓缩的酶液用缓冲液复溶,用于酶活力测定和后续制作CPP。
1.3.1.1 贝莱斯芽孢杆菌蛋白酶酶活力测定
采用GB/T 23527.1—2023《酶制剂质量要求 第1部分:蛋白酶制剂》以Folin法测定蛋白酶酶活力,以Tyr制作标准曲线,得到标准曲线为y=0.011 4x+0.015 7(R2=0.999 3)。
1.3.2 CPP的制备
以0.1 mol/L pH值为7.5 Tris-HCl缓冲液溶解配制2%(质量分数)酪蛋白。根据本实验室优化CPP制备工艺进行酶解:取0.6 mL粗酶液,加入10 mL 2%酪蛋白,初始pH值为8.0,60 ℃酶解60 min,反应时以1 mol/L NaOH溶液维持pH值不变。反应结束立即煮沸酶解液灭活,以1 mol/L HCl溶液调pH值至4.6,4 000 r/min离心,取上清液加入1.6 mL 1 mol/L CaCl2溶液,按1∶
1(体积比)加入无水乙醇,混匀后4 ℃静置过夜,次日在8 000 r/min离心15 min,收集沉淀真空冷冻干燥即为CPP粗品[14]。
1.3.2.1 CPP含量测定
按照GB 31617—2014《食品安全国家标准 食品营养强化剂 酪蛋白磷酸肽》,以钡乙醇法测定贝莱斯芽孢杆菌蛋白酶制得的CPP样品中CPP的含量。按照公式(1)计算CPP含量:
(1)
式中:ω,CPP含量,%;m1,恒重后沉淀与离心管的质量,g;m2,恒重后空离心管的质量,g;m,试样质量,g;ω0,试样干燥减量,%。
1.3.2.2 CPP中N/P测定
根据GB 5009.5—2016《食品安全国家标准 食品中蛋白质的测定》,以半微量凯氏定氮法测定样品含氮量。以抗坏血酸还原钼蓝分光光度法[15]测定磷含量。按照公式(2)计算N/P:
(2)
式中:n,N/P摩尔比;n1,样品N百分含量,%;n2,样品P百分含量,%;31,P的摩尔质量(g/moL);14,N的摩尔质量(g/moL)。
1.3.3 CPP-Ca的制备
参考文献[16],精确称取1 g CPP,以pH值为7.5 Tris-HCl缓冲液溶解定容至100 mL,加入50 mL 0.3 mol/L CaCl2溶液,调整pH值至7.5,混匀置于40 ℃水浴反应60 min,螯合完成后按1∶8体积比加入无水乙醇4 ℃静置过夜,次日在8 000 r/min离心15 min,沉淀真空冷冻干燥即得CPP-Ca粗品。
1.3.3.1 CPP-Ca中钙的得率测定
保留螯合离心后的上清液,按照GB 5009.92—2016《食品安全国家标准 食品中钙的测定》,采用火焰原子吸收光谱法测定游离钙含量。按照公式(3)计算螯合物中钙的得率:
得率![]()
(3)
式中:m0,反应体系钙含量,g;m1,游离钙含量,g。
1.3.3.2 CPP-Ca中Ca/P测定
钙含量的测定方法见1.3.3.1节,P含量的测定方法见1.3.2.2节,计算Ca/P。
1.3.3.3 CPP-Ca氨基酸组成分析
根据GB 5009.124—2016《食品安全国家标准 食品中氨基酸的测定》,以酸水解法使用氨基酸全自动分析仪进行氨基酸组成分析,进样量20 μL。
1.3.4 贝莱斯芽孢杆菌酶解产物钙螯合物的结构表征
1.3.4.1 紫外-可见吸收光谱分析
取螯合前后的样品10 mg,用pH值为7.5 Tris-HCl缓冲液溶解配制成1 mg/mL的溶液,使用紫外可见分光光度计于190~350 nm波长下扫描。
1.3.4.2 傅里叶红外光谱分析
将冷冻干燥后的粉末使用红外光谱仪ATR附件实现红外光谱分析,在4 500~500 cm-1波数下进行扫描。
1.3.4.3 X射线衍射分析
分别取适量螯合前后的样品于底板,压片制样,管电压40 kV,管电流40 mA,衍射角度5°~90°,扫描速度12.5 deg/min,步长0.02 deg/step,于粉末X射线衍射仪进行扫描。
1.3.4.4 扫描电镜分析
取一定量螯合前后的样品,对其进行表面喷金后采用扫描电子显微镜扫描,加速电压10 kV,将样品于2 000倍下观察整体形态,依次放大倍数观察,在10 000倍下观察其微观形态并拍照。
1.3.4.5 差示扫描量热分析
分别称取螯合前后的样品各10 mg于铝坩埚中,温度范围25~200 ℃,速度10 ℃/min,氮气流速50 mL/min,进行热稳定分析[17]。
1.3.4.6 热重分析
分别称取螯合前后的样品各5 mg于热重分析仪,温度范围25~200 ℃,速度10 ℃/min,氮气流速50 mL/min,进行热重分析[17]。
1.3.5 贝莱斯芽孢杆菌酶解产物钙螯合物功能特性
1.3.5.1 发泡能力及泡沫稳定性
将螯合前后的样品配制成1 mg/mL的溶液,准确吸取5 mL样液,调pH值为7.0,经漩涡振荡器(2 500 r/min,连续振荡3次,每次30 s)振荡,于室温下静置30 min,分别记录0、30 min时的泡沫体积[18],分别按照公式(4)和公式(5)计算发泡能力及泡沫稳定性:
发泡能力![]()
(4)
泡沫稳定性![]()
(5)
式中:V0,0 min时泡沫体积,mL;V1,蛋白质溶液体积,mL;c,样液质量浓度,g/100 mL;V30,30 min时泡沫体积,mL。
1.3.5.2 乳化活性及乳化稳定性
将螯合前后的样品配制成1 mg/mL的溶液,吸取一定量样液,以3∶1体积比分别加入样液与色拉油,经漩涡振荡器(2 500 r/min,连续振荡3次,每次30 s),取液体底部样液用0.01%(质量分数)十二烷基硫酸钠溶液稀释100倍,以0.01%十二烷基硫酸钠溶液调零,测定500 nm下吸光值A0,10 min后以相同步骤测定吸光值A10,分别按照公式(6)和公式(7)计算乳化活性及乳化稳定性[19]:
乳化活性![]()
(6)
乳化稳定性![]()
(7)
式中:T,2.303;A0,0 min吸光值;N,稀释倍数;c,乳化液形成前样液的质量浓度,g/mL;φ,乳化液中油的体积分数;Δt,10 min;A10,10 min吸光值。
1.3.6 CPP钙鳌合前后的抗氧化活性
1.3.6.1 CPP钙鳌合前后对DPPH自由基清除活性的测定
DPPH自由基清除率的测定参考文献[20]的方法稍作修改。配制0.16 mmol/L的DPPH工作液(以体积分数95%乙醇定容)。分别称取0.1 g CPP及CPP-Ca粗品,定容至100 mL,配制质量浓度为1 mg/mL的样品溶液做母液,用时稀释。
准确吸取不同质量浓度的样品溶液1 mL,加入1 mL Tris-HCl缓冲液、2 mL DPPH工作液为测定管,避光反应30 min。以1 mL Tris-HCl缓冲液加1 mL 95%乙醇作空白对照,测定517 nm处吸光值。以不同质量浓度抗坏血酸作阳性对照,测定DPPH自由基清除率,以反应体系终浓度表示质量浓度。按照公式(8)计算DPPH自由基清除率:
DPPH自由基清除率![]()
(8)
式中:A0,空白对照吸光值;A,样品吸光值。
1.3.6.2 CPP钙鳌合前后对ABTS阳离子自由基清除活性的测定
ABTS阳离子自由基清除率的测定参考文献[21]介绍的方法。准确吸取不同质量浓度的样品溶液1 mL,加入1 mL去离子水,2 mL ABTS工作液,混匀后避光反应6 min,测定734 nm下吸光值。以1 mL Tris-HCl缓冲液代替样液加1 mL去离子水再加2 mL ABTS工作液做对照。以不同浓度抗坏血酸作阳性对照,测定ABTS阳离子自由基清除率,以反应体系终浓度表示质量浓度。按照公式(9)计算ABTS阳离子自由基清除率:
ABTS阳离子自由基清除率![]()
(9)
式中:A0,空白对照吸光值;A,样品吸光值。
1.3.6.3 CPP钙鳌合前后对羟自由基清除活性的测定
羟自由基清除能力的测定参考文献[22]的方法稍作修改。准确吸取不同质量浓度的样液1 mL,依次加入1 mL 6 mmol/L FeSO4溶液、1 mL 6 mmol/L H2O2溶液,混匀静置10 min,加入1 mL 6 mmol/L水杨酸,混合均匀后于37 ℃水浴反应30 min,测定510 nm波长处吸光值。以1 mL Tris-HCl缓冲液代替样液,做空白对照,不同质量浓度抗坏血酸做阳性对照,以反应体系终浓度表示质量浓度。按照公式(10)计算羟自由基清除率:
羟自由基清除率![]()
(10)
式中:A0,空白对照吸光值;A,样品吸光值。
1.3.6.4 CPP钙鳌合前后对超氧阴离子自由基清除活性的测定
超氧阴离子自由基的抑制率测定参考文献[23]的方法,准确吸取不同质量浓度的样品溶液1 mL,分别加入pH 7.5 Tris-HCl缓冲液0.8 mL,依次加入750 mmol/L氮蓝四唑、30 mmol/L甲硫氨酸、20 mmol/L核黄素、100 mmol/L乙二胺四乙酸钠各0.3 mL,于4 000 lx下光照20 min,测定560 nm处吸光值,以1 mL Tris-HCl缓冲液代替样品溶液作对照管。以不同质量浓度抗坏血酸做阳性对照,测定超氧阴离子自由基清除率。以反应体系终浓度表示质量浓度。按照公式(11)计算超氧阴离子自由基清除率:
超氧阴离子自由基清除率![]()
(11)
式中:A0,空白对照吸光值;A,样品吸光值。
1.4 数据处理
采用Excel 2016软件对测试数据进行统计,结果均为3次测试的“平均值±标准差”,采用Origin 2021软件作图。
2 结果与分析
2.1 贝莱斯芽孢杆菌蛋白酶酶活力
将浓缩的酶液用缓冲液复溶后,采用Folin法测定蛋白酶活力,蛋白酶活力为(302.37±4.31) U/mL。
2.2 CPP的制备
如图1所示,贝莱斯芽孢杆菌蛋白酶酶解酪蛋白制得的CPP为淡黄色粉末,微苦,无异味,无杂质。该实验还表明,使用贝莱斯芽孢杆菌蛋白酶作为原料制备CPP,酶解时间为60 min,pH值为8.0,温度为60 ℃,酶底物比为6%体积分数,水解度高达23.71%,比文献[24]报道的用胰蛋白酶制备CPP的最优方案的水解度(水解度为22.85%)稍高,同时该方法耗时短,所用酶的成本更低,因此,采用该方法制备CPP更具优势。

图1 CPP粗品
Fig.1 Crude of CPP
2.2.1 CPP含量
钡乙醇法是向CPP样液中加入一定浓度的钡离子,使其与CPP形成桥连,在碱性环境下加入乙醇可以将分子团沉淀,干燥至恒重后即可计算CPP含量。姜春秀等[25]使用钡乙醇法对7种市面在售CPP进行了含量测定,含量最高的样品其含量为18.48%,含量最低的样品CPP含量仅有1.3%。本试验中,贝莱斯芽孢杆菌蛋白酶源CPP含量为47.9%。由此可见,以贝莱斯芽孢杆菌蛋白酶为酶源制得的CPP含量较高,具有一定的开发价值。
2.2.2 CPP中N/P
N/P是评价CPP质量的重要指标,CPP的纯度与N/P有关,纯度越高,N/P越小,当N/P较低时,其磷酸基密度较大。由表1可知,由贝莱斯芽孢杆菌蛋白酶制备的CPP,N含量为11.47%,P含量为5.48%,N/P为4.63。梁肖娜等[26]通过分析不同N/P大小的CPP阻止钙离子沉淀的效果,发现CPP延缓磷酸钙沉淀的时间随着N/P的降低而延长,N/P越低,其阻止磷酸钙沉淀的效果越好。目前市售CPP中N/P普遍在20以上,本实验中由贝莱斯芽孢杆菌蛋白酶制得的CPP中N/P显著低于市售产品,表明其在促进钙吸收方面有一定优势。
表1 CPP中N、P含量及其比值
Table 1 Content and ratio of CPP N and P
样品N含量/%P含量/%N/PCPP11.47±0.195.48±0.084.63±0.14
2.3 CPP-Ca的制备
2.3.1 CPP-Ca中钙的得率
由图2可以看出,由贝莱斯芽孢杆菌蛋白酶酶解CPP制得的CPP-Ca为白色粉末,无异味、杂质。经测定,CPP-Ca中钙的得率为26.20%,李海枝等[16]利用CPP螯合氯化钙,测得螯合物得率为27.97%,与本实验钙的得率相差不大,但仍需要对其螯合工艺进行优化,提高钙的螯合率,保证原料价值得到充分利用。

图2 CPP-Ca粗品
Fig.2 Crude of CPP-Ca
2.3.2 CPP-Ca中Ca/P
由表2可知,CPP-Ca中钙含量为5.71%,磷含量为4.88%,Ca/P为1.17。磷是影响机体钙吸收的重要因素,当摄入的膳食成分中磷含量过高时,容易与钙形成难溶性的磷酸钙沉淀,降低小肠对钙的吸收,当Ca/P为1∶1~2∶1时较为合理,有利于钙的吸收,当Ca/P为1∶3时,肠道对钙的吸收会大幅降低[2-3]。虽然CPP分子螯合钙时钙溶解的量远大于CPP分子的量,但由于CPP上的磷酸丝氨酰可结合的钙量几乎等于它本身[27],因此制备CPP-Ca时结合的钙量并不多。本实验中的贝莱斯芽孢杆菌酶解产物钙螯合物Ca/P合理,有促钙吸收价值。
表2 CPP-Ca中Ca、P含量及其比值
Table 2 Content and ratio of CPP chelated calcium Ca and P
样品Ca含量/%P含量/%Ca/PCPP-Ca5.71±0.524.88±0.031.17±0.10
2.3.3 氨基酸组分分析
利用氨基酸自动分析仪进行氨基酸组分分析,由于酸解过程破坏了Trp,致其未检出,故共检测出17种氨基酸。由表3可知,CPP-Ca富含Glu(11.32%)、Pro(11.07%)、Asp(3.36%)、Ile(3.25%)。螯合后CPP-Ca的氨基酸含量普遍降低,总氨基酸含量由47.83%降低至46.39%。但CPP-Ca的Asp、Ser、Glu、Gly、His含量有所升高。螯合前后必需氨基酸与总氨基酸的比值均在25%左右,具有一定营养价值。螯合后酸性氨基酸及碱性氨基酸占总氨基酸的比值分别增加至31.65%和10.96%,研究发现酸性氨基酸(Asp、Glu)和碱性氨基酸(His、Arg、Lys)所带电荷与金属离子的螯合有关[28],CPP-Ca中酸性氨基酸与碱性氨基酸含量的增加与此相符,其中Glu和His与钙离子的螯合能力优于其他氨基酸。CPP中疏水性氨基酸与总氨基酸的比值为47.95%,CPP-Ca中为46.98%,CPP芳香族氨基酸与总氨基酸的比值为3.84%,CPP-Ca则为1.96%,肽钙螯合物中二者的比值均略低于CPP。疏水性氨基酸是肽清除自由基能力的重要因素,这些氨基酸可以通过多种途径增强物质的自由基清除能力[29]。此外,芳香族氨基酸也与多肽的抗氧化能力有关[30]。综上所述,螯合钙离子后氨基酸含量发生了变化,这与钙离子的结合有关。
表3 CPP及CPP-Ca氨基酸组分分析 单位:%
Table 3 Composition analysis of amino acid composition of CPP and CPP-Ca
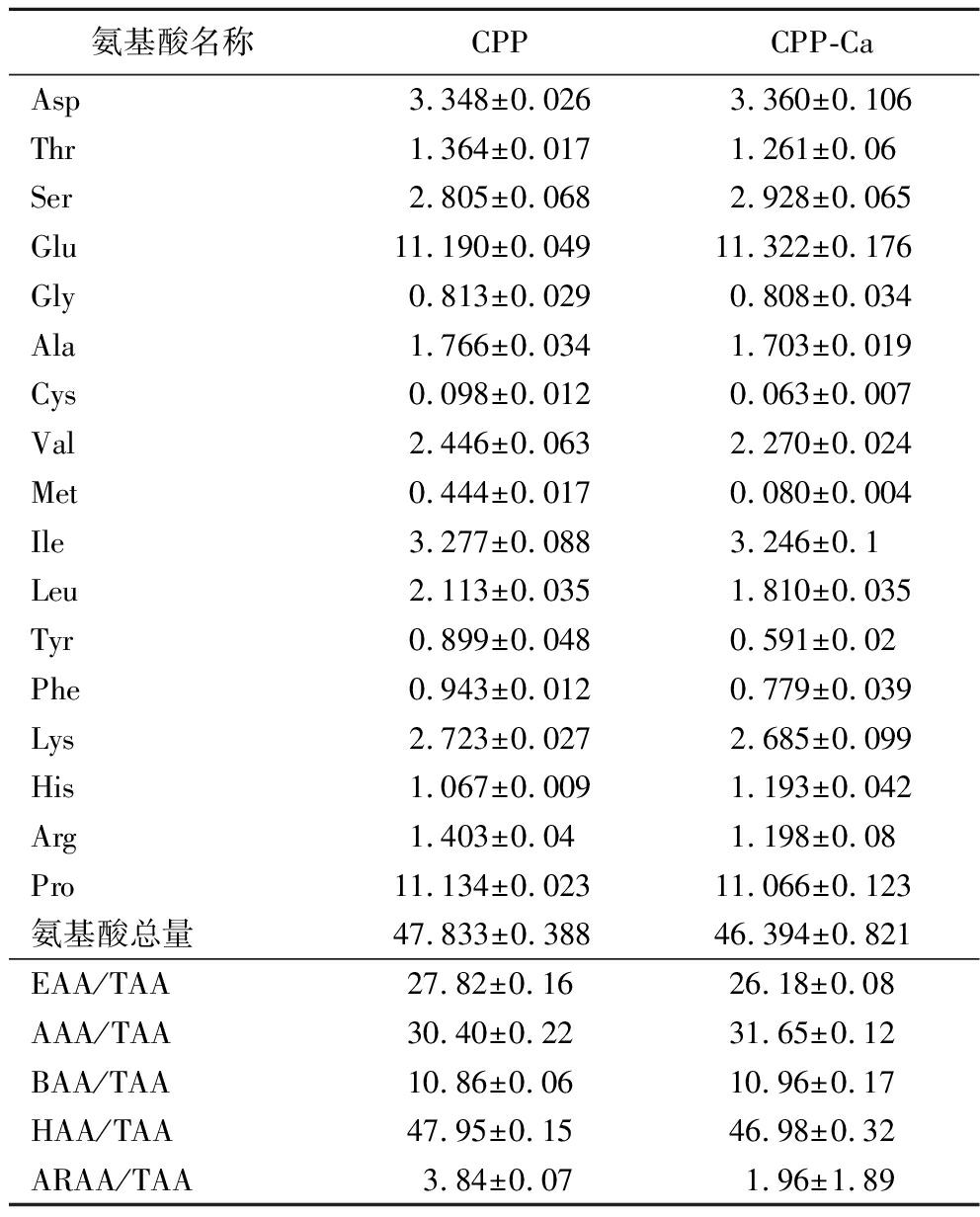
氨基酸名称CPPCPP-CaAsp3.348±0.0263.360±0.106Thr1.364±0.0171.261±0.06Ser2.805±0.0682.928±0.065Glu11.190±0.04911.322±0.176Gly0.813±0.0290.808±0.034Ala1.766±0.0341.703±0.019Cys0.098±0.0120.063±0.007Val2.446±0.0632.270±0.024Met0.444±0.0170.080±0.004Ile3.277±0.0883.246±0.1Leu2.113±0.0351.810±0.035Tyr0.899±0.0480.591±0.02Phe0.943±0.0120.779±0.039Lys2.723±0.0272.685±0.099His1.067±0.0091.193±0.042Arg1.403±0.041.198±0.08Pro11.134±0.02311.066±0.123氨基酸总量47.833±0.38846.394±0.821EAA/TAA27.82±0.16 26.18±0.08 AAA/TAA30.40±0.2231.65±0.12BAA/TAA10.86±0.0610.96±0.17HAA/TAA47.95±0.1546.98±0.32ARAA/TAA3.84±0.071.96±1.89
注:EAA:必需氨基酸(essential amino acids)(Trp、Phe、Met、Thr、Ile、Leu、Val);TAA:总氨基酸(total amino acids);AAA:酸性氨基酸(acidic amino acids)(Asp、Glu);BAA:碱性氨基酸(basic amino acids)(His、Arg、Lys);HAA:疏水性氨基酸(hydrophobic amino acids)(Ala、Phe、Ile、Leu、Met、Pro、Val、Gly);ARAA:芳香族氨基酸(aromatic amino acids)(Try、Tyr、Phe)。
2.4 贝莱斯芽孢杆菌酶解产物钙螯合物结构表征
2.4.1 紫外-可见吸收光谱分析
紫外吸收光谱法是用于研究物质的性质和含量的方法,常用来研究物质是否发生变化或有新的物质出现。扫描螯合前后的样品,其紫外吸收图谱如图3所示,CPP及CPP-Ca在209 nm及280 nm处有吸收峰,但位于209 nm波长处的吸收峰更强。肽键在200~225 nm处有吸收峰,此209 nm特征吸收峰为肽中酰胺键,主要由肽键中C![]() O的能级跃迁引起。研究表明,多肽与钙结合后酰胺键处羰基及羧基生色团、羟基及亚氨基助色团空间结构发生变化,导致肽钙螯合后在紫外光谱中的吸收强度增加或谱带红移[31],钙离子与CPP螯合后,在209 nm处的紫外吸收强度增大,这可能是螯合钙导致酰胺键的电子云和配体的吸收特性发生变化所引起。Tyr与Trp残基在280 nm处有最大吸收峰,螯合前后的样品图谱均在此处有吸收峰,表明样品中可能仍含有部分蛋白质。由此判断,CPP与钙离子螯合形成了新物质。
O的能级跃迁引起。研究表明,多肽与钙结合后酰胺键处羰基及羧基生色团、羟基及亚氨基助色团空间结构发生变化,导致肽钙螯合后在紫外光谱中的吸收强度增加或谱带红移[31],钙离子与CPP螯合后,在209 nm处的紫外吸收强度增大,这可能是螯合钙导致酰胺键的电子云和配体的吸收特性发生变化所引起。Tyr与Trp残基在280 nm处有最大吸收峰,螯合前后的样品图谱均在此处有吸收峰,表明样品中可能仍含有部分蛋白质。由此判断,CPP与钙离子螯合形成了新物质。
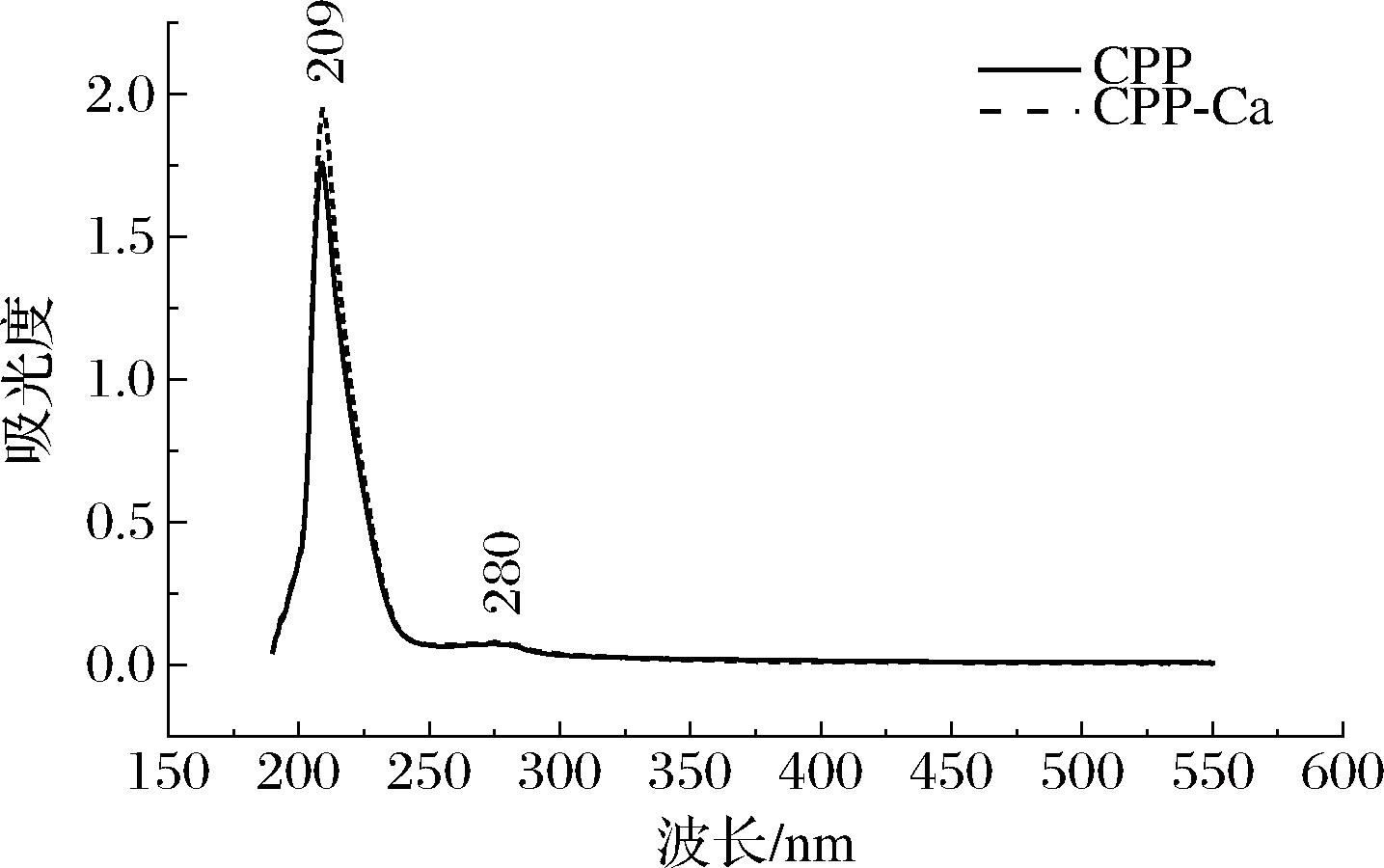
图3 CPP及CPP-Ca紫外吸收光谱图
Fig.3 Ultraviolet absorption spectra of CPP and CPP-Ca
2.4.2 傅里叶红外光谱分析
红外光谱分析是常用的鉴定化合物和研究分子结构的手段,其可作为金属离子与有机配体相互作用的有力证明[32]。鉴定肽的红外光谱图主要显示酰胺的特征,其中,酰胺Ι带、酰胺Ⅱ带与酰胺Ⅲ带对于结构分析较为重要,酰胺Ι带位于1 600~1 700 cm-1波段,主要为羰基C![]() O键的伸缩振动[33]。酰胺Ⅱ带位于1 500~1 600 cm-1,与C—H伸缩和N—H面内弯曲有关。酰胺Ⅲ带(1 230~1 250 cm-1)范围内存在与α螺旋、β构象及无规卷曲等二级结构相关的吸收峰[34]。由图4可以看出,螯合钙离子后螯合物的红外光谱图发生了显著变化,二者的图谱出现部分重叠,并发生了吸收峰的移动、消失、新增和变宽。在N—H伸缩带处,螯合物波数由3 260 cm-1红移至3 290 cm-1处,由此推断钙离子可能与—NH2基团发生了结合;位于酰胺Ι带的C
O键的伸缩振动[33]。酰胺Ⅱ带位于1 500~1 600 cm-1,与C—H伸缩和N—H面内弯曲有关。酰胺Ⅲ带(1 230~1 250 cm-1)范围内存在与α螺旋、β构象及无规卷曲等二级结构相关的吸收峰[34]。由图4可以看出,螯合钙离子后螯合物的红外光谱图发生了显著变化,二者的图谱出现部分重叠,并发生了吸收峰的移动、消失、新增和变宽。在N—H伸缩带处,螯合物波数由3 260 cm-1红移至3 290 cm-1处,由此推断钙离子可能与—NH2基团发生了结合;位于酰胺Ι带的C![]() O吸收峰从1 650 cm-1红移至1 670 cm-1处,表明羧基参与了钙离子的螯合过程。在酰胺Ⅱ带,多肽侧链基团—COO-的吸收峰范围内,CPP位于1 450 cm-1处的吸收峰消失,1 410 cm-1处的峰红移至1 420 cm-1处,表明肽的羧基氧参与了钙的结合。在指纹区,酰胺Ⅲ带内吸收峰由1 240 cm-1移动至1 260 cm-1处,表明钙的结合引起了肽的二级结构的变化。在1 070 cm-1处,螯合后吸收峰强度增加,表明钙离子的结合引起了C—N强烈单间伸缩振动。综上所述,CPP与钙离子螯合的主要位点为肽链的氨基、羧基、羧基氧,这些基团与钙离子配位结合形成了CPP-Ca,并引起了二级结构的变化。
O吸收峰从1 650 cm-1红移至1 670 cm-1处,表明羧基参与了钙离子的螯合过程。在酰胺Ⅱ带,多肽侧链基团—COO-的吸收峰范围内,CPP位于1 450 cm-1处的吸收峰消失,1 410 cm-1处的峰红移至1 420 cm-1处,表明肽的羧基氧参与了钙的结合。在指纹区,酰胺Ⅲ带内吸收峰由1 240 cm-1移动至1 260 cm-1处,表明钙的结合引起了肽的二级结构的变化。在1 070 cm-1处,螯合后吸收峰强度增加,表明钙离子的结合引起了C—N强烈单间伸缩振动。综上所述,CPP与钙离子螯合的主要位点为肽链的氨基、羧基、羧基氧,这些基团与钙离子配位结合形成了CPP-Ca,并引起了二级结构的变化。
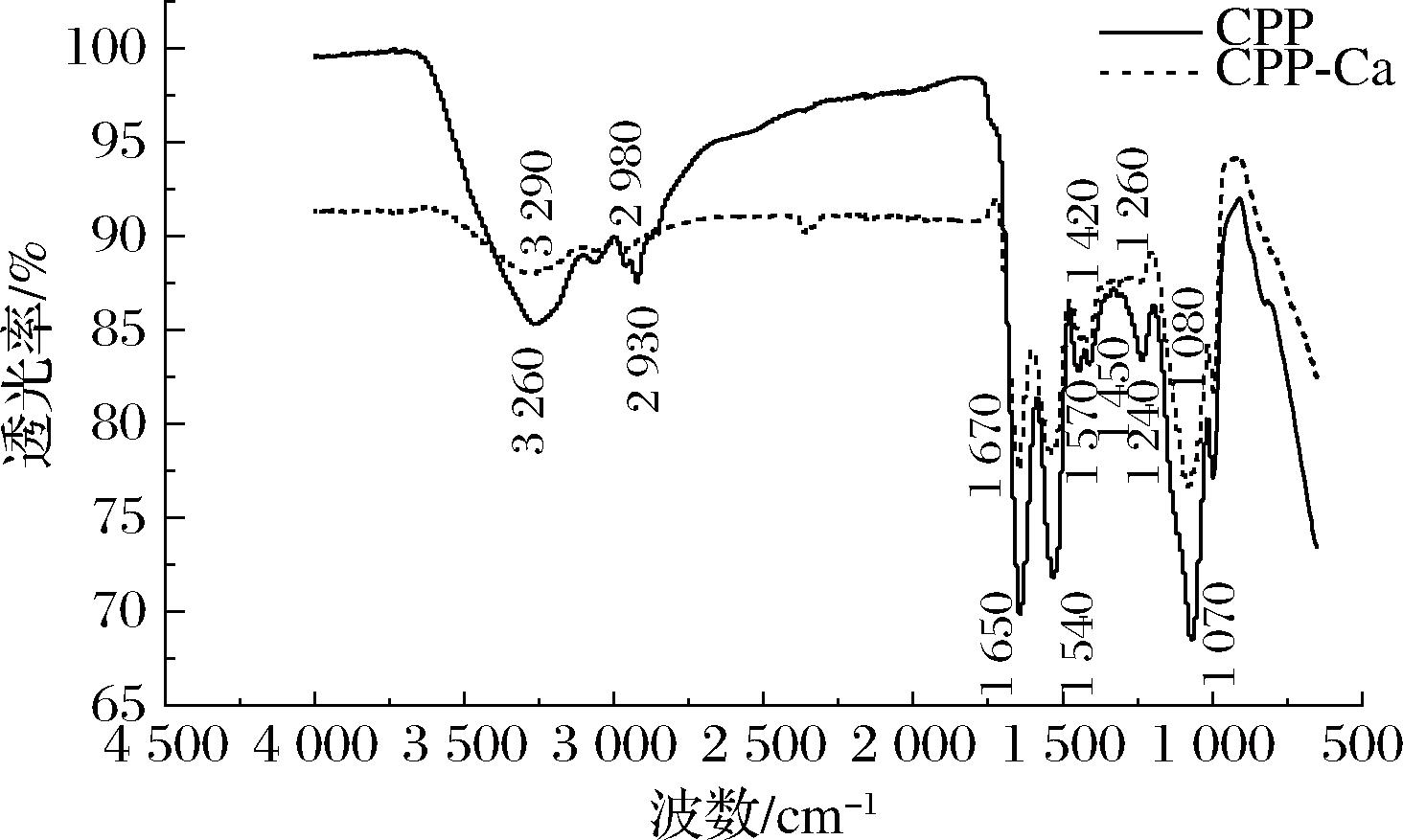
图4 CPP及CPP-Ca傅里叶红外光谱图
Fig.4 Fourier transform infrared spectra of CPP and CPP-Ca
2.4.3 X射线衍射分析
X射线衍射分析可用于分析物质粉末的晶体状态[35]。扫描结果如图5所示,螯合前后X射线衍射结果出现显著变化。CaCl2是CPP-Ca的钙离子来源,衍射图谱表明,其基线平整,在衍射角为11.74°、20.59°、29.30°、32.00°、42.85°等处表现出尖锐的强衍射峰,表明其结晶度较高。而CPP在衍射角为20.15°处有一个较宽的弥散峰,在31.72°处有一小的驼峰,该CPP为无规则的非晶型结构。在形成肽钙螯合物后,原来20.15°处弥散峰消失,仅31.77°处有一小的衍射峰。这表明CPP与钙离子通过化学作用形成了新的产物,表现出非晶型结构。
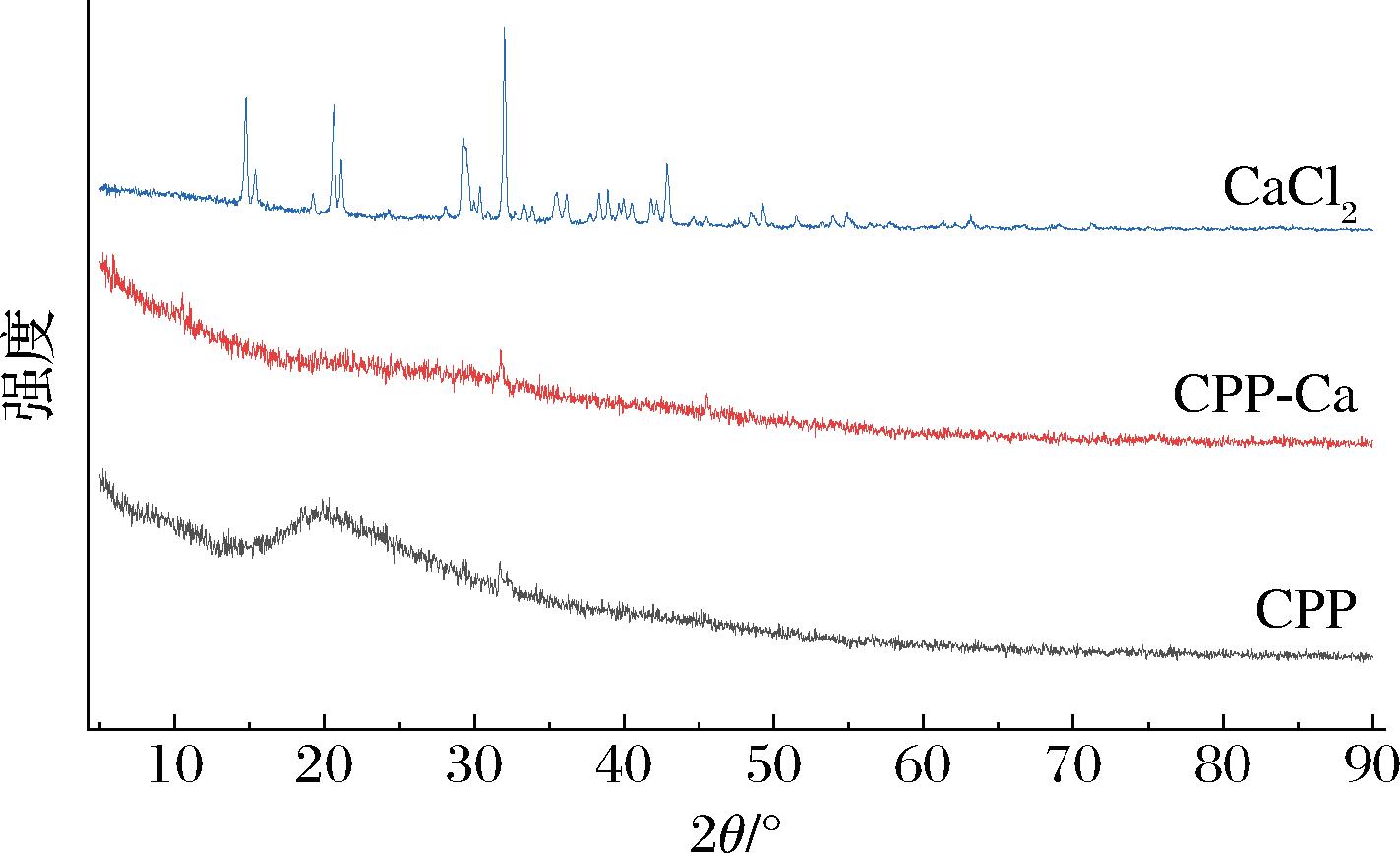
图5 CPP、CaCl2及CPP-Ca X射线衍射图谱
Fig.5 X-ray diffraction patterns of CPP, CaCl2 and CPP-Ca
2.4.4 扫描电镜分析
对螯合前后的样品在不同放大倍数下扫描电镜观察,结果如图6所示。二者表面均有裂缝,由于样品是真空冷冻干燥后研磨制成,可能是冷冻干燥过程中剧烈失水所致。由图6-a可知,CPP表面粗糙,为不规则块状颗粒,且表面有许多凹洞。由图6-b可知,CPP-Ca中,凹洞被填补,出现了更为光滑圆润的球形颗粒,直径变小,颗粒排列更紧密。可能是钙与肽的羧基氧原子发生作用,氨基酸与钙进行交联,颗粒间相互吸引而产生聚集[36]。球状颗粒相较于不规则块状,比表面积更大,溶解性较好[26]。因此,CPP与钙离子螯合后形成了一种形态不同的物质。

a-CPP;b-CPP-Ca
图6 CPP及CPP-Ca扫描电镜图谱
Fig.6 Scanning electron microscope atlas of CPP and CPP-Ca
2.4.5 差示扫描量热分析
差示扫描量热分析可用于检测物质的热量变化,分析肽的热稳定性。如图7所示,CPP在107 ℃时有一个吸热峰,键能为131.2 J/g。当发生螯合后,CPP-Ca的吸热峰右移至115 ℃,键能为264.8 J/g,断裂化学键的温度与键能显著升高,可能是CPP与钙离子结合改变了原有的构象,受热时需要更多能量来断裂CPP-Ca的化学键,因此螯合产生了一种对热更稳定的物质。
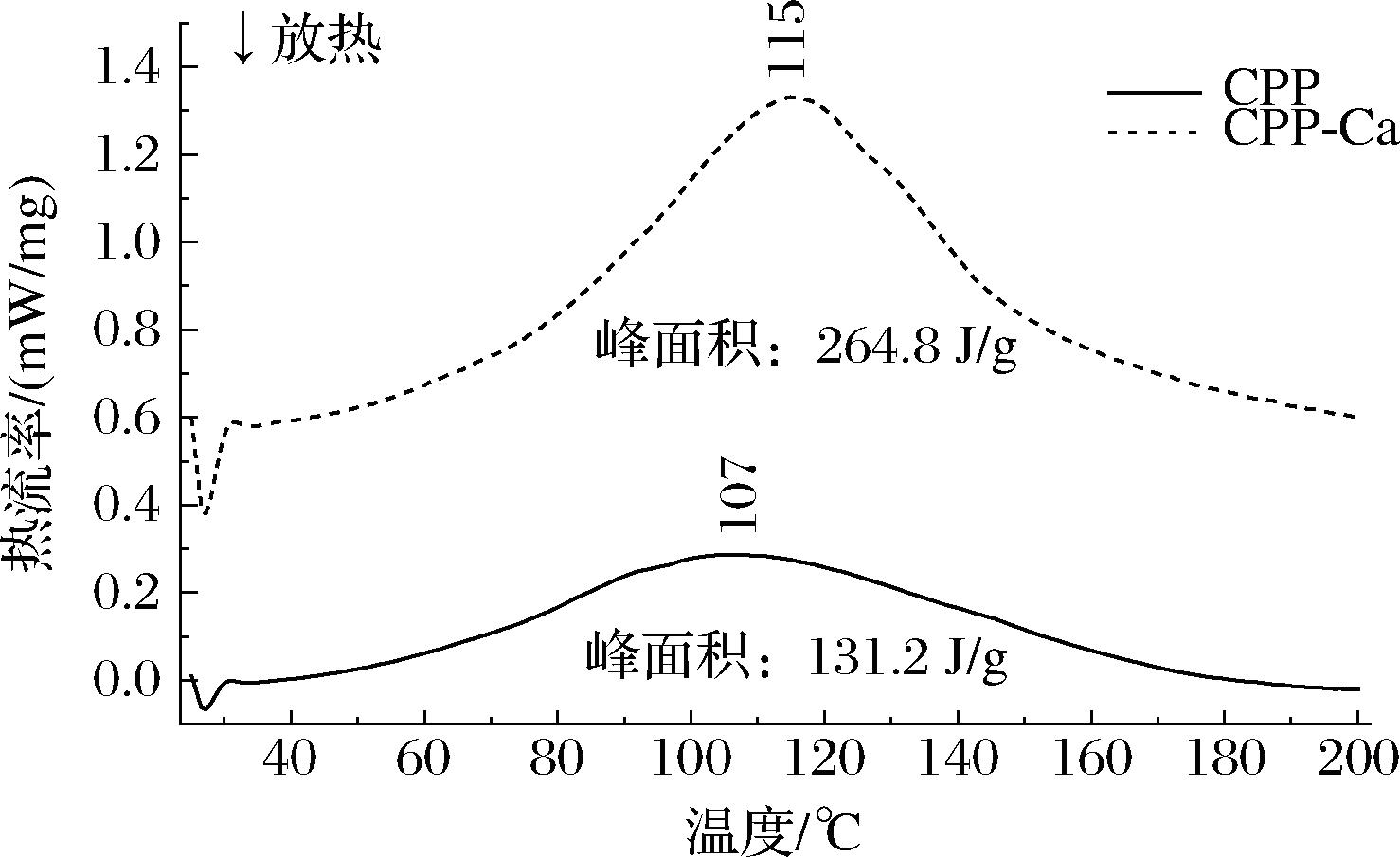
图7 CPP及CPP-Ca 差示扫描量热曲线
Fig.7 Differential scanning calorimetry curves of CPP and CPP-Ca
2.4.6 热重分析
热重扫描TG(thermo-gravimetric)曲线表示随着温度的变化,样品质量百分比变化规律的曲线,结果如图8所示,螯合前后的样品在30~200 ℃的温度范围内出现了一个失重区,CPP的质量下降19.26%,CPP-Ca质量下降8.13%。热处理是食品加工的常用工艺,随着温度的升高,CPP-Ca的质量变化较小,说明CPP与钙离子螯合形成的产物对热更稳定,这与差示扫描量热分析的结果一致。
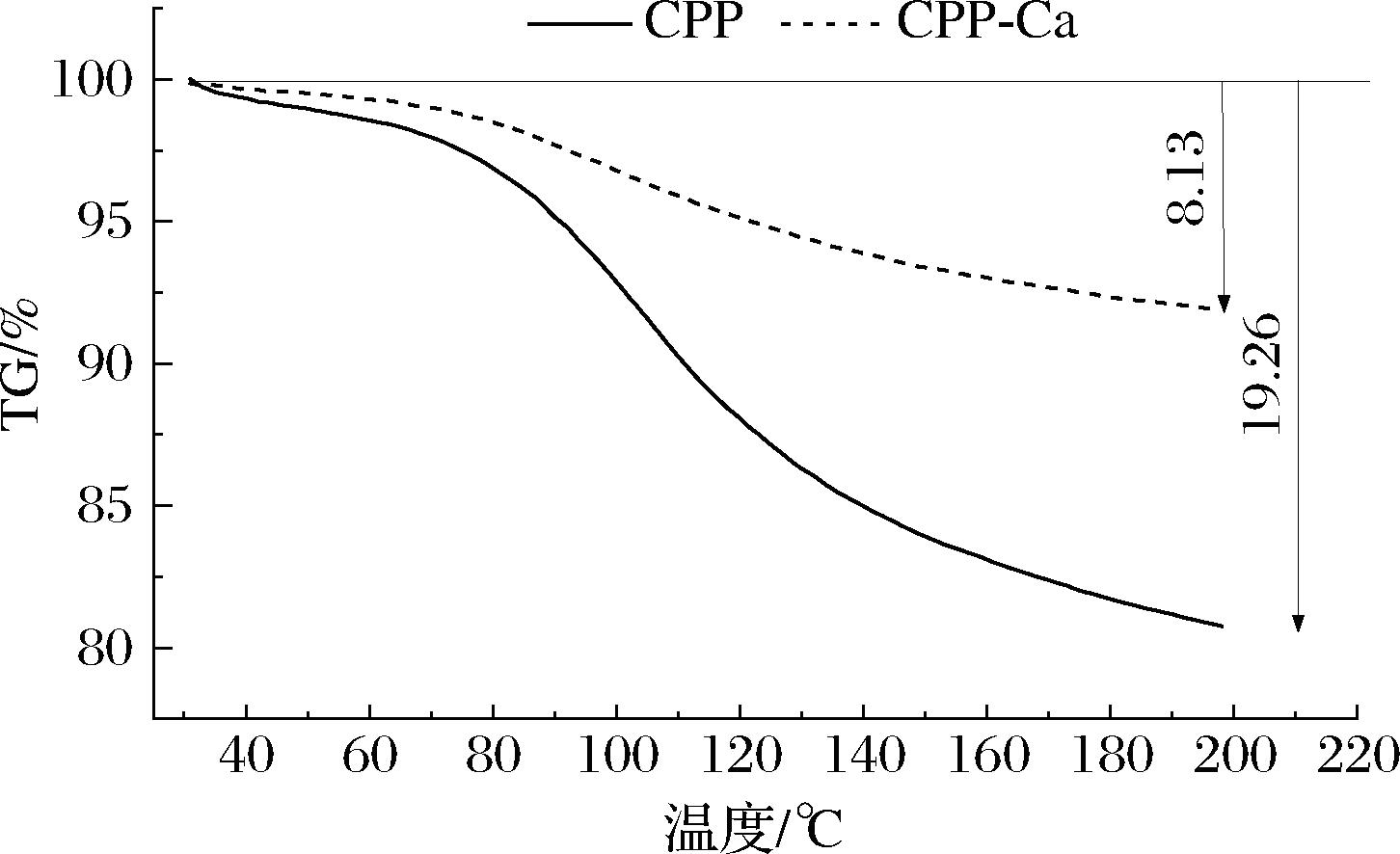
图8 CPP及CPP-Ca热重曲线
Fig.8 Thermo-gravimetric analysis curves of CPP and CPP-Ca
2.5 贝莱斯芽孢杆菌酶解产物钙螯合物功能特性研究
2.5.1 发泡能力及泡沫稳定性
蛋白质的发泡性能与溶液pH值、温度、离子强度、通气速度等有关。由表4可知,室温下1 mg/mL的CPP与CPP-Ca的发泡能力分别为15.67%、17.67%,但螯合前后二者的泡沫稳定性差异显著,随着时间的延长,泡沫体积均有不同程度的下降,室温下放置30 min 后,CPP和CPP-Ca的泡沫稳定性分别为17.08%、93.33%。蛋白质的发泡性能与加工工艺息息相关,有时需要利用其发泡能力,如加入蛋清协助面团膨松,有时则需要避免蛋白质的起泡。在促矿物质吸收多肽的应用中,起过多泡沫不利于生产,因此CPP虽有发泡能力,但其自身泡沫稳定性不高,可以自行消除,但在添加CPP作为食品或者保健品的营养液中,不易积累过多的泡沫,减少消泡剂的使用[19],降低成本,而CPP-Ca则需要适当添加消泡剂。
表4 CPP及CPP-Ca发泡性能
Table 4 Foaming properties of CPP and CPP -Ca
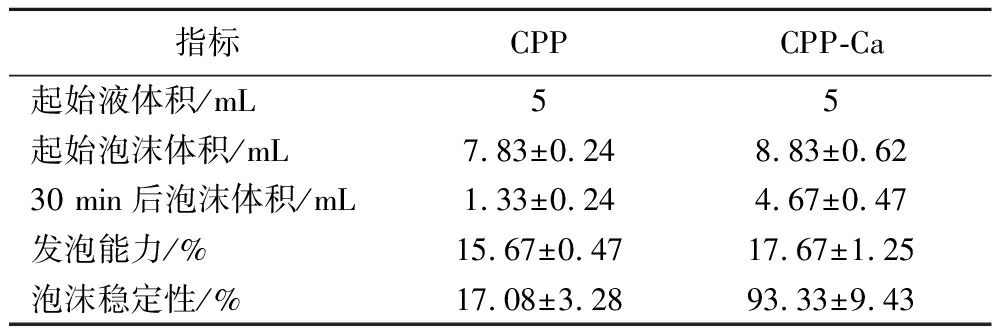
指标CPPCPP-Ca起始液体积/mL55起始泡沫体积/mL7.83±0.248.83±0.6230 min后泡沫体积/mL1.33±0.244.67±0.47发泡能力/%15.67±0.4717.67±1.25泡沫稳定性/%17.08±3.2893.33±9.43
2.5.2 乳化活性及乳化稳定性
乳化活性用于衡量水油形成乳状液的能力,乳化稳定性反应维持乳状液的能力。由表5可知,螯合前后样品的乳化活性差异不大,CPP为2.24 m2/g,CPP-Ca为6.49 m2/g。CPP-Ca的乳化稳定性(37.74 min)显著高于CPP(27.09 min),二者均具有乳化能力,但二者的乳状液稳定能力均不高,说明二者均不利于在油水界面上扩散,且吸附力弱。研究发现,小肽能在界面迅速扩散和吸附,但它们不能像蛋白质分子一样在界面定向和展开,因此无法减小界面张力,其次小肽能被有较强界面吸附能力的大肽从界面排挤掉,故乳化能力较弱[37]。
表5 CPP及CPP-Ca乳化性能
Table 5 Emulsifying properties of CPP and CPP-Ca
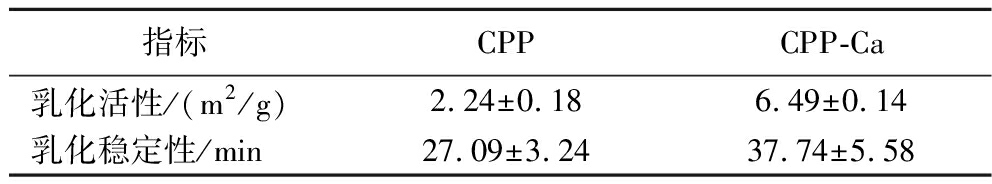
指标CPPCPP-Ca乳化活性/(m2/g)2.24±0.186.49±0.14乳化稳定性/min27.09±3.2437.74±5.58
2.5.3 CPP钙鳌合前后的抗氧化活性
2.5.3.1 CPP钙鳌合前后对DPPH自由基清除能力
由图9-a可知,不同质量浓度的CPP与CPP-Ca对DPPH自由基的清除能力随着质量浓度的增大而提高,为浓度依赖型关系。在200~1 200 μg/mL的质量浓度范围内,CPP的DPPH自由基清除能力由36.17%上升至92.90%,而CPP-Ca的清除能力仅由20.27%上升至45.73%,显著低于螯合前。IC50是自由基清除率为50%时所对应的样品质量浓度,IC50越小,则清除自由基所消耗的样品越少,清除能力越强[38],本实验中,CPP的IC50为510.62 μg/mL,CPP-Ca在此范围未检测到IC50,图9-b为阳性对照抗坏血酸,其在1.25~7.5 μg/mL的IC50为6.16 μg/mL。对DPPH自由基清除能力的顺序为抗坏血酸>CPP>CPP-Ca。有研究发现疏水性氨基酸和芳香族氨基酸的含量与多肽的抗氧化能力有关[39],CPP的抗氧化能力显著强于CPP-Ca,与文献[40]报道的结果一致。
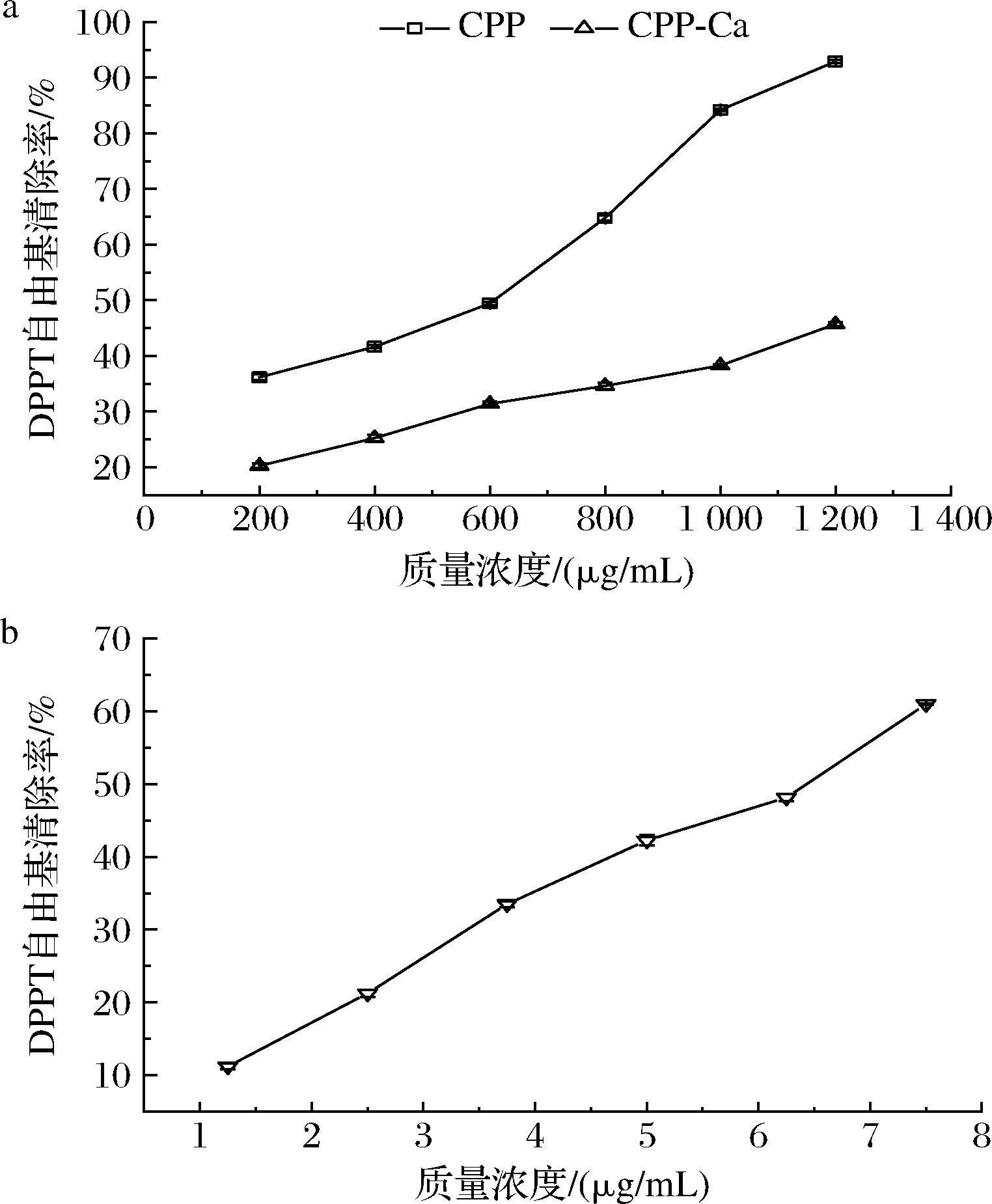
a-CPP、CPP-Ca;b-抗坏血酸
图9 CPP、CPP-Ca及抗坏血酸对DPPH自由基清除能力
Fig.9 The DPPH radical scavenging capacity of CPP,CPP-Ca, and ascorbic acid
2.5.3.2 CPP钙鳌合前后对ABTS阳离子自由基清除能力
由图10-a可知,CPP对ABTS阳离子自由基的清除能力显著高于CPP-Ca,在相同质量浓度范围内,CPP对ABTS阳离子自由基的清除能力由68.42%上升至96.53%,在此范围未检测出IC50。CPP-Ca的清除能力则由15.33%上升至60.87%,IC50为229.44 μg/mL,图10-b中抗坏血酸在1.25~7.5 μg/mL的IC50为4.03 μg/mL。总体对ABTS阳离子自由基的清除能力排序为抗坏血酸>CPP>CPP-Ca,该研究显示,在CPP和CPP-Ca含量为300 μg/mL时,对ABTS阳离子自由基的清除率为96.53%和60.87%,低于文献所报道的浓度范围(8 mg/mL)[40]。说明CPP、CPP-Ca具有很好的自由基清除效果。
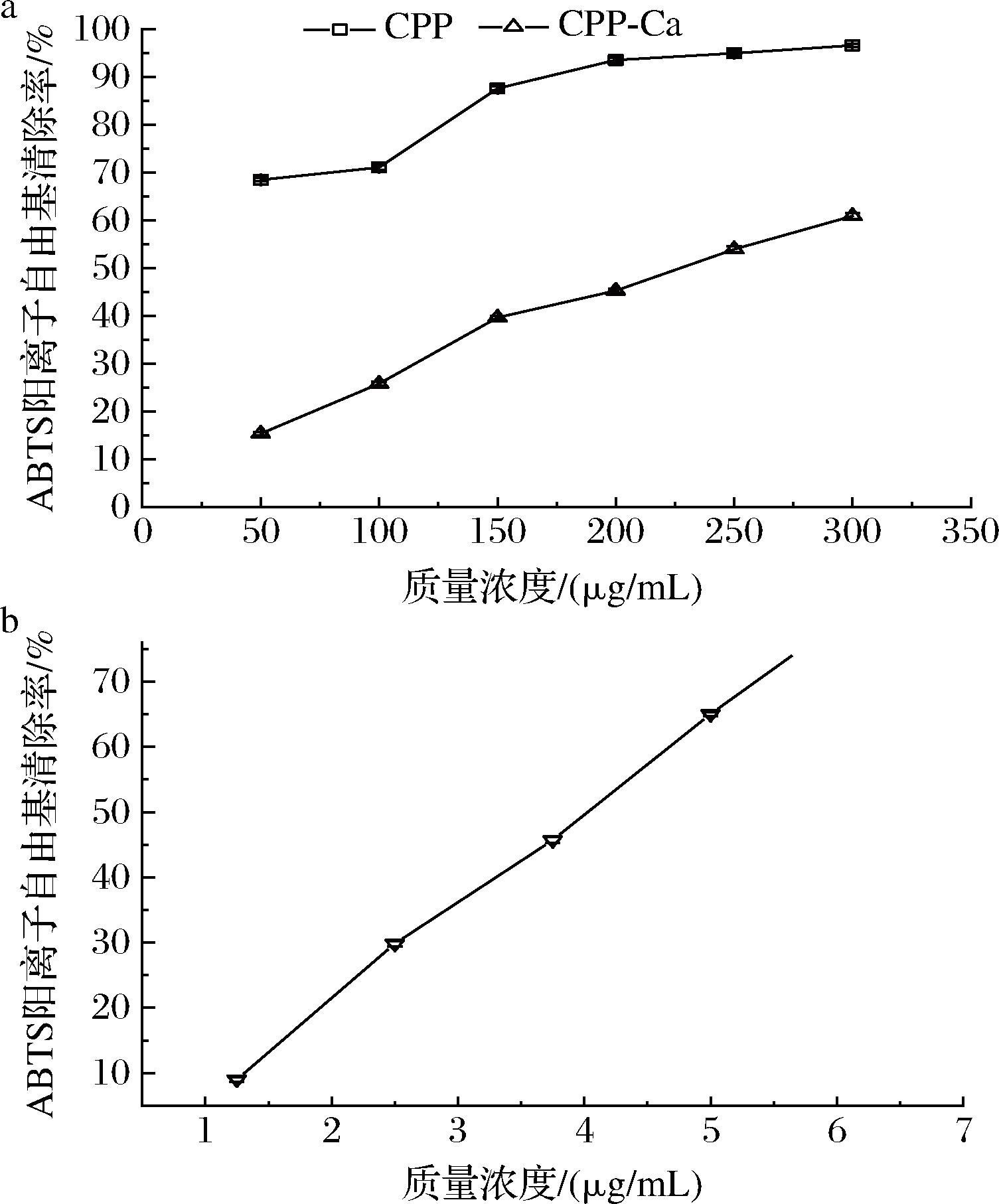
a-CPP、CPP-Ca;b-抗坏血酸
图10 CPP、CPP-Ca及抗坏血酸对ABTS阳离子自由基清除能力
Fig.10 The ABTS cation radical scavenging capacity of CPP,CPP-Ca, and ascorbic acid
2.5.3.3 CPP钙鳌合前后对羟自由基清除活性
由图11-a可知,在200~700 μg/mL,CPP对羟自由基的清除率从2.30%上升至96.54%,IC50为435.78 μg/mL。CPP-Ca对羟自由基的清除率从61.08% 上升至95.65%,在此浓度未检出IC50,图11-b中抗坏血酸在25~150 μg/mL的IC50为86.38 μg/mL。对羟自由基的清除能力综合排序为抗坏血酸>CPP-Ca>CPP。研究发现[39]多肽通过螯合金属离子,进而改变过渡金属的物理位置,可以阻碍金属与脂质和过氧化物的作用,从而实现抗氧化。这说明CPP螯合钙离子后能够阻碍脂质与过氧化物作用,具有一定的羟自由基清除能力。
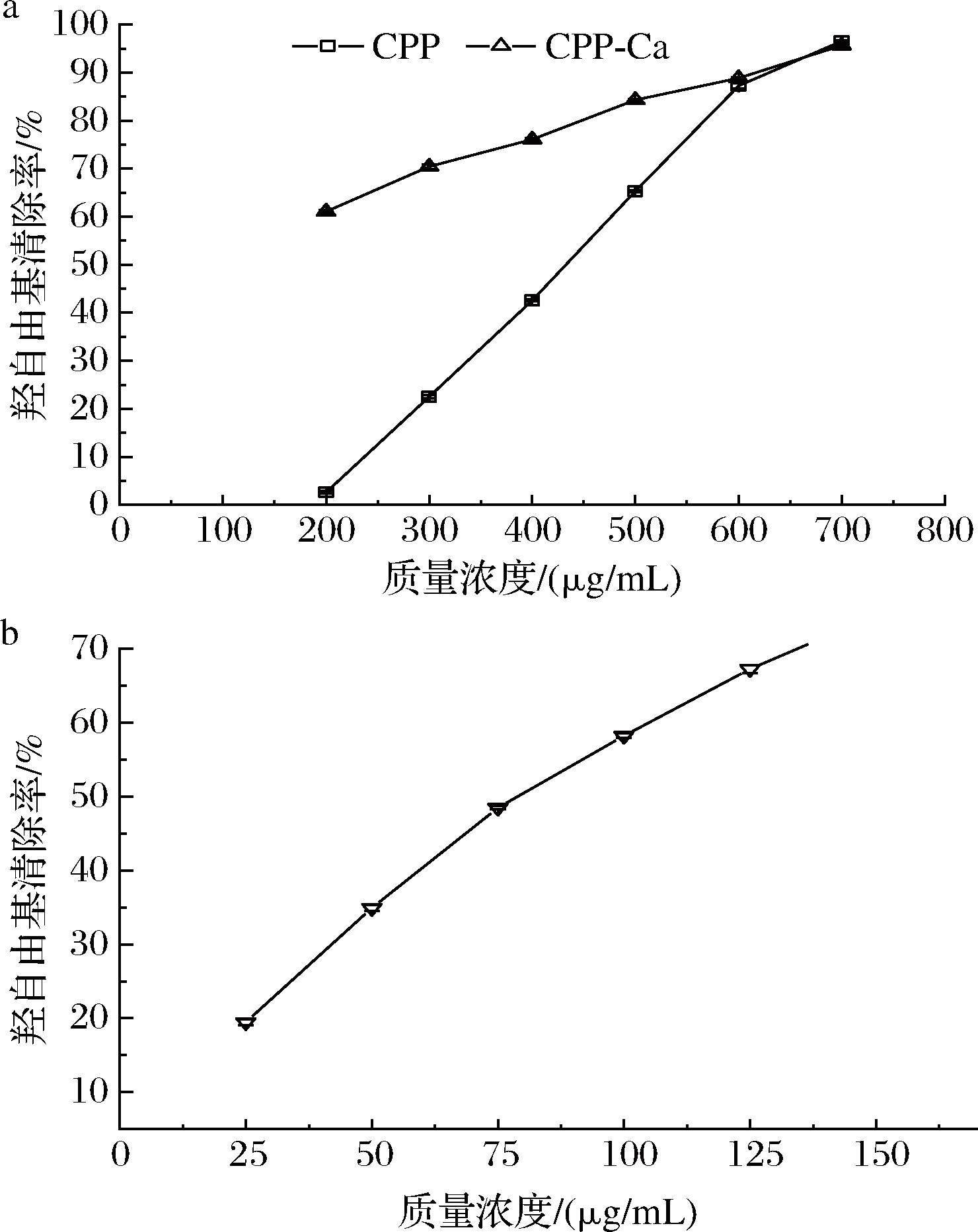
a-CPP、CPP-Ca;b-抗坏血酸
图11 CPP、CPP-Ca及抗坏血酸对羟自由基清除能力
Fig.11 The hydroxyl radical scavenging ability of CPP,CPP-Ca, and ascorbic acid
2.5.3.4 CPP钙鳌合前后对超氧阴离子自由基清除活性
由图12-a可知,在200~800 μg/mL,CPP的超氧阴离子自由基清除率由10.11%上升至54.51%,其IC50为726.05 μg/mL。CPP-Ca的超氧阴离子自由基清除率由12.31%上升至51.97%,IC50为797.51 μg/mL,CPP对超氧阴离子清除能力比CPP-Ca的清除能力高,但变化不大,总体趋势与DPPH自由基、ABTS阳离子自由基和羟自由基的清除趋势一致。图12-b中抗坏血酸在10~60 μg/mL的IC50为100.69 μg/mL。
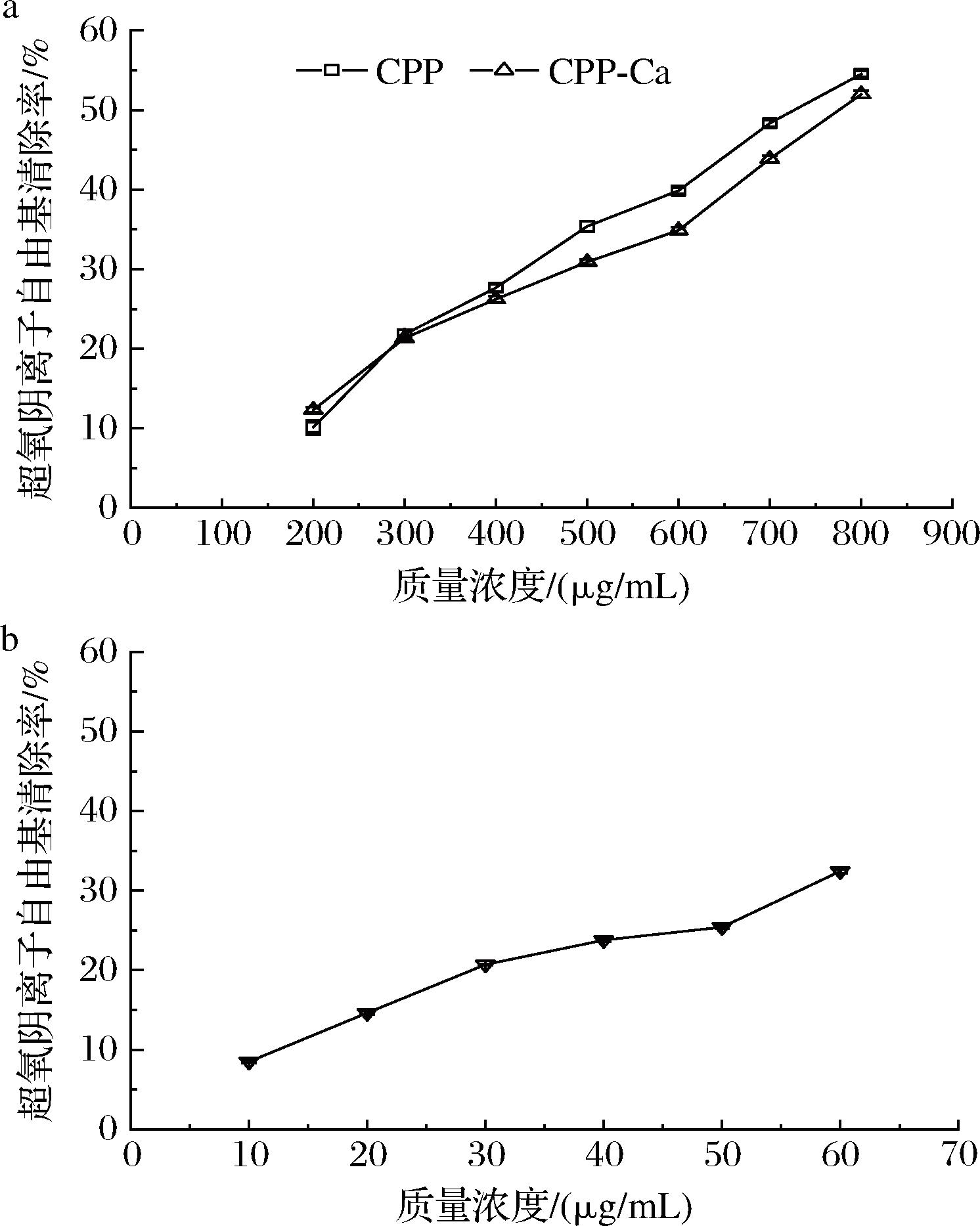
a-CPP、CPP-Ca;b-抗坏血酸
图12 CPP、CPP-Ca及抗坏血酸对超氧阴离子自由基清除能力
Fig.12 The Superoxide anion radical scavenging capacity of CPP, CPP-Ca, and ascorbic acid
抗氧化结果显示,CPP螯合Ca后,其抗氧化活性会发生显著变化,原因是CPP螯合钙后分子结构发生显著变化、多肽表面的负电荷被中和,这种电荷中和可能导致CPP的活性位点被屏蔽,降低了其抗氧化能力[7]。
3 结论
本文对贝莱斯芽孢杆菌酶解产物钙螯合物进行了表征和功能特性研究。结果表明,发现贝莱斯芽孢杆菌具有优良的产蛋白酶能力,透析液中酶活力为(302.37±4.31) U/mL。
以酪蛋白为底物,利用贝莱斯芽孢杆菌所产的蛋白酶酶解制备CPP,CPP含量为47.9%,N/P为4.63±0.14。然后以CPP为原料制备CPP-Ca,CPP-Ca中钙的得率为26.20%。
CPP和CPP-Ca的氨基酸组分分析发现,螯合后必需氨基酸占总氨基酸比值变化不大[27.82±0.16)% vs (26.18±0.08)%],酸性、碱性氨基酸含量均有所提高,疏水性氨基酸、芳香族氨基酸含量降低;紫外扫描发现螯合后形成了新的物质;傅里叶红外光谱显示CPP与钙离子主要在肽链上的氨基、羧基、羧基氧处结合,并引起了二级结构的变化;X衍射分析表明螯合物为无规则非晶型结构;扫描电镜发现螯合后晶体微粒直径变小,结构更致密;差示扫描量热分析及热重分析均显示CPP-Ca较CPP有更好的热稳定性能。
CPP与钙离子螯合后发泡能力及泡沫稳定性提高[(17.67±1.25)%,(93.33±9.43)%],但CPP-Ca极高的泡沫稳定性不利于生产加工,需及时添加消泡剂。此外,螯合后乳化活性及乳化稳定性也有所提升[(6.49±0.14) m2/g,(37.74±5.58) min],但总体吸附力弱,不利于在油水界面上扩散;抗氧化结果表明,CPP-Ca螯合物仍具有一定的抗氧化能力,对DPPH自由基、ABTS阳离子自由基和超氧阴离子自由基的清除能力均为CPP大于CPP-Ca螯合物,但CPP-Ca螯合物对羟自由基清除作用大于其他3种自由基。以上结果说明,CPP和CPP-Ca螯合物均具有较好的功能特性,在医药和食品领域具有应用前景。
综上所述,对贝莱斯芽孢杆菌所产的蛋白酶水解酪蛋白制备CPP并与钙螯合制备CPP-Ca,其具有一定营养及抗氧化能力,是一种极具开发潜力,兼具生物活性的优良补钙制剂。后续将对该菌的产酶能力进行优化和提纯,提高CPP及CPP-Ca的产量和纯度,并通过模拟胃肠道消化过程分析其生物利用度,进一步为贝莱斯芽孢杆菌的综合利用及提高CPP及钙螯合物的生物利用度提供理论依据。
[1] 王默涵, 雷蕾, 王俊, 等.人体的钙吸收与钙营养状况评价[J].现代食品, 2020, 26(24):25-30;47.WANG M H, LEI L, WANG J, et al.Calcium nutrition supplement and evaluation in human[J].Modern Food, 2020, 26(24):25-30;47.
[2] 陆芳芳, 仇立志, 于钦云, 等.基于钙吸收的几种有机钙盐溶解度的研究进展[J].山东化工, 2024, 53(18):109-113;129.LU F F, QIU L Z, YU Q Y, et al.Research on the solubility of several organic calcium salts based on calcium absorption[J].Shandong Chemical Industry, 2024, 53(18):109-113;129.
[3] 赵梓月, 王思远, 廖森泰, 等.多肽螯合钙的研究进展[J].食品研究与开发, 2020, 41(5):200-206.ZHAO Z Y, WANG S Y, LIAO S T, et al.Progress in research on peptide chelated calcium[J].Food Research and Development, 2020, 41(5):200-206.
[4] 乔巍, 许倩, 王宇, 等.酪蛋白磷酸肽提高矿物质元素生物利用度的研究进展[J].乳业科学与技术, 2024, 47(05):32-38.QIAO W, XU Q, WANG Y, et al.Research progress on the role of casein phosphopeptides in improving the bioavailability of mineral elements[J].Journal of Dairy Science and Technology, 2024, 47(5):32-38.
[5] CRUZ-HUERTA E, GARC A-NEBOT M J, MIRALLES B, et al.Caseinophosphopeptides released after tryptic hydrolysis versus simulated gastrointestinal digestion of a casein-derived by-product[J].Food Chemistry, 2015, 168:648-655.
A-NEBOT M J, MIRALLES B, et al.Caseinophosphopeptides released after tryptic hydrolysis versus simulated gastrointestinal digestion of a casein-derived by-product[J].Food Chemistry, 2015, 168:648-655.
[6] 刘成龙, 王玉树, 孙亚松, 等.酪蛋白磷酸肽的功能性研究进展[J].现代食品, 2023, 29(23):29-32.LIU C L, WANG Y S, SUN Y S, et al.Advances in functional research of casein phosphopeptides[J].Modern Food,2023, 29(23):29-32.
[7] 刘卫震, 王冠华, 袁延佩, 等.酪蛋白磷酸肽-钙螯合物的分级、表征及持钙特性[J].食品工业科技, 2024, 45(10):93-100.LIU W Z, WANG G H, YUAN Y P, et al.Fractionation, characterization and calcium-holding properties of casein phosphopeptide-calcium chelates[J].Science and Technology of Food Industry, 2024, 45(10):93-100.
[8] 凌敏, 董自星, 李玉, 等.碱性蛋白酶的异源表达及其在制备CPP中的应用[J].天津科技大学学报, 2016, 31(5):8-13.LING M, DONG Z X, LI Y, et al.Heterologous expression and application of gene encoded alkaline protease in preparation of CPP[J].Journal of Tianjin University of Science &Technology, 2016, 31(5):8-13.
[9] 许沛冬, 易剑锋, 陈迪, 等.贝莱斯芽孢杆菌生防次级代谢产物研究进展[J].生物技术通报, 2024, 40(3):75-88.XU P D, YI J F, CHEN D, et al.Research progress in the biocontrol secondary metabolites of Bacillus velezensis[J].Biotechnology Bulletin, 2024, 40(3):75-88.[10] 张德锋, 高艳侠, 王亚军, 等.贝莱斯芽孢杆菌的分类、拮抗功能及其应用研究进展[J].微生物学通报, 2020, 47(11):3634-3649. ZHANG D F, GAO Y X, WANG Y J, et al.Advances in taxonomy, antagonistic function and application of Bacillus velezensis[J].Microbiology China, 2020, 47(11):3634-3649.
[11] 蒲领平, 邓杰, 卫春会, 等.贝莱斯芽孢杆菌对小曲酒酿造过程中酵母菌生长及风味物质代谢的影响[J].中国酿造, 2023, 42(2):53-57.PU L P, DENG J, WEI C H, et al.Effects of Bacillus velesiensis on the growth and flavor metabolism of yeast during Xiaoqu Baijiu brewing[J].China Brewing, 2023, 42(2):53-57.
[12] 郭艳霞. 高产蛋白酶和乙偶姻的贝莱斯芽孢杆菌YB19的筛选鉴定及应用研究[D].太原:山西农业大学, 2021.GUO Y X.Screening, identification and application of Bacillusvelezensis YB19 based on producing acetoin[D].Taiyuan:Shanxi Agricultural University, 2021.
[13] 郑雪, 高海宁, 崔玮, 等.甲基营养型芽孢杆菌发酵甘草培养基优化[J].中兽医医药杂志, 2021, 40(4):23-28.ZHENG X, GAO H N, CUI W, et al.Optimization of medium for fermenting Radix Glycyrrhiza by Bacillus methylotrophicus[J].Journal of Traditional Chinese Veterinary Medicine, 2021, 40(4):23-28.
[14] 王艳萍. 食品生物技术实验指导[M].北京:中国轻工业出版社, 2012.WANG Y P.Food Biotechnology Experiment[M].Beijing:China Light Industry Press, 2012.
[15] 孟和, 沈明泉.农业生物基础实验教程[M].上海:上海科学技术文献出版, 2006.MENG H, SHEN M Q.Agricultural Biology Basic Experimental Course[M].Shanghai:Shanghai Scientific and Technological Literature Press, 2006.
[16] 李海枝, 王俊, 熊菲菲, 等.不同钙制剂体外消化的稳定性比较及消化后的结构研究[J].食品与发酵工业, 2021, 47(7):116-122.LI H Z, WANG J, XIONG F F, et al.Comparison of the structure and stability of different calcium prepara-tions after digestion in vitro[J].Food and Fermentation Industries, 2021, 47(7):116-122.
[17] 王俊强, 孔祥珍, 华欲飞.大豆肽钙螯合物的制备、稳定性及表征[J].中国油脂, 2019, 44(10):46-50.WANG J Q, KONG X Z, HUA Y F.Preparation,stability and characterization of calcium-binding peptides from soybean meal[J].China Oils and Fats, 2019, 44(10):46-50.
[18] 李静, 冉旭.大鲵皮胶原蛋白肽理化性质和功能特性研究[J].食品工业, 2016, 37(1):217-222.LI J, RAN X.Study on physico-chemical and functional properties of collagen peptide extracted from Andrias davidanus skin[J].The Food Industry, 2016, 37(1):217-222.
[19] 吴伟. 速溶酪蛋白磷酸肽粉的制备及性能研究[D].广州:华南理工大学, 2020.WU W.Study on fabrication and properties of instant casein phosphopeptide powder[D].Guangzhou:South China University of Technology, 2020.
[20] 张友维, 张晖, 王立, 等.枯草芽孢杆菌发酵制备花生多肽及其自由基清除活力的研究[J].中国油脂, 2011, 36(10):25-29.ZHANG Y W, ZHANG H, WANG L, et al.Preparation of peanut peptides using Bacillus subtilis fermentation and their radical-scavenging activities[J].China Oils and Fats, 2011, 36(10):25-29.
[21] 朱秀灵, 叶精勤, 盛伊健, 等.体外模拟消化对苹果多酚及其抗氧化活性的影响[J].食品与发酵工业, 2020, 46(8):63-71.ZHU X L, YE J Q, SHENG Y J, et al.Effects of in vitro simulated digestion on apple polyphenols and their antioxidant activities[J].Food and Fermentation Industries, 2020, 46(8):63-71.
[22] 李彩霞, 焦扬, 崔玮, 等.赤霞珠葡萄梗原花青素的表征及其抗氧化活性研究[J].中国酿造, 2021, 10(40):201-206.LI C X, JIAO Y, CUI W, et al.Characterization and antioxidant activity of proanthocyanidins from Cabernet Sauvignon stalk[J].China Brewing, 2021, 40 (10):201-206.
[23] 黎春红, 张雷刚, 罗淑芬, 等.外源乙烯对采后杏鲍菇内源乙烯释放和衰老进程的影响[J].食品科学, 2018, 39(23):182-191.LI C H, ZHANG L G, LUO S F, et al.Effect of exogenous ethylene treatment on endogenous ethylene production and senescence of postharvest Pleurotus eryngii[J].Food Science, 2018, 39(23):182-191.
[24] 徐曼. 酪蛋白磷酸肽的制备及其持钙能力的研究[D].武汉:武汉轻工大学, 2011.XU M.Preparation of casein phosphopeptides and studies on its calcium-holding ability[D].Wuhan:Wuhan Polytechnic University, 2011.
[25] 姜春秀, 全威, 陈洁, 等.不同酪蛋白磷酸肽产品理化性质与持钙能力的相关性分析[J].食品工业科技, 2021, 42(18):292-299.JIANG C X, QUAN W, CHEN J, et al.Correlation analysis between properties and calcium-holding capacity of different casein phosphopeptide products[J].Science and Technology of Food Industry, 2021, 42(18):292-299.
[26] 梁肖娜, 孔彦文, 张居明, 等.两种酪蛋白磷酸肽阻止钙沉淀形成的比较研究[J].现代食品科技, 2017, 33(3):60-66.LIANG X N, KONG Y W, ZHANG J M, et al.A comparative study on the prevention of calcium precipitation by two types of casein phosphopeptides[J].Modern Food Science and Technology, 2017, 33(3):60-66.
[27] 李建美, 孙琦, 潘健存, 等.两种酪蛋白磷酸肽产品的理化性质和持钙能力的比较[J].中国乳品工业, 2014, 42(3):7-10.LI J M, SUN Q, PAN J C, et al.Study on the comparative analysis of physicochemical properties and the calcium binding capacities between two casein phosphopeptide (CPP) products[J].China Dairy Industry, 2014, 42(3):7-10
[28] ADERINOLA T A, FAGBEMI T N, ENUJIUGHA V N, et al.Amino acid composition and antioxidant properties of Moringa oleifera seed protein isolate and enzymatic hydrolysates[J].Heliyon, 2018, 4(10):e00877.
[29] 张强, 李伟华.抗氧化肽的研究现状[J].食品与发酵工业, 2021, 47(2):298-304.ZHANG Q, LI W H.Research progress of antioxidant peptides[J].Food and Fermentation Industries, 2021, 47(2):298-304.
[30] ZOU T B, HE T P, LI H B, et al.The structure-activity relationship of the antioxidant peptides from natural proteins[J].Molecules, 2016, 21(1):72.
[31] HOU T, LIU Y S, GUO D J, et al.Collagen peptides from crucian skin improve calcium bioavailability and structural characterization by HPLC-ESI-MS/MS[J].Journal of Agricultural and Food Chemistry, 2017, 65(40):8847-8854.
[32] VAVRUSOVA M, SKIBSTED L H.Calcium nutrition bioavailability and fortification[J].LWT-Food Science and Technology, 2014, 59(2):1198-1204.
[33] 阎隆飞, 孙之荣.蛋白质分子结构[M].北京:清华大学出版社, 1999.YAN L F, SUN ZH R.Molecular Structure of Protein[M].Beijing:Tsinghua University Press, 1999.
[34] 杨福愉,黄芬.膜脂-膜蛋白相互作用及其在医学和农业上的应用[M].济南:山东科学技术出版社, 1996.YANG F Y, HUANG F.Study on Lipid-Protein Interaction of Biomembranes and its Applications in Medicine and Agriculture[M].Jinan:Shandong Science and Technology Press, 1996.
[35] 冯思敏, 王晶, 王羽莹, 等.珍珠肽螯合钙的制备与性质表征[J].食品工业科技, 2022, 43(1):119-126.FENG S M, WANG J, WANG Y Y, et al.Preparation and properties of pearl peptide chelated calcium[J].Science and Technology of Food Industry, 2022, 43(1):119-126.
[36] 宫瑞林, 刘伯业, 陈复生, 等.小麦蛋白肽钙螯合物的制备工艺及结构表征[J].河南工业大学学报(自然科学版), 2023, 44(06):1-8;43.GONG R L, LIU B Y, CHEN F SH, et al.Preparation and structural characterization of chelate of wheat protein peptide and calcium[J].Journal of Henan University of Technology(Natural Science Edition), 2023, 44(06):1-8;43.
[37] 牟光庆, 曹冬梅, 张丽萍.酪蛋白磷酸肽(CPP)理化特性的研究[J].食品工业科技, 2003, 24(10):125-127.MOU G Q, CAO D M, ZHANG L P.Study on physicochemical property of casein phosphopeptides[J].Science and Technology of Food Industry, 2003, 24(10):125-127.
[38] 黄爱妮, 王洪斌, 梅大佐, 等.青、红菱角皮中抗氧化物质的提取及其活性[J].食品工业, 2021, 42(6):77-82.HUANG A N, WANG H B, MEI D Z, et al.Extraction and activity of antioxidants from green and red water chestnut peel[J].The Food Industry, 2021, 42(6):77-82.
[39] 李雪芬, 杜斌, 丁轲, 等.金属螯合肽分离纯化及其抗氧化活性的研究进展[J].中国食物与营养, 2016, 22(3):35-39.LI X F, DU B, DING K, et al.Research progress of separation and purification of metal chelating peptides and antioxidant activity[J].Food and Nutrition in China, 2016, 22(3):35-39.
[40] WANG Y, BAI H S, WANG S J, et al.Casein phosphopeptide-calcium chelate:Preparation, calcium holding capacity and simulated digestion in vitro[J].Food Chemistry, 2023, 401:134218.