皮克林乳液(Pickering emulsion)作为一种新型乳液体系,在食品科学领域备受关注。不同于传统乳液,皮克林乳液是一种以固体颗粒作为乳化剂的乳液。固体颗粒在水相和油相中具有一定的浸润性,能够吸附在液滴表面形成致密的界面膜以防止液滴聚集[1]。相较于传统乳液,皮克林乳液具有更强的稳定性、更低的毒性和刺激响应性等优点[2]。无机固体颗粒(如SiO2或TiO2)虽然在乳液应用中显现出良好的特性,但由于它们多为合成材料,可能带来食品安全和环境污染等问题。因此,近年来,生物来源的有机颗粒(如多糖、蛋白质、脂质)作为乳化剂的研究逐渐增多,因其天然性和生物降解性,更加符合食品安全和可持续发展的需求[3]。其中,多糖颗粒因其独特的流变特性和界面活性,在Pickering乳液中展现出提高乳液稳定性、增强保湿性和生物相容性等优势。但单一多糖的功能有限,因此,研究人员通常使用物理或化学改性来改善它们的性能,或者通过多糖复合物作为固体颗粒来形成和稳定皮克林乳液。特别是膳食纤维,作为农业副产物,凭借其优异的生理功能和天然特性,正逐渐受到关注,并被认为是提高皮克林乳液稳定性的理想材料。
柑橘果皮中,不溶性膳食纤维约占柑橘果皮干重的50%,其中主要成分为纤维素、半纤维素和木质素[4]。研究表明,柑橘类纤维保水能力及黏度等性能显著高于其他常见纤维,这些特性使其成为一种有潜力的皮克林乳液颗粒稳定剂[5]。柚皮中含有大量的膳食纤维,并且具有独特的理化性质,表现出较高的保水性/保油性,是一种潜在的天然乳化剂来源。其中,纤维素纳米纤维(cellulose nanofibers,CNFs)、纤维素纳米晶体(cellulose nanocrystals,CNCs)和细菌纤维素(bacterial cellulose,BC),由于具有两亲性、生物相容性和高长径比等特点而被用于稳定食品相关的皮克林乳液。这些纳米纤维素所具备的各向异性纤维结构有助于在非常低的颗粒浓度下稳定乳液。研究人员通过对3种纳米纤维素制备得到的乳液进行表征,发现BC为完全柔性(长径比为615),几乎不具备乳化能力,无法稳定在O/W界面,而半柔性的CNFs乳化能力则优于刚性的CNC,但CNFs稳定的乳液体系中由于耗竭效应占主导,容易造成液滴团簇[6]。另一项研究表明,CNFs能够作用于乳液液滴表面,形成相互缠结的三维网状结构,但由于原纤维在连续相中的缠结,CNFs仍表现出一定的絮凝趋势[7]。果胶是一种可溶性膳食纤维,具有复杂的大分子结构,主要存在于植物细胞壁中。果胶结构区域复杂,其中RG-Ⅰ型果胶侧链能够提高乳化、增稠能力,并且表现出突出的增稠稳定作用[8]。由于单一果胶体系的乳液稳定性有限,目前多由果胶和蛋白复合体用于稳定乳液。但蛋白易受pH、离子强度和温度变化的影响,导致乳液稳定性有限。
因此,本研究以柚子加工副产物中的柚皮为原材料,通过高压均质法制备纤维素纳米纤维(pomelo peel cellulose nanofibers,PCNFs),超高压辅助碱提法提取柚皮果胶(pomelo peel pectin,PP)。构建了PCNFs-PP多糖复合体系来稳定皮克林乳液,对乳液稳定性、流变特性及稳定机理进行了探究,评价了它们在不同的温度、pH和离子强度下的稳定性。本研究将为多糖复合物的开发和应用提供新的参考。
1 材料与方法
1.1 材料与试剂
新鲜沙田柚,广东省梅州市集贸市场;一级大豆油,上海益海嘉里食品营销有限公司;ProClean 300,上海碧云天生物技术有限公司;染色剂尼罗红,上海阿拉丁生化科技股份有限公司;钙荧光白,上海懋康生物科技有限公司;所有化学试剂均为分析纯。
1.2 仪器与设备
ST85B3-1真空冷冻干燥机,美国 Millrock公司;GA-10H高压均质机,上海朗灏孚纳米科技有限公司;Ultra Turrax®T18高速均质机,德国 IKA 公司;UV-1900i紫外分光光度计,日本岛津公司;MCR502模块化智能高级流变仪,德国Anton Paar公司;Zatasizer Nano ZS 90纳米粒度仪、Mastersizer 3000激光粒度分析仪,英国Malvern公司;ECLIPSE Ts2-FL光学显微镜,日本东京Nikon 公司;Quanta 450生物冷冻扫描电镜,美国FEI公司。
1.3 实验方法
1.3.1 纤维素纳米纤维的制备
根据WEN等[9]描述的方法进行纳米纤维素的制备。首先将柚子海绵层切成2~3 cm的小块,干燥后使用粉碎机进行粉碎,过60目筛。将100 g粉末分散到2 L去离子水中,用盐酸调节pH值至1.7。将悬浮液在80 ℃下加热2 h去除果胶,静置冷却、离心(5 000 r/min,10 min)。沉淀用去离子水洗涤至中性,冷冻干燥后得到粗纤维素。将40 g粗纤维素粉末与800 mL 8%(质量分数)的NaOH混合在70 ℃下加热1.5 h,冷却,过300目滤布去除半纤维素和木质素。收集沉淀用去离子水洗涤至中性,干燥得到纯化后的纤维素。最后将纤维素以1∶200的质量比分散在去离子水中,然后通过高压均质机在140 MPa下均质10个循环以获得纤维素纳米纤维溶液。
1.3.2 果胶的制备
根据HOU等[10]描述的方法进行果胶的制备。萃取溶剂为0.01 mol/L氢氧化钠溶液(pH 12.0),将50 g 柚皮粉与2 L萃取溶剂混合,装入真空封口袋中。通过超高压装置进行处理,压力设置为500 MPa,保压时间为10 min,室温20~22 ℃。收集混合物,离心取上清液以1∶2的质量比加入95%(体积分数)乙醇,静置过夜,使果胶充分沉淀。将沉淀洗涤3次去除杂质,旋转蒸发去除乙醇,收集混合物冷冻干燥后得到PP。
1.3.3 皮克林乳液工艺参数的确定
将冷冻干燥得到的果胶分散到超纯水中,得到浓度为0.1%~0.9%(质量分数)的果胶溶液。同时制备浓度为0.1%~0.9%(质量分数)的纤维素纳米纤维溶液,保存在4 ℃冰箱中备用。使用T18高速均质机进行均质,固定转速为10 000 r/min。以乳化剂与油相的添加顺序、乳化剂添加比例以及乳化剂浓度为变量,通过测定乳液Zeta电位、粒径、乳化指数(emulsion index,EI)、乳化活性指数(emulsification activity index,EAI)以及乳化稳定性指数(emulsification stability index,ESI)来确定最佳乳液制备参数。
1.3.3.1 添加顺序对乳液性质的影响
固定PCNFs、PP溶液浓度均为0.5%(质量分数),先将2.5 mL PP与5 mL大豆油混合均质1 min得到混合物,随后向混合物中添加2.5 mL PCNFs混合均质1 min,将得到皮克林乳液转移到玻璃瓶中,样品记为A1。改变PCNFs和PP添加顺序,重复上述操作,得到的乳液样品记为A2。先将2.5 mL PCNFs与2.5 mL PP均质1 min得到混合物,随后向混合物中添加5 mL大豆油混合均质1 min,得到的乳液样品记为A3。
1.3.3.2 添加比例对乳液性质的影响
固定PCNFs、PP溶液浓度均为0.5%(质量分数),PCNFs、PP添加总量为5 mL。将PP和PCNFs分别按1∶0、1∶1、1∶3、1∶5、1∶7 体积比混合均质1 min,再添加5 mL大豆油混合均质1 min,得到的乳液转移至玻璃瓶中备用,样品分别记为B1、B2、B3、B4、B5。
1.3.3.3 添加浓度对乳液性质的影响
固定PCNFs溶液浓度为0.5%(质量分数),PCNFs、PP添加量均为2.5 mL。控制PP溶液浓度为0.1%、0.3%、0.5%、0.7%、0.9%(质量分数)。将PCNFs与不同浓度的PP溶液混合均质1 min,再添加5 mL大豆油混合均质1 min,得到的乳液转移到玻璃瓶中备用,样品分别记为C1、C2、C3、C4、C5。
1.3.4 皮克林乳液的乳化性质
根据PEARCE等[11]描述的方法测定乳化活性指数和乳化稳定性指数。简单来说,将50 μL新鲜乳液加入到5 mL 0.1%(体积分数)的SDS溶液中,混合均匀。然后使用紫外分光光度计在500 nm处测量吸光度。10 min后取50 μL乳液重复上述操作步骤,读取吸光度。以0.1%(体积分数)的SDS溶液为参比。EAI和ESI计算如公式(1)、公式(2)所示:
(1)
(2)
式中:A,500 nm处吸光度;DF,稀释倍数,100;c,10 000 g/m3;θ,乳液的油相体积分数,0.5;φ,比色皿长度,1 cm;A0和A10,第0 min和第10 min时稀释后乳液的吸光度;Δt,10 min。
1.3.5 皮克林乳液的制备
将冷冻干燥得到的果胶颗粒分散到去离子水中,得到0.5%(质量分数)的果胶溶液。固定高速剪切机均质条件为:10 000 r/min,1 min。先将0.5%(质量分数)的纤维素纳米纤维与大豆油混合,使混合物均质。再向混合物中加入与纤维素纳米纤维等体积的果胶溶液,均质得到粗乳液。粗乳液通过高压均质机均质2个循环,得到不同高压均质压力(p=30、50、70、90、110 MPa,φ=0.5)和不同油相分数(φ=20%、30%、40%、50%、60%,p=50 MPa)的皮克林乳液,并向乳液中加入ProClean 300(0.1%)以抑制微生物生长。形成的皮克林乳液转移到玻璃瓶中,保存在4 ℃冰箱中备用。
1.3.6 粒径和电位
采用Mastersizer 3000激光粒度仪测定颗粒大小。采用Zatasizer Nano ZS 90纳米粒度仪测量乳剂的Zeta电位。检测前用去离子水将样品稀释400倍,避免多次散射效应。这2项测量均在25 ℃的温度下进行。采用D[3,2]值对乳液粒径进行表征,D[3,2]值(表面加权平均直径)的计算如公式(3)所示:
(3)
式中:ni,具有相同直径的粒子数;di,直径。所有的试验都进行3次,结果显示为平均值。
1.3.7 乳液外观及乳化指数
用移液枪吸取5 mL乳液至试管内,通过目测观察和测量EI来表征乳液的贮存稳定性。乳化指数由公式(4)计算:
(4)
式中:H2,乳化层高度;H1,乳液总高度。
1.3.8 乳液微观结构观察
采用光学显微镜在用20倍物镜下观察乳液的微观结构。为了探究乳液的稳定机理,采用共聚焦激光扫描显微镜(confocal laser scanning microscopy,CLSM)观察乳液。观察前,将20 μL尼罗红和荧光白(1 mg/mL)加入到1 mL乳液中,在室温黑暗环境中孵育过夜,然后将 20 μL乳液沉积于凹形共聚焦显微镜载玻片上,盖上干净的盖玻片,并用20倍物镜观察乳液液滴。激发波长分别为514、405 nm。使用冷冻扫描电子显微镜(cryo-scanning electron microscopy,Cryo-SEM)进一步观察 PCNFs-PP在乳液液滴中的分布。将一滴乳液沉积于样品台上,然后将样品台投入液氮雪泥中快速冷冻30 s,使用低温冷冻制备传输系统在真空状态下将其转移至样品制备腔室进行升华镀金处理。样品在-90 ℃升华10 min之后以10 mA的电流溅射镀金60 s,送入扫描电镜样品室观察,冷台温度-140 ℃,加速电压5 kV。
1.3.9 流变特性
利用配有40 mm平行板的模块化智能高级流变仪表征乳液的流变学特性。测试时gap值设置为1.0 mm,温度为25 ℃。选取0.5%作为特定应变值进行频率扫描,记录频率从0.1 Hz变化到10 Hz的储能模量(G′)和损耗模量(G″)。对于稳态剪切黏度分析,剪切速率设定为0.1~100 s-1,将样品的表观黏度(η)记录为剪切速率的函数。
1.3.10 稳定性
探究不同pH、离子强度和温度对乳液稳定性的影响。首先固定PP、PCNFs浓度均为0.5%(质量分数),添加比例为1∶1,高压均质条件为:50 MPa,循环2次。在探究离子强度对乳液稳定性的影响时,用NaCl调整乳液的离子强度为:0、40、80、120、160、200 mmol/L。在探究温度对乳液稳定性的影响时,控制贮存温度为4、25、50、80 ℃。探究不同pH值对乳液稳定性的影响时,利用1 mol/L NaOH或1 mol/L HCl调节样品的pH值为:3、5、7、9、11。所有样品在不同环境下贮藏24 h。
1.4 数据处理
所有数据都采用 Microsoft Excel 进行处理,图片采用 Origin 2021 进行绘制,采用SPSS 22 软件进行统计学分析,P<0.05表示差异显著。每组实验进行3次平行实验,数据以“平均值±标准差”表示,字母代表显著性差异。
2 结果与分析
2.1 乳液工艺参数的确定
2.1.1 添加顺序对乳液性质的影响
Zeta电位是衡量体系稳定性的重要指标,其大小决定了分散体系在应用环境中能否保持良好的稳定性。目前普遍认为当Zeta电位绝对值大于30 mV时,较强的静电斥力能够阻止液滴聚集,有助于形成稳定的乳液[12]。在表1中,所有样品的Zeta电位绝对值均保持在33 mV以上且无显著性差异,表明改变颗粒稳定剂添加顺序对Zeta电位没有显著性影响。
表1 不同颗粒稳定剂添加顺序对乳液Zeta电位、粒径和乳化性质的影响
Table 1 Effects of different particle stabilizer addition sequence on Zeta potential, particle size and emulsification properties of emulsions

样品Zeta电位/mVD[4,3]/μmD[3,2]/μm乳化性质EAI/(m2/g)ESI/minA1-36.2±1.8a78.0±0.8c15.9±0.2c7.49±0.12a43.05±0.25bA2-33.5±2.0a58.7±0.4a11.8±0.2a7.80±0.10b45.04±0.08cA3-33.4±2.4a72.8±1.1b13.0±0.1b7.62±0.16a37.01±0.32a
注:不同小写字母表示组间具有显著性差异(P<0.05)(下同)。
众所周知,更小的液滴粒径有助于增强乳液的稳定性。表1显示了不同添加顺序对液滴尺寸具有显著性影响,样品A2的D[3,2]值最小为(11.8±0.2) μm,显著低于其余样品,这可能是由于PCNFs先与油相结合形成皮克林乳液,然后加入PP形成界面包覆,这些形态的变化影响了复合颗粒的吸附和堆积行为,进而减小了液滴粒径[13]。
EAI和 ESI值是表征乳液稳定能力和抵抗分离和保持分散能力的重要指标。在表1中,通过改变颗粒稳定剂的添加顺序对EAI和ESI具有显著影响。样品A2对应的EAI和ESI值显著高于其余样品,这是由于较小的乳液粒径通常意味着更高的表面积和接触面积,有助于增强乳液的稳定性和乳化效果。同添加顺序对乳液EI值的影响如图1所示,所有乳液在最初的2 h迅速分层,随后在3~4 d内脂肪上浮达到最终的平衡。EI值是衡量乳液稳定性的重要指标之一,EI值越低,说明乳液越稳定。样品A1和A2的EI值相对较高,且样品A2的粒径显著低于其他样品。因此选择先添加PCNFs,再添加PP作为皮克林乳液体系中颗粒稳定剂的添加顺序。
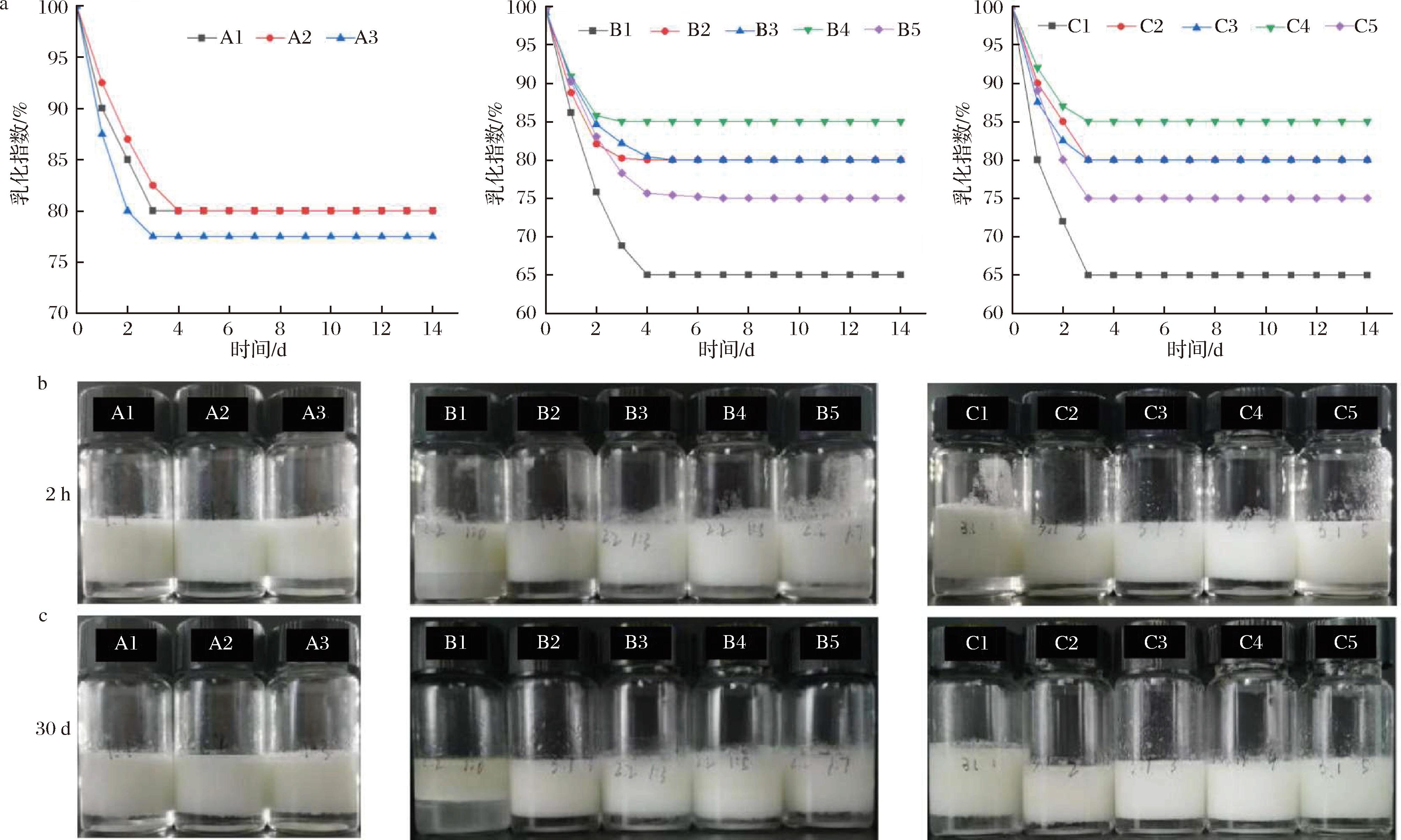
a-乳化指数变化图;b-贮存2 h后的乳液外观图;c-贮存30 d后的乳液外观图
图1 不同颗粒稳定剂的添加顺序、添加比例、添加浓度对乳液乳化指数和乳液外观的影响
Fig.1 Effects of addition sequence, proportion and concentration of different particle stabilizers on emulsion emulsification index and appearance
2.1.2 添加比例对乳液性质的影响
不同颗粒稳定剂添加比例对乳液性质的影响如表2所示,改变添加比例对乳液粒径及Zeta电位有显著性影响。随着PCNFs添加比例的升高,乳液Zeta 电位绝对值呈现逐渐升高的趋势,这可能归因于PCNFs 上大量的羧酸盐单元的存在,随着PCNFs比例的增加会导致乳液Zeta电位值进一步降低[14]。值得注意的是,样品B1的Zeta电位仅为(-17.5±2.1) mV,表明单一果胶乳液体系的稳定性较差,这点还反映在乳化指数上(图1)。此外,随着PCNFs添加比例的增加,乳液的粒径呈现先降低后升高的趋势,说明添加一定量的PCNFs有助于形成更稳定的乳液。样品B2的EAI值和ESI值在不同程度上高于其余样品。
表2 不同颗粒稳定剂添加比例对乳液Zeta电位、粒径和乳化性质的影响
Table 2 Effect of different proportion of particle stabilizer on Zeta potential, particle size and emulsification property of emulsion
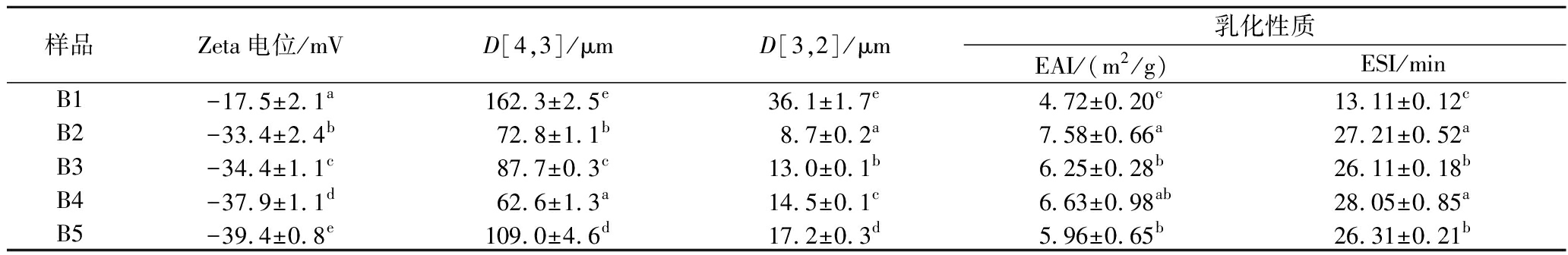
样品Zeta电位/mVD[4,3]/μmD[3,2]/μm乳化性质EAI/(m2/g)ESI/minB1-17.5±2.1a162.3±2.5e36.1±1.7e4.72±0.20c13.11±0.12cB2-33.4±2.4b72.8±1.1b8.7±0.2a7.58±0.66a27.21±0.52aB3-34.4±1.1c87.7±0.3c13.0±0.1b6.25±0.28b26.11±0.18bB4-37.9±1.1d62.6±1.3a14.5±0.1c6.63±0.98ab28.05±0.85aB5-39.4±0.8e109.0±4.6d17.2±0.3d5.96±0.65b26.31±0.21b
不同颗粒稳定剂添加比例对乳化指数的影响如图1所示,所有样品在最初的2 h迅速分层,并在2~4 d达到平衡。其中,样品B1在贮存14 d后破乳,油水两相完全析出,说明单一PP在贮存过程中无法有效稳定乳液。随着PCNFs的添加比例逐渐升高,乳液乳化指数呈现先升高后降低的趋势。除样品B1、B5,其余样品在贮存2周后EI值均保持在80%及以上,最终选取样品B2对应的添加比例[V(PP)∶V(PCNFs)=1∶1]作为皮克林乳液中颗粒稳定剂的添加比例。
2.1.3 添加浓度对乳液性质的影响
不同颗粒稳定剂添加浓度对乳液性质的影响如表3所示,由于果胶中羧基的存在,果胶被认为是一种聚电解质,在中性条件下带负电[15]。随着PP添加浓度的增加,样品的Zeta电位呈现逐渐降低的趋势。添加浓度的变化对乳液的粒径均具有显著性影响,随着PP添加浓度的增加乳液的粒径呈现先降低后增加的趋势,其中样品C3的粒径显著低于其他样品。观察表3可以发现,改变添加比例对乳液EAI值的影响较小,但对乳液ESI值具有显著性影响,样品C1的ESI值显著低于于其余样品,表明单一果胶稳定的乳液体系的稳定性较差。
表3 不同颗粒稳定剂添加浓度对乳液Zeta电位、粒径和乳化性质的影响
Table 3 Effects of different particle stabilizer concentrations on Zeta potential, particle size, and emulsification properties of emulsions

样品Zeta电位/mVD[4,3]/μmD[3,2]/μm乳化性质EAI/(m2/g)ESI/minC1-34.0±2.0c114.3±3.2c18.6±0.2c6.76±0.88a16.54±0.86cC2-31.8±1.5a101.5±5.6b18.2±0.6c7.22±0.19a26.40±0.75aC3-33.4±2.4b72.8±1.1a13.0±0.1a7.62±0.10a27.01±0.92aC4-36.8±1.7d113.7±3.2c18.5±0.6c5.28±0.40b26.60±0.69aC5-38.1±1.3e117.0±4.6c16.0±0.4b6.88±1.08a23.83±0.37b
不同颗粒稳定剂添加比例对乳化指数的影响如图1所示,所有样品在最初的2 h迅速分层,并在3 d内达到平衡。随着PP添加浓度的逐渐升高,乳液乳化指数呈现先升高后降低的趋势。除样品C1、C5外其余样品乳化指数均在80%及以上,最终选取样品C3对应的浓度(0.5% PP、0.5% PCNFs)作为皮克林乳液中颗粒稳定剂的添加浓度。
2.2 乳液的外观和微观结构分析
为探究高压均质压力(p)对乳液性质是否有影响,制备了不同高压均质压力(p=30、50、70、90、110 MPa)的乳液,并拍摄了不同贮存时间下的乳液外观图(图2)。结果表明,当高压均质压力从30 MPa增加到110 MPa时,乳液的外观并无明显变化,在贮存30 d后个别样品出现了轻微的析水现象。观察图2-d和图2-e发现,过高的高压均质压力反而会导致乳液粒径的增大和电位绝对值的降低,这与REN等[16]的研究结果类似,说明高压均质在一定压力范围内能够显著减小液滴的粒径,超过一定压力将导致液滴的聚集。

a-不同均质压力下乳液的光学显微镜图像;b-不同油相分数下乳液的光学显微镜图像;c-乳液外观图;d-乳液的粒径和乳化指数图;e-乳液的Zeta电位
图2 不同均质压力和油相比例对乳液微观结构、乳液外观、粒径、乳化指数以及Zeta电位的影响
Fig.2 Different homogeneous pressure and oil phase ratio on microstructure, latex emulsion appearance, particle size, emulsification index and the influence of Zeta potential
注:图a和图b中,A~E分别代表均质压力30、50、70、90、110 MPa;比例尺长度为50 μm(下同),不同小写字母表示组间具有显著性差异(P<0.05)(下同)。
此外,油相比例(φ)对乳液稳定性的影响至关重要。图2-c为不同油相比例(φ=20%、30%、40%、50%、60%,体积分数)的贮存外观图,当油相比例从20%增加到60%时,乳液乳化层比例逐渐升高直至全部乳化,虽然在贮存30 d后部分样品(φ=20%、30%、40%)的乳化指数略有下降(图2-d),但与GUO等[17]的样品相比仍表现出较强的贮藏稳定性。观察图2-b和图2-d会发现,油相比例的变化能显著影响乳液的粒径。研究结果表明,随着油相比例的增加,皮克林乳液的乳化层比例逐渐升高,液滴尺寸逐渐增大。BADAR等[18]也报道了类似的情况,当油水体积比从20%增加到80%,液滴尺寸约从7 μm提高到了23 μm,乳化指数也逐渐从30%提高到了100%。这可能归因于随着油相比例的增加,导致体系中的颗粒不足以有效地稳定所有油滴,最终聚集形成更大的液滴。
2.3 流变特性
为了说明不同高压均质压力和油相添加比例对乳液性质的影响,利用流变仪评价了在不同均质压力和不同油相比例下乳液的流变学特性。观察图3-a和图3-b可以发现,PCNFs-PP稳定的皮克林乳液表现出典型的剪切稀化行为,表观黏度随着剪切速率的增加而降低,表现出典型的乳液特征。在动态频率扫描范围内,均质压力对模量的影响没有明显差异。在不同剪切速率范围内,更高的均质压力诱导了更高的黏度,因此可以通过改变均质压力来控制PCNFs-PP基皮克林乳液的流变性能。

a-不同均质压力下乳液的黏度曲线;b-不同油相分数下乳液的黏度曲线;c-不同均质压力下乳液的模量曲线;d-不同油相分数下乳液的模量曲线
图3 不同均质压力和油相比例对乳液黏度、储能模量G′和损耗模量G″的影响
Fig.3 Different homogeneous pressure and oil phase proportion of emulsion viscosity and storage modulus G ′and loss modulus G″
图3-c和图3-d表征了不同均质压力和不同油相比例下乳液的频率-模量曲线。结果显示所有乳液样品的储能模量(G′)均大于损耗模量(G″),这表明PCNFs-PP稳定的皮克林乳液在在特定的频率范围(0.1~10 Hz)内表现为弹性凝胶样行为[19]。随着油相体积分数的增加,乳液的黏度以及模量随之增大,可以归因于高油相体积分数下油滴的紧密堆积导致乳液黏度和弹性的增加。
2.4 稳定性
在皮克林乳液应用的过程中,高温、高盐、酸碱性条件是普遍的过程操作环境。要使皮克林乳液应用到不同的给药或食品体系中,就需要针对不同的外部环境对乳液稳定性进行评价。探究了不同离子强度(40~200 mmol/L)、温度(4、25、50、80 ℃)和pH值(3.0~11.0)对乳液性质的影响。
在皮克林乳液的实际应用中,离子强度对乳液稳定性的影响不容忽视。实验探究了不同离子强度对皮克林乳液稳定性的影响如图4所示,当添加的NaCl浓度从40 mmol/L提高到200 mmol/L时,乳液的微观形态和液滴直径几乎保持不变(图4-a和图4-b)。乳液的Zeta电位绝对值随着离子强度的增加而持续降低,这可能导致乳液乳化指数的降低(图4-b和图4-c)。这可能归因于在加入不同浓度的NaCl后,产生的静电屏蔽效应导致乳液的液滴发生了不同程度的聚集现象[20]。然而,这些变化并没有破坏皮克林乳液。

a-光学显微镜图像;b-粒径和乳化指数图;c-Zeta电位图
图4 不同离子强度对乳液的微观结构、粒径、乳化指数以及Zeta电位的影响
Fig.4 Different ionic strength on the microstructure, particle size of emulsion, emulsion index and the influence of Zeta potential
注:a图中mM代表mmol/L。
不同贮存温度对乳液性质的影响如图5所示,乳液在不同温度下的微观形貌规则,大小均匀,液滴分散良好(图5-a)。在贮存24 h后乳液未发生絮凝和分层等现象,乳化指数始终保持在100%(图5-b)。当温度从4 ℃升高到50 ℃时,乳液的Zeta电位绝对值从44.93 mV降低到了43.13 mV,Zeta电位绝对值仍大于30 mV,说明乳液体系仍保持在高度稳定的状态。乳液粒径几乎保持不变(图5-b),这可能归因于低温下液滴的热运动减慢,导致颗粒之间的相互作用减弱,从而减少液滴的聚集倾向。当环境温度达到80 ℃时,乳液的粒径显著增大(24.3 μm,图5-b),伴随着液滴的聚集,乳液的Zeta电位也发生了相应变化,Zeta电位绝对值从最初的44.93 mV降低到了21.5 mV。这是由于乳液具有热力学不稳定性[21],在长期的高温条件(80 ℃)下,乳液液滴出现聚集现象。
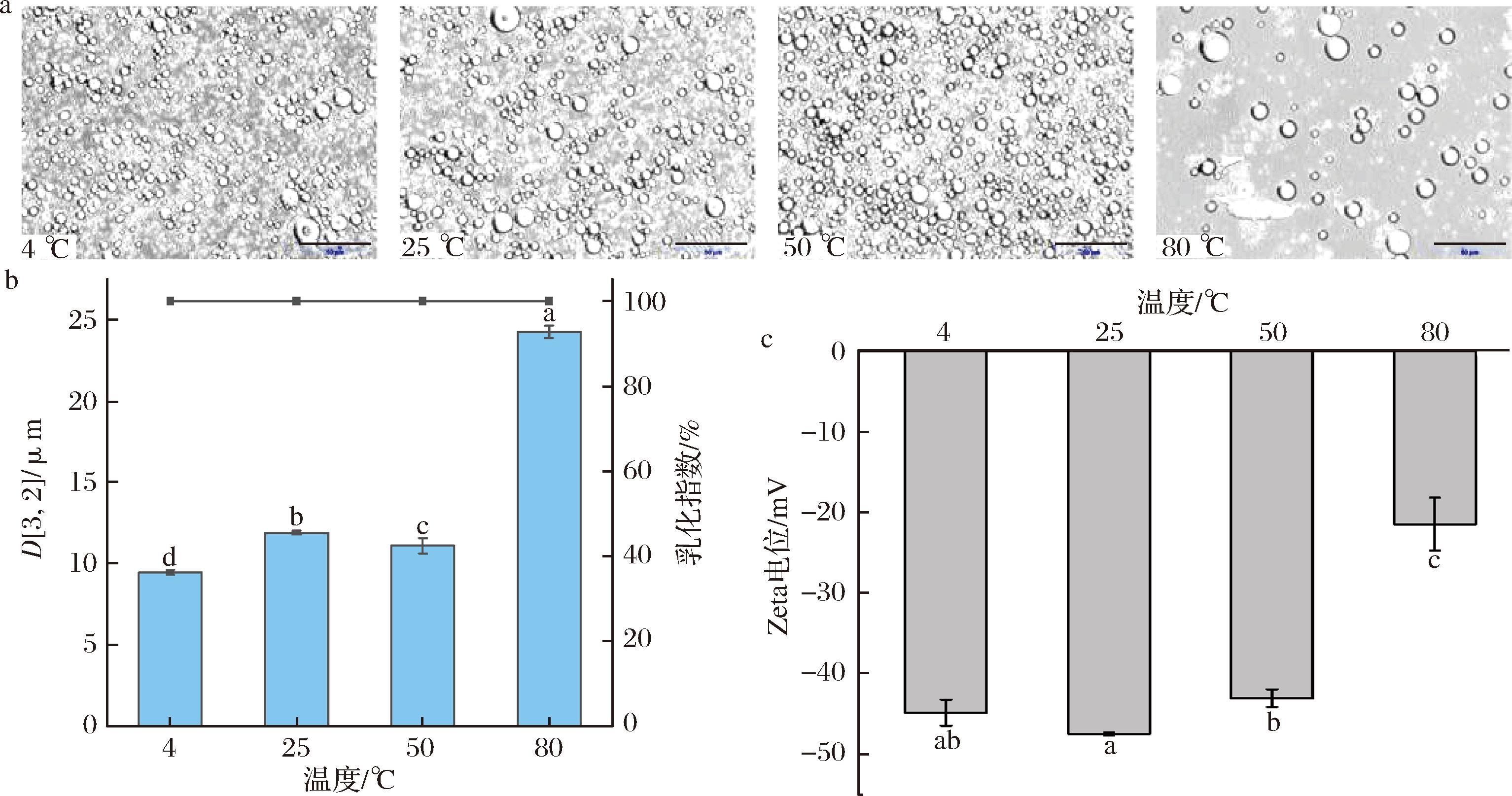
a-光学显微镜图像;b-粒径和乳化指数图;c-Zeta电位图
图5 不同温度对乳液微观结构、粒径、乳化指数以及Zeta电位的影响
Fig.5 Different temperature on the microstructure, particle size of emulsion, the emulsifying index and the influence of Zeta potential
这些结果表明,皮克林乳液在较宽的温度范围内具有较强的稳定性,能确保其在食品加工和贮存过程中保持良好的乳化状态。
不同pH值对乳液性质的影响如图6所示。从光学显微镜图像(图6-a)来看,乳液液滴呈规则的球形,所有样品显示出良好的分散性。在较宽的pH范围内(5~9)乳液粒径大小几乎没有显著变化(图6-b)。与之前的报道类似,皮克林乳液在酸性条件下(pH 3~5)的Zeta电位绝对值较低(图6-c),这可能归因于PP和PCNFs表面的部分羧酸基在酸性条件下的被质子化[22],导致液滴之间的静电斥力相对较弱。碱性条件下,随着环境pH的增加,PP和PCNFs逐渐去质子化,Zeta电位绝对值逐渐升高(图6-c)。值得注意的是,在酸性条件下乳液的乳化指数发生了轻微的降低(图6-b),随着环境pH的增加(pH 7~11),乳液的水层逐渐消失,这可能是因为柑橘纤维在碱性条件下具有更高的膨胀能力,能够使水分进入其中[23]。另外一项研究表明,纤维素表面的羟基能够与水分子形成氢键,使水分子结合在纤维表面,进而减少水分的析出[24]。

a-光学显微镜图像;b-粒径和乳化指数图;c-Zeta电位图
图6 不同pH值对乳液微观结构、粒径、乳化指数以及Zeta电位的影响
Fig.6 Different pH value on the microstructure, particle size of emulsion, emulsion index, and the influence of Zeta potential
此外,在不同pH条件下乳液的粒径均保持在11.9~14.1 μm,光学显微镜下乳液液滴分布均匀(图6-a),说明PCNFs-PP稳定的皮克林乳液具有较强的pH稳定性。
2.5 稳定机制
所有乳剂通过荧光染料染色,并在CLSM下观察其形态。图7描绘了由PCNFs-PP协同稳定的皮克林乳液的CLSM图像。由图7可以看出呈现红色荧光的油相被呈现蓝色荧光的PCNFs-PP水相所包覆,证明由PCNFs-PP稳定的皮克林乳液为水包油(O/W)型乳液。

图7 PCNFs-PP稳定的皮克林乳液的共聚焦激光扫描显微镜图像
Fig.7 Confocal laser scanning microscope image of PCNFs-PP stabilized Pickering emulsion
乳液在冷冻扫描电子显微镜图像中可以直接观察到颗粒在乳液中的分布。观察图8-a可以发现,PP在乳液中呈现多层网状结构,通过将乳液液滴捕获在层状结构中来稳定乳液。通过观察PCNFs在乳液液滴中的分布(图8-b),发现PCNFs 形成了连接乳液液滴的3D网络结构和聚集体。

a-PP颗粒;b-PCNFs颗粒;c-PCNFs-PP
图8 不同颗粒稳定的皮克林乳液的冷冻扫描电子显微镜图像
Fig.8 Freeze-scanning electron microscopy images of Pickering emulsions stabilized with different particles
在加入PP后乳液液滴被捕获并稳定在 PCNFs-PP形成的3D网状结构中(图8-c),并通过果胶形成的多层网状结构将其包裹,同时观察图8-a~图8-c可以发现,在相同的均质条件下,由PCNFs-PP协同稳定的皮克林乳液的液滴大小均匀,且粒径要明显小于单一颗粒所稳定的乳液。
3 结论
在本次研究中,首先通过对乳液的粒径、Zeta电位以及乳化性质进行表征和比较,确定了最佳的皮克林乳液制备方案为:先添加PCNFs稳定乳液,再添加PP进行协同稳定;PCNFs和PP的添加浓度均为0.5%(质量分数),添加质量比为1∶1。采用高压均质制备得到的皮克林乳液具有更小的粒径,不同的均质压力对乳液性质影响较小,油相的体积分数会显著影响乳液液滴的粒径和乳化指数。流变学结果表明,G′>G″,表明皮克林乳液形成了凝胶状网络结构,随着油相体积分数的增加,皮克林的黏度和模量逐渐增大,有利于提高乳液长期的稳定性。另外,研究了乳液在不同环境下的稳定性,结果表明,乳液在4~50 ℃能够保持长期的稳定,高温会使乳液发生严重的聚集现象。离子强度的增加会导致静电屏蔽效应的产生,使乳液性质发生轻微变化,但乳液在0~200 mmol/L的离子强度仍能保持稳定。由于纤维素碱性条件下的持水能力更强,因此乳液在中性及碱性条件下不容易发生相分离,具有较强的pH稳定性。CLSM和SEM图像观察证实,相对于单一颗粒制备的皮克林乳液,PCNFs-PP协同稳定的皮克林乳液具有更强的稳定性,乳液液滴通过与纤维素纳米纤维形成的三维网状结构和果胶形成的多层网状结构结合,阻碍了液滴的絮凝和聚集。本研究开发了一种新型的多糖复合体系作为稳定的皮克林乳液的颗粒,为多糖基皮克林乳液体系的开发和应用提供了参考。本研究开发的多糖基Pickering乳液原料成本约为7元/kg(实验室规模)。其核心优势在于将成本低廉的农业废弃物转化为高附加值的功能材料,同时兼具食品安全性和生物活性。该体系特别适用于功能性食品递送系统,如益生菌包埋、活性成分控释以及作为缓释给药载体,展现出良好的应用前景。本研究构建的新型多糖复合稳定体系,为开发低成本、高性能的食品级Pickering乳液提供了参考。
[1] CHEN L J, AO F, GE X M, et al.Food-grade Pickering emulsions:Preparation, stabilization and applications[J].Molecules, 2020, 25(14):3202.
[2] GONZALEZ ORTIZ D, POCHAT-BOHATIER C, CAMBEDOUZOU J, et al.Current trends in Pickering emulsions:Particle morphology and applications[J].Engineering, 2020, 6(4):468-482.
[3] BERTON-CARABIN C C, SCHROЁN K.Pickering emulsions for food applications:Background, trends, and challenges[J].Annual Review of Food Science and Technology, 2015, 6:263-297.
[4] YANG X H, MAO K M, SANG Y X, et al.Citrus derived Pickering emulsion stabilized by insoluble citrus dietary fiber modified by ultra-high pressure[J].LWT, 2023, 184:115112.
[5] QI J R, SONG L W, ZENG W Q, et al.Citrus fiber for the stabilization of O/W emulsion through combination of Pickering effect and fiber-based network[J].Food Chemistry, 2021, 343:128523.
[6] LU Y, LI J, GE L L, et al.Pickering emulsion stabilized with fibrous nanocelluloses:Insight into fiber flexibility-emulsifying capacity relations[J].Carbohydrate Polymers, 2021, 255:117483.
[7] PIROZZI A, BETTOTTI P, FACCHINELLI T, et al.Tailoring nanostructured cellulose for efficient Pickering emulsions stabilization[J].Macromolecular Materials and Engineering, 2024, 309(5):2300451.
[8] ZHANG S K, WATERHOUSE G I N, DU Y Y, et al.Structural, rheological and emulsifying properties of RG-I enriched pectins from sweet and sour cherry pomaces[J].Food Hydrocolloids, 2023, 139:108442.
[9] WEN J, ZHANG W, XU Y J, et al.Cellulose nanofiber from pomelo spongy tissue as a novel particle stabilizer for Pickering emulsion[J].International Journal of Biological Macromolecules, 2023, 224:1439-1449.[10] HOU Z Q, CHEN S G, YE X Q.High pressure processing accelarated the release of RG-I pectic polysaccharides from citrus peel[J].Carbohydrate Polymers, 2021, 263:118005.
[11] PEARCE K N, KINSELLA J E.Emulsifying properties of proteins:Evaluation of a turbidimetric technique[J].Journal of Agricultural and Food Chemistry, 1978, 26(3):716-723.
[12] SUN Y W, CHAI X H, HAN W J, et al.Pickering emulsions stabilized by hemp protein nanoparticles:Tuning the emulsion characteristics by adjusting anti-solvent precipitation[J].Food Hydrocolloids, 2023, 138:108434.
[13] CUI F Z, ZHAO S L, GUAN X, et al.Polysaccharide-based Pickering emulsions:Formation, stabilization and applications[J].Food Hydrocolloids, 2021, 119:106812.
[14] GONZ LEZ M M, BLANCO-TIRADO C, COMBARIZA M Y.Nanocellulose as an inhibitor of water-in-crude oil emulsion formation[J].Fuel, 2020, 264:116830.
LEZ M M, BLANCO-TIRADO C, COMBARIZA M Y.Nanocellulose as an inhibitor of water-in-crude oil emulsion formation[J].Fuel, 2020, 264:116830.
[15] HUMEREZ-FLORES J N, VERKEMPINCK S H E, VAN LOEY A M, et al.Targeted modifications of citrus pectin to improve interfacial properties and the impact on emulsion stability[J].Food Hydrocolloids, 2022, 132:107841.
[16] REN Z Y, CHEN Z Z, ZHANG Y Y, et al.Characteristics and rheological behavior of Pickering emulsions stabilized by tea water-insoluble protein nanoparticles via high-pressure homogenization[J].International Journal of Biological Macromolecules, 2020, 151:247-256.
[17] GUO S S, LI X, KUANG Y S, et al.Residual lignin in cellulose nanofibrils enhances the interfacial stabilization of Pickering emulsions[J].Carbohydrate Polymers, 2021, 253:117223.
[18] BADAR I H, WANG Z Y, SUN F D, et al.Influence of varying oil phase volume fractions on the characteristics of flaxseed-derived diglyceride-based Pickering emulsions stabilized by modified soy protein isolate[J].Food Research International, 2024, 175:113812.
[19] WANG D W, WANG K, ZHAO L, et al.Fabrication and application of pickering emulsion stabilized by high pressure homogenization modified Longan shell nanofiber[J].Journal of Food Engineering, 2023, 339:111264.
[20] LIU W, LIU K, WANG Y X, et al.Sustainable production of cellulose nanofibrils from Kraft pulp for the stabilization of oil-in-water Pickering emulsions[J].Industrial Crops and Products, 2022, 185:115123.
[21] JIANG H, SHENG Y F, NGAI T.Pickering emulsions:Versatility of colloidal particles and recent applications[J].Current Opinion in Colloid &Interface Science, 2020, 49:1-15.
[22] TAVAKOLIAN M, KOSHANI R, TUFENKJI N, et al.Antibacterial Pickering emulsions stabilized by bifunctional hairy nanocellulose[J].Journal of Colloid and Interface Science, 2023, 643:328-339.
[23] LUNDBERG B, PAN X J, WHITE A, et al.Rheology and composition of citrus fiber[J].Journal of Food Engineering, 2014, 125:97-104.
[24] LOVIKKA V A, RAUTKARI L, MALONEY T C.Changes in the hygroscopic behavior of cellulose due to variations in relative humidity[J].Cellulose, 2018, 25(1):87-104.