杜仲(Eucommia ulmoids.),为杜仲科杜仲属,是天然药食两用的植物[1-2]。杜仲是雌雄异株的植物,杜仲雄花生长于雄株的枝条基部,花量大且易于采集[3]。杜仲雄花2014年被国家卫生健康委列入新食品原料名单。在传统药理学中,杜仲雄花主要被用于滋补肝肾、强筋壮骨等,其花粉含有多种氨基酸、黄酮类化合物等有益成分,这些成分赋予了杜仲雄花一定的药用价值[4]。
氧化应激是指机体在遭受各种有害刺激时,体内高活性分子如活性氧自由基(reactive oxide species,ROS)和活性氮自由基(reactive nitrogen species,RNS)会产生过多,使得氧化程度超出氧化物的清除,氧化系统和抗氧化系统失衡,从而导致组织损伤。长期下来,这种损伤可能最终诱发衰老、炎症以及神经退行性等疾病[5]。抗氧化剂的使用能够有效预防由氧化应激所导致的疾病[6]。
抗氧化剂发挥作用的机理主要是通过清除自由基、阻断链式反应和螯合金属离子来保护细胞和组织免受氧化损伤[7]。相较于人工合成的抗氧化剂,来源于动植物或微生物的天然抗氧化剂通常被认为更安全且高效。其中,多肽作为一种新兴的天然抗氧化剂,因其具有抗氧化能力强、营养价值丰富、人体吸收快且无毒副作用等优点,近年来逐渐成为抗氧化剂领域研究的热点之一[8-9]。目前,对抗氧化肽的研究主要集中在它的来源、制备、分离纯化、结构鉴定、作用机制分析以及产品应用等方面[10-11],对杜仲雄花的研究主要集中于黄酮类、环烯醚萜类等活性成分的提取与分离及其药理活性的研究,以及功能性食品的开发应用[4,12-13],但关于杜仲雄花中的多肽是否具有抗氧化活性,以及抗氧化机制和作用靶点尚不清楚。
网络药理学和分子对接技术能从多维度评估活性成分的作用机制,并预测受体与配体之间的亲和力和相互作用模式为活性成分的研究提供了新思路和新方法[14]。本研究采用网络药理学方法筛选杜仲雄花多肽发挥抗氧化作用的潜在活性成分和靶点,并通过分子对接分析活性成分与抗氧化靶点之间的相互作用,探究其抗氧化作用机制,以期为杜仲雄花多肽抗氧化产品的开发和应用提供参考依据。
1 材料与方法
1.1 材料与试剂
杜仲雄花,湖南张家界;乙腈、二硫苏糖醇、三氟乙酸 ,成都科隆化学品有限公司;甲酸、蛋白酶抑制剂,默克密理博公司。
1.2 仪器与设备
NanoElute超高效液相质谱联用仪,Bruker Daltonics 公司;离心机,湘仪仪器有限公司;冷冻干燥机,东京理化 EYELA 公司。
1.3 实验方法
1.3.1 潜在活性成分筛选
杜仲雄花多肽序列来源于本课题组构建[15]。使用在线工具PeptideRanker(http://distilldeep.ucd.ie/PeptideRanker)对所有的序列进行生物活性评分,筛选评分大于0.9的序列[16];在SwissADME网站中预测其ADME性质,潜在活性成分的筛选标准为生物活性评分大于0.9、脂水分配系数(molecular lipophilicity,MLOGP)小于0、不具有血脑屏障透过性、是糖蛋白底物。
1.3.2 潜在活性成分-疾病靶点筛选
在网站Swiss Target Prediction(http://www.swisstargetprediction.ch)中获取杜仲雄花多肽潜在活性成分靶点。氧化应激相关的疾病靶点在GeneCards(https://www.genecards.org/)中检索,以“antioxidant”作为关键词。通过Veney2.1.0网站(https://bioinfogp.cnb.csic.es/tools/venny/index.html)获取活性成分靶点与氧化应激相关靶点的交集,得到杜仲雄花多肽潜在活性成分抗氧化的交集靶点,并绘制韦恩图[17]。
1.3.3 蛋白互作(protein-protein interaction,PPI)网络构建
将获得的抗氧化交集靶点在STRING网站(https://cn.string-db.org/)中构建PPI网络,最低要求交互得分设置为0.4,将网络中未连接点隐藏;通过Cytoscape10.3.2软件对PPI网络进行可视化处理;采用CentiScaPe插件计算网络节点的介数中心性(betweenness centrality,BC)、接近中心性(closenes centrality,CC)、度中心性(degree centrality,DC)值[18],分别选取BC值、CC值、DC值排名前八的靶点,取交集获得核心靶点[16]。
1.3.4 GO和KEGG富集分析
使用DAVID数据库(https://david.ncifcrf.gov/)对获得的交集靶点进行生物信息学分析,包括GO功能注释和KEGG通路的富集分析,筛选的条件为P<0.05,并在微生信平台上对数据进行可视化处理[19]。
1.3.5 分子对接
选取PPI网络中的核心靶点作为受体蛋白,以8种潜在活性成分作为配体分子,通过Chem Draw 21.0.0软件来构建多肽的3D结构,并在Chem 3D软件中对其进行能量最小化处理。受体蛋白的晶体结构从蛋白质数据库PDB(https://www.rcsb.org/)中下载,并删除晶体结构中的水分子和原配体,添加氢原子和CHARMm36力场。采用discovery studio(DS)软件进行分子对接,使用CDOCKER模块完成对接工作,从一个抗氧化肽的不同对接结果中,选择-CDOCKER ENERGY能量值最高的一个作为最终的结果[16,18]。
2 结果与分析
2.1 杜仲雄花多肽的长度、氨基酸组成分析
多肽的抗氧化活性与其氨基酸组成和疏水性密切相关[20]。如图1所示,杜仲雄花多肽的氨基酸肽数包含了六肽到三十六肽,主要集中于八肽(15%)、九肽(15%)、十肽(14%)、十一肽(12%)、十二肽(9%)(图1-A)。氨基酸组成中,疏水性氨基酸的占比最高,为40%,其次是极性不带电荷的氨基酸,为31%,碱性氨基酸占15%,酸性氨基酸占14%(图1-A、图1-C),此外,图1-B中杜仲雄花的N端含有48%的疏水性氨基酸,有研究发现,疏水性氨基酸,如丙氨酸(alanine,A)、缬氨酸(valine,V)、亮氨酸(leucine,L)和异亮氨酸(isoleucine,I)等,可以作为芳香残基侧链上自由基过氧化的供氢体,提高肽在脂质中的溶解度,从而增强抗氧化性[21],尤其是当疏水性氨基酸位于肽链的N端或者C端时,对多肽抗氧化活性的影响更大[22]。图1-B共包含20种不同的氨基酸,其中L占比最高为8%,其次A、V、精氨酸(arginine,R)、天冬氨酸(aspartic acid,D)、谷氨酸(glutamic acid,E)、甘氨酸(glycine,G)占比均为7%,赖氨酸(lysine,K)、I、丝氨酸(serine,S)占比均为6%。图1-B,碱性氨基酸,精氨酸(R)和赖氨酸(K)在C端占比最大,分别为55%和44%,有研究表明精氨酸具有清除DPPH自由基和ABTS阳离子自由基的能力,以及一定程度的还原力[23],赖氨酸能够增加谷胱甘肽浓度、降低ROS水平,并提高氧化剂耐受性[24]。基于以上分析,推测杜仲雄花多肽可能具有一定的抗氧化活性。

A-肽数的分布和组成的氨基酸性质;B-氨基酸的组成和分布;C-不同长度肽的氨基酸分布
图1 杜仲雄花多肽的统计分析
Fig.1 Statistical analysis of peptides from E.ulmoides male flowers
2.2 潜在活性成分筛选
共筛选出8种潜在活性成分,如表1所示,它们的序列分别为GGDLGPFGR、FDPGFYPR、GDGNCFFR、WDWDALR、EFMFYR、AWFQEFR、DPLFWR、GPFPFDK。一般来说,生物活性评分值越大,生物活性越大[25],这8种潜在活性成分的活性评分值分别为0.93、0.96、0.97、0.91、0.91、0.92、0.97、0.94,它们具有较高的生物活性。MLOGP是用于预测物质在油水两相中的分配情况的参数,它反映了物质的亲脂性,当MLOGP值越小,说明该物质越亲水,反之,越大,则越亲油[26]。在药物设计中,MLOGP小于等于0通常意味着化合物具有较好的亲水性,这可能有助于药物的吸收和生物利用度,这8种潜在活性成分的MLOGP均小于0,分别为-4.21、-2.16、-3.85、-2.89、-0.58、-2.45、-0.4、-0.37,说明它们具有较好的亲水性。不具有血脑屏障透过性的物质在药物设计中具有特定优势,它们可能更适合作为局部治疗剂,能减少对中枢神经系统的潜在副作用,或可用于靶向非中枢神经系统的疾病[27]。此外,这些物质可能更容易控制剂量和减少全身性副作用,8种潜在活性成分均不具有血脑屏障透过性,可能在药物设计中具有特定的优势。糖蛋白底物可以被糖蛋白识别并从细胞中排出,这可能有助于减少药物在体内的积累,从而降低毒性和副作用,这8种潜在活性成分作为糖蛋白底物,可能有助于调节药物的体内过程,从而提高药物的疗效和安全性[28]。
表1 杜仲雄花多肽中潜在活性成分
Table 1 Potential active ingredient in the peptides of E.ulmoides male flowers
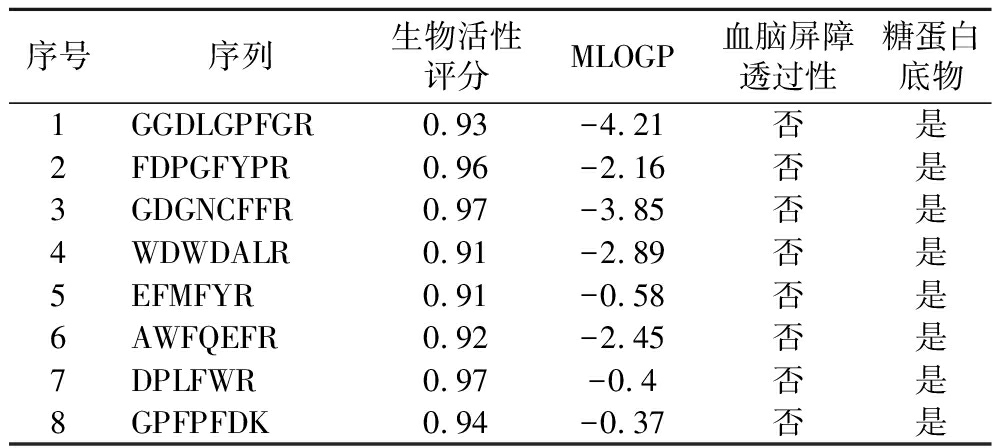
序号序列生物活性评分MLOGP血脑屏障透过性糖蛋白底物1GGDLGPFGR0.93-4.21否是2FDPGFYPR0.96-2.16否是3GDGNCFFR0.97-3.85否是4WDWDALR0.91-2.89否是5EFMFYR0.91-0.58否是6AWFQEFR0.92-2.45否是7DPLFWR0.97-0.4否是8GPFPFDK0.94-0.37否是
2.3 潜在活性成分-疾病靶点与PPI网络分析
通过Swiss Target Prediction数据库筛选出271个与杜仲雄花多肽相关的潜在活性成分靶点,以“antioxidant”作为搜索关键词,在数据库GeneCards中检索收集到与抗氧化相关的靶点4 923个[18]。使用Veney2.1.0网站,将潜在活性成分靶点与抗氧化相关的靶点取交集获得154个靶点(图2-A),占杜仲雄花多肽潜在活性成分靶点总数的56.83%,杜仲雄花多肽对抗氧化相关的靶点映射率为3.13%。
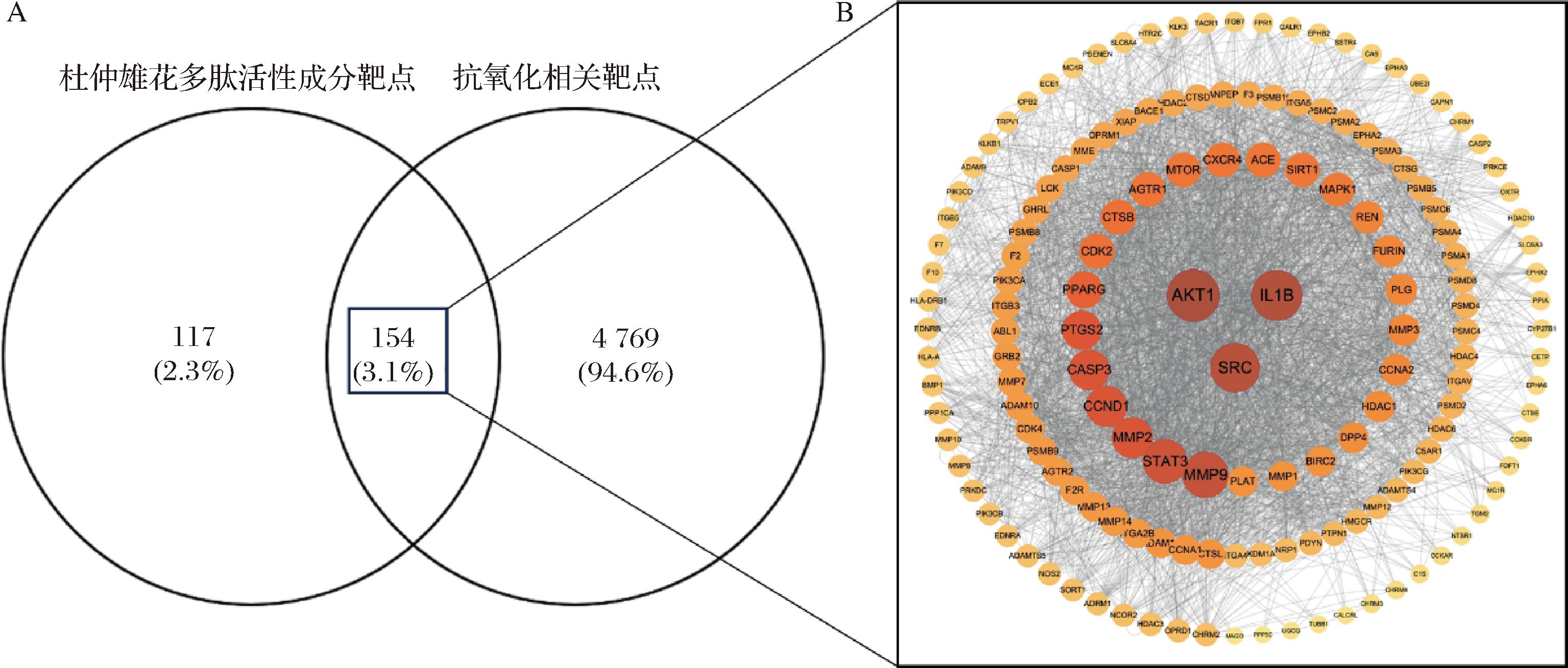
A-杜仲雄花多肽潜在活性成分靶点与抗氧化相关靶点交集韦恩图;B-杜仲雄花多肽抗氧化靶点蛋白PPI图
图2 杜仲雄花多肽中抗氧化靶点及其PPI网络图
Fig.2 Antioxidant targets and PPI network of peptides from E.ulmoides male flowers
将筛选出的154个交集靶点上传至STRING平台构建PPI网络。如图2-B所示,删除未连接的点后PPI网络共有153个蛋白节点,3 106条相互作用的边。每个节点根据DC值的不同大小呈现,Degree值越大,节点面积越大,颜色越深,说明该靶点可能发挥的作用越大[18,25]。SRC、IL1B、AKT1、STAT3、MMP9、MMP2、CCND1、CASP3等8个靶点的连接度较高,属于该网络的核心节点,可能是杜仲雄花多肽发挥抗氧化作用的关键靶点[29]。
分别取BC值、CC值、DC值排名前8的靶点,取交集获得核心靶点5个,见表2,分别为SRC(非受体型络氨酸激酶),IL1B(白介素1β),AKT1(蛋白激酶Bα),MMP9(基质金属蛋白酶9),STAT3(信号转导及转录激活蛋白3)。SRC是目前研究最多的SRC激酶,是细胞内信号传导中的关键激酶,它在氧化应激反应中的作用机制是多方面的,首先,SRC被激活后是许多生化级联反应的关键点,可介导NADPH氧化酶(NADPH oxidase,NOX)激活从而增加ROS水平,而增加的ROS水平可以通过促进关键半胱氨酸残基的氧化和硫化进一步激活SRC;此外,SRC还与非偶联内皮型一氧化氮合酶(endothelial nitric oxide synthase,eNOS)在血管内皮生长因子(vascular endothelial growth factor,VEGF)的刺激下磷酸化HSP90的Thr300残基,促进eNOS与HSP90的偶联,促进NO的释放,且在NO的负反馈调节机制中仍然存在SRC的作用;同时,SRC还调节核因子-E2相关因子的核输出及降解,抑制下游抗氧化酶基因的表达。以上这些作用表明SRC在氧化应激反应中发挥重要作用,通过影响ROS的产生和抗氧化酶的表达,进而影响细胞的氧化还原平衡[30]。IL1B靶点在氧化应激反应中的作用机制涉及炎症反应和氧化损伤的调控[31]。研究表明,雌马酚(Equol,一种大豆异黄酮代谢物)通过抑制IL1B,减轻了氧化应激对人牙周韧带干细胞(human periodontal ligament stem cells,hPDLSCs)成骨分化的抑制作用,具体表现为碱性磷酸酶活性和钙结节形成的恢复,以及骨形态发生蛋白2(bone morphogenetic protein 2,BMP2)和Runt相关转录因子2(runt-Related transcription factor 2,RUNX2)表达的上调。综上,调节IL1B靶点可减轻氧化应激反应,进而发挥抗氧化作用[32]AKT1是PI3K-AKT信号通路的关键分子,参与调节细胞存活、增殖和代谢,在抗氧化机制中,AKT1通过磷酸化下游分子如FOXO转录因子,影响抗氧化基因的表达从而保护细胞免受氧化损伤[33]。MMP9在细胞外基质重塑和炎症反应中起重要作用,MMP9可能通过影响细胞外基质的完整性和细胞间的相互作用,调节氧化应激相关的信号传导,如通过影响ROS的产生和清除,从而发挥抗氧化作用[34]。STAT3在细胞分化、增殖、存活、血管生成和免疫反应过程中起关键作用,STAT3通过激活JAK-STAT3、MAPK-ERK、PI3-AKT等信号通路,保护细胞免受氧化损伤,STAT3还参与调节抗氧化酶的表达,从而维持细胞内氧化还原平衡,发挥抗氧化机制[18,35]。
表2 核心靶点拓扑参数
Table 2 Core target topology parameters
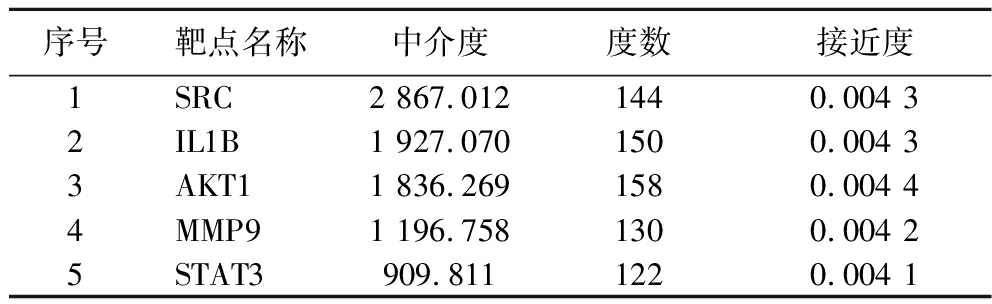
序号靶点名称中介度度数接近度1SRC2 867.0121440.004 32IL1B1 927.0701500.004 33AKT11 836.2691580.004 44MMP91 196.7581300.004 25STAT3909.8111220.004 1
2.4 GO和KEGG富集分析
通过DAVID数据库对154个交集靶点进行了GO富集分析,包括生物学过程(biological process,BP)、细胞组成(cell composition,CC)和分子功能(molecular function,MF)3个部分[36-37],图3-A展示了每部分前10个GO条目的富集情况。BP部分获得条目468个,主要富集在蛋白水解、细胞外基质分解、胶原蛋白分解代谢过程等;CC部分获得条目92个,主要富集在蛋白酶体复合物、细胞质膜、细胞表面等;MF部分获得条目107个,主要富集在内肽酶活性、肽酶活性、丝氨酸型内肽酶活性、金属内肽酶活性等[16,18]。推测杜仲雄花多肽可能主要通过调节蛋白水解、细胞外基质分解以及蛋白酶体复合物和细胞膜的功能,以及增强内肽酶和肽酶活性参与抗氧化过程[38]。

A-GO富集分析;B-KEGG富集分析
图3 杜仲雄花多肽抗氧化靶点GO和KEGG富集分析
Fig.3 GO and KEGG enrichment analysis of antioxidant targets of peptides from E.ulmoides male flowers
通过DAVID数据库对154个共同靶点进行KEGG通路富集分析,共得到148个KEGG项目。图3-B展示了富集程度最高的前20个KEGG通路。其中,排名前十的通路为蛋白酶体、阿尔茨海默病、神经活性配体-受体相互作用、EB病毒感染、癌症通路、脊髓小脑性共济失调、病毒致癌作用、肌动蛋白细胞骨架的调控、中性粒细胞胞外诱捕网形成、小细胞肺癌。有研究发现,在氧化应激条件下,蛋白质容易发生氧化损伤,这些受损的蛋白质如果积累过多,会导致细胞功能障碍甚至细胞死亡,蛋白酶体系统通过降解这些氧化受损的蛋白质,防止其积累,维持细胞内环境的稳定,从而发挥抗氧化作用[39]。此外,神经活性配体-受体相互作用与抗氧化也密切相关,如5-HT6受体配体和丁酰胆碱酯酶抑制剂能够使ABTS阳离子自由基减少35%,具有一定的抗氧化潜力[40]。基于以上分析推测,杜仲雄花多肽可能主要通过影响蛋白酶体和神经活性配体-受体相互作用等通路来调节氧化应激反应。
2.5 分子对接结果
以SRC(PDBID:4U5J)、STAT3(PDBID:1BJ1)、AKT1(PDBID:2UZR)、IL1B(PDBID:1T4Q)、MMP9(PDBID:4WZV)核心靶点作为蛋白受体,8种潜在活性成分作为配体进行分子对接,作为初步的分析验证。结果如表3所示,杜仲雄花多肽中8种潜在活性成分能够完全与SRC成功对接,其次是STAT3、MMP9、IL1B、AKT1,对接成功的个数分别为8、6、4、2、2,说明潜在活性成分与核心靶点之间亲和活性较好。
表3 杜仲雄花多肽潜在活性成分与核心靶点分子对接结果
Table 3 Results of molecular docking between potential active ingredients and core targets of E.ulmoides male flower peptides
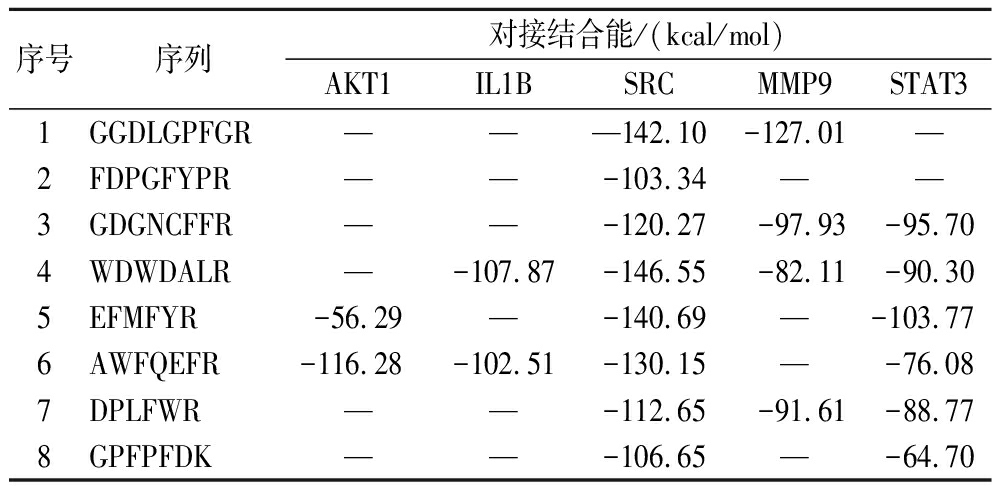
序号序列对接结合能/(kcal/mol)AKT1IL1BSRCMMP9STAT31GGDLGPFGR———142.10-127.01—2FDPGFYPR——-103.34——3GDGNCFFR——-120.27-97.93-95.704WDWDALR—-107.87-146.55-82.11-90.305EFMFYR-56.29—-140.69—-103.776AWFQEFR-116.28-102.51-130.15—-76.087DPLFWR——-112.65-91.61-88.778GPFPFDK——-106.65—-64.70
注:—表示没有对接成功。
杜仲雄花多肽按照对接结合能从大到小排列为WDWDALR>AWFQEFR>GDGNCFFR>EFMFYR>DPLFWR>GGDLGPFGR>GPFPFDK>FDPGFYPR,其中,肽段AWFQEFR与AKT1、IL1B、SRC、STAT3核心靶点的总结合能最高,分别为-116.28、-102.51、-130.15、-76.084 kJ/mol,图4对其相互作用进行了展示。AWFQEFR与各靶点之间形成多种相互作用力,主要包括氢键(conventional hydrogen bond)、盐键(salt bridge)、静电吸引力(attractive charge)、范德华力(vander waals)、π-阴离子(π-anion)、π-烷基(π-akyl)、π-Sigma[18]。其中,氢键可以增强配体-受体复合物的稳定性和结合亲和力,如AWFQEFR与SRC中Thr521、Lys423、Arg388、Gln526、Cys277、Ala390、Ala422、Asp386、Asp404共9个氨基酸残基相互作用形成氢键,由此,推测AWFQEFR与SRC较强稳定性主要原因是氢键,其次与IL1B中Asp35、Lys27、Gln38、Ser21共4个氨基酸残基相互作用形成氢键,与AKT1中Leu62、Glu85形成氢键,与STAT3中Gly42、Gln115形成氢键。此外,AWFQEFR-AKT1中Glu85残基同时参与氢键、盐键、静电吸引力的形成,Lys64残基还参与范德华力的形成[18]。结果表明,AWFQEFR与各靶点的结合口袋均展现出良好的匹配性,具有进一步研究的潜力。
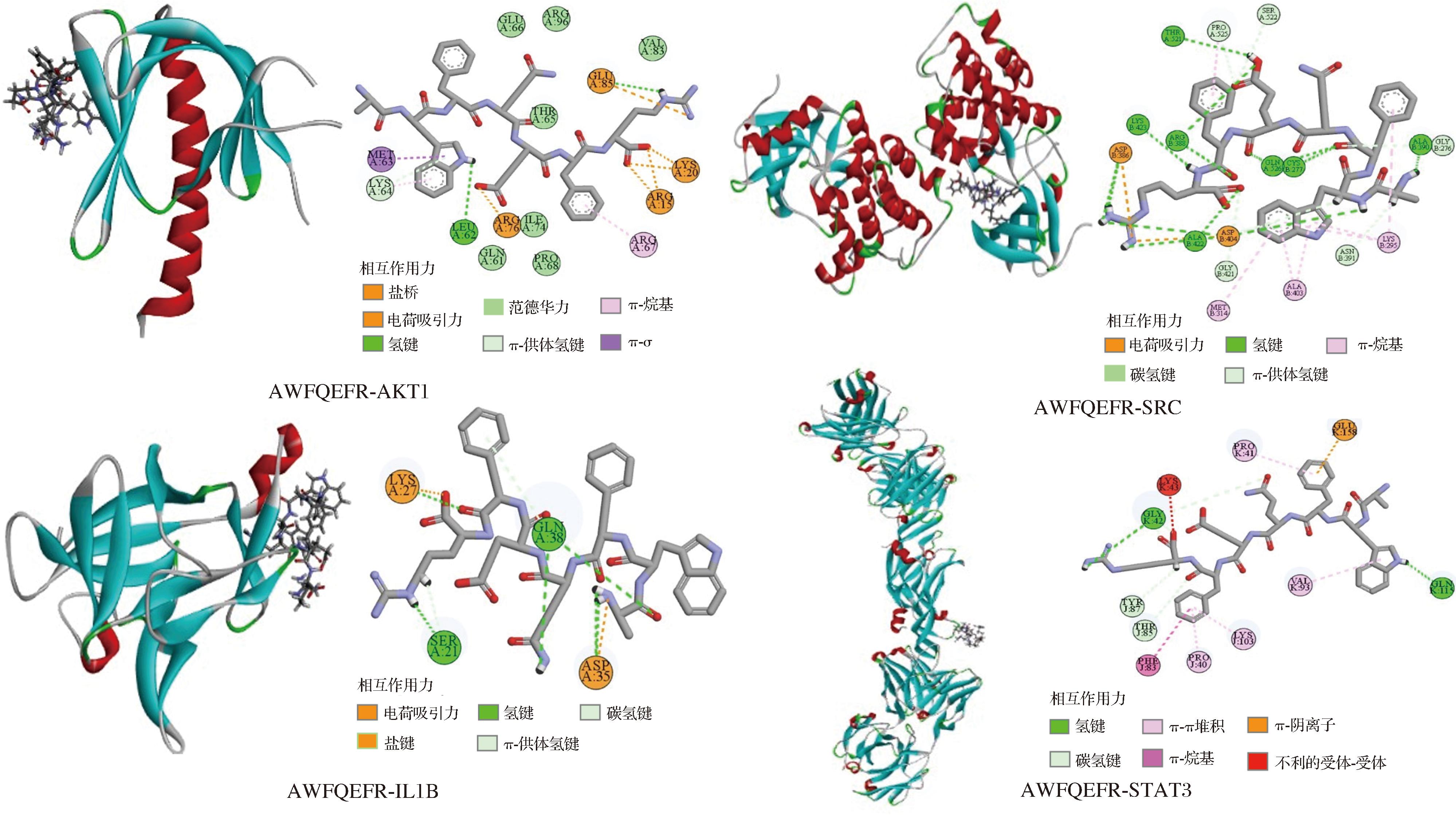
图4 AWFQEFR与核心靶点分子对接示意图
Fig.4 A molecular docking diagram for AWFQEFR and core targets
3 结论
本研究通过网络药理学方法预测杜仲雄花多肽潜在活性成分和抗氧化相关靶点,并构建潜在活性成分-抗氧化靶点网络图,通过蛋白互作分析筛选得到抗氧化作用的核心靶点;基于GO和KEGG分析筛选出与抗氧化相关的信号通路;最后通过分子对接验证分析了潜在活性成分与核心靶点之间亲和力和相互作用模式。结果发现,杜仲雄花多肽的氨基酸肽数包含了六肽到三十六肽,主要集中于八肽(15%)、九肽(15%)、十肽(14%)、十一肽(12%)、十二肽(9%),4种氨基酸性质中疏水性氨基酸的占比最高,为40%,20种不同的氨基酸中亮氨酸占比最高,为8%。共筛选出8种潜在活性成分,它们的序列分别为GGDLGPFGR、FDPGFYPR、GDGNCFFR、WDWDALR、EFMFYR、AWFQEFR、DPLFWR、GPFPFDK,5个抗氧化相关的核心靶点分别为SRC、IL1B、AKT1、MMP9、STAT3。GO分析表明杜仲雄花多肽可能通过调节蛋白水解、细胞外基质分解、细胞膜的功能以及增强内肽酶和肽酶活性参与抗氧化过程。KEGG分析表明杜仲雄花多肽可能通过影响蛋白酶体和神经活性配体-受体相互作用等通路来调节氧化应激。分子对接进一步验证了8种潜在活性成分与5个核心靶点存在较强的相互作用,其中,肽段AWFQEFR与SRC核心靶点亲和力最高,具有进一步的研究潜力。该研究与张红玉等在紫苏粕多肽研究中多靶点、多途径的方式发挥抗氧化应激作用有相似之处,发挥抗氧化作用的核心靶点都有SRC、STAT3,但在具体的生物学过程和通路上有所不同,杜仲雄花多肽更强调蛋白水解和细胞外基质分解等过程,以及蛋白酶体和神经活性配体-受体相互作用等通路。本研究为多肽抗氧化作用机制的研究提供了新靶点和新通路。然而,在后续的研究中,还需进一步通过细胞实验和动物从关键靶点基因、信号通路等多个角度验证杜仲雄花多肽的抗氧化作用机制,以期为杜仲雄花多肽抗氧化产品的开发提供更深入的理论参考。
[1] 陈丽华, 柯雅兴, 朱文佳, 等.杜仲不同部位标准分析及其产品发展现状[J].中华中医药杂志, 2024, 39(11):6158-6162.CHEN L H, KE Y X, ZHU W J, et al.Standard analysis of different parts of Eucommia ulmoides and its product development status[J].China Journal of Traditional Chinese Medicine and Pharmacy, 2024, 39(11):6158-6162.
[2] 杜庆鑫, 魏艳秀, 刘攀峰, 等.杜仲雄花主要活性成分含量的多样性[J].林业科学, 2017, 53(2):35-43.DU Q X, WEI Y X, LIU P F, et al.Diversity of the content of main active components in Eucommia ulmoides male flowers[J].Scientia Silvae Sinicae, 2017, 53(2):35-43.
[3] 文欢, 汪颀浩, 张大燕, 等.不同类型杜仲雄花茶活性成分的含量测定[J].保鲜与加工, 2019, 19(2):143-146.WEN H, WANG Q H, ZHANG D Y, et al.Determination of active components in different types of Eucommia ulmoides male flower tea[J].Storage and Process, 2019, 19(2):143-146.
[4] 岳芽, 胡竞月, 谭欣, 等.杜仲雄花活性成分及其生物活性研究进展[J].食品研究与开发, 2023, 44(18):219-224.YUE Y, HU J Y, TAN X, et al.Research progress on active components of Eucommia ulmoides male flower and their biological activities[J].Food Research and Development, 2023, 44(18):219-224.
[5] 孔雪晴, 沙咏怡, 项敏泓.氧化应激及天然食物中的抗氧化剂在干眼中的作用研究进展[J].眼科新进展, 2024, 44(3):235-238.KONG X Q, SHA Y Y, XIANG M H Research progress on oxidative stress and effects of antioxidants from natural foods on dry eyes[J].Recent Advances in Ophthalmology, 2024, 44(3):235-238.
[6] GULCIN ![]() and antioxidant methods:An updated overview[J].Archives of Toxicology, 2020, 94(3):651-715.
and antioxidant methods:An updated overview[J].Archives of Toxicology, 2020, 94(3):651-715.
[7] 王颖, 杜易潼, 薛婉玉, 等.植物源性天然抗氧化剂的机理及其在食品保鲜中的应用[J].中国调味品, 2023, 48(1):204-209.WANG Y, DU Y T, XUE W Y, et al.Mechanism of natural plant-derived antioxidants and their application in food preservation[J].China Condiment, 2023, 48(1):204-209.
[8] 包显颖, 陈丽, 倪姮佳, 等.抗氧化多肽研究及其应用前景[J].生命科学, 2016, 28(9):998-1005.BAO X Y, CHEN L, NI H J, et al.The research and application of the natural antioxidant peptides[J].Chinese Bulletin of Life Sciences, 2016, 28(9):998-1005.
[9] 欧阳小健. 当归多肽的制备及其抗氧化活性机制与构效关系研究[D].广州:广州中医药大学, 2021.OUYANG X J.The study of preparation, mechanism of antioxidant activity and structure-activity relationship of peptides in Angelica Sinensis Radix[D].Guangzhou:Guangzhou University of Traditional Chinese Medicine, 2021.[10] HUANG H, CEN J W, YANG D Q, et al.Isolation and characterization of antioxidant peptides from oyster (Crassostrea rivularis) protein enzymatic hydrolysates[J].Food Science &Nutrition, 2023, 11(1):261-273.
[11] XU B T, DONG Q, YU C X, et al.Advances in research on the activity evaluation, mechanism and structure-activity relationships of natural antioxidant peptides[J].Antioxidants, 2024, 13(4):479.
[12] 徐华琳, 秦令祥, 丁昱婵, 等.微波辅助低共熔溶剂提取杜仲雄花黄酮工艺优化及抗疲劳作用研究[J].保鲜与加工, 2024, 24(11):93-100.XU H L, QIN L X, DING Y C et al.Optimization of extraction process of flavonoids from male flowers of Eucommia ulmoides by microwave assisted deep eutectic solvents and its anti-fatigue effect[J].Storage and Process, 2024, 24(11):93-100
[13] 吴淼, 康建平, 刘建, 等.杜仲雄花代餐粉冲调特性改良[J].中国食品添加剂, 2020, 31(1):118-123.WU M, KANG J P, LIU J, et al.Improvement of flushing and blending characteristics of Eucommia male flower meal replacement powder[J].China Food Additives, 2020, 31(1):118-123
[14] 杨胜男, 赵斗, 蔡梦权, 等.基于网络药理学和分子对接探究菜芙蓉黄酮的免疫调节机制研究[J].中国畜牧杂志, 2024, 60(12):309-318.YANG S N, ZHAO D, CAI M Q, et al.Research on the immune regulatory mechanism of flavonoids in Hibiscus syringae based on network pharmacology and molecular docking[J].Chinese Journal of Animal Science, 2024, 60(12):309-318.
[15] 齐越. 杜仲雄花多肽对脂质代谢调控作用的初步研究[D].成都:成都大学, 2024.QI Y.Preliminary Studies on the regulatory effects of polypeptides from the male flowers of Eucommia on lipid metabolism[D].Chengdu:Chengdu University, 2024.
[16] 张红玉. 紫苏粕多肽制备及抗氧化活性研究[D].太原:中北大学, 2023.ZHANG H Y.Preparation and antioxidant activity of perilla meal peptides[D].Taiyuan:North University of China, 2023.
[17] 豆佳红, 王梓颖, 杨娟, 等.基于网络药理学和分子对接分析赤芍抗氧化应激作用的活性成分及其机制[J].中国畜牧兽医, 2023, 50(3):1229-1240.DOU J H, WANG Z Y, YANG J, et al.Analysis of the active ingredients and mechanism of Radix paeoniae rubra antioxidative stress based on network pharmacology and molecular docking[J].China Animal Husbandry &Veterinary Medicine, 2023, 50(3):1229-1240.
[18] 张红玉, 李会珍, 张志军, 等.基于体外实验和网络药理学探讨紫苏粕多肽抗氧化应激的作用机制[J].食品与发酵工业, 2024, 50(10):149-159.ZHANG H Y, LI H Z, ZHANG Z J, et al.Exploration of mechanism of anti-oxidative stress of perilla meal peptides based on in vitro experiments and network pharmacology[J].Food and Fermentation Industries, 2024, 50(10):149-159.
[19] 刘枭, 许云, 徐银莹, 等.白花蛇舌草治疗子宫肌瘤机制的网络药理学研究[J].中药新药与临床药理, 2020, 31(9):1070-1078.LIU X, XU Y, XU Y Y, et al.The mechanism of Hedyotis diffusa for the treatment of uterine fibroids based on network pharmacology[J].Traditional Chinese Drug Research and Clinical Pharmacology, 2020, 31(9):1070-1078.
[20] DOU L, ZHANG Z M, YANG W Q, et al.Separation and purification of antioxidant peptides from Idesia polycarpa Maxim.cake meal and study of conformational relationship between them[J].Food Science &Nutrition, 2024, 12(9):6206-6225.
[21] 左依瑾, 于子淇, 申雪晴, 等.鱼源抗氧化肽的结构与其功能关系研究进展[J].食品工业科技, 2023, 44(14):419-429.ZUO Y J, YU Z Q, SHEN X Q, et al.Recent advance on the structure-activity relationship in antioxidant peptides of fish[J].Science and Technology of Food Industry, 2023, 44(14):419-429.
[22] 林丹霓, 黄君婷, 钟玉鸣, 等.兜唇石斛发酵多肽抗氧化活性与氨基酸结构的关系[J].现代食品科技, 2023, 39(10):139-150.LIN D N, HUANG J T, ZHONG Y M, et al.Relationship between the oxidative activity and amino acid structure of fermented polypeptides from Dendrobium aphyllum[J].Modern Food Science and Technology, 2023, 39(10):139-150.
[23] 梁明才, 杨林.精氨酸抗氧化作用机制[J].生物信息学, 2020, 18(4):201-205.LIANG M C, YANG L Antioxidant mechanism of arginine[J].Chinese Journal of Bioinformatics, 2020, 18(4):201-205.
[24] OLIN-SANDOVAL V, YU J S L, MILLER-FLEMING L, et al.Lysine harvesting is an antioxidant strategy and triggers underground polyamine metabolism[J].Nature, 2019, 572(7768):249-253.
[25] CHEN J B, YU X D, CHEN Q Z, et al.Screening and mechanisms of novel angiotensin-I-converting enzyme inhibitory peptides from rabbit meat proteins:A combined in silico and in vitro study[J].Food Chemistry, 2022, 370:131070.
[26] SOLIMAN K, GRIMM F, WURM C A, et al.Predicting the membrane permeability of organic fluorescent probes by the deep neural network based lipophilicity descriptor DeepFl-LogP[J].Scientific Reports, 2021, 11:6991.
[27] HUANG E T C, YANG J S, LIAO K Y K, et al.Predicting blood-brain barrier permeability of molecules with a large language model and machine learning[J].Scientific Reports, 2024, 14:15844.
[28] LESPINE A, BLANCUFNEY C, PRICHARD R, et al.P-glycoproteins in anthelmintic safety, efficacy, and resistance[J].Trends in Parasitology, 2024, 40(10):896-913.
[29] 李磊, 赵花金, 伍子焘, 等.决明子抗氧化作用机制的网络药理学分析[J].浙江农业学报, 2020, 32(10):1855-1865.LI L, ZHAO H J, WU Zi T, et al.Network pharmacological analysis of anti-oxidant mechanism of Cassia semen[J].Acta Agriculturae Zhejiangensis, 2020, 32(10):1855-1865.
[30] 胡睿, 朱曙东.Src蛋白激酶活性的调节机制[J].生物化学与生物物理进展, 2016, 43(11):1061-1069.HU R, ZHU S D.Regulation of Src kinase activity[J].Progress in Biochemistry and Biophysics, 2016, 43(11):1061-1069.
[31] VIKHREVA P, PETROVA V, GOKBULUT T, et al.TAp73 upregulates IL-1β in cancer cells:Potential biomarker in lung and breast cancer?[J].Biochemical and Biophysical Research Communications, 2017, 482(3):498-505.
[32] JIANG X X, CHEN X, HE L X, et al.Equol promotes osteogenic differentiation of hPDLSCs by inhibiting oxidative stress via IL1B/NF-κB/CXCL1 signaling axis[J].Chemico-Biological Interactions, 2025, 407:111367
[33] MANNING B D, TOKER A.AKT/PKB signaling:Navigating the network[J].Cell, 2017, 169(3):381-405.
[34] 于沛霞, 薄立军, 黄立宁, 等.p38MAPK/MMP-9信号通路对新生大鼠脑缺氧缺血损伤的影响[J].河北医科大学学报, 2017, 38(9):1063-1067.YU P X, BO LI J, HUANG L N, et al.The effects of P38MAPK/MMP-9 signaling pathway on hypoxic ischemic brain damage in neonatal rats[J].Journal of Hebei Medical University, 2017, 38(9):1063-1067.
[35] 钱进, 郑艳莉.JAK2/STAT3/TWIST信号通路在子宫腺肌病上皮间质转化中的作用研究[J].重庆医学, 2023, 52(1):54-60.QIAN J, ZHENG Y L.Study on role of JAK2/STAT3/TWIST signal pathway in epithelial-mesenchymal transition of adenomyosis[J].Chongqing Medicine, 2023, 52(1):54-60.
[36] 高凯, 宋延平.基于网络药理学和分子对接探索金银花用于甲型H1 N1流感的分子机制[J].中国新药杂志, 2020, 29(23):2729-2737.GAO K, SONG Y P.Molecular mechanism of honeysuckle against H1 N1 influenza based on network pharmacology and molecular docking[J].Chinese Journal of New Drugs, 2020, 29(23):2729-2737.
[37] 程冰冰, 吕圭源, 吴汉松, 等.基于网络药理学及分子对接探讨山楂改善代谢性高血压的作用机制[J].中国现代应用药学, 2023, 40(24):3377-3388.CHENG B B, LYU G Y, WU H S, et al.Study on the mechanism of Crataegi fructus in improving metabolic hypertension based on network pharmacology and molecular docking[J].Chinese Journal of Modern Applied Pharmacy, 2023, 40(24):3377-3388.
[38] WU S L, CHEN R, CHEN J Y, et al.Study of the anti-inflammatory mechanism of β-carotene based on network pharmacology[J].Molecules, 2023, 28(22):7540.
[39] WANG X R, CHEMMAMA I E, YU C, et al.The proteasome-interacting Ecm29 protein disassembles the 26S proteasome in response to oxidative stress[J].Journal of Biological Chemistry, 2017, 292(39):16310-16320.
[40] JIANG T F, SUN Q, CHEN S D.Oxidative stress:A major pathogenesis and potential therapeutic target of antioxidative agents in Parkinson’s disease and Alzheimer’s disease[J].Progress in Neurobiology, 2016, 147:1-19.