酒精性肝病(alcoholic liver disease,ALD)是指摄入乙醇后,在肝脏中代谢产生大量乙醛和活性氧簇,引起肝细胞脂质过氧化、炎性因子高表达,进而导致一系列的肝脏功能障碍和病理损伤,包括酒精性脂肪肝、肝炎、纤维化及肝硬化等[1-2]。近年来,我国ALD的发病率及相应的疾病负担日益加重[3-4]。
膳食脂肪的生理功能与其脂肪酸组成及含量密切相关,其中脂肪酸不饱和度与健康的关系受到广泛关注。油脂中高含量的饱和脂肪酸(saturated fatty acids,SFA)通常与肝病、高血压等慢性代谢性疾病相关,不饱和脂肪酸(unsaturated fatty acids,UFA)相对更加健康。事实上,各类脂肪酸各有其功能,其具体的组成和比例似乎更加重要。有研究报道,SFA可以通过调节肠道屏障对ALD产生保护作用[5]。多不饱和脂肪酸(polyunsaturated fatty acids,PUFA)的种类及比例也对ALD产生一定影响,如过高含量n-6 PUFA可诱导细胞炎症反应,而提升n-3 PUFA占比能改善肝脏及全身代谢指标[6-7]。PUFA中n-6/n-3的值亦显著影响炎症进程与肝脏健康,如富含PUFA的核桃油、亚麻籽油(富含n-3 PUFA)可以有效改善ALD病症[8-9]。然而对于单不饱和脂肪酸(monounsaturated fatty acids,MUFA),其含量对ALD的影响学界尚存争议。有研究报道与富含PUFA的玉米油相比,富含MUFA的茶籽油可减轻慢性酒精诱导的肝损伤[10],而同样富含MUFA的橄榄油则加重了ALD小鼠的脂肪肝及肝损伤[11]。上述矛盾可能源于:a)油脂来源不同导致微量成分差异干扰结果;b)现有研究多聚焦单一类脂肪酸含量,缺乏针对MUFA、PUFA、SFA之间的比例与ALD进展相关性之间的系统性研究。
肠-肝轴是ALD进展的主要途径。乙醇代谢产物乙醛约30%在肝脏中解毒,其余大量乙醛通过胆汁排泄到胃肠道,进一步由肠道的乙醛脱氢酶 2(aldehyde dehydrogenase 2,ALDH2)代谢[12]。肝脏通过胆汁酸生成和肠肝循环,与肠道微生物群相互影响。膳食成分,包括饮酒均会导致肠道菌群发生变化[13]。已有研究表明,随着ALD发展,肠道菌群失调在门水平表现为拟杆菌门(Bacteroidetes)减少,变形菌门Boteobacteria和放线菌门Actinobacteria增加;在科水平表现为瘤胃球菌科Ruminococcaceae丰度降低;在属水平,与肠道屏障相关的共生有益菌Akkermansia muciniphila丰度降低。在重症酒精性肝炎患者体内,链球菌(Streptococcus)、肠杆菌(Enterobacter)和双歧杆菌(Bifidobacterium)的丰度升高,在酒精依赖伴肝硬化患者中乳酸杆菌属(Lactobacillus)、Bifidobacterium以及口腔微生物群有所增加[14]。与微生物组成变化相关且更有意义的研究是肠道微生物功能的变化;在人类肝脏疾病的背景下,主要影响脂多糖(也称为内毒素)和胆汁酸。粪便微生物群及功能能力的横断面宏基因组分析表明,与酒精代谢和炎症相关的功能性微生物群通路在肝硬化患者中上调;随着ALD进展,血清和粪便中的次级胆汁酸水平均升高,肠道通透性增加,血液内毒素增加[15-17]。
沙棘油包括沙棘果油(flesh oil,FO)和沙棘籽油(seed oil, SO)。FO富含以棕榈油酸(C16:1 n7)为主的MUFA,是为数不多的植物来源n-7脂肪酸,在降血糖、改善皮肤、改善心血管疾病、减缓炎症等方面表现出健康益处[18-19]。SO富含PUFA,主要为亚油酸和α-亚麻酸,在抗辐射、抗氧化、肝脏保护、心血管健康等方面表现出积极效果[20-21]。为了综合FO和SO的优势,进一步提高沙棘油的功效作用,经前期实验,筛选出FO与SO以体积比6∶4混合配制成沙棘混合油(mixed oil, MO),并研究了不同剂量MO对ALD小鼠肝损伤的保护作用[22]。在此基础上,本文分析3种原料沙棘油FO、SO和混合沙棘油MO中三类脂肪酸MUFA、PUFA、SFA的组成与比例,并以相同剂量(0.6 g/kg bw)干预ALD小鼠,以期找到能有效干预ALD的油脂的脂肪酸比例,为明晰油脂中脂肪酸比例与ALD进展的相关性这一问题提供实验案例。
1 材料与方法
1.1 材料与试剂
FO、SO,原料来自新疆大果沙棘(由太阳石健康产业发展有限公司提供);MO为FO与SO按体积比6∶4混合而成。
实验动物:6~8周龄SPF级雄性昆明小鼠50只,由北京市昌扬西山养殖场提供(许可证号:SCXK(京)2021-0008)。小鼠饲养温度为(24.0± 2.0)℃,相对湿度为40%~60%,12 h光照循环按动物中心实际情况进行,自由饮水。小鼠饲养遵守山西农业大学实验动物伦理委员会要求(IACUC 审查号:SXAU-EAW-2024M.GG.010009321)。
1.2 仪器与设备
MultiskanTM Sky全波长酶标仪,Thermo fisher scientific 公司;RM2016 病理切片机,上海徕卡仪器有限公司;DW-86L626 -80 ℃超低温冰箱,海尔智家股分有限公司;Eclipse C1 倒置荧光显微镜;DS-U3 成像系统,日本尼康公司;ProFlex 三头梯度基因扩增聚合酶链式反应仪,美国应用生物系统公司;实时荧光定量 PCR 仪,德国耶拿公司。
1.3 实验方法
1.3.1 沙棘油脂肪酸检测
MO、FO和SO按照GB 5009.168—2016《食品安全国家标准 食品中脂肪酸的测定》第三法测定脂肪酸组成与含量。
1.3.2 ALD小鼠模型的建立及动物分组
通过慢性酒精暴露进行ALD小鼠造模,动物分组及试验过程参考文献[22]并稍作修改。50只昆明小鼠适应性饲养1周后,随机分成5组(每组10只),空白对照组(normal control,NC组)灌胃蒸馏水,ALD模型组(ALD model control,AC组)及3 个干预组沙棘果油(FO)、沙棘籽油(SO)、沙棘混合油(MO)按 12 mL/kg bw 的量灌胃乙醇,从第1周到第6周乙醇体积分数分别为25%、25%、30%、35%、40%、45%。3个沙棘油干预组在按AC组同样程序灌胃乙醇的同时按0.6 g/kg bw的标准灌胃沙棘油,相当于成年人沙棘油摄入量3.6 g/d。第6周给予受试样品结束时,NC 组给予蒸馏水,其他组 1 次灌胃50%乙醇,禁食16 h,摘除眼球采血,脊椎脱臼处死小鼠。按照《保健食品功能检验与评价方法(2023 年版)》中酒精肝损伤模型, AC组肝组织中丙二醛、还原型谷胱甘肽和甘油三酯3个指标与NC组比较,差异显著,判定酒精性肝损伤小鼠造模成功。
1.3.3 样本采集及指标测定
血液、肝脏及粪便样品采集参考文献[22]进行,采样后进行组织病理学观察、肝指数检测,肝功能生化指标检测:血清谷丙转氨酶(alanine aminotransferase,ALT)、血清谷草转氨酶(aspartate aminotransferase,AST)、肝脏总甘油三酯(total triglycerides,TG)、肝脏总胆固醇(total cholesterol,TC)、肝高密度脂蛋白(high-density lipoprotein,HDL)、肝低密度脂蛋白(low-density lipoprotein,LDL)和肝总胆汁酸(total bile acid,TBA)含量,以上试剂盒购自上海江莱生物科技有限公司。肝脏氧化指标检测:肝脏丙二醛(malondialdehyde,MDA)、还原型谷胱甘肽(reduced glutathione,GSH)、髓过氧化物酶(myeloperoxidase,MPO)和超氧化物歧化酶(superoxide dismutase,SOD)活性,以上试剂盒购自北京盒子生工科技有限公司。肝脏炎症水平检测:小鼠肿瘤坏死因子(tumor necrosis factor-α,TNF-α)、小鼠白介素-1 (interleukin-1,lL-1)及小鼠白介素-6(interleukin-6,lL-6)水平,以上ELISA试剂盒购自武汉三鹰生物技术有限公司。所有检测按照相应试剂盒说明书操作。粪便样品送广州基迪奥科技服务有限公司进行16SrDNA测序,粪便菌群生信分析基于Omicsmart平台进行。
1.4 数据处理
采用Originpro 2021软件对数据进行统计分析,结果表示为“平均值±标准差”。组间多重比较采用单因素方差分析和Fisher’s LSD检验进行分析。P<0.05被认为组间差异显著。
2 结果与分析
2.1 3种沙棘油脂肪酸组成和比例分析
表1为沙棘果油、籽油和混合油的脂肪酸组成及比例分析。从脂肪酸长度来看,3种沙棘油均以C16和C18脂肪酸为主。从SFA和UFA比例来看,3种油均以UFA为主,FO、SO和MO中UFA/SFA的值分别为2.04、7.89和2.89。
表1 3种沙棘油的脂肪酸组成和比例分析 单位:g/100 g
Table 1 Analysis of the composition and proportion of fatty acids in 3 kinds of sea buckthorn oil
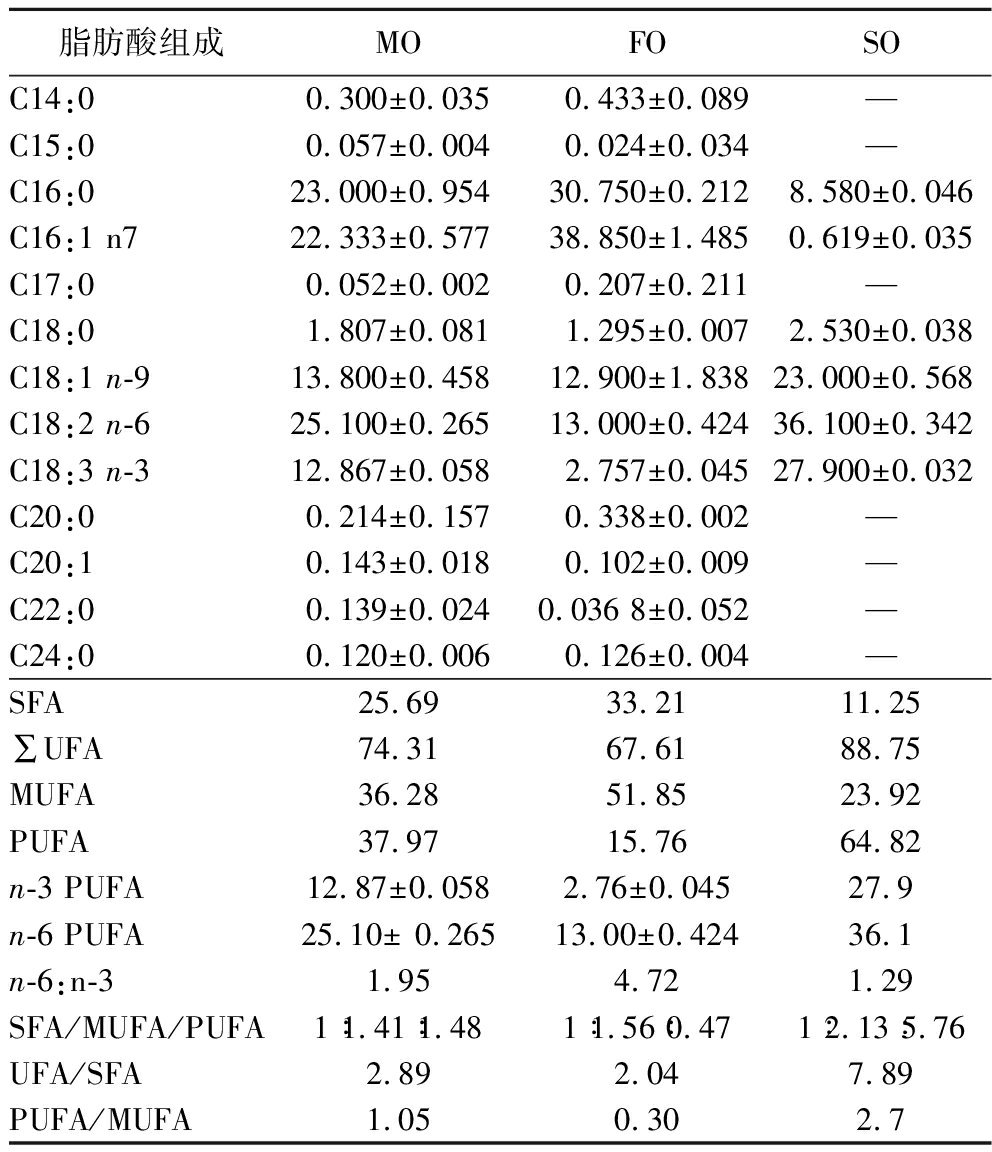
脂肪酸组成MOFOSOC14:00.300±0.0350.433±0.089—C15:00.057±0.0040.024±0.034—C16:023.000±0.95430.750±0.2128.580±0.046C16:1 n722.333±0.57738.850±1.4850.619±0.035C17:00.052±0.0020.207±0.211—C18:01.807±0.0811.295±0.0072.530±0.038C18:1 n-913.800±0.45812.900±1.83823.000±0.568C18:2 n-625.100±0.26513.000±0.42436.100±0.342C18:3 n-312.867±0.0582.757±0.04527.900±0.032C20:00.214±0.1570.338±0.002 —C20:10.143±0.0180.102±0.009 —C22:00.139±0.0240.036 8±0.052 —C24:00.120±0.0060.126±0.004—SFA25.6933.2111.25∑UFA74.3167.6188.75MUFA36.2851.8523.92PUFA37.9715.7664.82n-3 PUFA12.87±0.0582.76±0.04527.9n-6 PUFA25.10± 0.26513.00±0.42436.1n-6:n-31.954.721.29SFA/MUFA/PUFA1∶1.41∶1.481∶1.56∶0.471∶2.13∶5.76UFA/SFA2.892.047.89PUFA/MUFA1.050.302.7
注:“—”表示未检出。
从脂肪酸组成和比例来看,FO以MUFA(约51.85%)为主,且棕榈油酸C16:1n7含量丰富;其SFA、MUFA和PUFA三者比值为1∶1.56∶0.47。SO主要特征是PUFA含量高(64.82%),其中n-3 PUFA含量较高,几乎不含n-7脂肪酸;SFA、MUFA和PUFA三者比值为1∶2.13∶5.76。MO以FO和SO以体积比6∶4调配而成,含有n-3、n-6、n-7、n-9全部种类的UFA,其SFA、MUFA和PUFA三者比值为1∶1.41∶1.48。进一步量化分析,MO中UFA/SFA≈3,MUFA/PUFA≈1,PUFA中n-6/n-3≈2,上述脂肪酸比例参数值均介于SO与FO之间。总体而言,MO中脂肪酸组成更加全面,比例较单一沙棘油更加均衡。
2.2 小鼠体重和肝脏病理分析
各组小鼠体质量变化情况见表2。实验初始,各组小鼠体质量无显著差异。到第4周,AC组及干预组体质量显著低于NC组(P<0.05)。第6周MO干预组体质量快速增加,与NC组差异不显著(P>0.05),其他组体质量仍然显著低于NC组。肝脏指数可作为评估小鼠肝脏病理状态的重要量化指标之一。表2数据显示,AC组小鼠肝指数较对照组升高1.18倍,差异具有统计学意义(P<0.05),提示ALD造模导致肝脏肿大。沙棘油干预后,MO组肝指数显著降低至与NC组无统计学差异(P>0.05);FO组和SO组肝指数较AC组虽有下降趋势,但差异无统计学意义。结果表明,试验剂量下调整脂肪酸比例的沙棘混合油MO可完全逆转慢性酒精摄入所致的肝指数异常,其干预效果优于单一FO或SO。
表2 不同脂肪酸比例的3种沙棘油干预对ALD小鼠体质量和肝脏指数的影响
Table 2 Intervention effects of three kinds of sea buckthorn oils with different fatty acid ratios on body weight and liver index in mice with ALD

第0周/g第2周/g第4周/g第6周/g肝脏指数/%NC29.65±1.6338.8±3.43a43.95±3.93a46.55±2.63a0.039±0.001 6bAC29.35±1.8132.44±4.40b38.25±3.35b39.81±3.61b0.046±0.005 4aMO29.55±1.5434.14±3.6b39.71±2.94b43.30±3.77ab0.038±0.002 7bFO29.00±2.1833.63±2.97b39.06±2.48b40.71±3.34b0.042±0.005 4abSO27.77±2.7834.50±3.44b39.15±2.94b42.05±2.72b0.040±0.002 4ab
注:各列进行LSD多重比较,上标不同字母表示差异显著(P<0.05)。
如图1所示,NC组小鼠肝脏表面光滑、色泽正常;AC组肝脏表面可见裂痕、凹陷及大量出血点,局部颜色变浅,提示ALD造模导致肝脏损伤。3种沙棘油干预均可缓解肝脏损伤表型,其中 MO 组改善最为显著。苏木精-伊红染色结果显示,ALD模型组(AC组)肝切片可见大量细胞内脂滴;经3种沙棘油干预后,肝组织病理损伤显著改善。其中,MO组肝索及肝细胞结构清晰,胞质脂滴积累明显减少,表明脂肪酸比例均衡的沙棘混合油对肝脏结构损伤具有更强的保护作用。
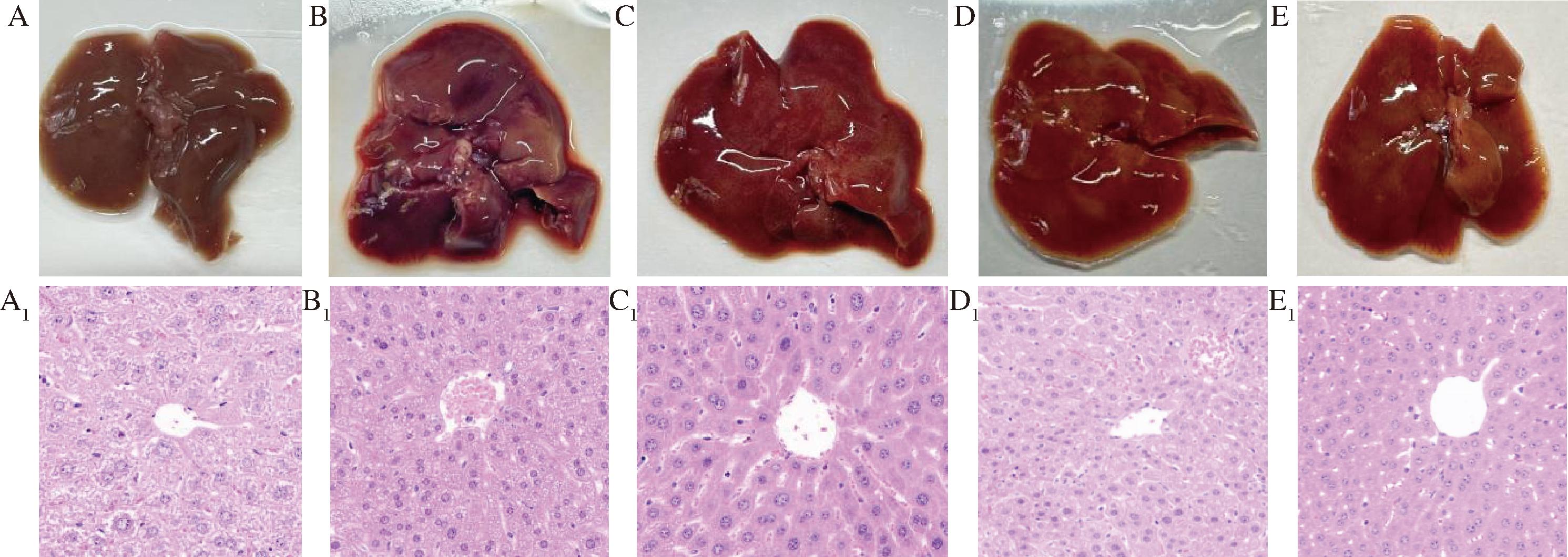
A、A1-NC组;B、B1-AC组;C、C1-MO组;D、D1-FO组;E、E1-SO组
图1 不同脂肪酸比例的3种沙棘油干预对ALD小鼠肝脏病理的影响
Fig.1 Intervention effects of three kinds of sea buckthorn oils with different fatty acid ratios on liver pathology of mice with ALD
注:A~E-肝脏表型;A1~E1-苏木精-伊红染色切片(200×)。
2.3 不同比例脂肪酸的沙棘油对ALD小鼠肝脏生化指标的影响
2.3.1 肝功能生化指标
如表3所示,酒精暴露致使 AC 组小鼠血清 ALT、AST 及肝脏 TC、TG、LDL 水平显著升高(P<0.05),HDL水平显著降低(P<0.05),表明小鼠肝功能受损。经3种沙棘油干预后,上述生化指标均得到显著改善(P<0.05)。
表3 不同脂肪酸比例的3种沙棘油干预对小鼠血清/肝脏生化指标的影响
Table 3 Intervention effects of three kinds of sea buckthorn oils with different fatty acid ratios on biochemical indicators in serum/liver of mice with ALD

NCACMOFOSO血清ALT/(nmol/g)2.26±1.470e38.82±1.650a25.45±0.606d30.35±4.223b28.04±1.661c血清AST/(nmol/g)2.50±0.315c3.32±0.384a2.92±0.143b2.80±0.145b2.71±0.138bc肝脏TG/(μg/g)23.04±1.142e38.82±1.650a25.45±0.606d30.35±4.223b28.04±1.661c肝脏TC/(μg/g)148.24±19.281e307.41±20.324a185.06±5.248d243.53±8.371c258.62±13.963b肝脏LDL/(ng/mL)48.02±0.321e81.47±0.730a58.00±2.435d66.98±2.887c74.33±6.499b肝脏HDL/(ng/mL)296.71±51.886a146.21±28.344c248.81±35.955b238.00±36.620b258.84±12.489b肝脏SOD/(U/g)1.87±0.101a1.16±0.115c1.39±0.176b1.47±0.135b1.40±0.155b肝脏GSH/(μg/g)440.70±9.735a351.76±12.200e419.56±11.491b395.03±25.677c377.42±12.058d肝脏MPO/(U/g)1.15±0.109 e2.20±0.178 a1.37±0.140 d1.93±0.157 b1.77±0.098 c肝脏MDA/(nmol/g)0.91±0.054d1.58±0.068a1.16±0.097c1.48±0.071b1.43±0.070b肝脏IL-1/(pg/mL)63.83±1.659d110.85±2.268a74.08±2.108c82.08±7.642b79.101±6.354b肝脏IL-6/(pg/mL)387.69±9.728d589.26±8.723a416.67±10.733c516.84±27.118b527.60±36.486b肝脏TNF-α /(pg/mL)75.57±6.617d127.93±4.612 a92.51±5.413c115.78±5.091b116.62±3.978b肝脏TBA/(nmol/g)3.36±0.178 e5.53±0.148 a3.81±0.103 d4.86±0.139 b4.64±0.135 c粪便TBA/(nmol/g)9.44±0.248 c12.35±0.594 a9.61±0.157 c11.21±0.328 b11.14±0.208 b
注:各行进行LSD多重比较,上标不同字母表示差异显著(P<0.05)。
其中,MO组在降低ALT、TG、TC及LDL水平方面显著优于FO组和SO组(P<0.05),提示脂肪酸比例均衡的沙棘混合油比单独果油或籽油具有更强的肝功能保护效果。
2.3.2 肝脏氧化应激表现
酒精在体内代谢为乙醛等毒性物质,导致肝细胞氧化损伤,同时机体产生抗氧化物质响应氧化胁迫。由表3可知,ALD造模过程中,AC组MDA和MPO显著升高(P<0.05),SOD和GSH显著下降(P<0.05),表明其肝细胞膜脂过氧化程度加剧且抗氧化系统受损。3种沙棘油干预均能显著下调MDA、MPO水平(P<0.05),上调SOD和GSH水平(P<0.05)。其中MO组对MDA、MOP和GSH的改善效果显著优于FO和SO组(P<0.05)。上述结果表明,沙棘油干预可通过减轻氧化应激损伤、增强抗氧化防御能力改善酒精性肝损伤,且脂肪酸比例更均衡的MO组抗氧化效能显著优于FO或SO。
2.3.3 肝脏炎症因子水平
过度脂质蓄积诱导的炎症反应是ALD的重要病理机制之一。如表3所示,与NC组相比,ALD造模后AC组小鼠肝脏TNF-α、IL-6和IL-1炎症因子水平显著升高(P<0.05);3种沙棘油干预能显著降低上述炎症因子水平(P<0.05),其中MO组对3个指标的改善效果显著优于FO或 SO (P<0.05)。
2.3.4 肝脏和粪便总胆汁酸水平
胆汁酸代谢与肝功能密切相关。由表3可知,ALD造模后AC组小鼠肝脏及粪便TBA水平较NC组均显著升高(P<0.05);经沙棘油干预后,两部位TBA水平均显著回落(P<0.05),且MO组效果显著优于FO和SO(P<0.05),其粪便TBA水平与NC组无统计学差异。该结果提示沙棘油可能通过调节胆汁酸代谢影响肠道菌群稳态。
基于以上病理生理、氧化应激及炎症等17项指标,采用偏最小二乘判别分析和聚类热图对各组干预效果进行综合评估(图2)。结果显示:AC组与NC组的样本分离度最大,MO组与NC组的样本分布最为接近,而SO组和FO组介于AC组与MO组之间(图2-A)。聚类热图(图2-B)亦呈现相似趋势。上述分析表明,脂肪酸比例更均衡的沙棘混合油MO对ALD小鼠肝脏的综合保护效能显著优于单一沙棘油。
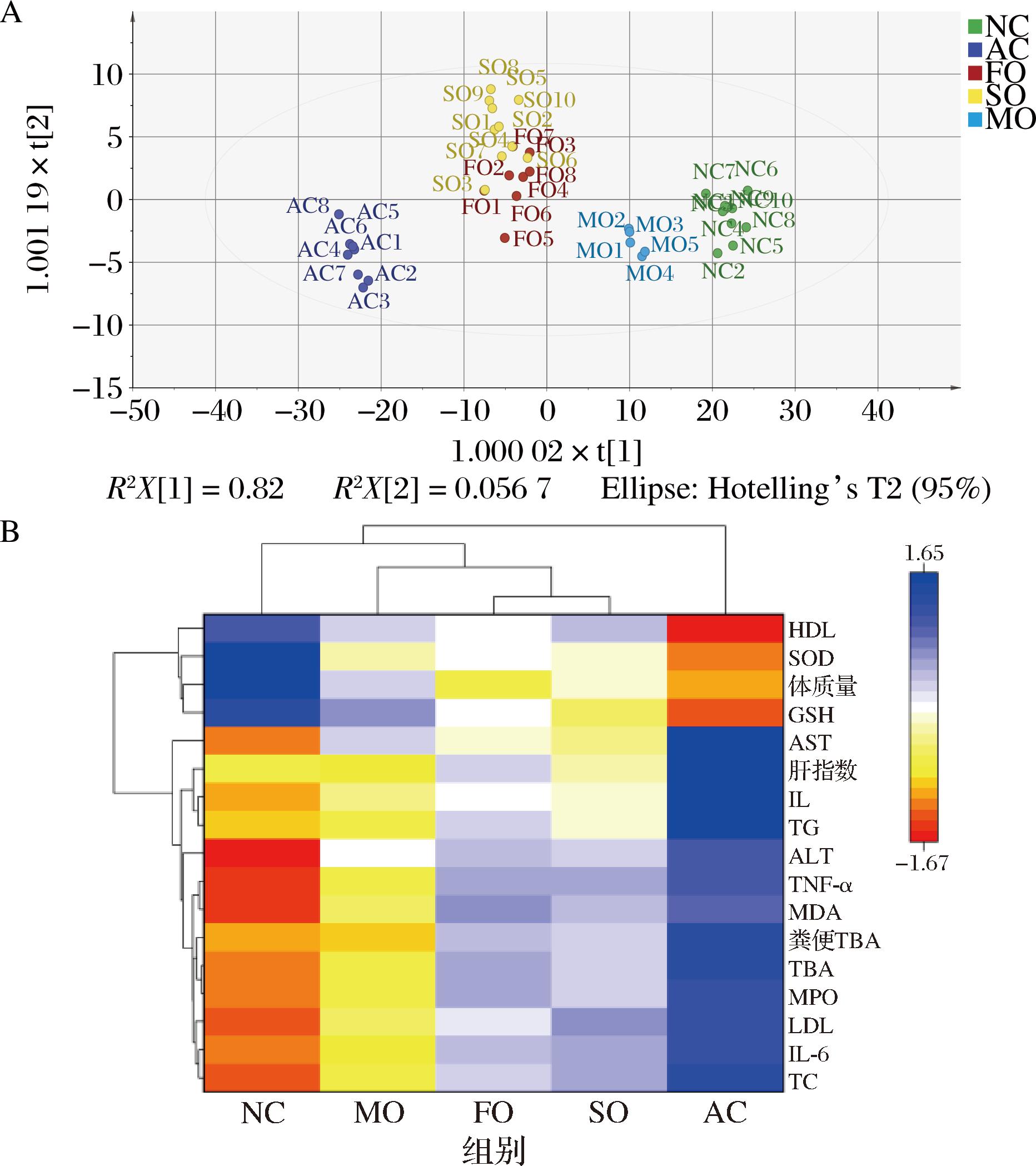
A-偏最小二乘法;B-热图聚类分析
图2 不同脂肪酸比例的3种沙棘油对ALD小鼠干预效果的综合评价
Fig.2 Comprehensive evaluation of the intervention effects of three kinds of sea buckthorn oils with different fatty acid ratios in mice with ALD
2.4 不同脂肪酸比例的沙棘油对ALD小鼠肠道菌群的调控作用
图3-A为各组分类操作单元(operational taxonomic unit,OTU)分布。如图3-A所示,NC组小鼠肠道菌群共有1 663个OTU,AC组则为1 941个,其中AC组特有OTU达1 066个,而NC与AC组的共有OTU仅16个,表明酒精暴露对小鼠肠道菌群的种类产生极大扰动。进一步分析显示,3个沙棘油干预组特有的OTU为16个,提示沙棘油干预可调节肠道菌群组成。α多样性分析(图3-B)显示,AC组较NC组呈上升趋势,但差异无统计学意义(P>0.05)。综上,酒精摄入可极大扰乱肠道菌群,使α多样性增加,沙棘油干预可能影响肠道菌群组成。

A-OTU数量;B-α多样性
图3 沙棘油干预对肠道菌群多样性的影响
Fig.3 Effects of sea buckthorn oil interventions on the diversity of intestinal flora
图4-A显示,小鼠粪便菌群门水平的优势菌门为厚壁菌门(Firmicutes)、Bacteroidetes、Proteobacteria和Actinobacteriota。酒精暴露后,AC组Firmicutes和Actinobacteria丰度降低,Bacteroidetes和Proteobacteria丰度升高,SO干预可完全逆转该菌群结构变化。科水平(图4-B)分析表明,小鼠粪便优势菌包括鼠杆状菌科(Muribaculaceae)、乳杆菌科(Lactobacillaceae)、毛螺菌科(Lachnospiraceae)、普雷沃氏菌科(Prevotellaceae)、拟杆菌科(Bacteroidaceae)和丹毒丝菌科(Erysipelotrichaceae)。酒精暴露导致AC组Lactobacillaceae和Erysipelotrichaceae丰度显著升高,而MO干预可显著降低这2个科的丰度。Lactobacillaceae是肠道共生菌,其中一些菌株也作为益生菌使用。本研究中发现酒精摄入使Lactobacillaceae丰度显著增加,在文献中也有报道随着ALD发展,肠道Lactobacillus和Bifidobacterium丰度增加[14]。值得注意的是AC组Erysipelotrichaceae丰度显著增加。已有研究表明Erysipelotrichaceae有很强的免疫原性,它在使用广谱抗生素治疗后有可能大量繁殖,其相对丰度与TNF-α水平呈正相关;此外,Erysipelotrichaceae的丰度与肝脏脂肪的变化呈正相关,在与肠外营养相关的肝损伤小鼠体内呈现群大量积累[23]。本研究在ALD组小鼠中也观察到Erysipelotrichaceae丰度与肝脏脂肪、TNF-α和肝损伤的正向相关性。经MO干预后,Erysipelotrichaceae丰度显著减少,SO也有部分效果,但FO效果甚微。以上结果表明Erysipelotrichaceae有可能作为ALD发展的一个肠道菌群标志物,且油脂的脂肪酸比例对Erysipelotrichaceae的调节至关重要。
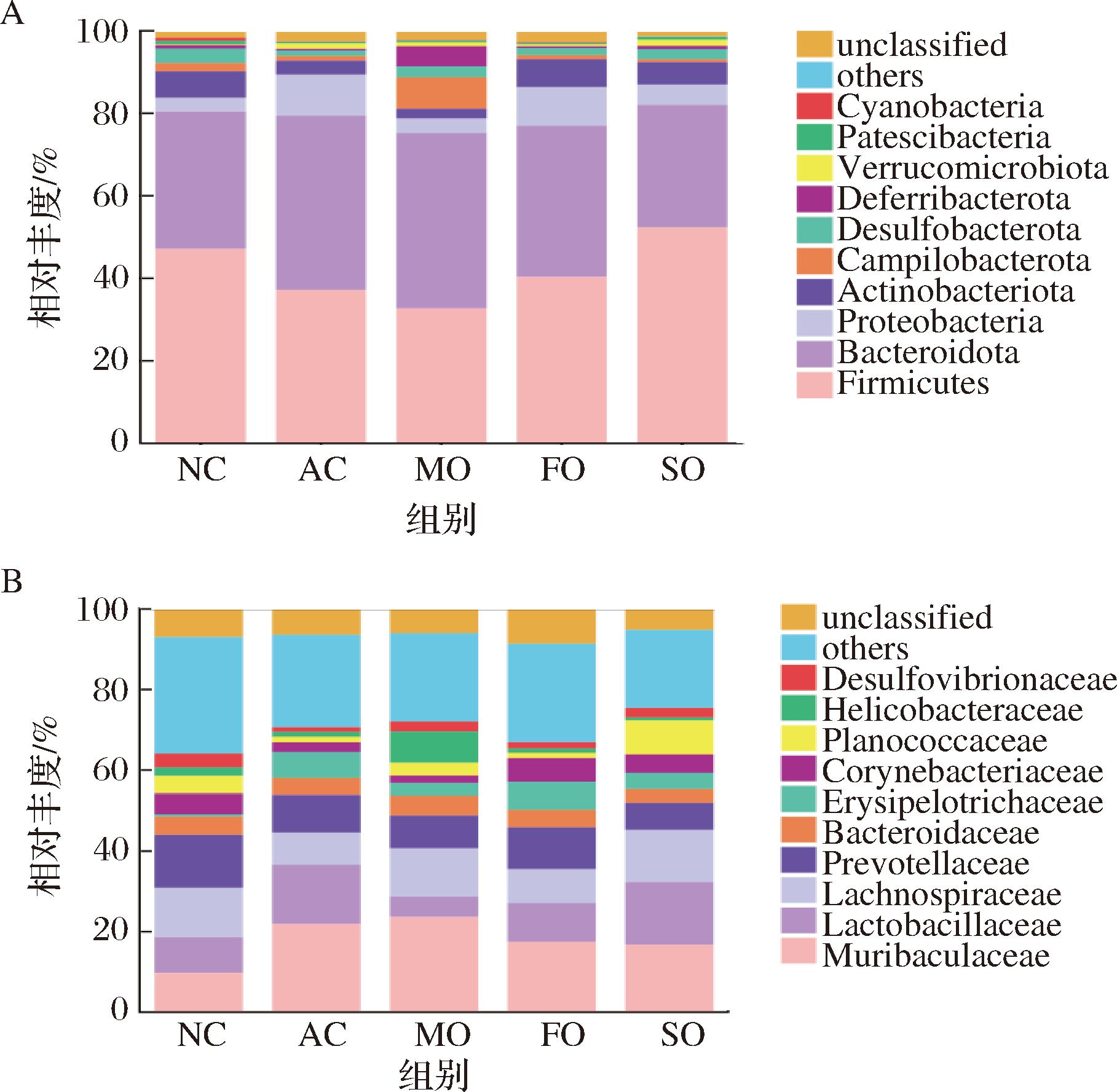
A-门水平;B-科水平
图4 小鼠粪便微生物相对丰度图
Fig.4 Relative abundance map of fecal microorganisms
指示值(IndVal)是表示一个物种在生态群落中的指示程度,它同时考虑了该物种出现的数量和频率。在属水平上(图5),酒精暴露后,AC组指示物种显示为粪杆菌属(Faecalibaculum),IndVal≥0.8;FO和SO组指示菌属分别为丁酸菌属(Butyricimonas)和单球菌属(Monoglobus)。
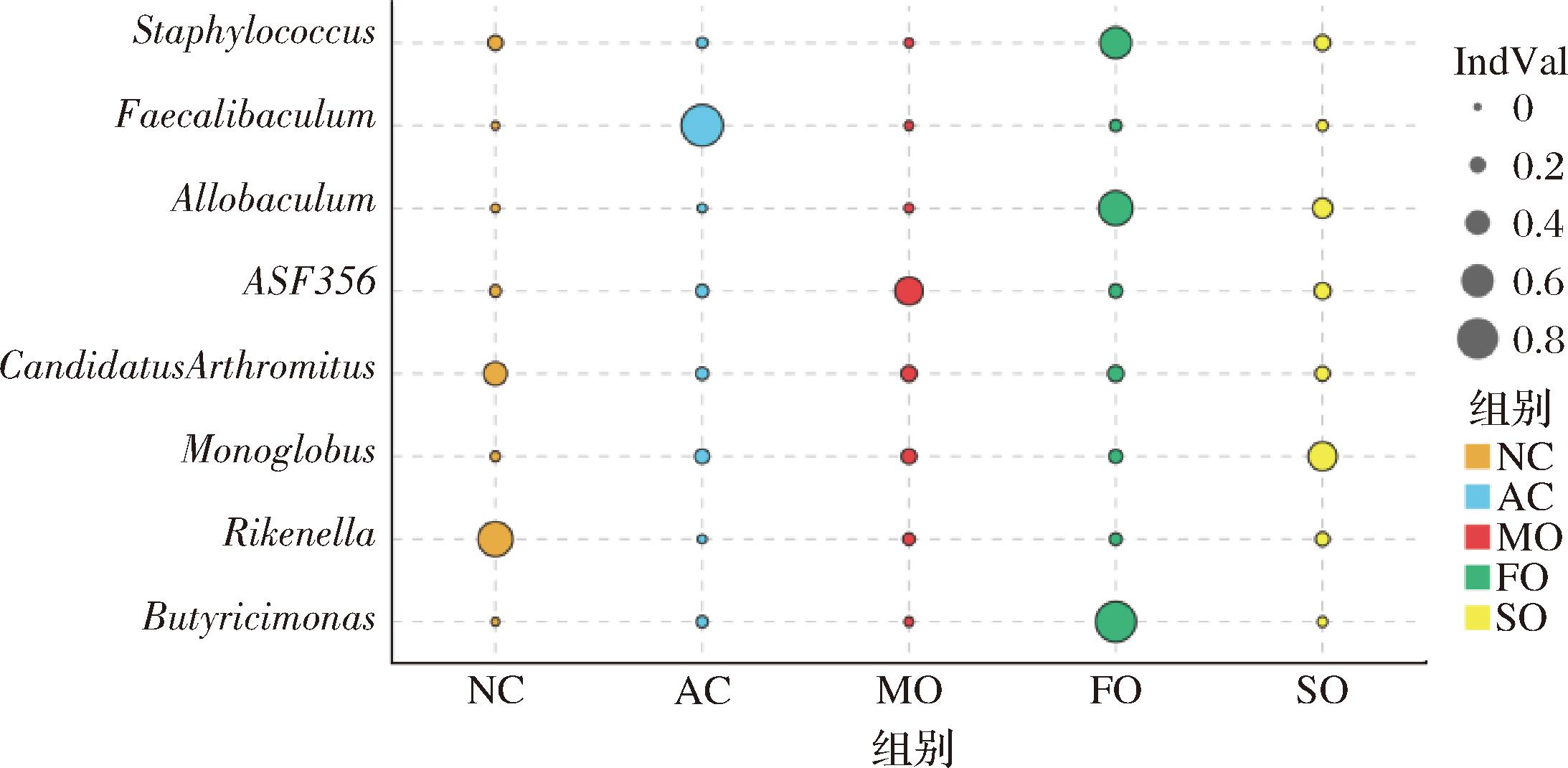
图5 粪便微生物属水平指示物种分析
Fig.5 Analysis of indicator species at the genus gevel of gecal microbiota
3 结论
本研究发现,FO、SO及MO均能显著改善酒精诱导的脂肪肝与肝脏炎症,其中MO的干预效果最优,其次FO保护效能总体优于SO。进一步分析表明,MO更加全面的脂肪酸组成(含n-3、n-6、n-7、n-9 UFA)及均衡比例(UFA/SFA≈3,PUFA/MUFA≈1,n-6/n-3≈2)是其发挥作用的关键。肠道菌群研究显示,MO可调控ALD模型中异常升高的Lactobacillaceae和Erysipelotrichaceae丰度,提示其肝保护作用可能通过肠道菌群-肠肝轴介导。上述结果证实,脂肪酸组成的全面性与比例均衡性是提升沙棘油抗ALD效能的重要因素。
[1] OSNA N A, RASINENI K, GANESAN M, et al. Pathogenesis of alcohol-associated liver disease[J]. Journal of Clinical and Experimental Hepatology, 2022, 12(6):1492-1513.
[2] BATALLER R, ARAB J P, SHAH V H. Alcohol-associated hepatitis[J]. New England Journal of Medicine, 2022, 387(26):2436-2448.
[3] TANG Z Z, DING Y J, ZHANG W, et al. Epidemiological characteristics of alcohol-related liver disease in China: A systematic review and meta-analysis[J]. BMC Public Health, 2023, 23(1):1276.
[4] WU M Y, QIN S X, TAN C Q, et al. Estimated projection of incidence and mortality of alcohol-related liver disease in China from 2022 to 2040: A modeling study[J].BMC Medicine, 2023, 21(1):277.
[5] ZHONG W, LI Q, XIE G X, et al. Dietary fat sources differentially modulate intestinal barrier and hepatic inflammation in alcohol-induced liver injury in rats[J]. American Journal of Physiology. Gastrointestinal and Liver Physiology, 2013, 305(12): G919-G932.
[6] ROBICHAUD P P, SURETTE M E. Polyunsaturated fatty acid-phospholipid remodeling and inflammation[J]. Current Opinion in Endocrinology, Diabetes, and Obesity, 2015, 22(2):112-118.
[7] CALDER P C. Marine omega-3 fatty acids and inflammatory processes: Effects, mechanisms and clinical relevance[J]. Biochimica et Biophysica Acta (BBA)-Molecular and Cell Biology of Lipids, 2015, 1851(4):469-484.
[8] ZHANG X X, WANG H, YIN P P, et al. Flaxseed oil ameliorates alcoholic liver disease via anti-inflammation and modulating gut microbiota in mice[J]. Lipids in Health and Disease, 2017, 16(1):44.
[9] MIAO F J, SHAN C L, YANG W, et al. Protective effect of walnut oil on alcoholic liver disease in mice[J]. Pakistan Journal of Zoology, 2022, 54(3): 1001-1500.
[10] GUO R, ZHU J Y, CHEN L, et al. Dietary camellia seed oil attenuates liver injury in mice chronically exposed to alcohol[J]. Frontiers in Nutrition, 2022, 9:1026740.
[11] GUO R, CHEN L, ZHU J Y, et al. Monounsaturated fatty acid-enriched olive oil exacerbates chronic alcohol-induced hepatic steatosis and liver injury in C57BL/6J mice[J]. Food &Function, 2023, 14(3):1573-1583.
[12] FU Y J, MACKOWIAK B, LIN Y H, et al. Coordinated action of a gut-liver pathway drives alcohol detoxification and consumption[J]. Nature Metabolism, 2024, 6(7):1380-1396.
[13] 肖瑞, 郭建锋, 王琳琳, 等. 基于宏基因组学分析不同膳食结构非酒精性脂肪肝患者的肠道菌群特点[J]. 食品与发酵工业, 2025, 51(4):123-130.XIAO R, GUO J F, WANG L L, et al. Metagenomic analysis reveals dietary structure-dependent gut microbiota characteristics in non-alcoholic fatty liver disease patients[J]. Food and Fermentation Industries, 2025, 51(4):123-130.
[14] BAJAJ J S. Alcohol, liver disease and the gut microbiota[J]. Nature Reviews Gastroenterology &Hepatology, 2019, 16(4):235-246.
[15] BAJAJ J S, KAKIYAMA G, ZHAO D, et al. Continued alcohol misuse in human cirrhosis is associated with an impaired gut-liver axis[J]. Alcoholism: Clinical and Experimental Research, 2017, 41(11):1857-1865.
[16] DUBINKINA V B, TYAKHT A V, ODINTSOVA V Y, et al. Links of gut microbiota composition with alcohol dependence syndrome and alcoholic liver disease[J]. Microbiome, 2017, 5(1):141.
[17] GAO Y. Inflammation and gut microbiota in the alcoholic liver disease[J]. Food &Medicine Homology, 2024, 1(2):9420020.
[18] MA Y, YAO J X, ZHOU L, et al. Comprehensive untargeted lipidomic analysis of sea buckthorn using UHPLC-HR-AM/MS/MS combined with principal component analysis[J]. Food Chemistry, 2024, 430:136964.
[19] HUANG P M, CHEN Z H, LI W Z, et al. Inquiry of modulatory role of sea buckthorn fruit oil on dyslipidemia and gut microbiota in hyperlipidemia mice[J]. Food Science and Human Wellness, 2025, 14(4):9250098.
[20] WANG Q, CAO B Y, ZHAN J W, et al. Sea buckthorn oil promotes the PI3K-Akt-ERK signaling pathway and macrophage M2 polarization to reduce radiation-induced skin injury[J]. Radiation Research, 2024, 202(5):785-794.
[21] HAO W J, HE Z Y, ZHU H Y, et al. Sea buckthorn seed oil reduces blood cholesterol and modulates gut microbiota[J]. Food &Function, 2019, 10(9):5669-5681.
[22] 王芳, 张滨, 张鑫, 等. 沙棘混合油对小鼠慢性酒精肝损伤及肠道菌群的调节作用[J]. 山西农业大学学报(自然科学版), 2025, 45(2):39-49.WANG F, ZHANG B, ZHANG X, et al. Regulatory effects of sea buckthorn mixed oil on chronic alcohol-induced liver injury and intestinal microbiota in mice[J]. Journal of Shanxi Agricultural University (Natural Science Edition), 2025, 45(2):39-49.
[23] KAAKOUSH N O. Insights into the role of Erysipelotrichaceae in the human host[J]. Frontiers in Cellular and Infection Microbiology, 2015, 5:84.