大曲是中国白酒酿造过程中不可或缺的关键要素,被誉为“酒之骨”[1]。其以纯种小麦为原料,经由润麦、粉碎、拌料、压制曲坯、入仓堆曲、堆积培养、拆曲贮存等环节制备而成[2]。高温大曲是酱香型白酒酿造所需的糖化发酵剂,具有提供菌源、糖化发酵、生香、投粮等功能,对酱香型白酒风格的形成和品质的提高起着决定性作用[3]。
高温大曲中的微生物是影响基酒产量和品质的直接因素,其群落结构复杂,主要包括细菌、霉菌和少量酵母菌、放线菌[4]。在高温大曲的生产过程中,不同的制曲温度以及环境等因素会影响大曲中微生物和酶的种类、数量,从而影响其发酵性能和代谢能力[5]。曲房是高温大曲堆积发酵的地点,ZHU等[6]对中高温大曲的研究发现,曲房中场地的异质性会对大曲中微生物群落及品质造成影响。李声睿等[7]对传统堆积和曲架堆积的高温大曲研究发现,2种不同工艺堆积的高温大曲微生物群落结构相似但相对丰度存在一定差异。目前的研究主要集中在利用高通量技术检测不同发酵时间[8]、不同工艺[5]、不同环境[9]等对高温大曲中微生物群落结构的影响,而对同一环境处于不同位置的高温大曲细菌群落结构变化及功能分析鲜有报道。
本研究结合实际生产工艺,选取同一批次、同一工艺但分别放置在曲房靠门、靠中、靠窗位置的3组高温大曲,在第一次入房、第一次翻曲、第二次翻曲、拆曲4个时间节点进行取样。通过宏基因组测序,分析比较曲房不同位置高温大曲发酵过程中的细菌群落结构演替规律及功能差异。本研究拟初步探索造成曲房不同位置高温大曲之间细菌群落差异的原因,分析特定功能的细菌来源类群,为理解不同位置高温大曲发酵过程中的细菌群落特征演变提供理论基础,为高温大曲制曲工艺的优化提供理论支撑,为提升成品酱香型白酒风味与质量提供新的思路。
1 材料与方法
1.1 材料
高温大曲:取自四川省泸州市江阳区某酱香型白酒高温大曲制曲车间。
Mag-Bind®土壤DNA提取试剂盒,美国Omega Bio-tek公司;琼脂糖,美国Thermo Scientific公司。
1.2 仪器与设备
TL2010S中通量组织研磨破碎仪,鼎浩源科技发展(天津)有限公司;Eppendorf N13462C移液器、Eppendorf 5424R高速台式冷冻离心机,德国Eppendorf公司;Sub System 70电泳槽,美国Labnet公司;JY600C电泳仪,北京君意东方电泳设备有限公司;NanoDrop2000超微量分光光度计,美国Thermo Fisher Scientific公司。
1.3 实验方法
1.3.1 样品采集
结合实际生产工艺,分别在高温大曲入房阶段(d0)、第一次翻曲阶段(d7)、第二次翻曲阶段(d14)、拆曲阶段(d40)4个节点设置取样时间。曲房内的温度、湿度控制对高温大曲的质量有着至关重要的影响,在生产中,制曲师傅需要根据天气变化适时开关门窗,以控制曲房内的温度、湿度,确保有益微生物的繁殖。曲房的空间示意图及取样位点如图1所示,曲块堆积位置位于曲房两侧,中间为过道,为研究曲房内不同位置对高温大曲细菌群落和功能的影响,取样位点分别为左侧堆垛的靠门(D)、靠中(C)、靠窗(W)3个不同位置。分别在选取位点的上中下层取3块大曲,大曲经粉碎混匀后,用无菌取样袋密封并置于超低温冰箱贮存,用于总DNA的提取。
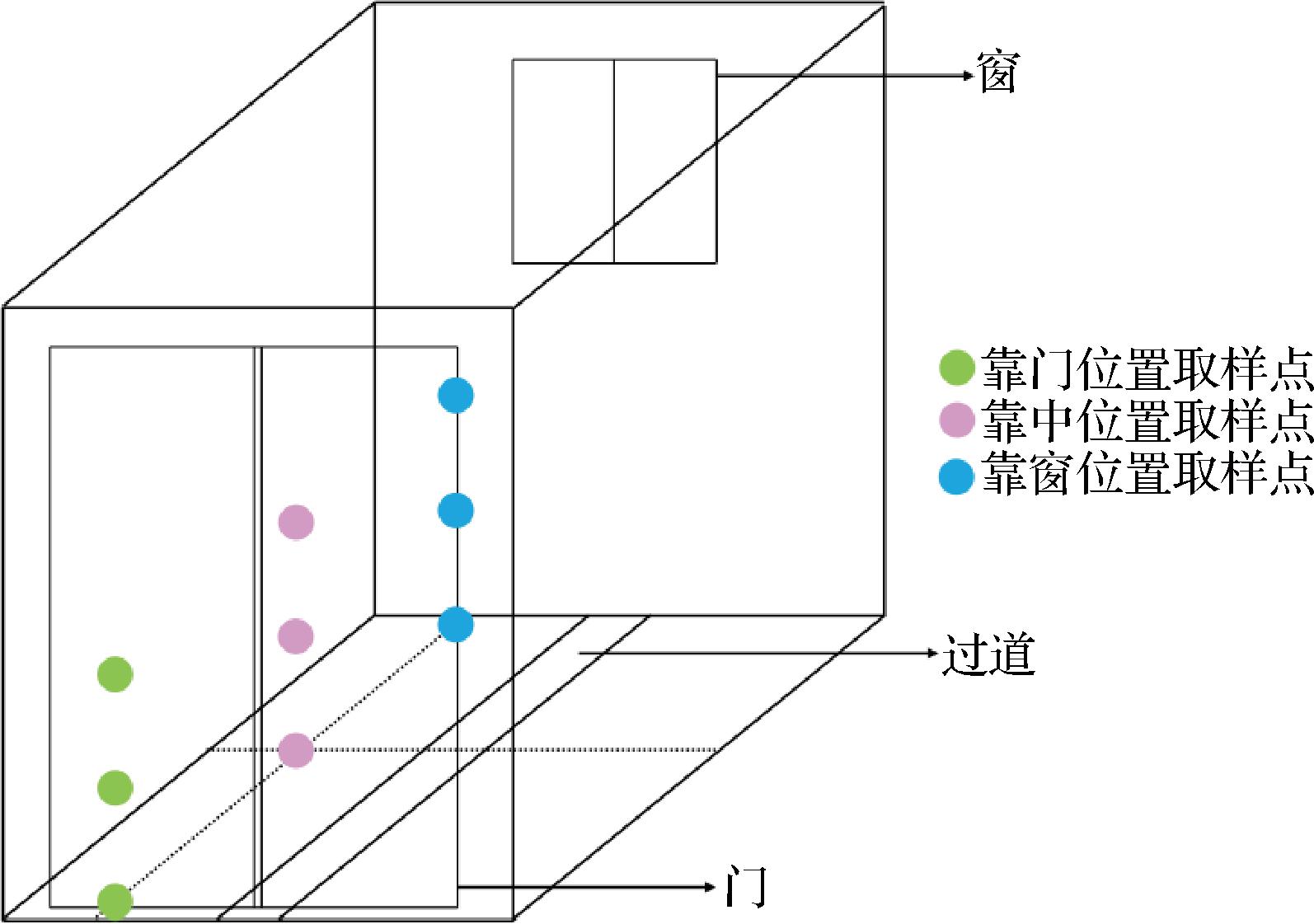
图1 曲房的空间示意图及取样位点
Fig.1 Spatial diagram of the Qu room and sampling location
1.3.2 样品DNA的提取
以组织研磨破碎仪结合液氮冷冻对适量样品进行预处理后,使用试剂盒进行样品DNA抽提。完成DNA抽提后,通过超微量分光光度计检测DNA质量和浓度,利用1%(质量分数)琼脂糖凝胶电泳检测DNA完整性。将符合上机要求的DNA样品用干冰运送至上海美吉生物医药科技有限公司,使用HiSeqTM X Ten平台(Illumina,美国)进行宏基因组测序。
1.3.3 数据统计与分析
参照YANG等[10]的方法,使用Fastp v0.20.0对序列进行质控过滤和去宿主序列,使用MEGAHIT v1.1.2对序列进行拼接组装,使用Prodigal v2.6.3进行基因预测,使用CD-HIT v4.6.1构建样品非冗余基因集,使用Diamond v2.0.13进行非冗余数据库(Non-Redundant,NR)注释。在分析时,仅保留细菌域相关数据用于多样性、功能及贡献度分析。功能注释包括KEGG数据库和CAZy(Carbohydrate-active enzymes)数据库注释。使用R v3.3.1软件进行丰度计算,使用Python v2.7.0软件进行基因贡献度计算等操作。本研究基于“美吉云分析平台”(https://cloud.majorbio.com/)完成上述分析和作图。本研究中宏基因组学原始数据已提交至国家生物信息中心组学原始测序数据库(https://bigd.big.ac.cn/gsa),编号为CRA024183。
2 结果与分析
2.1 曲房不同位置高温大曲α多样性分析
在本次检测中,获得的DNA经宏基因测序,共获得995 020 884条Reads,其中98.41的序列为高质量序列,经过MEGAHIT组装共获得2 284 575条Contigs,对组装结果中的Contigs进行开放阅读框(open reading frames,ORFs)预测,共预测得2 705 501个ORFs,经CD-HIT聚类得到由1 102 358个基因组成的非冗余基因集,基因平均长度为587.84 bp。本研究对区房不同位置高温大曲中细菌菌群的α多样性进行了比较分析,结果如表1所示。
表1 高温大曲细菌的α多样性分析结果
Table 1 Analysis results of alpha diversity of high-temperature Daqu bacteria
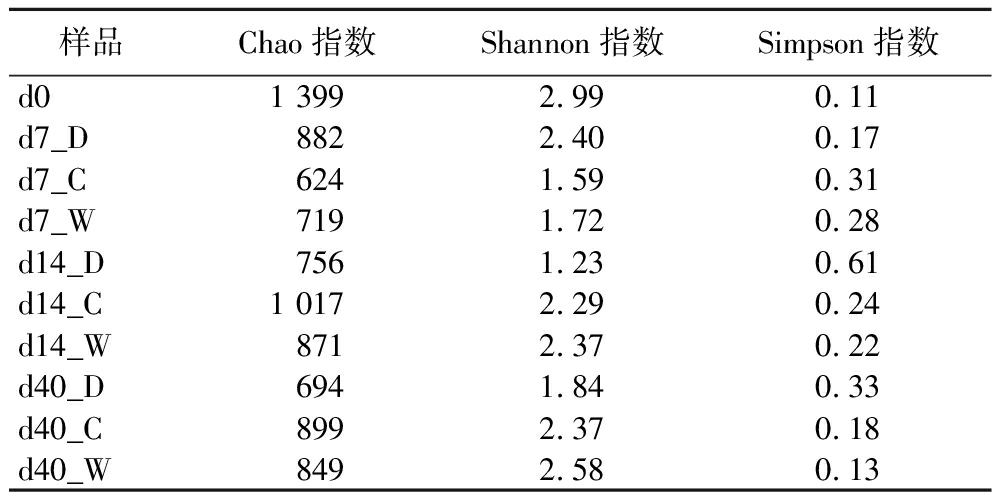
样品Chao指数Shannon指数Simpson指数d01 3992.990.11d7_D8822.400.17d7_C6241.590.31d7_W7191.720.28d14_D7561.230.61d14_C1 0172.290.24d14_W8712.370.22d40_D6941.840.33d40_C8992.370.18d40_W8492.580.13
总体来看,高温大曲在入房阶段,细菌菌群的Chao指数和Shannon指数分别为1 399和2.99,Simpson指数为0.11,细菌的多样性和丰富度最高,与邓阿玲等[11]的研究结果相似,这可能是因为高温大曲制曲原料未经灭菌处理,其微生物含量非常丰富。随着高温大曲发酵的进行,靠门、靠中、靠窗位置高温大曲Chao指数从1 399分别降低至694、899、849,Shannon指数从2.99分别降低至1.84、2.37、2.58,Simpson指数从0.11分别升高至0.33、0.18、0.13,细菌的丰富度和多样性总体呈现下降趋势。高温大曲的堆积发酵过程中,随着温度的升高,一些耐热性较差的微生物会被淘汰,导致细菌的丰富度和多样性下降。在拆曲阶段,曲房靠中位置和靠窗位置高温大曲的细菌多样性和丰富度差异不大,靠门位置的细菌多样性和丰富度最小,这可能是由于曲房靠门位置的温度、湿度、氧气含量等环境因素因人员进出等原因,易受到外界环境的影响,靠中位置和靠窗位置稳定的环境条件更适合大曲中细菌的生长。
2.2 曲房不同位置高温大曲β多样性分析
基于Bary-Curtis算法计算各高温大曲样品的距离,随后采用非度量多维尺度分析(non-metric multidimensional scaling,NMDS)比较大曲样品中细菌群落的差异,结果见图2。在第一次翻曲时,靠中和靠窗位置样品点距离较近,而靠门位置与这2个位置样品点距离较远,说明高温大曲在发酵初期,靠门位置的环境对其细菌菌落的影响较大。在拆曲阶段,不同发酵位置的大曲样品点距离较远,说明不同发酵位置高温大曲中细菌群落结构差异显著。这一结果与唐慧芳等[12]研究结果相一致,表明发酵场地异质性对高温大曲发酵微生物的生长和繁殖影响显著。
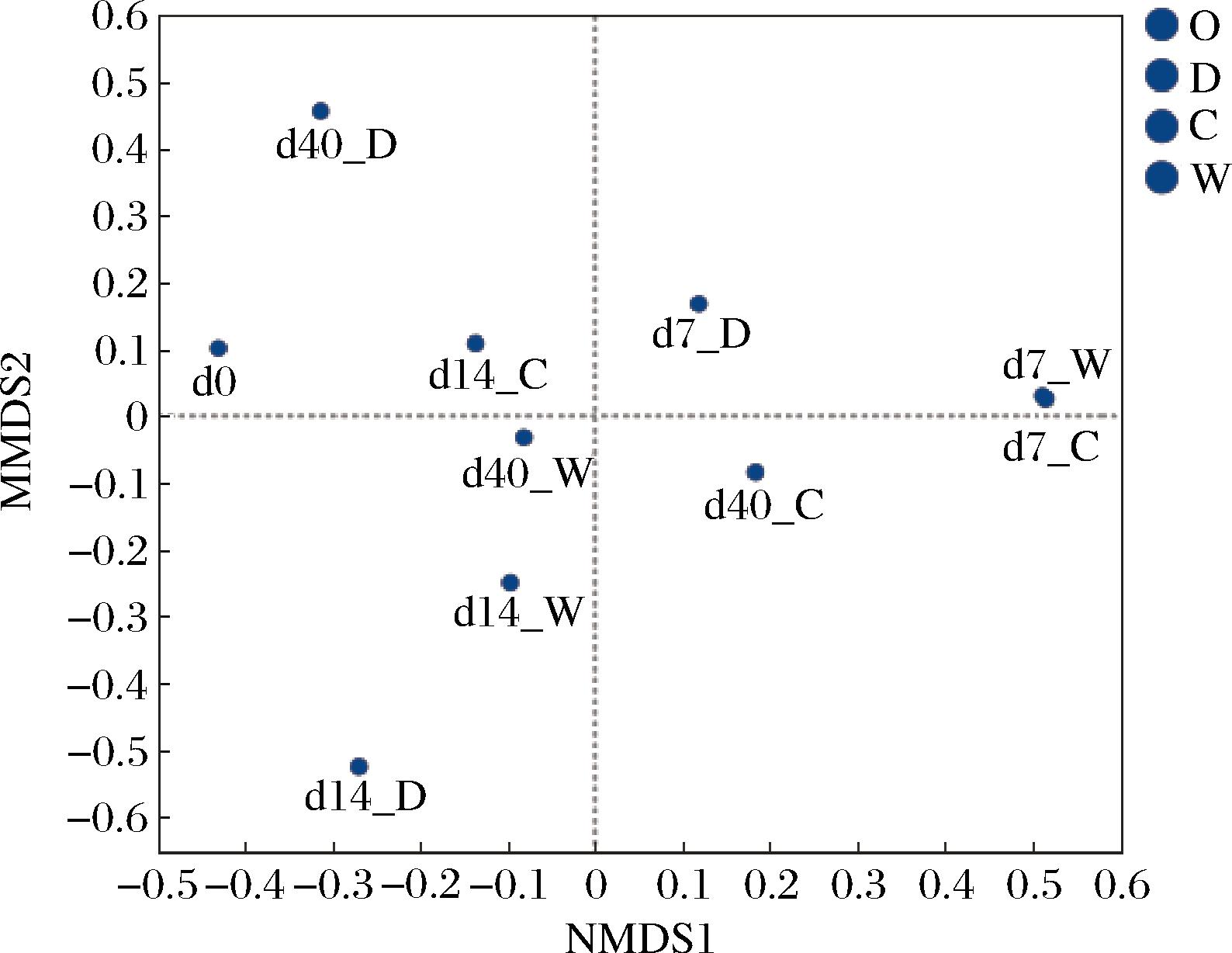
图2 不同发酵位置高温大曲细菌群落的NMDS图
Fig.2 NMDS diagram of high-temperature Daqu bacterial communities at different fermentation positions
2.3 曲房不同位置高温大曲细菌群落结构分析
进一步对不同发酵时间和不同位置的高温大曲细菌群落的构成进行比较分析并绘制了Venn图,结果如图3所示。高温大曲在整个发酵过程中共有的菌属数为804,占总数的58.35%,而第7天、第14天、第40天独有的菌属数分别为69、168、116,占总数的5.01%、12.19%、8.42%。靠门、靠中、靠窗位置共有的菌属数为862,占总数的62.55%,而靠门、靠中、靠窗位置特有的菌属数分别为69、192、67,占总数的5.01%、13.93%、4.86%。曲房中间位置特有的菌属数最多,这可能是因为中间位置温度较高且稳定,适合高温大曲中嗜热细菌的生长。结合α多样性分析结果,多样性最丰富的中间位置大曲中存在特有的192个菌属,表明中间位置大曲细菌菌群具有复杂性和特殊性。
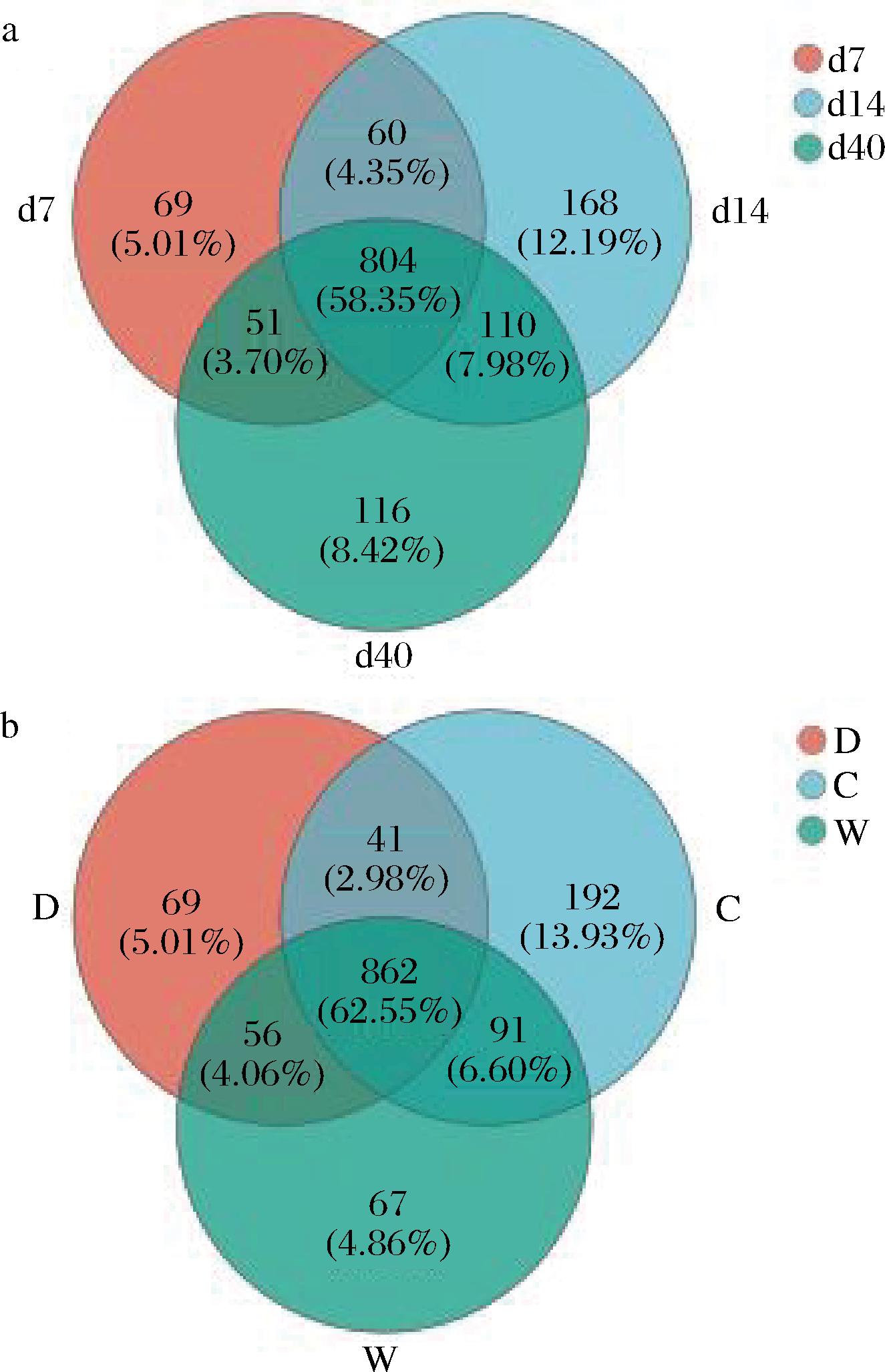
a-不同发酵时间;b-不同发酵位置
图3 高温大曲细菌种属数的Venn图
Fig.3 Venn diagram of bacterial species in high-temperature Daqu
10个样品在NR数据库中共检出50个门、101个纲、211个目、464个科、1 673个属、10 772个种,根据物种注释结果,选取在门水平和属水平上相对丰度排序前10的物种(others为其他物种的并集)生成物种相对丰度堆积图,以便直观地分析不同位置高温大曲细菌的相对丰度情况,结果如图4所示。

a-门水平高温大曲细菌群落;b-属水平高温大曲细菌群落
图4 高温大曲细菌群落结构柱状图
Fig.4 Bar diagram of bacterial community structure in high-temperature Daqu
门水平上(图4-a),在高温大曲的发酵过程中,芽孢杆菌门(Bacillota)和放线菌门(Actinomycetota)为优势菌门,其中Bacillota为绝对优势菌门。Actinomycetota存在于高温大曲发酵全过程,但是丰度较低。假单胞菌门(Pseudomonadota)在第一次入房时丰度较高,但随着高温大曲在曲房中发酵的进行逐渐减少,这与韩培杰[13]的研究结果一致。这可能是因为一部分Pseudomonadota为好氧菌,不适应高温大曲发酵过程中缺氧、高酸的环境,因而相对丰度随着发酵的进行逐渐减少。在第二次翻曲时,靠中位置的Bacillota显著高于其他2个位置,这可能是因为一部分Bacillota为厌氧菌、嗜酸菌,它们具备在酸性较强且氧气稀缺的环境中生存的能力[14]。在第一次翻曲阶段和拆曲阶段,不同位置高温大曲在门水平上差异不显著。在此基础上,进一步在属水平上对大曲样品中的细菌菌群结构进行分析。
属水平上(图4-b),在第一次翻曲阶段,靠门位置的优势细菌属分别是魏斯氏菌属(Weissella,29.63%)、克罗彭斯特菌属(Kroppenstedtia,20.91%)、片球菌属(Pediococcus,15.61%),靠中位置的优势细菌属分别是Weissella(45.72%)、Pediococcus(26.46%),靠窗位置的优势细菌属分别是Weissella(44.78%)、Pediococcus(22.37%)。发酵初期,曲房3个不同位置的环境因子差异不大,微生物变化情况不明显。
在第二次翻曲阶段,靠门位置的优势细菌属分别是糖多孢菌属(Saccharopolyspora,75.24%),靠中位置的优势细菌属分别是高温放线菌属(Thermoactinomyces,44.92%)、Pediococcus(7.88%)、Kroppenstedtia(6.96%),靠窗位置的优势细菌属分别是Saccharopolyspora(41.96%)、Kroppenstedtia(9.45%)、Weissella(8.50%)。Thermoactinomyces在靠中位置的丰度明显高于靠门位置和靠窗位置,这可能是因为其主要分布于陆生性热泉等高温环境中,最适生长温度为45 ℃,在50~60 ℃的超高温范围内仍能够正常生长代谢[15],在高温大曲发酵过程中,曲房靠中位置温度明显高于靠门位置和靠窗位置,更适合其生长。亦有研究表明,其在高温条件下生长旺盛,有助于其在大曲内部发生焦糖化反应和美拉德反应,形成大量深棕色化合物,是后期大曲酱味物质形成的关键[16]。
在拆曲阶段,靠门位置的优势细菌属分别是慢生芽孢杆菌属(Lentibacillus,51.31%)、Kroppenstedtia(21.04%)、链孢子菌属(Desmospora,7.78%),靠中位置的优势细菌属分别是Thermoactinomyces(24.48%)、Weissella(14.93%)、Lentibacillus(14.50%),靠窗位置的优势细菌属分别是Thermoactinomyces(26.56%)、Weissella(25.54%)、Pediococcus(16.29%)、Lentibacillus(3.19%)。Weissella为高温大曲中较为典型的乳酸菌,被确定为大曲中最丰富的细菌类群之一,其能够降解纤维二糖并在酸性发酵环境中生长代谢[17],其在生长代谢过程中产生的乳酸能为酵母菌属的酯化反应提供代谢底物,进而产生乳酸乙酯等风味化合物来改善酱香型白酒的风味[18]。靠门位置的Weissella和Pediococcus相对丰度明显低于靠中位置和靠窗位置,靠中位置高温大曲Weissella相对丰度最高,究其原因可能Weissella和Pediococcus是兼性厌氧菌[19],靠门和靠窗位置空气流动性比中间位置空气流动性大,高温大曲与环境中的氧气充分接触,2种菌的生长受到抑制。亦有研究表明,在高温大曲的发酵过程中,区域位置不同,Weissella的相对丰度也会随之发生变化,说明该菌属易受环境条件的影响[20]。靠门位置和靠窗位置环境条件稳定性差以及易受杂菌的影响,导致Weissella相对丰度偏低。
综上所述,在属水平上,高温大曲发酵过程中优势细菌类型为:Weissella、Saccharopolyspora、Pediococcus、Lentibacillus、Thermoactinomyces、Kroppenstedtia。这些优势菌属也是其他高温大曲堆积发酵过程中的优势菌属。何猛超等[21]对茅台地区高温大曲微生物群落的分析发现,芽孢杆菌属(Bacillus)、海洋芽孢杆菌属(Oceanobacillus)、乳杆菌属(Lactobacillus)、Thermoactinomyces、Kroppenstedtia、Weissella、Pediococcus、链球菌属(Streptococcus)、醋杆菌属(Acetobacter)为其优势细菌属。孙羊羊等[22]对天津地区高温大曲微生物群落的分析发现,Kroppenstedtia、Bacillus、枝芽孢杆菌属(Virgibacillus)、Oceanobacillus、葡萄球菌属(Staphylococcus)和Saccharopolyspora为其优势细菌属。由此可见,不同地区高温大曲中细菌类群十分丰富且存在差异,但各地区在优势细菌属的菌群结构组成上具有高度相似性,这可能与大曲的种类、制作工艺、发酵环境等有着较大的关系。
2.4 基于KEGG数据库的功能特征分析
比对KEGG数据库获得基因对应的KEGG功能注释信息并进行统计。去除药物开发和人类疾病2个一级分类,共获得4 360个KEGG同源基因分类(KEGG orthology,KO),将这些KO映射到的KEGG Pathway Level2(L2)信息与基因丰度进行关联,可计算得到不同功能途径的相对丰度信息,如图5所示。
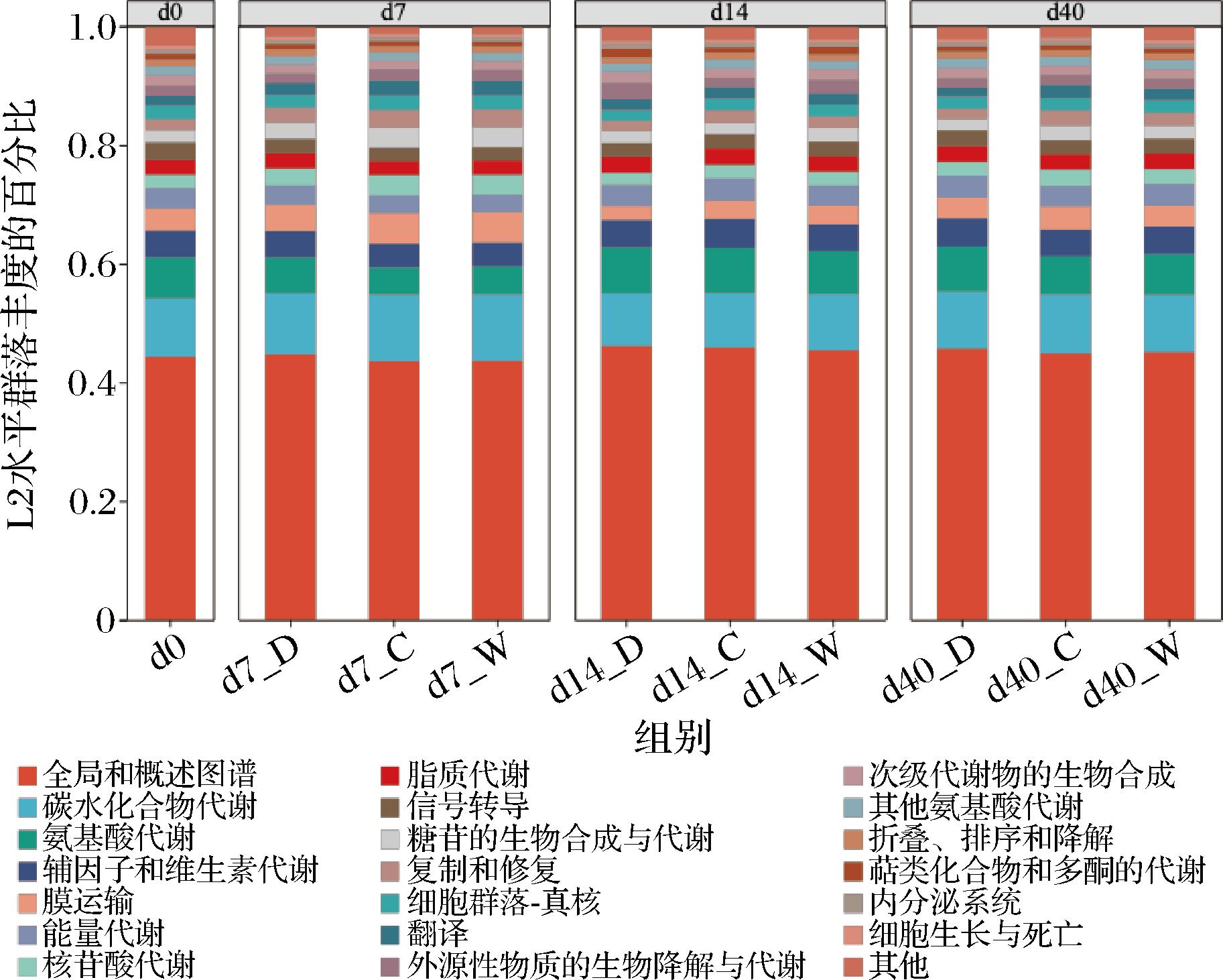
图5 高温大曲中细菌KEGG代谢功能组成
Fig.5 KEGG metabolic function composition of bacteria in high-temperature Daqu
在KEGG功能层级分类体系下,全局和概述图谱被注释到的基因数最多,其次是碳水化合物代谢与氨基酸代谢,三者均属于KEGG一级功能“代谢”分类下的二级代谢功能。全局和概述图谱涵盖了包括主要代谢通路、碳代谢、翻译、单向转导、折叠、分选和降解以及其他次生代谢的生物合成途径等多个关键的代谢通路和生物过程[23]。这些通路和过程是生物体生存和功能维持的基础,因此在大多数研究中,这些分类下的基因数目通常是最多的,这与之前的研究一致[24]。在相同发酵时间不同发酵位置的高温大曲代谢通路途径中,相较于另外靠中和靠窗位置,靠门位置的碳水化合物代谢较低而氨基酸代谢较高。小麦中的蛋白质在发酵过程中会被微生物分泌的蛋白酶降解为氨基酸,这些氨基酸不仅是微生物生长的重要氮源,同时也是多种风味物质(如高级醇、酯类等)合成的前体物质,在酒的香型及口感形成中起着重要作用[25]。由此说明,曲房不同位置发酵成熟的高温大曲,其风味化合物可能也会存在差异,这与张金萍等[24]的研究一致。
除去全局和概述图谱,被注释到基因数最多的为碳水化合物代谢,同时,成熟高温大曲在酱香型白酒生产过程中担任着糖化剂等重要角色[23],因此,本研究将进一步对曲房不同位置高温大曲基于碳水化合物活性酶数据库的功能特征进行分析。
2.5 基于CAZy数据库的功能特征分析
比对CAZy数据库获得基因对应的CAZy功能注释信息并进行统计。共有12 082条非冗余基因在碳水化合物活性酶数据库中显示出明确的功能注释信息,共获得碳水化合物活性酶基因功能注释信息343条,分属于184个糖苷水解酶(glycoside hydrolases,GHs),60个糖基转移酶(glycosyl transferases,GTs),34个多糖裂合酶(polysaccharide lyases,PLs),34个碳水化合物结合模块(carbohydrate-binding modules,CBMs),16个碳水化合物酯酶(carbohydrate esterases,CEs),15个辅助氧化还原酶(auxiliary activities,AAs)。如图6-a所示,在CAZy注释六大功能中,GHs注释结果最多,说明大曲在执行碳水化合物代谢功能中,GHs是促进多糖的水解的主要酶系。
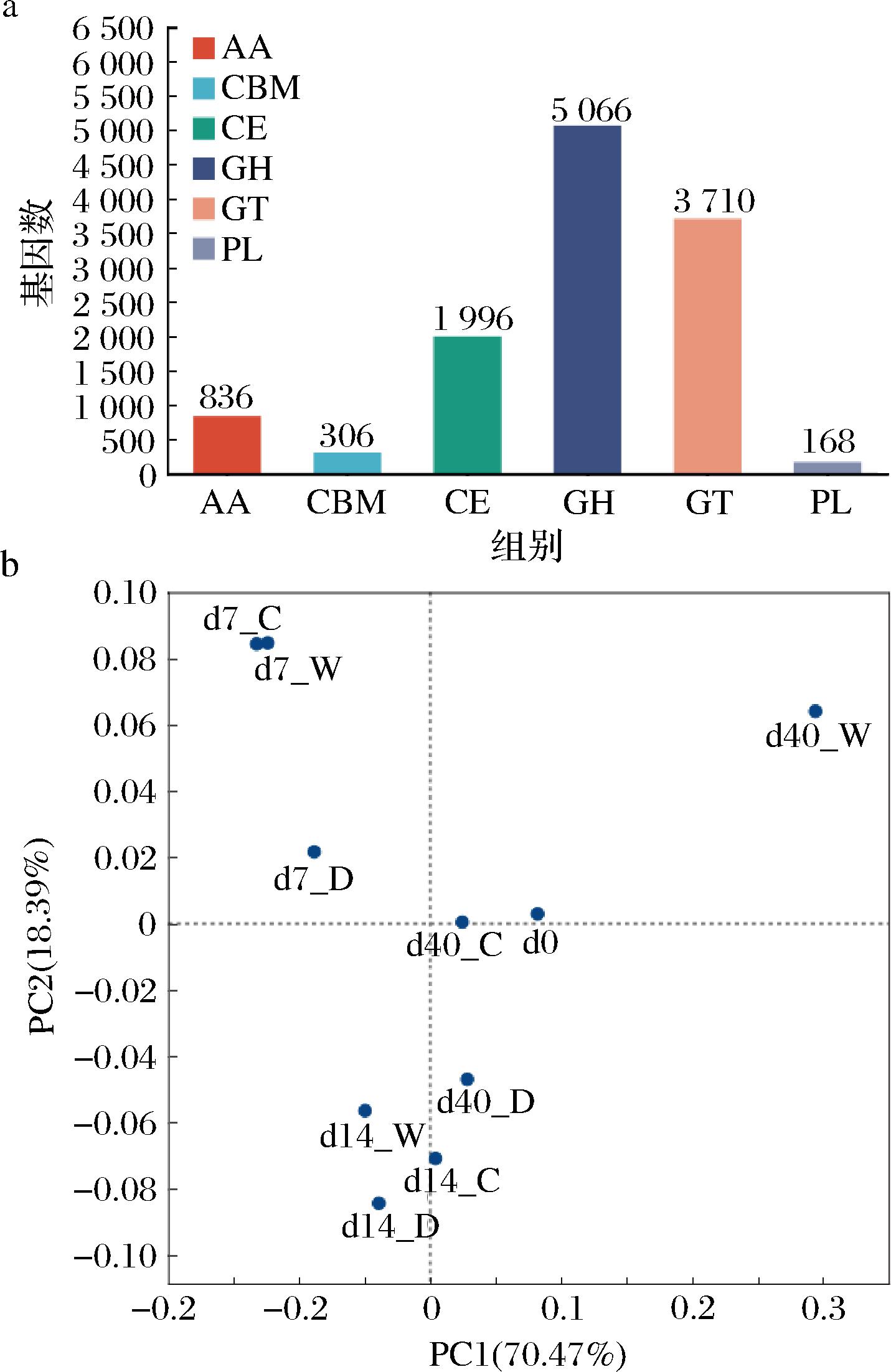
a-细菌CAZy功能分类统计图;b-细菌PCoA聚类分析图
图6 高温大曲中细菌CAZy功能分类统计和PCoA聚类分析
Fig.6 Classification and statistical analysis of bacterial CAZy function and PCoA clustering analysis in high-temperature Daqu
基于Bary-Curtis算法计算各高温大曲样品的距离,随后采用主坐标分析(principal co-ordinates analysis,PCoA)比较高温大曲样品中CAZy功能的差异,结果见图6-b。主坐标第一轴方差贡献率为70.47%,主坐标第二轴方差贡献率为18.39%,由此可知,物种差异的累计方差贡献率为88.86%,对差异的描述性较高,可利用前2个主成分来解释该模型的变量。各样品在坐标轴中的分布情况与基于高温大曲属水平微生物群落的主坐标分析结果类似,主要表现为相同发酵时间不同发酵位置的大曲差异显著,尤其是在拆曲阶段。
微生物群落的结构特征与其功能存在密切关联,故需进一步解析不同碳水化合物活性酶的潜在来源微生物类群。基于高温大曲样本的物种和功能相对丰度,进行物种丰度与功能丰度之间的关联分析,找出特定菌属的功能贡献度(图7)。结果显示,GTs、GHs、CEs、AAs的细菌贡献度相似,PLs和CBMs的细菌贡献度相似。GHs作为多数大曲样品中基因丰度最高的碳水化合物活性酶类,在发酵第7天时,主要源于Weissella和Pediococcus,曲房不同位置差异不显著;在发酵第14天,靠门和靠窗位置主要源于Saccharopolyspora,而靠中位置主要源于Thermoactinomyces;在发酵第40天,靠门位置主要源于Lentibacillus和Kroppenstedtia,而靠中和靠窗位置主要源于Weissella和Thermoactinomyces。在大曲的不同发酵阶段和曲房不同发酵位置,微生物对GHs的贡献度也随之发生变化。在拆曲阶段,靠门位置的大曲六大类碳水化合物活性酶基因来源菌属与其他2个位置差异较大,说明靠门位置的发酵环境对高温大曲的成熟影响较大,这与多样性分析的结果相似。
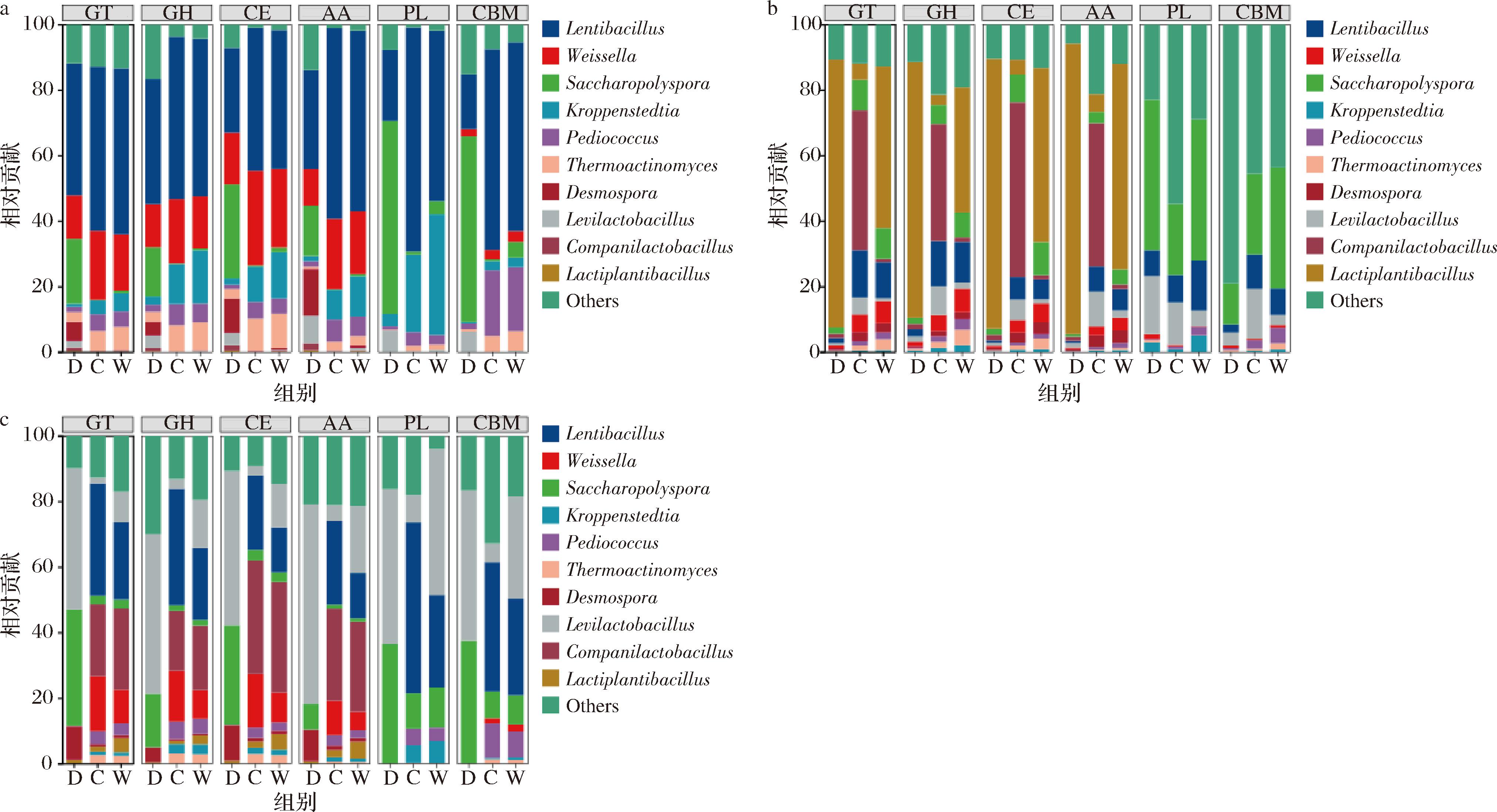
a-第一次翻曲阶段;b-第二次翻曲阶段;c-拆曲阶段
图7 高温大曲中六大类碳水化合物活性酶基因来源菌属分布图
Fig.7 Distribution diagram of bacterial genera responsible for the six major categories of carbohydrate active enzyme genes in high-temperature Daqu
酱香型白酒酿造工艺的核心环节中,高温大曲所含的碳水化合物活性酶系在底物转化中发挥着关键作用。本研究通过宏基因组学技术,进一步明确了其微生物来源,若基于菌群代谢特性进行定向筛选功能菌株,在构建强化大曲体系与精准调控发酵进程方面展现出显著的应用潜力。该方法的创新应用,为提升白酒酿造效能与品质稳定性提供了科学依据,也是长期聚焦的研究方向。
3 结论
本研究通过高通量测序技术系统解析了四川地区高温大曲在曲房不同位置(靠门、靠中、靠窗)发酵过程中细菌群落结构及其功能特征的动态变化。结果表明,发酵位置的异质性显著影响高温大曲的微生物群落组成与多样性。主坐标分析进一步证实,不同位置大曲的细菌群落结构差异显著。属水平上,靠中和靠窗位置高温大曲中Thermoactinomyces显著富集,其高温适应性及代谢活性可能通过促进焦糖化与美拉德反应,成为酱香物质形成的关键驱动因素。而靠门位置因环境波动频繁,优势菌属Weissella和Pediococcus的丰度较低,推测与氧气接触抑制厌氧菌生长相关。功能注释分析表明,碳水化合物代谢和GHs相关基因丰度最高。高温大曲中六大类碳水化合物活性酶基因来源菌属分布研究结果表明,GHs作为多数大曲样品中基因丰度最高的碳水化合物活性酶类主要源于Weissella和Thermoactinomyces。
为缩小不同空间位点高温大曲的品质差异,提升批次均一性,最终为白酒风味稳定性提供保障,可以从以下3个方面对曲房设计进行优化:a)空间分区布局优化:由于靠门位置因环境波动导致Weissella等关键功能菌丰度降低,而靠中、靠窗区域稳定的热环境更利于高温菌属(如Thermoactinomyces)富集。据此,建议在曲房设计时减少门、窗等开放区域的直接暴露,增设缓冲区或隔离带,降低外界气流扰动,同时强化中部区域的保温与控氧能力,以促进核心功能菌群的空间均一性分布;b)通风与温湿度调控:由于空气流动性差异影响兼性厌氧菌的丰度。因此,可优化曲房通风系统,采用定向气流设计(如顶部送风、底部回风),平衡不同区域的氧气分布,避免局部过氧或厌氧环境,从而维持功能菌群的协同代谢活性;c)监测点位布设参考:微生物群落的空间异质性提示,传统单点监测可能无法全面反映曲房状态。建议在曲房三维空间内设置多点温湿度传感器,重点关注靠门、靠窗等易受干扰区域的动态变化,实现精准环境调控。
在后续的研究中,可在以下3个方面开展深入探索:a)开发曲房三维空间温湿度实时监测系统,构建关键环境参数的动态变化模型,为解析微环境异质性对菌群演替的影响提供精准数据支撑;b)整合宏基因组与代谢组学技术,构建基于空间位置的菌群互作网络,揭示不同发酵位点间微生物的协同与竞争机制;c)运用地理统计学方法,建立环境因子与功能菌群的空间关联模型,量化各驱动因子对菌群空间分异的贡献度。特别值得关注的是,不同位点间优势菌属的竞争排斥机制及其对代谢通路空间分异的调控作用,这些科学问题的阐明将为优化曲房空间布局、实现大曲品质精准调控提供理论依据。此外,开发具有空间特异性的功能菌剂,探索其在传统发酵食品中的应用价值,也将是未来研究的重要方向。
本研究首次揭示了同一曲房内不同位置高温大曲的细菌群落演替规律及功能特征差异,为优化曲房结构设计、提升大曲品质均一性提供理论依据,同时为传统发酵食品微生物资源的空间化利用提供新思路,对提升酱香型白酒风味品质具有重要实践意义。
[1] 杜向军, 明红梅, 马浩, 等.机制与人工大曲曲块部位间微生物群落结构差异及其关键影响因素[J].食品与发酵工业, 2023, 49(3):83-91.DU X J, MING H M, MA H, et al.Microbial community structure differences and key influencing factors among different parts of mechanical and artificial Daqu[J].Food and Fermentation Industries, 2023, 49(3):83-91.
[2] YAN C, HUANG Z J, TU R K, et al.Revealing the differences in microbial community and quality of high-temperature Daqu in the southern Sichuan-northern Guizhou Region[J].Foods, 2025, 14(4):570.
[3] ZHANG Y D, DING F, SHEN Y, et al.Characteristics of the microbiota and metabolic profile of high-temperature Daqu with different grades[J].World Journal of Microbiology and Biotechnology, 2022, 38(8):137.
[4] WANG L M, CHENG Y X, HU X X, et al.Analysis of bacterial diversity and functional differences of Jiang-flavored Daqu produced in different seasons[J].Frontiers in Nutrition, 2023, 9:1078132.
[5] 唐绍培, 朱国军, 王振林, 等.人工和机械化生产酱香型高温大曲过程中微生物群落多样性比较[J].中国酿造, 2024, 43(7):79-85.TANG S P, ZHU G J, WANG Z L, et al.Comparison of microbial community diversity in the manual work and mechanized production process of sauce-flavor high-temperature Daqu[J].China Brewing, 2024, 43(7):79-85.
[6] ZHU M, ZHENG J, XIE J, et al.Effects of environmental factors on the microbial community changes during medium-high temperature Daqu manufacturing[J].Food Research International, 2022, 153:110955.
[7] 李声睿, 张立强, 魏阳, 等.不同堆积发酵方式高温大曲理化指标及微生物关联性研究[J].食品与发酵工业, 2025, 51(7):105-114.LI S R, ZHANG L Q, WEI Y, et al.Investigation of physicochemical indexes and microbial correlation of high- temperature Daqu in different fermentation methods[J].Food and Fermentation Industries, 2025, 51(7):105-114.
[8] YANG L, FAN W L, XU Y.Effects of storage period and season on the microecological characteristics of Jiangxiangxing high-temperature Daqu[J].Food Research International, 2024, 196:115034.
[9] KHAN M, KHALILIAN A, KANG S W.A high sensitivity IDC-electronic tongue using dielectric/sensing membranes with solvatochromic dyes[J].Sensors, 2016, 16(5):668.[10] YANG Y, WANG S T, LU Z M, et al.Metagenomics unveils microbial roles involved in metabolic network of flavor development in medium-temperature Daqu starter[J].Food Research International, 2021, 140:110037.
[11] 邓阿玲, 唐杰, 朱楚天, 等.黑色型高温大曲在固态发酵过程中的微生物群落及风味化合物演替驱动机制[J].食品科学, 2024, 45(23):102-112.DENG A L, TANG J, ZHU C T, et al.Driving mechanisms for microbial community succession and change of volatile flavor compounds during the solid-state fermentation of black high-temperature Daqu[J].Food Science, 2024, 45(23):102-112.
[12] 唐慧芳, 黄钧, 周荣清, 等.场地异质性对中高温大曲微生物群落及品质影响的研究[J].食品与发酵工业, 2023, 49(8):237-244.TANG H F, HUANG J, ZHOU R Q, et al.Effect of site heterogeneity on microbial community and quality of medium-high temperature Daqu[J].Food and Fermentation Industries, 2023, 49(8):237-244.
[13] 韩培杰. 中国白酒大曲微生物多样性研究[D].福州:福建林业大学, 2023.HAN P J.Study on microbial diversity of Chinese Baijiu Daqu[D].Fuzhou:Fujian Agriculture and Forestry University, 2023.
[14] KE L Q, WANG L L, LI H B, et al.Molecular identification of lactic acid bacteria in Chinese rice wine using species-specific multiplex PCR[J].European Food Research and Technology, 2014, 239(1):59-65.
[15] 李豆南, 黄魏, 王晓丹, 等.酱香型大曲中高温放线菌的筛选及风味成分分析[J].食品科学, 2018, 39(6):171-176.LI D N, HUANG W, WANG X D, et al.Identification and flavor profile of a thermoactinomycetaceae strain separated from Moutai-flavor Daqu[J].Food Science, 2018, 39(6):171-176.
[16] DENG L, MAO X, LIU D, et al.Comparative analysis of physicochemical properties and microbial composition in high-temperature Daqu with different colors[J].Frontiers in Microbiology, 2020, 11:588117.
[17] 陈乐乐, 王乙伊, 汪怡宁, 等.浙江地区中温大曲贮存过程细菌群落多样性及功能预测分析[J].中国酿造, 2023, 42(1):109-114.CHEN L L, WANG Y Y, WANG Y N, et al.Diversity and functional prediction of bacterial community during the storage of medium-temperature Daqu in Zhejiang region[J].China Brewing, 2023, 42(1):109-114.
[18] LIU P L, MIAO L H.Multiple batches of fermentation promote the formation of functional microbiota in Chinese miscellaneous-flavor Baijiu fermentation[J].Frontiers in Microbiology, 2020, 11:75.
[19] 赵慧君, 王玉荣, 侯强川, 等.不同成曲方式制备高温大曲的细菌菌群解析及其功能与表型预测[J].食品工业科技, 2025, 46(8):156-163.ZHAO H J, WANG Y R, HOU Q C, et al.Analysis of bacterial communities and prediction of functions and phenotypes in the preparation of high temperature Daqu using different methods[J].Science and Technology of Food Industry, 2025, 46(8):156-163.
[20] 陈绍依, 郎莹, 邱树毅, 等.茅台镇不同区域酱香大曲微生物群落结构及生产性能对比[J].食品科学, 2023, 44(14):134-143.CHEN S Y, LANG Y, QIU S Y, et al.Comparative studies on microbial community structure and production performance of Jiang-flavor Daqu in different areas of Maotai town[J].Food Science, 2023, 44(14):134-143.
[21] 何猛超, 任义平, 熊林, 等.茅台地区不同高温大曲微生物群落结构解析[J].中国酿造, 2022, 41(6):51-57.HE M C, REN Y P, XIONG L, et al.Microbial community structure of different high-temperature Daqu in Maotai area[J].China Brewing, 2022, 41(6):51-57.
[22] 孙羊羊, 尹亚格, 吴雨甍, 等.基于高通量测序技术分析天津高温大曲微生物菌群多样性[J].中国酿造, 2023, 42(5):28-34.SUN Y Y, YIN Y G, WU Y M, et al.Analysis of microbial community diversity of Tianjin high-temperature Daqu based on high-throughput sequencing technology[J].China Brewing, 2023, 42(5):28-34.
[23] WANG Y R, CAI W C, WANG W P, et al.Analysis of microbial diversity and functional differences in different types of high-temperature Daqu[J].Food Science &Nutrition, 2021, 9(2):1003-1016.
[24] 张金萍, 于佳俊, 贾福晨, 等.基于宏基因组学分析西藏青稞酒发酵过程中微生物多样性与风味形成的关系[J].食品与发酵工业, 2025, 51(5):310-321.ZHANG J P, YU J J, JIA F C, et al.Macrogenomics-based analysis of the relationship between microbial diversity and flavour formation during the fermentation of Tibetan highland barley wine[J].Food and Fermentation Industries, 2025, 51(5):310-321.
[25] 麻颖垚, 胡萍, 孙利林, 等.宏基因组学分析酱香型白酒窖内发酵优势菌与代谢功能的相关性[J].现代食品科技, 2020, 36(6):128-136.MA Y Y, HU P, SUN L L, et al.Metagenomics analyze the relationship between the dominant bacteria and fungi and metabolism function in the pit fermentation of Maotai-flavor liquor[J].Modern Food Science and Technology, 2020, 36(6):128-136.