“曲为酒之骨”,大曲是以小麦为主要原料,经过粉碎并与水混合后压制成型,并在特定的曲房环境中培育成熟的“多菌多酶”复合体[1]。大曲是白酒酿造过程中的糖化发酵剂,为发酵提供丰富的微生物、功能酶及风味(前体)物质,依据发酵顶温的不同,大曲主要分为高温大曲(品温顶温为60~65 ℃)、中高温大曲(品温顶温为55~60 ℃)和低温大曲(品温顶温低于50 ℃)[2],其中,中高温大曲主要用于浓香型白酒(如五粮液)的酿造。大曲的质量与白酒的品质有着直接的影响,研究表明大曲质量的优劣很大程度上取决于微生物群落组成及其代谢功能特征[3]。传统上,大曲的质量是根据主观感官特性和基础理化性质来评估的,感官评价通常依据曲块的外观、断面及香味等,虽操作简单快捷,但易受人为因素影响,结果稳定性较差。因此,深入剖析不同等级大曲中微生物群落的特征及代谢物特性,并解析大曲质量与微生物、理化性质及风味物质之间的相关性,对于揭示大曲品质的形成机制具有重要的理论意义与应用价值。
近年来,研究人员通过各种方法对不同等级大曲的微生物群落结构和挥发性化合物进行了分析。ZHANG等[4]研究发现,特级大曲的细菌群落丰富度较高,以慢生芽孢杆菌(Lentibacillus)、伯克氏菌(Burkholderia)、糖多孢菌(Saccharopolyspora)和嗜热子囊菌(Thermoascus)为主导,而普通大曲的真菌群落相对丰富,以葡萄球菌(Staphylococcus)和梭杆菌(Scopulibacillus)为主导属。HAN等[5]在探讨微生物群落对大曲品质的影响时观察到,优质大曲中酵母菌的数量及其功能性微生物的相对丰度显著超越了劣质大曲。特别是,地衣芽孢杆菌(Bacillus licheniformis)、扣囊覆膜酵母(Saccharomycopsis fibuligera)以及横亘霉(Lichtheimia ramosa)这3种微生物,在优质大曲中的丰度表现尤为显著。这一发现强调了特定微生物群体在提升大曲质量方面的重要性。向港兴等[6]的研究指出,尽管不同等级浓香型大曲的细菌群落结构显示出较高的相似性,但在微生物丰度方面存在一定的差异。具体而言,优级大曲中嗜热子囊菌的相对丰度显著高于一级大曲。大曲既是发酵生香剂也是香味化合物的载体,不同等级的大曲香气成分存在差别。丁芳等[7]发现不同等级大曲的挥发性代谢物主要在醇类、醛酮类和酯类物质上存在差异。其中,特级大曲相较于优级大曲具有更高的乙酸和乙酸乙酯含量。TANG等[8]对不同等级大曲的挥发性成分进行了分析,发现优质大曲的香气成分更为丰富,其醇类、酯类、酸类、醛酮类等物质的含量明显高于普通大曲。
本研究系统分析了不同等级中高温大曲(优级曲、一级曲、二级曲)的理化性质、挥发性风味物质及微生物群落组成,并分别采用冗余分析(redundancy analysis,RDA)和Spearman相关性解析了优势微生物与理化性质的相关性以及优势微生物与重要风味物质的潜在联系,从多个维度揭示不同等级大曲的品质差异性,为大曲质量评价及生产工艺优化提供理论支持。
1 材料与方法
1.1 实验样品
样品:产于西北某酒厂贮存6个月的中高温大曲。
不同等级大曲样品评定:大曲的等级由8位具备丰富经验的评曲师从外观、断面、曲皮厚及曲香等方面进行评定[9]。不同等级大曲的感官特征如表1所示。
表1 不同等级大曲感官特征
Table 1 Sensory characteristics of different grades of Daqu

大曲级别感官特征优级曲曲香纯正、发酵状态好、菌丝穿衣好、曲皮薄、断面整齐、菌丝健壮呈灰白色、无青霉菌感染、无湿心一级曲曲香一般、无异杂味、发酵良好、菌丝穿衣良好、曲皮较厚、断面较整齐、菌丝正常、有少量裂缝、有青霉菌感染、无湿心二级曲有异香、发酵状态一般、菌丝穿衣一般、曲皮厚、菌丝一般、裂缝较多、青霉菌感染较多、有湿心
取样方法:分别从不同等级大曲(优级曲、一级曲、二级曲)样品中各随机抽取10片,将曲块一分为四,粉碎后按五点取样法取样。测理化性质的样品于4 ℃ 冰箱密封保存,测微生物多样性和挥发性风味的物质样品置于-80 ℃冰箱密封保存。大曲样品编号记作优级曲(FQ)、一级曲(SQ)、二级曲(TQ),每个样品做3次平行分析。
1.2 仪器与设备
TL-48R粉碎研磨仪,上海万柏生物科技有限公司;5424R高温台式冷冻离心机,德国Eppendorf公司;A200型PCR仪,中国杭州朗基公司;Biowest Agarose琼脂糖,西班牙Biowest公司;DYY-6C电泳仪,北京市六一仪器厂;NanoDrop2000超微量分光光度计,美国Thermo Fisher Scientific公司;NovaSeq Reagent Kits/VAHTS® Universal Plus DNA Library Prep Kit for MGI V2测序试剂盒、Illumina Miseq测序仪,美国Illumina公司;NEXTFLEX Rapid DNA-Seq Kit建库试剂盒,美国Bioo Scientific公司;DVB/CarbonWR/PDMS-120 μm萃取头、5977B-8890 GC-MS仪、DB-WAX UI色谱柱(30 m×0.250 mm×0.25 μm),美国Agilent公司;PAL RSI多功能自动进样系统,广州智达实验室科技有限公司。
1.3 实验方法
1.3.1 大曲理化检测
大曲理化参照QB/T 4257—2011《酿酒大曲通用分析方法》进行分析;酸性蛋白酶采用福林酚法[10]。
1.3.2 大曲的DNA提取、PCR扩增及高通量测序
依据E.Z.N.A.® Soil DNA Kit操作步骤进行总DNA的提取,选用纯度达标的DNA作为模板,用16S rRNA基因V3~V4区域设计的一对通用引物341F(5′-CCTAYGGGRBGCASCAG-3′)与806R(5′-GGACTACHVGGGTWTCTAAT-3′)进行聚合酶链式反应(PCR)扩增。PCR扩增完成后,采用2%(体积分数)的琼脂糖凝胶电泳技术对所得PCR产物进行质量检测。随后,通过AxyPrep DNA Gel Extraction Kit试剂盒完成PCR产物的纯化步骤,并借助QuantusTM Fluorometer荧光计实现PCR产物的精确定量及均一化处理。最后运用Illumina NovaSeq平台以PE250双端测序模式开展高通量测序分析。
1.3.3 大曲的挥发性化合物检测
大曲挥发性化合物的检测参考梁二宏等[11]的方法进行。
1.3.4 统计学分析
显著性分析采用SPSS 26.0软件完成;RDA使用CANOVO 5软件实现;相关性热图通过在线平台https://www.chiplot.online/绘制;其他图通过Origin 2021绘制。
2 结果与分析
2.1 大曲理化性质分析
不同等级大曲理化指标如表2所示,3种等级大曲的水分均低于13%,符合大曲酿酒生产的要求。酸度是评价大曲质量的重要指标,能够反映大曲产酸微生物的代谢情况[12]。优级曲和一级曲的酸度高于二级曲,且优级曲和二级曲酸度存在显著差异(P<0.05)。糖化力的大小反映其对淀粉原料降解和消耗能力的强弱[13]。优级曲的糖化力为778 mg/(g·h),相比之下,一级曲的糖化力偏高[1 196 mg/(g·h)],而二级曲的糖化力偏低[438 mg/(g·h)]。研究揭示,若糖化力过低,则可能导致酿酒原料中的淀粉无法完全糖化,进而影响发酵进程并降低酒精产出率。相反,若糖化力过高,可能会造成酒醅变得过于黏稠,从而抑制其正常的发酵活动[14]。发酵力是评估大曲微生物产酒能力的关键参数,并在一定程度上体现大曲质量[6]。结果表明优级曲和一级曲的发酵力均高于二级曲。酯化力指大曲发酵过程中固有的生酯催化能力,随霉菌等微生物生长繁殖逐步积累[15]。优级曲酯化力为1 105 mg/(50 g·7 d),是二级曲的1.7倍,且存在显著差异(P<0.05)。优级曲的酸性蛋白酶活力和氨态氮含量最高,其次为一级曲,二级曲最低。3种等级大曲的糖化力、发酵力与酸性蛋白酶活性值均存在显著差异(P<0.05)。
表2 不同等级大曲理化指标测定结果
Table 2 Determination of physicochemical indexes of different grades of Daqu
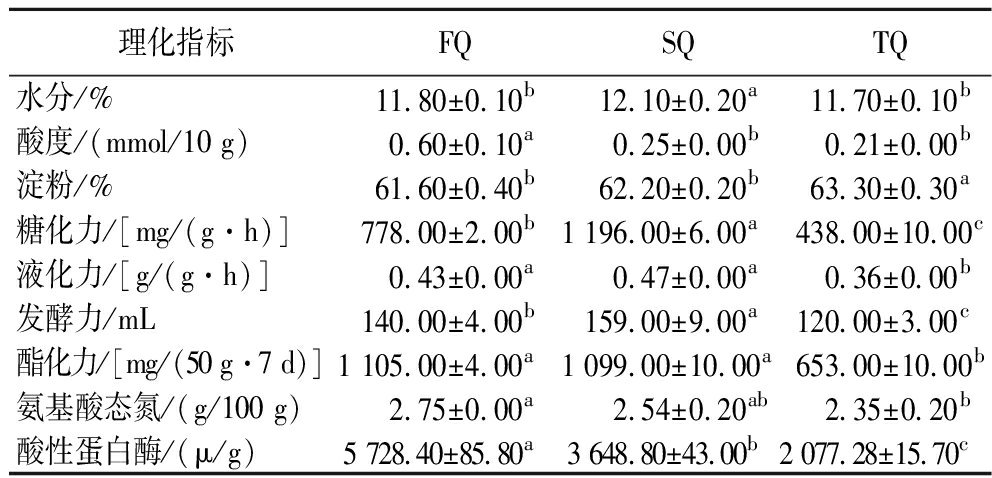
理化指标FQSQTQ水分/%11.80±0.10b12.10±0.20a11.70±0.10b酸度/(mmol/10 g)0.60±0.10a0.25±0.00b0.21±0.00b淀粉/%61.60±0.40b62.20±0.20b63.30±0.30a糖化力/[mg/(g·h)]778.00±2.00b1 196.00±6.00a438.00±10.00c液化力/[g/(g·h)]0.43±0.00a0.47±0.00a0.36±0.00b发酵力/mL140.00±4.00b159.00±9.00a120.00±3.00c酯化力/[mg/(50 g·7 d)]1 105.00±4.00a1 099.00±10.00a653.00±10.00b氨基酸态氮/(g/100 g)2.75±0.00a2.54±0.20ab2.35±0.20b酸性蛋白酶/(μ/g)5 728.40±85.80a3 648.80±43.00b2 077.28±15.70c
注:同行字母不同表示差异显著(P<0.05)(下同)。
2.2 大曲微生物群落的组成特征
如图1所示,3种不同等级大曲中平均相对丰度超过1%的细菌门主要包括厚壁菌门(Firmicutes,88.08%)、放线菌门(Actinobacteriota,5.23%)以及变形菌门(Proteobacteria,4.53%);平均相对丰度超过1%的真菌门为子囊菌门(Ascomycota,98.8%)和毛霉门(Mucoromycota,1.09%)。厚壁菌门和子囊菌门在3个等级的大曲中均占据绝对优势地位,这可能与它们较强的环境耐受性和适应性密切相关。
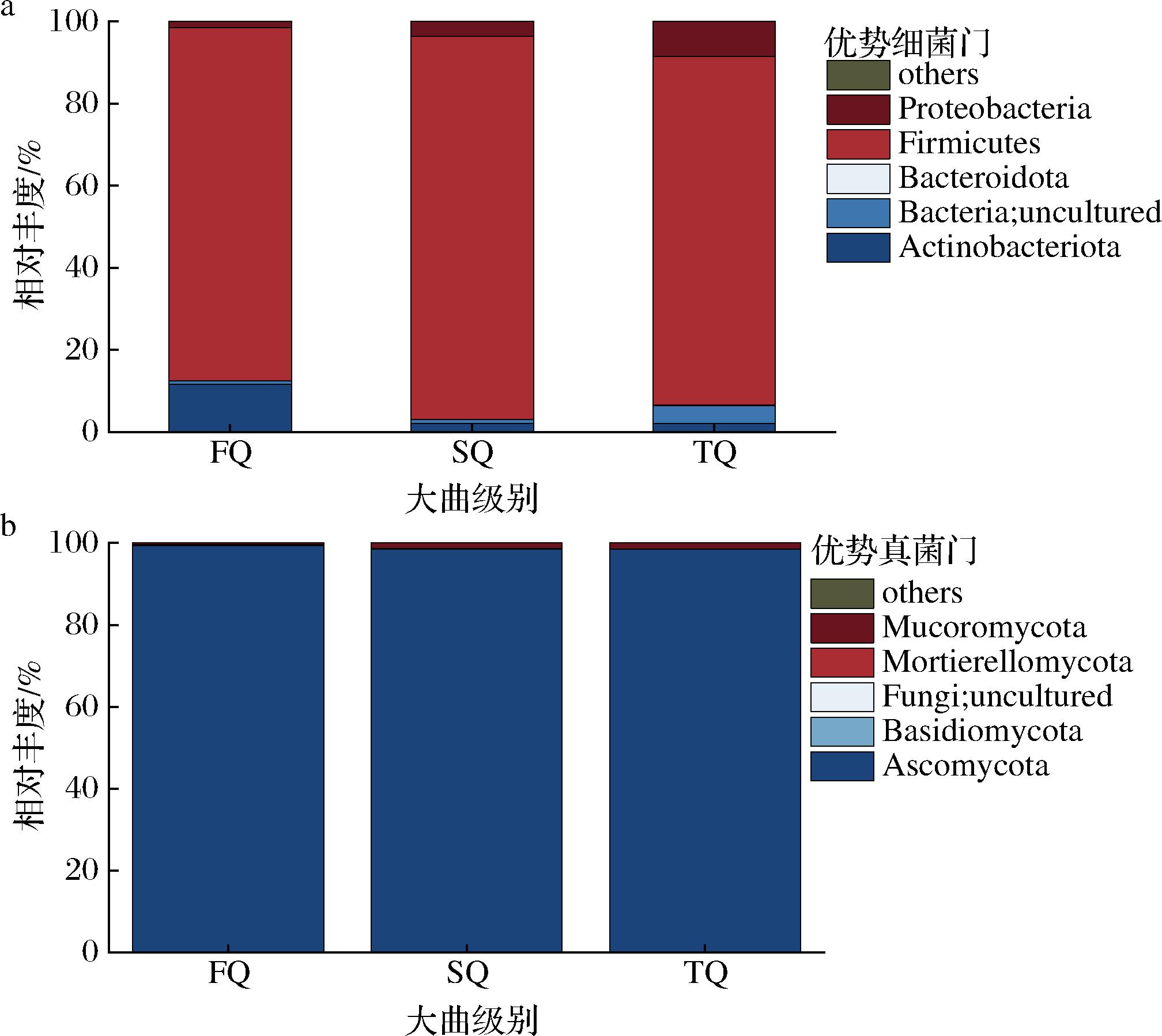
a-优势细菌门;b-优势真菌门
图1 不同等级大曲优势菌门
Fig.1 Advantageous bacterial phyla of different grades of Daqu
图2-a为大曲中平均相对丰度大于1%的属水平优势细菌群落,其中魏斯氏菌(Weissella,44.99%)、乳杆菌(Lactobacillus,28.21%)、高温放线菌(Thermoactinomyces,5.83%)、糖多孢菌(Saccharopolyspora,4.14%)和葡萄球菌(Staphylococcus,4.03%)为优势细菌属(平均相对丰度大于4%)。图2-b为大曲中平均相对丰度大于1%的属水平的真菌群落,其中嗜热子囊菌(Thermoascus,36.06%)、嗜热真菌(Thermomyces,17.5%)、念珠菌(Candida,15.06%)、覆膜孢酵母(Saccharomycopsis,14.02%)和曲霉菌(Aspergillus,5.59%)为优势真菌属(平均相对丰度大于5%),该结果与李娜等[16]关于河套地区中高温大曲优势真菌类群结构的结论相似。
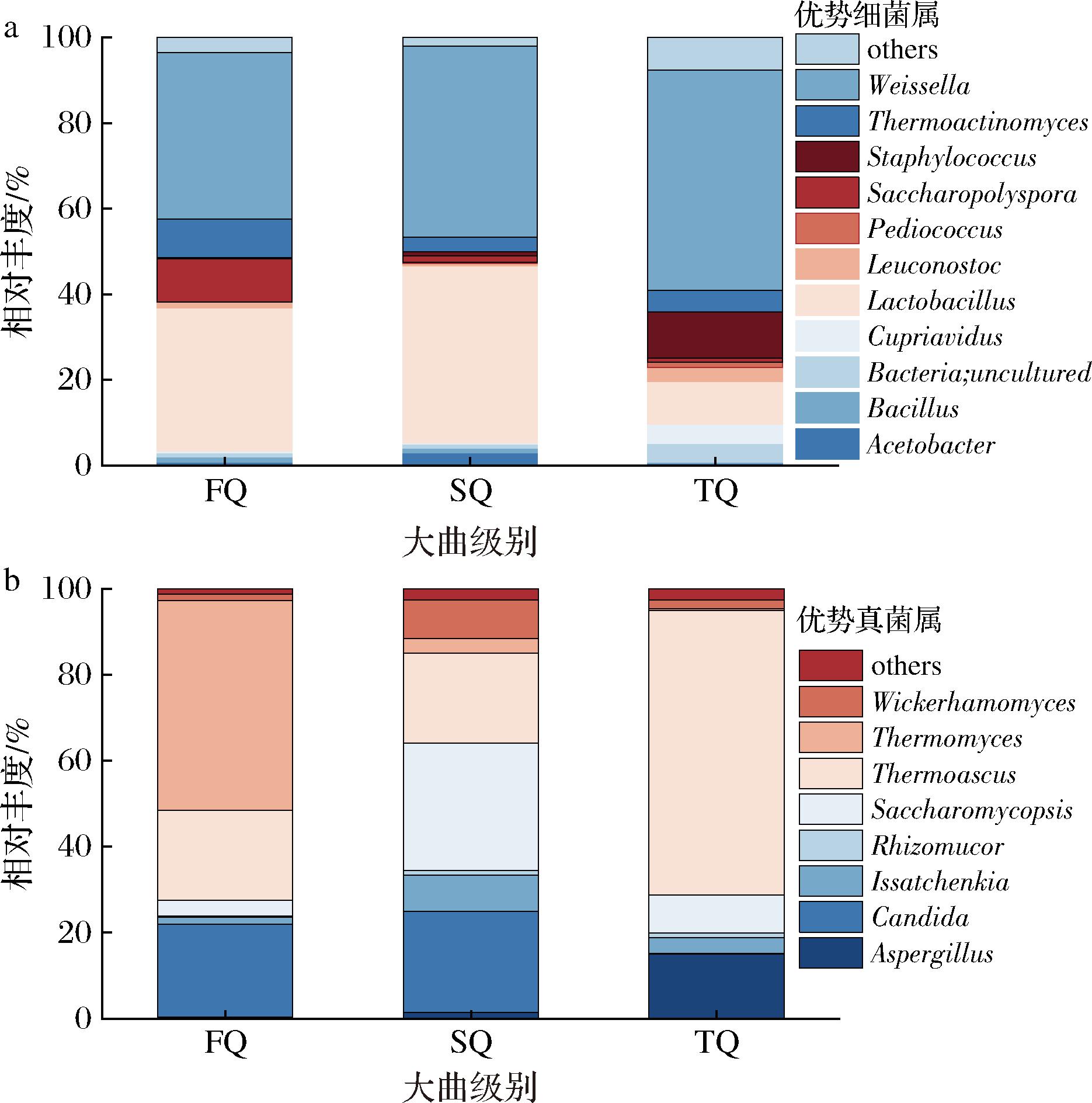
a-优势细菌属;b-优势真菌属
图2 不同等级大曲优势菌属
Fig.2 The dominant bacterial genera of different grades of Daqu
从大曲质量等级的角度分析,魏斯氏菌在3种等级大曲中相对丰度最高,芽孢杆菌(0.85%)和明串珠菌(Leuconostoc,1.80%)的平均相对丰度较低。根据ZHENG等[17]的研究表明,魏斯氏菌、芽孢杆菌及明串珠菌对浓香型白酒中关键香味成分-己酸乙酯的生成有促进作用。魏斯氏菌是一种兼性厌氧微生物,可通过异型发酵路径利用葡萄糖生成包括乳酸在内的多种有机酸,这些有机酸进一步与乙醇反应,形成乙酸乙酯和乳酸乙酯。此外,该菌能够表达β-葡萄糖苷酶,可能在发酵过程中承担纤维素降解的角色[18];同时,明串珠菌利用葡萄糖进行异型乳酸发酵,产生D-型乳酸和醋酸,这2种物质是乳酸乙酯和乙酸乙酯的重要前体[19];芽孢杆菌作为白酒发酵过程中的关键细菌种类,具有快速繁殖的特点,并能水解淀粉和分解蛋白质,为发酵过程提供必要的营养支持[20]。芽孢杆菌属和明串珠菌属相对丰度较低的原因可能与曲库管理有关。研究表明,曲库的温湿度控制水平对大曲的陈化、生香以及感官质量具有重要影响[21]。因此,建议在后续生产中建立并执行大曲陈储及温湿度控制的标准化作业流程,以优化大曲质量。糖多孢菌(10.05%)和高温放线菌(9.07%)在优级大曲中的相对丰度较高。高温放线菌能够分泌多种水解酶(如淀粉酶、纤维素酶、蛋白酶和脂肪酶等),高效降解大曲中的淀粉、纤维素、蛋白质和脂类原料,从而生成糖类、氨基酸和脂肪酸等重要的代谢前体(物质)[22]。此外,有研究推测,高温放线菌在代谢过程中可能参与了丁酸代谢[23]。覆膜孢酵母属、嗜热子囊菌和嗜热真菌等由于能够适应高温高湿等极端环境,通过在大曲发酵过程中的潮火期、大火期和后火期逐渐积累成为优势真菌,其中嗜热真菌属(FQ:48.74%;SQ:3.43%;TQ:0.32%)在优级曲中相对丰度明显高于一级曲和二级曲,DENG等[24]发现嗜热真菌是白酒酿造过程中合成己酸乙酯的核心微生物。整体而言,优级曲的细菌和真菌种类更加丰富,且其整体相对丰度高于一级曲和二级曲,尤其是嗜热真菌和高温放线菌等优势菌属在优级大曲中丰度显著增加,这些微生物对提升白酒风味和质量发挥了重要作用。
2.3 大曲挥发性代谢物分析
本研究采用顶空固相微萃取结合气相色谱-质谱联用技术(headspace solid-phase microextraction-gas chromatography-mass spectrometry,HS-SPME-GC-MS)对3种等级的大曲样本进行检测,共识别出约141种挥发性风味化合物,包括55种烃类、39种酯类、12种醇类、8种酮类、8种醛类、7种芳香族化合物、4种吡嗪类、2种酸类以及6种其他类。结果显示,不同等级的大曲在其挥发性成分的相对丰度和具体含量上均表现出显著差异。酯类是大曲中的主导组分,约占其总成分的67%(图3-a),且在3种不同等级大曲中的相对含量均占据首要地位(图3-b),研究表明酯类不仅影响白酒的风味,而且也是衡量白酒品质的重要指标之一[25]。如表3所示,3个等级大曲酯类化合物平均含量较高的物质包括亚油酸乙酯(7.24 mg/kg)、棕榈酸乙酯(6.459 mg/kg)、油酸乙酯(3.109 mg/kg)、辛酸乙酯(0.664 mg/kg)、亚麻酸乙酯(0.26 mg/kg)和庚酸乙酯(0.208 mg/kg)等,亚油酸乙酯、棕榈酸乙酯和油酸乙酯在一级曲中的相对含量均高于二级曲。己酸乙酯和乙酸乙酯在3个等级的大曲中相对含量分别为1.032~4.232 mg/kg和0.119~0.451 mg/kg,这2种成分是浓香型白酒中的主要香味物质,赋予白酒独特的水果香气。在白酒中,醇类化合物含量丰富,与其他物质的相互作用共同决定了白酒的风格类型,例如,具有焦糖香气的糠醇[26],蜂蜜香的苯甲醇[27],黄油和奶油香味的2,3-丁二醇和丙三醇,以及能够分解单宁、去除苦涩味的甘油等。这些化合物均在3种等级的大曲中被检测到,且浓度存在差异。总体来看,优级曲中醇类物质的含量高于一级曲和二级曲。此外,大曲中还检测到4种吡嗪类化合物,分别为2,6-二甲基吡嗪(坚果、烘烤、霉味)、2,3,5-三甲基吡嗪(青草、坚果、土豆、烘烤)、2,3,5,6-川芎嗪(咖啡、烘烤)和2-乙基-6-甲基吡嗪(烘烤、坚果、土豆、土味)[28]。吡嗪类化合物的香味阈值低,对白酒的风味有着显著的贡献。
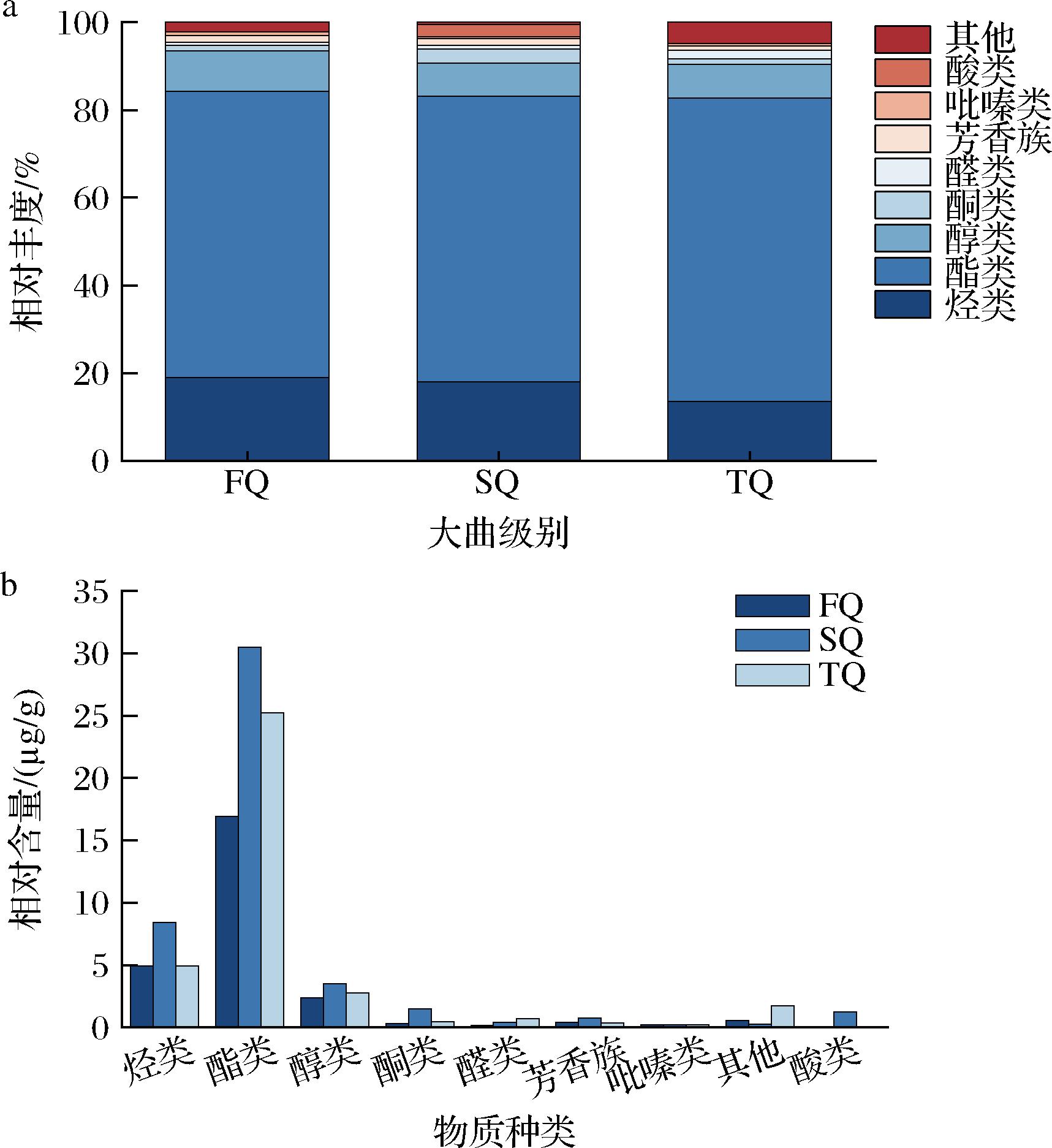
a-不同挥发性化合物的比例;b-各种挥发性化合物的相对含量
图3 不同等级大曲中挥发性化合物比较
Fig.3 Comparison of volatile compounds in different grades of Daqu
表3 不同等级大曲重要挥发性风味成分GC-MS的分析结果
Table 3 GC-MS analysis results of important volatile flavour components of different grades of Daqu
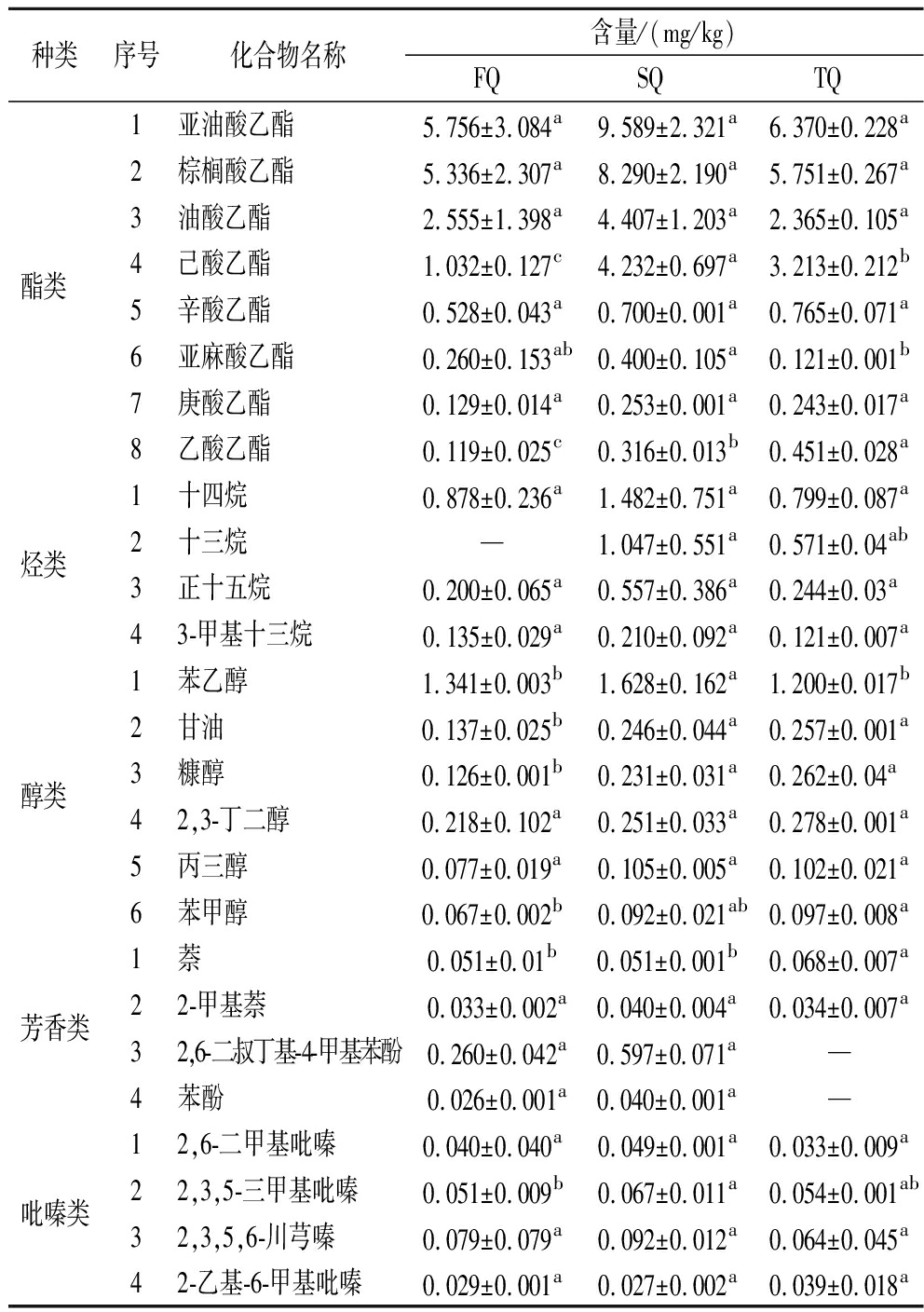
种类序号化合物名称含量/(mg/kg)FQSQTQ酯类 1亚油酸乙酯5.756±3.084a9.589±2.321a6.370±0.228a2棕榈酸乙酯5.336±2.307a8.290±2.190a5.751±0.267a3油酸乙酯2.555±1.398a4.407±1.203a2.365±0.105a4己酸乙酯1.032±0.127c4.232±0.697a3.213±0.212b5辛酸乙酯0.528±0.043a0.700±0.001a0.765±0.071a6亚麻酸乙酯0.260±0.153ab0.400±0.105a0.121±0.001b7庚酸乙酯0.129±0.014a0.253±0.001a0.243±0.017a8乙酸乙酯0.119±0.025c0.316±0.013b0.451±0.028a烃类 1十四烷0.878±0.236a1.482±0.751a0.799±0.087a2十三烷—1.047±0.551a0.571±0.04ab3正十五烷0.200±0.065a0.557±0.386a0.244±0.03a43-甲基十三烷0.135±0.029a0.210±0.092a0.121±0.007a醇类 1苯乙醇1.341±0.003b1.628±0.162a1.200±0.017b2甘油0.137±0.025b0.246±0.044a0.257±0.001a3糠醇0.126±0.001b0.231±0.031a0.262±0.04a42,3-丁二醇0.218±0.102a0.251±0.033a0.278±0.001a5丙三醇0.077±0.019a0.105±0.005a0.102±0.021a6苯甲醇0.067±0.002b0.092±0.021ab0.097±0.008a芳香类1萘0.051±0.01b0.051±0.001b0.068±0.007a22-甲基萘0.033±0.002a0.040±0.004a0.034±0.007a32,6-二叔丁基-4-甲基苯酚0.260±0.042a0.597±0.071a—4苯酚0.026±0.001a0.040±0.001a—吡嗪类12,6-二甲基吡嗪0.040±0.040a0.049±0.001a0.033±0.009a22,3,5-三甲基吡嗪0.051±0.009b0.067±0.011a0.054±0.001ab32,3,5,6-川芎嗪0.079±0.079a0.092±0.012a0.064±0.045a42-乙基-6-甲基吡嗪0.029±0.001a0.027±0.002a0.039±0.018a
注:“—”表示未检测到。
2.4 大曲理化性质与主要微生物属间相关性分析
RDA表明了大曲中主要微生物菌属与理化性质之间的关系,如图4所示,细菌属中的醋酸菌(Acetobacter)、芽孢杆菌、乳杆菌和真菌属中的念珠菌、异常威克汉姆酵母(Wickerhamomyces)、伊萨酵母、覆膜孢酵母与糖化力、液化力、发酵力和酯化力呈正相关;芽孢杆菌属、乳杆菌属、糖多孢菌、高温放线菌和嗜热真菌与酸性蛋白酶、氨基酸态氮和酸度呈正相关;与葡萄球菌、魏斯氏菌和曲霉菌呈负相关。研究表明,芽孢杆菌属和乳杆菌属是影响大曲酸度、酯化力和蛋白酶活性的主要优势菌群[29],此外,这些菌群能够大量产生乳酸,乳酸作为合成乳酸乙酯的重要底物,对大曲中多种挥发性成分的含量具有重要影响[30]。以上结果揭示了中高温大曲中微生物群落与理化性质之间的动态相关性,表明某类微生物不仅能影响多个理化指标,同时同一理化指标也可能受到不同微生物群体的共同作用,进而形成复杂的构效关系。
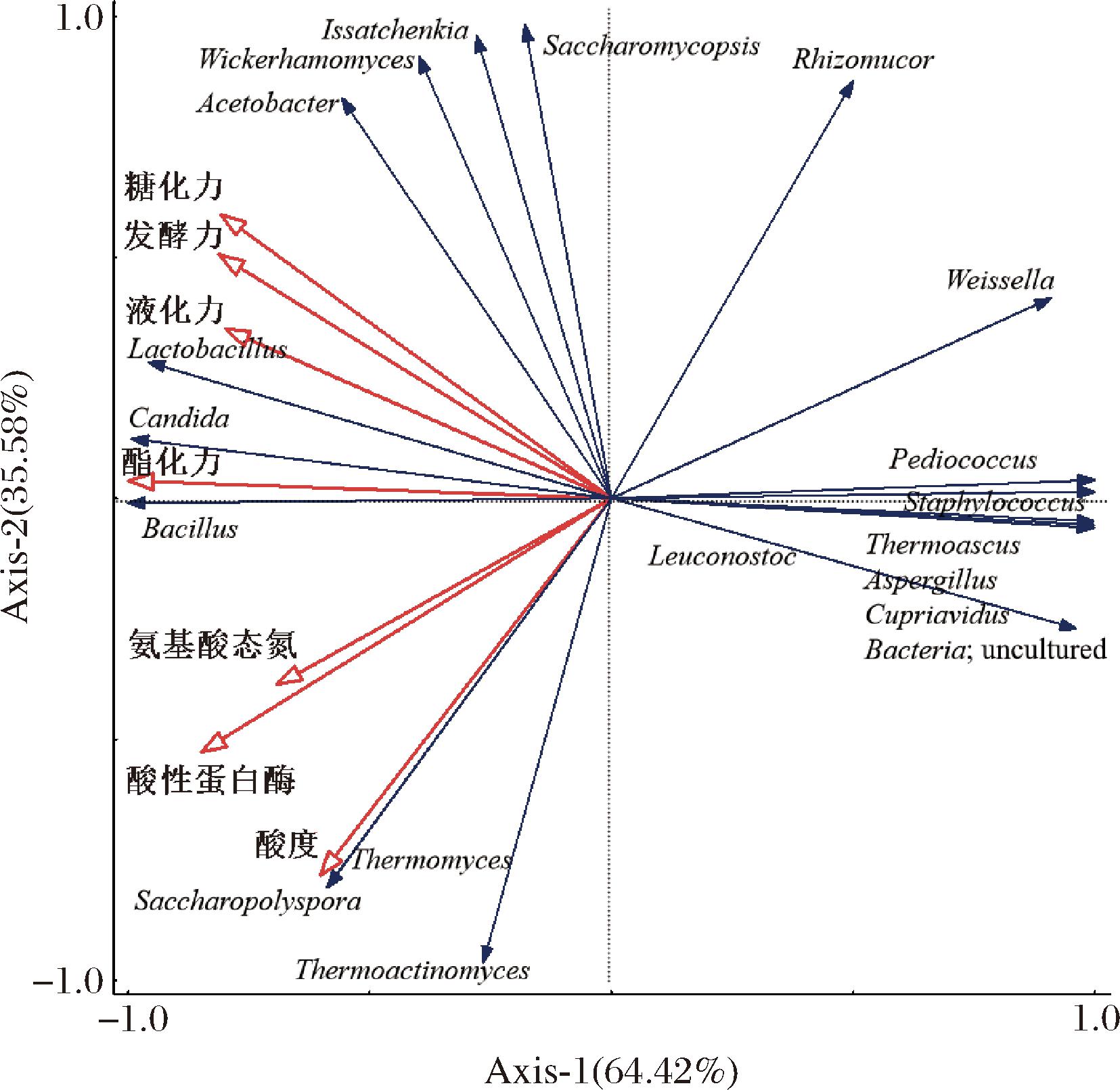
图4 不同等级大曲主要菌属与主要理化指标的冗余分析
Fig.4 RDA of the main genera and main physical and chemical indexes of different grades of Daqu
2.5 大曲重要风味化合物与主要微生物属间相关性分析
利用Spearman相关性分析,研究了3种不同等级大曲中重要挥发性化合物与核心微生物属之间的潜在联系,分析结果如图5所示。细菌属贪铜菌(Cupriavidus)和明串珠菌与2种酯类(油酸乙酯和亚麻酸乙酯)、2种烃类(十四烷和3-甲基十三烷)、2种芳香类化合物(2-甲基萘和2,6-二叔丁基-4-甲基苯酚)、2种吡嗪类化合物(二甲基吡嗪和川芎嗪)以及苯乙醇呈负相关。而真菌属威克汉姆酵母、伊萨酵母、根毛霉(Rhizomucor)和覆膜孢酵母与3种酯类(亚油酸乙酯、棕榈酸乙酯、庚酸乙酯)、2种烃类(十三烷和正十五烷)、丙三醇、2-甲基萘及三甲基吡嗪呈正相关。表明它们是大曲中重要挥发性代谢物的主要贡献者。此外,糖多孢菌属和嗜热真菌属与辛酸乙酯、乙酸乙酯、2,3-丁二醇、甘油、糠醇和苯甲醇呈负相关,而片球菌属(Pediococcus)则与这些化合物呈正相关。表明不同微生物在大曲重要挥发性化合物合成中发挥关键作用,揭示了微生物群落与发酵产物之间复杂的互作关系。
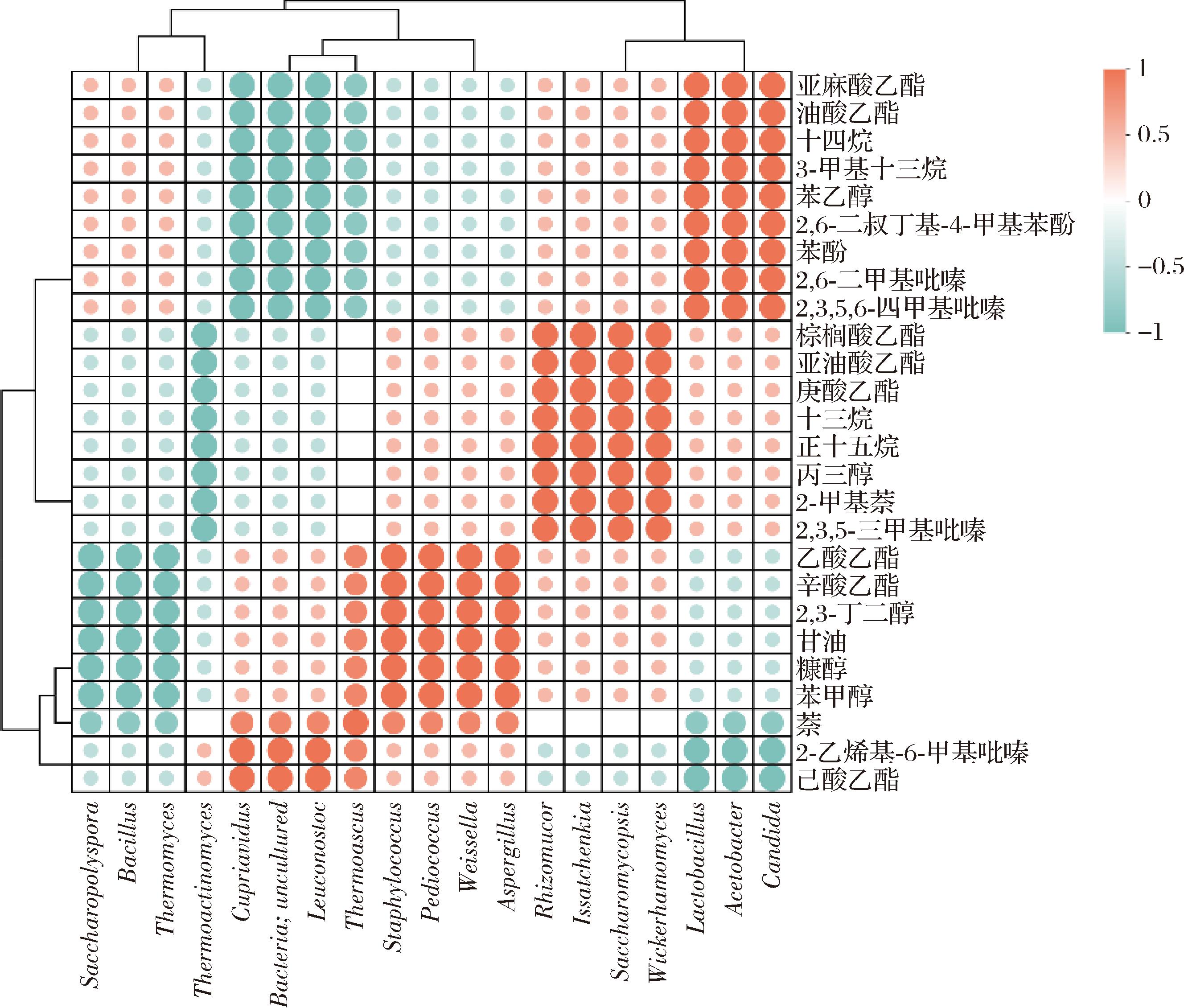
图5 不同等级大曲主要菌属与重要风味化合物的相关性热图
Fig.5 Heat map of the correlation between major genera and important flavour compounds of different grades of Daqu
3 结论
本研究系统分析了3种不同等级(优级、一级和二级)中高温大曲的理化性质、微生物群落结构以及挥发性风味化合物组成,揭示了其在浓香型白酒生产中的特性及品质差异。结果表明,3种大曲在糖化力、发酵力与酸性蛋白酶活性方面存在显著差异(P<0.05),优级曲的酸度、酸性蛋白酶活性和氨态氮含量显著高于一级曲和二级曲。微生物群落结构分析发现,魏斯氏菌、乳杆菌和高温放线菌是主要优势细菌属,嗜热子囊菌、嗜热真菌和念珠菌是主要优势真菌属。优级曲的微生物多样性和整体相对丰度显著高于一级曲和二级曲,尤其是嗜热真菌和高温放线菌等关键菌属在优级曲中的丰度显著增加。挥发性风味物质分析表明,3种等级大曲在醛类、酮类和芳香类化合物的组成上存在差异,且关键风味物质如己酸乙酯和乙酸乙酯在一级曲中的相对含量较高,且与魏斯氏菌、嗜热子囊菌和曲霉菌呈正相关。RDA显示芽孢杆菌和乳杆菌与酸度、酯化力和酸性蛋白酶活性呈正相关。本研究为中高温大曲的生产和评价体系的优化提供了重要的理论依据。然而,研究中仍存在一定的局限性,如样本数量的限制及具体的微生物功能特征尚未深入挖掘。未来的研究可以进一步探讨不同环境因素对大曲微生物群落结构和挥发性风味物质的影响,以完善大曲质量控制与标准化生产流程。以上相关研究成果对指导大曲生产及大曲科学评价体系的构建具有重要意义。
[1] 商海林. 中高温大曲高产糖化酶及蛋白酶活力菌株的筛选与应用研究[D].济南:齐鲁工业大学, 2024.SHANG H L.Screening and application of active strains with high yield of saccharification enzyme and protease in middle and high temperature Daqu[D].Jinan:Qilu University of Technology, 2024.
[2] 崔新莹. 中高温大曲香气成分分析及评价模型的研究[D].济南:齐鲁工业大学, 2023.CUI X Y.Research on the analysis and evaluation model of aroma composition of medium-high temperature Daqu[D].Jinan:Qilu University of Technology, 2023.
[3] 王柏文, 吴群, 徐岩, 等.中国白酒酒曲微生物组研究进展及趋势[J].微生物学通报, 2021, 48(5):1737-1746.WANG B W, WU Q, XU Y, et al.Recent advances and perspectives in study of microbiome in Chinese Jiuqu starter[J].Microbiology China, 2021, 48(5):1737-1746.
[4] ZHANG Y D, DING F, SHEN Y, et al.Characteristics of the microbiota and metabolic profile of high-temperature Daqu with different grades[J].World Journal of Microbiology and Biotechnology, 2022, 38(8):137.
[5] HAN P J, LUO L J, HAN Y, et al.Microbial community affects Daqu quality and the production of ethanol and flavor compounds in Baijiu fermentation[J].Foods, 2023, 12(15):2936.
[6] 向港兴, 陈莹琪, 沈毅, 等.不同等级浓香型大曲微生物群落结构与理化性质的比较分析[J].食品科学, 2022, 43(18):184-191.XIANG G X, CHEN Y Q, SHEN Y, et al.Comparative analysis of microbial community structure and physicochemical properties of different grades of Nongxiangxing Daqu[J].Food Science, 2022, 43(18):184-191.
[7] 丁芳, 张原頔, 蒋英丽, 等.不同等级高温大曲微生物群落和代谢物的特征分析[J].中国酿造, 2022, 41(11):24-30.DING F, ZHANG Y D, JIANG Y L, et al.Microbial communities and metabolites characteristics of high temperature Daqu with different grades[J].China Brewing, 2022, 41(11):24-30.
[8] TANG P, WANG L Q, ZHAO Q, et al.Characterization of key aroma compounds and relationship between aroma compounds and sensory attributes in different quality of high temperature Daqu[J].LWT, 2024, 194:115801.
[9] 刘延波, 刘润雨, 赵志军, 等.赊店老酒大曲质量差异研究[J].食品工业科技, 2019, 40(23):77-80;87.LIU Y B, LIU R Y, ZHAO Z J, et al.Study on quality difference of Daqu in SheDianLaoJiu[J].Science and Technology of Food Industry, 2019, 40(23):77-80;87.
[10] 冯利芳. 大曲蛋白酶的效果分析及其功能菌的分离鉴定和应用研究[D].太原:山西师范大学, 2018.FEN L F.Analysis of protease effect from Daqu and isolation identification and application of functional bacteria in Daqu[D].Taiyuan:Shanxi Normal University, 2018.
[11] 梁二宏, 李金洋, 李微微,等.3种高温大曲功能特征与微生物群落结构差异性分析[J].食品科学, 2024, 45(21):166-175.LIANG E H, LI J Y, LI W W, et al.Differences in functional characteristics and microbial community structures of three types of high-temperature Daqu[J].Food Science, 2024, 45(21):166-175.
[12] FAN G S, DU Y H, FU Z L, et al.Characterisation of physicochemical properties, flavour components and microbial community in Chinese Guojing roasted sesame-like flavour Daqu[J].Journal of the Institute of Brewing, 2020, 126(1):105-115.
[13] CHI Z M, CHI Z, LIU G L, et al.Saccharomycopsis fibuligera and its applications in biotechnology[J].Biotechnology Advances, 2009, 27(4):423-431.
[14] 任海伟, 李云帆, 阿丽米热·克热穆, 等.不同等级金徽酒大曲储存过程中的细菌群落演替规律和组装机制[J/OL].食品科学, 2025.DOI:10.7506/spkx1002-6630-20240612-075.REN H W, LI Y F, ALIMIRE KEREMU, et al.Community succession pattern and assembly mechanism of bacteria during storage of different grades of strong-flavor Jinhui Daqu[J/OL].Food Science, 2025.DOI:10.7506/spkx1002-6630-20240612-075.
[15] 张肖克, 黄平, 姜萤.制曲行业呼唤大曲质量统一标准[J].酿酒科技, 2005(11):25-29.ZHANG X K, HUANG P, JIANG Y.Starter-making industry calling for unified Daqu quality standards[J].Liquor-Making Science &Technology, 2005(11):25-29.
[16] 李娜, 张海波, 叶明波, 等.河套地区中高温大曲真菌类群结构解析[J].中国酿造, 2024, 43(12):110-115.LI N, ZHANG H B, YE M B, et al.Analysis of fungal community structure of medium-high temperature Daqu in Hetao area[J].China Brewing, 2024, 43(12):110-115.
[17] ZHENG X W,YAN Z, ROBERT NOUT M J, et al.Characterization of the microbial community in different types of Daqu samples as revealed by 16S rRNA and 26S rRNA gene clone libraries[J].World Journal of Microbiology &Biotechnology, 2015, 31(1):199-208.
[18] 李艳, 董振玲, 李佳, 等.羊羔美酒大曲中乳酸菌多样性及分子鉴定[J].食品科学, 2015, 36(13):167-171.LI Y, DONG Z L, LI J, et al.Diversity and molecular biological identification of lactic acid bacteria from Yanggaomeijiu Daqu,a traditional Chinese liquor fermentation starter[J].Food Science, 2015, 36(13):167-171.
[19] 梁晨, 杜海, 徐岩.大曲贮存过程中原核微生物群落结构及风味成分演替规律[J].微生物学通报, 2017, 44(2):384-393.LIANG C, DU H, XU Y.The succession of procaryotic microbial community and the flavor components in the storage process of Daqu[J].Microbiology China, 2017, 44(2):384-393.
[20] 薄涛, 吕娜, 杨凯环, 等.白酒大曲发酵过程中微生物群落及功能研究进展[J].食品科学, 2023, 44(19):385-393.BO T, LYU N, YANG K H, et al.Recent advances in understanding the composition and functions of microbial community in the fermentation of Baijiu Daqu[J].Food Science, 2023, 44(19):385-393.
[21] 施思, 彭智辅, 乔宗伟, 等.浓香型大曲储藏过程中细菌菌群差异性分析[J].食品工业科技, 2017, 38(18):151-154;159.SHI S, PENG Z F, QIAO Z W, et al.Difference analysis of bacterial community for Luzhou-flavor Daqu during storage[J].Science and Technology of Food Industry, 2017, 38(18):151-154;159.
[22] 张建敏, 黄永光, 周文美, 等.传统白酒固态发酵过程放线菌的研究进展[J].酿酒科技, 2013(10):73-79.ZHANG J M, HUANG Y G, ZHOU W M, et al.Research advance in actinobacterial in traditional liquor solid fermentation process[J].Liquor-Making Science &Technology, 2013(10):73-79.
[23] YANG Y, WANG S T, LU Z M, et al.Metagenomics unveils microbial roles involved in metabolic network of flavor development in medium-temperature Daqu starter[J].Food Research International, 2021, 140:110037.
[24] DENG Y K, HUANG D, HAN B L, et al.Correlation:Between autochthonous microbial diversity and volatile metabolites during the fermentation of Nongxiang Daqu[J].Frontiers in Microbiology, 2021, 12:688981.
[25] 郭学武, 范恩帝, 马冰涛, 等.中国白酒中微量成分研究进展[J].食品科学, 2020, 41(11):267-276.GUO X W, FAN E D, MA B T, et al.Recent progress in micro components of Chinese Baijiu[J].Food Science, 2020, 41(11):267-276.
[26] 杨婷婷, 黄永光, 左乾程, 等.酱香白酒酿造过程糠醛及糠醇的时空分布规律及溯源分析[J].食品科学, 2025, 46(5):38-47.YANG T T, HUANG Y G, ZUO Q C, et al.Temporal and spatial distribution patterns and traceability analysis of furfural and furfuryl alcohol in the brewing process of sauce-flavor Baijiu[J].Food Science, 2025, 46(5):38-47.
[27] DETERRE S, LECLAIR C, BAI J H, et al.Chemical and sensory characterization of orange (Citrus sinensis) pulp, a by-product of orange juice processing using gas-chromatography-olfactometry[J].Journal of Food Quality, 2016, 39(6):826-838.
[28] WANG L Q, TANG P, ZHANG P J, et al.Unraveling the aroma profiling of Baijiu:Sensory characteristics of aroma compounds, analytical approaches, key odor-active compounds in different Baijiu, and their synthesis mechanisms[J].Trends in Food Science &Technology, 2024, 146:104376.
[29] MU Y, HUANG J, ZHOU R Q, et al.Comprehensive analysis for the bioturbation effect of space mutation and biofortification on strong-flavor Daqu by high-throughput sequencing, volatile analysis and metabolomics[J].Food Chemistry, 2023, 403:134440.
[30] YU Q, MOU F Y, XIAO J W, et al.Correlational analysis of physicochemical indexes, microbial communities, and volatile components in light-flavor Daqu from north and south regions of China[J].World Journal of Microbiology &Biotechnology, 2023, 40(2):54.