猪肉丸是一种富含营养与风味的中国传统肉糜凝胶制品,受到众多消费者的喜爱[1]。与其他肉糜制品相比,猪肉丸中的脂肪比例通常较高,赋予了该产品较好的风味、质地、外观等基本的感官和质量特征[2]。然而,长期摄入高含量的动物脂肪会增加肥胖、心脏病、心血管疾病等患病风险[3]。同时,在冷链过程中,不可避免的反复冻融使得高蛋白、高脂肪的猪肉丸氧化程度增加,由此对其质地、风味和整体可接受性造成负面影响[4]。据报道,冻融循环引起的冰晶大小和位置的变化会破坏凝胶结构,降低凝胶强度和持水能力[5]。作为需要深度加工的肉制品,猪肉丸在融入功能型食品配料方面具备天然优势[6]。因此,通过外源添加的方式减少脂肪含量和提升冻融稳定性对于猪肉丸的品质改善至关重要。
大豆分离蛋白(soy protein isolate, SPI)是由脱脂大豆制成的高纯度植物蛋白,具有营养价值高、生物相容性好、成本低等优势[7]。GUO等[8]研究发现微颗粒化SPI通过发挥两亲优势有效替代了食品中的部分油脂。姜黄素(curcumin, CUR)是一种从姜黄根茎中提取的天然酚类化合物,具有较强的抗氧化活性,但水溶性不佳、化学性质不稳定,在食品领域的应用受限[9]。同时值得注意的是,直接添加较高质量分数的SPI会使热诱导凝胶结构变得更为松散和无序,对凝胶特性产生负面影响[10]。此外,猪肉丸的加工和贮存环境较为复杂,可采用合适的包封方式对大豆分离蛋白与姜黄素进行微囊化处理。
相较于其他包封方式,蔗糖共结晶法更加灵活、经济和方便,在共结晶过程中,蔗糖晶体从致密状态转变为不规则的多孔结构,具有相当的孔隙和表面积用于包封芯材,所形成的固体纳米颗粒稳定性更高[11]。此外,蔗糖本身是一种性能良好的商业抗冻剂,可推测蔗糖共结晶法包封CUR-SPI复配物制成的固体颗粒具有一定的乳化、抗氧化和抗冻功能,但能否在低脂猪肉糜基质中发挥协同功效值得进一步研究。因此,本研究采用蔗糖共结晶法包埋CUR-SPI复配物,制备功能复合型蔗糖共结晶颗粒,表征其结构与功能特性,并将该固体颗粒作为代脂添加物应用于猪肉丸中,探究其对低脂猪肉丸冻融稳定性的影响,为高品质低脂肉制品的开发提供理论依据。
1 材料与方法
1.1 材料与试剂
猪后腿肉,购于合肥麦德龙超市;白砂糖,太古糖业(中国)有限公司;姜黄素(纯度>95%)、大豆分离蛋白、过硫酸钾、5,5′-二硫代双(2-硝基苯甲酸) [5,5′-dithiobis-(2-nitrobenzoic acid), DTNB]、2,4-二硝基苯肼(2,4-dinitrophenylhydrazine, DNPH)、DPPH、ABTS,上海麦克林生化科技股份有限公司;牛血清蛋白、三氯乙酸、2-硫代巴比妥酸、乙酸乙酯、盐酸胍、乙二胺四乙酸,国药集团化学试剂有限公司。
1.2 仪器与设备
DSC214差示扫描量热仪,德国耐驰仪器制造有限公司;ZEISS300扫描电子显微镜,卡尔·蔡司股份公司;NI10傅里叶变换红外吸收光谱仪,赛默飞世尔科技公司;Agilent5500原子力显微镜,安捷伦科技(中国)有限公司;Universal TA质构仪,上海腾拔仪器科技有限公司;Varioskan LUX酶标仪,赛默飞世尔科技公司;CR-400色差计,深圳市三恩时科技有限公司。
1.3 实验方法
1.3.1 功能复合型蔗糖共结晶产物制备
根据WANG等[12]方法,略作修改。将白砂糖(sucrose, SC)与蒸馏水混合后(6∶1,质量比)在容器中持续搅拌并加热至(121±2) ℃,随后关闭热源并保持搅拌状态,当糖浆中有轻微浑浊(约70 ℃)时,按照表1的配方,依次加入各个质量分数的CUR和CUR-SPI复配物,并在室温下持续搅拌,直到形成干燥的团聚体。将共结晶团聚体铺成薄层,于40 ℃对流烘箱中干燥24 h,研磨后通过200目筛网,得到粒度均匀的蔗糖共结晶产物,以未处理的SC作为对照组。
表1 功能复合型蔗糖共结晶产物及对应编号
Table 1 Functional complex sucrose co-crystallized products and corresponding number
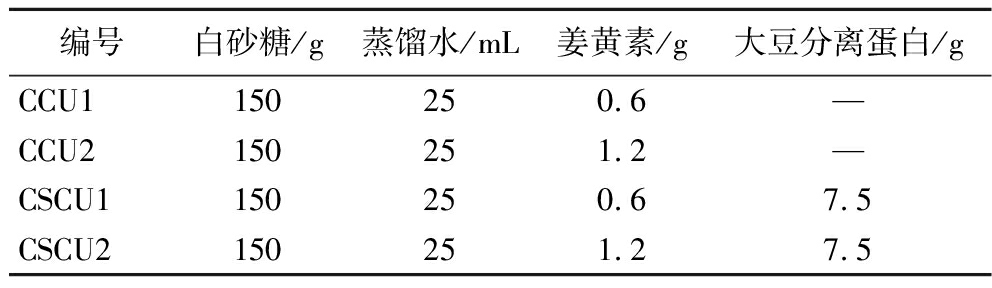
编号白砂糖/g蒸馏水/mL姜黄素/g大豆分离蛋白/gCCU1150250.6—CCU2150251.2—CSCU1150250.67.5CSCU2150251.27.5
注:CCU为单独包埋CUR的蔗糖共结晶(co-crystallized curcumin),CSCU为包埋CUR和SPI的蔗糖共结晶(co-crystallized soy protein isolate-curcumin);CCU1表示包埋0.4%姜黄素的蔗糖共结晶,CCU2表示包埋0.8%姜黄素的蔗糖共结晶,CSCU1表示包埋0.4%姜黄素和5%大豆分离蛋白的蔗糖共结晶,CSCU2表示包埋0.8%姜黄素和5%大豆分离蛋白的蔗糖共结晶。—代表未添加(下同)。
1.3.2 共结晶抗氧化能力测定
1.3.2.1 DPPH自由基清除率
参考SINGH等[13]方法,略作修改。使用无水乙醇配制25 mg/L的DPPH标准储备液,在517 nm处测定其吸光度为0.72±0.02。将1 g共结晶粉末加入9 mL去离子水中充分溶解,取50 μL样液与1.5 mL DPPH-乙醇溶液混匀,黑暗处孵育30 min后于517 nm测定吸光度,以同等质量的去离子水与DPPH-乙醇溶液的混合物为空白对照,计算如式(1)所示。
DPPH自由基清除率![]()
(1)
式中:A1,空白对照的吸光度值;A2,样品的吸光度值。
1.3.2.2 ABTS阳离子自由基清除率
将ABTS(7.0 mmol/L)和过硫酸钾(2.45 mmol/L)溶液1∶
1(体积比)混合,并在室温下避光反应12 h,然后将混合物用无水乙醇稀释,使其在734 nm处达到0.72±0.02的吸光度,以此制备ABTS储备液。将1 g共结晶粉末加入9 mL去离子水中充分溶解,取0.2 mL样液加入2 mL的ABTS储备液中,黑暗孵育30 min后在734 nm处测量样品的吸光度,以2 mL的ABTS储备液和0.2 mL乙醇溶液的混合物用作空白对照,计算如式(2)所示。
ABTS阳离子自由基清除率![]()
(2)
式中:A1,空白对照的吸光度值;A2,样品的吸光度值。
1.3.3 共结晶颗粒形貌分析
1.3.3.1 共结晶微观结构
采用扫描电子显微镜(scanning electron microscope, SEM)对蔗糖共结晶纳米产物的表观结构进行观察,将共结晶粉末粘附到观测平台上,离子溅射喷金后在5 kV加速电压下以4 000×放大倍数进行拍照分析。
1.3.3.2 共结晶表观形貌
用去离子水将所有共结晶产物的浓度调整至5 mg/mL,取10 μL样液涂抹到云母片表面,自然干燥后用原子力显微镜(atomic force microscopy, AFM)观察,悬臂梁的弹性常数0.35 N/m,扫描频率1.0 Hz,分辨率512×512像素。
1.3.4 共结晶热力学性质分析
参考孙雪等[14]方法,将3~5 mg共结晶样品放在密封的铝坩锅中,以空坩锅作为参照,设定差示扫描量热仪(differential scanning calorimeter, DSC)的氮气流速40 mL/min,以10 ℃/min的速率将样品从25 ℃加热至250 ℃。
1.3.5 红外光谱分析
利用傅立叶变换红外光谱耦合金刚石晶体的衰减全反射来确定共结晶产物的红外光谱图,在室温下以400至4 000 cm-1的频率范围内对样品进行分析,分辨率为4 cm-1。
1.3.6 猪肉丸制备及冻融处理
去除猪后腿肉可见结缔组织与肉皮,将瘦肉与肥肉分开,过绞肉机4 mm孔板后分别制成瘦肉糜与肥肉糜,具体配方如表2所示,将所有配料依次混合置于料理机中搅拌3 min,始终保持肉糜中心温度在10 ℃以下,将猪肉糜制成直径2 cm的丸子坯,于50 ℃水浴定型5 min后再放入90 ℃水浴中煮制15 min,冷却至室温。将制备后的猪肉丸样品放置于-20 ℃冷冻48 h后取出,在室温完全解冻4 h为1次冻融循环,依次进行5次循环,以未经冻融的样品为对照。
表2 实验添加组及对应编号 单位:g
Table 2 Experimental addition group and corresponding number
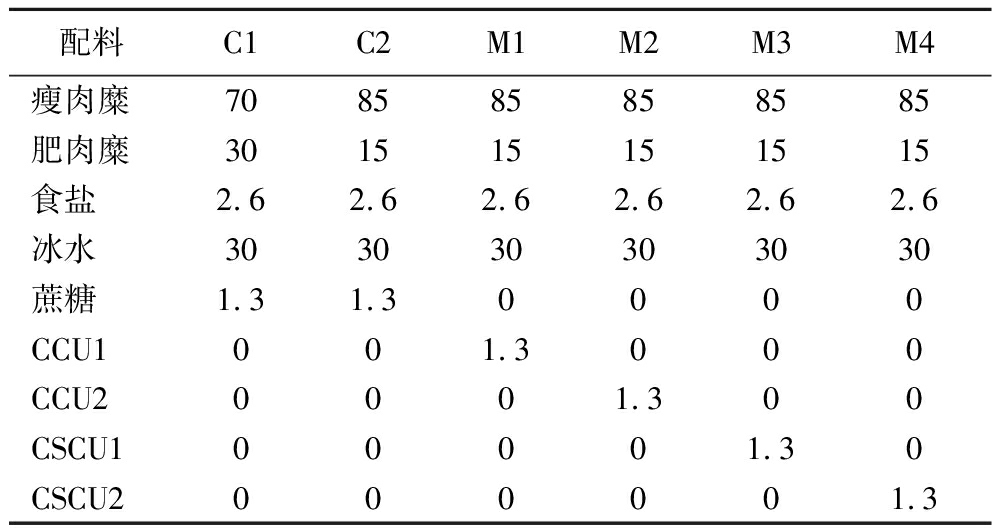
配料C1C2M1M2M3M4瘦肉糜708585858585肥肉糜301515151515食盐2.62.62.62.62.62.6冰水303030303030蔗糖1.31.30000CCU1001.3000CCU20001.300CSCU100001.30CSCU2000001.3
注:C1表示常规脂猪肉丸,C2表示低脂猪肉丸,M1表示添加CCU1的低脂猪肉丸,M2表示添加CCU2的低脂猪肉丸,M3表示添加CSCU1的低脂猪肉丸,M4表示添加CSCU2的低脂猪肉丸(下同)。
1.3.7 猪肉丸色泽测定
采用色差计测量猪肉丸内部至少3个不同区域的亮度(L*)、红度(a*)和黄度(b*)值。
1.3.8 猪肉丸质构特性测定
将猪肉丸切成1.5 cm×1.5 cm×1.5 cm规格的块,并用质构仪的全质构分析(texture profile analysis, TPA)模式进行测定,选用P/35探头,设定测前速度1.0 mm/s,测试速度为1.0 mm/s,触发力为5 g,测试间隔为5 s,形变量50%,每个样品至少重复测定3~6次。
1.3.9 猪肉丸持水力测定
称取切碎后的猪肉丸并称重(w1),用滤纸包好后离心10 min(8 000 r/min,4 ℃),取出称重(w2),计算如公式(3)所示:
持水力![]()
(3)
式中:w1为样品初始质量;w2为离心后样品质量。
1.3.10 猪肉丸显微结构分析
将猪肉丸样品切割成规格为2 mm×2 mm×3 mm的肉丁,质量分数2.5%戊二醛固定后分别进行乙醇梯度脱水和石蜡包埋,组织切片后采用苏木精-伊红染色法进行染色处理,利用光学显微镜在放大200倍条件下观察,拍照。
1.3.11 肌肉氧化程度测定
1.3.11.1 羰基含量测定
通过DNPH法评估猪肉丸的羰基含量,首先称取1 g粉碎的猪肉丸样品浸入10 mL磷酸盐缓冲液(20 mmol/L K2HPO4,0.6 mol/L KCl,pH 6.0)中,15 000 r/min匀浆3 min后取1 mL的样液与1 mL DNPH混合,将混合物置于黑暗中孵育1 h,每隔15 min振动1次,随后加入1 mL三氯乙酸(20 g/L)反应5 min,将混合物离心(10 000 r/min,4 ℃,10 min),去除上清液后用乙醇/乙酸乙酯溶液(1∶1,体积比)洗涤沉淀,并加入3 mL盐酸胍(6 mol/mL)进行溶解。最后将混合物离心(10 000 r/min,4 ℃,10 min)取上清液,在370 nm处测量上清液的吸光度,使用摩尔消光系数22 000 mol/(L·cm)计算羰基含量。
1.3.11.2 总巯基含量测定
称取1 g粉碎的猪肉丸样品与20 mL磷酸盐缓冲液(8 mol/L尿素、0.6 mol/L氯化钠、6 mmol/L EDTA,pH 7.2)混合进行冰浴匀浆,将4 mL混合样液添加到0.5 mL缓冲液(10 mmol/L DTNB和0.2 mol/L Tris-HCl,pH 8.0)中,充分混匀并在40 ℃下孵育25 min,随后冷却至室温并测定其在412 nm处的吸光度,使用摩尔消光系数13 600 mol/(L·cm)计算总巯基含量。
1.3.11.3 脂质过氧化值测定
根据LI等[15]方法,略作修改,以测定硫代巴比妥酸反应物(thiobarbituric acid reactive substances, TBARS)来表征猪肉丸的脂质过氧化值。取5 g粉碎的猪肉丸样品与25 mL含有75 g/ L三氯乙酸和1 g/L乙二胺四乙酸的溶液混合,均质60 s后离心10 min(8 000 r/min,4 ℃),取5 mL上清液与5 mL 2-硫代巴比妥酸溶液(0.02 mol/L)混合,在沸水浴中煮40 min 后向混合物中加入5 mL三氯甲烷,充分摇匀后静置分层,分别测定上层清液在532 nm和600 nm处的吸光值,计算如公式(4)所示:
(4)
1.4 数据处理
所有实验均至少重复3次,结果以“平均值±标准差”表示。使用IBM SPSS 26软件进行单因素方差分析和Duncan多范围检验(P<0.05为显著差异水平),采用Origin 2021软件进行作图。
2 结果与分析
2.1 共结晶抗氧化活性
图1显示了不同蔗糖共结晶产物的DPPH自由基和ABTS阳离子自由基清除率,与对照组SC相比,包埋CUR后的共结晶蔗糖均表现出显著的抗氧化活性,且自由基清除率随着CUR在共结晶体系中质量分数的提高而有所增加,这主要与CUR丰富的酚羟基有关[16]。值得注意的是,在相同质量分数CUR的添加量下,CSCU的DPPH自由基和ABTS阳离子自由基清除率均显著高于CCU(P<0.05),表明包埋CUR-SPI的蔗糖共结晶抗氧化效果显著优于单一的CUR共结晶,这可能由于SPI本身含有一些氨基酸和肽段也具有一定的抗氧化能力,能够与CUR产生协同抗氧化效应。
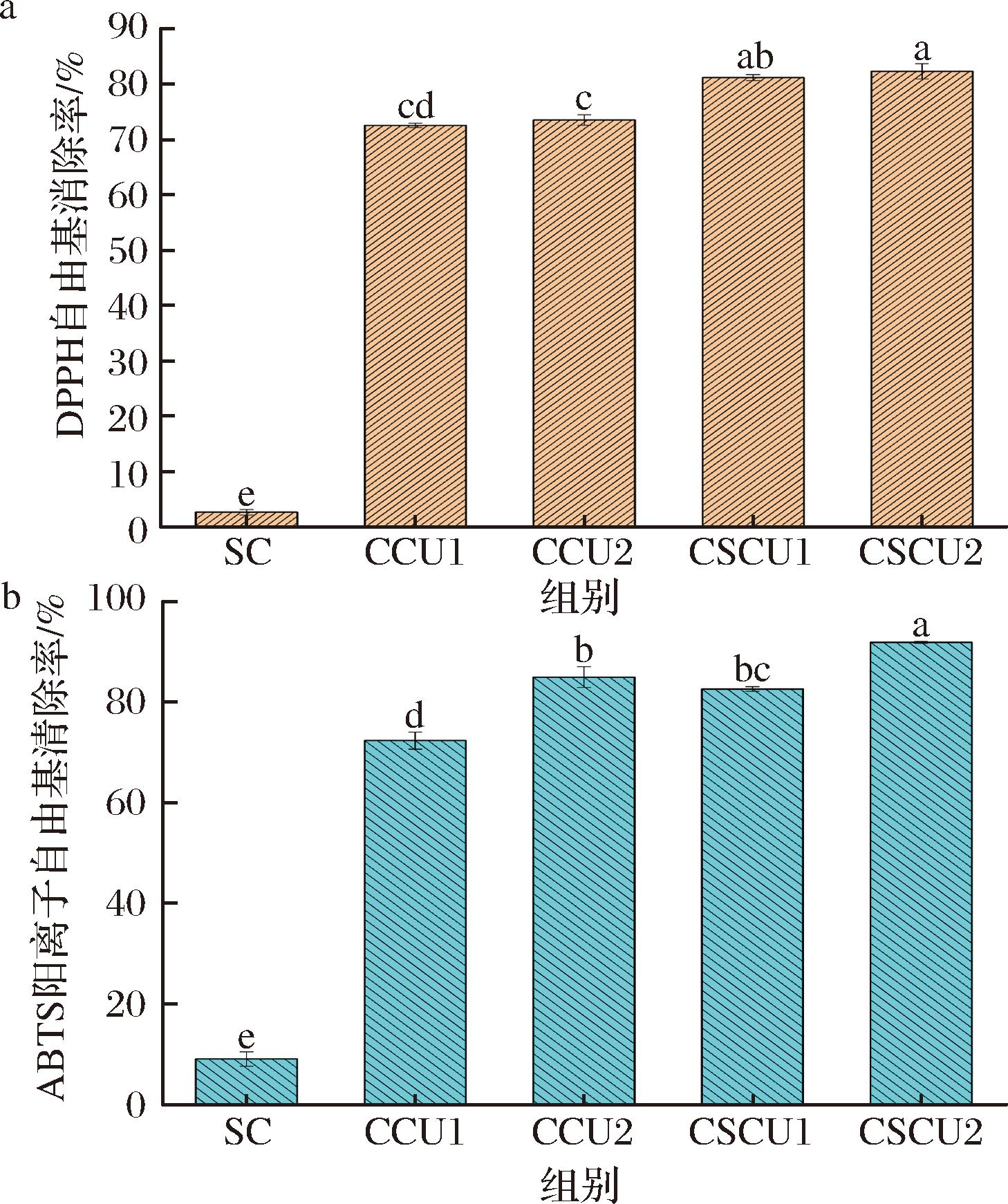
a-DPPH自由基清除率;b-ABTS阳离子自由基清除率
图1 功能复合型蔗糖共结晶的抗氧化活性
Fig.1 Antioxidant activity of functional composite co-crystallized sucrose
注:SC表示蔗糖,CCU1表示包埋质量分数0.4%姜黄素的蔗糖共结晶,CCU2表示包埋质量分数0.8%姜黄素的蔗糖共结晶,CSCU1表示包埋质量分数0.4%姜黄素和5%大豆分离蛋白的蔗糖共结晶,CSCU2包埋质量分数0.8%姜黄素和5%大豆分离蛋白的蔗糖共结晶。不同字母表示组间差异显著(P<0.05)(下同)。
2.2 共结晶热力学性质
通过DSC表征共结晶过程中壁材和芯材之间可能发生的相互作用及热稳定性的变化。如图2所示, SC在189.5 ℃时出现吸热峰,这对应蔗糖的熔融温度。在包封芯材后,DSC图谱中未观察到CUR和SPI的熔融峰,且未出现二阶相变,表明蔗糖共结晶法能够极大程度地提高了活性化合物的热稳定性,并保持了蔗糖的晶体结构,这与WANG等[12]的研究结果相似。此外,CSCU的熔融温度大于191 ℃,显著高于CCU与SC,表现出更高的热稳定性,这可能与SC-SPI-CUR的复杂相互作用网络的形成有关,由此极大地稳定了共晶体的结构,使其需要更高的能量才能被破坏。
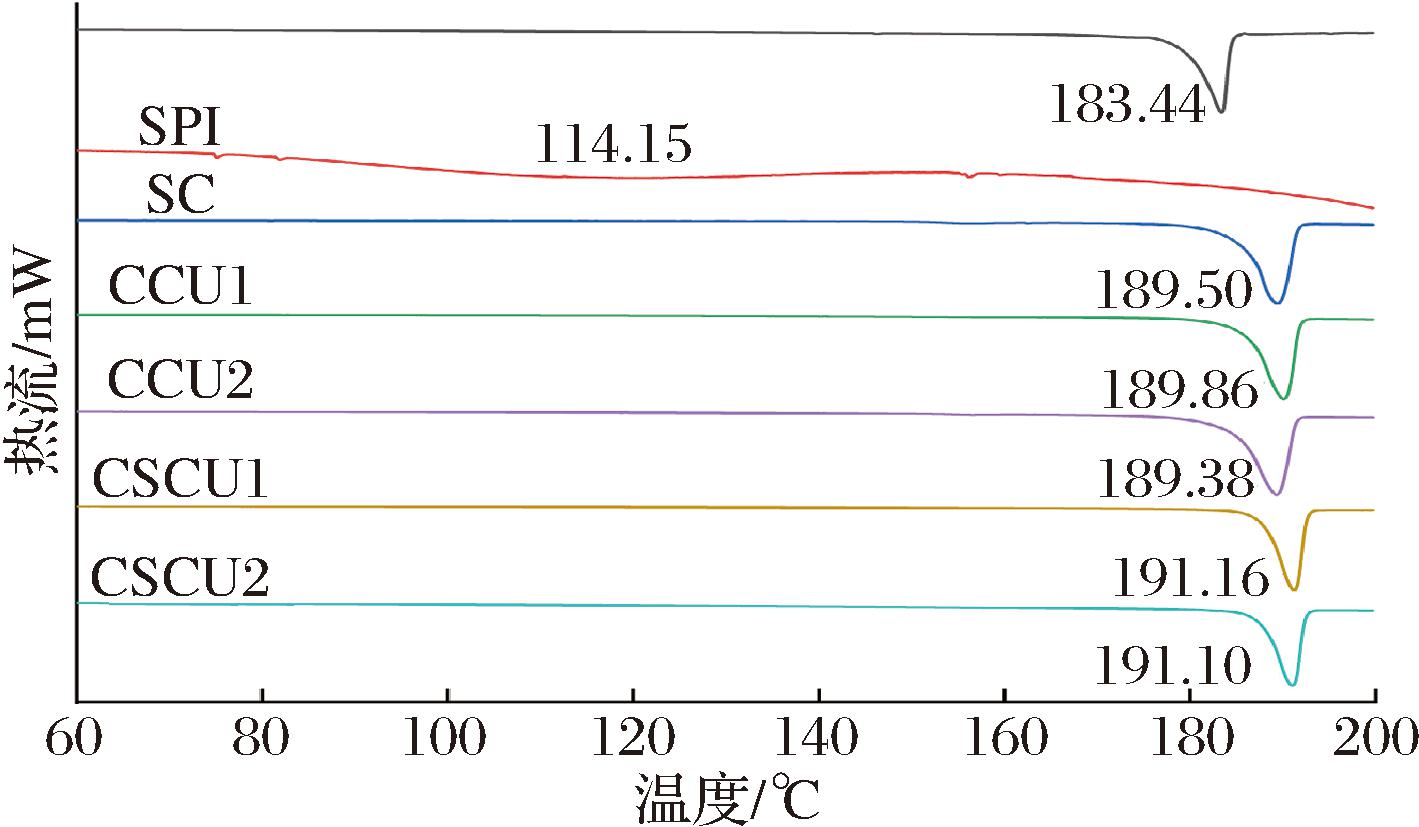
图2 功能复合型蔗糖共结晶的热稳定性
Fig.2 Thermal stability of functional composite co-crystallized sucrose
2.3 共结晶红外光谱
利用红外光谱表征共结晶产物分子间互作和化学结构的变化。如图3所示,SC在3 559.95 cm-1和3 382.53 cm-1处形成强而尖锐的峰,这主要表示蔗糖晶体分子间和分子内羟基(O—H)引起的伸缩振动;CUR的特征峰则包括3 507.89 cm-1处由酚羟基(O—H)和1 506.13 cm-1处由姜黄素苯环(C![]() C)引起的伸缩振动峰;SPI在3 270.68 cm-1处出现较宽的峰,主要代表酰胺A带(N—H)和O—H的伸缩振动峰,表明SPI中存在较强的氢键网络[18]。值得注意的是,所有共结晶样品的特征官能团带与蔗糖分子一致,并未观察到CUR与SPI的特征峰,表明CUR与SPI已被成功包裹在蔗糖共结晶体系中,且共结晶过程并没有改变被蔗糖包埋的CUR和SPI的化学结构,这与L
C)引起的伸缩振动峰;SPI在3 270.68 cm-1处出现较宽的峰,主要代表酰胺A带(N—H)和O—H的伸缩振动峰,表明SPI中存在较强的氢键网络[18]。值得注意的是,所有共结晶样品的特征官能团带与蔗糖分子一致,并未观察到CUR与SPI的特征峰,表明CUR与SPI已被成功包裹在蔗糖共结晶体系中,且共结晶过程并没有改变被蔗糖包埋的CUR和SPI的化学结构,这与L PEZ-C
PEZ-C RDOBA等[19]的研究结果类似。
RDOBA等[19]的研究结果类似。
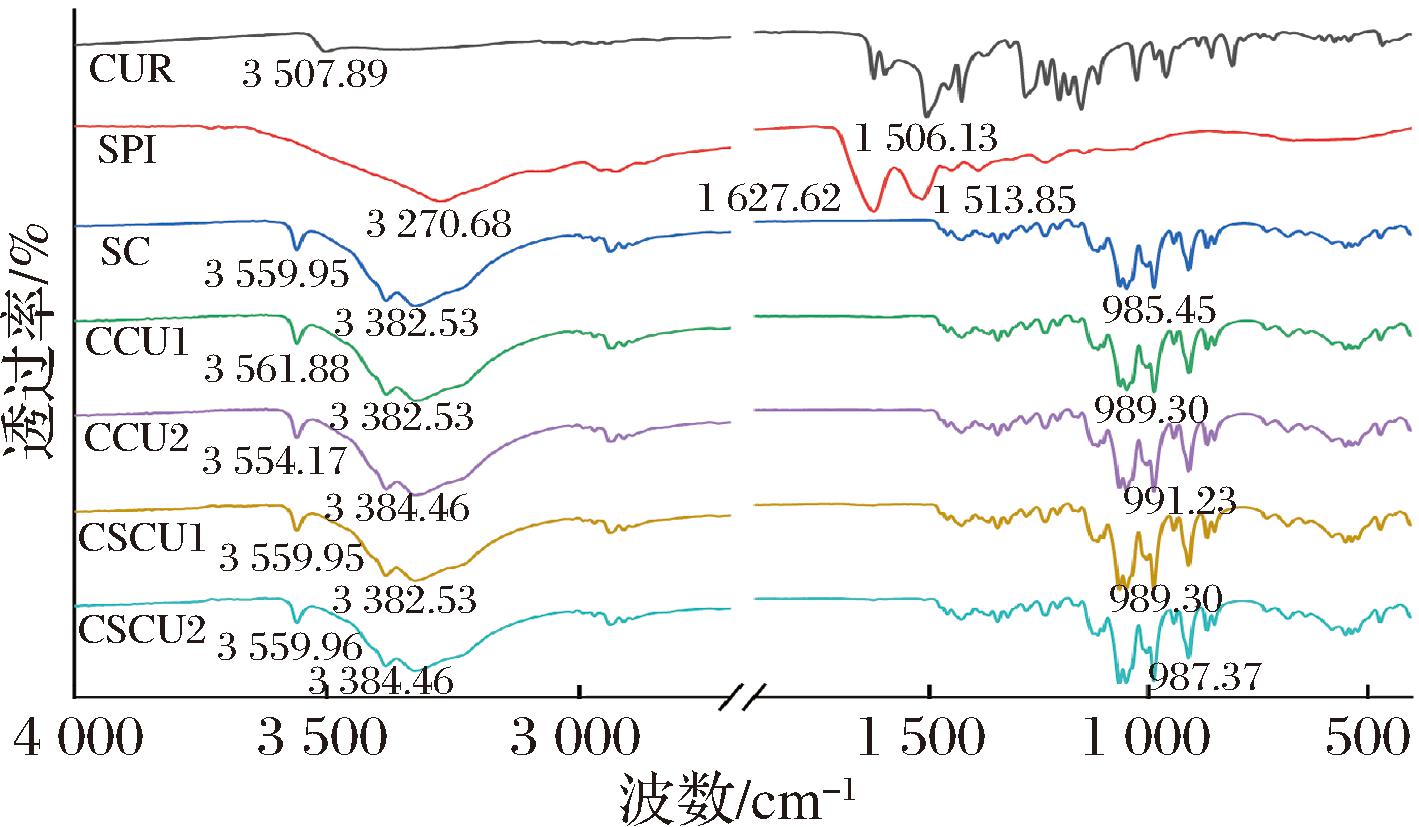
图3 功能复合型蔗糖共结晶的红外光谱
Fig.3 Infrared spectrum of functional composite co-crystallized sucrose
2.4 共结晶颗粒形貌
2.4.1 微观结构
由图4可知,相较于SPI与SC,纯CUR的粒度较小,而SPI呈典型的球状分布,SC则呈现相对大且规则的晶体结构,表面光滑、棱角清晰。与SC相比,包埋芯材后的蔗糖共结晶粒度变小,并呈现粗糙的簇状团块、更多的孔洞和不整齐的边缘,这可能由于疏水性CUR的加入干扰了重结晶蔗糖分子的规则排列和水合过程,导致形成的晶体尺寸变小,而CUR则以不规则包埋物的形式存在于重结晶蔗糖晶体表面或内部,且随着CUR质量分数的升高而分布得更加均匀,证实了采用蔗糖共结晶法包封CUR的可行性,与CHEZANOGLOU等[20]的研究结果相似。此外,与CCU相比,CSCU的晶体尺寸均一性更佳,主要因为两亲性的SPI作为乳化剂和稳定剂,显著提高了CUR在蔗糖共结晶体系中的分散性和稳定性,这也进一步解释了CSCU样品组较高的抗氧化活性与热稳定性的重要原因。

图4 功能复合型蔗糖共结晶的扫描电镜图(4 000×)
Fig.4 SEM image of functional composite co-crystallized sucrose (4 000×)
2.4.2 表观形貌
利用AFM对不同功能复合型蔗糖共结晶的表观形貌进行定量表征。如图5所示,表面粗糙度(Rq)是AFM的重要指标,SPI的Rq值为27.793 nm,显著高于其他样品组,这与其高分子质量和复杂的分子构象有关。芯材及其质量分数对共结晶产物的表面特性具有显著影响,其中CCU2的Rq值高达10.667 nm,这可能与高浓度的疏水性CUR无法在重结晶蔗糖基质中完全均匀分散,从而形成纳米聚集体或颗粒突出于晶体表面有关。
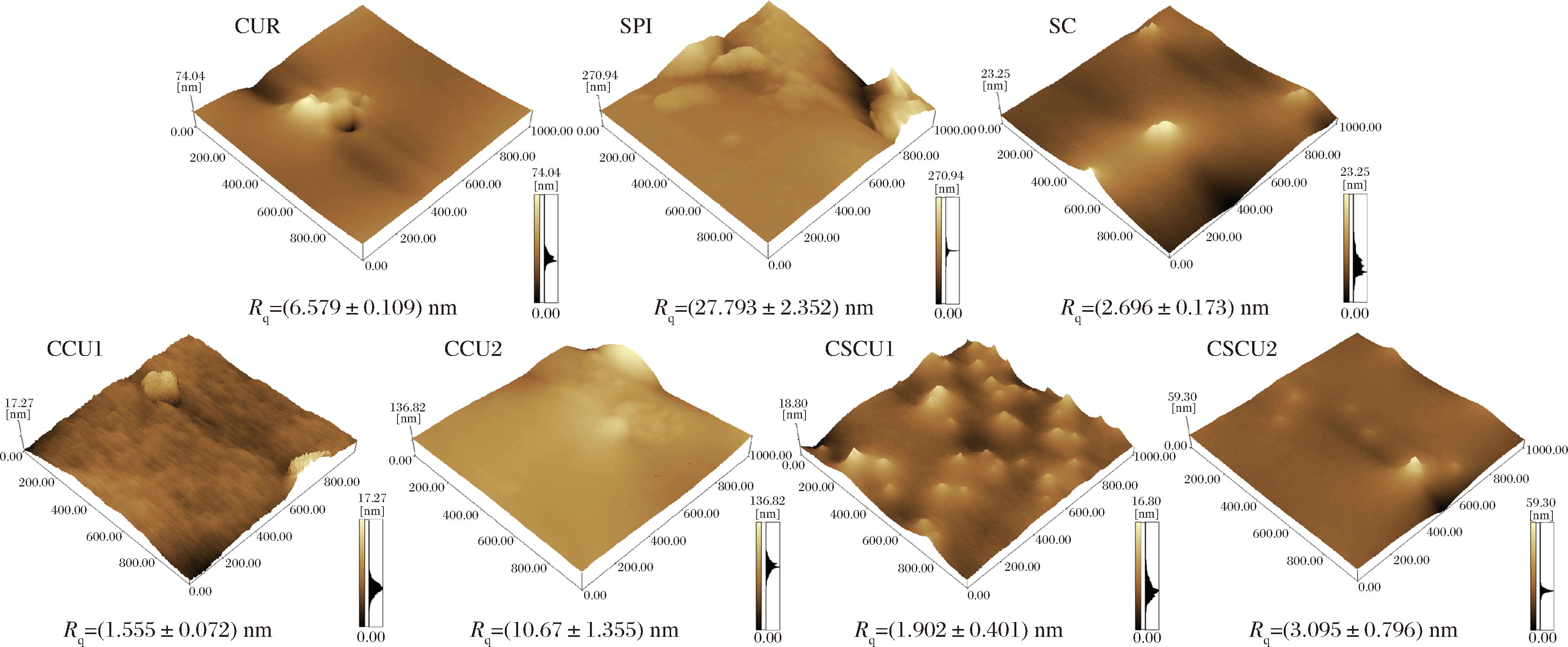
图5 功能复合型蔗糖共结晶的原子力显微镜图(4 000×)
Fig.5 AFM image of functional composite co-crystallized sucrose (4 000×)
而对CUR-SPI复配物进行共结晶处理,能有效维持且仅轻微增加共结晶产物的Rq值,表明即使在较高质量分数CUR添加下,SPI的存在能够提升共结晶的表面平整度。已有研究显示,较低的表面粗糙度与材料的功能特性强相关[21],这与抗氧化活性、DSC、SEM的结果相互印证。
2.5 猪肉丸的持水力与色泽
由表3可知,与未冻融处理组相比,经过5次冻融循环后各样品的持水力均明显降低(P<0.05),其中C2的降幅最为明显(82.51%),这主要与直接减脂导致的凝胶乳化不充分有关。而CSCU添加组(M3、M4)在冻融循环前后的持水力始终显著高于其他样品组(P<0.05),表明多组分共结晶产物可能通过更多的氢键结合水分,并较好地抑制了冻融过程中猪肉丸内部的冰晶生长,减少肌纤维结构的破坏。C1和C2在冻融后的亮度(L*)值显著增加(P<0.05),主要与冰晶挤压肌纤维导致内部水分析出附着于样品表面增加光散射有关[22]。而添加蔗糖共结晶能有效维持M1~M4在冻融过程中的L*值,这与持水力的结果一致。
表3 功能复合型蔗糖共结晶的添加与反复冻融对低脂猪肉丸持水力与色泽的影响
Table 3 Effect of incorporating functional composite co-crystallized sucrose and repeated freeze-thaw cycles on the color and water-holding capacity of low-fat pork meatballs
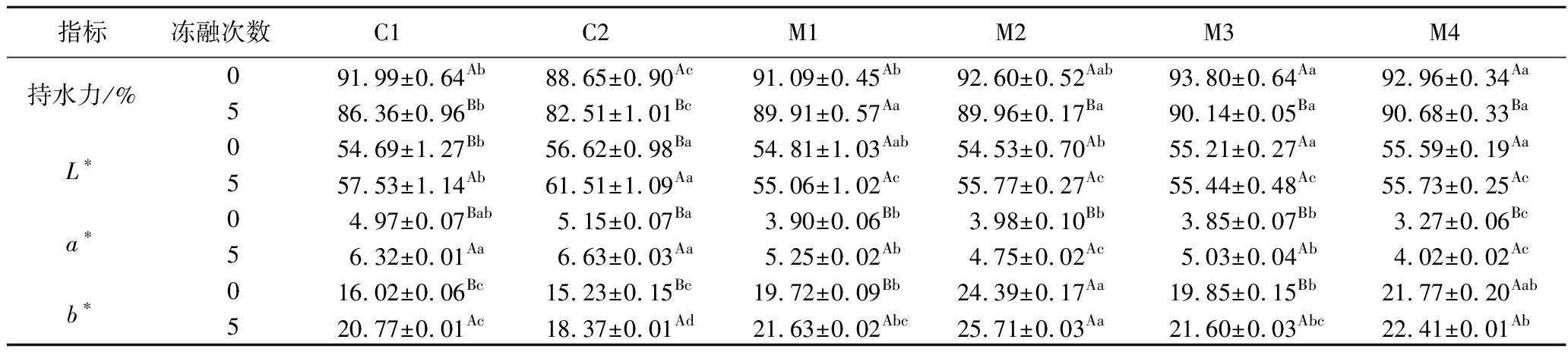
指标冻融次数C1C2M1M2M3M4持水力/%091.99±0.64Ab88.65±0.90Ac91.09±0.45Ab92.60±0.52Aab93.80±0.64Aa92.96±0.34Aa586.36±0.96Bb82.51±1.01Bc89.91±0.57Aa89.96±0.17Ba90.14±0.05Ba90.68±0.33BaL∗054.69±1.27Bb56.62±0.98Ba54.81±1.03Aab54.53±0.70Ab55.21±0.27Aa55.59±0.19Aa557.53±1.14Ab61.51±1.09Aa55.06±1.02Ac55.77±0.27Ac55.44±0.48Ac55.73±0.25Aca∗04.97±0.07Bab5.15±0.07Ba3.90±0.06Bb3.98±0.10Bb3.85±0.07Bb3.27±0.06Bc56.32±0.01Aa6.63±0.03Aa5.25±0.02Ab4.75±0.02Ac5.03±0.04Ab4.02±0.02Acb∗016.02±0.06Bc15.23±0.15Bc19.72±0.09Bb24.39±0.17Aa19.85±0.15Bb21.77±0.20Aab520.77±0.01Ac18.37±0.01Ad21.63±0.02Abc25.71±0.03Aa21.60±0.03Abc22.41±0.01Ab
注:对于同一指标,同列标注大写字母不同者表示不同冻融次数的样品差异显著(P<0.05),同行标注小写字母不同者表示各样品组间差异显著(P<0.05)。
反复冻融会导致肌红蛋白氧化为高铁肌红蛋白,表观红度增加,而M4组在冻融前后的红度(a*)值均保持最低值。同时,M3、M4组的b*值在冻融前后相对稳定,这可能由于CSCU体系较为稳定,能够在冻融过程中通过缓释CUR来减轻低脂猪肉丸的氧化反应。
2.6 猪肉丸的质构特性
不同添加组低脂猪肉丸质构特性的变化如图6所示,所有样品的硬度、弹性、咀嚼性等参数均显著受到共结晶添加、冻融次数及其交互作用的影响(P<0.05),而功能复合型蔗糖共结晶的添加显著改善了低脂猪肉丸反复冻融后的质构稳定性。冻融前,与C2相比,添加CSCU2的低脂猪肉丸(M4)硬度、弹性、咀嚼性分别提升了42.0%、30.7%和32.2%,其质构特性与常规脂猪肉丸(C1)无显著差异(P>0.05),可能归因于SPI在肌纤维间隙形成的弹性水合网络,以及姜黄素通过疏水相互作用增强蛋白基质内聚性,弥补了减脂后因乳化不充分导致的凝胶网络结构弱化。经过5次冻融后,M4仍维持较高的硬度、弹性和咀嚼性,且显著优于其他样品组(P<0.05),这可能由于CSCU2共结晶在冻融过程中缓慢释放功能成分,通过抑制氧化与减少冰晶生长来降低凝胶网络的机械损伤。
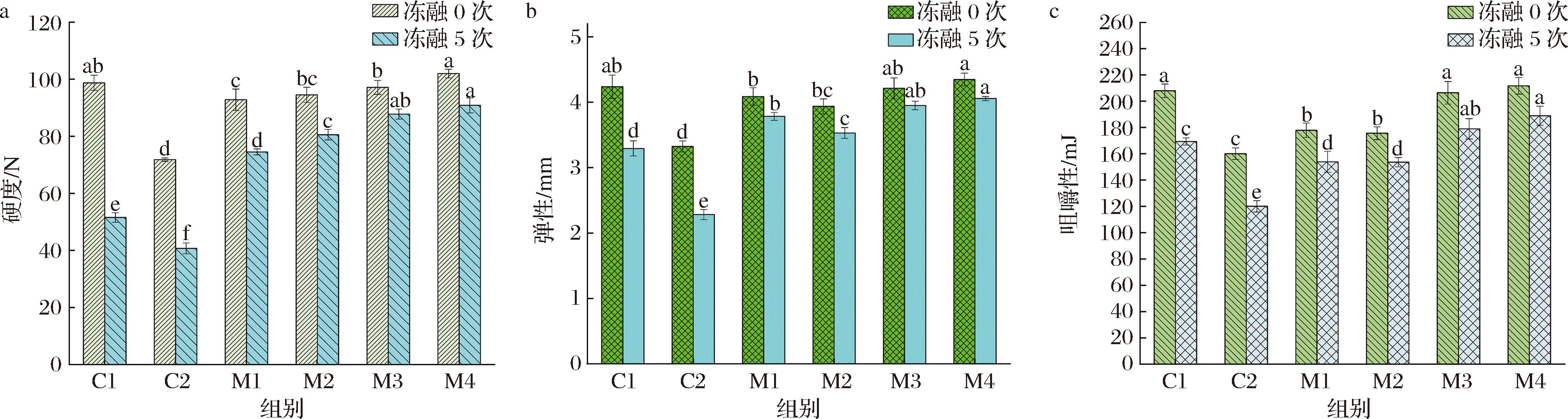
a-硬度;b-弹性;c-咀嚼性
图6 功能复合型蔗糖共结晶的添加与反复冻融对低脂猪肉丸质构特性的影响
Fig.6 Effect of incorporating functional composite co-crystallized sucrose and repeated freeze-thaw cycles on textural properties of low-fat pork meatballs
注:C1表示常规脂猪肉丸,C2表示低脂猪肉丸,M1表示添加CCU1的低脂猪肉丸,M2表示添加CCU2的低脂猪肉丸,M3表示添加CSCU1的低脂猪肉丸,M4表示添加CSCU2的低脂猪肉丸。各组间字母不同者表示差异显著(P<0.05)(下同)。
2.7 猪肉丸的微观结构
由图7-a可知,在冻融前,C1呈现较为致密的凝胶网络结构,肌纤维间隙被脂肪球均匀填充,而C2则显示出明显的肌纤维间隙增大和结构松散,并出现较大的滴水通道,印证了脂肪缺失导致的凝胶基质缺陷。添加功能型蔗糖共结晶能够有效改善低脂猪肉丸的结构完整性,其中CSCU2添加组(M4)的肌纤维排列最紧密,这可能归因于SPI在肌纤维间隙形成连续水合凝胶层,并通过姜黄素增强了蛋白-蛋白的交联程度。经5次冻融后(图7-b),C1和C2的肌纤维出现断裂,且孔洞扩大,形成了较多的滴水通道,其中C2最明显,这主要与于冰晶生长引起的机械损伤有关,与持水力和质构特性的结果对应。此外,M4组仍保持相对完整的凝胶网络结构,这进一步表明了具有多重功能组分的蔗糖共结晶乳化、抗氧化和抗冻的协同性能。

a-冻融0次;b-反复冻融5次
图7 功能复合型蔗糖共结晶的添加与反复冻融对低脂猪肉丸微观结构的影响(200×)
Fig.7 Effect of incorporating functional composite co-crystallized sucrose and repeated freeze-thaw cycles on textural properties of low-fat pork meatballs (200×)
2.8 猪肉丸的氧化特性
羰基和巯基含量是评价肉类蛋白氧化的重要指标[23],由图8-a可知,所有样品的羰基含量在冻融后均有一定程度的升高,其中C1的升幅最大,C2次之,而添加功能型蔗糖共结晶对减少羰基的形成具有积极作用,主要归因于共结晶中的酚类化合物能够有效抑制羰基的生成,与TURGUT等[24]研究一致。图8-b显示在未添加蔗糖共结晶的情况下,C1和C2的总巯基含量在5次冻融后降到较低值,主要由于冰晶的反复生长导致了促氧化因子的形成,使得含硫氨基酸受到氧化[25]。冻融后,M3和M4的总巯基含量仍处于较高值,两者无显著差异(P>0.05),表明CSCU的添加可较好地抑制冰晶生长,从而抑制巯基的冷冻氧化产生二硫键。猪肉丸TBARS含量的变化趋势与羰基结果较为一致(图8-c),由于脂肪含量较高,冻融后C1的TBARS值显著高于其他样品组(P<0.05),而添加CSCU后,M3和M4的TBARS值升幅较小,显示出较低的脂质氧化率。综合看来,与直接减脂和添加CCU相比,CSCU的添加能更好地抑制低脂猪肉丸在冻融过程中的氧化反应。
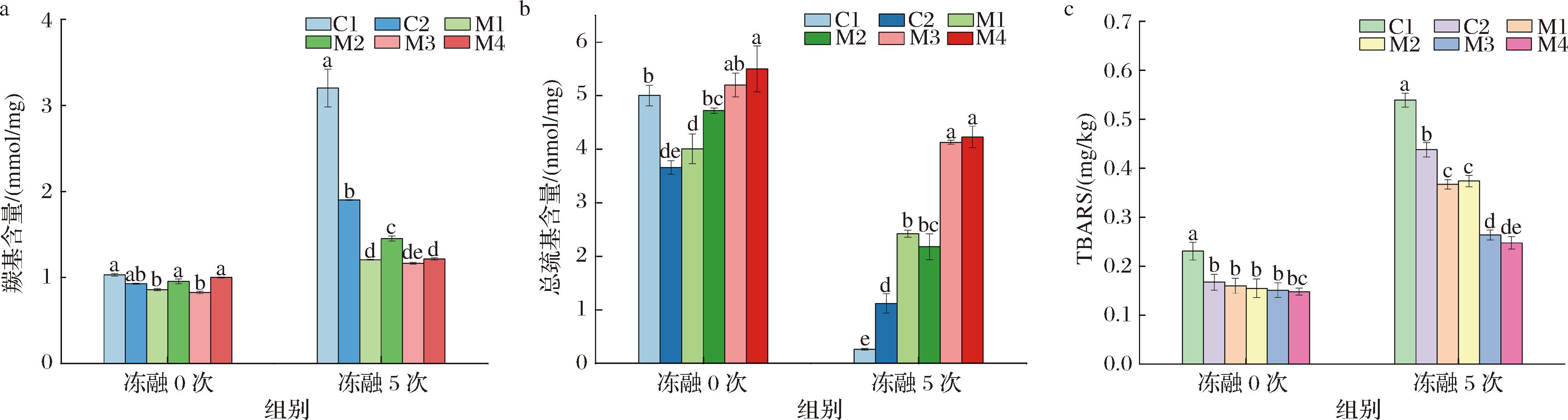
a-羰基含量;b-总巯基含量;c-脂质过氧化值
图8 功能复合型蔗糖共结晶的添加与反复冻融对低脂猪肉丸氧化特性的影响
Fig.8 Effect of incorporating functional composite co-crystallized sucrose and repeated freeze-thaw cycles on oxidation properties of low-fat pork meatballs
3 结论
本研究采用蔗糖共结晶法包埋不同质量分数的CUR与CUR-SPI复配物,制备了功能复合型蔗糖共结晶颗粒。结果显示,所有共结晶产物的红外光谱特征官能团带与蔗糖分子一致,并未观察到CUR与SPI的特征峰,表明CUR与SPI已被成功包裹在蔗糖共结晶体系中。此外,SEM和AFM结果显示,SPI的存在明显提高了CUR在蔗糖共结晶体系中的分散性和稳定性,使得包埋CUR-SPI的蔗糖共结晶抗氧化效果显著优于单一的CUR共结晶,并表现出更高的热稳定性。进一步将蔗糖共结晶产物作为代脂添加物应用于猪肉丸中,结果显示与直接减脂和添加CCU相比,CSCU通过发挥乳化、抗氧化和抗冻的协同性能,使得低脂猪肉丸在冻融过程中仍保持较为完整的凝胶网络结构,并减少了氧化反应,由此显著提升了低脂猪肉丸的持水力和质构稳定性。
[1] ZHANG R Z, LIU J B, CAO S J, et al. Tailoring an egg white protein double network emulsion gel as a novel fat substitute for improving freeze-thaw stability of minced meat gel[J]. Food Hydrocolloids, 2024, 150:109763.
[2] GUO J X, CUI L J, MENG Z. Oleogels/emulsion gels as novel saturated fat replacers in meat products: A review[J]. Food Hydrocolloids, 2023, 137:108313.
[3] SYAN V, KAUR J, SHARMA K, et al. An overview on the types, applications and health implications of fat replacers[J]. Journal of Food Science and Technology, 2024, 61(1):27-38.
[4] WAN Z C, WEI R, YANG M Y, et al. Mechanism of brittleness deterioration of pork meatballs induced by freeze-thaw cycles based on ice crystals and molecular conformation[J]. Food Research International, 2025, 202:115711.
[5] DING Y X, FENG R N, ZHU Z F, et al. Effects of different protein cross-linking degrees on physicochemical and subsequent thermal gelling properties of silver carp myofibrillar proteins Sol subjected to freeze-thaw cycles[J]. Food Chemistry: X, 2024, 22:101448.
[6] 郑雪珂, 陈晖, 刘海波, 等. 不同脂肪替代品对猪肉丸品质及消化特性的影响[J]. 肉类研究, 2024, 38(1):19-27.ZHENG X K, CHEN H, LIU H B, et al. Effects of different fat replacers on eating quality and digestive characteristics of pork meatballs[J]. Meat Research, 2024, 38(1):19-27.
[7] NISHINARI K, FANG Y, GUO S, et al. Soy proteins: A review on composition, aggregation and emulsification[J]. Food Hydrocolloids, 2014, 39:301-318.
[8] GUO J, ZHOU Q, LIU Y C, et al. Preparation of soy protein-based microgel particles using a hydrogel homogenizing strategy and their interfacial properties[J]. Food Hydrocolloids, 2016, 58:324-334.
[9] ZOROFCHIAN MOGHADAMTOUSI S, ABDUL KADIR H, HASSANDARVISH P, et al. A review on antibacterial, antiviral, and antifungal activity of curcumin[J]. BioMed Research International, 2014, 2014(1):186864.
[10] ZHAO X X, SUN X K, LAI B C, et al. Insighting the effect of lard-based diacylglycerol on the thermal gelation and rheological properties of myofibrillar protein influenced by soy protein isolate[J]. Food Hydrocolloids, 2024, 154:110082.
[11] KAUR P, ELSAYED A, SUBRAMANIAN J, et al. Encapsulation of carotenoids with sucrose by co-crystallization: Physicochemical properties, characterization and thermal stability of pigments[J]. LWT, 2021, 140:110810.
[12] WANG H P, GAO S M, ZHANG D, et al. Encapsulation of catechin or curcumin in co-crystallized sucrose: Fabrication, characterization and application in beef meatballs[J]. LWT, 2022, 168:113911.
[13] SINGH A, SABALLY K, KUBOW S, et al. Microwave-assisted extraction of phenolic antioxidants from potato peels[J]. Molecules, 2011, 16(3):2218-2232.
[14] 孙雪, 李新萍, 陈成, 等. 改性甘蔗渣微晶纤维素特性及其对明胶膜性能的影响[J]. 食品与发酵工业, 2023, 49(13):183-190.SUN X, LI X P, CHEN C, et al. Preparation and properties of modified bagasse microcrystalline cellulose/gelatin membrane[J]. Food and Fermentation Industries, 2023, 49(13):183-190.
[15] LI N, ZHANG M H, LI P P, et al. Effects of the trehalose and star anise extract on the water retention of pork meatballs and the functional structure of myofibrillar protein[J]. Journal of the Science of Food and Agriculture, 2025, 105(8):4412-4421.
[16] 秦娟娟, 杨敏, 陈欣, 等. 姜黄素与酪蛋白-海藻酸钠相互作用及复合物性质研究[J]. 食品与发酵工业, 2025, 51(12):132-142.QIN J J, YANG M, CHEN X, et al. Interaction between curcumin and casein-sodium alginate and properties of their complexes[J]. Food and Fermentation Industries, 2025, 51(12):132-142.
[17] RAI K, CHHANWAL N, SHAH N N, et al. Encapsulation of ginger oleoresin in co-crystallized sucrose: Development, characterization and storage stability[J]. Food &Function, 2021, 12(17):7964-7974.
[18] LI L, YAO P. High dispersity, stability and bioaccessibility of curcumin by assembling with deamidated zein peptide[J]. Food Chemistry, 2020, 319:126577.
[19] L PEZ-C
PEZ-C RDOBA A, GALLO L, BUCAL
RDOBA A, GALLO L, BUCAL V, et al. Co-crystallization of zinc sulfate with sucrose: A promissory strategy to render zinc solid dosage forms more palatable[J]. Journal of Food Engineering, 2016, 170:100-107.
V, et al. Co-crystallization of zinc sulfate with sucrose: A promissory strategy to render zinc solid dosage forms more palatable[J]. Journal of Food Engineering, 2016, 170:100-107.
[20] CHEZANOGLOU E, GOULA A M. Properties and stability of encapsulated pomegranate peel extract prepared by co-crystallization[J]. Applied Sciences, 2023, 13(15):8680.
[21] 闵聪. 亚麻籽蛋白-绿豆淀粉复合凝胶的形成机制及其质构分级变化规律的研究[D]. 西安: 陕西科技大学, 2023.MIN C. Fabrication and molecular insight of flaxseed protein-mung bean starch composite gels varing in texture classification[D]. Xi’an: Shaanxi University of Science &Technology, 2023.
[22] ZHANG X T, YU P J, YAN J Y, et al. Effects of whey peptides on the quality of pork ball preprepared dishes during repeated freezing-thawing[J]. Foods, 2023, 12(19):3597.
[23] NISHAD J, KOLEY T K, VARGHESE E, et al. Synergistic effects of nutmeg and citrus peel extracts in imparting oxidative stability in meat balls[J]. Food Research International, 2018, 106:1026-1036.
[24] TURGUT S S, SOYER A, I
 KÇ
KÇ F. Effect of pomegranate peel extract on lipid and protein oxidation in beef meatballs during refrigerated storage[J]. Meat Science, 2016, 116:126-132.
F. Effect of pomegranate peel extract on lipid and protein oxidation in beef meatballs during refrigerated storage[J]. Meat Science, 2016, 116:126-132.
[25] WALAYAT N, TANG W, WANG X P, et al. Effective role of konjac oligosaccharide against oxidative changes in silver carp proteins during fluctuated frozen storage[J]. Food Hydrocolloids, 2022, 131:107761.