非甾体抗炎药(non-steroidal anti-inflammatory drug,NSAIDs)是临床上广泛使用的药物[1],然而,这类药物可能会引发胃炎、消化性溃疡以及胃肠道出血等不良反应。例如,单次服用650 mg阿司匹林可能会导致胃黏膜出血,而如果在24 h内分次给予相同剂量,则可能会引发胃糜烂[2]。在长期服用NSAIDs的患者中,约有15%~30%的人会出现胃或十二指肠溃疡。尽管质子泵抑制剂(proton pump inhibitors,PPIs)可以通过抑制胃酸分泌来缓解这些症状,但长期使用可能会带来一些副作用,如骨质疏松、维生素B12缺乏以及肾功能损伤。因此,开发一种既能修复胃黏膜损伤,又能避免传统治疗副作用的新型干预策略,显得尤为迫切。
胞外多糖(exopolysaccharides,EPS)是一种由微生物产生的高分子量碳水化合物生物聚合物。益生菌EPS具有多种生物活性和健康益处,例如益生元作用、免疫调节、降胆固醇、抗癌、抗氧化、抗病毒、抗糖尿病、抗溃疡以及抗胃炎等特性[3-4]。
近年来,微生物EPS因其独特的生物活性,成为胃肠疾病治疗的潜在候选分子[5-6]。研究表明,EPS不仅能够耐受胃酸和肠道消化酶的作用,还可通过2种机制发挥抗炎作用。一方面,其通过菌群-宿主相互作用间接调控免疫稳态,例如,植物乳植杆菌KX041产生的EPS具有益生元潜力,能促进阿克曼菌属的富集[7],并且对胃和肠道的刺激消化产生高度的耐受性[8],双歧杆菌EPS可增加肠道短链脂肪酸(short chain fatty acids,SCFAs)水平,而SCFAs可以抑制巨噬细胞极化为炎性M1亚型[9-10],减轻胃肠道炎症。另一方面,EPS可以直接调节先天性和适应性免疫反应,例如,戊糖乳杆菌LZ-R-17的EPS可以通过激活巨噬细胞的吞噬功能并促进IL-10分泌,平衡促炎因子与抗炎因子表达[11],而植物乳植杆菌JLAU103的EPS则通过抑制Iκ-Bα磷酸化,阻断NF-κB活化,减少IL-6和前列腺素E2(prostaglandin E2,PGE2)的过度释放[12]。然而,现有研究大多集中于单一机制上,且对于EPS在乙酰水杨酸(阿司匹林)诱导的胃炎模型中是否依赖肠道菌群协同作用,仍存在争议。
本研究聚焦于一株具有体外抗炎功效的罗伊氏粘液乳杆菌(Limosilactobacillus reuteri)CCFM1453 EPS(下文中EPS专指罗伊氏粘液乳杆菌CCFM1453的EPS),旨在深入解析EPS对阿司匹林诱导的胃黏膜损伤的修复机制,重点关注其“菌群依赖性”和“直接免疫调节”2种机制下的修复效果。为此,本研究构建了阿司匹林诱导的胃炎小鼠模型,并通过伪无菌小鼠与普通小鼠的对比体系,综合评估EPS干预对胃炎修复、炎症因子及相关信号通路表达的影响。此外,结合肠道菌群分析,进一步明确EPS在调控胃炎中的具体作用机制。本研究结果将为EPS的精准应用提供重要的机制依据。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株来源
实验所用罗伊氏粘液乳杆菌CCFM1453由江南大学食品微生物菌株保藏中心(Culture Collection of Food Microorganisms,CCFM)提供。
1.1.2 药品与试剂
PGE2、三叶因子(trefoil factor,TFF3)、IL-6、IL-10、环氧化酶-2(cyclooxygenase-2,COX-2)的ELISA试剂盒,南京森贝佳生物科技有限公司;实时荧光定量PCR(quantitative real-time polymerase chain reaction, qPCR)相关引物,上海生工生物工程有限公司;BCA蛋白浓度测定试剂盒,上海碧云天生物技术有限公司;RNA提取试剂盒、反转录试剂盒、qPCR荧光定量试剂盒,南京诺唯赞生物科技有限公司;通用型组织固定液(中性),武汉赛维尔生物科技有限公司;其他化学药品,国药集团试剂有限公司。
1.2 仪器与设备
隔水式恒温培养箱,上海森信实验仪器有限公司;384实时定量PCR仪器、实时定量基因扩增仪,美国Bio-Rad公司;高速冷冻离心机,Eppendorf公司;蒸汽灭菌锅,日本三洋公司;高通量组织研磨机、冷冻干燥机,宁波新芝生物科技股份有限公司;自动生化分析仪,深圳迈瑞生物医疗电子股份有限公司;切片电子扫描仪,匈牙利3DHISTECH公司;多功能酶标仪,上海智诚有限公司。
1.3 实验方法
1.3.1 罗伊氏粘液乳杆菌CCFM1453的培养
罗伊氏粘液乳杆菌CCFM1453从牛乳中分离,使用引物27F(5′-AGAGTTTGATCCTGGCTCAG-3′)和1492R(5′-GGTTACCTTGTT ACGACT T-3′)扩增16S rRNA基因。使用Sanger方法和ABI3730XL自动测序仪进行测序,随后的序列数据上传到NCBI服务器进行综合分析,后保藏于广东省微生物菌种保藏中心。将罗伊氏粘液乳杆菌CCFM1453接种到5 mL 无菌液体MRS培养基中,并以2%(体积分数)传代3次,后接种到200 mL MRS培养基中,将在培养箱摇床上以120 r/min、37 ℃孵育36 h。
1.3.2 EPS提取
罗伊氏粘液乳杆菌CCFM1453的发酵上清液进行真空浓缩。随后,加入乙醇进行沉淀,并通过离心分离得到粗多糖。接着,用纯净水将粗多糖复溶,再用三氯乙酸去除蛋白[13],将溶液置于1 000 Da的透析袋中,在4 ℃条件下用蒸馏水透析72 h,以去除小分子杂质。最后,将透析后的多糖溶液进行冷冻干燥,得到罗伊氏粘液乳杆菌CCFM1453 EPS。
1.3.3 小鼠模型建立
实验小鼠均来自于维通利华公司。动物实验方案已获得江南大学实验动物实验伦理委员会批准(伦理编号为:JN.No20240630b1040811)。将30只Balb/c小鼠随机分为伪无菌小鼠组别和正常小鼠组别,每组15只,2个组别分别包括空白组、模型组和EPS组。乙酰水杨酸诱导的胃炎模型建立过程如图1所示,模型组和EPS组小鼠每天以400 mg/kg的剂量灌胃乙酰水杨酸,连续7 d,诱导Balb/c小鼠的慢性胃炎[14-15],造模完成后,EPS组小鼠每天以50 mg/kg的剂量灌胃EPS,持续10 d,用于修复胃黏膜损伤[16]。另外,伪无菌组别在灌胃多糖的同时灌胃四连抗生素(四联抗生素:万古霉素100 mg/kg;新霉素200 mg/kg;氨苄青霉素200 mg/kg;甲硝唑200 mg/kg),抗生素配方参考既往研究方法[17-19],以验证EPS起效机制。
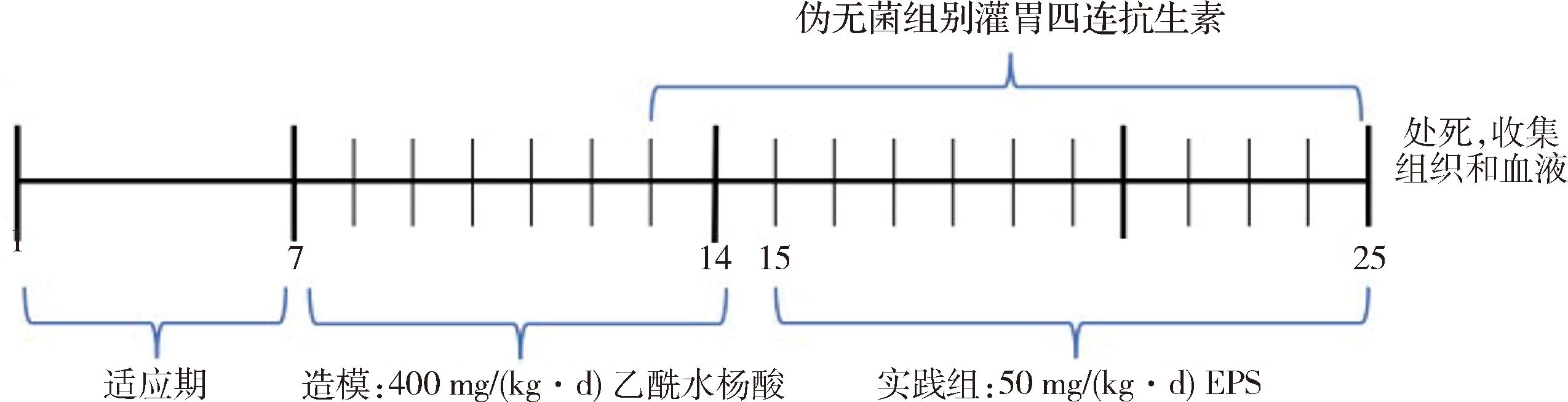
图1 小鼠造模方式
Fig.1 Mouse modeling methods
1.3.4 收集血清和组织样本
实验第26天,眼部静脉丛取血后应颈椎脱臼法处死小鼠,后解剖收集胃部、脾、肾肝、肠道组织样本。用生理盐水冲洗小鼠器官后,用滤纸去除残留的水分,然后称重、拍照和测量。器官指数的计算如公式(1)所示:
脾脏指数![]()
(1)
1.3.5 病理学分析
使用脱水机和包埋机将组织样品在4%多聚甲醛中固定24 h后,用切片机将包埋的组织样品切成4 μm 切片,然后用二甲苯洗涤以去除石蜡残留物。胃部组织样本进行苏木精-伊红(hematoxylin-eosin,H&E)染色,通过Pannoramic MIDI数字切片扫描仪扫描成片,观察评估肾脏切片病理学特征。
1.3.6 生化指标测定
取等质量的小鼠胃部组织加入9倍质量的预冷PBS和适量研磨珠,用高通量组织破碎机制成匀浆,以3 000 r/min,4 ℃离心20 min,收集上清液完成组织的匀浆上清样本制备。采用森贝伽ELISA试剂盒(货号:SBJ-M0055-96T、SBJ-M0920-96T、SBJ-M0657-96T、SBJ-M0073-96T、SBJ-M0847-96T)测定胃部组织或血清中PGE2、TFF3、IL-6、IL-10、COX-2的含量。
1.3.7 实时荧光定量PCR mRNA分析
按照Vazyme RNA提取试剂盒的指南,对小鼠肾脏组织进行提取,接着按照Vazyme逆转录试剂盒的指南,反转录得到cDNA。通过qPCR检测本次实验关键基因的表达情况,这些基因包括STAT3、SOCS3、TRPV4、MyD88、AKT、IKBα以及用作对照的GAPDH。这些基因的特定引物序列均已详细列于表1中。
表1 引物序列
Table 1 Primer Sequence
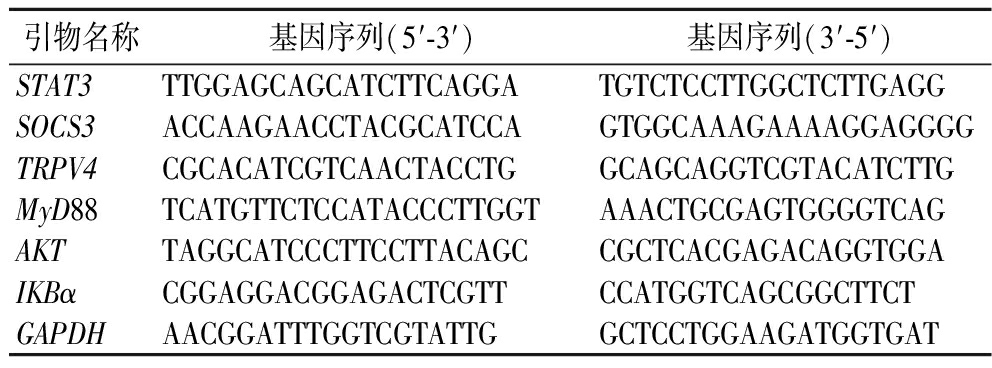
引物名称基因序列(5′-3′)基因序列(3′-5′)STAT3TTGGAGCAGCATCTTCAGGATGTCTCCTTGGCTCTTGAGGSOCS3ACCAAGAACCTACGCATCCAGTGGCAAAGAAAAGGAGGGGTRPV4CGCACATCGTCAACTACCTGGCAGCAGGTCGTACATCTTGMyD88TCATGTTCTCCATACCCTTGGTAAACTGCGAGTGGGGTCAGAKTTAGGCATCCCTTCCTTACAGCCGCTCACGAGACAGGTGGAIKBαCGGAGGACGGAGACTCGTTCCATGGTCAGCGGCTTCTGAPDHAACGGATTTGGTCGTATTGGCTCCTGGAAGATGGTGAT
1.3.8 菌群测定
采用Illumina Miseq测序系统对样本进行16 s高通量测序分析,用QIIME生物信息学软件对各组数据进行分析及处理,根据样本的操作分类单元(operational taxonomic unit,OTU)丰度进行主成分分析(principal components analysis,PCA),计算Observed OTUs、Chao1菌群丰度指数及Shannon多样性指数;通过与数据库比对,对OTUs进行物种分类并分别从不同水平进行物种分类及丰富度统计分析。进行多组数据间显著性分析时(不少于3组),使用单因素方差分析(One-Way ANOVA);进行2组数据间显著性分析时,使用T-test。P<0.05表示具有显著性差异,P<0.01表示差异极显著。
1.4 统计分析
采用GraphPad Prism 9.0.0软件进行作图和对显著性差异完成统计分析,实验结果以“平均值±标准差”表示,组间比较使用One-Way ANOVA。P<0.05记为*,P<0.01记为**,P<0.001记为***,P<0.000 1记为****;“ns”表示无显著差异。
2 结果与分析
2.1 EPS有效减缓胃炎小鼠体重降低并减轻脾脏指数
通过体重和脾脏指数评估小鼠的炎症状态。如图2所示,在伪无菌小鼠组中小鼠的体重呈下降趋势,在之前的研究中提到过这种现象,可能是伪无菌小鼠组小鼠缺乏肠道微生物群,食物消化能力下降,部分营养物质的吸收效率降低,导致体重增长受限或短期内出现下降趋势[20-21]。模型组的体重显著降低,而EPS组小鼠的体重表现出明显的恢复趋势,体重逐渐上升并接近空白组水平,这说明EPS治疗对胃炎模型小鼠的体重恢复具有显著的促进作用。相比之下,普通小鼠的肠道菌群更为复杂,其总体体重变化不明显。脾脏是重要的免疫器官,参与机体免疫应答。脾脏指数升高意味着免疫系统激活、炎症反应加剧。伪无菌小鼠和普通小鼠在经过EPS修复后,均能改善脾脏指数,伪无菌小鼠显示出更好的修复效果。
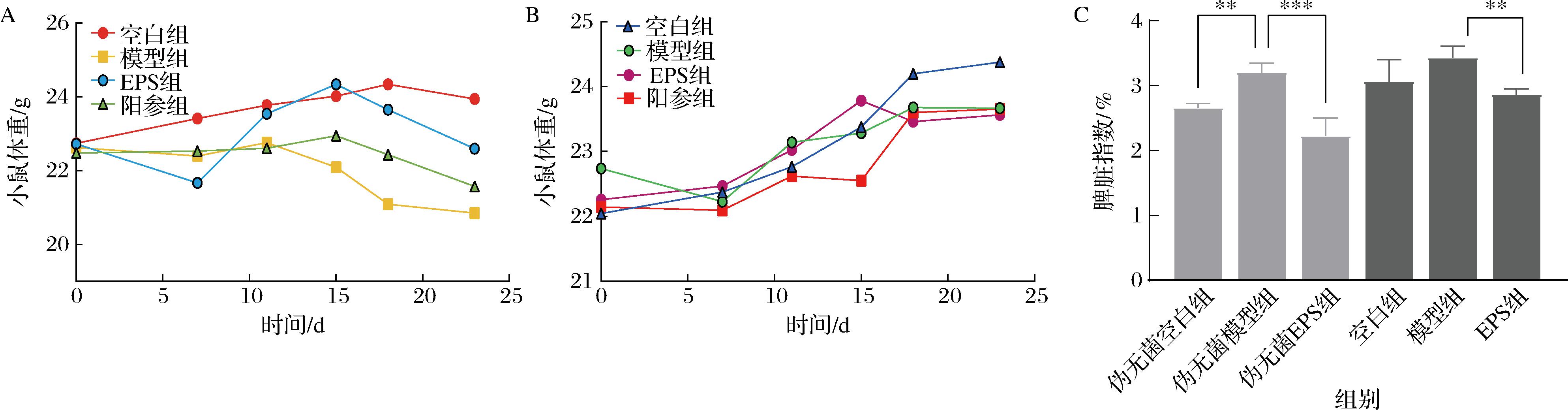
A-伪无菌小鼠组别的体重变化;B-普通小鼠组别的体重变化;C-小鼠脏器指数变化
图2 小鼠的体重和脏器指数变化
Fig.2 Changes of body weight and organ index in mice
注:**表示P<0.01,***表示P<0.001(下同)。
2.2 胃部组织HE切片分析
病理学切片分析如图3所示,相比于空白组,模型组可见表浅糜烂,黏膜层、黏膜固有层疏松水肿,少许炎症浸润,固有基层疏松水肿。经过EPS修复后,黏膜屏障受损情况有所好转,水肿程度减轻,炎症细胞浸润明显减少。

图3 小鼠胃部组织H&E病理学切片
Fig.3 H&E histopathological sections of mouse gastric tissue
2.3 EPS对胃炎标志物PGE2、TFF3含量的影响
PGE2是前列腺素家族中的一种重要炎症介质,PGE2在维持黏膜屏障完整性、黏液分泌、调节胃血流方面起主要作用[22],可减少胃酸分泌,抑制胃中的炎症和氧化应激,当PGE2水平显著升高时,往往提示炎症反应过度,加重胃黏膜损伤[1,23]。如图4-A所示,相比于空白组(伪无菌空白组、普通空白组:3.28,5.17 pg/mg),模型组的PGE2水平显著上升(11.70、9.37 pg/mg),表明胃炎模型小鼠存在明显的炎症反应,炎症刺激导致PGE2合成增加,提示胃黏膜受到损伤,炎症反应过度激活。EPS能够缓解胃炎引起的炎症反应(4.04、3.69 pg/mg),分别较模型组降低了65.47%和60.62%,改善胃黏膜的炎症状态,促进黏膜修复,这和前人的研究结果相似[24]。
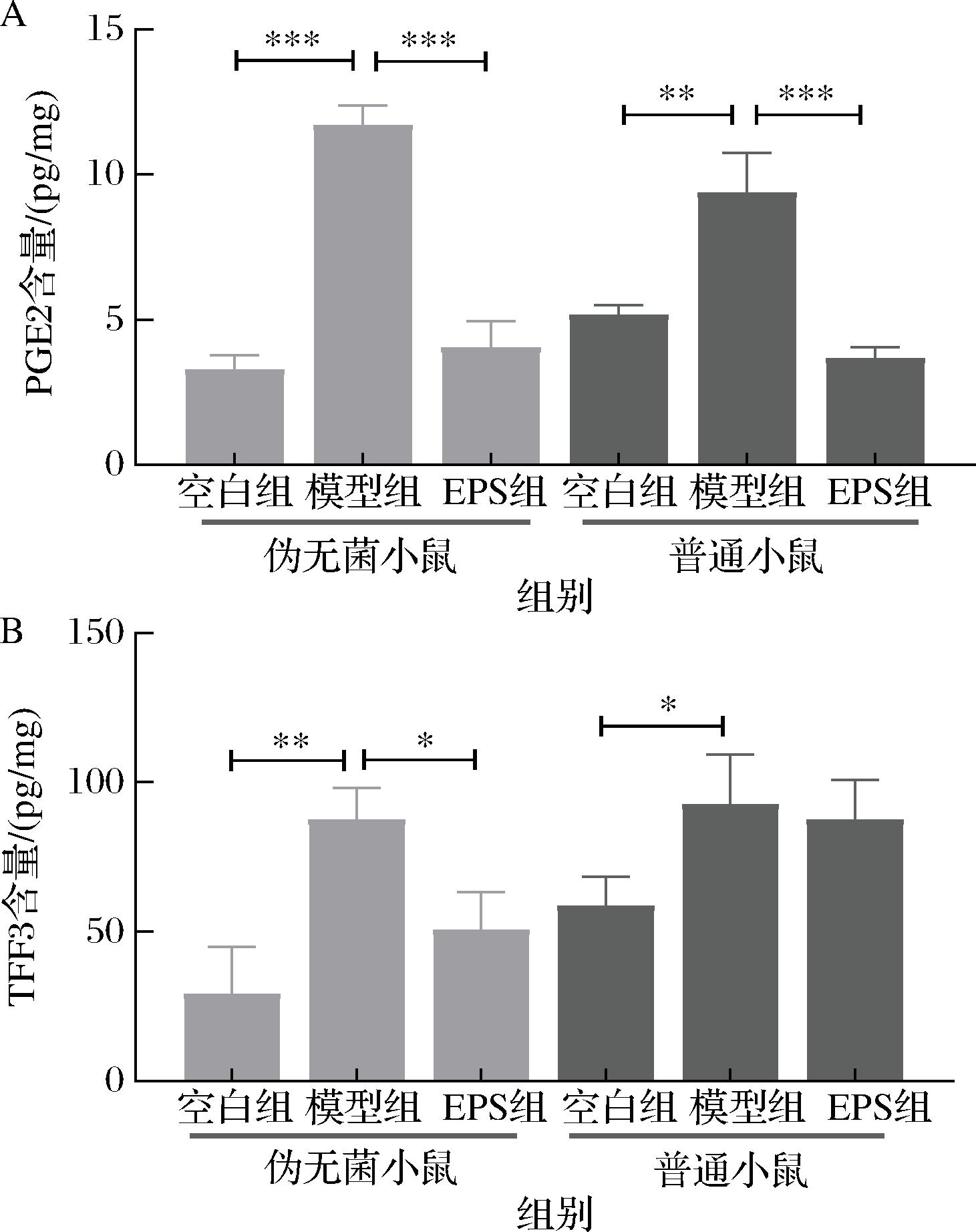
A-PGE2;B-TFF3
图4 小鼠胃部组织PGE2、TFF3含量
Fig.4 Mouse gastric tissue PGE2 and TFF3 content
注:*表示P<0.05(下同)。
三叶草因子家族(trefoil factor family,TFF)由3种热稳定且抗蛋白酶的多肽组成,其主要由胃肠道的黏液分泌细胞分泌,在维持其完整性以抵抗黏膜损伤方面起着重要作用[25],TFF3是胃肠道重要的保护因子之一,主要功能包括促进胃黏膜的修复和愈合。在胃炎中,TFF3的变化通常反映了胃黏膜的损伤与修复过程[26]。如图4-B所示,相比于空白组(29.18、58.53 pg/mg),模型组的TFF3水平显著上升(87.42、92.58 pg/mg),表明胃黏膜受损,修复机制被激活,胃炎引起的炎症反应和修复过程活跃。在伪无菌小鼠组别中,EPS能够通过调节TFF3的表达,促进胃黏膜的修复,减轻胃炎引起的过度炎症反应(50.59 pg/mg),较模型组降低了42.13%,这与前人的研究结果相似[27],在炎症恢复后,TFF3的含量逐渐降低。TFF3作为胃炎标志物,反映了胃黏膜损伤和修复的动态过程。
伪无菌组小鼠在缺乏肠道菌群的参与下,EPS依然能显示出抗胃炎的效果,并且在下调TFF3的表达方面优于普通小鼠。可能由于菌群代谢产物会刺激胃黏膜,使黏膜损伤更严重,TFF3需要长时间维持高表达以促进修复,并且肠道菌群可能会影响EPS的效果。
2.4 EPS对促炎因子和抗炎因子含量的影响
如图5所示,EPS对胃炎的抗炎和修护效果主要体现在促炎因子的降低和抗炎因子的增加。模型组小鼠的IL-6水平显著升高,其中伪无菌模型组升高至7.12 pg/mg,普通模型组升高至7.86 pg/mg,EPS能够有效降低IL-6水平,分别降低至3.53 pg/mg(伪无菌EPS组)和4.35 pg/mg(普通EPS组),这表明EPS可以有效缓解胃炎引起的炎症反应,并保护胃黏膜免受进一步损伤。
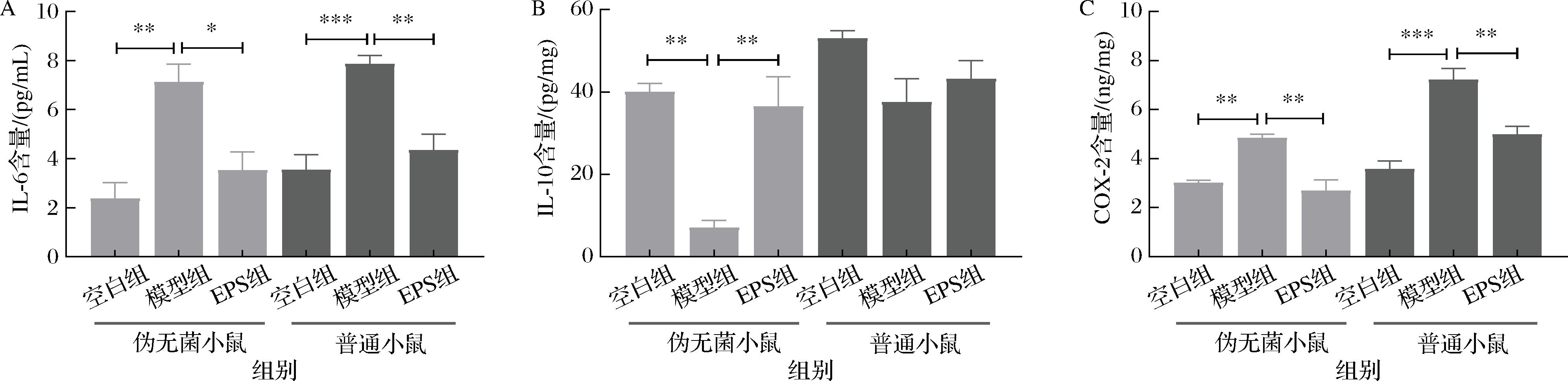
A-IL-6;B-IL-10;C-COX-2
图5 小鼠胃部组织炎症因子IL-6、IL-10、COX-2含量表达
Fig.5 Expression of inflammatory cytokines IL-6, IL-10, and COX-2 in mouse gastric tissue
在抗炎因子方面,伪无菌模型组的IL-10表达量较低,仅为7.08 pg/mg,表明其胃黏膜处于持续炎症状态,修复能力较弱。而EPS处理后,伪无菌EPS组IL-10的表达显著提高至36.53 pg/mg,增强了抗炎作用,抑制了过度炎症反应,并促进了胃黏膜的修复。相比之下,普通组的IL-10含量未发生显著变化。
模型组小鼠的COX-2水平显著升高,伪无菌组的COX-2水平升高至4.85 ng/mg,普通组升高至7.23 ng/mg,导致PGE2过量生成,从而加剧炎症反应并延缓胃黏膜的修复。而EPS处理后,COX-2的表达显著降低,分别降至2.70 ng/mg(伪无菌EPS组)和4.98 ng/mg(普通EPS组),减少炎症介质的生成,减轻胃黏膜的炎症程度,并加速了黏膜的修复过程。
EPS在伪无菌小鼠组中对胃炎的抗炎和修复效果更为显著,这可能与肠道菌群及其代谢产物对炎症反应的影响有关。在正常小鼠中,肠道菌群的复杂性可能会导致炎症因子的过度表达,从而加重胃黏膜的炎症反应,进而限制EPS的抗炎效果。相比之下,伪无菌小鼠缺乏复杂的肠道菌群,这使得EPS能够更有效地调节炎症因子(如IL-6、IL-10和COX-2)的表达,从而快速减轻炎症并促进胃黏膜的修复。
2.5 EPS综合调控JAK/STAT、TLR/MyD88/NF-κB、PI3K/AKT多通路修复胃炎
STAT3是JAK/STAT信号通路的核心分子,参与细胞增殖、存活、分化、血管生成等多种生物过程,同时也与炎症、肿瘤和免疫反应等病理过程密切相关[28]。经过EPS修复后,伪无菌组和普通组的STAT3 mRNA表达量分别降低了63.81%和89.35%,这表明EPS可能通过抑制JAK/STAT通路的过度激活,有效缓解炎症反应。SOCS3是JAK/STAT通路的负调控因子,在胃肠道疾病中的影响一直是研究热点[29-30],相比于模型组,修复后伪无菌EPS组和普通EPS组的SOCS3 mRNA表达量分别降低了76.51%和63.96%,表达水平降低可能表明炎症信号已得到缓解,减少了对负反馈调控的需求。有研究表明,IL-6可能通过激活JAK/STAT3信号通路,在食管癌细胞中发挥抗凋亡因子的作用[31]。
TRPV4的激活会降低内皮细胞的跨膜电阻值,提升屏障通透性[16],可能与NF-κB呈负相关[32],在本研究中,与模型组相比,经过EPS修复后,伪无菌组和普通组的TRPV4 mRNA表达量分别降低了76.53% 和90.52%,表明EPS可能通过抑制TRPV4的活性,降低屏障通透性,从而减轻炎症反应。MyD88是TLR信号通路中的关键接头蛋白,其表达下降表明EPS可能通过TLR/MyD88/NF-κB信号通路抑制TLR信号的激活,减少促炎信号转导[33-34]。经过EPS修复后,伪无菌组的MyD88 mRNA表达量分别降低了52.08%,显著抑制了促炎因子的过度激活。IKBα主要作用是抑制NF-κB的激活[35-36],与模型组相比,经过EPS的修复后,伪无菌组和普通组的IKBα mRNA表达量分别降低了64.31%和83.79%,这表明EPS通过降低IKBα的表达,减少了NF-κB的激活,从而抑制促炎因子的表达,缓解炎症反应。
AKT的表达恢复表明EPS可能通过调控PI3K/AKT通路,促进细胞存活和胃黏膜修复,这一过程主要是通过AKT下游蛋白对炎症介质的调节来实现的[37-38]。相比于模型组,经过EPS的修复后,伪无菌组和普通组的AKT mRNA表达量分别降低了82.70%和52.42%。此外,激活的AKT催化NF-κB抑制剂IκB的磷酸化和降解,触发NF-κB信号通路的激活,加剧炎症反应[35],这与YE等[38]对霍山石斛茎多糖修复高盐饮食导致的胃炎机制研究结果类似。
EPS通过调控JAK/STAT、TLR/MyD88/NF-κB、PI3K/AKT等多条信号通路,在伪无菌组中依然展现出良好的抗炎和修复能力,这表明EPS本身是一种重要的功能性抗炎物质,可通过直接调节宿主细胞内的信号通路来发挥作用。具体见图6。

A-STAT3;B-SOCS3;C-TRPV4;D-AKT;E-MyD88;F-ikBα
图6 小鼠胃部组织相关通路mRNA表达水平
Fig.6 Expression levels of mRNA in gastric tissue-related pathways of mice
注:****表示P<0.000 1。
2.6 EPS对伪无菌组和普通组菌群的影响
2.6.1 alpha多样性分析
如图7所示,Chao1指数和Shannon指数均显示出伪无菌小鼠在各组中的菌群多样性明显低于普通小鼠,这表明抗生素处理显著降低了肠道菌群的物种丰富度和均匀度。此外,相较于模型组,EPS处理组普通小鼠的Chao1和Shannon指数略有恢复,表明EPS可能对肠道菌群的恢复具有一定的促进作用。
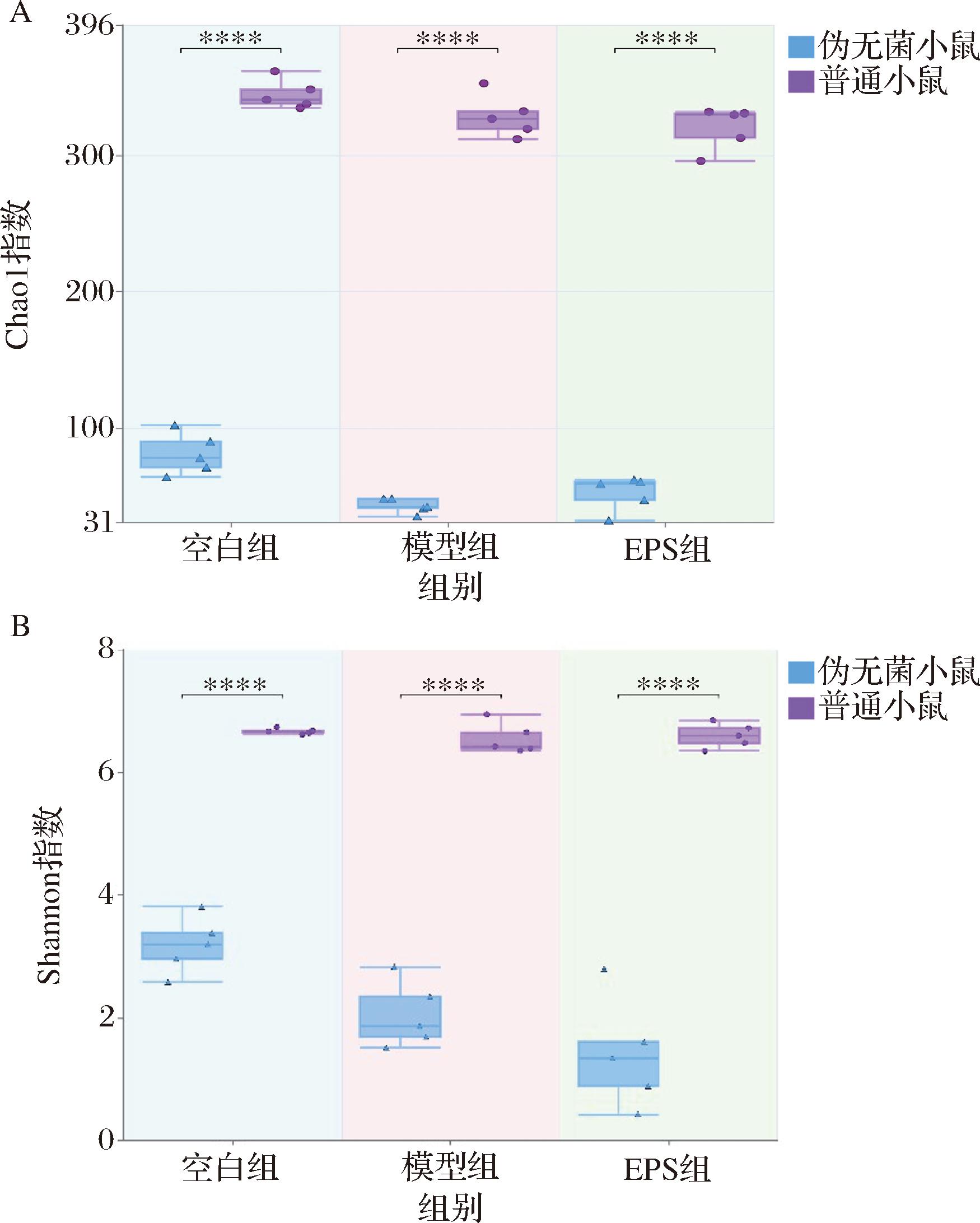
A-Chao1指数;B-Shannon指数
图7 小鼠肠道菌群Chao1指数和Shannon指数
Fig.7 Chao1 index and Shannon index of mouse gut microbiota
2.6.2 beta多样性分析
根据样本的OTU丰度进行PCA,结果如图8所示,伪无菌小鼠组别的差异并不大,肠道菌群的变化可能受限于小鼠的伪无菌处理,外部因素的干预难以引起显著变化;普通小鼠的各组别的肠道菌群组成有较显著的分离,炎症导致的菌群失调使空白组和模型组有较大差异,和LI等[39]的结果类似,乙酰水杨酸和EPS的处理改变了小鼠菌群结构,EPS可通过调节菌群代谢物或促进有益菌的增殖来修复炎症。
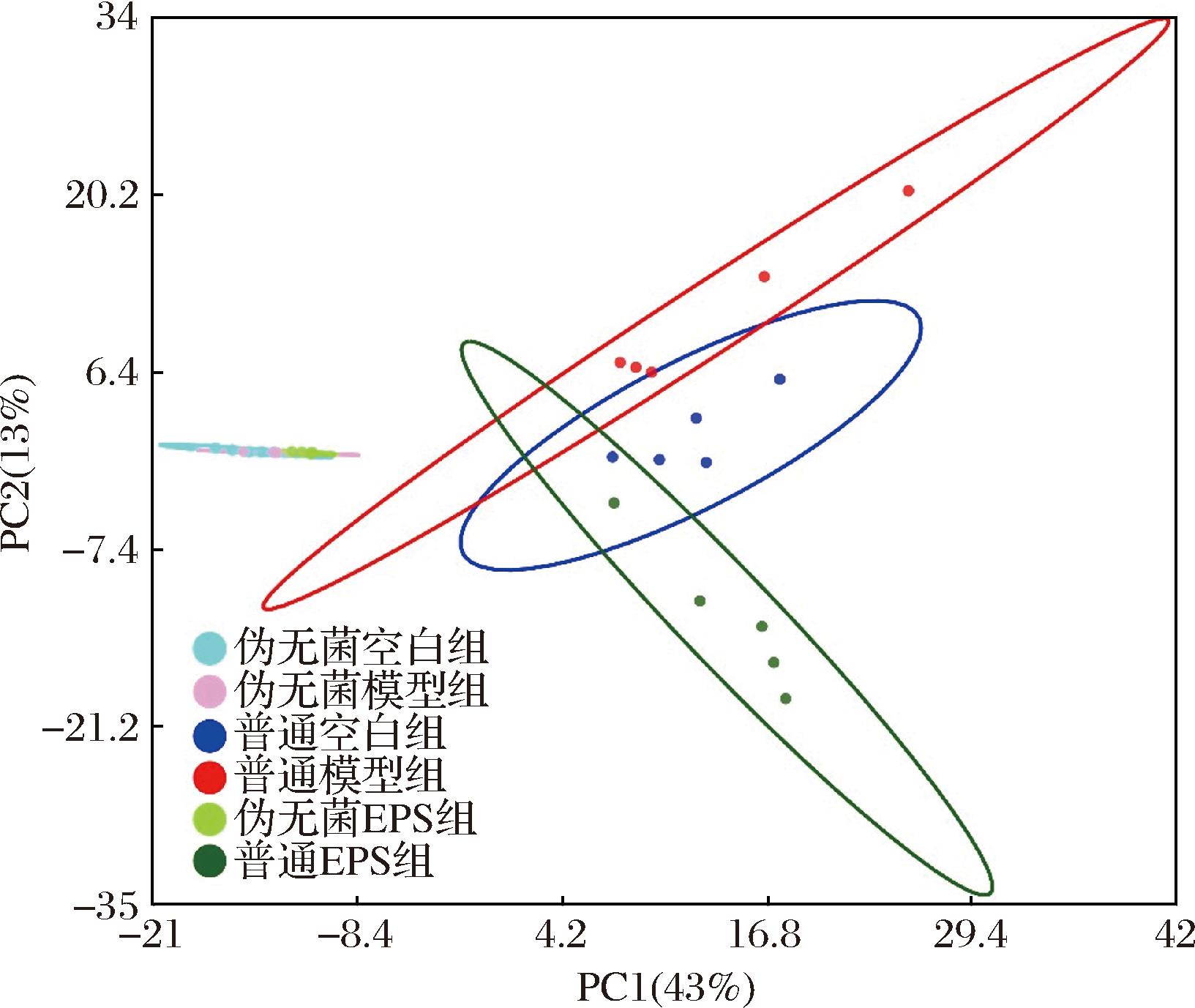
图8 小鼠肠道菌群组成PCA
Fig.8 PCA of mouse gut microbiota composition
2.6.3 菌群组成分析
对比伪无菌小鼠和普通小鼠的肠道菌群组成,结果如图9所示,在门水平上,普通小鼠的肠道菌群主要由拟杆菌门(Bacteroidetes)和厚壁菌门(Firmicutes)组成,两者总占比超过96%,经过抗生素处理后的伪无菌小鼠的肠道菌群主要由变形菌门(Proteobacteria)、蓝细菌门(Cyanobacteria)、厚壁菌门组成,总含量占比超过97%,这个结果与郑志天[40]有一些差异。在属水平上,普通小鼠的菌群多样性显著优于伪无菌小鼠,伪无菌小鼠菌群以伯克氏菌科(Burkholderiaceae)罗尔斯通菌属(Ralstonia)为主,这些菌群可能在伪无菌环境下更具有适应性,但在正常小鼠肠道中并不占主导地位。普通小鼠在属水平上菌群组成明显比伪无菌小鼠丰富,在胃炎模型的影响下,乳酸杆菌属(Lactobacillus)减少,这说明炎症影响乳酸杆菌属的生长,而乳酸杆菌属的减少可能导致肠道屏障功能下降,多糖修复后,乳酸杆菌含量明显上升,相对丰度有所恢复。多糖可能通过改善炎症状态和菌群稳态,间接促进乳酸杆菌的恢复,从而增强其对胃炎的修复作用,先前的研究也得出了类似的结论,即乳酸杆菌属等有益菌群的增加与抗炎免疫反应呈正相关[41]。

A-门水平;B-属水平
图9 门水平、属水平上的小鼠菌群组成
Fig.9 Composition of mouse microbiota at the phylum and genus levels
3 结论与讨论
本研究通过对比伪无菌小鼠与普通小鼠模型,揭示了罗伊氏粘液乳杆菌CCFM1453 EPS抗胃炎的双重机制。伪无菌小鼠因抗生素预处理导致肠道菌群丰度显著降低,在此背景下,EPS仍能通过直接抑制JAK/STAT和TLR/MyD88/NF-κB通路的过度激活,显著降低胃炎标志物PGE2、TFF3和促炎因子IL-6、COX-2的表达,同时上调抗炎因子IL-10表达。
这一结果表明,EPS的抗炎机制可以不依赖菌群互作,而是通过靶向宿主免疫信号通路直接调控炎症-修复平衡。可能原因有以下2点,一是EPS作为一种益生元,即使在没有肠道微生物的情况下,也能通过激活AMPK通路,增强胃肠上皮细胞的紧密连接,从而对胃炎进行修复[42-43],这一结论可以由诸多体外实验证明。并且,在消除肠道微生物及其代谢产物的干扰下,EPS更易直接靶向胃肠上皮细胞的TLR4受体[44],从而增强其与受体的结合效率,激活下游抗炎信号通路和调控蛋白。二是普通小鼠可能由于造模剂乙酰水杨酸的作用导致肠道菌群紊乱,从而介导促炎级联反应,间接加剧胃肠道黏膜炎症[45-47]。传统观点常强调肠道菌群的代谢支持、屏障保护及免疫调节等有益作用,然而在某些情况下菌群的“有益性”高度依赖于其组成稳定性及宿主内环境的稳态。在对肠道菌群在酒精性肝损伤中的关键作用的研究中[47],结果也显示了肠道微生物群落的生态功能具有显著的环境依赖性,在急性酒精暴露的病理条件下,肠道菌群可通过释放病原相关分子模式(pathogen-associated molecular patterns,PAMPs)激活TLR4/NF-κB通路,引发系统性炎症,而伪无菌小鼠则因缺乏菌群驱动的炎症信号而受到保护。另外有相关文献表明,乳酸杆菌的丰度下降,可能导致黏膜屏障功能受损[48],而EPS虽能恢复部分乳酸杆菌,提升菌群的属水平丰度和Chao1指数、Shannon指数,提高菌群多样性,但其对胃炎的调控效果弱于伪无菌组,这表明普通小鼠中EPS是通过菌群调节与直接免疫协同作用的结果,而伪无菌模型排除了菌群干扰,更凸显EPS本身的直接功能。
EPS在伪无菌模型中的优异表现可以证明其分子结构或功能基团可能具有直接结合免疫受体的活性,这为未来的深入探究提供了重要线索,进一步提升其靶向性。此外,也为长期使用非甾体抗炎药患者的胃黏膜保护提供新思路,即利用胞外多糖实现精准抗炎修复。同时拓展了益生菌胞外多糖的应用场景,具有重要的临床应用价值和研究意义。
[1] RAISH M, AHMAD A, AHMAD ANSARI M, et al.Momordica charantia polysaccharides ameliorate oxidative stress, inflammation, and apoptosis in ethanol-induced gastritis in mucosa through NF-kB signaling pathway inhibition[J].International Journal of Biological Macromolecules, 2018, 111:193-199.
[2] LAINE L.Gastrointestinal effects of NSAIDs and coxibs[J].Journal of Pain and Symptom Management, 2003, 25(2):32-40.
[3] YANG S, XU X Q, PENG Q, et al.Exopolysaccharides from lactic acid bacteria, as an alternative to antibiotics, on regulation of intestinal health and the immune system[J].Animal Nutrition, 2023, 13:78-89.
[4] ZANG J W, YAN B X, LIU Z B, et al.Current state, challenges and future orientations of the applications of lactic acid bacteria exopolysaccharide in foods[J].Food Microbiology, 2025, 126:104678.
[5] WANG K, NIU M M, SONG D W, et al.Preparation, partial characterization and biological activity of exopolysaccharides produced from Lactobacillus fermentum S1[J].Journal of Bioscience and Bioengineering, 2020, 129(2):206-214.
[6] RIAZ RAJOKA M S R, JIN M L, ZHAO H B, et al.Functional characterization and biotechnological potential of exopolysaccharide produced by Lactobacillus rhamnosus strains isolated from human breast milk[J].LWT, 2018, 89:638-647.
[7] YUE F F, HAN H Y, XU J X, et al.Effects of exopolysaccharides form Lactobacillus plantarum KX041 on high fat diet-induced gut microbiota and inflammatory obesity[J].International Journal of Biological Macromolecules, 2025, 289:138803.
[8] FUKUDA S, TOH H, HASE K, et al.Bifidobacteria can protect from enteropathogenic infection through production of acetate[J].Nature, 2011, 469(7331):543-547.
[9] ALE E C, BOURIN M J, PERALTA G H, et al.Functional properties of exopolysaccharide (EPS) extract from Lactobacillus fermentum Lf2 and its impact when combined with Bifidobacterium animalis INL1 in yoghurt[J].International Dairy Journal, 2019, 96:114-125.
[10] MA C, ZHENG X B, ZHANG Q, et al.A postbiotic exopolysaccharide synergizes with Lactobacillus acidophilus to reduce intestinal inflammation in a mouse model of colitis[J].International Journal of Biological Macromolecules, 2025, 291:138931.
[11] YOU X, YANG L, ZHAO X J, et al.Isolation, purification, characterization and immunostimulatory activity of an exopolysaccharide produced by Lactobacillus pentosus LZ-R-17 isolated from Tibetan kefir[J].International Journal of Biological Macromolecules, 2020, 158:408-419.
[12] WANG J, FANG X B, WU T, et al.In vitro immunomodulatory effects of acidic exopolysaccharide produced by Lactobacillus planetarium JLAU103 on RAW264.7 macrophages[J].International Journal of Biological Macromolecules, 2020, 156:1308-1315.
[13] KUSMIATI K, NURKANTO A, FANANI A, et al.Anti-hypercholesterolemia properties of exopolysaccharide from Lactiplantibacillus plantarum MI01:Computational and in vivo approaches[J].Case Studies in Chemical and Environmental Engineering, 2025, 11:101146.
[14] RODR GUEZ C.Therapeutic effect of Streptococcus thermophilus CRL 1190-fermented milk on chronic gastritis[J].World Journal of Gastroenterology, 2010, 16(13):1622-1630.
GUEZ C.Therapeutic effect of Streptococcus thermophilus CRL 1190-fermented milk on chronic gastritis[J].World Journal of Gastroenterology, 2010, 16(13):1622-1630.
[15] ONCEL S, GUPTA R, WANG Q G, et al.ZINC40099027 promotes gastric mucosal repair in ongoing aspirin-associated gastric injury by activating focal adhesion kinase[J].Cells, 2021, 10(4):908.
[16] LIU B, LI Q M, SHANG Z Z, et al.Anti-gastric cancer activity of cultivated Dendrobium huoshanense stem polysaccharide in tumor-bearing mice:Effects of molecular weight and O-acetyl group[J].International Journal of Biological Macromolecules, 2021, 192:590-599.
[17] HAGHIKIA A, ZIMMERMANN F, SCHUMANN P, et al.Propionate attenuates atherosclerosis by immune-dependent regulation of intestinal cholesterol metabolism[J].European Heart Journal, 2022, 43(6):518-533.
[18] LIU Y, YANG K N, JIA Y Q, et al.Gut microbiome alterations in high-fat-diet-fed mice are associated with antibiotic tolerance[J].Nature Microbiology, 2021, 6(7):874-884.
[19] 周永康. 生物转化葛根异黄酮菌株的筛选及其解酒护肝的应用[D].无锡:江南大学, 2024.ZHOU Y K.Screening of strains for biotransforming isoflavones from Pueraria lobata and its application in anti-alcoholism and liver protection[D].Wuxi:Jiangnan University, 2024.
[20] 卞恒娟, 曾本华, 王丽, 等.C57BL/6 J伪无菌与SPF小鼠高脂饮食诱导的比较研究[J].现代食品科技, 2016, 32(11):29-34.BIAN H J, ZENG B H, WANG L, et al.Comparative study of high fat diet in induced C57BL/6 J pseudo germ-free mice and specific-pathogen-free (SPF) mice[J].Modern Food Science and Technology, 2016, 32(11):29-34.
[21] MORETTI C H, SCHIFFER T A, LI X C, et al.Germ-free mice are not protected against diet-induced obesity and metabolic dysfunction[J].Acta Physiologica, 2021, 231(3):e13581.
[22] LIU B H, FENG X X, ZHANG J, et al.Preventive effect of anji white tea flavonoids on alcohol-induced gastric injury through their antioxidant effects in kunming mice[J].Biomolecules, 2019, 9(4):137.
[23] SHAN J M, YANG C, ZHOU D X, et al.Human gastrogenic Lactobacillus plantarum Lpf-01:A promising candidate for nsaids-induced acute erosive hemorrhagic gastritis[J].Blood, 2024, 144:5517.
[24] SALEH S A A, SHAWKY H, EZZAT A, et al.Prebiotic-mediated gastroprotective potentials of three bacterial levans through NF-κB-modulation and upregulation of systemic IL-17A[J].International Journal of Biological Macromolecules, 2023, 250:126278.
[25] KAISE M, JUN M W, TASHIRO J, et al.The combination of serum trefoil factor 3 and pepsinogen testing is a valid non-endoscopic biomarker for predicting the presence of gastric cancer:A new marker for gastric cancer risk[J].Journal of Gastroenterology, 2011, 46(6):736-745.
[26] ARNOLD P, RICKERT U, HELMERS A K, et al.Trefoil factor 3 shows anti-inflammatory effects on activated microglia[J].Cell and Tissue Research, 2016, 365(1):3-11.
[27] MONK J M, ZHANG C P, WU W Q, et al.White and dark kidney beans reduce colonic mucosal damage and inflammation in response to dextran sodium sulfate[J].The Journal of Nutritional Biochemistry, 2015, 26(7):752-760.
[28] SUN S J, WANG L, WANG J M, et al.Maresin1 prevents sepsis-induced acute liver injury by suppressing NF-κB/Stat3/MAPK pathways, mitigating inflammation[J].Heliyon, 2023, 9(11):e21883.
[29] INAGAKI-OHARA K, MAYUZUMI H, KATO S, et al.Enhancement of leptin receptor signaling by SOCS3 deficiency induces development of gastric tumors in mice[J].Oncogene, 2014, 33(1):74-84.
[30] ZHANG H, WANG Y, LI S X, et al.SOCS3 protects against neonatal necrotizing enterocolitis via suppressing NLRP3 and AIM2 inflammasome activation and p65 nuclear translocation[J].Molecular Immunology, 2020, 122:21-27.
[31] SIMONDURAIRAJ C, KRISHNAKUMAR R, SUNDARAM S, et al.Interleukin-6 receptor (IL-6R) expression in human gastric carcinoma and its clinical significance[J].Cancer Investigation, 2019, 37(7):293-298.
[32] NIU L, WANG S L, XU Y Y, et al.Honokiol targeting ankyrin repeat domain of TRPV4 ameliorates endothelial permeability in mice inflammatory bowel disease induced by DSS[J].Journal of Ethnopharmacology, 2024, 325:117825.
[33] ZHANG H H, LANG W Y, WANG S Y, et al.Echinacea polysaccharide alleviates LPS-induced lung injury via inhibiting inflammation, apoptosis and activation of the TLR4/NF-κB signal pathway[J].International Immunopharmacology, 2020, 88:106974.
[34] SU Y, CUI Z Y, CHEN C, et al.Lactobacillus paracasei JY062 with its exopolysaccharide ameliorates intestinal inflammation on DSS-induced experimental colitis through TLR4/MyD88/NF-κB signaling pathway[J].Food Bioscience, 2025, 63:105689.
[35] GUO Q, JIN Y Z, CHEN X Y, et al.NF-κB in biology and targeted therapy:New insights and translational implications[J].Signal Transduction and Targeted Therapy, 2024, 9:53.
[36] EL-DEEB N M, YASSIN A M, AL-MADBOLY L A, et al.A novel purified Lactobacillus acidophilus 20079 exopolysaccharide, LA-EPS-20079, molecularly regulates both apoptotic and NF-κB inflammatory pathways in human colon cancer[J].Microbial Cell Factories, 2018, 17(1):29.
[37] XIAO J D, XIE L M, ZHENG B, et al.Polygonatum cyrtonema saponin supplementation ameliorated DSS-induced intestinal barrier injury via targeting the PI3K/AKT/mTOR-mediated autophagy/microbiota axis[J].Food Bioscience, 2024, 61:104727.
[38] YE H Y, SHANG Z Z, GAO X, et al.Dendrobium huoshanense stem polysaccharide exhibits gastroprotective effect via regulating PI3K/AKT, NF-κB and Nrf-2 signaling in high-salt diet-induced gastritis mice[J].Food Bioscience, 2024, 62:105309.
[39] LI Y C, LIU Y J, LIU M C, et al.Polygonatum odoratum fermented polysaccharides enhance the immunity of mice by increasing their antioxidant ability and improving the intestinal flora[J].Food Bioscience, 2024, 58:103650.
[40] 郑志天. β-葡聚糖和拟杆菌对伪无菌小鼠肠道菌群及其代谢的影响[D].南昌:南昌大学, 2021.ZHENG Z T.Effects of β-glucan and Bacteroides on gut microbiota and microbial metabolism of pseudo-germ-free mice[D].Nanchang:Nanchang University, 2021.
[41] ZHANG L L, XU J Y, XING Y F, et al.Lactobacillus rhamnosus GG alleviates radiation-induced intestinal injury by modulating intestinal immunity and remodeling gut microbiota[J].Microbiological Research, 2024, 286:127821.
[42] SON H K, JHUN H, LEE H B, et al.Influence of different types of dietary sugars on the intestinal mucosa and hepatic lipid metabolism in germ-free mice[J].Biochemical and Biophysical Research Communications, 2024, 733:150707.
[43] WONGKRASANT P, PONGKORPSAKOL P, ARIYADAMRONGKWAN J, et al.A prebiotic fructo-oligosaccharide promotes tight junction assembly in intestinal epithelial cells via an AMPK-dependent pathway[J].Biomedicine &Pharmacotherapy, 2020, 129:110415.
[44] AKKERMAN R, OERLEMANS M M P, FERRARI M, et al.Exopolysaccharides from Bifidobacterium longum subsp.infantis and Bifidobacterium adolescentis modulate Toll-like receptor signaling[J].Carbohydrate Polymers, 2025, 349:123017.
[45] WANG M, FU R J, XU D Q, et al.Traditional Chinese Medicine:A promising strategy to regulate the imbalance of bacterial flora, impaired intestinal barrier and immune function attributed to ulcerative colitis through intestinal microecology[J].Journal of Ethnopharmacology, 2024, 318:116879.
[46] LI H Z, LI H T, STANTON C, et al.Alleviative effects of exopolysaccharides from Limosilactobacillus mucosae CCFM1273 against ulcerative colitis via modulation of gut microbiota and inhibition of Fas/Fasl and TLR4/NF-κB pathways[J].International Journal of Biological Macromolecules, 2024, 260:129346.
[47] CANESSO M C C, LACERDA N L, FERREIRA C M, et al.Comparing the effects of acute alcohol consumption in germ-free and conventional mice:The role of the gut microbiota[J].BMC Microbiology, 2014, 14:240.
[48] WANG X Y, HU R Q, LIN F, et al.Lactobacillus reuteri or Lactobacillus rhamnosus GG intervention facilitates gut barrier function, decreases corticosterone and ameliorates social behavior in LPS-exposed offspring[J].Food Research International, 2024, 197:115212.