刺糖(Alhagi sparsifolia honey) 又称刺蜜、洋槐蜜,是由豆科植物骆驼刺叶子分泌的糖分泌物凝结成的糖粒[1]。数百年来,骆驼刺在中国西北部[2](主产区新疆、甘肃、宁夏)、印度北部[3]、伊朗[4]和巴基斯坦[5]、埃及[6]等国家作为一种重要的药食两用植物[7]而广泛分布,具有丰富的群产量。《本草拾遗》中记载:“刺糖,味甘,无毒;主骨热,痰嗽,痢暴下血,开胃,止渴除烦”。新疆民间常用其治疗神经性头痛,牙痛,并与其他药材配伍用于治疗痢疾、腹泻疾病;刺糖果亦可泡酒,帮助消化,减轻胃肠道不适等症状。
刺糖中含有丰富的天然多糖和低聚糖[8]。多糖作为一类由单糖经糖苷键连接聚合而成的天然高分子碳水化合物,是刺糖的主要活性物质。研究表明,天然多糖具有抗炎、免疫调节、抗氧化以及调节肠道微生物群及其代谢产物等多种生物活性[9-12]。随着对刺糖药用价值研究的不断深入,其显著的市场化应用前景日益凸显。因此,准确测定刺糖中多糖的含量,是其质量控制与功效评价的关键环节。然而,目前广泛应用的刺糖多糖含量测定方法(如苯酚-硫酸法)常涉及危险化学品使用,具有较高的危险性,且操作繁琐耗时,难以满足对环保及大批量样本快速准确测定的实际需求。因此,建立高效、安全的替代检测方法已成为迫切需求。
近红外光谱技术(near infrared spectroscopy,NIRS)作为一种现代分析手段,其光谱范围(780~2 500 nm)介于可见光与中红外光之间,光谱信息主要反映含氢基团(—CH、—NH、—OH等)的倍频与合频吸收[13-14]。该技术具有多组分同步分析、无需复杂样品预处理、绿色环保(不产生有毒污染物)、检测速度快以及操作简便等显著优势[15-16]。已有研究证实NIRS结合化学计量学的有效性:例如,ZHONG等[17]基于近红外光谱技术,成功构建了59批灵芝孢子粉中三油酸甘油酯和多糖含量快速预测,克服了单一技术的局限性,为食品安全检测提供新的视角;WANG等[18]则实现了71批管花肉苁蓉多糖含量的快速测定。然而,以上研究存在样本量少,产地来源单一等部分问题,是否满足不同产地、大批量药材的含量测定还有待深入探究。鉴于此,本研究拟基于NIRS,结合偏最小二乘法(partial least squares,PLS),以不同产地、足够的样本量为基础,建立刺糖中多糖含量的快速检测模型,以期为刺糖的质量评价及深度开发利用提供新的理论依据和技术支撑。
100批次刺糖药材,分别来自于课题组前期留存,新疆维吾尔医院及麦迪森药业有限公司购买,具体信息见表1,经新疆医科大学药学院丛媛媛教授鉴定为豆科骆驼刺属植物骆驼刺(Alhagi sparsifolia Desv.)的分泌糖粒——刺糖(Alhagi sparsifolia honey)。
表1 不同刺糖药材样品信息
Table 1 Information of different samples of Alhagi sparsifolia honey

编号样本数产地批号S1~S3434中国新疆吐鲁番20100105;20100122;20100312;20100402;20120104;20120112;20130116;20140123;20140311;20140408;20150124;20150711;20160216;20160217;20160223;20160224;20160820;20160824;20161002;20170112;20170115;20171003;20171006;20171007;20171124;20180322;20180326;20191003;20191004;20191115;20191126;20191207;20191218;20191221S35~S6935巴基斯坦20130912;20130915;20130924;20130925;20140103;20140212;20140213;20140728;20140803;20140804;20140813;20140815;20140822;20140901;20140924;20140925;20140927;20140930;20141003;20141011;20141028;20141203;20150104;20150111;20150122;20150213;20150219;20150713;20150717;20150723;20150802;20150803;20151211;20160223;20160305S70~S10031中国新疆和田20161201;20161202;20161203;20170902;20170912;20170915;20171001;20171002;20171003;20171004;20171005;20180914;20180916;20180917;20180919;20180513;20180614;20180615;20180723;20181004;20181005;20191102;20191106;20191122;20200503;20210701;20220612;20230516;20231004;20231005;20231006
葡萄糖对照品(≥95%,天津市致远化学试剂有限公司);无水乙醇、苯酚、浓硫酸(天津市富宇精细化工有限公司),所有试剂均为国产分析纯。
UV-2 700紫外分光光度计,岛津仪器(苏州)有限公司;近红外Quest光谱仪,美国Ocean Optics公司;AB135-S分析天平,梅特勒-托利多仪器(上海)有限公司;电热鼓风干燥箱,北京市永光明医疗仪器有限公司。
1.3.1 样品前处理
将100批次刺糖样本置于60 ℃烘箱干燥6 h,粉碎,过四号筛,获刺糖粉末,编号S1~S100,密封后保存备用。
1.3.2 近红外光谱采集
取适量刺糖样本粉末均匀平铺于表面皿中,采用积分漫反射法,波长扫描范围设置为780~2 500 nm,扫描次数为32次,积分时间为12 ms,内置背景被作为空白参比进行背景扣除。每个样本重复测定3次,得到其平均光谱进行分析。
1.3.3 苯酚-硫酸法测定刺糖中多糖含量
参考课题组前期研究方法制备刺糖多糖[8]:精密称取刺糖粉末1 g,按照料液比1∶9(g∶mL)加入纯水,在70 ℃ 水浴中提取1.5 h,提取2次;合并滤液浓缩至一定体积后,在滤液中加入一定量乙醇进行醇沉,使最终醇体积分数达到80%,冰箱静置24 h,3 000 r/min离心5 min,得刺糖多糖沉淀,复溶,加纯水依次稀释1 000倍,备用。精密吸取供试品溶液1 mL 于20 mL具塞试管中,加纯水至2 mL,摇匀,苯酚-硫酸法显色,于490 nm下测定其吸光度值,实验设3个重复。
精密称取葡萄糖对照品(105 ℃烘干)10 mg,加水定容至100 mL,得浓度为0.1 mg/mL 葡萄糖储备液。分别精密吸取葡萄糖母液0.3、0.5、0.7、0.9、1.1 mL 于20 mL具塞试管中,加纯水至2 mL,摇匀,苯酚-硫酸法显色,于490 nm下测定其吸光度值,计算回归曲线。
1.3.4 模型的建立与评价
将100批次刺糖的近红外光谱数据与实测多糖含量精准匹配,结合机器学习,通过PLS构建定量分析模型。首先,采用Kennard- Stone算法[19],按7∶2比例将样本划分为校正集和预测集。为优化模型,通过卷积平滑法(savitzky-Golay smoothing, SG)、标准正态变量(standard normal variate,SNV)、多元散射校正(multiplicative scatter correction,MSC)、一阶导数(first derivative,FD)、二阶导数(second derivative,SD)及其组合形式对光谱进行预处理。并筛选建模波段以剔除无关信息、抑制过拟合,同时优化主因子数。以校正均方根偏差(root mean square error of calibration,RMSEC)、预测均方根偏差(root mean square error of prediction,RMSEP)![]() 为关键指标评估模型的稳定性与准确性[20-21],据此综合确定最佳预处理方法、建模波段及主因子数,建立最优多糖定量模型。最后,进一步使用独立的外部验证集样本检验模型准确性及预测能力。
为关键指标评估模型的稳定性与准确性[20-21],据此综合确定最佳预处理方法、建模波段及主因子数,建立最优多糖定量模型。最后,进一步使用独立的外部验证集样本检验模型准确性及预测能力。
100批次刺糖样本近红外原始光谱如图1所示,原始光谱图趋势大致相同,但不同样本间吸光度存在一定的差异,说明各样本中成分含量有所不用,能够为刺糖中多糖含量的测定提供光谱信息基础。观察图谱发现,在1 100~1 300 nm、1 350~1 500 nm、1 600~1 800 nm、2 000~2 300 nm波段范围内,均具有比较明显的吸收峰,但光谱基线存在明显偏移,光谱峰值大量重叠,从光谱的波长范围、峰形和位置不能确定样本之间的差异。因此,需要通过数据预处理等方法来确定差异,从而提高预测模型的稳定及准确性。
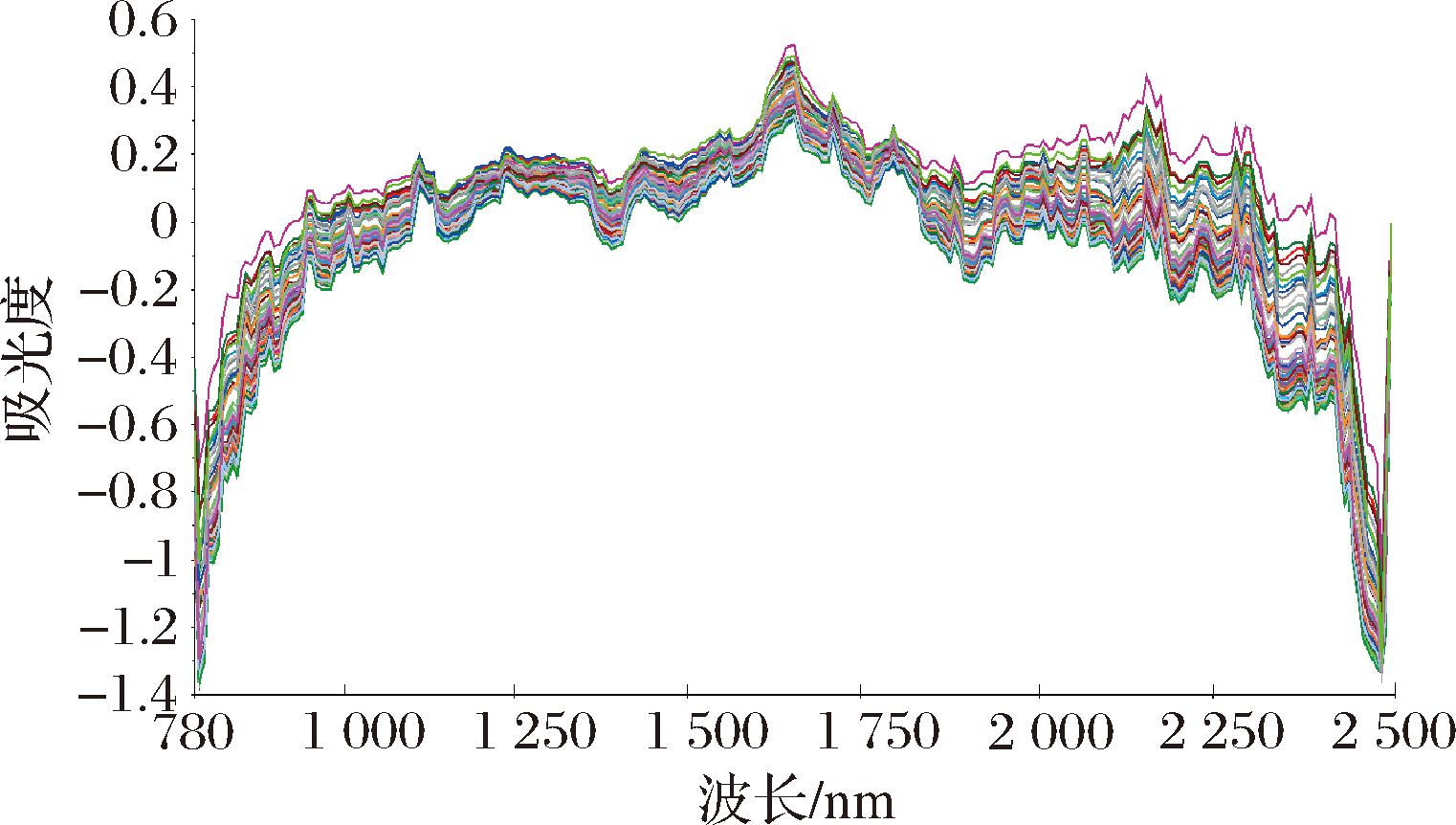
图1 刺糖样本原始近红外光谱图(n=100)
Fig.1 Raw NIR spectra of the Alhagi sparsifolia honey samples(n=100)
本研究共收集100批具有广泛代表性的刺糖样本,其多糖含量范围覆盖2.06%~5.48%,具备较强的代表性。为确保模型验证的独立性,首先从中随机抽取10批样品(S6、S24、S33、S40、S53、S60、S67、S70、S82、S92)作为完全外部验证集,该验证集不参与后续建模过程。剩余90批样本则采用K-S算法,依据样本间欧氏距离进行代表性筛选,按7∶2的比例划分为校正集与预测集(校正集70个样本,预测集20个样本)。K-S算法的核心在于通过精确计算样本间欧氏距离,确保校正集在光谱空间上分布均匀且具有代表性。如表2统计结果所示,校正集样本的多糖含量范围完整涵盖了预测集样本的含量范围。表明,本次样本集的划分科学合理,为构建稳定、准确的定量模型奠定了坚实基础,并为后续分析提供了可靠保障。
表2 样本集划分及刺糖中多糖含量分布
Table 2 Sample set division and distribution of polysaccharide content in Alhagi sparsifolia honey
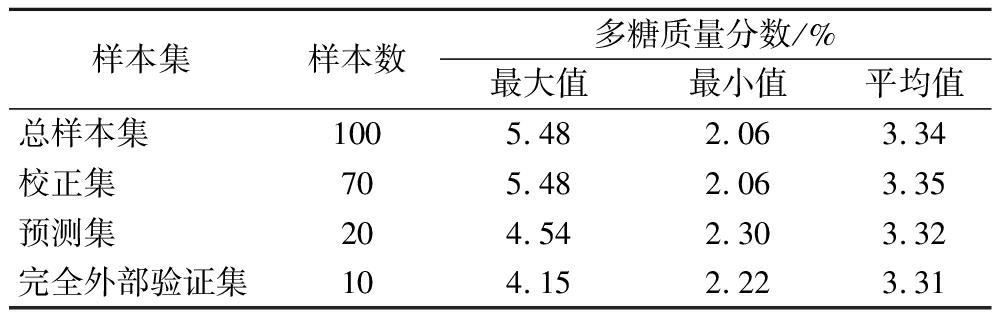
样本集样本数多糖质量分数/%最大值最小值平均值总样本集1005.48 2.06 3.34 校正集705.48 2.06 3.35 预测集204.54 2.30 3.32 完全外部验证集104.15 2.22 3.31
在获取光谱的过程中,光谱会受到样本的均匀性和仪器状态的影响。为了消除这些干扰,需要对原始光谱进行预处理,从而提高模型的预测能力。使用的预处理方法包括SG、SNV、MSC、FD、SD及其多种组合形式,如FD+SG、FD+SNV等。其中,SG通过特定卷积运算对光谱数据进行平滑处理,有效减少噪声干扰;SNV可消除因光程变化和颗粒散射造成的基线漂移;MSC致力于校正样本颗粒散射带来的误差;FD、SD以突出光谱特征,增强对重叠峰的分辨能力[22-24]。光谱预处理后的部分图谱如图2所示,结果见表3。其中RMSEC和RMSEP分别衡量模型在校正集和预测集上的预测误差,数值越低表明模型预测越精准;![]() 和
和![]() 反映模型对数据的拟合优度,取值越接近1,代表模型的可靠性和稳定性越高。结果显示,与原始数据相比,绝大多数预处理方法都显著提高了模型精度。进一步对比发现:SNV、MSC单独使用时效果优异
反映模型对数据的拟合优度,取值越接近1,代表模型的可靠性和稳定性越高。结果显示,与原始数据相比,绝大多数预处理方法都显著提高了模型精度。进一步对比发现:SNV、MSC单独使用时效果优异![]() RMSEP≈0.079 0),显著优于SG和FD、SD单独处理,说明基线漂移和散射效应是本数据集的主要干扰因素,SNV和MSC能有效校正。组合形式中,导数与基线校正的组合效果最佳,其中FD+SNV和FD+MSC在预测集表现
RMSEP≈0.079 0),显著优于SG和FD、SD单独处理,说明基线漂移和散射效应是本数据集的主要干扰因素,SNV和MSC能有效校正。组合形式中,导数与基线校正的组合效果最佳,其中FD+SNV和FD+MSC在预测集表现![]() 上远超其他方法,其R2值较高且比较接近,主因子数均为5。而FD+SNV与FD+MSC之间,FD+SNV的预测误差(RMSEP=0.077 9)略低于FD+MSC(RMSEP=0.078 7),同时其校正集性能
上远超其他方法,其R2值较高且比较接近,主因子数均为5。而FD+SNV与FD+MSC之间,FD+SNV的预测误差(RMSEP=0.077 9)略低于FD+MSC(RMSEP=0.078 7),同时其校正集性能![]() 也略优
也略优![]() 值得注意的是,包含SD的组合方法在校正集表现尚可,但在预测集表现(如
值得注意的是,包含SD的组合方法在校正集表现尚可,但在预测集表现(如![]()
![]() 明显弱于FD组合及单独基线校正,表明SD可能导致了过拟合,泛化能力与稳定性不足。因此,选择FD+SNV作为刺糖中多糖含量快速检测模型的最佳预处理方式。
明显弱于FD组合及单独基线校正,表明SD可能导致了过拟合,泛化能力与稳定性不足。因此,选择FD+SNV作为刺糖中多糖含量快速检测模型的最佳预处理方式。
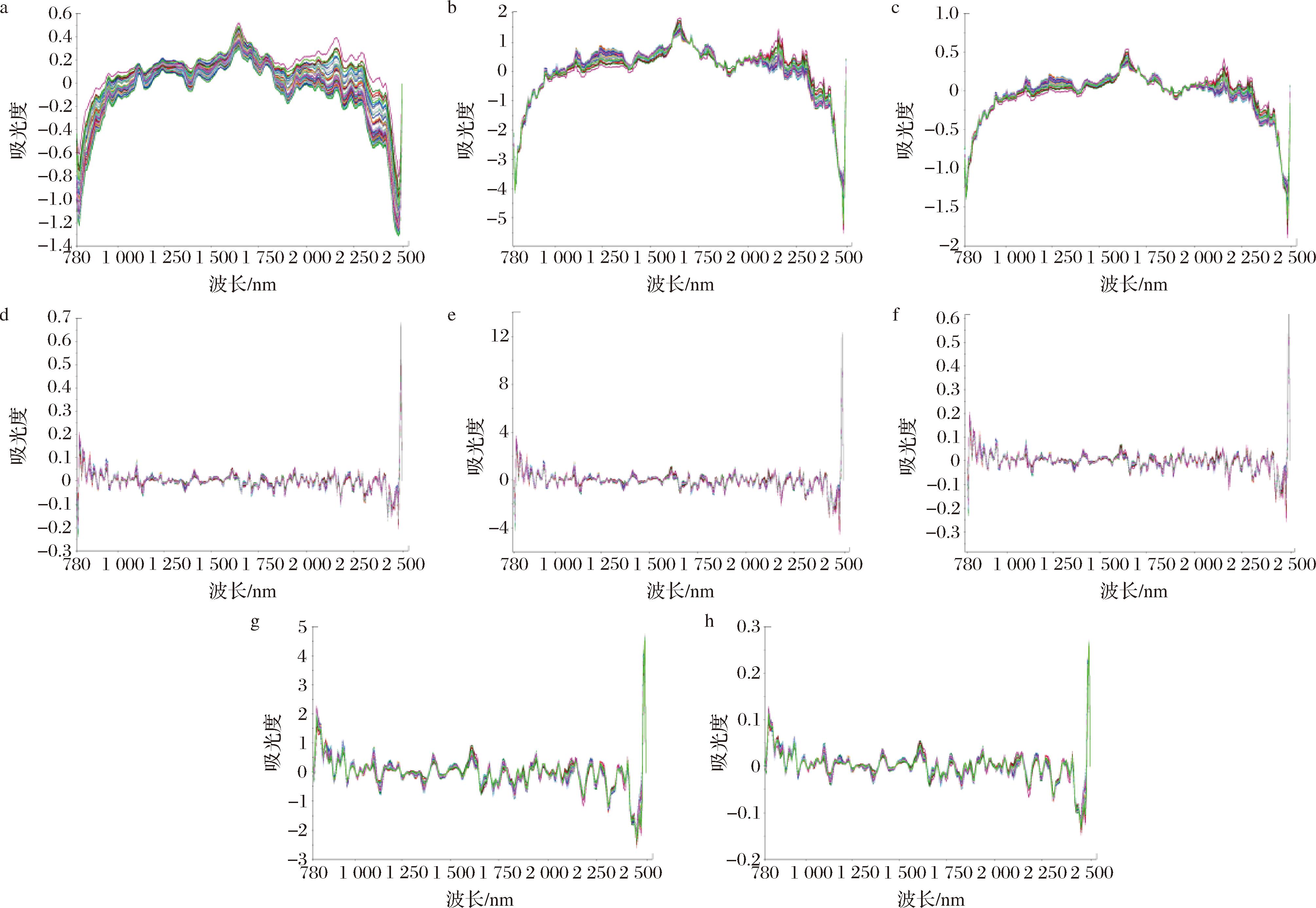
a-SG;b-SNV;c-MSC;d-FD;e-FD+SNV;f-FD+MSC;g-FD+SNV+SG;h-FD+MSC+SG
图2 不同预处理方式处理后的近红外光谱图(n=70)
Fig.2 NIR spectra after treatment with different preprocessing methods(n=70)
表3 不同光谱预处理方式的PLS建模结果
Table 3 PLS modelling results for different spectral pre-processing methods
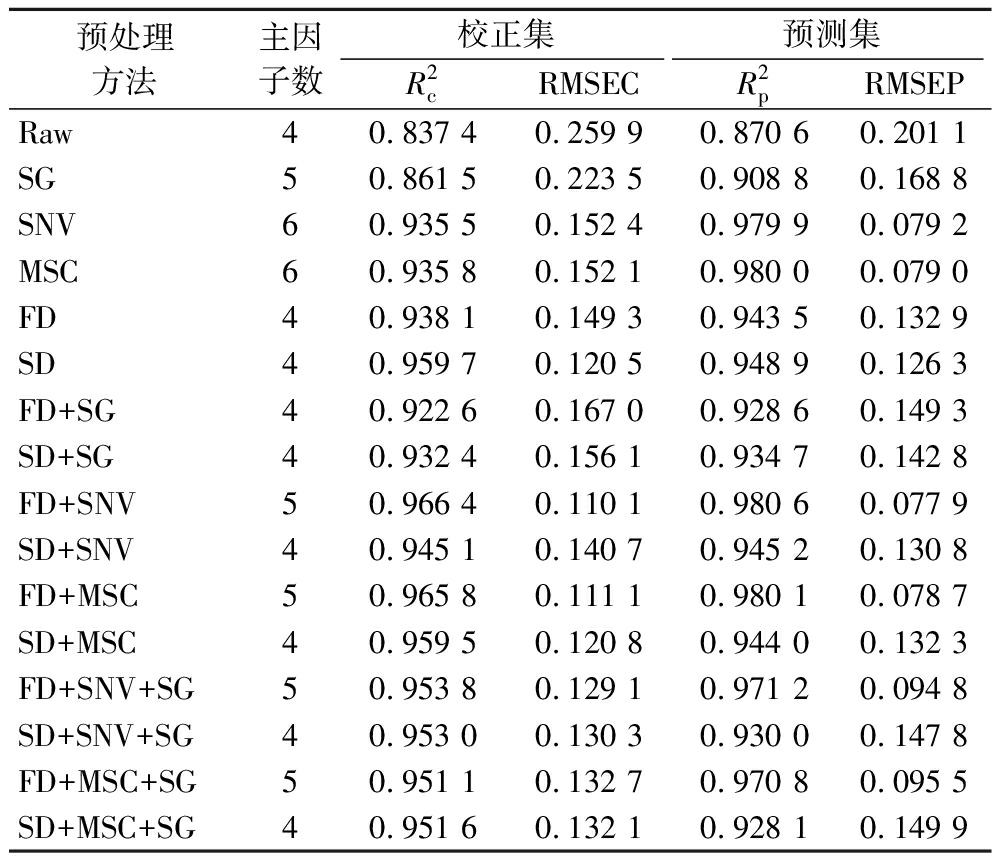
预处理方法主因子数校正集预测集R2cRMSECR2pRMSEPRaw4 0.837 4 0.259 9 0.870 6 0.201 1 SG5 0.861 5 0.223 5 0.908 8 0.168 8 SNV6 0.935 5 0.152 4 0.979 9 0.079 2 MSC6 0.935 8 0.152 1 0.980 0 0.079 0 FD4 0.938 1 0.149 3 0.943 5 0.132 9 SD4 0.959 7 0.120 5 0.948 9 0.126 3 FD+SG4 0.922 6 0.167 0 0.928 6 0.149 3 SD+SG4 0.932 4 0.156 1 0.934 7 0.142 8 FD+SNV5 0.966 4 0.110 1 0.980 6 0.077 9 SD+SNV4 0.945 1 0.140 7 0.945 2 0.130 8 FD+MSC5 0.965 8 0.111 1 0.980 1 0.078 7 SD+MSC4 0.959 5 0.120 8 0.944 0 0.132 3 FD+SNV+SG5 0.953 8 0.129 1 0.971 2 0.094 8 SD+SNV+SG4 0.953 0 0.130 3 0.930 0 0.147 8 FD+MSC+SG5 0.951 1 0.132 7 0.970 8 0.095 5 SD+MSC+SG4 0.951 6 0.132 1 0.928 1 0.149 9
近红外光谱中存在部分区域,如某些高信噪比但响应弱或与多糖结构关联性差的区域,对建立稳健预测模型作用不大。因此,需结合模型自身的评价参数,依据多糖主链及侧链化学键(如C—H伸缩、O—H伸缩与变形)的特征吸收波段筛选建模区间[25]。结合2.1节,刺糖光谱信号被划分为:1 100~1 300 nm(C—H二级倍频区,主要为CH2伸缩振动)、1 350~1 500 nm(O—H伸缩振动区,主要为水或多糖羟基伸缩振动)、1 600~1 800 nm(C—H伸缩振动的一级倍频,主要为CH2或CH3不对称伸缩)、2 000~2 300 nm (O—H与C![]() O组合频区,包括C
O组合频区,包括C![]() O伸缩振动和O—H弯曲振动)等特征波段。通过评估多种谱区方案,结合模型评价参数及多糖特征吸收峰位,筛选出最优建模区间,结果见表4。结果表明,在全部多糖特征吸收组合波段,即在1 100~1 300 nm、1 350~1 500 nm、1 600~1 800 nm、2 000~2 300 nm波段范围内,获得较高的
O伸缩振动和O—H弯曲振动)等特征波段。通过评估多种谱区方案,结合模型评价参数及多糖特征吸收峰位,筛选出最优建模区间,结果见表4。结果表明,在全部多糖特征吸收组合波段,即在1 100~1 300 nm、1 350~1 500 nm、1 600~1 800 nm、2 000~2 300 nm波段范围内,获得较高的![]() (0.985 9)和较小的RMSEC(0.096 6)、RMSEP(0.066 3),因此选择该组合波段作为最优建模区间。
(0.985 9)和较小的RMSEC(0.096 6)、RMSEP(0.066 3),因此选择该组合波段作为最优建模区间。
表4 不同光谱范围的PLS建模结果
Table 4 PLS modelling results for different spectral ranges

波长选择模型波段/nm校准集预测集R2cRMSECR2pRMSEP全部波数780~2 5000.966 4 0.110 10.980 6 0.077 9 全部特征组合波段1 100~1 300 1 350~1 5001 600~1 8002 000~2 3000.974 1 0.096 60.985 9 0.066 3 特征波段(一)1 100~1 3000.443 8 0.447 90.583 4 0.360 9 特征波段(二)1 350~1 5000.599 2 0.380 20.884 6 0.189 9 特征波段(三)1 600~1 8000.630 2 0.365 20.914 2 0.163 7 特征波段(四)2 000~2 3000.672 1 0.343 90.816 6 0.239 4 部分特征组合波段(五)1 100~1 300 1 350~1 5002 000~2 3000.880 7 0.207 40.954 1 0.119 7 部分特征组合波段(六)1 100~1 300 1 600~1 8002 000~2 3000.916 6 0.173 40.966 6 0.102 1 部分特征组合波段(七)1 350~1 5001 600~1 8002 000~2 3000.853 3 0.230 00.945 6 0.130 3
在PLS建模时,对主因子数进行系统考察也是模型构建的核心环节。主因子数不足将导致模型无法充分提取数据中的有效协变结构,造成拟合不足,进而削弱模型的预测性能;反之,主成分数量过多则易引入噪声,引发过拟合,使模型在训练集上表现良好而在独立样本上的预测能力严重劣化[26]。因此,需通过交叉验证方法,以最小化交叉验证均方根误差(root mean square error of cross validation,RMSECV)为评价指标,精准识别预测误差下降趋于平缓的拐点区域,结果见图3,当主因子数为5时,RMSECV值最小为0.472 7。此时,![]() 为0.974
为0.974 ![]() 为0.985 9,可满足建模的要求,其后随主因子数增大,RMSECV随之增大并趋于平缓。因此,最终选择主因子数为5,作为定量参数用于模型的建立。
为0.985 9,可满足建模的要求,其后随主因子数增大,RMSECV随之增大并趋于平缓。因此,最终选择主因子数为5,作为定量参数用于模型的建立。
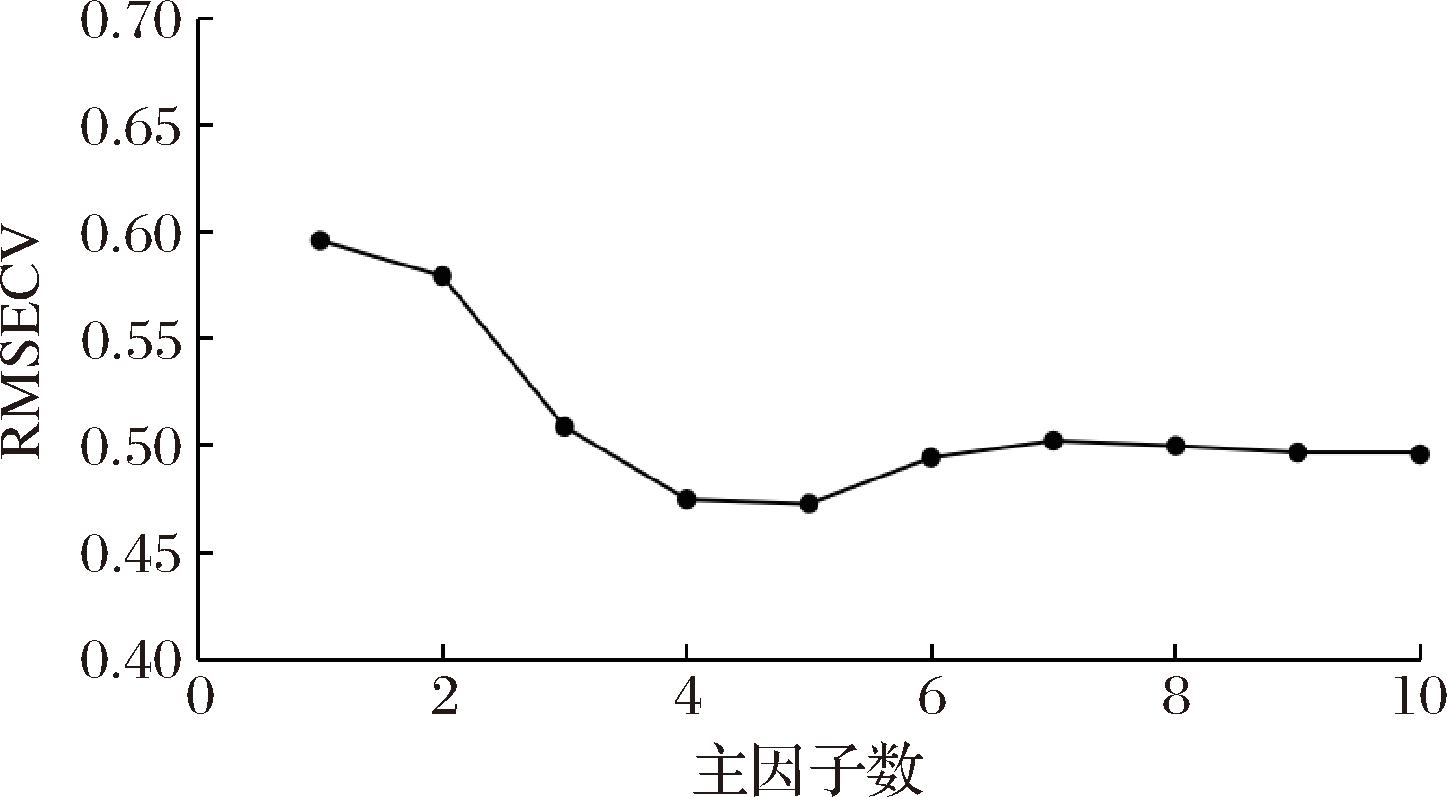
图3 主因子数与RMSECV的关系图
Fig.3 Plot of principal factors with RMSECV
基于筛选确立的PLS最优建模条件,成功建立了刺糖中多糖含量的近红外定量分析模型,如图4所示。所建立模型的![]() 为
为![]() 为0.985 9,RMSEC为0.096 6,RMSEP为0.066 3。图4直观呈现了刺糖中多糖含量的实际测量值与模型预测值之间的相关性。由图4可知,校正集与预测集的数据较为均匀的分布在拟合直线的两侧,且未出现显著偏移离群点。上述分布特征表明,所建近红外定量模型对刺糖多糖含量具有优异的预测精度与可靠性。综上所述,经过FD+SNV预处理的光谱数据结合PLS算法,可实现刺糖中多糖含量的快速准确定量分析。
为0.985 9,RMSEC为0.096 6,RMSEP为0.066 3。图4直观呈现了刺糖中多糖含量的实际测量值与模型预测值之间的相关性。由图4可知,校正集与预测集的数据较为均匀的分布在拟合直线的两侧,且未出现显著偏移离群点。上述分布特征表明,所建近红外定量模型对刺糖多糖含量具有优异的预测精度与可靠性。综上所述,经过FD+SNV预处理的光谱数据结合PLS算法,可实现刺糖中多糖含量的快速准确定量分析。
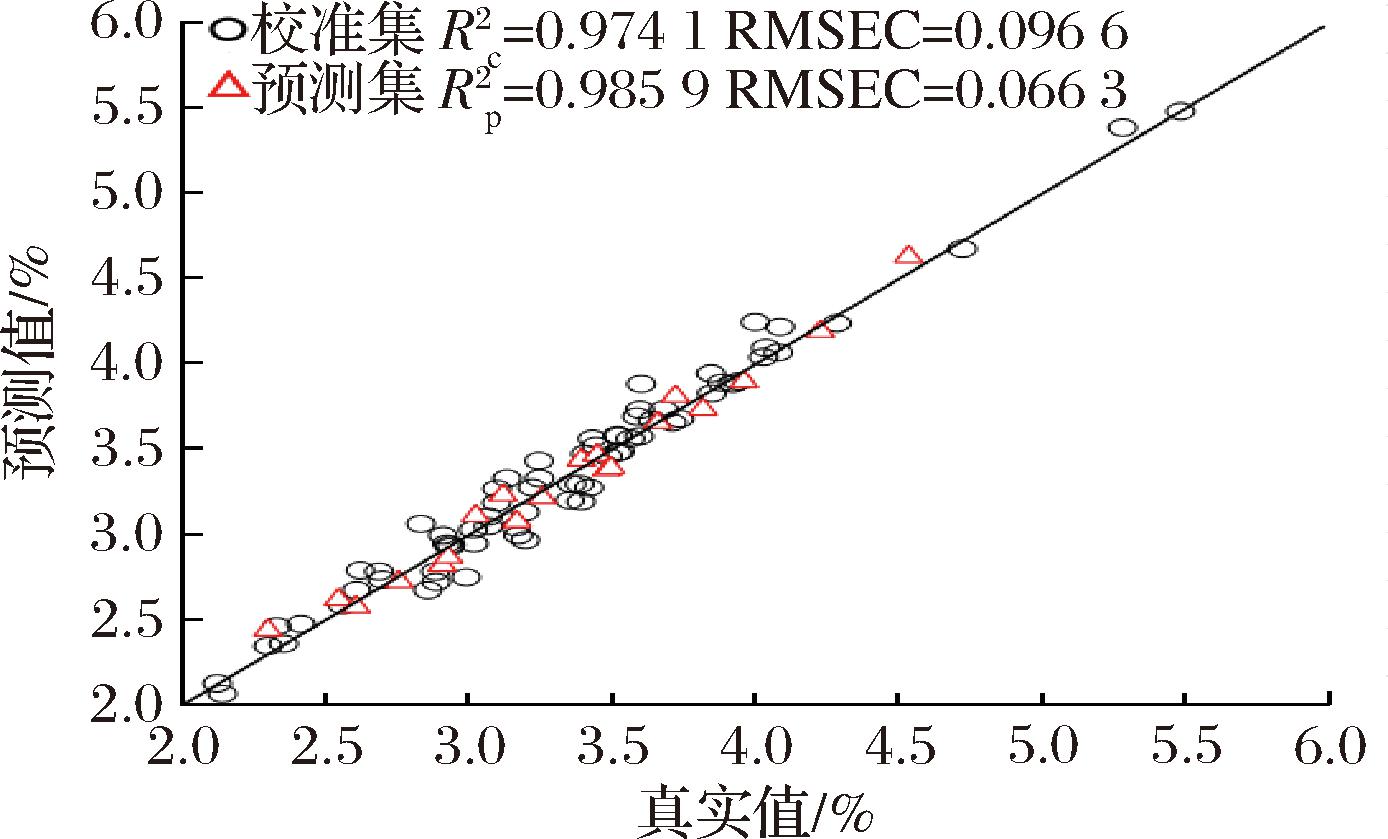
图4 PLS近红外定量分析模型(nc=70,np=20)
Fig.4 The quantitative NIR analysis model in PLS(nc=70,np=20)
为进一步验证模型的准确性,将建模样本集外的完全外部验证集的10组数据分别输入到所建模型中,所得的预测结果如图5所示,样本多糖含量实测值与模型预测值间未出现显著系统性偏差,进一步表明所建立的近红外定量分析模型对刺糖中多糖含量预测,具有较高准确性。经验证,该模型满足定量分析要求,可实现科研与生产应用中刺糖多糖含量的快速检测。
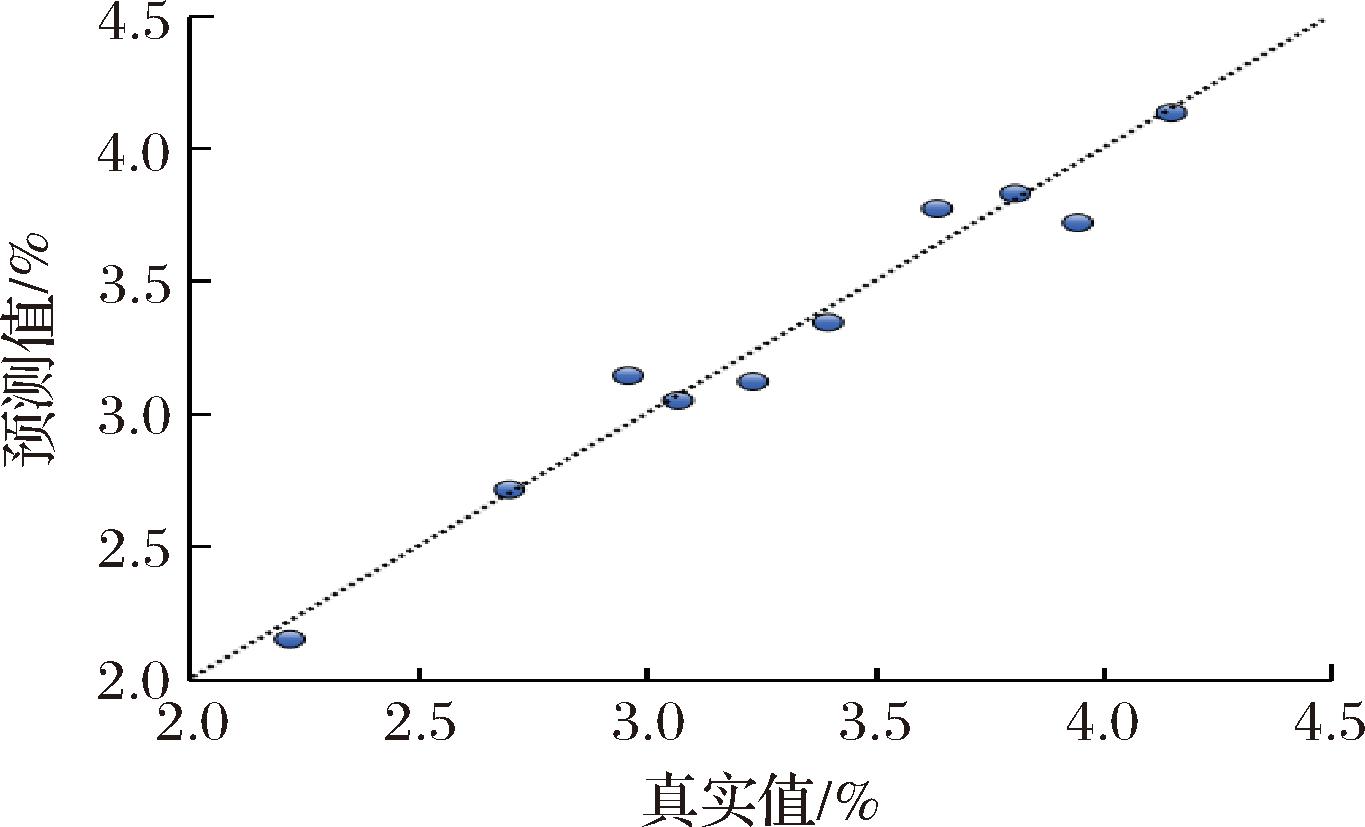
图5 模型验证结果(n=10)
Fig.5 Model validation results(n=10)
本研究采用近红外光谱技术结合偏最小二乘回归算法,成功建立了刺糖多糖含量的快速检测模型。通过对代表性样本进行科学分组及系统优化,确定FD+SNV为最优光谱预处理方法,并精准筛选特征波段(1 100~1 300 nm, 1 350~1 500 nm, 1 600~1 800 nm, 2 000~2 300 nm)与主因子数(5)。结果显示,校正集决定系数![]() 1)与预测集决定系数
1)与预测集决定系数![]() 9)均大于0.9,且RMSEC与RMSEP较小,表明该模型性能优异,具备高度准确性与稳定性,可快速、可靠地测定多糖含量。该技术突破传统苯酚-硫酸法的局限,避免了危化品使用与复杂预处理,显著提升了分析效率、降低成本。基于其快速、准确、安全及操作简便的核心优势,该模型在刺糖相关产业的工业化应用前景广阔,极具潜力转化为在线实时监控、快速分选及过程优化的实用工具。这不仅为完善刺糖质量评价体系与产品开发提供了新的技术支撑,也为其他药材含量测定研究奠定了重要理论基础,并推动产业向高效、智能、绿色方向升级。
9)均大于0.9,且RMSEC与RMSEP较小,表明该模型性能优异,具备高度准确性与稳定性,可快速、可靠地测定多糖含量。该技术突破传统苯酚-硫酸法的局限,避免了危化品使用与复杂预处理,显著提升了分析效率、降低成本。基于其快速、准确、安全及操作简便的核心优势,该模型在刺糖相关产业的工业化应用前景广阔,极具潜力转化为在线实时监控、快速分选及过程优化的实用工具。这不仅为完善刺糖质量评价体系与产品开发提供了新的技术支撑,也为其他药材含量测定研究奠定了重要理论基础,并推动产业向高效、智能、绿色方向升级。
[1] 杨卫星. 新疆常见药用植物实用图谱[M]. 乌鲁木齐: 新疆科学技术出版社, 2006: 63. YANG W X. Practical Atlas of Common Medicinal Plants in Xinjiang[M]. Urumqi: Xinjiang Science and Technology Press, 2006:63.
[2] 尹辉, 张波, 荆瑞雪, 等. 干旱区不同地理种群骆驼刺元素组成及表面结构特征的对比研究[J]. 生态学报, 2019, 39(18):6745-6752.YIN H, ZHANG B, JING R X, et al. Elemental compositions and surface structures of Alhagi sparsifolia Shap. in different geographical populations in arid zone[J]. Acta Ecologica Sinica, 2019, 39(18):6745-6752.
[3] GOWTHAMI R, SHARMA N, PANDEY R, et al. Status and consolidated list of threatened medicinal plants of India[J]. Genetic Resources and Crop Evolution, 2021, 68(6):2235-2263.
[4] SHARAFATMANDRAD M, KHOSRAVI MASHIZI A. Ethnopharmacological study of native medicinal plants and the impact of pastoralism on their loss in arid to semiarid ecosystems of southEastern Iran[J]. Scientific Reports, 2020, 10:15526.
[5] UMAIR M, ALTAF M, BUSSMANN R W, et al. Ethnomedicinal uses of the local flora in Chenab riverine area, Punjab province Pakistan[J]. Journal of Ethnobiology and Ethnomedicine, 2019, 15(1):7.
[6] SHEWEITA S A, MASHALY S, NEWAIRY A A, et al. Changes in oxidative stress and antioxidant enzyme activities in streptozotocin-induced diabetes mellitus in rats: Role of Alhagi maurorum extracts[J]. Oxidative Medicine and Cellular Longevity, 2016, 2016:5264064.
[7] 高霜, 陈章浩, 李进发, 等. 基于肠道菌群探讨刺糖酸性多糖对UC小鼠的影响[J]. 食品与发酵工业, 2025, 51(7):74-81.GAO S, CHEN Z H, LI J F, et al. Effects of Alhagi-honey acid polysaccharide on UC mice based on intestinal flora[J]. Food and Fermentation Industries, 2025, 51(7):74-81.
[8] 陈盈盈, 李杰, 宋建忠, 等. 刺糖多糖脱色脱蛋白工艺及抗氧化活性研究[J]. 化学试剂, 2023, 45(1):46-53.CHEN Y Y, LI J, SONG J Z, et al. Study on decoloration and deproteinization technology and antioxidant activity of spinosad polysaccharide[J]. Chemical Reagents, 2023, 45(1):46-53.
[9] 李杰, 陈盈盈, 王昆, 等. 基于TLR4/MyD88信号通路探讨刺糖多糖对溃疡性结肠炎小鼠的作用及机制[J]. 中药新药与临床药理, 2022, 33(9):1143-1148.LI J, CHEN Y Y, WANG K, et al. Discussion on the effect and mechanism of polysaccharide from Alhagi-honey on ulcerative colitis in mice based on TLR4/MyD88 signaling pathway[J]. Traditional Chinese Drug Research and Clinical Pharmacology, 2022, 33(9):1143-1148.
[10] LIU Y L, ZHOU M Y, YANG M, et al. Pulsatilla chinensis saponins ameliorate inflammation and DSS-induced ulcerative colitis in rats by regulating the composition and diversity of intestinal flora[J]. Frontiers in Cellular and Infection Microbiology, 2021, 11:728929.
[11] LIU S Q, SONG S L, ZHANG Y, et al. Delivery of penetration-enhancing antioxidant polyphenol nanoparticles with Codonopsis pilosula polysaccharide microneedles for synergistic treatment of psoriasis[J]. Carbohydrate Polymers, 2025, 363:123777.
[12] ZHANG T J, HUANG D J, LIU X Y, et al. Antioxidant activity and semi-solid emulsification of a polysaccharide from coffee cherry peel[J]. International Journal of Biological Macromolecules, 2023, 244:125207.
[13] ZHANG Y T, LI J, SUN J, et al. Rapid identification of Vicatia thibetica de boiss and quantitative analysis of the content of six chemical components based on near-infrared spectroscopy[J]. Molecules, 2025, 30(9):1867.
[14] HUA H M, YI Y, LI H L, et al. Monitoring the extraction process of acidic polysaccharides in Poria cocos by near infrared spectroscopy combined with chemometrics[J]. Infrared Physics &Technology, 2021, 113:103613.
[15] 吕悦, 吴杭莎, 韦飞扬, 等. 黄精多指标成分近红外光谱快速定量分析模型建立[J]. 中成药, 2022, 44(9):2878-2884.LYU Y, WU H S, WEI F Y, et al. Model establishment for quantitative analysis of multiple bioactive constituents of Polygonati Rhizoma by near-infrared spectrometry[J]. Chinese Traditional Patent Medicine, 2022, 44(9):2878-2884.
[16] 李珊珊, 张付杰, 李丽霞, 等. 基于近红外光谱技术结合ARO-LSSVR的天麻中有效成分含量快速检测[J]. 食品科学, 2024, 45(4):207-213.LI S S, ZHANG F J, LI L X, et al. Rapid determination of active ingredient contents in rhizoma gastrodiae using near-infrared spectroscopy combined with artificial rabbits optimization-least square support vector regression[J]. Food Science, 2024, 45(4):207-213.
[17] ZHONG L J, FAN Y J, WU Y L, et al. Data fusion strategy for rapid prediction of glyceryl trioleate and polysaccharide content in Ganoderma lucidum spore powder based on near-infrared spectroscopy and hyperspectral imaging[J]. Journal of Food Composition and Analysis, 2025, 141:107403.
[18] WANG Y, TIAN Z P, XIE J J, et al. Rapid determination of polysaccharides in Cistanche tubulosa using near-infrared spectroscopy combined with machine learning[J]. Journal of AOAC International, 2023, 106(4):1118-1125.
[19] 薛忠, 刘德玄, 曹春琪, 等. 基于不确定曲线策略的近红外定量分析丹参酮提取物中丹参酮ⅡA含量[J]. 药物分析杂志, 2023, 43(12):2147-2153.XUE Z, LIU D X, CAO C Q, et al. Determination of tanshinone ⅡA content in tanshinone extract by near infrared spectroscopy based on uncertainty profile strategy[J]. Chinese Journal of Pharmaceutical Analysis, 2023, 43(12):2147-2153.
[20] 李琳, 孙慧慧, 曹荣, 等. 基于近红外光谱技术的南极磷虾品质快速评定[J/OL]. 食品工业科技, 2025:1-12. (2025-04-27). https://link.cnki.net/doi/10.13386/j.issn1002-0306.2024120219. LI L, SUN H H, CAO R, et al. Rapid quality assessment of Antarctic krill based on near-infrared spectroscopy[J/OL]. Science and Technology of Food Industry, 2025:1-12. (2025-04-27). https://link.cnki.net/doi/10.13386/j.issn1002-0306.2024120219.
[21] 黄若冰, 刘易佳, 郭亚勤. 基于近红外光谱技术的电子烟油中多种添加剂含量的快速定量检测研究[J]. 分析测试学报, 2025, 44(6):1196-1201.HUANG R B, LIU Y J, GUO Y Q. Rapid quantitative detection of multiple additives in E-liquids based on near-infrared spectroscopy technology[J]. Journal of Instrumental Analysis, 2025, 44(6):1196-1201.
[22] ESPA A-FARI
A-FARI AS M P, CAZ
AS M P, CAZ N P, URQUIJO-ZAMORA L, et al. Application of near infrared spectroscopy combined with chemometrics to authenticate local cultivar flour content in the production of protected geographical indication “Galician bread”[J]. Food Control, 2025, 176:111409.
N P, URQUIJO-ZAMORA L, et al. Application of near infrared spectroscopy combined with chemometrics to authenticate local cultivar flour content in the production of protected geographical indication “Galician bread”[J]. Food Control, 2025, 176:111409.
[23] 占可, 陈季旺, 徐言, 等. 基于近红外光谱特征的冷冻小龙虾鲜度快速检测方法[J]. 食品科学, 2024, 45(2):299-307.ZHAN K, CHEN J W, XU Y, et al. A rapid detection method for freshness of frozen crayfish based on near-infrared spectroscopy[J]. Food Science, 2024, 45(2):299-307.
[24] IZIDORO M, PEDROSA V M D, SPRICIGO P C, et al. Feasibility of near-infrared spectroscopy as a tool to estimate carotenoid content in ‘IAC Rurik’ specialty potato cultivar[J]. Journal of Food Composition and Analysis, 2025, 139:107130.
[25] 杨唯瀚, 郝经文, 黄和平, 等. 近红外漫反射光谱法快速测定蕨菜多糖含量的研究[J]. 中国现代应用药学, 2023, 40(5):597-602.YANG W H, HAO J W, HUANG H P, et al. Rapid determination of polysaccharide in Pteridium aquilinum by near infrared diffuse reflectance spectroscopy[J]. Chinese Journal of Modern Applied Pharmacy, 2023, 40(5):597-602.
[26] XIAO Y X, LI C, JIN C, et al. Detection of soluble solid content in citrus fruit using near-infrared spectroscopy with machine learning regression: An exploration of the influence of sampling positions[J]. Journal of Food Composition and Analysis, 2025, 142:107554.