食源性致病菌是指通过食物传播并引发人类疾病的一大类细菌性微生物。其主要通过侵染食品或者水源,最终通过人类口腔摄入进入体内,导致食物中毒甚至造成严重的食源性疾病。近5年,由食源性致病菌造成的食品中毒事件层出不穷,对人类身体健康造成了严重威胁。根据世界卫生组织(World Health Organization,WHO)公布的统计数据,全球范围内每年有约6亿人次因为食用食源性致病菌污染的食品而感染食源性疾病,并导致42万人死亡[1]。据食源性疾病监测网统计,我国食源性疾病平均每年暴发3 572起,发病人数25 452人,死亡129人[2]。食品源性疾病已成为影响食品安全与人类健康的一个重大隐患。
食源性致病菌种类众多,目前已经确认有31种病原菌会引发食源性疾病[3]。其中,常见的食源性致病菌包括大肠杆菌(Escherichia coli)、沙门氏菌(Salmonella)、金黄色葡萄球菌(Staphylococcus aureus)、阪崎肠杆菌(Enterobacter sakazakii)、副溶血性弧菌(Vibrio parahaemolyticus)、铜绿假单胞菌(Pseudomonas aeruginosa)等[4]。由于不同的食源性致病菌的生存条件和作用机制不同,所以人们感染食源性致病菌后的症状也不尽相同,总体症状主要包括恶心、呕吐、腹泻、腹部不适以及体温升高等,病情严重时可能会引发身体脱水、休克状态乃至威胁生命[5]。
随经济发展和食品产业扩张,食品安全监管,尤其是致病菌检测控制更显重要。截至目前,在食品安全领域针对食源性致病菌的检测方法主要包括平板培养法、分子生物学技术和免疫学技术[6]。免疫分析法因快速、灵敏、特异,在食源性致病菌检测中潜力较大。纳米抗体作为新型抗体,具有稳定性好、特异强、生产成本低等优势,在免疫分析中具有广阔的应用前景。如图1所示,2010—2024年,基于纳米抗体的免疫分析研究论文发表数量不断增加,已成为免疫检测领域研究的新热点。

图1 2010—2024年基于纳米抗体的免疫分析研究论文发表数量统计
Fig.1 Number of research papers published on nanobody-based immunoassays from 2010 to 2024
注:检索数据库:Pubmed;检索关键词:Nanobody、Immunoassay、纳米抗体、免疫分析。
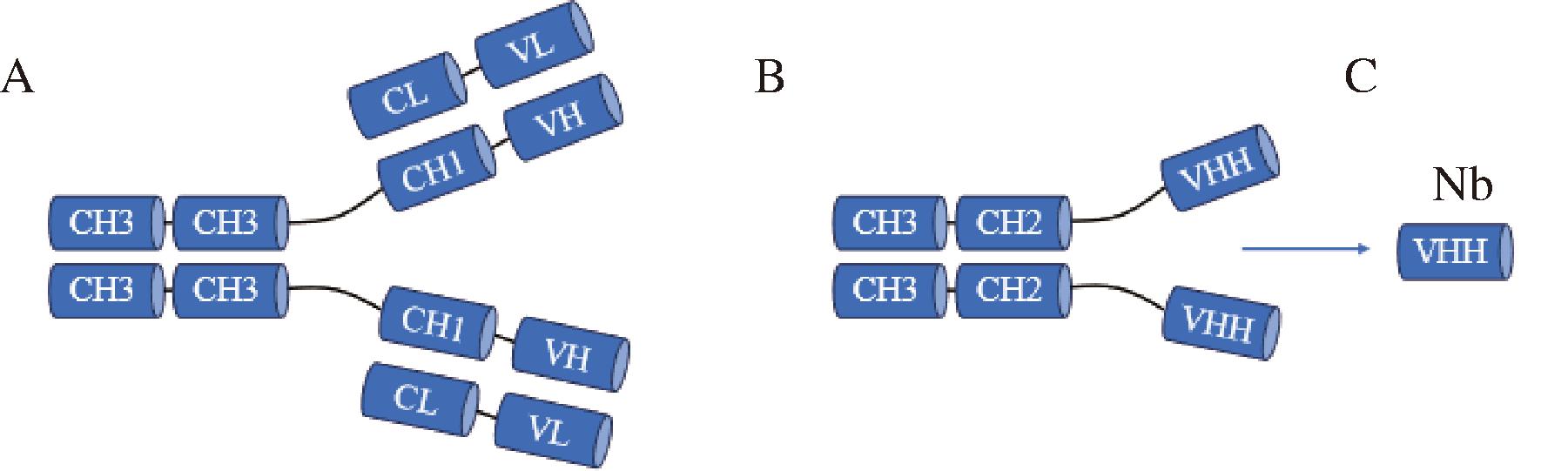
A-传统抗体;B-重链抗体;C-纳米抗体
图2 抗体结构示意图
Fig.2 Schematic diagram of antibody structure
注:CH3:重链恒定区3(constant domain 3 of heavy chain);CH2:重链恒定区2(constant domain 2 of heavy chain);CH1:重链恒定区1(constant domain 1 of heavy chain);CL:轻链恒定区(Constant domain of Light chain)。

图3 VH与VHH结构对比示意图
Fig.3 Comparison of VH and VHH structure
本文主要综述了纳米抗体的基本特点以及基于纳米抗体的食源性致病菌免疫检测方法的最新研究进展,并分析了纳米抗体在实际应用中的优缺点,对未来发展进行了展望,旨在为纳米抗体在食源性致病菌检测中的研究与应用提供参考。
1 纳米抗体简介
1.1 纳米抗体的发现
传统抗体(Immunoglobulin G,IgG)通常是由2条重链(H链)和2条轻链(L链)组成,H链折叠成4个结构域,而L链包括2个结构域,H链和L链的N端结构域的序列随着抗体的种类的不同而改变,称为抗体的重链可变区(variable region of heavy chain,VH)和轻链可变区(variable region of light chain,VL)[7]。1993年,比利时科学家HAMERS-CASTERMAN在骆驼科动物的血清中提取出仅由2条重链组成的同源二聚体,这种特殊结构的抗体被命名为重链抗体[8-10]。这些天然缺失轻链和重链恒定区CH1重链抗体,同传统抗体一样拥有完整的抗体识别功能[11],其抗原识别区域主要位于重链可变区。在此基础上,研究人员通过基因工程技术克隆表达得到了仅含有重链可变区的单域抗体[12],并将其命名为VHH抗体,即重链抗体重链可变区(variable domain of heavy chain of heavy-chain,VHH),或者纳米抗体(nanobody,Nb)。
1.2 纳米抗体的结构和特性
纳米抗体外形呈椭圆,分子质量约为15 kDa,仅为传统抗体分子质量的十分之一左右。内部结构包括4个骨架区(framework region,FR)和3个互补决定区(complementarity determiningregion,CDR)[13]。由互补结构区构成的三维结构决定了纳米抗体识别抗原的能力大小,其中,CDR3对提供抗原识别位点起到了主导作用。纳米抗体的可变区相较于传统抗体延伸区域更大、体积更小而且CDR形成的三维结构的大凸环能够深入结合传统抗体难以接近或阻塞的抗原结合区域。基于此特性,研究人员通过实验发现即使某些抗原结合位点被靶蛋白包裹隐藏后,纳米抗体依旧可以有效识别,而普通抗体不具备这样的识别能力[14]。纳米抗体的4个骨架区主要起到了提高了纳米抗体的稳定性和水溶性的作用,位于纳米抗体FR2骨架区域的4个亲水性氨基酸(Phe 37、Glu 44、Arg 45、Gly 47)取代了原有的疏水性氨基酸(Val 37、Gly 44、Leu 45、Trp 47),大大提高了纳米抗体的亲水性和稳定性[15]。基于纳米抗体优良的水溶性与穿透性,生物医学领域研发多项纳米抗体的药物,能有效穿过细胞屏障来医治癌症等疾病[16]。除此之外,纳米抗体骨架区中存在的保守二硫键和互补决定区之间形成的额外二硫键,2种二硫键的存在极大提高了CDR3区凸性结构的稳定性。张翠[17]通过差示扫描量热仪(differential scanning calorimeter,DSC)和间接酶联免疫吸附法(enzyme-linked immunosorbent assay method,ELISA)共同验证评估纳米抗体的热稳定性,发现即使在95 ℃高温下,纳米抗体仍然具有65%的生物活性,显著优于普通抗体的稳定性。纳米抗体的CDR3区域还可以和CDR1、FR2间形成一条二硫键,用于优化抗原识别位点的拓扑结构,同时促进CDR3朝向抗原的方向。因此,纳米抗体具有更强的抗原结合能力[18]。此外,由于纳米抗体的单域结构,与传统抗体相比结构更加简单且分子质量小,使得纳米抗体可以在较短周期内在大肠杆菌、酵母菌等表达体系中大批量表达,极大节约了工业生产过程中的成本、时间等资源。
2 纳米抗体的筛选与表达
2.1 纳米抗体的筛选
纳米抗体可以通过天然抗体库、免疫抗体库和合成抗体库[19]筛选获得。常用的体外展示筛选技术包括:噬菌体展示技术、酵母展示技术、mRNA展示技术等。
噬菌体展示技术的核心机制在于,将外源性蛋白质的DNA片段嵌入噬菌体外壳蛋白的基因序列中,随着外壳蛋白的合成,外源基因所编码的蛋白质也会同步表达,并与外壳蛋白融合,进而展示在噬菌体的表层[20]。这种展示方式确保了被展示的蛋白质或多肽能够维持其特有的空间构象和生物活性,为后续的筛选工作奠定了坚实基础[21]。基于噬菌体展示技术,研究人员已成功获得众多食品危害因子的纳米抗体,包括农药残留[22-24]、真菌毒素[25-27]、过敏原[28]等。
随着生物技术的不断发展,其中以酵母表面展示(yeast surface display,YSD)技术为代表的真核表达平台展现出显著优势[29]。该技术以酵母细胞作为理想宿主,已成功应用于多个工业菌株体系,包括:酿酒酵母(Saccharomyces cerevisiae)H型菌株、毕赤酵母(Pichia pastoris)R系列菌株等菌株[30],其中酿酒酵母展示体系已建立标准化的操作流程。从细胞结构层面分析,酵母细胞壁呈现典型双层超微结构:内层由β-1,3-葡聚糖网络构成结构骨架,外层则由甘露糖蛋白复合物形成功能界面。关键功能蛋白α-agglutinin分子包含特征性锚定结构域,该二聚体为由Aga1p核心亚基与Aga2p结合亚基共同组成的复合体。在分子工程实践中,通过基因工程手段将VHH片段与外源蛋白融合后导入酵母细胞,经诱导表达后,GPI锚定系统(glycosylphosphatidylinositol anchoring system)可将重组蛋白精准定位至细胞壁特定区域[31]。该过程涉及Aga2p亚基N/C末端融合位点的选择性修饰,通过二硫键介导的亚基共价连接机制,最终在信号肽引导的分泌通路作用下实现纳米抗体(nanobodies,Nbs)在细胞表面的定向锚定[32]。该技术平台具有双重生物加工优势:其一,真核表达系统特有的蛋白翻译后修饰功能(包括三维结构折叠调控和特异性糖基化修饰)显著提升异源蛋白的活性;其二,结合流式细胞分选技术(fluorescence-activated cell sorting,FACS)建立的高通量筛选体系,可实现对高亲和力、高稳定性纳米抗体的定向进化筛选[33]。这种技术融合策略为抗体工程领域提供了革命性的研究工具。MEI等[34]通过构建酵母展示纳米抗体合成文库,筛选获得18种金黄色葡萄球菌凝集因子A的特异性纳米抗体,均展现出较高亲和活性[EC50 (1.1±0.1)~(4.8±0.3) nmol/L]。
mRNA展示技术作为一种体外筛选手段,相较于体内展示筛选纳米抗体而言,在一定程度上规避了转化效率的限制,展现出独特的优势[35]。其核心机制在于,通过共价连接的方式,将特定的核酸序列直接与其编码的蛋白质产物相联结,构建出mRNA-蛋白质融合物。首先,从dsDNA文库中获取的序列在体外被转录成mRNA;随后,模拟tRNA氨基酰基作用的嘌呤霉素连接子介入核糖体的A位点,通过阻断常规的蛋白质合成途径,促使mRNA的3′末端与新生肽链的羧基末端以共价键相连[36]。随着肽键的连续形成,多肽链得以延伸,最终生成mRNA-蛋白质融合体,巧妙地将遗传信息(基因型)与生物功能(表型)融为一体[37]。在获得mRNA-蛋白质融合体后,研究者利用特定的标签进行纯化,随后通过反转录步骤,将这些融合体转换成cDNA-mRNA-蛋白质复合结构。接下来,这些复合结构被引入覆盖有抗原的固定支持物表面,经过洗涤步骤去除未发生特异性结合的成分。之后,将牢固结合的特异性复合体从固定相中释放,并利用酶处理使cDNA与融合体分离,再通过聚合酶链反应(polymerase chain reaction,PCR)扩增相应的基因片段。最后,经过TA克隆技术处理,对筛选出的序列进行深入分析。KANG等[38]基于上述展示技术,成功筛选出线粒体解偶联蛋白的特异性纳米抗体,并利用冷冻电镜技术成功解析了其高分辨率三维空间构象。
2.2 纳米抗体的表达
目前,纳米抗体的表达主要基于大肠杆菌与酵母两大类表达系统。其中,大肠杆菌表达系统具有操作便捷性、经济成本低以及高产量等优势,已成为一种高度成熟的表达平台。
大肠杆菌的细胞周质空间,作为菌体内独有的氧化环境区域,同时含有丰富的折叠辅助因子(如Dsb家族异构酶),已成为表达含有特定二硫键的纳米抗体的理想选择,在这种环境下,纳米抗体能够实现高效表达,据研究表明,现有的周质表达策略可使纳米抗体的产量高达10 mg/L[39],并且,通过标记细胞周质间隙中二硫键的形成,可以使得从细胞周质提取物中分离纯化纳米抗体变得相对简便[40]。
对于无法有效分泌至周质的纳米抗体,常以无活性包涵体形式存在,需通过尿素梯度透析等复性工艺恢复其天然构象,而胞质内固有的硫氧还蛋白-谷胱甘肽氧化还原系统在还原过程中发挥关键作用。值得注意的是,通过基因工程手段改造大肠杆菌的胞质氧化还原平衡,可定向增强胞质折叠能力,实现包涵体纳米抗体的高效复原性[41-42]。
针对大肠杆菌表达系统可以采用高密度发酵专用培养基(如EnPresso、TB)替代传统LB培养基,结合优化后的诱导温度、振荡速率及异丙基-β-D-硫代半乳糖苷(isopropyl-β-D-thiogalactopyranoside,IPTG)浓度梯度,可使VHH表达量提升5~10倍[43]。此外,融合多组纯化标签(如His-tag与SUMO标签)并采用串联层析技术,可同步提升目标蛋白的捕获效率与终产物纯度[44]。然而,对于需要功能化修饰的纳米抗体,大肠杆菌表达系统无法进行翻译后修饰;此外,大肠杆菌产生的内毒素(脂多糖)在医疗应用中存在严格限制。
毕赤酵母表达系统因其不积累有害的乙醇、内源性蛋白分泌量极低,并且毕赤酵母表达的蛋白质糖基化模式与哺乳动物细胞相近,从而有效降低了免疫原性,是最常用的真核表达系统之一。毕赤酵母表达的纳米抗体在临床治疗领域得到了广泛应用[45-46]。FRENKEN等[47]开创性地利用了毕赤酵母系统来表达纳米抗体,并成功地生产出了2种针对黏蛋白MUC1的纳米抗体。通过引入诱导剂以及一系列的条件优化措施,成功将这些纳米抗体的产量提升至10~15 mg/L,但与大肠杆菌相比仍存在有高密度发酵周期较长、规模化成本较高的问题,可以通过基因编辑改造酵母碳代谢途径,增强对廉价碳源(如甘油、木糖)的利用效率从而达到提升菌株生长效率节约成本的目的。
除此之外,纳米抗体表达还可通过哺乳动物细胞表达系统、昆虫细胞表达系统以及植物细胞表达系统等多种表达系统,这些表达系统因具备不同的优缺点,并在商业化应用领域中展现出不同的前景与潜力。哺乳动物细胞因其高效生产治疗性重组蛋白的能力而备受关注,Thompson实验室首先在其原始的CHO细胞系基础上,成功分离并培育出了CHO-S细胞株。随后,Gibco公司接手并进一步改良了这一细胞株,通过驯化使其不仅具备了快速的生长能力,还显著提升了转染效率,同时实现了在无血清的CD CHO培养基中的悬浮生长。这一改进后的细胞株在早期阶段,经常被广泛应用于重组蛋白的瞬时表达过程中[48-49]。
植物细胞表达系统是一种利用植物细胞作为生产外源蛋白(如疫苗、抗体、酶等)的技术。其核心是通过基因工程技术将目标基因导入植物细胞,利用植物的天然代谢机制实现目标蛋白的表达、翻译后修饰和积累。VANMARSENILLE等[50]将弯曲杆菌纳米抗体与鸡IgA和IgY的恒定结构域(Fc)融合构建重组蛋白,并在本氏烟草的叶片和拟南芥种子中进行表达生产,结果显示,纳米抗体重组蛋白在种子中的产量约占可溶性总蛋白的1%~8%。
3 纳米抗体在食源性致病菌检测中的应用
纳米抗体凭借其分子质量小、稳定性强等优势,可作为新型生物探针用于食品致病菌检测,通过与量子点标记、侧向层析等技术结合,可显著提升对沙门氏菌、金黄色葡萄球菌、阪崎肠杆菌等目标菌的检测灵敏度,为食品安全现场筛查提供便携化解决方案(表1)。
表1 纳米抗体技术在食源性致病菌监测中的研究应用进展总结
Table 1 Research progress in the application of nanobody technology in the monitoring of foodborne pathogenic bacteria
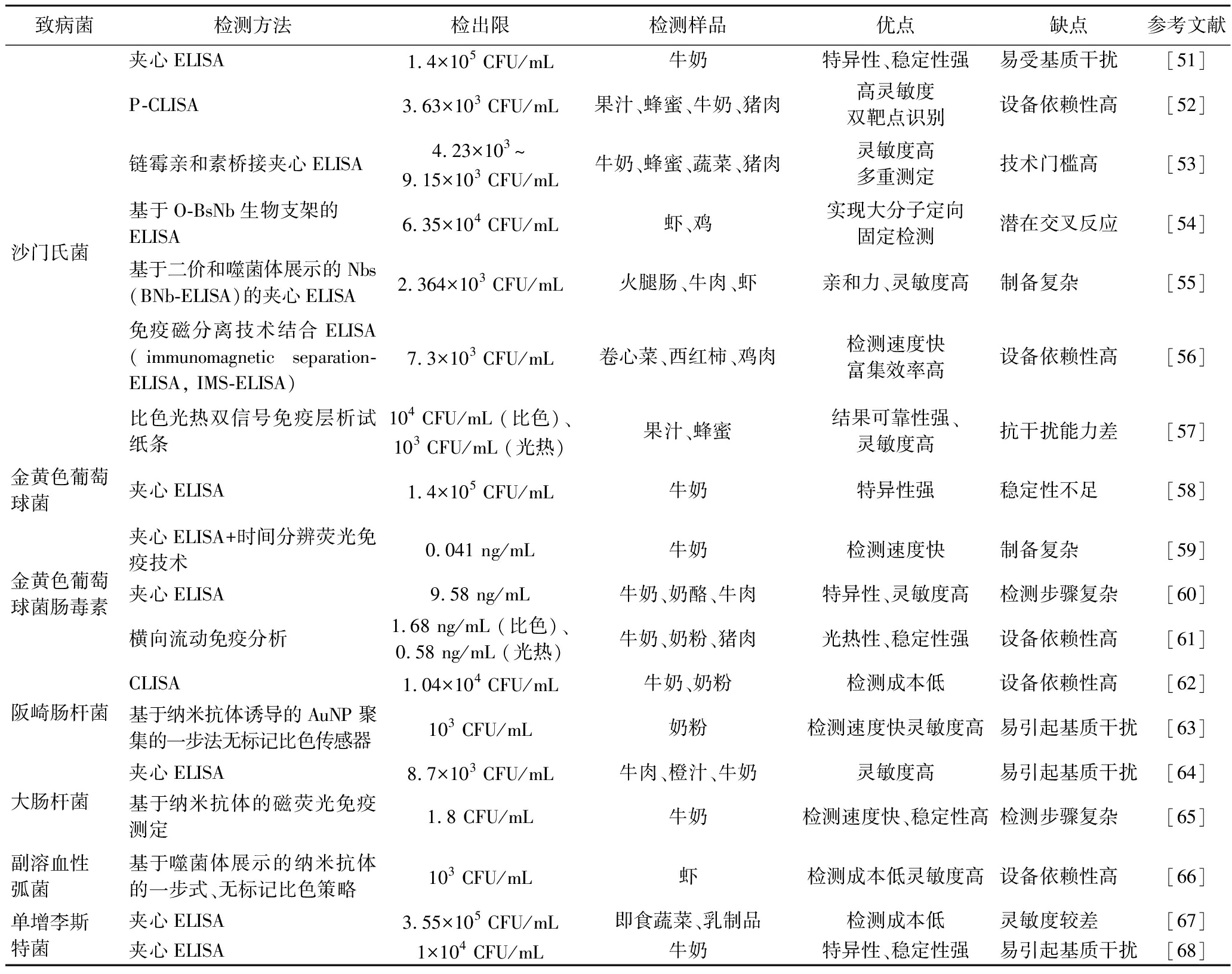
致病菌检测方法检出限检测样品优点缺点参考文献沙门氏菌夹心ELISA1.4×105 CFU/mL牛奶特异性、稳定性强易受基质干扰[51]P-CLISA3.63×103 CFU/mL果汁、蜂蜜、牛奶、猪肉高灵敏度双靶点识别设备依赖性高[52]链霉亲和素桥接夹心ELISA4.23×103~9.15×103 CFU/mL牛奶、蜂蜜、蔬菜、猪肉灵敏度高多重测定技术门槛高[53]基于O-BsNb生物支架的ELISA6.35×104 CFU/mL虾、鸡实现大分子定向固定检测潜在交叉反应[54]基于二价和噬菌体展示的Nbs(BNb-ELISA)的夹心ELISA2.364×103 CFU/mL火腿肠、牛肉、虾亲和力、灵敏度高制备复杂[55]免疫磁分离技术结合ELISA(immunomagnetic separation-ELISA, IMS-ELISA)7.3×103 CFU/mL卷心菜、西红柿、鸡肉检测速度快富集效率高设备依赖性高[56]比色光热双信号免疫层析试纸条104 CFU/mL (比色)、103 CFU/mL (光热)果汁、蜂蜜结果可靠性强、灵敏度高抗干扰能力差[57] 金黄色葡萄球菌夹心ELISA1.4×105 CFU/mL牛奶特异性强稳定性不足[58]金黄色葡萄球菌肠毒素夹心ELISA+时间分辨荧光免疫技术0.041 ng/mL牛奶检测速度快制备复杂[59]夹心ELISA9.58 ng/mL牛奶、奶酪、牛肉特异性、灵敏度高检测步骤复杂[60]横向流动免疫分析1.68 ng/mL (比色)、0.58 ng/mL (光热)牛奶、奶粉、猪肉光热性、稳定性强设备依赖性高[61]阪崎肠杆菌CLISA1.04×104 CFU/mL牛奶、奶粉检测成本低设备依赖性高[62]基于纳米抗体诱导的AuNP聚集的一步法无标记比色传感器103 CFU/mL奶粉检测速度快灵敏度高易引起基质干扰[63]大肠杆菌夹心ELISA8.7×103 CFU/mL牛肉、橙汁、牛奶灵敏度高易引起基质干扰[64]基于纳米抗体的磁荧光免疫测定1.8 CFU/mL牛奶检测速度快、稳定性高检测步骤复杂[65]副溶血性弧菌基于噬菌体展示的纳米抗体的一步式、无标记比色策略103 CFU/mL虾检测成本低灵敏度高设备依赖性高[66]单增李斯特菌夹心ELISA3.55×105 CFU/mL即食蔬菜、乳制品检测成本低灵敏度较差[67]夹心ELISA1×104 CFU/mL牛奶特异性、稳定性强易引起基质干扰[68]
3.1 纳米抗体在沙门氏菌检测中的应用
沙门氏菌作为一种分布广泛的食源性致病菌,能够导致感染性腹泻、肠胃炎等多种临床病症。其危害性已被WHO高度关注,被列为具有严重危害的、通过食源性途径传播的致病菌[69]。因此,建立针对沙门氏菌的特异性高灵敏检测方法具有重要意义。HE等[51]通过免疫骆驼,构建噬菌体展示纳米抗体文库,经生物淘选,首次成功分离出3种沙门氏菌特异性纳米抗体,具有良好的热稳定性及高特异性。以多克隆抗体为捕获抗体,纳米抗体为检测抗体,研发了一种检测肠炎沙门氏菌的夹心ELISA,检测灵敏度可达1.4×105 CFU/mL。为了实现双纳米抗体免疫分析方法的建立,ZHANG等[52]以噬菌体为介导构建了一种噬菌体介导的双纳米抗体夹心化学发光酶免疫分析(chemiluminescence enzyme immunoassay,P-CLISA)用于鼠伤寒沙门氏菌检测(图4-A),检出限达到了3.63×103 CFU/mL。

A-基于噬菌体介导的双纳米抗体夹心 P-CLISA[52];B-基于链霉亲和素桥连的夹心ELISA[53];C-基于双价纳米抗体的增强型夹心免疫测定法[55];D-比色/光热双模式免疫层析试纸条[57]
图4 基于纳米抗体的沙门氏菌快速检测方法原理图
Fig.4 Schematic diagram of nanobody-based rapid detection method of Salmonella
注:Luminol:3-氨基邻苯二甲酰肼(3-aminophthalhydrazide);phage:噬菌体;streptavidin:链霉亲和素;biotinylated:生物素化的;Reconstruction:重建;Sandwich:三明治结构;Monovalent:单价的;Bivalent:二价的;Laser:激光;Thermal Detector:热探测器;probes:探针;TMB:3,3′,5,5′-四甲基联苯胺(3,3′,5,5′-tetramethylbenzidine);anti-M13-HRP:辣根过氧化物酶标记的抗M13抗体(anti-M13 horseradish peroxidase conjugate)。
由于纳米抗体体积小,采用物理吸附的方式将其固定在固相载体上容易造成活性位点被掩盖问题,导致抗体活性下降。针对这一问题,研究人员通过抗体定向固定[70-71]、构建多价纳米抗体[72-73]等方式提高抗体固定效率与检测灵敏度。REN等[53]采用链霉亲和素-生物素为桥连,将纳米抗体定向固定到酶标板上,显著提高了沙门氏菌免疫分析方法的灵敏度(图4-B)。WANG等[54]开发了一种具有双重靶向能力的双特异性纳米抗体(BsNb),该抗体能够特异性识别沙门氏菌与副溶血性弧菌,通过生物体介导实现纳米抗体的定向固定。相较于物理吸附,该方法的检测灵敏度提高了13.4倍。构建多价纳米抗体是提高纳米抗体结合效率与活性的重要方式。LIAO等[55]采用基因工程手段构建了沙门氏菌双价纳米抗体与铁蛋白纳米抗体,亲和活性提高了2个数量级(图4-C)。
目前,基于纳米抗体的沙门氏菌酶联免疫分析方法有诸多研究,然而相关免疫层析技术报道较少。ZHANG等[57]以沙门氏菌多克隆抗体为检测线(C线),将纳米抗体与MnO2修饰的Au纳米花为检测探针,建立了一种鼠伤寒沙门氏菌比色/光热双模式免疫层析试纸条,该方法的比色检测限为104 CFU/mL,光热检测限为103 CFU/mL,在实际样品中的检测回收率为79.4%~117.4%(图4-D)。
尽管纳米抗体在沙门氏菌检测中展现出独特优势,但其在实际应用中仍存在一定的局限性。单价纳米抗体的亲和力通常低于传统单克隆抗体(如IgG),可能导致检测灵敏度受限。苑懿等[74]基于单克隆抗体的比色型生物传感器方法对沙门氏菌的检测限可达102 CFU/mL以下,而现有纳米抗体体系尽管通过多价构建或信号放大技术可提升1~2个数量级,但仍需复杂工程化改造。未来研究需在保持纳米抗体高表达效率的同时提升其固有亲和力,并开发更稳定的标记体系以充分发挥其技术潜力。
3.2 纳米抗体在金黄色葡萄球菌及肠毒素检测中的应用
作为一种在全球范围内普遍存在的食源性致病菌,金黄色葡萄球菌已被公认为是对人类健康构成重大威胁的主要食源性致病菌之一。在条件适宜的情况下,这种病菌能够迅速增殖,并产生一系列对人体有害的毒素,包括金黄色葡萄球菌肠毒素A(staphylococcal enterotoxin A,SEA)、金黄色葡萄球菌B型肠毒素(staphylococcal enterotoxin B,SEB)、金黄色葡萄球菌肠毒素C(staphylococcal Enterotoxin C,SEC)、金黄色葡萄球菌肠毒素D(staphylococcal Enterotoxin D,SED)等[75]。由于金黄色葡萄球菌表面含有蛋白A,能够与传统单克隆或多克隆抗体的Fc片段产生非特异性结合,使得基于传统抗体的金黄色葡萄球菌免疫分析方法特异性下降,易产生假阳性结果。针对这一问题,孙颖[58]基于噬菌体展示技术,制备了4种金黄色葡萄球菌特异性纳米抗体,以纳米抗体Nb147为捕获抗体,生物素化纳米抗体Bio-Nb147为检测抗体,研发了一种检测金黄色葡萄球菌的双抗体夹心ELISA方法,其最低检测限达到了1.4×105 CFU/mL,以脱脂牛奶为实际样品进行的加标回收实验中,回收率为97%~110%,为食品中金黄色葡萄球菌快速检测提供了新方法。
金黄色葡萄球菌肠毒素是由金黄色葡萄球菌分泌的一类具有超抗原活性的外毒素,是引起食物中毒的重要病原因子。肠毒素具有耐高温和蛋白酶的特性,使其在食品加工中难以灭活,极微量(ng级)即可引发呕吐、腹泻等中毒症状,严重时危及生命。因此,建立快速、灵敏、特异的检测方法对食品安全监管和临床诊断至关重要。目前,针对SEA、SEB、SEC均已研制出特异性纳米抗体,并建立了相应的免疫分析方法。ZHANG等[76]筛选获得6种SEA特异性纳米抗体,在此基础上构建了纳米抗体-辣根过氧化物酶双功能蛋白(SEA33-vHRP),以纳米抗体SEA18为捕获抗体,SEA33-vHRP为检测抗体,建立了一种化学发光/荧光双模式免疫分析方法,检出限分别为0.09、0.40 ng/mL(图5)。唐丽[59]基于纳米抗体构建了一种时间分辨免疫层析方法,对SEB检测能力显著提升,其检测限低至0.041 ng/mL,最低定量限为0.302 ng/mL。季艳伟等[77]成功研发出一种特异性识别SEB和SEC的纳米抗体BC16,可同时靶向SEB和SEC的保守表位,BC16的独特设计显著降低了传统单克隆抗体的交叉反应风险。
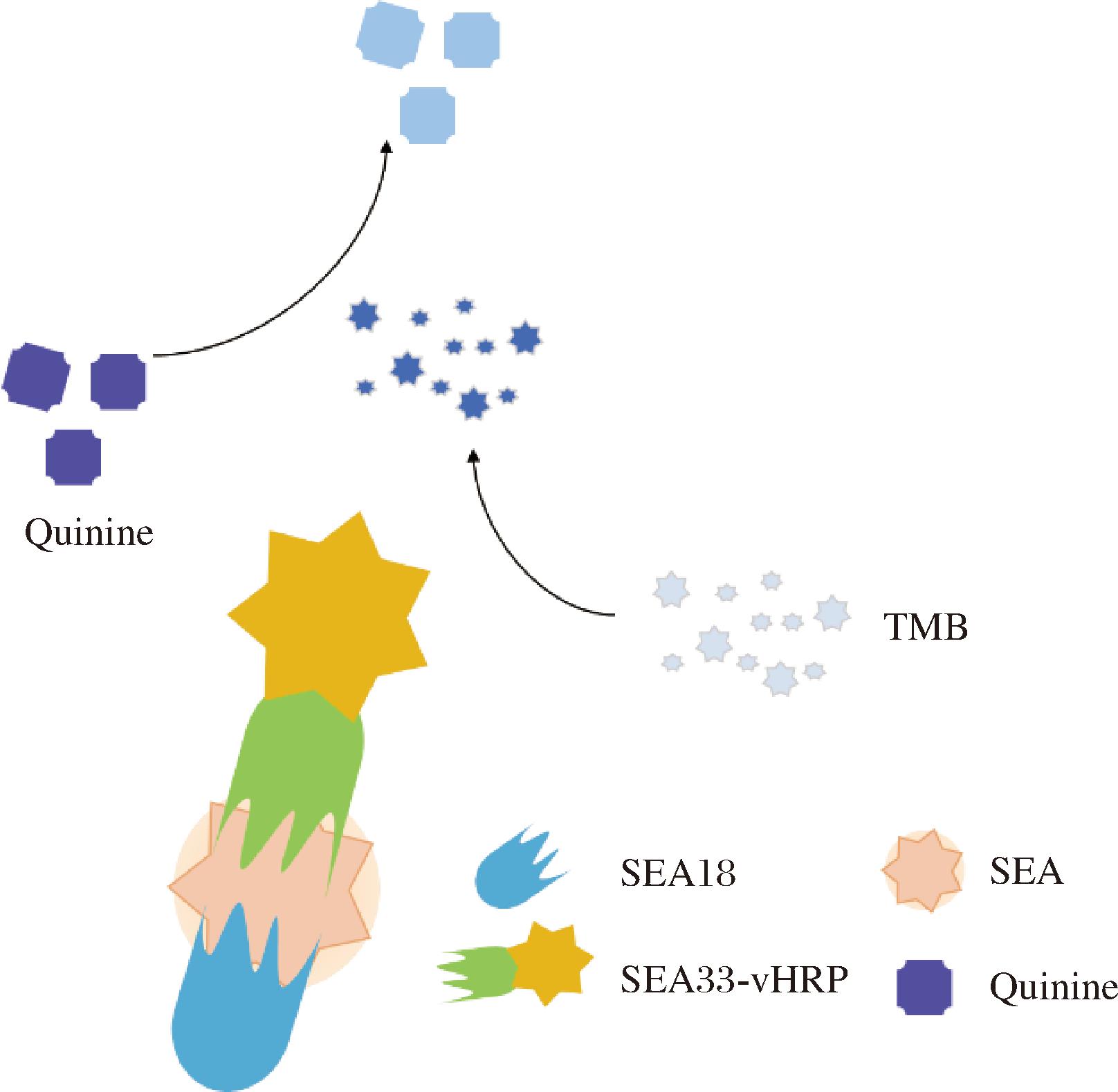
图5 基于纳米抗体的化学发光/荧光双模式免疫分析方法检测肠毒素原理图[76]
Fig.5 Schematic diagram of a nanobody-based chemiluminescence/fluorescence dual-mode immunoassay method[76]
此外,纳米抗体在肠毒素的中和方面也具有潜在的研究与应用价值。HUGHES等[78]制备了16种SEB纳米抗体,其中11种能够中和SEB的超抗原活性,有效抑制人体PBMC细胞中IL-2的表达。
3.3 纳米抗体在阪崎肠杆菌检测中的应用
阪崎肠杆菌(克罗诺杆菌属)是一种兼性厌氧革兰氏阴性菌,是新生儿脑膜炎、菌血病和小肠结肠炎等疾病的重要病原体,死亡率高达50%以上,易污染婴儿配方奶粉,对婴幼儿生命健康造成严重威胁[79]。因此,建立阪崎肠杆菌快速检测方法能及时阻断污染源,降低感染风险,对保障食品安全具有重要意义。ZHANG等[62]从免疫文库中淘选获得7种阪崎肠杆菌特异性纳米抗体,并建立了噬菌体介导的CLISA,检测限为1.04×104 CFU/mL,在乳制品样本中的添加回收率为98.15%~114.63%,证明了该方法的有效性和准确性。基于纳米抗体诱导的金纳米粒子(AuNP)聚集现象,CHEN等[63]开创性地建立了一种阪崎肠杆菌比色传感器,该方法的核心在于纳米抗体诱导AuNP聚集,而靶细菌的存在会抑制这种聚集。同时目标菌的浓度与目标聚集抑制程度呈正相关,这一变化引起反应溶液颜色和吸光度发生变化。在最优实验条件下,该传感器对阪崎肠杆菌的肉眼检测限为103 CFU/mL,并且在20 min内即可实现136 CFU/mL的定量检测。该方法突破了致病菌免疫分析法需要配对抗体的局限,仅利用一种纳米抗体即可实现阪崎肠杆菌的高灵敏快速检测(图6)。
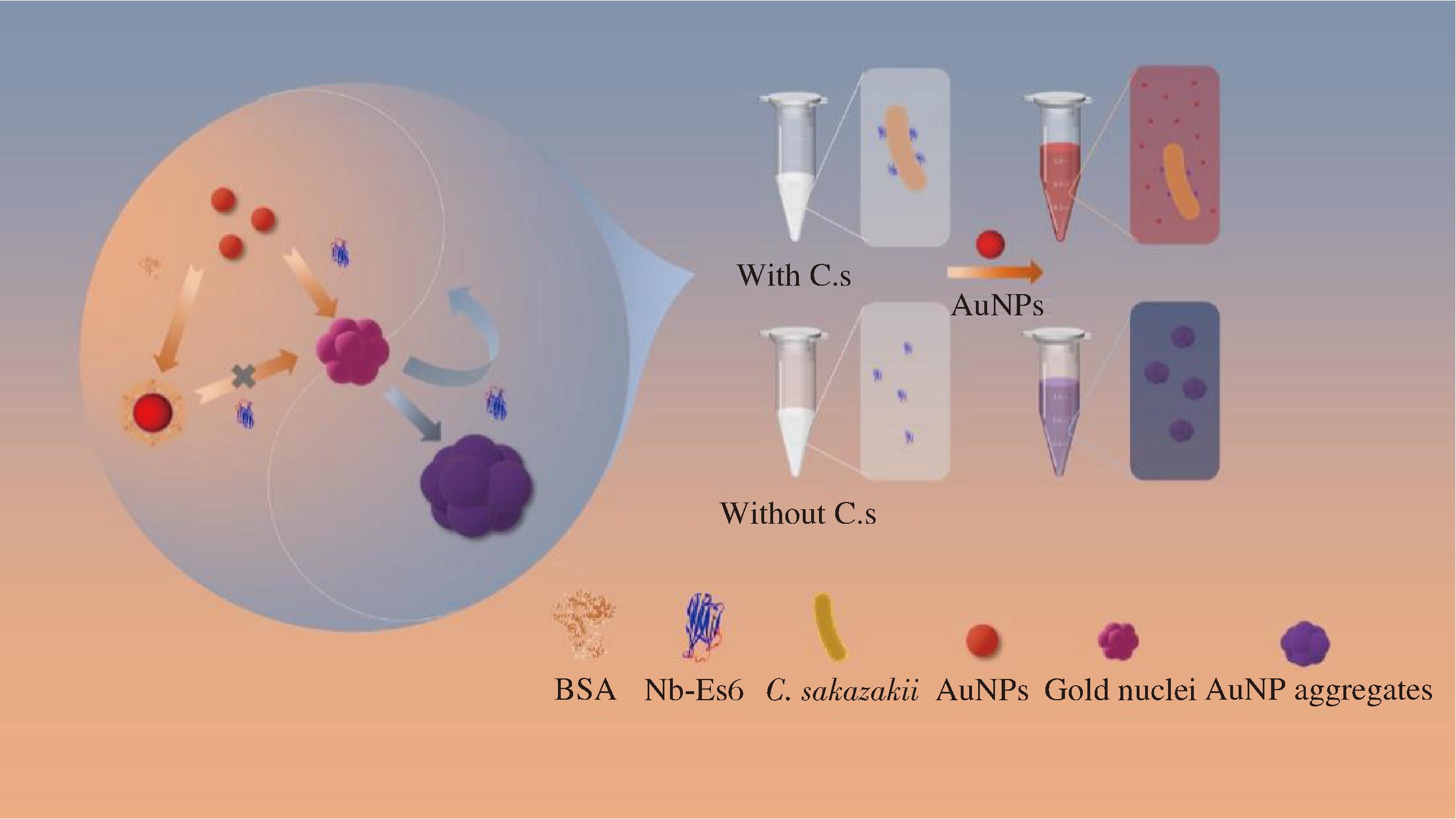
图6 基于纳米抗体诱导的AuNPs聚集检测阪崎肠杆菌的“混读”比色免疫传感器的原理图[63]
Fig.6 Preparation of a “Mix-and-Read” colorimetric immunosensor for detection of C.sakazakii based on nanobody-induced aggregation of AuNPs[63]
注:BSA: 牛血清白蛋白(bovine serum albumin)。
3.4 纳米抗体在大肠杆菌检测中的应用
大肠杆菌作为一种极为普遍的肠道致病菌,广泛存在于环境中,并能通过多种途径传播,轻易引发多种食源性疾病,对消费者的健康构成了不容忽视的严重威胁[80]。纳米抗体在大肠杆菌监测领域同样也展现出了显著的实际应用潜力和适用性。HE等[64]成功制备特异性识别大肠杆菌O157:H7的纳米抗体,以多克隆抗体为捕获抗体,噬菌体展示纳米抗体为检测抗体建立免疫分析方法,检测限为8.7×103 CFU/mL,并成功在牛奶、橙汁、肉等食品中应用。DHEHIBI等[65]采用了一种基于纳米抗体的磁荧光免疫测定法来特异性检测致病性大肠杆菌F17阳性菌株(E.coli F17),该方法可在90 min内完成检测,检测限为1.8 CFU/mL,实现了对大肠杆菌F17阳性菌株快速高灵敏检测。
3.5 纳米抗体在其他食源性致病菌检测中的应用
纳米抗体特异性检测技术同样也被广泛运用于多种其他食源性致病菌的高效检测中。为了实现对副溶血性弧菌的快速检测,WANG等[66]创新性提出了一种基于M13噬菌体展示的纳米抗体(噬菌体-Nb)的一步式、无标记比色策略,基于可见的颜色变化表面等离子体共振特性,研究人员成功开发了一种简单且灵敏的比色免疫传感器,用于特异性检测副溶血性弧菌。该测定可在100 min内完成,其视觉检出限为104 CFU/mL,定量限为103 CFU/mL。
王妍入等[67]成功研发出一种特异性检测单增李斯特菌的纳米抗体,其表达产量高、生产成本相对低,为后续该种纳米抗体的工业化大规模生产奠定了基础。基于该发明,建立了双纳米抗体ELISA分析方法用于特异性检测单增李斯特菌,检测灵敏度为3.55×105 CFU/mL,该分析方法在即食蔬菜、乳制品等多种食品的检测中均有较高的回收率,具备较好的实际应用价值。
通过荧光激活细胞分选(fluorescence activated cell sorting,FACS),LIN等[81]将CH1和CH2域的单细胞逆转录和聚合酶链反应(polymerase chain reaction,PCR)扩增能够识别和排除表达常规抗体的B细胞克隆。然后Nbs在大肠杆菌细胞中表达,4种Nbs对铜绿假单胞菌外毒素A(pseudomonas aeruginosa exotoxin A,PEA)表现出高亲和力,可用于食品中铜绿假单胞菌的特异性检测。
3.6 纳米抗体在食源性致病菌检测应用中的优势与不足
纳米抗体在食源性致病菌检测中展现出显著优势:纳米抗体分子质量小(约15 kDa)赋予其高渗透性,可识别传统IgG抗体难以触及的隐蔽表位(如细菌鞭毛蛋白疏水区),具有更强的特异性[82]。此外,纳米抗体具备突出的环境耐受性,可耐受80 ℃高温或极端pH环境(pH 2~12活性保留>70%);具有对复杂食品基质的高耐受性,避免了繁琐的前处理过程。生产层面,基于原核表达系统(如大肠杆菌)的纳米抗体制备周期短(<1周)、成本仅为哺乳动物细胞表达抗体的10%~20%,相较依赖杂交瘤技术且生产周期长达3~6个月的传统单抗,显著提升了技术经济性[83]。
然而,纳米抗体检测应用仍面临诸多挑战。首先,基于纳米抗体的免疫分析技术灵敏度多处于103~104 CFU/mL,远低于PCR技术(1~10 CFU/mL),而大多数食源性致病菌在食品中不允许检出。因此,为了满足检测需求,现有的免疫分析方法仍需要6~10 h的预增菌过程,难以实现真正的“快速检测”。其次,纳米抗体的体积小,当与纳米材料结合时,容易造成材料聚集或抗体失活,往往需要如生物素-链霉亲和素桥连等技术进行探针制备。与传统抗体相比,纳米抗体标记步骤复杂,且稳定性不足,造成其在免疫层析技术中的应用受限。再次,纳米抗体主要识别食源性致病菌的鞭毛、脂多糖或菌体蛋白等,样品的不同处理方式有时造成菌的表面蛋白结构变化或缺失,导致抗体的结合活性发生变化。
3.7 纳米抗体研究与应用的未来发展趋势
纳米抗体作为前沿抗体技术,在免疫分析领域具有广阔的研究与应用空间。当前,纳米抗体的研制主要依赖动物免疫与文库筛选,人工智能(artificial intelligence,AI)的快速发展为纳米抗体筛选与功能化设计开辟了新的方向。BENNETT等[84]采用RFdiffusion网络计算蛋白设计,成功研制了针对流感病毒等靶标的纳米抗体和单链抗体,证明了从头设计抗体结构域的可行性。在应用方面,纳米抗体越来越多的与其他检测技术相结合,实现灵敏度的提高,如基于CRISPR-Cas协同检测体系。纳米抗体捕获目标菌后触发Cas12a酶的反式切割活性,通过荧光信号级联放大使检测限达到10 CFU/mL,较传统免疫层析试纸条检测限灵敏度提高3个数量级,且无需依赖PCR设备[85]。同时,生物素化纳米抗体与链霉亲和素磁珠的定向偶联技术[58],结合微流控芯片的流体动力学富集效应,可将目标菌捕获效率提升至高于90%,显著降低基质干扰对检测限的影响。上述策略联用拓宽了免疫分析技术的应用范围,为真正实现现场化检测提供了新的路径。
4 结语
食源性微生物污染是威胁公众生命健康的关键问题之一。传统的食源性致病菌检测方法操作繁琐,耗时长,难以满足快速检测的需求。免疫分析技术可有效解决以上问题,实现食品中食源性致病菌的快速检测。抗体是免疫分析的核心,在食源性致病菌的检测中,传统抗体存在特异性不足、生成成本高等问题。在此背景下,纳米抗体凭借其独特的优势,如分子小、水溶性好、高亲和力与稳定性、强特异性、易于表达生产及可进一步修饰等特性,在食品安全快速检测领域展现出了广阔的应用前景。尽管纳米抗体在食品安全领域已有诸多应用,如农药兽药残留和真菌毒素的检测,但在食源性致病菌检测方面的研究仍相对有限,尚处于起步阶段。
目前的研究主要聚焦于沙门氏菌、金黄色葡萄球菌、大肠杆菌等几种常见致病菌。在食源性致病菌检测中,纳米抗体主要用于ELISA检测和免疫磁珠富集。特别是夹心ELISA方法,相较于传统ELISA,能显著提高检测的特异性。此外,研究者们还在传统ELISA的基础上,开发出了多种创新方法。例如,免疫磁分离技术与ELISA结合的IMS-ELISA方法,通过免疫磁珠进行预处理,提高了检测的灵敏度;夹心化学发光ELISA(CLISA)方法,采用化学发光替代传统的显色反应,使检测信号的敏感度提升了百倍。以上将ELISA与其他技术相结合的方法,在免疫检测中得到了越来越广泛的应用,对提高检测的特异性和灵敏度起到了重要作用。尽管纳米抗体在食源性微生物污染检测领域已取得了一定进展,但目前的研究尚未转化为可用于现场检测的有效手段,相较于传统抗体仍存在部分局限性,如单价结合特性可能导致某些检测场景下灵敏度不足,未来研究可通过构建双特异性或多聚体纳米抗体,同时靶向致病菌的多个表位或毒素,提升检测灵敏度与广谱性;或利用蛋白质工程、固定化载体等技术优化纳米抗体的耐热性与存储性能,满足现场检测需求。
因此,后续研究应聚焦于实际应用,充分发挥纳米抗体的优势,使食品安全检测更加快速、便携和准确。同时,考虑到食品基质的复杂性,还需改进样品前处理方式,并提高纳米抗体的稳定性,以应对室温环境下的存放需求。在食品安全控制领域方面,纳米抗体可通过靶向食源性致病菌表面关键蛋白(如黏附因子、生物膜形成相关蛋白),直接抑制细菌的定殖与增殖,实现食源性致病菌的有效防控。
本文综述了基于纳未抗体的食源性致病菌快速检测方法的现有研究,旨在为开发更加高效、准确、便捷的检测方法提供参考,并推动纳米抗体在更多种类的食源性微生物污染检测以及控制中的应用。通过持续的研究和创新,纳米抗体将在未来食品安全检测领域发挥更加重要的作用。
[1] 李伊涵. 浅谈微生物食源性疾病现状及建议[J].食品界, 2024(9):93-95.LI Y H.A brief discussion on the current situation of microbial foodborne diseases and suggestions[J].Food Industry, 2024(9):93-95.
[2] 陈秀琴, 黄梅清, 郑敏, 等.食源性致病菌快速检测技术及其应用研究进展[C].中国畜牧兽医学会兽医公共卫生学分会第六次学术研讨会论文集, 2018.CHEN X Q, HUANG M Q, ZHENG M, et al.Advances on rapid detection of foodborne pathogens and the application[C].Collection of Papers from the Sixth Academic Seminar of the Veterinary Public Health Branch of Chinese Association of Animal Science and Veterinary Medicine, 2018.
[3] 王筱. 食源性致病菌:餐桌上的隐形威胁[J].家庭医学, 2025(5): 35-36.WANG X. Foodborne pathogens: The invisible threat at the dinner table[J].Family Medicine, 2025(5): 35-36.
[4] 吕珍. 食品中食源性致病菌的检测与防控技术研究[J].中外食品工业, 2024(19):49-51.LYU Z.Research on detection and prevention technologies for foodborne pathogens in food[J].Global Food Industry, 2024(19):49-51.
[5] World Health Organization.WHO estimates of the global burden of foodborne diseases[R].World Health Organization, 2015.
[6] 张翔渝. 食品安全快速检测技术在食源性致病菌检测中的应用[J].现代食品, 2024, 30(14):79-81.ZHANG X Y.Application of rapid food safety detection technology in the detection of foodborne pathogens[J].Modern Food, 2024, 30(14):79-81.
[7] CONROY P J, LAW R H P, CARADOC-DAVIES T T, et al.Antibodies:From novel repertoires to defining and refining the structure of biologically important targets[J].Methods, 2017, 116:12-22.
[8] HAMERS-CASTERMAN C, ATARHOUCH T, MUYLDERMANS S, et al.Naturally occurring antibodies devoid of light chains[J].Nature, 1993, 363(6428):446-448.
[9] TANG H P, GAO Y, HAN J Y.Application progress of the single domain antibody in medicine[J].International Journal of Molecular Sciences, 2023, 24(4):4176.
[10] 刘星, 陈奇.鲨源单域抗体的研究进展[J].生物工程学报, 2020, 36(6):1069-1082.LIU X, CHEN Q.Progress in shark single-domain antibody[J].Chinese Journal of Biotechnology, 2020, 36(6):1069-1082.
[11] NTANIOS F, MEIJER G, HEPBURN P.Comments on the review by Nguyen et al.The cholesterol-lowering action of plant stanol esters[J].The Journal of Nutrition, 2000, 130(9):2390-2392.
[12] 白梦凡. 基于纳米抗体磁富集的肠炎沙门氏菌免疫分析方法研究[D].杨凌:西北农林科技大学, 2022.BAI M F.Development of a nanobody-based immunomagnetic separation-ELISA for rapid detection of Salmonella enteritidis in food[D].Yangling:Northwest A&F University, 2022.
[13] ![]() I, MUYLDERMANS S.The therapeutic potential of nanobodies[J].BioDrugs, 2020, 34(1):11-26.
I, MUYLDERMANS S.The therapeutic potential of nanobodies[J].BioDrugs, 2020, 34(1):11-26.
[14] NAMBULLI S, XIANG Y F, TILSTON-LUNEL N L, et al.Inhalable Nanobody (PiN-21) prevents and treats SARS-CoV-2 infections in Syrian hamsters at ultra-low doses[J].Science Advances, 2021, 7(22):eabh0319.
[15] MAEDA R, FUJITA J, KONISHI Y, et al.A panel of nanobodies recognizing conserved hidden clefts of all SARS-CoV-2 spike variants including omicron[J].Communications Biology, 2022, 5:669.
[16] HOU J, DU K J, LI J L, et al.Research trends in the use of nanobodies for cancer therapy[J].Journal of Controlled Release, 2025, 381:113454.
[17] 张翠. 鼠伤寒沙门氏菌纳米抗体的制备及免疫分析方法研究[D].杨凌:西北农林科技大学, 2022.ZHANG C.The development of nanobody and construction of immunoassay towords Salmonella typhimurium[D].Yangling:Northwest A&F University, 2022.
[18] LAI J Y, LIM T S.Infectious disease antibodies for biomedical applications:A mini review of immune antibody phage library repertoire[J].International Journal of Biological Macromolecules, 2020, 163:640-648.
[19] 刘碧霞, 刘媛, 谢静, 等.噬菌体展示技术在全人源性抗体发现中的应用[J].免疫学杂志, 2023, 39(10):910-915.LIU B X, LIU Y, XIE J, et al.Progresses of phage display technology application in fully human antibody discovery[J].Immunological Journal, 2023, 39(10):910-915.
[20] 唐秀兰, 邓安琦, 陈文聪, 等.纳米抗体筛选技术研究进展[J].生物工程学报, 2024, 40(2):350-366.TANG X L, DENG A Q, CHEN W C, et al.Advances in nanobody screening technology[J].Chinese Journal of Biotechnology, 2024, 40(2):350-366.
[21] XU C X, YANG Y, LIU L W, et al.Microcystin-LR nanobody screening from an alpaca phage display nanobody library and its expression and application[J].Ecotoxicology and Environmental Safety, 2018, 151:220-227.
[22] PANG J R, GUO M W, WANG Y, et al.Determination of parathion by time-resolved fluorescence immunochromatographic assay based on nanobody:Aiming at improving strip sensitivity[J].Talanta, 2025, 285:127359.
[23] HE Q Q, CHEN Y J, WANG Z X, et al.Efficient selection of the 2,4-dichlorophenoxyacetic acid nanobody gene from the phage library constructed with sorted specific cells and expression in plants to confer herbicide resistance[J].Journal of Agricultural and Food Chemistry, 2024, 72(50):27850-27860.
[24] LIANG Y F, PAN Q Y, WANG Y, et al.Enhanced nanobody-driven bioluminescent immunoassay for rapid parathion detection using engineered split-nanoluciferase[J].Biosensors and Bioelectronics, 2025, 269:116913.
[25] ZHANG Y L, HE Z Y, SUN Z C, et al.Genetic engineering-powered dual-mode lateral flow immunosensor for colorimetric and fluorescent detection of ochratoxin A in pepper[J].Journal of Hazard Material, 2025, 489:137636.
[26] CAI C, XIA Y H, GUO Y Z, et al.Biosynthetic small molecule antigens mimics medicated lateral flow immunoassay for mycotoxin Fumonisin B1 using nanobody fusion proteins[J].Journal of Hazardous Materials, 2025, 487:137194.
[27] YUAN B, LI Z Q, LI P W, et al.Genetically engineered integrated aflatoxin B1 and deoxynivalenol bispecific nanobody as surrogate antigens for constructed time-resolved immunoassay dual detection methods[J].Biosensors and Bioelectronics, 2025, 273:117137.
[28] WANG Y, WU S H, WANG H T, et al.M13 bacteriophage based fluorescence immunoassay against food allergens of Ara h 3 and Mac i 1[J].Food Chemistry, 2025, 469:142617.
[29] BAN B, BLAKEII R C, BLAKE D A.Yeast surface display platform for rapid selection of an antibody library via sequential counter antigen flow cytometry[J].Antibodies, 2022, 11(4):61.
[30] DONG C, QIAO J, WANG X P, et al.Engineering Pichia pastoris with surface-display minicellulosomes for carboxymethyl cellulose hydrolysis and ethanol production[J].Biotechnology for Biofuels, 2020, 13(1):108.
[31] MÜLLER G A.Membrane insertion and intercellular transfer of glycosylphosphatidylinositol-anchored proteins:Potential therapeutic applications[J].Archives of Physiology and Biochemistry, 2020, 126(2):139-156.
[32] LI Y B, WANG X, ZHOU N Y, et al.Yeast surface display technology:Mechanisms, applications, and perspectives[J].Biotechnology Advances, 2024, 76:108422.
[33] 董新莹, 高晓薇, 宋浩, 等.纳米抗体的研究进展及其应用现状[J].生物工程学报, 2024, 40(12):4324-4338.DONG X Y, GAO X W, SONG H, et al.Research progress and application of nanobodies[J].Chinese Journal of Biotechnology, 2024, 40(12):4324-4338.
[34] MEI M, LU M Q, LI S Q, et al.Development of nanobodies specific to clumping factors A of Staphylococcus aureus by yeast surface display[J].International Journal of Biological Macromolecules, 2024, 259:129208.
[35] 周永飞, 杨敬鹏, 常军亮, 等.人源化单克隆抗体的研究进展[J].中国生物制品学杂志, 2021, 34(9):1114-1119.ZHOU Y F, YANG J P, CHANG J L, et al.Progress in research on humanized monoclonal antibody[J].Chinese Journal of Bioproducts, 2021, 34(9):1114-1119.
[36] 朱光, 王译晨, 宋莎莎, 等.纳米抗体筛选和表达技术研究进展[J].中国动物检疫, 2021, 38(7):79-87.ZHU G, WANG Y C, SONG S S, et al.Research progress on the screening and expression of nanobody[J].China Animal Health Inspection, 2021, 38(7):79-87.
[37] WANG H, LIU R H.Advantages of mRNA display selections over other selection techniques for investigation of protein-protein interactions[J].Expert Review of Proteomics, 2011, 8(3):335-346.
[38] KANG Y L, CHEN L.Structural basis for the binding of DNP and purine nucleotides onto UCP1[J].Nature, 2023, 620(7972):226-231.
[39] BAKHERAD H, MOUSAVI GARGARI S L, RASOOLI I, et al.In vivo neutralization of botulinum neurotoxins serotype E with heavy-chain camelid antibodies (VHH)[J].Molecular Biotechnology, 2013, 55(2):159-167.
[40] BILLEN B, VINCKE C, HANSEN R, et al.Cytoplasmic versus periplasmic expression of site-specifically and bioorthogonally functionalized nanobodies using expressed protein ligation[J].Protein Expression and Purification, 2017, 133:25-34.
[41] YANG Z Y, SCHMIDT D, LIU W L, et al.A novel multivalent, single-domain antibody targeting TcdA and TcdB prevents fulminant Clostridium difficile infection in mice[J].The Journal of Infectious Diseases, 2014, 210(6):964-972.
[42] J RVILUOMA A, STRANDIN T, LÜLF S, et al.High-affinity target binding engineered via fusion of a single-domain antibody fragment with a ligand-tailored SH3 domain[J].PLoS One, 2012, 7(7):e40331.
RVILUOMA A, STRANDIN T, LÜLF S, et al.High-affinity target binding engineered via fusion of a single-domain antibody fragment with a ligand-tailored SH3 domain[J].PLoS One, 2012, 7(7):e40331.
[43] HENRY K A, SULEA T, VAN FAASSEN H, et al.A rational engineering strategy for designing protein A-binding camelid single-domain antibodies[J].PLoS One, 2016, 11(9):e0163113.
[44] OLICHON A, SURREY T.Selection of genetically encoded fluorescent single domain antibodies engineered for efficient expression in Escherichia coli[J].The Journal of Biological Chemistry, 2007, 282(50):36314-36320.
[45] BAGHBAN R, GARGARI S L M, RAJABIBAZL M, et al.Camelid-derived heavy-chain nanobody against Clostridium botulinum neurotoxin E in Pichia pastoris[J].Biotechnology and Applied Biochemistry, 2016, 63(2):200-205.
[46] BAGHBAN R, FARAJNIA S, GHASEMI Y, et al.New developments in Pichia pastoris expression system, review and update[J].Current Pharmaceutical Biotechnology, 2018, 19(6):451-467.
[47] FRENKEN L G J, VAN DER LINDEN R H J, HERMANS P W J, et al.Isolation of antigen specific Llama VHH antibody fragments and their high level secretion by Saccharomyces cerevisiae[J].Journal of Biotechnology, 2000, 78(1):11-21.
[48] 蔡美娜, 王佑春.哺乳动物细胞表达系统研究进展[J].中国医药生物技术, 2024, 19(3):254-259.CAI M N, WANG Y C.Research progress on mammalian cell expression systems[J].Chinese Medicinal Biotechnology, 2024, 19(3):254-259.
[49] YOU M, LIU Y N, CHEN Y W, et al.Maximizing antibody production in suspension-cultured mammalian cells by the customized transient gene expression method[J].Bioscience, Biotechnology, and Biochemistry, 2013, 77(6):1207-1213.
[50] VANMARSENILLE C, ELSEVIERS J, YVANOFF C, et al.In planta expression of nanobody-based designer chicken antibodies targeting Campylobacter[J].PLoS One, 2018, 13(9):e0204222.
[51] HE Y X, REN Y R, GUO B, et al.Development of a specific nanobody and its application in rapid and selective determination of Salmonella enteritidis in milk[J].Food Chemistry, 2020, 310:125942.
[52] ZHANG C, LIU Z L, BAI M F, et al.An ultrasensitive sandwich chemiluminescent enzyme immunoassay based on phage-mediated double-nanobody for detection of Salmonella Typhimurium in food[J].Sensors and Actuators B: Chemical, 2022, 352:131058.
[53] REN Y R, WEI J, WANG Y, et al.Development of a streptavidin-bridged enhanced sandwich ELISA based on self-paired nanobodies for monitoring multiplex Salmonella serogroups[J].Analytica Chimica Acta, 2022, 1203:339705.
[54] WANG Y Q, ZHANG L, WANG P, et al.Enhancing oriented immobilization efficiency:A one-for-two organism-bispecific nanobody scaffold for highly sensitive detection of foodborne pathogens[J].Analytical Chemistry, 2023, 95(46):17135-17142.
[55] LIAO X R, WANG J M, GUO B, et al.Enhancing nanobody immunoassays through ferritin fusion:Construction of a Salmonella-specific fenobody for improved avidity and sensitivity[J].Journal of Agricultural and Food Chemistry, 2024, 72(26):14967-14974.
[56] BAI M F, WANG Y Q, ZHANG C, et al.Nanobody-based immunomagnetic separation platform for rapid isolation and detection of Salmonella enteritidis in food samples[J].Food Chemistry, 2023, 424:136416.
[57] ZHANG C, WANG Y Q, LIU Z L, et al.Nanobody-based immunochromatographic biosensor for colorimetric and photothermal dual-mode detection of foodborne pathogens[J].Sensors and Actuators B:Chemical, 2022, 369:132371.
[58] 孙颖. 金葡特异性纳米抗体的制备及免疫检测方法的构建[D].天津:天津科技大学, 2021.SUN Y.Preparation of specific nanobodies against staphylococcus aureus and establishment of immunoassay[D].Tianjin:Tianjin University of Science and Technology, 2021.
[59] 唐丽. 金黄色葡萄球菌肠毒素B纳米抗体的制备及检测应用[D].赣州:赣南医科大学, 2024.TANG L.Preparation and detection applications of staphylococcal enterotoxin B nanobodies[D].Ganzhou:Gannan Medical University, 2024.
[60] 郭鹏利, 路云龙, 李想, 等.基于纳米抗体的酶联免疫吸附法检测食品中金黄色葡萄球菌肠毒素B[J].食品与发酵工业, 2019, 45(20):250-255.GUO P L, LU Y L, LI X, et al.Detection of Staphylococcal enterotoxin B in foodstuffs by nanobody-based ELISA[J].Food and Fermentation Industries, 2019, 45(20):250-255.
[61] WU H F, LI Y H, LI Y C, et al.The “umbrella of tolerance”:Nanobodies-armed photothermal lateral flow immunoassay for the detection of staphylococcal enterotoxin B[J].Chemical Engineering Journal, 2023, 470:144273.
[62] ZHANG Y, LIAO X R, YU G G, et al.Phage-displayed nanobody as a sensitive nanoprobe to enhance chemiluminescent immunoassay for Cronobacter sakazakii detection in dairy products[J].Analytical Chemistry, 2023, 95(36):13698-13707.
[63] CHEN P Y, YANG Q K, LI S R, et al.Nanobody-induced aggregation of gold nanoparticles:a mix-and-read strategy for the rapid detection of Cronobacter sakazakii[J].Analytical Chemistry, 2024, 96(44):17602-17611.
[64] HE Q Y, PAN J K, XU Z H, et al.Development of a nanobody-based immunoassay for the detection of Escherichia coli O157:H7 in food samples[J].Food Chemistry, 2025, 473:142987.
[65] DHEHIBI A, ALLAOUI A, RAOUAFI A, et al.Nanobody-based sandwich immunoassay for pathogenic Escherichia coli F17 strain detection[J].Biosensors, 2023, 13(2):299.
[66] WANG P, YU G G, WEI J, et al.A single thiolated-phage displayed nanobody-based biosensor for label-free detection of foodborne pathogen[J].Journal of Hazardous Materials, 2023, 443:130157.
[67] 王妍入, 魏娟, 王悦琦, 等.特异识别单增李斯特菌的纳米抗体, 重组载体, 宿主细胞及其应用:中国, CN202111407056.5[P].2024-10-30.WANG Y R, WEI J, WANG Y Q, et al.Nanobodies specifically recognizing Listeria monocytogenes, recombinant vectors, host cells and their applications:China, CN202111407056.5[P].2024-10-30.
[68] TU Z, CHEN Q, Li Y P, et al.Identification and characterization of species-specific nanobodies for the detection of Listeria monocytogenes in milk[J].Analytical Biochemistry, 2016, 493:1-7.
[69] 周芳, 黄曾, 詹卓蓬, 等.一起沙门菌引起的食物中毒情况分析[J].实用临床医学, 2023, 24(1):99-101.ZHOU F, HUANG Z, ZHAN Z C, et al.Analysis of a food poisoning incident caused by Salmonella[J].Practical Clinical Medicine, 2023, 24(1):99-101.
[70] 王庆信, 毛心怡, 时国庆.基于定向固定化抗体的侧向流免疫检测试纸建立食用油中玉米赤霉烯酮的检测方法[J].食品安全质量检测学报, 2024, 15(10):56-63.WANG Q X, MAO X Y, SHI G Q.Development of lateral flow immunoassay based on oriented immobilized antibodies for the detection of zearalenone in edible oil[J].Journal of Food Safety and Quality, 2024, 15(10):56-63.
[71] 刘爱平, 申文浩, 王小红, 等.免疫学检测中抗体固定化方法的研究现状[J].江苏农业学报, 2017, 33(3):714-720.LIU A P, SHEN W H, WANG X H, et al.A review on antibody immobilization in immunoassays[J].Jiangsu Journal of Agricultural Sciences, 2017, 33(3):714-720.
[72] AYRTON J P, HO C, ZHANG H R, et al.Multivalent nanobody engineering for enhanced physisorption and functional display on gold nanoparticles[J].Nanoscale, 2024, 16(42):19881-19896.
[73] SUN M X, SUN Y, YANG Y B, et al.Multivalent nanobody-based sandwich enzyme-linked immunosorbent assay for sensitive detection of porcine reproductive and respiratory syndrome virus[J].International Journal of Biological Macromolecules, 2024, 258:128896.
[74] 苑懿, 黄羽文, 邢巾, 等.基于多孔金@铂纳米酶的比色型生物传感器用于检测牛乳中鼠伤寒沙门氏菌研究[J].中国乳品工业, 2023, 51(12):48-53.YUAN Y, HUANG Y W, XING J, et al.Colorimetric biosensor based on porous gold@platinum nanocatalysts for detection of Salmonella typhimurium in milk[J].China Dairy Industry, 2023, 51(12):48-53.
[75] 安刚. 食品中金黄色葡萄球菌肠毒素研究进展[J].食品安全导刊, 2024(33):141-143.AN G.Research progress on staphylococcal enterotoxins in food[J].China Food Safety Magazine, 2024(33):141-143.
[76] ZHANG Y, LIU D, TIAN Y D, et al.Bifunctional nanobody facilitates a colorimetric and fluorescent dual-mode immunoassay of Staphylococcal enterotoxin A[J].Food Chemistry, 2025, 467:142362.
[77] 季艳伟, 崔艳, 张开惠, 等.特异性识别金黄色葡萄球菌肠毒素B、C的纳米抗体BC16及其应用:中国, CN202211032221.8[P].2023-08-11.JI Y W, CUI Y, ZHANG K H, et al.Nanobody BC16 specifically recognizing Staphylococcus aureus enterotoxins B and C and its applications:China, CN202211032221.8[P].2023-08-11.
[78] HUGHES A C, KIRKLAND M, DU W X, et al.Development of thermally stable nanobodies for detection and neutralization of staphylococcal enterotoxin B[J].Toxins, 2023, 15(6):400.
[79] SONG D, CHENG J Q, DONG K, et al.Based on TLR4-NLRP3-IL-1β inflammatory pathway:Comparison of necrotizing enterocolitis induced by different classes of antibiotic-induced Cronobacter sakazakii[J].Food Bioscience, 2024, 62:105114.
[80] 张盼. 牛奶中大肠杆菌检测方法探究[J].食品安全导刊, 2025(5):148-150.ZHANG P.Exploration on the detection methods of Escherichia coli in milk[J].China Food Safety Magazine, 2025(5):148-150.
[81] LIN J T, GU Y, XU Y R, et al.Characterization and applications of nanobodies against Pseudomonas aeruginosa Exotoxin A selected from single alpaca B cells[J].Biotechnology &Biotechnological Equipment, 2020, 34(1):1028-1037.
[82] STIJLEMANS B, CALJON G, NATESAN S K A, et al.High affinity nanobodies against the Trypanosome brucei VSG are potent trypanolytic agents that block endocytosis[J].PLoS Pathogens, 2011, 7(6):e1002072.
[83] WANG J, MUKHTAR H, MA L, et al.VHH antibodies:Reagents for mycotoxin detection in food products[J].Sensors, 2018, 18(2):485.
[84] BENNETT N R, WATSON J L, RAGOTTE R J, et al.Atomically accurate de novo design of antibodies with RFdiffusion[J].Nature, 2025:1-11.
[85] WANG Y D, XIANY Y L.Nanobody and nanozyme-enabled immunoassays with enhanced specificity and sensitivity[J].Small Methods, 2022, 6(4):2101576.