生鲜蔬菜是构成健康饮食的主要食材,可以为人体提供多种维生素及矿物质,并且是膳食纤维的主要来源之一。全球不断变化的生活方式增加了对方便、新鲜、营养、和无添加剂的生鲜即食食品(例如果蔬沙拉)的需求,这使生鲜蔬菜和生鲜蔬菜即食(ready-to-eat, RTE)产品在食品市场上越来越受欢迎[1-2]。1961—2021年,全球水果和蔬菜人均消费量从每年63.29 kg增加到147.04 kg[3]。预计从2023—2029年,欧洲包装沙拉市场将以约7.1%的复合年增长率增长[4]。在中国,蔬菜一直被认为是最重要的食物之一。传统的中国饮食与大多数西方的饮食不同,是以植物为基础的[5]。2017年,中国人均蔬菜消费量达到447 kg,显著高于世界平均人均消费量(134 kg)。截至2022年中国的蔬菜产量达到79 997.22万t,与此同时,蔬菜需求量约为79 069.42万t[6]。目前,中国以超过全球蔬菜产量50%的份额,成为世界上最大的蔬菜生产国[7]。在消费量增加的同时,有证据表明与之相关的食源性疾病的暴发在增加,1999—2019年,美国与细菌有关的食源性疾病暴发大幅增加,根据世界银行2019年关于食源性疾病经济负担的报告,治疗食源性疾病的年度成本估计为150亿美元,低收入和中等收入国家食源性疾病造成的生产力损失总额估计为每年952亿美元[8]。因此,控制由微生物引起的食源性疾病的爆发是降低生命与经济损失的关键。
生鲜蔬菜在整个供应链的各个环节中都面临着食源性病原体引入的多重风险。由于生鲜蔬菜水分活度高的易腐特性,在生产和零售流通过程中很容易受到病菌的污染,其引发的微生物危害风险和潜在的食品安全问题日益受到重视。包含了定量微生物风险评估(quantitative microbial risk assessment,QMRA)和危害分析与关键控制点(hazard analysis and critical control points, HACCP)的预测微生物管理体系是预防和控制微生物危害风险的核心,为风险决策和食品安全管理提供了科学依据。然而,目前我国对于初级农产品(包含生鲜蔬菜)生产、加工、贮藏和分销过程中重要微生物的危害风险评估相对缺乏,难以为标准的制定和企业食品安全管理提供有力支撑[9]。因此,加强我国生鲜蔬菜中主要微生物危害风险定量评估与控制研究工作将会是未来研究趋势。
本研究旨在对生鲜蔬菜的微生物危害、风险评估和控制研究的相关文献进行综述,以分析、讨论和识别主要致病微生物(优先与生鲜蔬菜和其即食产品相关的细菌和病毒)的安全风险因素、危害,和所针对的定量微生物风险评估方法,以及在零售流通中对这些微生物危害的有效控制管理方法的研究。此外,本文还基于目前文献研究的不足,为未来的研究作出建议。
1 生鲜蔬菜中主要致病微生物危害风险
在过去20年的相关研究中,中外学者对生鲜蔬菜中的微生物危害和所引发的疾病做了广泛的统计与分析。研究发现生鲜蔬菜(如洋葱、蘑菇、萝卜、土豆、韭菜),包括绿叶蔬菜(菠菜、生菜、卷心菜)和草药调味菜(欧芹、罗勒、香菜、芥菜、水芹)易被常见的致病因子污染。这些病原体也被认为会传播食源性疾病,导致许多国家的食源性疾病暴发[10]。近年来,许多国家都报告了由于食用受微生物污染的生鲜蔬菜而暴发的疫情,这其中包括美国(56.5%的疫情与生菜中的致病性大肠杆菌有关,60%与其他绿叶蔬菜中的致病性大肠杆菌有关)[11],加拿大(50%的疫情与沙门氏菌有关,其次是33%的疫情与大肠杆菌相关, 绿叶蔬菜和草药调味菜中的志贺氏菌占17%)[12],澳大利亚(1.5%的疫情与水果/蔬菜中的沙门氏菌有关)[13]和欧盟国家(54.3%的疫情与诺如病毒相关,61.3%的蔬菜中含沙门氏菌)[14-15]。
在我国,食物中毒事件发生的主要风险类型按照大类分为微生物性、化学性、有毒植物和食用菌以及其他因素。4种风险因子类型引发的中毒事件起数和致死人数在每年的构成比中,微生物引发的中毒事件最高,占全年发生起数的1/3甚至更多。刘明等[16]在2021年通过对公开报道的2002—2017年相关食源性疾病(食物中毒) 事件情况的统计[17]发现:在微生物性食物中毒事件中致病因素主要为细菌;引发频次最高的致病微生物分别为葡萄球菌、蜡样芽孢杆菌、非伤寒沙门氏菌等,因此,细菌性事件风险大部分处于极严重风险水平。肖兴宁等[18]在2019年8~11月,随机从浙江省基地和市场抽检75 份散叶与结球生菜样品,共检出14 份样品受到食源性致病菌污染,总污染率为18.7%,其中大肠杆菌污染率为8%。总地来说,生鲜蔬菜中食源性细菌污染引起的食物中毒是威胁人类健康的一个有待解决的难题[19]。
表1对THOMAS等[20]学者在2024年总结的美国2006—2023年由于食用生鲜蔬菜和即食蔬菜沙拉而致的疾病流行情况,和中国学者[16]在2021年对国内食源性疾病事件的发生统计数据的研究做了比较,结果发现在与生鲜蔬菜微生物污染有关的肠道病原体数量中,大肠杆菌、沙门氏菌属、单核细胞增生李斯特菌在美国已发表的研究中报告最多。因此,3种常见的细菌物种(本综述的重点)是沙门氏菌、大肠杆菌和单核细胞增生李斯特菌。尽管其他细菌包括蜡样芽孢杆菌、霍乱弧菌、弯曲杆菌属、志贺氏菌属和梭状芽孢杆菌属也有报道,但它们的总占比相对较低[20]。细菌性事件风险大部分处于极严重风险水平,病毒处于高危险度风险水平。因此,在风险优先级方面,表1的重点是细菌和病毒。在国内,食源性疾病涉及的高风险食品类别和发生占比排名前3的分别是蔬菜及其制品(29%)、肉及肉制品(26%)、水产及其制品(17%)。微生物性中毒事件是引发食源性疾病事件的主要因素,化学性中毒事件发生起数和致死人数逐年呈明显下降趋势[16]。因此,对生鲜蔬菜中引发食源性疾病爆发的主要微生物的危害风险的评估及控制十分重要。表1对2002—2017年中国食源性疾病事件的总结表明引发食源性疾病的主要毒素和细菌排名前3的分别是葡萄球菌肠毒素、蜡样芽孢杆菌和非伤寒沙门氏菌;主要病毒为诺如病毒,其中,蜡样芽孢杆菌主要存在于受污染的米饭和米粉中,而在生鲜蔬菜中,沙门氏菌和诺如病毒是引发食源性疾病的主要致病微生物。目前,从国内外的研究报告的比较分析中发现在生鲜蔬菜中引发疾病频次最高的微生物主要是沙门氏菌、大肠杆菌、李斯特菌和诺如病毒。这些微生物的污染来源多样,贯穿了从农场到餐桌的供应链的各个环节(图1)[15,21],包括受污染的土壤、灌溉水、肥料以及加工设备等。消费者通过生食或未充分加热的蔬菜摄入这些致病微生物,可能导致严重的食源性疾病。表2基于MISHRA等[8]学者在2024年的研究,总结了这4种主要微生物的危害风险(对人类健康的危害)及消除预防污染的简单措施。
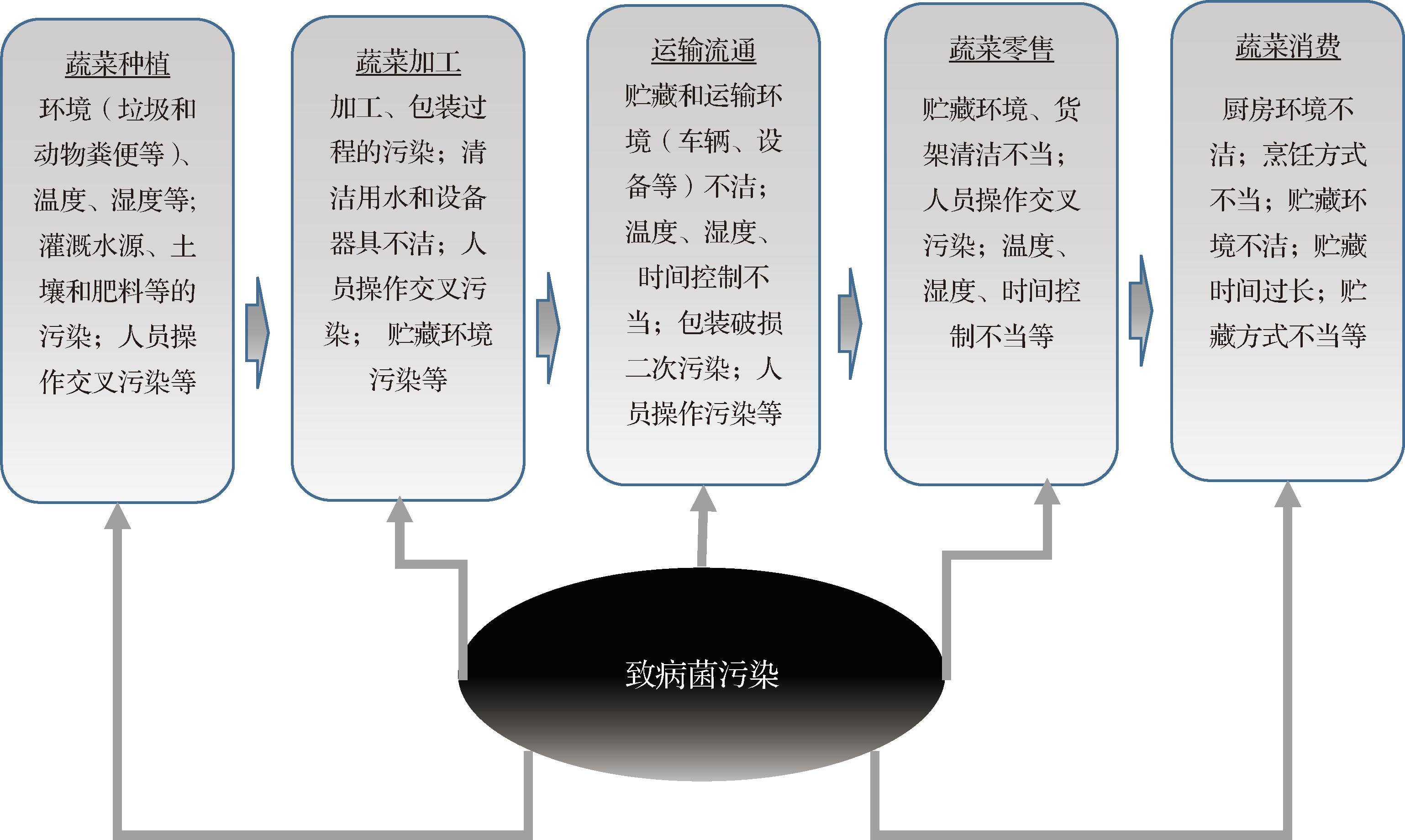
图1 贯穿蔬菜供应链的致病菌污染的潜在路径
Fig.1 Potential contamination routes of pathogens through the supply chain of vegetables
表1 中美两国因生鲜蔬菜而致的食源性疾病事件和与之相关的主要致病微生物数据比较[16-17,20]
Table 1 A comparison of number of food-borne disease outbreaks associated with contaminated vegetables and major pathogens in the United States and China[16-17,20]
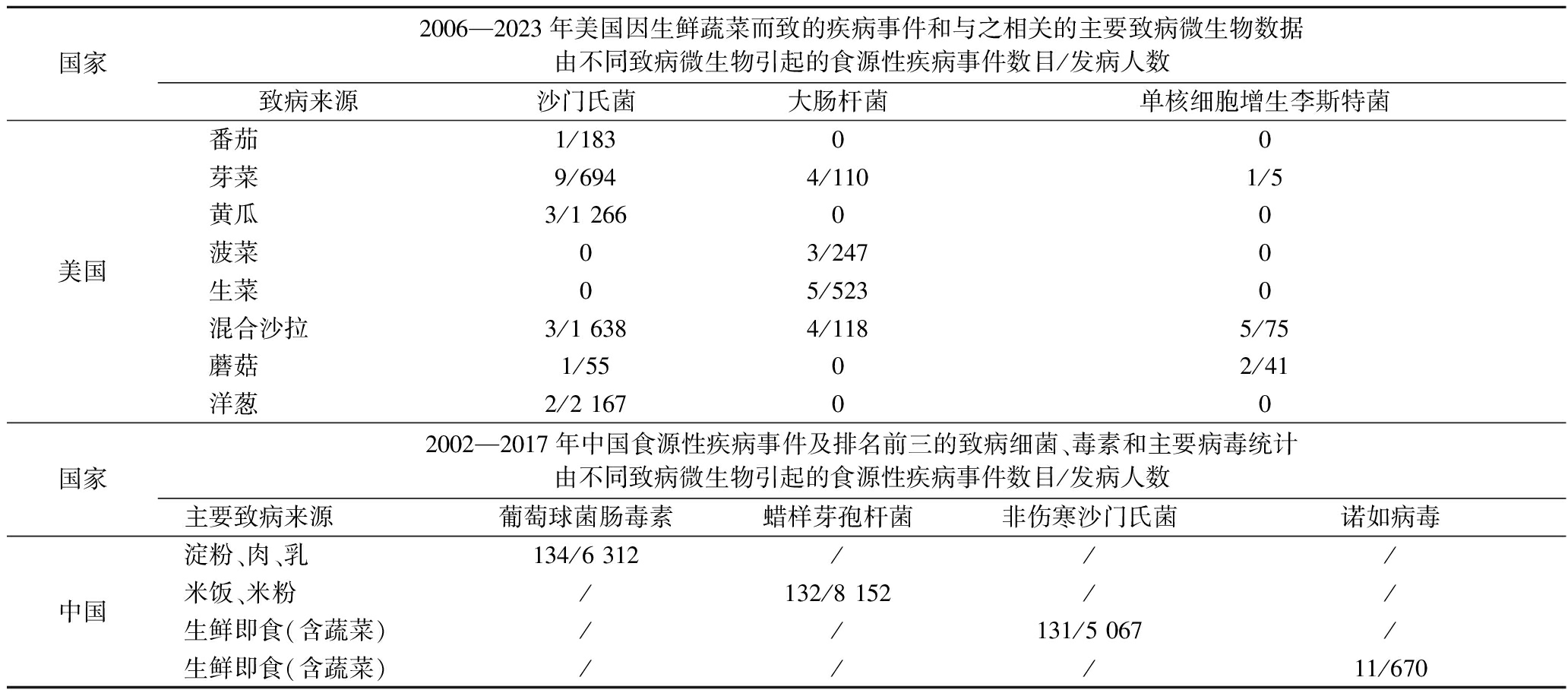
国家2006—2023年美国因生鲜蔬菜而致的疾病事件和与之相关的主要致病微生物数据由不同致病微生物引起的食源性疾病事件数目/发病人数致病来源沙门氏菌大肠杆菌单核细胞增生李斯特菌美国番茄1/18300芽菜9/6944/1101/5黄瓜3/1 26600菠菜03/2470生菜05/5230混合沙拉3/1 6384/1185/75蘑菇1/5502/41洋葱2/2 16700国家2002—2017年中国食源性疾病事件及排名前三的致病细菌、毒素和主要病毒统计由不同致病微生物引起的食源性疾病事件数目/发病人数主要致病来源葡萄球菌肠毒素蜡样芽孢杆菌非伤寒沙门氏菌诺如病毒中国淀粉、肉、乳134/6 312///米饭、米粉/132/8 152//生鲜即食(含蔬菜)//131/5 067/生鲜即食(含蔬菜)///11/670
注:/表示该项无相应数据。
表2 生鲜蔬菜中主要的食源性致病微生物健康危害及预防[8]
Table 2 Symptoms (Hazards) and prevention of major food borne pathogens in vegetables[8]

主要致病微生物健康危害(病征)预防措施沙门氏菌腹部绞痛;腹泻;恶心和呕吐;发烧和头痛避免交叉污染;避免使用未经巴氏消毒的产品;彻底煮熟食物;养成良好的卫生习惯;适当贮存(低于4 ℃)李斯特菌失去平衡和协调;抽搐;败血症;肌肉酸痛;胃肠道症状;发烧;流感样症状冷藏;彻底煮熟食物;谨慎食用高风险食物;养成良好的食品卫生习惯大肠杆菌恶心和呕吐;腹泻;腹痛和痉挛;食欲不振避免交叉污染;彻底煮熟食物;注意卫生清洁诺如病毒低烧;头痛和身体疼痛;腹痛和呕吐养成良好的个人卫生习惯;清洁和消毒表面
1.1 沙门氏菌
沙门氏菌是一种食源性病原体,主要寄生于人类和动物的肠道内。由沙门氏菌引发的感染可导致多种疾病,包括胃肠炎、菌血症、败血症以及局部感染,严重的病例可能会导致宿主死亡[22]。沙门氏菌是欧美细菌性食源性疾病爆发的主要诱因,也是美国已知由食源性病原体而致住院和死亡的主要原因。此外,在欧盟,食品监测抽样报告称,高达0.84%的即食水果和蔬菜中沙门氏菌呈阳性[23]。美国2006—2023年疫情报告的数据显示了一系列由于食用受到沙门氏菌污染的蔬菜而致的疫情(表1)。发芽的蔬菜、黄瓜和西红柿是沙门氏菌属的常见媒介[24]。受沙门氏菌属污染的新鲜绿叶蔬菜已与全球众多疫情暴发相关联[25]。在已确定的2 600多种沙门氏血清中,肠炎沙门氏菌和鼠伤寒沙门氏菌最常见[26]。另外由于抗生素的大量使用,促进了耐药沙门氏菌的出现。近些年因为对抗生素使用的控制, 沙门氏菌中的很多常见血清型的耐药率都出现了下降的趋势。不同国家使用抗生素的类型有所不同,从而导致耐药性的产生也不同,因此,在分析菌株耐药性时,需要考虑国家间的差异。近期国内研究建议使用相同的采样方法,相同的药敏试验方法和相同的标准来解释结果,可以可靠地评估抗生素耐药性的趋势和比较从不同地理区域、不同人类或动物来源获得的沙门氏菌耐药分离株的百分比[27]。动物源具有抗性的沙门氏菌是人类感染的主要来源, 但是,其他感染来源也必须要考虑,例如被污染的蔬菜[27]。蔬菜受到沙门氏菌污染的风险发生在种植、收获、加工到零售流通与消费各个阶段,污染源来自动物、水、空气、以粪便为基础的肥料、操作人员、箱子或运输包装污染,以及零售与消费不当操作等(图1)。灭菌的效果取决于沙门氏菌属在叶片表面的附着情况,以及其存活能力和随后向蔬菜组织内部的侵入情况[28]。
1.2 大肠杆菌
大肠杆菌是一种几乎完全非致病性细菌,是哺乳动物共生菌群的一部分,有助于食物的消化和维生素K的产生[29]。然而,某些菌株可引起人类腹泻、尿路感染、败血症和脑膜炎。腹泻性大肠杆菌大致分为七类,称为病理类型:产肠毒素(enterotoxigenic Escherichia coli, ETEC)、致肠病性(enteropathogenic Escherichia coli,EPEC)、产志贺毒素(shiga toxin-producing Escherichia coli,STEC)、肠聚集性(enteroaggregative Escherichia coli, EAEC)、肠侵袭性(enteroinvasive Escherichia coli, EIEC)、黏附侵袭性(adherent invasive Escherichia coli, AIEC)和弥漫性黏附性大肠杆菌(diffusely adherent Escherichia coli,DAEC)[30]。研究表明,在生鲜叶菜和即食菜沙拉中,大肠杆菌的微生物流行率很高,并带有病理组特异性毒力因子[16]。在美国,与新鲜农产品中大肠杆菌相关的食源性疾病暴发率较高,分别占细菌性食源性疾病暴发的12.2% 和3.8%[31]。在美国32 个州爆发的大肠杆菌O157∶H7食物中毒事件就是因为人们食用了受到污染的生菜所致[32]。COULOMBE等[33]报道称加拿大2008—2018年中11 起大肠杆菌O157∶H7感染事件都与绿叶菜有关,其中生菜导致9起(81.8%)。多数大肠杆菌在60 ℃以上加热数分钟即可被杀灭,但一些耐热菌株可在更高温度下存活。由于抗生素的使用,大肠杆菌的耐药现象广泛存在,在一些蔬菜种植区域,由于农业用水中含有抗生素残留,使得污染蔬菜的大肠杆菌耐药性增强。基于2019年全球因抗生素耐药性致死的数据显示由于耐抗生素大肠杆菌致死率为41.4例/10万人口[34]。
1.3 单核细胞增生李斯特菌
沙门氏菌和大肠杆菌是与食用新鲜水果和蔬菜有关的细菌性食源性疾病暴发的2个主要原因,而单核细胞增生李斯特菌引起的暴发相对较少,但其导致的食品污染而产生的损失的成本更高。在本文讨论的3种细菌病原体中,单核细胞增生李斯特菌导致的病死率最高,并且是食源性疾病导致的最常见死因之一。单核细胞增生李斯特菌可细分为至少13种血清型(类似于血清型),其致病性不同,血清型4b是大多数李斯特菌病暴发的原因。近十年美国报告了几次与受污染的水果和蔬菜有关的单核细胞增生李斯特菌全国性暴发[20](表1)。2022年的相关研究回顾了1969—2022年间各国李斯特菌病的暴发流行情况,其感染菌株的血清型主要为1/2a、1/2b及4b[35]。在5个欧盟成员国中,由于食用单核细胞增生李斯特菌血清型4b污染的冷冻甜玉米和其他冷冻蔬菜曾导致47例病例和9例死亡[36]。由李斯特菌引起的疾病是欧盟报告的第5大人畜共患病,2021年报道有2183例,较2020年增长14%[37]。根据美国疾病控制和预防中心的数据, 2015年7月至2016年1月之间发生的李斯特菌中毒事件中, 100%的患者中毒和食用绿叶菜沙拉有关,其中81%和食用罗马生菜相关[38]。我国已于2000年将单核细胞增生李斯特菌纳入食源性疾病常规监测[39]。北京市卫健委监测数据显示2018年1月1日至2020年12月31日,单核细胞增生李斯特菌感染病例达134例,其中凉菜是易被单核细胞增生李斯特菌污染的高风险性食物。彩椒、洋葱、黄瓜、圣女果、生菜等为常见制作凉菜的原料,均有被李斯特菌污染的相关报道[40]。由于李斯特菌具有耐盐、耐酸、碱、耐低温及易形成生物膜等的特性而广泛存在于自然界、食物及加工环境中,易造成持续和交叉污染,且感染类型和含量未知。一旦生物膜形成,常规消毒剂难以将其完全消除,因此需要有效的控制策略防控单核细胞增生李斯特菌的污染[39]。此外,来自新鲜蔬菜的单核细胞增生李斯特菌分离株具有对抗生素、重金属和消毒剂表现出不同程度的抗性,这些防控难点突出了对单核细胞增生李斯特菌的防控以及针对特定地区的监测和控制的必要性[41]。
1.4 诺如病毒
诺如病毒是引起病毒性胃肠炎爆发的主要病毒,广泛存在于生鲜产品中。其引发的病例占全球急性胃肠炎病例的1/5。诺如病毒每年导致约 20 万人死亡,对全球健康构成了严重威胁,尤其是对免疫力低下的人群[42]。诺如病毒属于杯状病毒科,是小型的单链、无包膜核糖核酸(RNA)病毒,包含 10 个基因组群(GⅠ~GⅩ),其中 GⅠ、GⅡ 和 GⅣ 组是人类感染的主要来源[43-44]。诺如病毒通过与感染者的直接或间接接触,以及接触受污染的水和食物(例如生鲜果蔬等)进行传播。控制诺如病毒的传播面临着相当大的挑战,因为它具有高度传染性,传播所需的感染剂量低,稳定性高,病毒会持续排出,并且存在无症状感染的特点[44]。在我国公开报道的2002—2017年食源性疾病的发生事件中,由诺如病毒引发的致病人数为670人(表1),诺如病毒为我国近年来引起食源性疾病的主要病毒。
1.5 主要致病菌在生鲜蔬菜中的存活形式及风险
在新鲜蔬菜收获后的加工过程中,有众多因素会影响交叉污染,这些因素包括机械力、接触时间、生物膜的形成等。许多交叉污染因素的作用都与细胞黏附和存留活性相关,在过去几年中,人们对这些展开了较为广泛深入的研究[45]。
研究表明细菌病原体黏附到新鲜蔬菜表面后,其在蔬菜表面存活和定植的能力是导致食源性疾病发生的关键因素。这里,“存活”指病原体能够在植物表面长时间存活,“定植”则指病原体在植物表面繁殖的能力。生物膜是微生物有组织生长的聚集体,可以在叶片、果实、根部表面以及植物组织内部形成,这为细菌在植物上持续生存并抵抗消毒处理提供了基础。不同细菌菌株形成生物膜的能力存在差异。从新鲜蔬菜中分离出的沙门氏菌菌株,相比从家禽中分离出的菌株,形成的生物膜更强。此外,形成更强生物膜或产生更多生物膜的沙门氏菌菌株,相比形成弱生物膜或不形成生物膜的菌株,对叶片组织的黏附更牢固。同样,从植物宿主中分离出的大肠杆菌,相比从哺乳动物宿主中分离出的大肠杆菌,表现出更强的生物膜形成和胞外基质产生能力。单核细胞增生李斯特菌也能在生菜叶上形成生物膜。这些都表明生物膜的形成可能是细菌在植物上生存的一种适应方式[20,46]。病原体附着和定植在表面的能力与细菌形成的生物膜直接相关。生物膜的形成与细菌菌株、营养物质的可获取性以及温度直接相关。先前的研究表明,不同的鼠伤寒沙门氏菌和单核细胞增生李斯特菌菌株能够在包括聚苯乙烯、聚碳酸酯、不锈钢、玻璃和橡胶等多种表面形成生物膜。此外, 叶片叶际栖息着多样且动态变化的微生物群落[47]。收获后的叶片常常会受到损伤,这会改变叶片的叶际环境,为病原体提供附着位点。例如,在叶菜从田间收获到加工的过程中,叶片上的损伤区域会增多,导致蔬菜叶片上肠杆菌科细菌的相对丰度增加[48]。生菜叶片的机械损伤会使大肠杆菌和沙门氏菌的数量增多。新鲜蔬菜的切割阶段也可能引入病原体。生菜的切割边缘能支持更高水平的单核细胞增生李斯特菌生长[49]。对植物的机械损伤还包括其包装过程。包装时植物组织破裂会释放出富含水分和营养的渗出物(为致病菌生长提供适宜条件),在绿叶蔬菜种植的农场和加工操作过程中都可能发生这种情况[20,50]。
多项研究表明[20,51-52],蔬菜的贮存条件会影响病原体的繁殖和存活。不同病原体在蔬菜上的温度依赖性存活情况也可能不同。例如,在约 4 ℃下贮存的黄瓜上,单核细胞增生李斯特菌数量显著增加,而沙门氏菌数量在相同温度下则显著减少。在蔬菜生长和贮存过程中,沙门氏菌、大肠杆菌、和单核细胞增生李斯特菌等致病微生物会在一些“不良”的环境中(例如低温、干燥),可能进入活的但不可培养(viable but nonculturable, VBNC)状态。处于该状态的细菌虽然失去在常规培养基上生长的能力,但仍保持代谢活性和致病性。当环境条件适宜时,VBNC 状态的致病菌可复苏并恢复生长,这给蔬菜微生物安全检测带来挑战。此外, 部分致病菌存在持留态细胞,这些细胞对抗生素等外界压力具有高度耐受性。在蔬菜加工过程中,即使大部分细菌被杀死,持留态细胞仍可存活下来,并在适宜条件下重新生长繁殖,成为潜在的污染源[20,51-52]。
综上所述,沙门氏菌、大肠杆菌、单核细胞增生李斯特菌等致病微生物在生鲜蔬菜上存在多种风险因素。它们在抗性方面,对干、热、冷、抗菌剂等表现出不同程度的耐受能力,且抗药性问题突出。在存活形式上,生物被膜、VBNC 状态等增加了其在蔬菜上的存活时间和传播风险。同种菌种的不同分离株在各方面也存在显著差异,使得这些致病微生物在生鲜蔬菜中的风险状况更为复杂。未来,需要进一步深入研究这些风险因素,制定针对性的防控措施,以保障生鲜蔬菜的微生物安全,降低食源性疾病的发生风险[20]。
2 针对主要微生物危害风险的QMRA研究
2.1 QMRA
生鲜蔬菜的主要微生物污染预防的主要方式通常为高温灭菌、低温抑菌和清洁(表2)。由于微生物污染的高隐匿性和生鲜蔬菜的鲜脆及易腐特性,高温灭菌会使其损失营养和口感,低温抑菌和清洁不充分仍会导致危害风险。因此,建立风险评估和安全风险分析,科学的管理控制措施是有效控制微生物危害风险的关键。QMRA是一种系统化的风险评估方法,包括4个主要步骤:危害识别、暴露评估、剂量-反应评估和风险特征描述(图2)[21]。QMRA是生鲜类食品安全风险分析评估的核心体系,识别评估生鲜食品在供应链过程、致病菌和人类疾病之间的相互作用和联系,为风险决策和食品安全管理提供了科学依据。食品安全风险评估是指对食品原料中生物性、化学性和物理性危害对人体健康可能造成的不良影响所进行的科学评估,主要包含危害识别、危害特征描述、暴露评估和风险特征描述4 步[53]。不同于物理和化学危害在污染过程中呈现“相对稳定”的状态,食源性致病菌随时间的推进和环境的变化在食品中可能不断发生着数量和性质上的变化。对致病菌进行“定量风险评估”来应对这种动态非常重要。QMRA是根据致病微生物对食品的污染情况和引发疾病的临床特征研究,将微生物的摄入量与对人体产生不良反应之间的关系通过统计模型进行描述,建立不同的评估模型最终拟合人体患病概率,还可以通过敏感性分析对相应的干预措施进行评估,为控制风险提出相应建议[9]。例如,通常评估特定危害对特定人群产生的影响,会使用QMRA中的微生物预测模型和剂量-反应模型[54]。在危害食品安全的生物性因素中,食源性致病菌污染是引起食源性疾病的首要原因,食品供应链各阶段的多个步骤可能会增加微生物食源性疾病预防管理的复杂性。保持卫生和遵守安全标准对于降低生鲜蔬菜的食源性污染风险至关重要。QMRA 是通过估计与接触食源性病原体相关的风险的可能性和程度来帮助确保安全的食品生产过程。通过量化微生物污染的概率和健康影响,QMRA能够为食品安全管理提供科学依据。与传统评估方法相比,QMRA具有更高的精确性和可操作性。风险评估方法可以在过程开始时使用,以了解风险的重要性并确定是否需要进行更深入的分析。
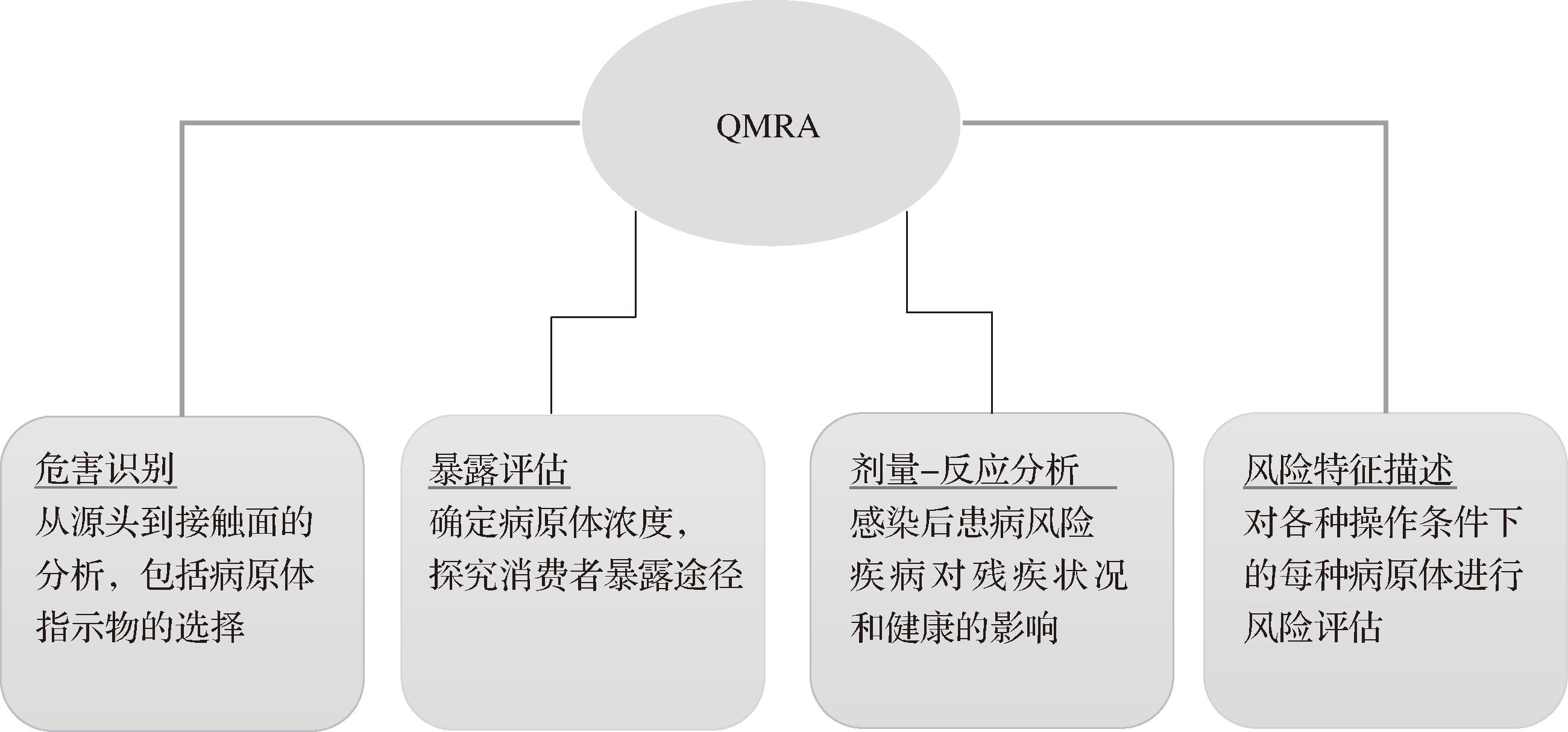
图2 QMRA框架[21]
Fig.2 QMRA Framework[21]
2.2 目前国内外已开展的致病菌定量风险评估研究
目前在已开展的致病菌定量风险评估中,过程风险模型(process risk model,PRM)被广泛引入,它将食品产业全链条的行为模拟为一个连续的过程,并做风险评估,描述了定量风险评估方法与情景分析和预测微生物学的集成和应用,着重过程中的卫生特性。食物产业链中的风险评估需要定量建模,描述致病菌沿食物产业链的数量变化规律,以便预测风险并施加干预措施。模块化过程风险模型(modular process risk model, MPRM)以PRM为基础,将食物链划分为微生物的失活、生长及食品处理过程中混合、分割、交叉污染、消减6 个模块,并对每个模块及交互作用进行建模,简化了模型的构建过程[9]。此外,蒙特卡洛(Monte Carlo)建模技术通常用于包括来自食物链的可用数据。使用蒙特卡洛模拟的概率建模是一种易于实现、广泛使用的建模技术,它结合了随机抽样和统计建模来对复杂系统的输出变量进行采样。它的工作原理是构建一个概率/随机模型,该模型包含从农场到餐桌生产链中的所有重要过程。在微生物风险的背景下,蒙特卡洛从农场到餐桌系统可以预测食品中病原生物的生命周期作为时间的函数,其中时间元素包括存在生长,不生长和腐烂条件的所有步骤。蒙特卡洛模拟可用于集成多个概率密度函数使用相关参数对复杂领域的不确定性和可变性进行建模。了解不确定性和可变性的影响可以有助于更好地理解输入对模型输出的影响,从而确定和指导未来的研究需求。这种方法过去曾用于评估与生鲜即食品相关的微生物风险[55-56]。
致病微生物的不同菌群和分离株在生物学特性、致病机制、环境适应性等方面存在显著差异。传统的QMRA模型往往基于通用参数,难以准确反映特定微生物的实际风险。通过针对特定微生物的特性进行参数调整和优化的模型能够更真实地模拟其在食品链中的行为和对人类健康的影响,这种精细化模型的建立需要大量的实验数据支持,包括不同微生物的生长动力学、存活率、传播途径等。此外,模型的复杂性增加也对计算能力和算法提出了更高要求。有研究表明在旨在涵盖各种不同微生物物种的预测建模方法方面,已经取得了进展,例如,在灭活过程中,针对特定细胞进行一系列的迭代实验、计算机模拟和数学分析[57]。微生物种群在灭活过程中耐受性的差异,以及灭活时间的不同,都是建模方法[58-59]。近年来,由于抗生素的大量使用,部分致病菌的耐药性广泛存在,给人类健康和生命安全造成威胁。基于QMRA的基础,研究人员开发了QMRA-DALY模型,该模型整合了QMRA 和健康负担-伤残调整生命年(disability-adjusted life years, DALYs),用于根据感染的可能性评估微生物风险。该模型考虑了使用蒙特卡洛模拟进行感染概率和健康负担评估的不确定性,即综合考虑了病原微生物环境暴露的不确定性、死亡率、残疾权重和住院时间等因素,以评估感染对健康造成的负担。通过QMRA可以估算环境中致病性抗生素抗性细菌的感染概率[34]。QMRA-DALY目前主要应用于源于环境与水的污染,以及肉类中致病菌污染所致的健康负担风险的相关研究,对于评估来源于蔬菜中的致病菌而致的健康风险研究相对较少。
目前,尽管一些研究尝试开发针对特定微生物的QMRA模型,但其应用范围仍相对有限,且模型的验证和标准化工作仍需进一步加强。现有文献提出了一些更先进的建模方法,即多层次分析,在建模方法中纳入细菌菌株的变异性。此外,通过在 GitHub 等平台上与全球研究团队共享计算源代码,使得进行全面风险评估成为可能可以更有效地完善QMRA[59-60]。
2.3 国内外针对生鲜蔬菜中4种主要致病微生物的定量风险评估研究
近年来,QMRA在蔬菜微生物控制中的应用逐渐增多。例如,研究表明,通过QMRA可以量化灌溉水中大肠杆菌的污染风险,并优化灌溉水质标准。此外,QMRA还被用于评估冷链物流中温度波动对蔬菜微生物安全的影响,为改进冷链管理提供依据[15,61-62]。因此,国外已经进行了许多关于应用QMRA来评估新鲜农产品(如生鲜果蔬和蔬菜沙拉)的病原体载量及其对公众健康的相关污染风险的综合研究。表3依据ABE 等[63]在2024年和BHATIA等[15,64]分别在2024年和2025年的文献总结,结合TAKAYAMA等[65]在2023年以及SONWANI等[66]在2022年的研究,归纳了针对生鲜蔬菜和即食蔬菜中主要的4种微生物危害的风险评估方法及应用研究。可以看出,蒙特卡洛模拟方法是应用于生鲜蔬菜和即食蔬菜中的QMRA模型中最常见和最常用的技术(表3)。表3证明了QMRA通过“危害识别-暴露评估-剂量反应-风险特征”4步来量化风险,其中蒙特卡洛模拟因能整合供应链多源异构数据,成为主流建模技术,例如:菠菜中大肠杆菌风险评估采用MPRM框架模拟灌溉水污染场景,帮助种植者就减少微生物污染的有效预防措施做出决策[67];对于即食沙拉中的李斯特菌的控制基于泊松-对数正态模型,明确适当的贮存条件,可减低风险[68]。综述总结了风险评估研究中QMRA方法的使用,包含建模步骤和用于识别食源性疾病和评估与食用受污染的新鲜农产品作物相关的人类健康风险系统的评估框架(基于网络)[62]。虽然文献总结的每项研究都有其独特的应用,但广泛趋同。这些方法为生鲜蔬菜的微生物风险管理提供了应用启发[62,69],其中很多应用突出了新鲜农产品链中的关键污染变量和过程[61,67],评估了已经实施的预防措施的有效性,阐述了因知识不足而产生的数据差距所致的风险因素[63,70],并提供了旨在降低风险的干预措施的制定和采用建议[56,65,71-74]。由此可见,近年来,QMRA在蔬菜微生物控制中的应用逐渐增多。文献研究表明由于微生物的生长、改变具有不可预测性和不确定性,利用全面的编程模拟软件来评估微生物降解过程中的可变性将有助于开发下一代建模工具[66,58]。目前,旨在捕获各种微生物物种的预测建模方法已经取得了进步[57]。尽管QMRA在蔬菜微生物控制中表现出巨大潜力,但其应用仍面临一些挑战。例如,数据获取困难、模型构建复杂以及不确定性分析不足等问题限制了QMRA的广泛应用。在表3 的总结中可以看出QMRA对蔬菜中4种主要致病微生物的评估应用主要集中在供应链的前端和中部,对来自消费操作和交叉污染的评估数据不足。由此可见,整合交叉污染情景的QMRA模型存在局限性,这在一定程度上可归因于微生物转移数据的缺乏,以及食品处理实践和消费者行为方面信息的不足。由于收获后单元操作的复杂性,QMRA 模型通常无法准确描述交叉污染对疾病/死亡风险的贡献。尽管整合交叉污染情景的QMRA模型存在局限性,QMRA仍可用于确定特定交叉污染因素(如接触/触摸次数、洗手频率以及干预策略)对最终风险的相对影响,从而有可能就合适的干预措施和工艺参数提出建议,以降低因食用新鲜蔬菜而产生的风险[45]。目前我国对于生鲜蔬菜生产、加工、贮藏和分销过程中重要微生物的危害风险评估相对缺乏,难以为标准的制定和企业食品安全管理提供有力支撑[9]。因此,加强我国生鲜蔬菜中主要微生物危害风险定量评估与控制研究工作将会是未来研究趋势。未来研究应注重数据标准化、模型优化和多学科交叉合作。
表3 针对生鲜蔬菜和即食蔬菜中主要致病微生物的风险评估研究
Table 3 Risk assessment studies conducted for major foodborne pathogens in fresh vegetables and ready-to-eat fresh produce

致病来源致病微生物风险评估方法应用、局限性及未来应用研究参考文献即食蔬菜沙门氏菌基于网络的新鲜农产品的评估框架工具进行实地考察和灌溉用水评估的信息工具,帮助在农场阶段控制管理微生物风险[62]水培蔬菜、番茄沙门氏菌概率风险评估模型(蒙特卡洛)应用定量微生物风险评估框架来量化水培蔬菜和番茄中的沙门氏菌属带来的健康风险[65,71]生切生菜大肠杆菌概率风险评估模型(蒙特卡洛)协助识别绿叶蔬菜行业中与大肠杆菌污染相关的潜在风险 , 通知食品安全风险,帮助管理人员及时制定适当的风险管理策略[61]生长-死亡模型(蒙特卡洛)帮助风险管理者和决策者考虑生鲜产品链上的关键控制因素帮助评估拟议的风险缓解干预措施效果[70][63]生菜大肠杆菌李斯特菌人体暴露定量评估模型(蒙特卡洛)为生产者设定最大允许风险控制域提供基础,提供恰当的采后实践建议[56]模块化过程风险方法(蒙特卡洛)用于开发类似模型,以确定受污染灌溉水和基因转移对新鲜农产品的影响[69]定量风险评估模型(蒙特卡洛)帮助建议识别零售和消费阶段受微生物污染的潜在风险,为未来的(风控)需求提供科学数据[63]生鲜果蔬大肠杆菌卷积神经网络预测微生物在果蔬中的生长变化[66]诺如病毒概率风险评估模型(蒙特卡洛)以考虑社区灰水再利用可能增加的影响以及本模型中未包括的其他风险(化学风险、土壤和环境健康)[68]脆头莴苣诺如病毒病毒转运模型协助研究不同因素对农业用水污染引发疾病的影响;为病原体运输和植物-微生物相互作用的新数据提供框架[73]小菠菜大肠杆菌基于模块化过程风险模型框架建立的粪便污染模型帮助种植者就减少微生物污染的有效预防措施做出决策[67]混合沙拉李斯特菌、大肠杆菌泊松-对数正态剂量反应模型和指数剂量反应模型(蒙特卡洛)告知食品生产者适当的贮存条件,以降低食源性疾病的风险[64,68]诺如病毒概率风险评估模型(蒙特卡洛)强调了卫生操作与水质控制法规的需求,为未来的(疾控)指导方针和政策提供基础[72]李斯特菌离散事件模型构建了基于农场到餐桌人类暴露评估模型,以研究其与食源性肠道病原体相关的潜在风险;为风险管理人员提供有关零售场所食品安全实践和缓解(风险)策略的信息[74]
3 生鲜蔬菜零售流通环节中的重要微生物安全控制管理
在生鲜蔬菜供应链各个环节的操作中,特别是后端的零售流通中,如果不能按照良好生产规范进行正确控制,可能会导致致病微生物污染。预测性微生物学在食品安全的各个方面发挥着关键作用,包括危害分析、HACCP系统、QMRA和应对新出现的风险。预测性微生物学利用数学模型和统计工具来预测食品中微生物的行为,为风险管理策略提供有价值的见解[75],能够主动评估与食品相关的潜在微生物危害。通过结合预测模型,食品安全专业人员可以预测病原体或腐败微生物在不同条件下的生长和行为。这些信息对于识别潜在危害和实施预防措施以确保食品供应链的安全至关重要[59,76]。对于生鲜蔬菜供应链后端的微生物安全风险的控制主要是预防风险管理控制。目前,以识别关键危害控制点来对安全风险进行控制的HACCP是国内外控制食品安全的主要预防管理体系[77]。HACCP是一种识别、评估和控制食品安全危害的系统方法。HACCP管理首先要识别零售与流通过程中的每一个关键危害风险点,对关键危害风险控制点进行分析以设定关键控制流程和方法来控制管理蔬菜的质量安全风险。因此,识别风险和风险管理是HACCP管理的基础。目前,国内外学者在对生鲜蔬菜零售流通阶段的风险管理执行点的研究中发现对于生鲜蔬菜零售流通中的风险控制措施包含了从供应商的选择,蔬菜和设备容器的清洁,蔬菜的贮存和运输,货架陈列的控制,到员工培训、样检、信息管理(及追溯)等贯穿了零售流通流程中的每一个关键风险点。HACCP管理既是对这些风险进行有效的控制与管理[78-79]。同时,在对关键风险点的确定中,微生物风险预测模型有助于确定关键控制点。在这些控制点中,干预措施可以有效地预防、消除或将危害减少到可接受的水平。通过将预测性微生物学纳入HACCP框架,可以提高生鲜蔬菜微生物安全控制管理措施的精确度和有效性,从而将微生物污染的风险降至最低[59,80]。
基于对国内外相关研究的比较和分析, 本文献研究明确了HACCP-QMRA集成框架是生鲜蔬菜零售流通环节中的重要微生物安全控制管理的有效控制框架,提出“预测-识别-干预”三级控制体系如下:
a)预测层:利用QMRA模拟温度波动对微生物生长的非线性影响(例如不同温度下的不同致病菌的增殖速率提高倍数)建立预测。
b)识别层:实施HACCP,通过敏感性分析确定关键控制点(例如确定不同种类蔬菜的货架期)。
c)干预层:制定基于风险阈值的动态监管策略(如菌落数超限自动触发追溯机制)。
4 结语与展望
由于生鲜蔬菜的营养性和日益健康的生活方式的转变, 人们对生鲜蔬菜的需求越来越大,全球蔬菜的生产量和消费量日益增长, 随之而来的安全风险也日渐突出。由致病微生物所致的食源性疾病的爆发是食用生鲜蔬菜最大的安全风险之一。生鲜蔬菜在整个供应链的各个环节中都面临着食源性病原体引入的多重风险。由于生鲜蔬菜水分活度高的易腐特性,在生产和零售流通过程中很容易受到病菌的污染,其引发的微生物危害风险和潜在的食品安全问题日益受到重视。在对国内外报道的由于食用被污染的生鲜蔬菜而致的食源性疾病爆发事件的分析中发现沙门氏菌、大肠杆菌、李斯特菌和诺如病毒是生鲜蔬菜中存在的最常导致疾病爆发的主要微生物。在对国内外已开展的针对蔬菜中的这4种主要微生物的风险危害、评估方法与控制研究的总结分析发现:
a)包含了QMRA和 HACCP的预测微生物管理体系是预防和控制微生物危害风险的核心。
b)蒙特卡洛模拟法是应用于生鲜蔬菜和即食蔬菜中的QMRA模型中最常见和最常用的技术。它结合了随机抽样和统计建模来对复杂系统的输出变量进行采样,是一种易于实现、广泛使用的建模技术。对于QMRA方法的应用的研究,其中很多突出了新鲜农产品链中的关键污染变量和过程,评估了已经实施的预防措施的有效性,为未来生鲜蔬菜的微生物风险管理提供了应用启发。例如,开发MPRM,将生鲜蔬菜供应链分解为6个可量化模块(失活/生长/交叉污染等),支持多场景风险模拟;创新应用泊松-对数正态混合模型,解决低剂量病原体暴露的非线性剂量-反应关系难题。
c)预测性微生物学在食品安全的各个方面发挥着关键作用,包括危害分析、HACCP系统、QMRA和应对新出现的风险。在零售流通环节中,生鲜蔬菜致病微生物的控制需要预测性微生物学的支持。对于生鲜蔬菜供应链后端的微生物安全风险的控制主要是预防风险管理控制。目前,以识别关键危害控制点来对安全风险进行控制的HACCP是国内外控制食品安全的主要预防管理体系。有效地识别零售流通过程中的每一个关键控制点是控制生鲜蔬菜微生物危害风险的关键。QMRA-HACCP协同框架,将蒙特卡洛模拟的动态风险评估与HACCP的关键控制点识别相结合,突破传统静态评估局限。通过构建“预测-识别-干预”三级模型,实现微生物污染风险从量化分析到精准干预的全流程闭环管理。
总而言之,生鲜蔬菜的微生物安全风险存在于食品供应链的各个环节,供应链前端和中间环节各个步骤的有害微生物的侵入,都会给后端零售流通环节带来严重的微生物风险。由于微生物在生长初期的高隐匿性,以及“动态”的变异性,包含了QMRA和HACCP的预测微生物管理体系是预防和控制微生物危害风险的核心。目前,我国对于生鲜蔬菜的生产、加工、贮藏和分销过程中重要微生物的危害风险评估相对缺乏,因此,加强我国生鲜蔬菜中主要微生物危害风险定量评估与控制研究工作将会是未来研究趋势。
此外, QMRA通过量化微生物风险动态,为生鲜蔬菜供应链精细化管理提供新范式。然而,我国在生鲜蔬菜的零售流通控制管理中仍需突破两大瓶颈:数据壁垒和技术转化。建议建立跨部门微生物监测网络,实现农场-零售数据实时共享来突破数据壁垒;同时,推动QMRA与区块链溯源技术融合,构建风险预警平台完成技术转化。因此,未来研究应聚焦人工智能驱动的QMRA(如深度学习预测微生物生长曲线),同时加强国际合作,共建全球蔬菜微生物风险评估数据库。
[1] SHAHARUDIN M S, FERNANDO Y. Cold supply chain of leafy green vegetables: A social network analysis approach[J]. Journal of Science and Technology Policy Management, 2024, 15(4):794-817.
[2] MACHADO-MOREIRA B, RICHARDS K, BRENNAN F, et al. Microbial contamination of fresh produce: What, where, and how?[J]. Comprehensive Reviews in Food Science and Food Safety, 2019, 18(6):1727-1750.
[3] FAO (Food and Agriculture Organization of the United Nations). Vegetable Consumption Per Capita 2022[EB/OL]. Our World in Data. (2024-03-14)[2025-01-06].https://ourworldindata.org/grapher/vegetable-consumption-per-capita.
[4] KLI TINCOV
TINCOV N, PIN L, PU
N, PIN L, PU K
K ROV
ROV A, et al. From farm to fork: Fungal and bacterial contaminants and their diagnostics in the production steps of ready-to-eat salads[J]. Trends in Food Science &Technology, 2024, 150:104573.
A, et al. From farm to fork: Fungal and bacterial contaminants and their diagnostics in the production steps of ready-to-eat salads[J]. Trends in Food Science &Technology, 2024, 150:104573.
[5] CHENG L, JIANG S, ZHANG S, et al. Consumers’ behaviors and concerns on fresh vegetable purchase and safety in Beijing urban areas, China[J]. Food Control, 2016, 63:101-109.
[6] OECD (Organization for Economic Co-operation and Development). OECD-FAO agricultural outlook 2018-2027[EB/OL]. (2018-07-03)[2024-0-06].https://www.oecd.org/content/dam/oecd/en/publications/reports/2018/07/oecd-fao-agricultural-outlook-2018-2027_g1g8c661/agr_outlook-2018-en.pdf.
[7] NBSC (National Bureau of Statistics of China). China statistical yearbook 2017[EB/OL].(2017-10-13)[2023-07-08]. http://www.stats.gov.cn/english/.
[8] MISHRA A, ROY S, ISRAEL SHAIKH N, et al. Recent advances in multiplex aptasensor detection techniques for food-borne pathogens: A comprehensive review of novel approaches[J]. Biosensors and Bioelectronics: X, 2024, 16:100417.
[9] 蒋雪晴, 张一敏, 罗欣, 等. 冷鲜肉中致病菌定量风险评估研究进展[J]. 食品科学, 2023, 44(3):288-295.JIANG X Q, ZHANG Y M, LUO X, et al. A review of quantitative risk assessment of pathogenic bacteria in chilled meat[J]. Food Science, 2023, 44(3):288-295.
[10] BERNARDO R, BARRETO A S, NUNES T, et al. Estimating Listeria monocytogenes growth in ready-to-eat chicken salad using a challenge test for quantitative microbial risk assessment[J]. Risk Analysis, 2020, 40(11):2427-2441.
[11] HADJILOUKA A, TSALTAS D. Cyclospora cayetanensis: Major outbreaks from ready to eat fresh fruits and vegetables[J]. Foods, 2020, 9(11):1703.
[12] ZHANG H, YAMAMOTO E, MURPHY J, et al. Microbiological safety of ready-to-eat fresh-cut fruits and vegetables sold on the Canadian retail market[J]. International Journal of Food Microbiology, 2020, 335:108855.
[13] DYDA A, NGUYEN P Y, AHMAD CHUGHTAI A, et al. Changing epidemiology of Salmonella outbreaks associated with cucumbers and other fruits and vegetables[J]. Global Biosecurity, 2020, 1(3):1-13.
[14] AIYEDUN S O, ONARINDE B A, SWAINSON M, et al. Foodborne outbreaks of microbial infection from fresh produce in Europe and North America: A systematic review of data from this millennium[J]. International Journal of Food Science &Technology, 2021, 56(5):2215-2223.
[15] BHATIA V, NAG R, BURGESS C M, et al. Microbial risks associated with Ready-To-Eat Fresh Produce (RTEFP)-A focus on temperate climatic conditions[J]. Postharvest Biology and Technology, 2024, 213:112924.
[16] 刘明, 曹梦思, 彭雪菲, 等. 重大活动中食源性疾病的食品安全风险评估分级研究[J]. 中国食品卫生杂志, 2021, 33(6):657-665.LIU M, CAO M S, PENG X F, et al. Food safety risk assessment and risk rating study for foodborne disease at major events[J]. Chinese Journal of Food Hygiene, 2021, 33(6):657-665.
[17] 王霄晔, 任婧寰, 王哲, 等. 2017年全国食物中毒事件流行特征分析[J]. 疾病监测, 2018, 33(5):359-364.WANG X Y, REN J H, WANG Z, et al. Epidemiological characteristics of food poisoning events in China, 2017[J]. Disease Surveillance, 2018, 33(5):359-364.
[18] 肖兴宁, 王珍, 何天, 等. 浙江省生菜致病微生物污染现状与分析[J]. 浙江农业科学, 2020, 61(11):2333-2335.XIAO X N, WANG Z, HE T, et al. Status of pathogenic microbial contamination in lettuce in Zhejiang Province[J]. Journal of Zhejiang Agricultural Sciences, 2020, 61(11):2333-2335.
[19] 白亚龙, 廖小艳, 崔妍. 消除鲜食生菜中细菌污染的研究进展[J]. 食品科学, 2022, 43(19):367-374.BAI Y L, LIAO X Y, CUI Y. Progress in eliminating bacterial contamination in ready-to-eat lettuce[J]. Food Science, 2022, 43(19):367-374.
[20] THOMAS G A, GIL T P, MÜLLER C T, et al. From field to plate: How do bacterial enteric pathogens interact with ready-to-eat fruit and vegetables, causing disease outbreaks?[J]. Food Microbiology, 2024, 117:104389.
[21] NATISHAH A J, S SAMUEL M, VELMURUGAN K, et al. Contamination of groundwater by microorganisms and risk management: Conceptual model, existing data, and challenges[J]. Groundwater for Sustainable Development, 2025, 29:101408.
[22] LU J E, WU H, WU S B, et al. Salmonella: Infection mechanism and control strategies[J]. Microbiological Research, 2025, 292:128013.
[23] European Food Safety Authority, European Centre for Disease Prevention and Control. The European Union summary report on trends and sources of zoonoses, zoonotic agents and food-borne outbreaks in 2015[J]. EFSA Journal, 2016, 14(12): e04634.
[24] DA SILVA R T, DE SOUZA PEDROSA G T, DOS SANTOS FRANCO A J, et al. Transfer, survival and photoinactivation of Salmonella enterica on fresh produce and gloves[J]. International Journal of Food Microbiology, 2025, 431:111089.
[25] CDC (Center for Disease Control and Prevention). Salmonella Outbreak linked to fresh basil, April 2024[EB/OL]. (2024-06-18)[2025-03-15].https://www.cdc.gov/salmonella/outbreaks/basil-04-24/index.html
[26] LIU T Y, ZHANG W, LI D Z, et al.Isolation and characterization of Salmonella Typhimurium monophasic variant phage and its application in foods[J]. Food Research International, 2025, 203:115852.
[27] 郑林, 祝令伟, 郭学军, 等. 沙门氏菌主要流行血清型耐药性的研究进展[J]. 江苏农业科学, 2020, 48(6):8-12.ZHENG L, ZHU L W, GUO X J, et al. Research progress of antimicrobial resistance of major epidemic serotypes of Salmonella[J]. Jiangsu Agricultural Sciences, 2020, 48(6):8-12.
[28] FARIA D B, ULSEN C, MAFFEI D F, et al. Role of post-harvest abiotic factors on interactions of Salmonella typhimurium with lettuce leaves (Lactuca sativa L. var crispa)[J]. Food Microbiology, 2025, 128:104732.
[29] MARTINSON J N V, WALK S T. Escherichia coli residency in the gut of healthy human adults[J]. EcoSal Plus, 2020, 9(1). DOI: 10.1128/ecosalplus.ESP-0003-2020.
[30] ROJAS-LOPEZ M, MONTEIRO R, PIZZA M, et al. Intestinal pathogenic Escherichia coli: Insights for vaccine development[J]. Frontiers in Microbiology, 2018, 9:440.
[31] CALLEJ N R M, RODR
N R M, RODR GUEZ-NARANJO M I, UBEDA C, et al. Reported foodborne outbreaks due to fresh produce in the United States and European Union: Trends and causes[J]. Foodborne Pathogens and Disease, 2015, 12(1):32-38.
GUEZ-NARANJO M I, UBEDA C, et al. Reported foodborne outbreaks due to fresh produce in the United States and European Union: Trends and causes[J]. Foodborne Pathogens and Disease, 2015, 12(1):32-38.
[32] 瞿洋, 白亚龙, 林婷, 等. 生菜叶片完整性对金黄色葡萄球菌生长的影响[J]. 上海农业学报, 2020, 36(4):89-93.QU Y, BAI Y L, LIN T, et al. The effects of lettuce leaf integrity on the growth of Staphylococcus aureus[J]. Acta Agriculturae Shanghai, 2020, 36(4):89-93.
[33] COULOMBE G, CATFORD A, MARTINEZ-PEREZ A, et al. Outbreaks of Escherichia coli O157: H7 infections linked to romaine lettuce in Canada from 2008 to 2018: An analysis of food safety context[J]. Journal of Food Protection, 2020, 83(8):1444-1462.
[34] GOH S G, HALLER L, NG C, et al. Assessing the additional health burden of antibiotic resistant Enterobacteriaceae in surface waters through an integrated QMRA and DALY approach[J]. Journal of Hazardous Materials, 2023, 458:132058.
[35] KOOPMANS M M, BROUWER M C, V ZQUEZ-BOLAND J A, et al. Human listeriosis[J]. Clinical Microbiology Reviews, 2023, 36: e00060-19.
ZQUEZ-BOLAND J A, et al. Human listeriosis[J]. Clinical Microbiology Reviews, 2023, 36: e00060-19.
[36] European Food Safety Authority, European Centre for Disease Prevention and Control. Multi-country outbreak of Listeria monocytogenes serogroup IVb, multi-locus sequence type 6, infections linked to frozen corn and possibly to other frozen vegetables-first update[J]. EFSA Supporting Publications, 2018, 15(7):1448E.
[37] KONG Y J, CAI X L, GAO C, et al. Synergistic antimicrobial effect of ultrasound and carvacrol nanoemulsion against Listeria monocytogenes and its application in cabbage preservation[J]. Food Bioscience, 2025, 68:106359.
[38] SELF J L, CONRAD A, STROIKA S, et al. Multistate outbreak of listeriosis associated with packaged leafy green salads, United States and Canada, 2015-2016[J]. Emerging Infectious Diseases, 2019, 25(8):1461-1468.
[39] 刘凌云, 毛盼, 陈晋妮, 等. 1株李斯特菌噬菌体的分离、保存及生物学特性研究[J]. 中国人兽共患病学报, 2024, 40(5):435-441.LIU L Y, MAO P, CHEN J N, et al. Isolation, preservation, and biological characteristics analysis of a Listeria bacteriophage[J]. Chinese Journal of Zoonoses, 2024, 40(5):435-441.
[40] 景宇, 李景云, 王学硕, 等. 可生食蔬菜中单核细胞增生李斯特菌生存特征研究[J]. 中国食品卫生杂志, 2023, 35(12):1704-1709.JING Y, LI J Y, WANG X S, et al. Study of survival characteristics of Listeria monocytogenes on edible vegetables[J]. Chinese Journal of Food Hygiene, 2023, 35(12):1704-1709.
[41] G MEZ-BALTAZAR A, HERN
MEZ-BALTAZAR A, HERN NDEZ-PÉREZ C F, FRANCO-FRIAS C U, et al. Genomic diversity and distribution of Listeria monocytogenes strains isolated from imported and national fresh produce in Mexico from 2014 to 2018[J]. Food Research International, 2025, 208:116211.
NDEZ-PÉREZ C F, FRANCO-FRIAS C U, et al. Genomic diversity and distribution of Listeria monocytogenes strains isolated from imported and national fresh produce in Mexico from 2014 to 2018[J]. Food Research International, 2025, 208:116211.
[42] ZHANG X B, CHEN C, DU Y X, et al. Global burden and trends of norovirus-associated diseases from 1990 to 2019: An observational trend study[J]. Frontiers in Public Health, 2022, 10:905172.
[43] RANDAZZO W. Pioneering use of human intestinal enteroids to prevent foodborne transmission of human norovirus[J]. Trends in Food Science &Technology, 2025, 156:104843.
[44] HAN J H, LEE N R, CHOI S W, et al. Antiviral activity of Polygonum aviculare extract against murine norovirus as norovirus surrogate and its application in model food[J]. LWT, 2024, 211:116887.
[45] POSSAS A, PÉREZ-RODR GUEZ F. New insights into cross-contamination of fresh-produce[J]. Current Opinion in Food Science, 2023, 49:100954.
GUEZ F. New insights into cross-contamination of fresh-produce[J]. Current Opinion in Food Science, 2023, 49:100954.
[46] KYERE E O, FOONG G, PALMER J, et al. Biofilm formation of Listeria monocytogenes in hydroponic and soil grown lettuce leaf extracts on stainless steel coupons[J]. Lwt, 2020, 126:109114.
[47] SOHRABI R, PAASCH B C, LIBER J A, et al. Phyllosphere microbiome[J].Annual Review of Plant Biology, 2023, 74:539-568.
[48] MULAOSMANOVIC E, LINDBLOM T U T, WINDSTAM S T, et al. Processing of leafy vegetables matters: Damage and microbial community structure from field to bag[J]. Food Control, 2021, 125:107894.
[49] GORSKI L, WALKER S, ROMANOLO K F, et al. Growth and survival of attached Listeria on lettuce and stainless steel varies by strain and surface type[J]. Journal of Food Protection, 2021, 84(5):903-911.
[50] BOTTICHIO L, KEATON A, THOMAS D, et al. Shiga toxin-producing Escherichia coli infections associated with romaine lettuce-United States, 2018[J]. Clinical Infectious Diseases, 2020, 71(8): e323-e330.
[51] MARIK C M, ZUCHEL J, SCHAFFNER D W, et al. Growth and survival of Listeria monocytogenes on intact fruit and vegetable surfaces during postharvest handling: A systematic literature review[J]. Journal of Food Protection, 2020, 83(1):108-128.
[52] BARDSLEY C A, TRUITT L N, PFUNTNER R C, et al. Growth and survival of Listeria monocytogenes and Salmonella on whole and sliced cucumbers[J]. Journal of Food Protection, 2019, 82(2):301-309.
[53] 张立实, 李晓蒙, 吴永宁. 我国食品安全风险评估及相关研究进展[J]. 现代预防医学, 2020, 47(20):3649-3652.ZHANG L S, LI X M, WU Y N. Food safety risk assessment in China and related research progress[J]. Modern Preventive Medicine, 2020, 47(20):3649-3652.
[54] 董庆利, 王海梅, Pradeep K MALAKAR, 等. 我国食品微生物定量风险评估的研究进展[J]. 食品科学, 2015, 36(11):221-229. DONG Q L, WANG H M, MALAKAR P, et al. Review of progress in quantitative microbiological risk assessment in China[J]. Food Science, 2015, 36(11):221-229.
[55] NAG R, RUSSELL L, NOLAN S, et al. Quantitative microbial risk assessment associated with ready-to-eat salads following the application of farmyard manure and slurry or anaerobic digestate to arable lands[J]. Science of the Total Environment, 2022, 806(Pt 3):151227.
[56] O’FLAHERTY E, SOLIMINI A G, PANTANELLA F, et al. Human exposure to antibiotic resistant-Escherichia coli through irrigated lettuce[J]. Environment International, 2019, 122:270-280.
[57] VO H D, FORERO-QUINTERO L S, AGUILERA L U, et al. Analysis and design of single-cell experiments to harvest fluctuation information while rejecting measurement noise[J]. Frontiers in Cell and Developmental Biology, 2023, 11:1133994.
[58] YADAV K K, NIMONKAR Y, PODDAR B J, et al. Two-dimensional cell separation: A high-throughput approach to enhance the culturability of bacterial cells from environmental samples[J]. Microbiology Spectrum, 2022, 10(3): e0000722.
[59] KUMAR V, AHIRE J J, TANEJA N K. Advancing microbial food safety and hazard analysis through predictive mathematical modeling[J]. The Microbe, 2024, 2:100049.
[60] Pecht T, Aschenbrenner A C, Ulas T, et al. Modeling population heterogeneity from microbial communities to immune response in cells[J]. Cellular and Molecular Life Sciences: CMLS, 2020, 77(3):415-432.
[61] BOZKURT H, BELL T, VAN OGTROP F, et al. Assessment of microbial risk during Australian industrial practices for Escherichia coli O157∶H7 in fresh cut-Cos lettuce: A stochastic quantitative approach[J]. Food Microbiology, 2021, 95:103691.
[62] Food Standards Scotland. Fresh Produce Tool[EB/OL].[2024-07-06]. https://www.foodstandards.gov.scot/business-guidance/running-a-food-business/tools-and-training/fresh-produce-tool.
[63] ABE H, ANDO A, KOYAMA K, et al. Effects of at-home-preparation on the risk of foodborne illness in Japan: Analysis of quantitative microbial risk assessment of Escherichia coli O157: H7, Salmonella Typhimurium, Listeria monocytogenes, and Campylobacter jejuni in lettuce salad made at home[J]. Microbial Risk Analysis, 2024, 27-28:100316.
[64] BHATIA V, NAG R, BURGESS C M, et al. Risk ranking of microbial hazards from consumption of ready-to-eat fresh produce (RTEFP)[J]. Food Control, 2025, 168:110986.
[65] TAKAYAMA S, ZHANG Q, ZWE Y H, et al. Quantitative microbial risk assessment of antibiotic-resistant Salmonella enterica contaminating hydroponic leafy vegetables[J]. Microbial Risk Analysis, 2024, 27-28:100330.
[66] SONWANI E, BANSAL U, ALROOBAEA R, et al. An artificial intelligence approach toward food spoilage detection and analysis[J]. Frontiers in Public Health, 2021, 9:816226.
[67] ALLENDE A, CASTRO-IB
 EZ I, LINDQVIST R, et al. Quantitative contamination assessment of Escherichia coli in baby spinach primary production in Spain: Effects of weather conditions and agricultural practices[J]. International Journal of Food Microbiology, 2017, 257:238-246.
EZ I, LINDQVIST R, et al. Quantitative contamination assessment of Escherichia coli in baby spinach primary production in Spain: Effects of weather conditions and agricultural practices[J]. International Journal of Food Microbiology, 2017, 257:238-246.
[68] SÖDERQVIST K, LAMBERTZ S T, VÅGSHOLM I, et al. Fate of Listeria monocytogenes, pathogenic Yersinia enterocolitica, and Escherichia coli O157∶H7 gfp+ in ready-to-eat salad during cold storage: What is the risk to consumers?[J]. Journal of Food Protection, 2017, 80(2):204-212.
[69] NJAGE P M K, BUYS E M. Quantitative assessment of human exposure to extended spectrum and AmpC β-lactamases bearing E. coli in lettuce attributable to irrigation water and subsequent horizontal gene transfer[J]. International Journal of Food Microbiology, 2017, 240:141-151.
[70] PANG H, LAMBERTINI E, BUCHANAN R L, et al. Quantitative microbial risk assessment for Escherichia coli O157: H7 in fresh-cut lettuce[J]. Journal of Food Protection, 2017, 80(2):302-311.
[71] LEE E S , IM S , MIN S C. Effects of in-package cold plasma treatment on the physicochemical and oral toxicological properties of raw grape tomatoes and the probability of salmonellosis from consumption of the tomatoes[J]. Food Control, 2023, 152:109809.
[72] BOUWKNEGT M, VERHAELEN K, ![]() A, et al. Quantitative farm-to-fork risk assessment model for norovirus and hepatitis A virus in European leafy green vegetable and berry fruit supply chains[J]. International Journal of Food Microbiology, 2015, 198:50-58.
A, et al. Quantitative farm-to-fork risk assessment model for norovirus and hepatitis A virus in European leafy green vegetable and berry fruit supply chains[J]. International Journal of Food Microbiology, 2015, 198:50-58.
[73] CHANDRASEKARAN S, JIANG S C. A dynamic transport model for quantification of norovirus internalization in lettuce from irrigation water and associated health risk[J]. Science of the Total Environment, 2018, 643:751-761.
[74] POUILLOT R, GALLAGHER D, TANG J, et al. Listeria monocytogenes in Retail Delicatessens: An Interagency Risk Assessment-model and baseline results[J]. Journal of Food Protection, 2015, 78(1):134-145.
[75] POSSAS A, VALERO A, PÉREZ-RODR GUEZ F. New software solutions for microbiological food safety assessment and management[J]. Current Opinion in Food Science, 2022, 44:100814.
GUEZ F. New software solutions for microbiological food safety assessment and management[J]. Current Opinion in Food Science, 2022, 44:100814.
[76] TARLAK F. The use of predictive microbiology for the prediction of the shelf life of food products[J]. Foods, 2023, 12(24):4461.
[77] RUBY G E, UNGKU ZAINAL ABIDIN U F, LIHAN S, et al. A cross sectional study on food safety knowledge among adult consumers[J]. Food Control, 2019, 99:98-105.
[78] DE OLIVEIRA L L, DA SILVA A L, PEREIRA C R, et al. The stakeholder’s roles in risk management related to food supply chain recalls: A systematic literature review[J]. The International Journal of Logistics Management, 2023, 34(1):106-129.
[79] GUNTZBURGER Y, THÉOLIER J, BARRERE V, et al. Food industry perceptions and actions towards food fraud: Insights from a pan-Canadian study[J]. Food Control, 2020, 113:107182.
[80] LEE J C, DARABA A, VOIDAROU C, et al. Implementation of food safety management systems along with other management tools (HAZOP, FMEA, ishikawa, Pareto). The case study of Listeria monocytogenes and correlation with microbiological criteria[J]. Foods, 2021, 10(9):2169.