肥胖和与之相关联的代谢性疾病(如胰岛素抵抗、非酒精性脂肪炎以及心血管疾病等)已成为全球公共卫生重大挑战。其中高脂饮食(high-fat diet,HFD)是肥胖的主要诱因之一,其可通过诱导全身心慢性低度炎症、加重机体氧化应激和扰乱体内脂质代谢,加剧代谢综合征的发展[1-2]。近年来,膳食活性脂质因其在调控炎症反应、改善脂质代谢和缓解氧化应激中的潜在作用而受到广泛关注。特别是多不饱和脂肪酸(polyunsaturated fatty acids,PUFAs),如二十碳五烯酸(eicosapentaenoic acid,EPA)和α-亚麻酸(α-linolenic acid,ALA),已被证实具有明显的缓解炎症和抵抗氧化应激的特性[3-4]。然而,关于共轭亚油酸(conjugated linoleic acid,CLA)及油酸(oleic acid,OA)等不同膳食脂质,对于HFD所诱发的代谢异常之具体调控效应,目前尚未得到全面系统的阐述。
研究表明,HFD不仅会导致体重增加和血脂异常,还会引发肠道功能障碍和肠道炎症,进一步加剧代谢紊乱[5-7]。肠道作为营养物质吸收和免疫调节的重要器官,其形态和功能的改变在肥胖及相关疾病的发生发展中起关键作用。HFD可导致肠道绒毛缩短、绒隐比降低,进而影响营养吸收和肠道屏障功能[8-10]。另外,长期HFD喂养可以激活核因子-κB信号通路,进而促进促炎细胞因子包括肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)与白细胞介素-1β(interleukin-1β, IL-1β)等的分泌,从而加重肠道炎症反应[11-12]。同时,HFD所引起的炎症因子水平的提升,会进一步激活体内的还原型辅酶Ⅱ,促进活性氧(reative oxygen species,ROS)的产生,进而使氧化应激指标超氧化物歧化酶(superoxide dismutase,SOD)和谷胱甘肽(glutathione,GSH)等的活性降低,两者相互作用,不断损害肠道健康[12-15]。
尽管EPA已被广泛研究并证实具有显著的抗炎和抗氧化作用,但其前体物质ALA的缓解肥胖及对肠道屏障功能的保护作用仍需深入探索。此外,CLA和OA虽在体外研究中表现出代谢调控潜力,但其在体内模型中的效果仍存在争议[16-17]。因此,系统评估不同膳食活性脂质对HFD诱导的肥胖及相关代谢紊乱的干预效果,对开发精准营养策略具有重要意义。
本研究利用HFD来诱导小鼠的肥胖,探究ALA、CLA及OA对小鼠体重、血清与肝脏血脂代谢、肠道组织形态、炎症因子TNF-α、IL-1β表达和氧化应激水平SOD、丙二醛(malondialdehyde,MDA)、过氧化氢酶(catalase,CAT)等的影响。旨在筛选出具有显著调控作用的活性脂质,为膳食脂质在肥胖及相关疾病中的应用提供实验依据。
1 材料与方法
1.1 材料与试剂
小鼠普通维持饲料、60%脂肪供能高脂纯化型饲料,江苏省协同医药生物工程有限责任公司;ALA、OA,上海颖心实验室;EPA、CLA,上海麦克林生化科技股份有限公司;血脂四项总胆固醇(total cholesterol, TC)、甘油三酯(triglyceride, TG)、低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-C)和高密度脂蛋白胆固醇(high density lipoprotein cholesterol, HDL-C)水平检测试剂盒,南京建成生物工程研究所;氧化应激试剂盒(SOD、MDA、CAT、GSH)、BCA蛋白浓度检测试剂盒,上海碧云天生物科技有限公司;TNF-α、IL-1β qPCR引物,上海生工生物工程有限公司。
1.2 仪器与设备
ME204E电子天平,上海梅特勒-托利多仪器有限公司;TGL-25M冷冻高速离心机、S1000TM Thermal Cycler梯度PCR扩增仪,赛默飞世尔科技有限公司;Synergy HTX多功能酶标仪,美国Berten公司;WH-861涡旋混匀器,太仓华立达公司生产。
1.3 实验方法
1.3.1 实验动物饲养条件
于上海杰斯捷实验动物有限公司购入6~8周龄SPF级C56BL/6 J雄性小鼠;实验动物许可证编号为SCXK(沪)2018-0004。饲养环境保持良好的空气流通,温度维持在(22±2) ℃,湿度控制在(55±5)%,并实行12 h的光照与黑暗交替循环。所有小鼠均可自由摄食和饮水。所有涉及动物的实验均严格遵循中国实验动物标准的指导方针,且按照国际有效的指导方针和协议进行的,并事先得到动物伦理委员会的批准,批准文号:IRB-AF63-V1.0。
1.3.2 实验动物分组设计
将鼠适应性喂养7 d,并按照每组8只的标准将其随机分成6组,分别为对照组(Con)、HFD组,EPA阳性对照组、ALA组、CLA组、OA组。除对照组自由摄入正常维持饲料外,其余所有小鼠自由摄入60%脂肪供能高脂纯化型饲料持续5周,构建肥胖小鼠模型。从第6周开始,EPA组、ALA组、CLA组、OA组每天给予1次脂质灌胃,Con组和HFD组灌胃等体积的生理盐水持续4周。在造模及干预期间每过1周记录1次小鼠体重。
各组灌胃体积及浓度如下:Con组与HFD组每日每只小鼠灌胃200 μL生理盐水;EPA组每天灌胃浓度为1 g/kg的200 μL EPA;ALA组每天灌胃浓度为0.221 g/kg的200 μL ALA;CLA组每天灌胃浓度为0.445 g/kg的200 μL CLA;OA组每天灌胃浓度为0.77 g/kg的200 μL OA;所有剂量参考于国家卫生标准WS/T 578.1—2017《中国居民膳食营养素参考摄入量 第1部分:宏量营养素》中各脂质的人体每日适宜摄入量并换算为小鼠适宜剂量,或者由前人实验所得[18-19]。给药浓度虽有所不同,但均为每日适宜摄入量,都可达到其最好的吸收与作用效果。
到第9周末,对小鼠实施16 h的禁食不禁水处理后,通过摘眼球取血法采集小鼠血液样本,并将其收集于添加了20 μL 1%(体积分数)EDTA的EP管内,随后对小鼠实施颈椎脱臼法处死。采集的血样于室温条件下静置2 h后,以4 000 r/min的转速离心10 min,分离取上清液。同时,迅速采集实验所需的小鼠各组织器官,并立即浸入液氮中进行快速冷冻后,转至-80 ℃冰箱中保存,以备后续实验所用。
1.3.3 血清及肝脏的脂质水平分析
从各组小鼠中采集血清及肝脏组织样本,依照试剂盒所提供的操作指南,对各样本的血脂指标进行测定与分析。具体指标包括血清及肝脏中的TC、TG含量、LDL-C水平以及HDL-C的测定。
1.3.4 小肠组织H&E染色
小鼠小肠组织形态观察采用苏木精和伊红(hematoxylin-eosin,H&E)染色法。首先将小肠组织样品用4%(体积分数)多聚甲醛固定48 h后,用梯度乙醇溶液脱水,并在二甲苯透明后在包埋框中进行石蜡包埋。使用切片机将包埋好的组织蜡块切片后,烤片2 h,然后在二甲苯中进行脱蜡处理2次,梯度乙醇水化后,用苏木精对切片进行染色。然后经过分色和反蓝步骤后使用伊红对其进行染色,最后进行脱水、透明、封片及镜检,并使用image J软件测量空肠绒毛长度与隐窝深度,计算绒隐比。
1.3.5 小肠组织炎症因子mRNA表达水平测定
用实时荧光定量逆转录PCR进行小肠组织炎症因子相关基因表达量的测定,先将引物使用TE(Tris-EDTA)缓冲液稀释到100 mol/L,再使用焦碳酸二乙酯(diethyl pyrocarbonate,DEPC)处理水稀释到10 μmol/L存于-20 ℃备用,引物列表如表1所示。
表1 实时荧光定量PCR引物序列
Table 1 Real time fluorescent quantitative PCR primer sequence
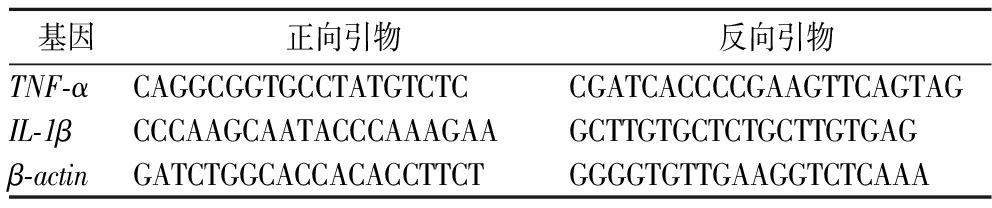
基因正向引物反向引物TNF-αCAGGCGGTGCCTATGTCTCCGATCACCCCGAAGTTCAGTAGIL-1βCCCAAGCAATACCCAAAGAAGCTTGTGCTCTGCTTGTGAGβ-actinGATCTGGCACCACACCTTCTGGGGTGTTGAAGGTCTCAAA
适量截取小鼠空肠组织并将其在液氮冷冻状态下研磨成粉。用EZ-10总RNA小量提取试剂盒提取RNA,注意离心时温度保持在4 ℃,其余步骤温度保持在室温即可。RNA的纯度及浓度使用酶标仪进行分析。使用HiscriptIIQRTSupermixforqPCR(+gDNAwiper)将RNA逆转录成cDNA。以逆转录的cDNA为模板,在ThermoLifeTech ABI Quant Studio3系统中使用SYBR Green PCR Core Reagent进行实时PCR,剩下的cDNA放于-20 ℃贮存以便下次使用,应注意避免反复冻融。mRNA的表达水平通过β-actin的表达水平为内参。用2-ΔΔCt法计算mRNA的相对表达量。
1.3.6 小肠组织氧化应激相关因子表达水平测定
从各组小鼠中获取小肠组织样本后,依据试剂盒的详细指导说明,对各组小鼠小肠组织的氧化应激水平进行测定与分析。具体指标包括SOD、CAT、GSH活性以及MDA浓度的测定。
1.4 统计分析
所有实验结果重复次数均不小于3次,所有数据均以“平均值±标准差”表示,数据图均通过Graph Pad Prism 9.5.0绘制,采用IBM SPSS Statistics 25独立样本T检验与普通单因素方差分析进行比较,差异有统计学意义(*P<0.05,**P<0.01,***P<0.001)。
2 结果与分析
2.1 不同膳食脂质对HFD小鼠一般体征的影响
如图1所示,长期HFD饲喂造模后各组小鼠的体重明显增加,而在EPA干预后体重长被抑制,ALA干预后与EPA阳性对照组呈现出相近的趋势,而CLA和OA干预则没有明显的抑制体重增加的效果;如表2所示,HFD喂养使小鼠器官质量增加,不同膳食脂质的干预有着不同程度的作用效果,其中ALA组相比于HFD组器官质量显著降低且与EPA组有相近趋势。综上,在3种膳食脂质中,ALA具有明显的缓解HFD小鼠体重增长及器官质量增加的效果,而CLA与OA则无显著影响。
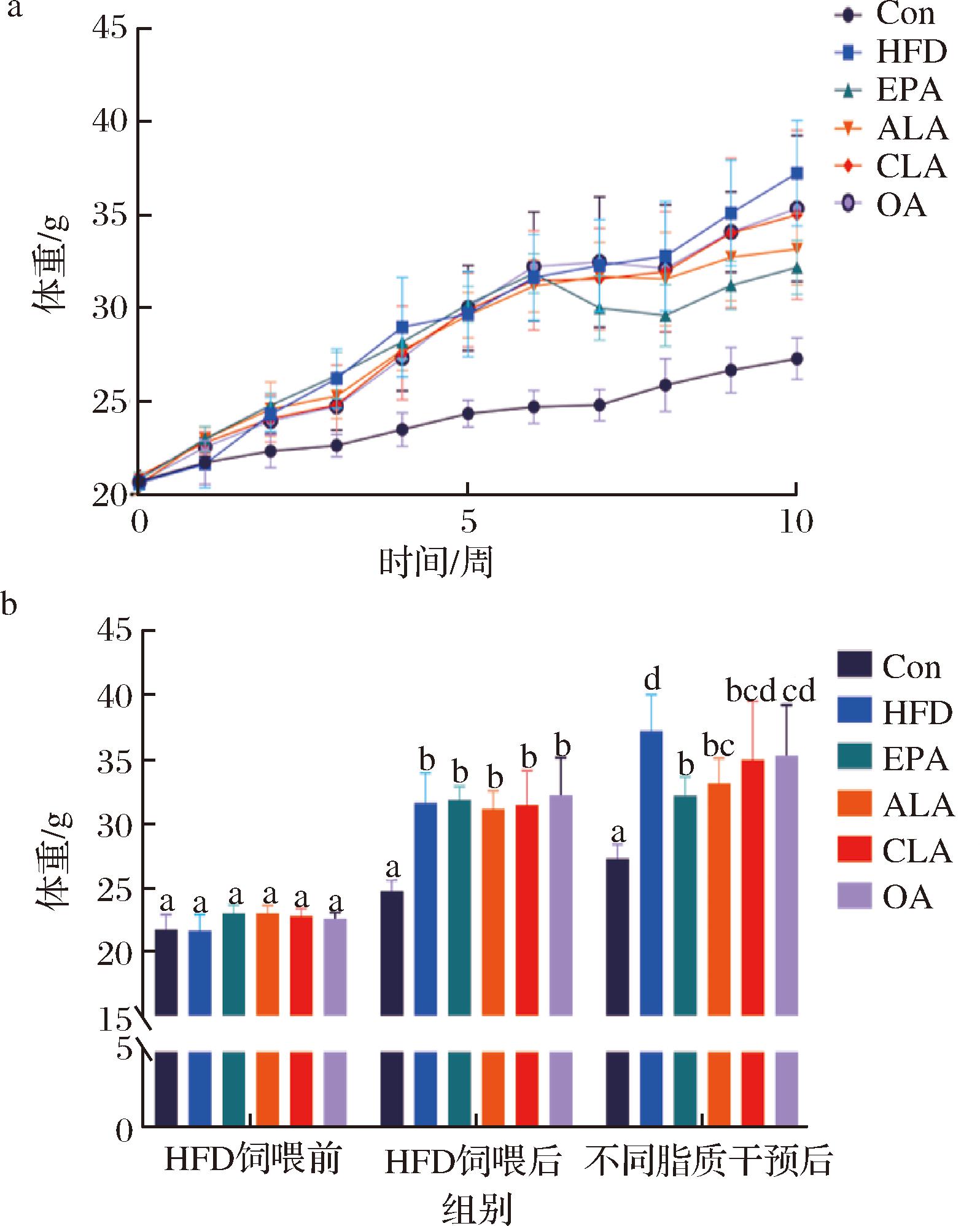
a-小鼠体重变化趋势;b-小鼠各关键阶段体重
图1 不同膳食脂质对HFD小鼠体重的影响
Fig.1 The effect of different dietary lipids on body weight of HFD mice
注:图中相同字母表示无显著性差异(P>0.05)。
表2 不同膳食脂质对HFD小鼠器官质量的影响
单位:g
Table 2 The effect of different dietary lipids on organ weight in HFD mice
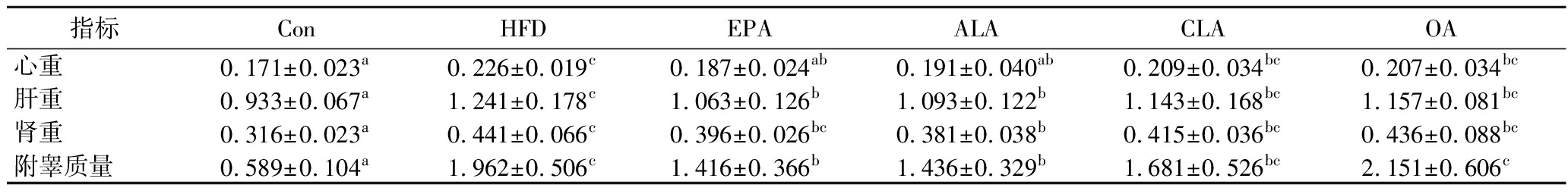
指标ConHFDEPAALACLAOA心重0.171±0.023a0.226±0.019c0.187±0.024ab0.191±0.040ab0.209±0.034bc0.207±0.034bc肝重0.933±0.067a1.241±0.178c1.063±0.126b1.093±0.122b1.143±0.168bc1.157±0.081bc肾重0.316±0.023a0.441±0.066c0.396±0.026bc0.381±0.038b0.415±0.036bc0.436±0.088bc附睾质量0.589±0.104a1.962±0.506c1.416±0.366b1.436±0.329b1.681±0.526bc2.151±0.606c
注:均值上标不同字母表示差异显著 (P≤0.05), 相同字母表示差异不显著(P>0.05)。
2.2 不同膳食脂质对HFD小鼠血清脂质谱的影响
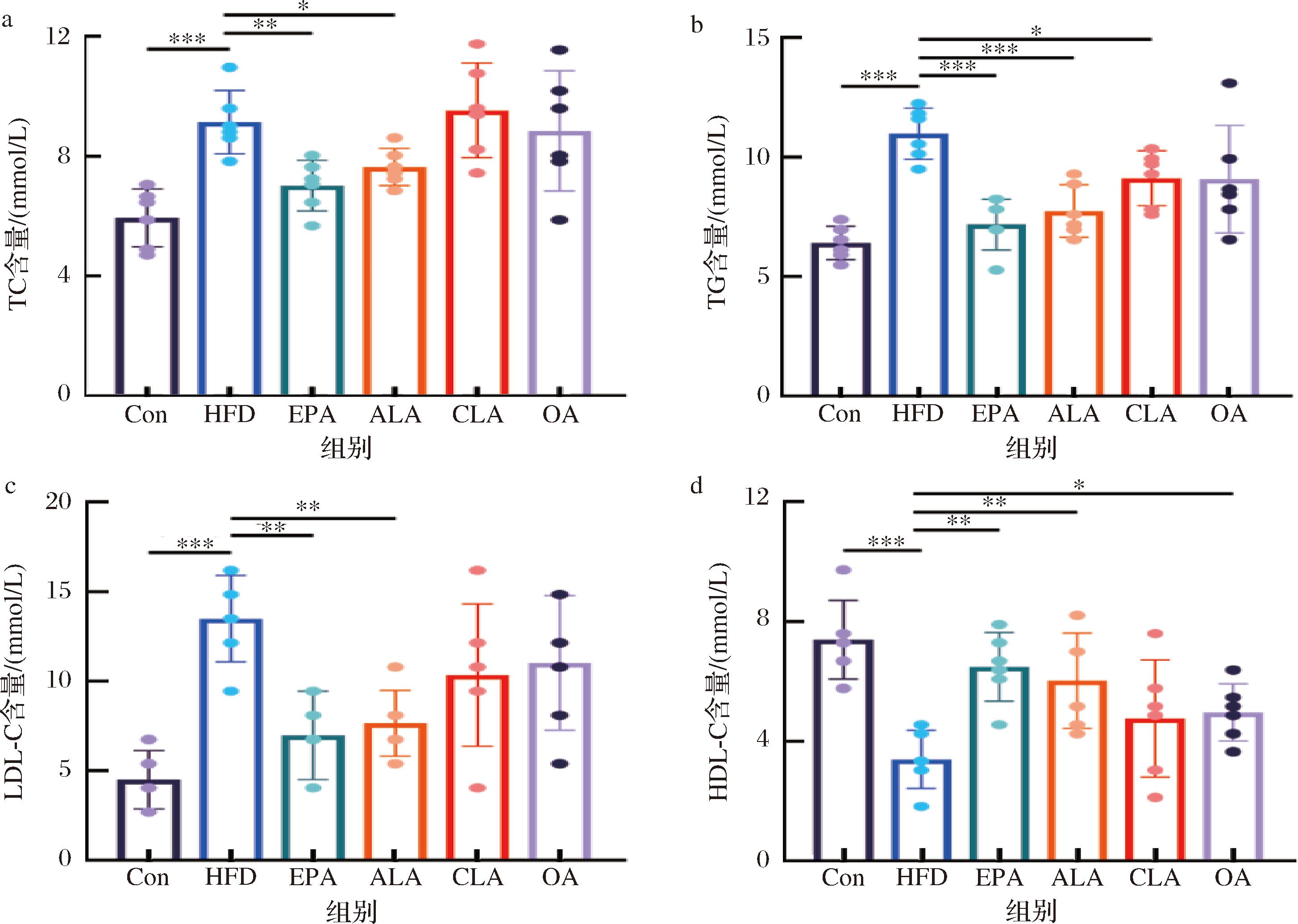
为深入研究不同膳食脂质对HFD小鼠代谢紊乱的影响,采用试剂盒法分别检测了小鼠血清与肝脏中的TC、TG、LDL-C及HDL-C的含量。不同膳食活性脂质对肥胖小鼠血清生化指标的影响如图2所示,小鼠的各项血脂指标在HFD喂养后均表现异常,其中TC、TG、LDL-C水平均显著提高,HDL-C则明显下降,表明HFD饲喂成功诱导了肥胖动物模型且导致血脂升高。而在EPA干预后显著缓解了这种趋势,且ALA组显示出与EPA相似的结果。CLA组与OA组则无明显效果。

a-小鼠血清TC;b-小鼠血清TG;c-小鼠血清LDL-C;d-小鼠血清HDL-C
图2 不同膳食脂质对HFD小鼠血清脂质谱的影响
Fig.2 The effect of different dietary lipids on serum lipids indicators in HFD mice
注:*P<0.05,**P<0.01,***P<0.001(下同)。
2.3 不同膳食脂质对HFD小鼠肝脏脂质谱的影响
不同膳食脂质对肥胖小鼠肝脏生化指标的影响如图3所示,HFD饲喂后小鼠的TC、TG含量及LDL-C表达水平显著上升,而HDL-C也明显下降。在ALA干预后显著逆转了小鼠肝脏血脂所表现出的异常状态,同时EPA组也显示出相似的结果,且肝脏血脂指标变化趋势与血清血脂指标变化趋势相同。这些结果表明,膳食ALA的干预可以促进小鼠体内血清及肝脏中的脂质代谢,改善了小鼠的脂质谱。
a-小鼠肝脏TC;b-小鼠肝脏TG;c-小鼠肝脏LDL-C;d-小鼠肝脏HDL-C
图3 不同膳食脂质对HFD小鼠肝脏生化指标的影响
Fig.3 The effect of different dietary lipids on liver lipids indicators in HFD mice
2.4 不同膳食脂质对HFD小鼠小肠组织形态的影响
为了探究不同膳食脂质对长期HFD饲喂小鼠小肠的影响,采用H&E染色的方法对小鼠小肠组织进行染色并观察各组的组织形态变化。各组小鼠空肠组织形态、绒毛长度及其绒隐比如图4所示,长时间的高脂饲料喂养使小鼠小肠绒毛长度缩短、绒隐比降低,ALA干预后显著逆转该趋势并与EPA组表现出相近的改善效果,且在ALA干预后肠绒毛排列更加紧密。而CLA组与OA组相比于HFD组无明显改善作用。
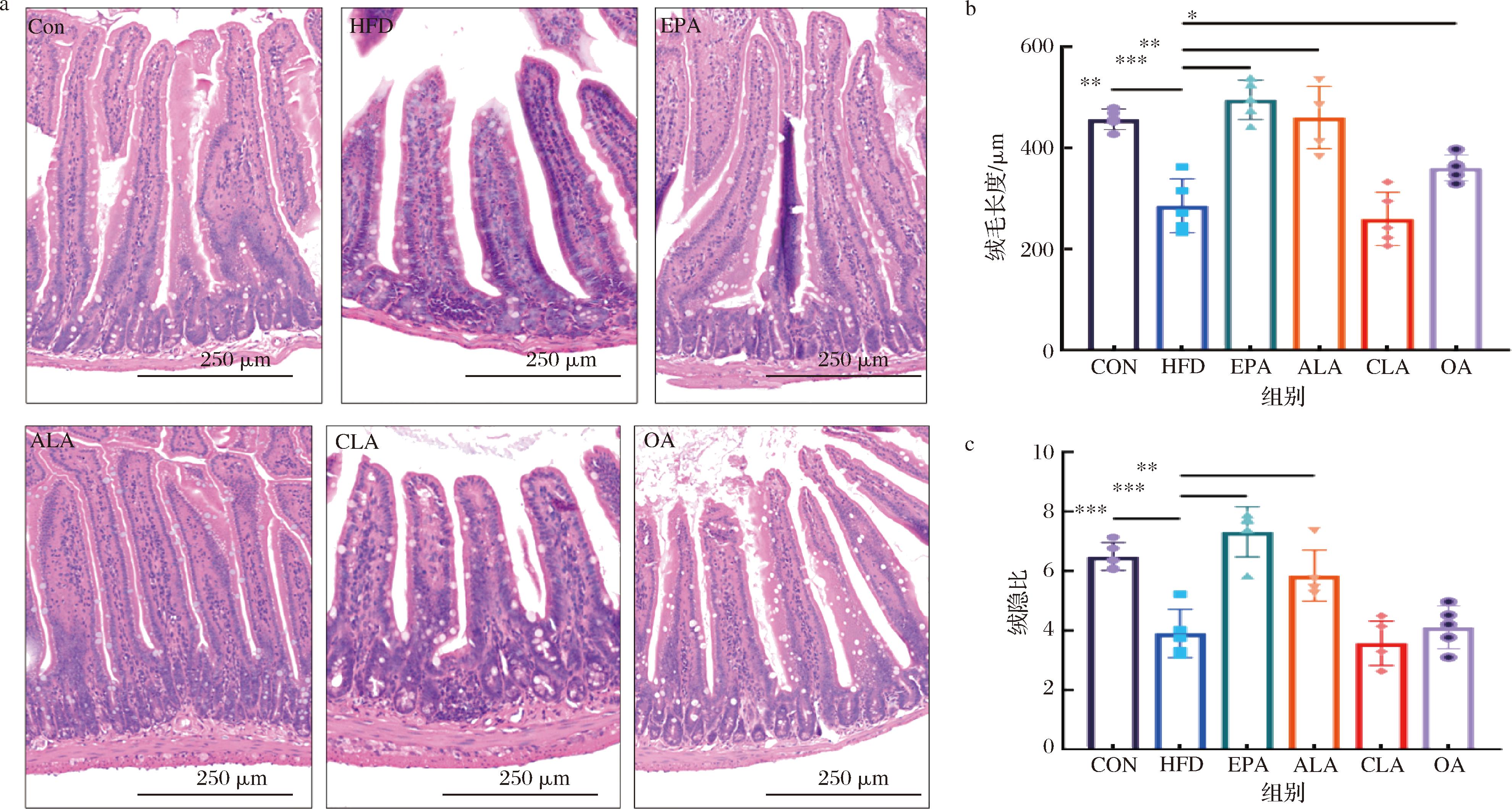
a-小鼠小肠组织形态;b-小鼠小肠绒毛长度;c-小鼠小肠绒隐比
图4 不同膳食脂质对HFD小鼠肠道组织形态的影响
Fig.4 The effect of different dietary lipids on the morphology of intestinal tissue in HFD mice
2.5 不同膳食脂质对HFD小鼠小肠炎症水平的影响
HFD诱导的肥胖常伴有低度炎症的产生,为了阐明不同膳食脂质对HFD小鼠小肠组织炎症水平的作用差异,利用实时荧光定量qPCR技术对小鼠小肠组织中的炎症因子TNF-α与IL-1β进行了检测。不同膳食活性脂质对各组小鼠小肠组织炎症因子表达水平的影响检测结果如图5所示,高脂饲料喂养使小鼠小肠的TNF-α和IL-1β的mRNA表达水平升高,不同脂质干预后该趋势得到不同程度缓解,而ALA组的效果最为显著,且与EPA阳性对照组有相似的效果,这表明ALA可显著缓解HFD饲喂所引起的低度炎症状态。
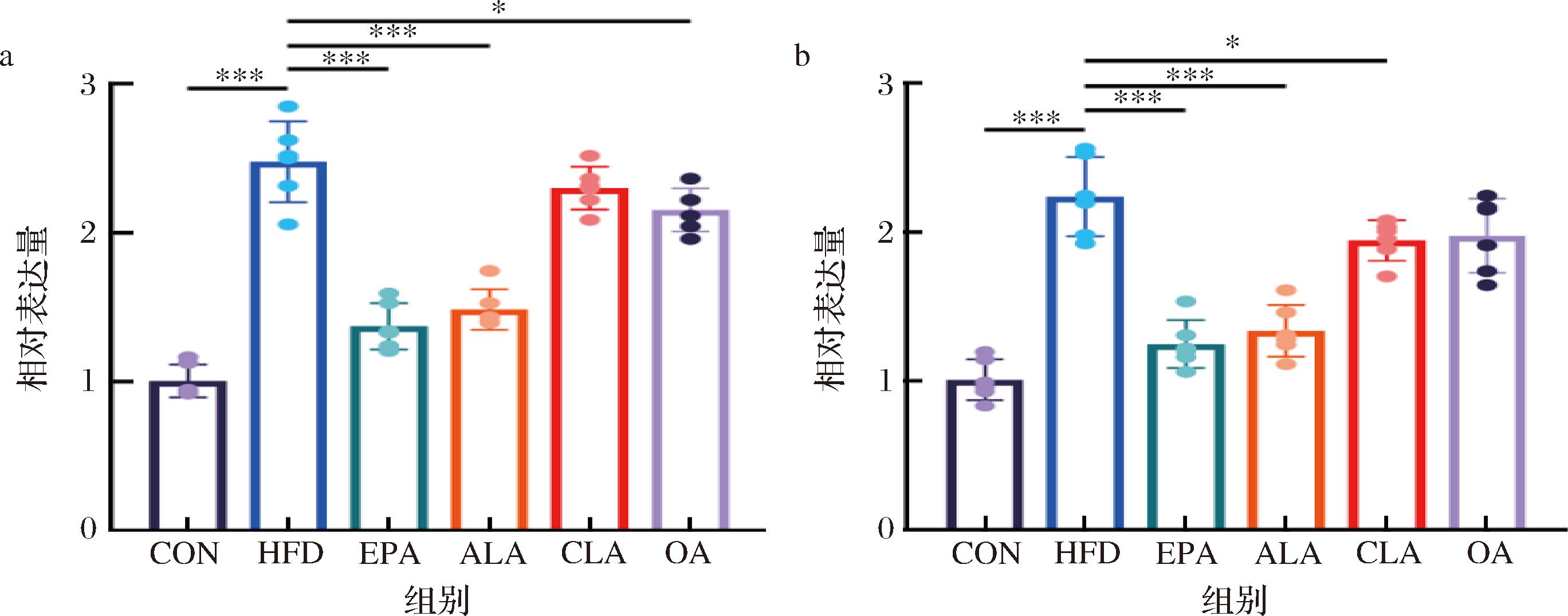
a-小鼠小肠组织TNF-α表达水平;b-小鼠小肠组织IL-1β表达水平
图5 不同膳食脂质对HFD小鼠小肠炎症因子水平的影响
Fig.5 The effect of different dietary lipids on the levels of inflammatory factors in the small intestine of HFD mice
2.6 不同膳食脂质对HFD小鼠小肠氧化应激水平的影响
HFD饲喂所引发的低度炎症往往会促进活性氧ROS的产生,进而加重体内的氧化应激水平。为了探究不同膳食脂质对小鼠小肠氧化应激水平的影响,采用试剂盒法分别检测了小鼠小肠组织中SOD、CAT、GSH表达水平以及MDA含量变化。活性脂质对各组肥胖小鼠空肠组织氧化应激水平的影响检测结果如图6所示,高脂饲料喂养刺激小鼠肠道氧化应激水平提高,SOD、CAT与GSH水平下降,MDA含量增加,不同脂质干预后该趋势得到一点缓解且ALA组效果最佳,并与EPA组趋势相同。综上所述表明,ALA的干预可以显著缓解肥胖小鼠体内的氧化应激水平,改善氧化应激相关指标的异常变化。

a-小鼠小肠组织SOD活性;b-小鼠小肠组织CAT活性;c-小鼠小肠组织GSH水平;d-小鼠小肠组织MDA含量
图6 不同膳食脂质对HFD小鼠小肠组织氧化应激水平的影响
Fig.6 The effect of different dietary lipids on oxidative stress levels in small intestine of HFD mice
3 结论与讨论
作为n-3 PUFAs的ALA,其代谢产物EPA和DHA已被证实具有抗炎、抗氧化及调节脂代谢的作用[3,20-26]。本研究发现,ALA的干预可以显著缓解HFD饲喂诱导的小鼠体重增长以及血清和肝脏中的血脂水平的异常变化。这一结果与前人的研究一致,即n-3 PUFAs可以激活过氧化物酶体增殖物激活受体α,促进脂肪酸氧化并抑制脂质合成,从而改善脂代谢紊乱[3,27]。值得指出的是,ALA的抗肥胖效应可能与其肠道代谢特性相关。近期研究表明,ALA可通过肠道菌群转化为短链脂肪酸,进而调节宿主能量代谢并抑制脂肪积累[28]。此外,ALA对肠道形态的修复作用如增加绒隐比和绒毛长度等,表明其可能通过增强肠道屏障完整性,减少脂多糖进入体内,从而缓解代谢性内毒素血症引发的全身性炎症[7]。
本研究显示,ALA也显著抑制了HFD诱导的小肠组织炎症因子TNF-α、IL-1β的表达水平,并逆转了SOD、GSH、CAT、MDA等氧化应激指标的变化。这可能与n-3 PUFAs竞争性抑制促炎性类二十烷酸(如花生四烯酸衍生的PGE2)的合成有关[29]。此外,也有研究表明ALA可通过激活核因子E2相关因子2(Nrf2)通路,上调抗氧化酶(如SOD、CAT)的表达,从而清除过量ROS并减轻肠道氧化损伤[30]。尽管ALA需经去饱和酶转化为EPA/DHA才能发挥部分作用,但本实验表明,在HFD模型中,ALA本身即具有直接的代谢保护效应,表明其可能通过非依赖EPA的途径如缓解肠道屏障受损、改善肠道菌群组成或胆汁酸代谢等发挥作用[31]。
与ALA和EPA不同,CLA与OA在本研究中未表现出显著缓解肥胖效果。CLA结果的争议性可能与其异构体不同相关。例如,反-10,顺-12共轭亚油酸虽可抑制脂肪生成,但可能同时诱发胰岛素抵抗和肝脏脂肪变性[16-17],而本研究中使用的反-9,顺-11异构体类型,可能影响了结果的一致性。OA作为单不饱和脂肪酸,其代谢调控作用高度依赖剂量与模型。有研究指出,低剂量OA可通过激活AMPK通路改善胰岛素敏感性,但高剂量可能加剧脂质过氧化[32]。此外,HFD诱导小鼠肠道菌群失调可能削弱OA的生物利用度,导致其干预效果受限[12]。
本研究系统评估了ALA、CLA、OA对长期HFD饮食诱导的肥胖小鼠代谢紊乱的干预效果。结果显示,ALA在抑制体重增加、改善血脂谱、修复小肠组织形态、降低炎症因子表达及缓解氧化应激方面表现出与EPA相近的显著效果,而CLA与OA的干预效果未达统计学意义。
本研究通过系统的比较不同膳食脂质在相同HFD诱导小鼠模型中的效果,揭示了ALA的直接缓解肥胖作用。然而,实验周期较短,未能评估长期干预效果;抗小肠炎症、修复肠道屏障分子机制等问题仍需通过进一步的实验进行验证。
[1] HOTAMISLIGIL G S.Inflammation, metaflammation and immunometabolic disorders[J].Nature, 2017, 542(7640):177-185.
[2] HOTAMISLIGIL G S.Inflammation and metabolic disorders[J].Nature, 2006, 444(7121):860-867.
[3] CALDER P C.Marine omega-3 fatty acids and inflammatory processes:Effects, mechanisms and clinical relevance[J].Biochimica et Biophysica Acta (BBA)-Molecular and Cell Biology of Lipids, 2015, 1851(4):469-484.
[4] BORK C S, LARSEN J M, LUNDBYE-CHRISTENSEN S, et al.Plant omega-3 fatty acids may lower risk of atrial fibrillation in individuals with a low intake of marine omega-3 fatty acids[J].The Journal of Nutrition, 2024, 154(9):2827-2833.
[5] OUYANG J, LI X P, LIU C W, et al.Junshanyinzhen tea extract prevents obesity by regulating gut microbiota and metabolic endotoxemia in high-fat diet fed rats[J].Food Science and Human Wellness, 2024, 13(4):2036-2047.
[6] PRASHANTH V, DEVARAJAN A K, PERUMAL M K.Morin attenuates high-fat diet induced inflammation and enhances the Akkermansiaceae richness in the gut of C57BL/6 J mice[J].Food Bioscience, 2025, 66:106153.
[7] CANI P D, BIBILONI R, KNAUF C, et al.Changes in gut microbiota control metabolic endotoxemia-induced inflammation in high-fat diet-induced obesity and diabetes in mice[J].Diabetes, 2008, 57(6):1470-1481.
[8] CAI Y, DENG W L, YANG Q P, et al.High-fat diet-induced obesity causes intestinal Th17/Treg imbalance that impairs the intestinal barrier and aggravates anxiety-like behavior in mice[J].International Immunopharmacology, 2024, 130:111783.
[9] LI X, HUANG G W, ZHANG Y N, et al.Succinate signaling attenuates high-fat diet-induced metabolic disturbance and intestinal barrier dysfunction[J].Pharmacological Research, 2023, 194:106865.[10] BISCHOFF S C, BARBARA G, BUURMAN W, et al.Intestinal permeability:A new target for disease prevention and therapy[J].BMC Gastroenterology, 2014, 14:189.
[11] FUKUI H.Increased intestinal permeability and decreased barrier function:Does it really influence the risk of inflammation?[J].Inflammatory Intestinal Diseases, 2016, 1(3):135-145.
[12] KIM K A, GU W, LEE I A, et al.High fat diet-induced gut microbiota exacerbates inflammation and obesity in mice via the TLR4 signaling pathway[J].PLoS One, 2012, 7(10):e47713.
[13] AKOUMIANAKIS I, ANTONIADES C.Impaired vascular redox signaling in the vascular complications of obesity and diabetes mellitus[J].Antioxidants &Redox Signaling, 2019, 30(3):333-353.
[14] LI S R, EGUCHI N, LAU H, et al.The role of the Nrf2 signaling in obesity and insulin resistance[J].International Journal of Molecular Sciences, 2020, 21(18):6973.
[15] MARSEGLIA L, MANTI S, D’ANGELO G, et al.Oxidative stress in obesity:A critical component in human diseases[J].International Journal of Molecular Sciences, 2014, 16(1):378-400.
[16] HAGHIGHATDOOST F, NOBAKHT M GH B F.Effect of conjugated linoleic acid on blood inflammatory markers:A systematic review and meta-analysis on randomized controlled trials[J].European Journal of Clinical Nutrition, 2018, 72(8):1071-1082.
[17] LIANG C W, CHENG H Y, LEE Y H, et al.Effects of conjugated linoleic acid and exercise on body composition and obesity:A systematic review and meta-analysis[J].Nutrition Reviews, 2023, 81(4):397-415.
[18] FUSSBROICH D, COLAS R A, EICKMEIER O, et al.A combination of LCPUFA ameliorates airway inflammation in asthmatic mice by promoting pro-resolving effects and reducing adverse effects of EPA[J].Mucosal Immunology, 2020, 13(3):481-492.
[19] FUJITA Y, KANO K, KISHINO S, et al.Dietary Cis-9, trans-11-conjugated linoleic acid reduces amyloid β-protein accumulation and upregulates anti-inflammatory cytokines in an Alzheimer’s disease mouse model[J].Scientific Reports, 2021, 11(1):9749.
[20] ZHENG J N, CHEN S M, LIU L, et al.In vitro gastrointestinal digestibility and lipid oxidation of fish oil-in-water emulsions:Influence of different EPA/DHA ratios[J].LWT, 2024, 210:116855.
[21] DASILVA G, BOLLER M, MEDINA I, et al.Relative levels of dietary EPA and DHA impact gastric oxidation and essential fatty acid uptake[J].The Journal of Nutritional Biochemistry, 2018, 55:68-75.
[22] EL-MOWAFY A M, ABDEL-AZIZ A A, ABDEL-DAYEM M A.Novel protection by omega-3-FAs (DHA or EPA) against carbamazepine’s liver-injury:Differential suppression of oxidative-stress and inflammatory markers, and the influence on carbamazepine-clearance[J].Clinical Nutrition Open Science, 2022, 42:14-26.
[23] SHERRATT S, LIBBY P, BHATT D, et al.Eicosapentaenoic acid (EPA) modulated expression of endothelial proteins linked to detoxification and inhibition of oxidative stress during inflammation[J].Atherosclerosis, 2023, 379:S2-S3.
[24] SHERRATT S C R, LIBBY P, BHATT D L, et al.Eicosapentaenoic acid (EPA) combined with high-intensity statins reduce lipid oxidation in model membranes compared to docosahexaenoic acid (DHA)[J].Atherosclerosis, 2022, 355:93.
[25] YANG X, LI X D, HU M J, et al.EPA and DHA differentially improve insulin resistance by reducing adipose tissue inflammation:Targeting GPR120/PPARγ pathway[J].The Journal of Nutritional Biochemistry, 2024, 130:109648.
[26] ZHANG X W, LI C, REN W Z, et al.Omega-3 polyunsaturated fatty acids, especially DHA and EPA, remold gut microbiota to suppress inflammation in rabbits with atherosclerosis[J].Animals and Zoonoses, 2025,1(2): 122-130.
[27] JUMP D B.The biochemistry of n-3 polyunsaturated fatty acids[J].Journal of Biological Chemistry, 2002, 277(11):8755-8758.
[28] COSTANTINI L, MOLINARI R, FARINON B, et al.Impact of omega-3 fatty acids on the gut microbiota[J].International Journal of Molecular Sciences, 2017, 18(12):2645.
[29] HUANG J W, WANG X Y, XIE L Y, et al.Extract of Danggui-Shaoyao-San ameliorates cognition deficits by regulating DHA metabolism in APP/PS1 mice[J].Journal of Ethnopharmacology, 2020, 253:112673.
[30] ZENG Y Y, JIANG W D, LIU Y, et al.Dietary alpha-linolenic acid/linoleic acid ratios modulate intestinal immunity, tight junctions, anti-oxidant status and mRNA levels of NF-κB p65, MLCK and Nrf2 in juvenile grass carp (Ctenopharyngodon idella)[J].Fish &Shellfish Immunology, 2016, 51:351-364.
[31] KALIANNAN K, WANG B, LI X Y, et al.Omega-3 fatty acids prevent early-life antibiotic exposure-induced gut microbiota dysbiosis and later-life obesity[J].International Journal of Obesity, 2016, 40(6):1039-1042.
[32] TERÉS S, BARCEL -COBLIJN G, BENET M, et al.Oleic acid content is responsible for the reduction in blood pressure induced by olive oil[J].PNAS, 2008, 105(37):13811-13816.
-COBLIJN G, BENET M, et al.Oleic acid content is responsible for the reduction in blood pressure induced by olive oil[J].PNAS, 2008, 105(37):13811-13816.