啤酒酿造过程中,酵母对于啤酒的风味质量具有重要影响。历史上啤酒酿造经历了混菌酿造到纯种酿造的变革,目前绝大多数啤酒都是由单一菌种纯种酿造而成。然而随着日益多样化的产品需求,混合酿造又成为了当代啤酒酿造及新产品开发的新途径。非酿酒酵母是相对于酿酒酵母提出的一个概念,主要指除酿酒酵母之外的所有酵母菌种。它的发酵性能和酒精耐受性一般不如酿酒酵母好,一些非酿酒酵母还会代谢产生硫化氢、乙醛等对啤酒风味不利的化合物[1],因此,早期一般被认为是不适合用于啤酒酿造的微生物。然而随着现代研究的不断深入,人们发现使用某些非酿酒酵母能改变啤酒风味物质的组成和含量,从而改善啤酒口感,增加风味多样性,同时还能赋予啤酒一定的地域特色。目前,非酿酒酵母已经被广泛应用到提升啤酒香气、生产酸啤酒、低醇啤酒以及功能性啤酒等领域中[2]。
啤酒花中存在2种形态的萜类化合物:游离态和糖苷结合态。游离态的萜类化合物因其较低的香气阈值,即使在极低的浓度下也能赋予啤酒浓郁的酒花香味;糖苷结合态的萜类化合物则无味且不具挥发性[3]。非酿酒酵母在发酵过程中能分泌胞外酶,其中β-葡萄糖苷酶能通过水解糖苷结合态萜类物质的糖苷键释放出萜类物质,从而增强啤酒的酒花香气[4]。研究发现陆生伊萨酵母(Issatchenkia terricola)表现出高水平的β-葡萄糖苷酶活性,可水解萜烯基糖苷,并增加酒体中萜烯、C13类异戊二烯和乙酯的含量[5]。除了萜烯类化合物之外,硫醇类化合物以及他们的前体物质在酒花中也广泛存在,由于其风味阈值极低,可被感知到的质量浓度以ng/L计,因此微量的硫醇类物质对啤酒香气有重要贡献。啤酒中的挥发性硫醇大部分来自啤酒花,游离态的挥发性硫醇能通过干投直接释放到啤酒中,而结合态挥发性硫醇则通过酵母的生物转化作用被释放[6]。啤酒中研究较多的具有热带水果香气的3种挥发性硫醇分别是3-巯基己醇(3-mercaptohexyl alcohol,3MH)、3-巯基己基乙酸酯(3-mercaptohexyl acetate,3MHA)和4-巯基-4-甲基-2-戊酮(4-mercapto-4-methyl-2-pentanone,4MMP),它们分别赋予啤酒番石榴、百香果和黑醋栗的香气。已有研究表明麦汁中结合态硫醇转化为游离硫醇的比例只有0.1%~0.5%,而酒花中有10%~20%的挥发性硫醇是以结合态形式存在的,结合态硫醇的释放主要通过β-裂解酶断开S-半胱氨酸和硫醇基团之间的化学键来释放硫醇[7]。由于酿酒酵母的β-裂解酶活性普遍较低,大多数硫醇前体在成品啤酒中仍以无风味活性的形式存在。因此筛选β-裂解酶活性高的非酿酒酵母,应用到啤酒发酵中,提高硫醇物质的转化效率从而增强啤酒发酵香气,具有重要的研究价值。
本研究前期筛选到一株异常威克汉姆酵母,将其与啤酒酵母进行混菌发酵,探究其应用于啤酒发酵的最佳工艺条件,为筛选适宜啤酒发酵的非酿酒酵母提供新思路。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株
商业Ale型啤酒酵母(Saccharomyces cerevisiae)US-05,简称为US-05。异常威克汉姆酵母(Wickerhamomyces anomalus)M3(CGMCC No.28666),简称为M3。
1.1.2 实验试剂
酒花颗粒,美国雅基玛酒花有限公司;乙酸乙酯、乙酸异戊酯、乙酸苯乙酯、月桂酸乙酯、乙醛、正丙醇、异丁醇、异戊醇、芳樟醇、橙花醇、香叶醇、β-香茅醇、3-巯基己醇、4-巯基-4-甲基-2-戊酮等色谱纯标准品,上海麦克林生化科技股份有限公司。
1.2 仪器与设备
SW-CJ-1C双人单面净化工作台,苏州净化有限公司;电子天平、分析天平、pH计,梅特勒-托利多仪器上海有限公司;CX21FS1显微镜,上海荣丰科学仪器有限公司;UV-2000紫外可见分光光度计,日本Olympus 公司;电热恒温水浴锅,上海医用恒温设备厂;HYG-A全温摇瓶柜,太仓市实验设备厂;HPX-180BS-Ⅱ恒温恒湿培养箱,上海新苗医疗器械制造有限公司;HVE-50全自动高压蒸汽灭菌锅,日本Hirayama-HVE-50;金属浴,Eppendorf公司;磁力搅拌器,上海司乐仪器有限公司;MICROL17台式高速离心机,Thermo Scientific;Counterstar细胞计数仪,上海睿钰生物科技有限公司。
1.3 实验方法
1.3.1 啤酒酿造工艺
采用普通全麦芽艾尔啤酒酿造工艺,将麦芽粉碎去皮,采用浸出糖化法对麦芽进行糖化[8]。63 ℃投料,保温1 h,再升温至78 ℃保温10 min,糖化结束。糖化结束后将麦汁进行煮沸,在煮沸结束前5 min添加酒花,酒花添加量为3 g/L。煮沸结束后用100目滤布过滤得到澄清的麦汁,调整麦汁浓度为12 °P,煮沸灭菌20 min后冷却至室温。将活化好的酵母液添加到冷麦汁中,在20、22、24 ℃下进行啤酒酿造,每天监测发酵失重,当失重小于0.1 g/100 mL时结束发酵。
1.3.2 混菌发酵工艺设计
混菌发酵实验设计如表1、表2所示,选择同时接种、间隔接种2种接种方式,将US-05与M3分别以不同接种比例,接种至12 °P麦汁中发酵,对酵母的生长情况,CO2累计失重、发酵指标及挥发性化合物进行分析。根据同时接种中较优的实验结果,选择22 ℃为间隔接种的发酵温度,间隔接种顺序为先接种M3,后接种US-05。
表1 同时接种实验设计
Table 1 Experiment design of simultaneous inoculation
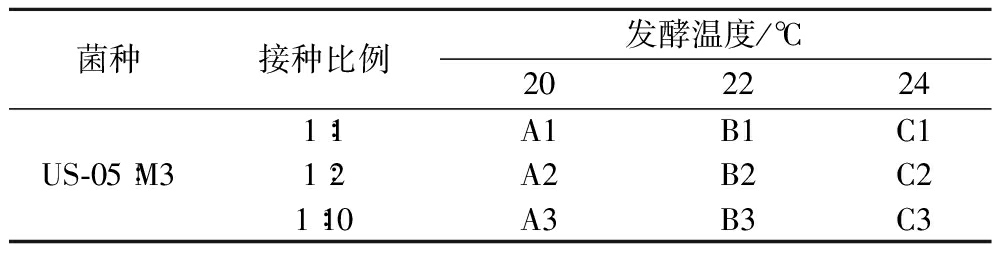
菌种接种比例发酵温度/℃2022241∶1A1B1C1US-05∶M31∶2A2B2C21∶10A3B3C3
注:接种比例为细胞浓度之比;编号A~C分别表示发酵温度为20、22、24 ℃的样品;A1~A3分别表示US-05与M3接种比例分别为1∶1、1∶2、1∶10的样品;B1~B3、C1~C3编号方式同A1~A3(下同)。
表2 间隔接种实验设计
Table 2 Experimental design of interval inoculation

菌种接种比例间隔1 d间隔2 d1∶1D1E1US-05∶M31∶2D2E21∶10D3E3
注:间隔接种发酵温度为22 ℃;编号D与E分别表示间隔1 d接种与间隔2 d接种的样品;D1~D3分别表示US-05与M3接种比例分别为1∶1、1∶2、1∶10的样品;E1~E3编号方式同D1~D3(下同)。
表3 挥发性化合物标准曲线
Table 3 Standard curve of volatile compounds

化学物质CAS号标准曲线相关系数乙酸乙酯141-78-6y=555.09x+16 121R2=0.994 3乙酸异丁酯110-19-0y=123.7x+8.010 1R2=0.993 4正丙醇71-23-8y=13 526x+4 531.5R2=0.996 3异丁醇78-83-1y=1 963.5x+3 296.8R2=0.996 1乙酸异戊酯123-92-2y=21.179x+263.97R2=0.998 6异戊醇123-51-3y=771.01x+13 342R2=0.999 4辛酸乙酯106-32-1y=5.829 3x-50.907R2=0.987 1芳樟醇78-70-6y=23.462x+49.845R2=0.996 2癸酸乙酯110-38-3y=12.916x+29.55R2=0.988 2橙花醇106-25-2y=24.425x+12.33R2=0.997 1乙酸苯乙酯103-45-7y=7.671 4x-1.820 8R2=0.987 8香叶醇106-24-1y=15.498x-88.25R2=0.999 2月桂酸乙酯106-33-2y=16.13x+35.81R2=0.998 9苯乙醇60-12-8y=190.07x+4 914.7R2=0.989 3α-松油醇98-55-5y=58.64x+93.603R2=0.993 8β-香茅醇106-22-9y=105.33x+7.37R2=0.992 5己酸乙酯123-66-0y=36.534x+24.512R2=0.998 3正辛醇111-87-5y=6.167x+36.759R2=0.997 8肉豆蔻酸乙酯124-06-1y=7.168 3x+156.19R2=0.994 6壬酸乙酯123-29-5y=110.68x+80.06R2=0.992 7月桂酸异戊酯6309-51-9y=28.165x+45.32R2=0.992 4癸酸334-48-5y=163.47x+2 604.4R2=0.995 4癸酸异丁酯30673-38-2y=136.63x+73.326R2=0.997 4辛酸124-07-2y=612.32x+241.3R2=0.997 82,4-二叔丁基酚96-76-4y=15.017x+22.82R2=0.993 6
注:x:化学物质峰面积/内标峰面积;y:浓度。
1.3.3 啤酒理化指标的检测
a)总酸:总酸含量测定依据GB 12456—2021《食品安全国家标准 食品中总酸的测定》酸碱指示剂滴定法测定。
b)pH值:本研究pH值使用手持pH计检测:打开pH计,先取少量酒液对电极头部位和烧杯进行润洗,再接取酒样,使酒液没过电极头后缓慢摇晃pH计,读数稳定后记录pH值。
c)苦味质:向50 mL离心管中加入5 mL已过滤处理的待测酒样,然后再向其中加入3 mol/L的HCl溶液0.5 mL和异辛烷10 mL,密封好待测酒样然后放到振荡器上振荡15 min,溶液出现分层现象后将上清液移至比色皿,以异辛烷在275 nm波长下的吸光值作为空白,测待测酒样在275 nm波长下的吸光值。待测酒样的苦味质的计算如公式(1)所示:
待测酒样的苦味质/BU=A275×50
(1)
式中:A275为待测酒样在275 nm波长下的吸光值。
d)本研究酒精度、真实浓度、原麦汁浓度和真实发酵度使用Alcolyzer啤酒分析系统(Anton paar)检测。
e)双乙酰含量:双乙酰含量测定依据GB/T 4928—2008《啤酒分析方法》进行双乙酰检测。
1.3.4 气相色谱-质谱检测啤酒中挥发性化合物
采用顶空固相微萃取法对待测样品进行提取,然后使用GC-MS对成品啤酒中的风味物质进行测定[9]。
a)标品制备:将乙酸乙酯、乙酸异戊酯、乙酸苯乙酯、月桂酸乙酯、芳樟醇、橙花醇、香叶醇、β-香茅醇等色谱纯标准品分别用无水乙醇配制成标准品母液,用4%(体积分数)的乙醇溶液稀释成不同浓度的混标稀释液进行标曲测定。取8 mL混标稀释液,2.0 g NaCl至20 mL顶空气相瓶中,加入25 mg/L的2-辛醇内标溶液50 μL,充分混匀后上机测试。
b)样品制备:将啤酒过滤除气,取8 mL样品,2.0 g NaCl至20 mL顶空气相瓶中,加入25 mg/L的2-辛醇内标溶液50 μL,充分混匀后上机测试。
c)GC条件:使用TG-WAXMSA色谱柱(60 m×0.25 mm×0.25 μm),加热程序为40 ℃保持1 min,随后以3 ℃/min的速率加热到180 ℃,接着以20 ℃/min 的速度加热至230 ℃,并保持15 min。使用高纯度氦气(纯度>99.99%)作为载气,流量为1.0 mL/min,在无分流和1 min的溶剂延迟时间下,采用250 ℃的汽化室。MS条件:使用电子电离(electronic ionization,EI)源,离子源温度为230 ℃,四级杆温度为150 ℃,接口温度为280 ℃,发射电流为34.6 μA,电子能量为70 eV。质量扫描范围为29~500 amu。
d)定性定量分析:采用GC-MS分析检测获取啤酒风味物质的总离子流图。通过在美国国家生物技术信息中心(National Center of Biotechnology Information,NIST)2014标准质谱库中进行检索,结合保留指数(retention index,RI),对发酵液中的挥发性风味成分进行比对,达到定性的目的。随后,采用峰面积归一法来对风味成分与内标物的峰面积进行比较,以确定它们的相对含量。
1.3.5 啤酒中硫醇的检测
参考LIU等[10]的方法并略作修改,硫醇检测方法分3个步骤进行,以下分别用a)~c)表示。
a)衍生化:
将样品用4,4′-联吡啶二硫醚(4,4′-dipyridyl disulfide,DTDP)试剂进行衍生化处理。取10 mL发酵液加入200 μL 70 mmol/L的EDTA-2Na溶液和200 μLDTDP衍生化溶液,混匀。样品混合物在室温下以120 r/min振荡3 h,滤纸过滤,4 ℃密封保存。
b)纯化:
将样品溶液依次通过使用6 mL甲醇和6 mL超纯水活化处理的萃取柱。然后用12 mL 50%(体积分数)甲醇和12 mL水进行洗涤,最后用1.5 mL甲醇洗脱,并收集洗脱液,在常温下使用氮吹仪用温和的氮气流浓缩至400 μL,用0.22 μm有机膜过滤后避光贮存于4 ℃冰箱中,用于LC-MS/MS测定。
c)LC-MS/MS仪器条件设置:
LC-MS/MS系统包括Agilent 1290 Infinity Ⅱ型高效液相色谱系统和Agilent 6470三重四极质谱仪。液相条件为:流动相0.1%(体积分数)甲酸水和乙腈。梯度洗脱流速为0.2 mL/min。质谱条件为:采用选择反应检测扫描模式(selective reaction monitoring,SRM)进行检测,离子源电压3 200 V,毛细管温度350 ℃,蒸发温度250 ℃。
1.3.6 感官评价
选择20名20~30岁的年轻人(10名男性,10名女性)进行感官评价。参与品评人员使用啤酒以及酒花香气酒鼻子训练3个月,啤酒香气酒鼻子采用中国食品发酵工业研究院啤酒香气试剂,酒花香气酒鼻子采用Abstrax Hops Profile及Omni Hop Profiles进行训练。啤酒提前在4 ℃避光贮藏,取15 mL酒样分别倒入品评杯中,要求品评者对啤酒总体感官特征分别进行评价,具体评价标准如表4所示。同时,品评者根据给出的香气描述词,单独对啤酒香气特征进行排序打分,香气描述分类如下:谷物味(麦芽汁),泥土味(发霉、谷仓),青草味,柑橘类(柚子、橙子),热带水果香(芒果、木瓜),核果香(杏、油桃),不新鲜(纸板、氧化),蔬菜味(洋葱、芹菜),溶剂味。香气强度按照0~9分进行排序,0=无,9=极强。
表4 啤酒感官品评标准
Table 4 Beer sensory evaluation standard
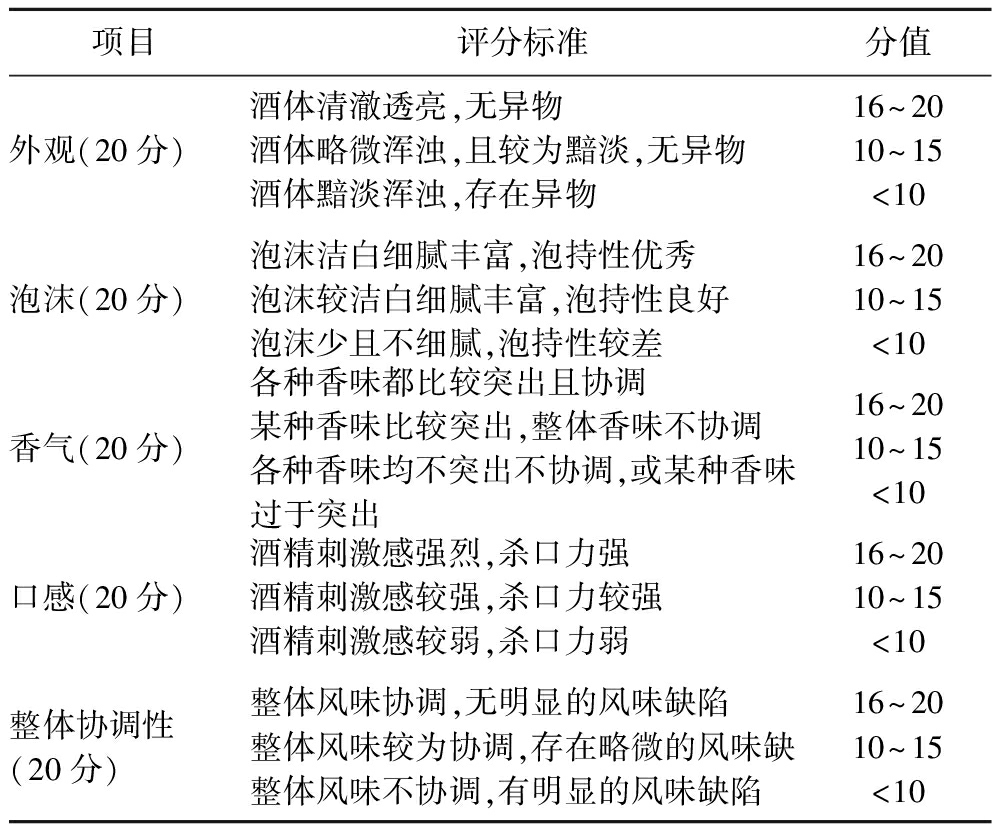
项目评分标准分值外观(20分)酒体清澈透亮,无异物酒体略微浑浊,且较为黯淡,无异物酒体黯淡浑浊,存在异物16~2010~15<10泡沫(20分)泡沫洁白细腻丰富,泡持性优秀泡沫较洁白细腻丰富,泡持性良好泡沫少且不细腻,泡持性较差16~2010~15<10香气(20分)各种香味都比较突出且协调某种香味比较突出,整体香味不协调各种香味均不突出不协调,或某种香味过于突出16~2010~15<10口感(20分)酒精刺激感强烈,杀口力强酒精刺激感较强,杀口力较强酒精刺激感较弱,杀口力弱16~2010~15<10整体协调性(20分)整体风味协调,无明显的风味缺陷整体风味较为协调,存在略微的风味缺整体风味不协调,有明显的风味缺陷16~2010~15<10
1.4 数据分析
在本研究中,折线图、柱状图使用Origin Pro 2021绘制;单因素方差分析使用SPSS 26.0中的Duncan检验方法,显著性水平P<0.05;半定量聚类分析热图的制作使用TBtools软件绘制。
2 结果与分析
2.1 混菌发酵工艺研究
2.1.1 接种比例对酵母生长及发酵的影响
非酿酒酵母应用于酒精饮料生产,其发酵能够产生不同于酿酒酵母的风味特征,本研究选择不同接种比例、发酵温度以及接种方式,探究混合发酵对啤酒的挥发性物质以及发酵指标的影响。依据1.3.2节的方法,A1、A2、A3代表发酵温度为20 ℃,接种比例分别为1∶1、1∶2、1∶10的样品;B1、B2、B3为22 ℃发酵的样品,C1、C2、C3为24 ℃发酵的样品。如图1所示,同时接种条件下,M3的生长受到严重抑制,最大细胞浓度不超过2×107 CFU/mL。在酿酒酵母与非酿酒酵母的同时接种发酵中,非酿酒酵母在早期呈现指数型死亡的现象,主导地位逐渐由酿酒酵母替代,原因可能是非酿酒酵母较低的乙醇耐受性[11],以及其与酿酒酵母在高细胞密度下的细胞接触作用导致的[12]。由此可见,2株菌不太适合同时接种发酵。图2为间隔接种下2种酵母的细胞浓度变化,US-05与M3接种比例分别为1∶1、1∶2、1∶10,D1、D2、D3为间隔1 d接种,E1、E2、E3为间隔2 d接种的样品。随着M3接种比例的提高,酿酒酵母US-05的细胞浓度逐渐减少,延滞期逐渐延长,达到稳定期的时间逐渐增加。非酿酒酵母M3的存在会与酿酒酵母US-05争夺营养物质,并且竞争随着非酿酒酵母的接种比例而增加[13]。
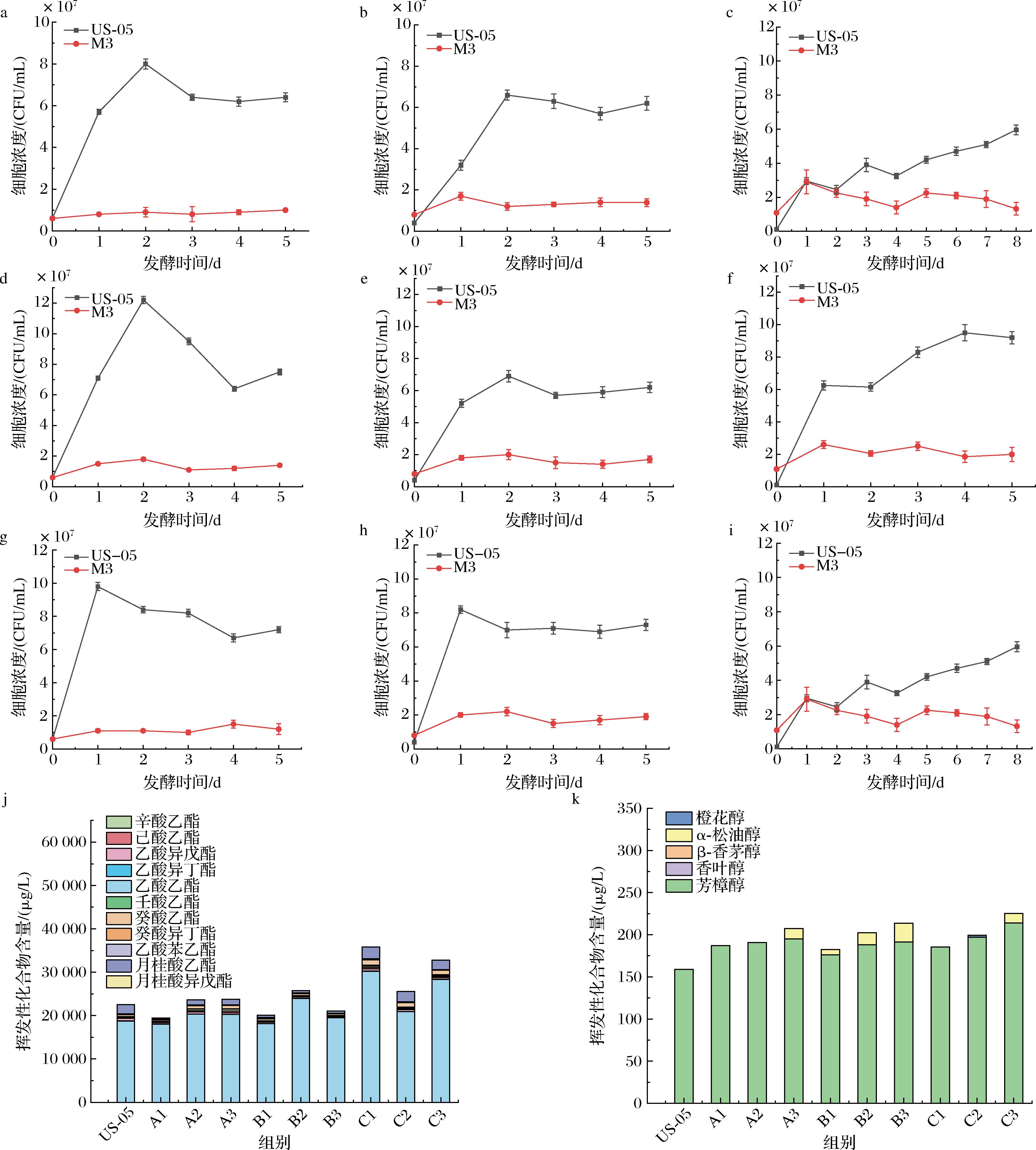
a-A1;b-A2;c-A3;d-B1;e-B2;f-B3;g-C1;h-C2;i-C3;j-酯类化合物含量;k-萜烯类化合物含量
图1 同时接种混菌发酵的酵母生长曲线与挥发性化合物含量
Fig.1 Growth curves of yeasts and the content of volatile compounds in mixed fermentation with simultaneous inoculation
注:图a~i为酵母生长曲线。
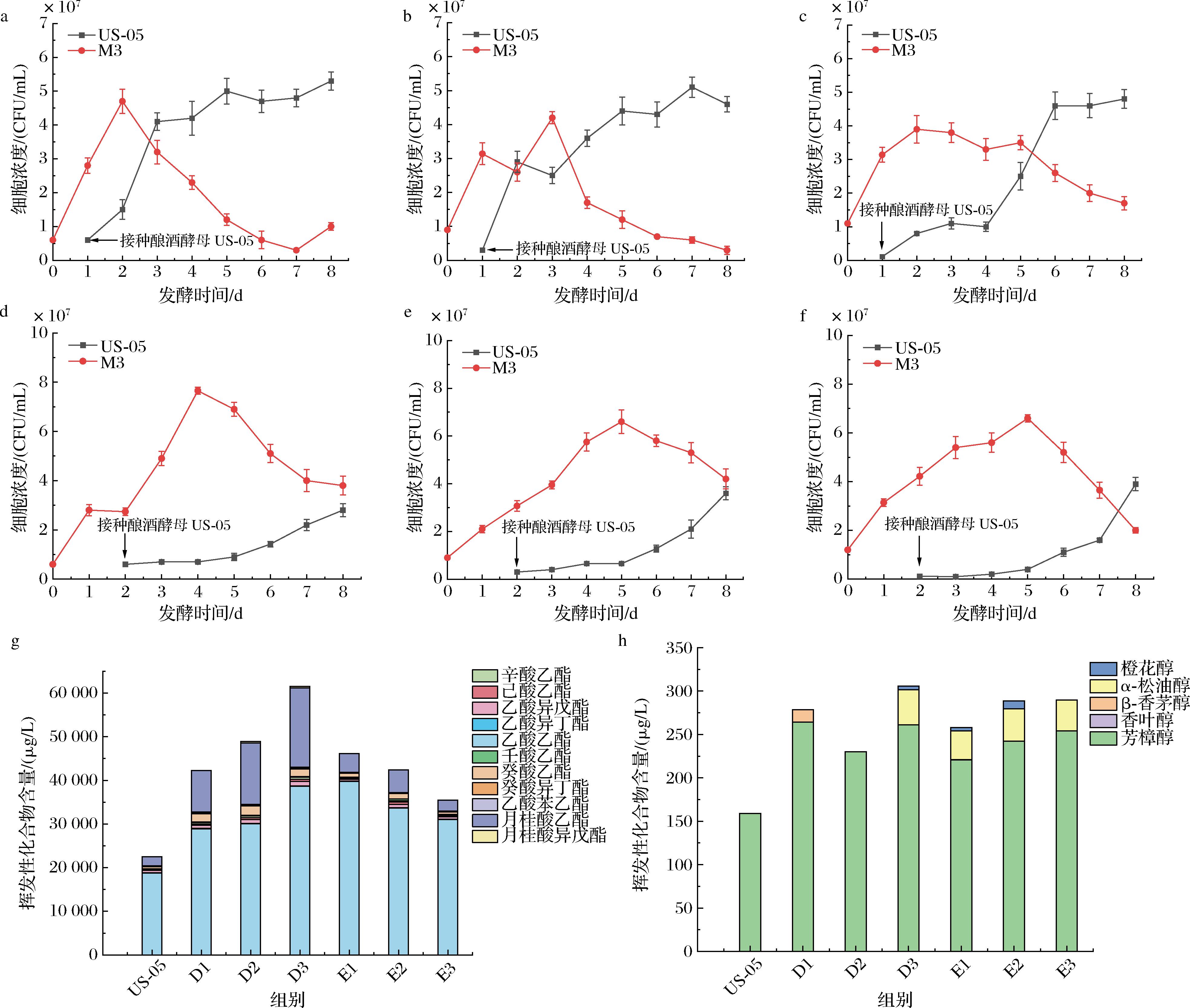
a-D1;b-D2;c-D3;d-E1;e-E2;f-E3;g-酯类化合物含量;h-萜烯类化合物含量
图2 间隔接种22 ℃混菌发酵的酵母生长曲线与挥发性化合物含量
Fig.2 Growth curves of yeasts and the content of volatile compounds in mixed fermentation at 22 ℃ with interval inoculation
注:图a~f为酵母生长曲线。
酯类化合物是啤酒中由酵母发酵产生的重要香气物质,可进一步分为乙酸酯、乙酯和其他酯类。乙酸酯和乙酯,它们是通过乙酰辅酶A和醇乙酰转移酶合成相应的醇而产生的,主要的香气表现为果味、甜香和酯香味[14]。通过GC-MS对混菌发酵的15组样品挥发性化合物含量做定量分析,结果如图1-j和图1-k所示。由图1-j可知,同时接种时,B3与B1的样品相比,乙酸乙酯的含量增加了7.72%,乙酸异戊酯的含量降低了9.29%,C3与C1相比乙酸异戊酯的含量也降低了23.40%。中链脂肪酸乙酯是主要的乙酯,如己酸乙酯、辛酸乙酯、月桂酸乙酯和癸酸乙酯。辛酸乙酯具有果味,存在于许多水果中,而癸酸乙酯则赋予酒类果味和白兰地般的风味[15]。如图2-g和图2-h所示,这些化合物的含量在D2、D3、E2中均显著增加,而其含量在E3中却显著小于E1。通过对比E1与E3发现,虽然M3接种比例提高了,但主要酯类化合物含量依然降低,这是由于过高的接种量会消耗更多营养物质或产生菌株之间的相互竞争,从而影响菌株合成酯的能力。
由图1-k可知,随着M3接种比例的增加,芳樟醇的含量逐渐提高,A3中芳樟醇质量浓度比A1提高了4.29%,比A2提高了2.32%;B3芳樟醇质量浓度比B1提高了8.59%,比B2提高1.79%;C3芳樟醇质量浓度比C1提高了15.31%,比C2提高8.69%。说明M3对芳樟醇的合成能力随着初始接种量的提高而提升。综合比较酯类与萜烯类化合物的含量发现,随着M3接种比例的增加,酯类与萜烯类化合物的含量逐渐提升,但当间隔2 d接种且M3接种比例过高时(US-05∶M3=1∶10)主要酯类化合物的含量反而降低,同时US-05与M3接种比例为1∶10与1∶2时,酯类与萜烯类化合物含量差异不明显,因此选择US-05 与M3初始接种比例为1∶2为较优接种方案。
2.1.2 发酵温度对酵母生长及发酵的影响
由图1可知,随着温度的升高,US-05在对数期的生长速率加快,且乙酯类化合物含量逐渐增加,主要包括:乙酸乙酯、己酸乙酯、辛酸乙酯、壬酸乙酯、癸酸乙酯。酵母中的酯可以通过2条合成途径合成:a)酵母在醇酰基转移酶的作用下通过酵母产生的醇和酰基辅酶A形成;b)酵母在酯酶的作用下以酵母产生的醇和脂肪酸合成[16]。发酵温度会对酵母产生的酶活性产生一定的影响,继而影响发酵液中酯类物质的含量[17]。SAERENS等[18]的研究发现较高的发酵温度促进酵母合成更多的辛酸乙酯和癸酸乙酯。与A2相比,B2中乙酸乙酯质量浓度提高了17.97%,壬酸乙酯质量浓度提高了5.81%,癸酸异丁酯质量浓度提高了28.50%,总酯质量浓度提高了8.96%。但随着温度的升高,萜烯类化合物的含量没有显著增加。B2中产生了14.53 μg/L的α-松油醇,而C2中并没有监测到α-松油醇的产生,表明过高的发酵温度可能不利于酵母合成萜烯类化合物。QIN等[19]的研究表明,较低的发酵温度显著促进了酵母萜类化合物的合成和流出,包括甘草次酸、β-石竹烯和α-淀粉酶。此外,随着发酵温度升高乙醛的含量也逐渐升高,24 ℃发酵的啤酒样品中的乙醛质量浓度超过10 mg/L,乙醛含量过高会引起过量饮酒后的头疼感,且会有辛辣的青草味,造成啤酒风味的不协调。温度过高会对细胞工厂产生不利影响,导致蛋白质错误折叠、活性氧增加、细胞生长速率减慢甚至细胞死亡等问题,因此最适发酵温度为22 ℃。
2.1.3 接种方式对酵母生长及发酵的影响
依据2.1.2节的实验结果,间隔接种的发酵温度选择在22 ℃下进行。间隔1 d接种条件下,US-05与M3的细胞浓度与同时接种相比显著下降(P<0.01);间隔2 d接种时,US-05的细胞浓度与单独发酵相比显著降低,M3的生长不受影响(P<0.01)。由图2-a~图2-c可知,未接种US-05时,M3细胞浓度随发酵时间增长,接种US-05后,M3的细胞浓度从第2天或第3天开始下降。乙醇积累以及其他胁迫如营养限制和较低的pH值,可能是与酿酒酵母共发酵时M3活力的降低的主要原因[20]。据报道,酿酒酵母在其细胞表面积累抗菌肽,通过细胞间接触促进了非酵母菌的死亡。间隔2 d接种时US-05迟滞期延长,且酵母增长速率缓慢,主要是由于此时M3已经形成菌种优势,与US-05竞争营养物质从而抑制US-05的生长导致的。间隔接种的发酵周期长于同时接种,发酵时间比同时接种平均延长了4~5 d,可能是由于间隔接种时US-05前期生长受抑制,前期发酵较慢。
由图1-j与图2-g相比可知,间隔接种(D和E)发酵与同时接种(A、B和C)发酵相比产生了更多的乙酯和乙酸酯,尤其是乙酸乙酯、乙酸异戊酯、辛酸乙酯、癸酸乙酯、乙酸苯乙酯与月桂酸乙酯。接种方式的变化也影响酵母合成萜烯类化合物的能力,主要体现在芳樟醇和α-松油醇的含量变化。由图1-k与图2-h可知,同时接种时啤酒样品中的芳樟醇质量浓度均低于200 μg/L,间隔接种时芳樟醇的质量浓度均高于200 μg/L。间隔1 d接种(D3)的样品中α-松油醇的质量浓度最高,为40.4 μg/L,同时,在D3中检测到了橙花醇,其质量浓度为4.15 μg/L。间隔2 d 接种时,在E1和E2样品中检测到橙花醇,质量浓度分别为3.76 μg/L和8.84 μg/L,而在同时接种的样品中均未检测到橙花醇。间隔2 d接种的样品中,α-松油醇的质量浓度有显著提升,萜烯类化合物转化效率提高,因此确定间隔接种为较优的混菌发酵方式。
2.2 发酵条件正交优化试验
选取表5中发酵温度、接种比例和接种方式为三试验因素,将萜烯类化合物气味活性值(odor activity value,OAV)总和(Y1),酯类化合物OAV总和(Y2)和感官评分(Y3)根据重要性关系,折算成综合评分。萜烯化合物OAV值总和的权数取4,酯类化合物的权数取2,感官评分的权数均取4,计算加权指标得出综合评分,以综合评分为Y值,使用L9(34)正交表进行发酵条件优化计算。实验条件和结果见表6。9组条件下发酵得到的啤酒酒精度在4.55%(体积分数)至5.39%(体积分数)之间,没有显著差异(P<0.05);双乙酰质量浓度都低于0.1 mg/L。根据极差的结果,得出发酵温度是对挥发性物质的感官阈值和感官得分影响最大的因素,接种方式次之,接种比例是影响最小的因素。最终选择的最优组合为发酵温度22 ℃,接种比例1∶2,接种方式为间隔1 d接种。以最优发酵工艺进行3次发酵验证试验,得到啤酒的酒精度:5.24%(体积分数),发酵度62.13%,萜烯类化合物质量浓度286.73 μg/L,酯类化合物质量浓度46.51 mg/L。
表5 啤酒发酵正交试验设计
Table 5 Orthogonal experiment design for beer fermentation
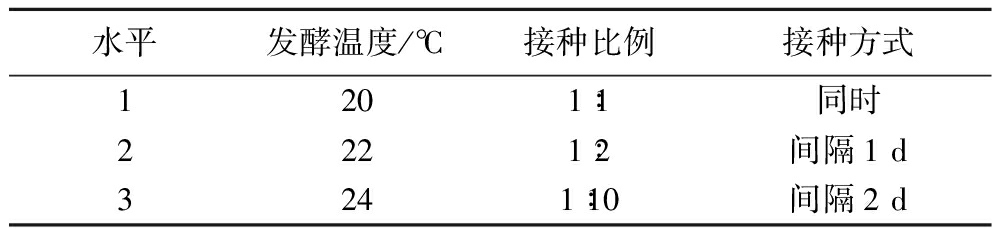
水平发酵温度/℃接种比例接种方式1201∶1同时2221∶2间隔1 d3241∶10间隔2 d
表6 混菌发酵正交试验结果
Table 6 Results of orthogonal test of mixed fermentation
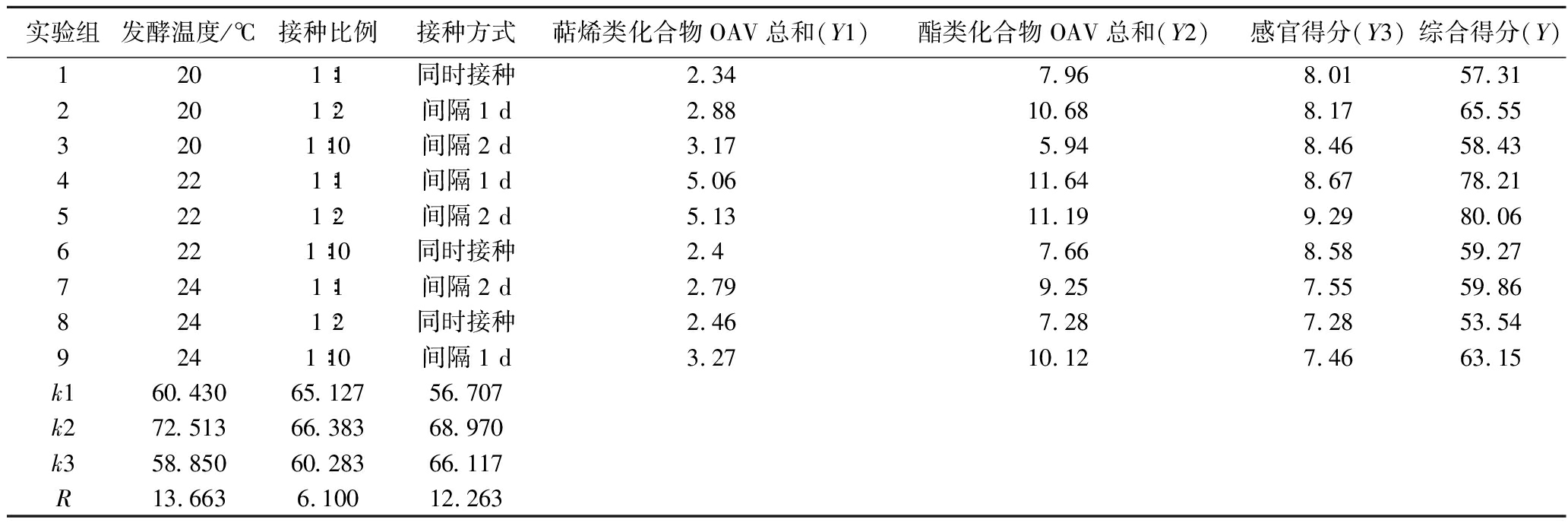
实验组发酵温度/℃接种比例接种方式萜烯类化合物OAV总和(Y1)酯类化合物OAV总和(Y2)感官得分(Y3)综合得分(Y)1201∶1同时接种2.347.968.0157.312201∶2间隔1 d2.8810.688.1765.553201∶10间隔2 d3.175.948.4658.434221∶1间隔1 d5.0611.648.6778.215221∶2间隔2 d5.1311.199.2980.066221∶10同时接种2.47.668.5859.277241∶1间隔2 d2.799.257.5559.868241∶2同时接种2.467.287.2853.549241∶10间隔1 d3.2710.127.4663.15k160.43065.12756.707k272.51366.38368.970k358.85060.28366.117R13.6636.10012.263
2.3 混菌发酵啤酒理化与风味分析
通过正交的方法最终得到的最优工艺条件为,发酵温度22 ℃,US-05∶M3=1∶2,间隔1 d接种,以上述条件进行3次啤酒发酵验证实验,最后进行5 L体系的发酵实验,对成品啤酒的理化指标与挥发性化合物进行分析。如表7所示,混菌发酵啤酒与US-05单菌发酵的基本理化指标类似,说明混菌发酵并没有影响啤酒的发酵。其中,混菌发酵的啤酒中总酸含量比US-05单菌发酵啤酒高了3.37 g/L,但两者的pH值并没有显著差异,可能是混菌发酵过程中由M3产生的有机酸类物质。对啤酒的挥发性化合物进行分析,并对相关香气物质进行定量,结果如表8所示,混菌发酵啤酒的酯类和萜烯类化合物含量提升显著。酯类化合物可进一步分为乙酸酯、乙酯和其他酯类,乙酸酯和乙酯主要带来果味、甜香和酯香味。与US-05单独发酵相比,混菌发酵啤酒中乙酸酯的含量有显著提高(P<0.05),主要包括乙酸乙酯(香蕉和苹果)、乙酸异戊酯(香蕉和梨),乙酸苯乙酯(玫瑰、蜂蜜)、乙酸异丁酯(果香)。乙酸乙酯是啤酒中最主要的酯类物质之一,混菌发酵的啤酒中乙酸乙酯的质量浓度为33.71 mg/L,比US-05单独发酵时提高了36.36%。另外,混菌发酵啤酒中乙酸苯乙酯的质量浓度比US-05单独发酵时提高了40.95%,OAV提高了0.50。中链脂肪酸乙酯是主要的乙酯,如己酸乙酯、辛酸乙酯、月桂酸乙酯和癸酸乙酯,这些化合物的含量在混菌发酵样品中均有显著提高(P<0.05)。辛酸乙酯的质量浓度比US-05单独发酵时提高了26.57%,乙酯类物质含量的提高为啤酒带来果香。混菌发酵的啤酒中检测到月桂酸异戊酯,其质量浓度为0.26 mg/L,而在US-05单菌发酵啤酒中并未检测到,表明月桂酸异戊酯完全由M3产生。乙酸异戊酯质量浓度与US-05单菌发酵相比提高了15.66%,月桂酸乙酯的质量浓度提高了57.79%。
表7 成品啤酒理化指标
Table 7 Physicochemical parameters of the final beer product

理化指标US-05单菌发酵混菌发酵乙醛/(mg/L)8.32±0.57a7.39±1.74b总酸/(g/L)8.51±0.12b11.88±0.09apH值4.88±0.06a4.82±0.03a苦味质/BU34.60±2.36b36.51±3.21a酒精度/%(体积分数)5.01±0.31a5.03±0.28a真实浓度/%(体积分数)4.94±0.27b5.16±0.39a原麦汁浓度/°P12.00±0.012.00±0.0真实发酵度/%62.10±0.22a61.10±0.42a双乙酰含量/(mg/L)0.061±0.001a0.043±0.002a
注:同一行不同字母表示差异显著(P<0.05)(下同)。
表8 混菌发酵啤酒挥发性化合物分析
Table 8 Analysis of volatile compounds in beer produced by mixed fermentation

指标化合物质量浓度/(μg/L)OAVUS-05单菌发酵混菌发酵US-05单菌发酵混菌发酵乙酸乙酯24 719.68±13.42b33 708.62±28.71a0.981.34乙酸异丁酯38.94±1.78a30.27±0.95b0.080.06乙酸异戊酯1 578.13±3.57b1 825.29±36.78a2.32.67辛酸乙酯383.84±12.54b485.83±8.95a1.221.56癸酸乙酯264.56±21.42a194.66±26.88b0.490.36乙酸苯乙酯251.75±9.46b354.84±13.67a1.251.75月桂酸乙酯5 443.21±13.6b8 588.63±24.23a1.542.42月桂酸异戊酯—255.45±3.93\
注:—表示物质在样品中未检测到;\表示未查询到该物质的风味阈值;3MH与4MMP为挥发性硫醇。
萜烯醇比萜烯更亲水,更容易保留在啤酒中,被认为是酒花风味的重要物质基础[21]。混合发酵啤酒中芳樟醇的质量浓度比US-05单独发酵提高了66.14%,OAV为3.3,说明添加了M3菌株对芳樟醇的生物转化有显著贡献,这可能是由于M3具有较高的β-葡萄糖苷酶活性,提高了萜烯类化合物的转化效率。混菌发酵中β-香茅醇的质量浓度为14.14 ng/L,US-05单独发酵的啤酒中没有检测到β-香茅醇,表明增加的β-香茅醇完全由M3菌株产生。TAKOI等[22]的研究表明在酒花和麦汁中几乎不存在的β-香茅醇在发酵过程中逐渐增加,这是由于酵母将香叶醇转化为β-香茅醇的结果;单萜醇在发酵过程中被酵母转化,包括还原、易位、顺式到反式异构化和环化[23],单个萜类化合物的生物转化通常导致多种产物的产生,增加了啤酒香气的复杂性。香叶醇主要通过还原反应转化为β-香茅醇,通常发生在啤酒发酵的第2~4天。在模型麦汁中添加10 mg/L的香叶醇,发酵结束时检测到的萜类化合物包括香叶醇、香茅醇、香茅酰乙酸酯、橙花醇、香茅醛、二氢香茅醇和二氢芳樟醇,表明在发酵过程中存在多种生物转化途径[24]。
在混菌发酵的啤酒中检测到3MH,其质量浓度为144.09 ng/L,OAV为2.40,与US-05单独发酵相比提高了70.28%。有研究指出酒花中10%~20%的硫醇是以结合态形式存在,需要β-裂解酶的催化将其释放,这也表明M3产生的β-裂解酶对于酒花中硫醇物质的释放有积极作用。进一步对啤酒中21种主要挥发性化合物作主成分分析,结果如图3所示,样品相距越远说明差异越大。结果显示混菌发酵工艺与3MH、芳樟醇、β-香茅醇、乙酸乙酯、乙酸苯乙酯、月桂酸乙酯、辛酸乙酯和苯乙醇的形成有很强的相关性,这几种物质对啤酒的香气特别是柑橘类、花香等有重要的贡献。
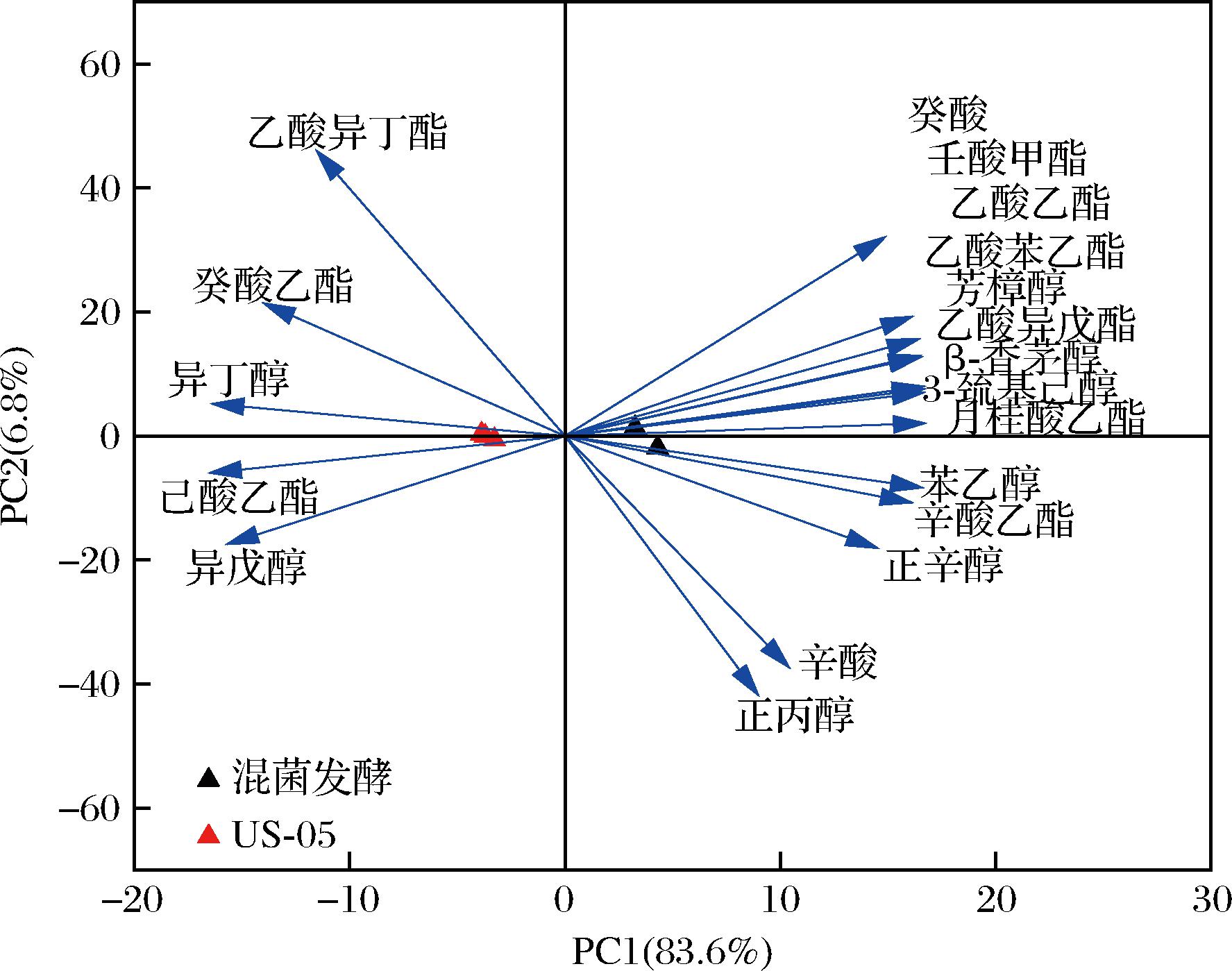
图3 不同酵母酿造啤酒主成分分析
Fig.3 Analysis of principal components of beer fermented by different yeasts
2.4 啤酒的感官评价
对啤酒的香气、口感予以感官评价,根据品评记录得分绘制风味雷达图,结果如图4所示。与US-05单菌发酵的啤酒相比,混菌发酵的啤酒样品核果香气、热带水果香、柑橘香更明显,而老化味则低于US-05 单菌发酵啤酒。从口味来看,2种啤酒无明显异味,有杀口感,混菌发酵的啤酒香气表现更好,整体协调性更高,这与M3酿造啤酒具有相对丰富的酯类、萜烯类、硫醇等化合物有一定的关系。综合评价,M3与US-05混合发酵的啤酒风味协调,热带水果香气突出,纯正爽口,酒体饱满,将菌株M3应用于啤酒发酵中具有增强啤酒香气,酿造风格独特的啤酒的潜力。

a-香气评价;b-整体评价
图4 不同组啤酒风味品评结果雷达图
Fig.4 Sensory evaluation of beer from mixed fermentation and single strain fermentation
3 结论与讨论
对前期研究中筛选到的一株产β-葡萄糖苷酶与β-裂解酶活性较高的非酿酒酵母M3,将其与US-05混合发酵,以提升啤酒风味。β-葡萄糖苷酶是一种水解含有β-D-葡萄糖苷键的底物,释放具有芳香性质的葡萄糖和游离葡萄糖苷配体,从而促进芳香化合物产生的酶。前期研究结果表明M3通过转化酒花模拟基质中的风味化合物提高了基质中芳樟醇、香叶醇、β-香茅醇以及α-松油醇的含量,值得注意的是,原始的酒花基质中并没有检测到β-香茅醇和α-松油醇的存在。本研究中M3与US-05混合发酵显著提高了啤酒中香叶醇、芳樟醇、松油醇、β-香茅醇、β-二氢离子酮等关键萜烯的含量。有研究者认为,β-香茅醇的生成可能涉及一些未知的机制,而不是在模型发酵中简单地将香叶醇转化为β-香茅醇。TAKOI等[25]也指出β-香茅醇增加的部分原因可能是啤酒酵母分泌的糖苷水解酶催化糖苷结合的风味前体产生的。由于萜烯烃的高疏水性,在发酵过程中通过蒸发或在泡沫中的吸收而急剧减少,因此延迟啤酒花加成时间可能对保留萜烯烃有效。菌株M3可能同时存在β-葡萄糖苷酶和芳樟醇异构酶,发酵过程中进行酒花物质转化获得高水平的β-香茅醇。此外,芳樟醇、香叶醇和β-香茅醇之间存在着加和效应,香叶醇和β-香茅醇的加和效应仅为5 μg/L,因此,香叶醇和β-香茅醇也可能在较低水平下(低于其感官阈值)对啤酒花啤酒风味有贡献[25]。
β-裂解酶催化半胱氨酸-S共轭化合物的β消除反应,这是挥发性硫醇释放的关键反应[26]。在酵母菌中,IRC7基因编码半胱氨酸S-共轭β-裂解酶,它可以从半胱氨酸化前体形式中释放多功能硫醇,从而促进啤酒中的硫醇香气[27]。此类硫醇如4MP,其被描述为具有黄杨和黑加仑香气[28];3MHA以百香果和番石榴味而闻名[29],而3MH呈现出一种葡萄味。这些硫醇大多来自于啤酒花,少部分来自麦芽,由于其风味阈值极低,因此对啤酒的风味影响十分显著, 酿酒师们使用富含硫醇的酒花开发了许多啤酒新产品,来满足市场的差异化需求。硫醇在啤酒花中的存在形式为结合态,其含量因品种、收获年份和储存时间的不同而有所差异。研究人员已经成功地利用基因改造将编码β-裂解酶的基因整合到菌株中,从而增强硫醇的释放能力[30]。因此,酵母菌株的β-裂解酶活性以及它们影响啤酒中硫醇释放香气的能力具有很大的研究价值。
综上所述,将具有较高β-葡萄糖苷酶和β-裂解酶活性的M3与US-05混合发酵酿造啤酒,研究获得优化工艺条件,发酵温度22 ℃,US-05∶M3=1∶2,间隔1 d接种。混菌发酵啤酒中乙酯类化合物、芳樟醇、β-香茅醇以及3MH的含量都明显高于US-05单独发酵所产生的。感官评价的结果表明混菌发酵啤酒在柑橘香、热带水果香、核果香气方面有突出的优势,同时在口感和整体协调性上也优于单菌发酵的啤酒。将M3菌株与啤酒酵母混合发酵,有助于提高啤酒中萜烯类化合物与挥发性硫醇的含量进而丰富啤酒香气,酿造风格独特的啤酒。
[1] MESTRE FURLANI M V, VARGAS PERUCCA M F, PETRIGNANI D B, et al. Enhancing flavor complexity in craft beer: Sequential inoculation with indigenous non-Saccharomyces and commercial Saccharomyces Yeasts[J]. Fermentation, 2024, 10(12):657.
[2] YEO H Q, LIU S Q.An overview of selected specialty beers:Developments, challenges and prospects[J].International Journal of Food Science and Technology, 2014, 49(7):1607-1618.
[3] 王笑语, 陈晶瑜, 马长伟.非酿酒酵母在多元化啤酒酿造应用中的研究进展[J].食品与发酵工业, 2024, 50(10):362-370.WANG X Y, CHEN J Y, MA C W.Application of non-Saccharomyces in diversified beer brewing:A review[J].Food and Fermentation Industries, 2024, 50(10):362-370.
[4] 覃秋杏, 韩小雨, 黄卫东, 等.非酿酒酵母产生的β-葡萄糖苷酶在发酵酒中的应用研究进展[J].食品科学, 2022, 43(3):306-314.QIN Q X, HAN X Y, HUANG W D, et al.Progress in the application of β-glucosidase produced by Non-Saccharomyces cerevisiae Yeasts in beer and wine[J].Food Science, 2022, 43(3):306-314.
[5] SHI W K, WANG J, CHEN F S, et al.Effect of Issatchenkia terricola and Pichia kudriavzevii on wine flavor and quality through simultaneous and sequential co-fermentation with Saccharomyces cerevisiae[J].LWT, 2019, 116:108477.
[6] SVEDLUND N, EVERING S, GIBSON B, et al.Fruits of their labour:Biotransformation reactions of yeasts during brewery fermentation[J].Applied Microbiology and Biotechnology, 2022, 106(13):4929-4944.
[7] ROLAND A, SCHNEIDER R, RAZUNGLES A, et al.Varietal thiols in wine:Discovery, analysis and applications[J].Chemical Reviews, 2011, 111(11):7355-7376.
[8] KALB V, SEEWALD T, HOFMANN T, et al.Studies on the impact of malting and mashing on the free, soluble ester-bound, and insoluble ester-bound forms of desired and undesired phenolic acids aiming at styrene mitigation during wheat beer brewing[J].Journal of Agricultural and Food Chemistry, 2020, 68(44):12421-12432.
[9] 林睿, 吴殿辉, 彭政聪, 等.茶叶不同添加方式对太平猴魁绿茶啤酒风味影响[J].食品与发酵工业, 2025, 51(1):81-89.LIN R, WU D H, PENG Z C, et al.Effect of different tea addition methods on flavor of Taiping Houkui green tea beer[J].Food and Fermentation Industries, 2025, 51(1):81-89.[10] LIU Y, DANCKER P, BIENDL M, et al.Comparison of polyfunctional thiol, element, and total essential oil contents in 32 hop varieties from different countries[J].Food Chemistry, 2024, 455:139855.
[11] 李海峰, 李砷, 牟志勇, 等.非酿酒酵母在酒类酿造过程中的微生物相互作用及功能特性研究进展[J].食品与发酵工业, 2024, 50(7):313-323.LI H F, LI S, MOU Z Y, et al.Research progress on microbial interaction and functional characteristics of non-Saccharomyces yeasts in wine brewing process[J].Food and Fermentation Industries, 2024, 50(7):313-323.
[12] 李柔, 刘源, 宋开阔, 等.非酿酒酵母与酿酒酵母在米酒混菌发酵中的相互作用机制分析[J].食品与发酵工业, 2024, 50(2):41-47.LI R, LIU Y, SONG K K, et al.Interaction mechanism of non-Saccharomyces yeast and Saccharomyces cerevisiae in mixed fermentation of Mijiu[J].Food and Fermentation Industries, 2024, 50(2):41-47.
[13] CIANI M, MORALES P, COMITINI F, et al.Non-conventional yeast species for lowering ethanol content of wines[J].Frontiers in Microbiology, 2016, 7:642.
[14] YOSHIMOTO H, BOGAKI T.Mechanisms of production and control of acetate esters in yeasts[J].Journal of Bioscience and Bioengineering, 2023, 136(4):261-269.
[15] TIAN H X, XIONG J J, SUN J S, et al.Dynamic transformation in flavor during hawthorn wine fermentation:Sensory properties and profiles of nonvolatile and volatile aroma compounds coupled with multivariate analysis[J].Food Chemistry, 2024, 456:139982.
[16] YOSHIOKA K, HASHIMOTO N.Ester formation by alcohol acetyltransferase from brewers’ yeast[J].Agricultural and Biological Chemistry, 1981, 45(10):2183-2190.
[17] 陈玉香, 张雯, 蔡琪琪, 等.发酵温度对异常维克汉姆酵母产挥发性风味物质的影响[J].中国食品学报, 2016, 16(9):122-128.CHEN Y X, ZHANG W, CAI Q Q, et al.Effect of fermentation temperature on volatile flavor compounds produced by Wickerhamomyces anomalus[J].Journal of Chinese Institute of Food Science and Technology, 2016, 16(9):122-128.
[18] SAERENS S M G, DELVAUX F, VERSTREPEN K J, et al.Parameters affecting ethyl ester production by Saccharomyces cerevisiae during fermentation[J].Applied and Environmental Microbiology, 2008, 74(2):454-461.
[19] QIN L, MA D S, LIN G Y, et al.Low temperature promotes the production and efflux of terpenoids in yeast[J].Bioresource Technology, 2024, 395:130376.
[20] ALBERGARIA H, ARNEBORG N.Dominance of Saccharomyces cerevisiae in alcoholic fermentation processes:Role of physiological fitness and microbial interactions[J].Applied Microbiology and Biotechnology, 2016, 100(5):2035-2046.
[21] DIETZ C, COOK D, WILSON C, et al.Exploring the multisensory perception of terpene alcohol and sesquiterpene rich hop extracts in lager style beer[J].Food Research International, 2021, 148:110598.
[22] TAKOI. Screening of geraniol-rich flavor hop and interesting behavior of beta-citronellol during fermentation under various hop-addition timings[J]. Journal of the American Society of Brewing Chemists, 2014, 71(1): 22-29.
[23] OHASHI Y, HUANG S, MAEDA I.Biosyntheses of geranic acid and citronellic acid from monoterpene alcohols by Saccharomyces cerevisiae[J].Bioscience, Biotechnology, and Biochemistry, 2021, 85(6):1530-1535.
[24] ROBERTS R, SILCOCK P, LEUS M, et al.Analysis of terpenoid biotransformation in beer by commercial Saccharomyces cerevisiae yeast using headspace SPME-GC/MS[J].Food Chemistry Advances, 2024, 4:100692.
[25] TAKOI K, KOIE K, ITOGA Y, et al.Biotransformation of hop-derived monoterpene alcohols by lager yeast and their contribution to the flavor of hopped beer[J].Journal of Agricultural and Food Chemistry, 2010, 58(8):5050-5058.
[26] SCHWARTZ M, POIRIER N, MORENO J, et al.Microbial β C-S lyases:Enzymes with multifaceted roles in flavor generation[J].International Journal of Molecular Sciences, 2024, 25(12):6412.
[27] MOLITOR R W, FISCHBORN T, DAGAN L, et al.Examining how the fermentation medium influences thiol expression and its perceived aroma in commercial brewing yeast strains[J].Journal of Agricultural and Food Chemistry, 2023, 71(5):2493-2502.
[28] LI H K, CHANG C F,LIN H J, et al.Conversion of a thiol precursor into aroma compound 4-mercapto-4-methyl-2-pentanone using microbial cell extracts[J].Fermentation, 2021, 7(3):129.
[29] MA N, YI F P, ZHU J C. Characterization of aroma-active compounds and perceptual interaction between esters and sulfur compounds in Xi baijiu[J].European Food Research and Technology, 2020, 246(12):2517-2535.
[30] MOLITOR R W, ROOP J I, DENBY C M, et al.The sensorial and chemical changes in beer brewed with yeast genetically modified to release polyfunctional thiols from malt and hops[J].Fermentation, 2022, 8(8):370.