琼脂,又名琼胶、洋菜、冻粉、燕菜精、洋粉、寒天,是一种存在于红藻细胞壁中的天然水溶性高分子线性多糖,主要来源于江蓠、石花菜、紫菜及其他红藻类水生植物[1-3]。琼脂首次于1658年在日本京都被客栈老板米诺亚·塔拉佐蒙偶然发现,比其他2种藻胶体(卡拉胶和海藻酸盐)早200年[4]。琼脂因具备优良的凝胶性、增稠性以及稳定性被广泛应用于食品、化工及医药等领域[5-6]。其中,凝胶性能是评价琼脂质量的关键指标,对于琼脂的价值具有决定性作用。琼脂主要由2部分组成,分别为琼脂糖和琼脂胶[7-8]。其中,琼脂糖是形成凝胶的主要成分,而琼脂胶上存在硫酸基团,会影响琼脂在凝固过程中双螺旋结构的形成从而降低琼脂的凝胶强度[9-10],因此,去除琼脂中的硫酸基团十分必要。
琼脂脱硫方法可分为化学法脱硫、酶法脱硫及微生物法脱硫。化学法脱硫是工业上常用的脱硫方法,其可以有效去除琼脂中的硫酸基团,但该方法存在污染环境、降低琼脂性能等缺点。化学法脱硫在处理琼脂的过程中会使用氢氧化钠等强碱从而造成环境污染[11-12],且在强碱处理后需要使用大量的淡水来清洗琼脂,水资源浪费严重[13-14]。化学法可以去除L-半乳糖C-6位置的硫酸基团,而对于D-半乳糖C-4和C-6位置的硫酸基团却不能去除[15]。强碱在处理琼脂的过程中还会因反应剧烈而导致琼脂多糖链发生严重解聚,并导致琼脂产物发生褐变,从而影响琼脂的产率和凝胶强度等性能。因此,迫切需要建立绿色环保且不影响琼脂性能的脱硫方法来替代化学法琼脂脱硫。酶法脱硫具备绿色无污染及反应速率较快的优势,但存在脱硫过程复杂、酶不易回收、耗费成本高等缺点,至今仍停留在实验室阶段,没有实现工业化[16]。本团队在前期研究中建立了基于微生物的琼脂脱硫方法[17]。微生物法脱硫是在酶法脱硫的基础上,对脱硫工艺进行了简化,其不再需要对酶进行制备纯化,而是将琼脂作为唯一硫源加入培养基中来发酵具有脱硫能力的菌株,菌株在发酵过程中,分泌脱硫酶至培养基中来脱除琼脂中的硫酸基团,释放出游离的硫酸根作为硫源供菌株生长使用,菌株在生长过程中会分泌更多的酶来脱硫,形成正向循环[18]。微生物法脱硫具备环境友好、工艺简单、成本低的优势,并有望实现琼脂糖的直接制备,对于推动国家琼脂工业的绿色转型具有重要意义。
巨大芽孢杆菌是以琼脂为唯一硫源筛选出的脱硫菌株,目前其对于琼脂的脱硫率达74.67%,是可以有效提升琼脂品质的菌株[17]。但巨大芽孢杆菌对于琼脂中硫酸基团的去除还不够彻底,且将巨大芽孢杆菌应用于食品中的安全性还不够强,因此需要寻找更加安全高效的菌株来进行脱硫。
本研究使用本实验室现存菌株解脂耶氏酵母进行发酵脱硫尝试,其具备公认的安全性,且分子操作体系成熟[19],有利于后续进行代谢工程改造。经实验验证表明其可以琼脂为唯一硫源生长而不利用琼脂中的碳源。为了确定微生物琼脂脱硫的最佳形态,采用解脂耶氏酵母分别对粉状及条状琼脂进行了发酵脱硫。为了进一步提升脱硫效率使得脱硫后的琼脂性能接近于琼脂糖的水平,本文分别采用解脂耶氏酵母及巨大芽孢杆菌对琼脂进行了连续转接脱硫。并以脱硫后的琼脂作为核酸电泳凝胶原料进行了性能测试。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株
巨大芽孢杆菌(Priestia megaterium WMX)及解脂耶氏酵母(Yarrowia lipolytica PO1 h-URA)为中国海洋大学食品科学与工程学院海洋食品生物技术与工程实验室所保藏菌株。
1.1.2 试剂
次氯酸钠溶液,上海麦克林生化科技股份有限公司;5×M9基础盐、M9微量元素,艾礼生物科技(上海)有限公司;D-葡萄糖、氯化钠、氯化钡、明胶、硫酸钾、盐酸,国药集团化学试剂有限公司;蛋白胨、胰蛋白胨、酵母提取物,英国OXOID公司;生化琼脂粉,上海索莱宝生物科技有限公司;琼脂条,福建省莆田市城厢区福利琼脂厂。本研究所用试剂均为分析纯。
1.1.3 培养基
a)LB培养基(g/L):胰蛋白胨10、酵母提取物5、氯化钠10[配制固体培养基时额外加入1.5%~2.0%(质量分数)的琼脂粉]。于高压灭菌锅中在121 ℃下灭菌15 min,备用。
b)酵母浸出粉胨葡萄糖(yeast extract peptone dextrose,YPD)培养基:在900 mL去离子水中加入10 g 酵母提取物,20 g蛋白胨[配制固体培养基时额外加入1.5%~2.0%(质量分数)的琼脂粉],于高压灭菌锅中在121 ℃下灭菌15 min,于超净台中加入100 mL灭菌后的20%(质量分数)的葡萄糖溶液。
c)琼脂条硫源M9培养基(g/L):基础盐56.4(Na2HPO4 33.90、KH2PO4 15.00、NaCl 2.50、NH4Cl 5.00),配制成5×M9基础盐溶液,取10 mL液体于250 mL锥形瓶中,加入35 mL去离子水,于高压灭菌锅中在121 ℃下灭菌15 min,在使用前加入5 mL 200 g/L葡萄糖溶液和0.1%(质量分数)的M9微量元素溶液(无菌),琼脂原料采用1 g次氯酸钠灭菌后的琼脂条。
d)琼脂粉硫源M9培养基:琼脂原料采用琼脂条粉碎后的琼脂粉,使用次氯酸钠作灭菌处理,其余配方与c)中相同。
e)生化琼脂片硫源M9培养基:琼脂原料采用琼脂片(在100 mL的去离子水中加入1.5 g生化琼脂粉,于高压灭菌锅中在115 ℃下灭菌30 min,趁热于超净台中倒入培养皿中,待冷却凝固后切割成约1.0 cm×1.0 cm×0.3 cm的琼脂片)其余配方与c)中相同。
f)生化琼脂片碳源M9培养基:琼脂原料采用琼脂片[琼脂片制备方法参考e)],除不加入5 mL 200 g/L葡萄糖溶液外,其余配方与c)中相同。
1.2 仪器与设备
ZEALWAY GR60DA立式高压蒸汽灭菌锅,致微仪器公司;DHP-9012B微生物培养箱、DHG-9013A电热鼓风干燥箱,上海一恒科技有限公司;TMS-TOUCH质构仪,美国FTC公司;Multiskan FC酶标仪,美国赛默飞世尔科技公司;V-5600(PC)紫外分光光度计,上海元析仪器有限公司;ZSZY-88CH振荡培养箱,知楚仪器有限公司;HFsafe-1200LC(A2)超净台,力新仪器(上海)有限公司。
1.3 实验方法
1.3.1 次氯酸钠处理琼脂灭菌
称取1 g琼脂于250 mL锥形瓶中,加入100 mL 0.025%(体积分数)的次氯酸钠溶液,于恒温摇床中振荡灭菌40 min(30 ℃,220 r/min),取出于超净台中用灭菌后的去离子水清洗琼脂3次,加入50 mL去离子水,于恒温摇床(30 ℃,220 r/min)振荡24 h去除余氯[17]。
1.3.2 微生物发酵脱硫方法
种子液的配制:取保菌管中的菌液5 μL划线于LB或YPD固体平板中,巨大芽孢杆菌置于37 ℃恒温培养箱中生长12 h,解脂耶氏酵母置于30 ℃恒温培养箱中生长24 h,取平板上的菌落用LB或YPD液体培养基摇瓶培养过夜(37 ℃或30 ℃,220 r/min),取1 mL液体接种于生化琼脂片硫源M9培养基中培养1 d(37 ℃或30 ℃,220 r/min)作为种子液。
摇瓶发酵脱硫:取5 mL种子液接种于琼脂条(粉)硫源M9培养基中,于恒温摇床中进行培养(37 ℃或30 ℃,220 r/min),每24 h取样测定OD600(取200 μL菌液于96孔板中,使用酶标仪在600 nm波长下测定细胞密度)[17]。
脱硫后琼脂处理:待菌株生长至平稳期后,将发酵处理后的琼脂用去离子水清洗3次,置于电热鼓风干燥箱中烘干,烘干后测量琼脂的硫含量及凝胶强度[17]。
解脂耶氏酵母脱硫可行性验证:分别将菌株接种于生化琼脂片硫源M9培养基及生化琼脂片碳源M9培养基中,于恒温振荡摇床中进行培养(30 ℃,220 r/min),培养过程中每24 h测量OD600。
解脂耶氏酵母对琼脂形态的筛选:分别将菌株接种于琼脂粉硫源M9培养基及琼脂条硫源M9培养基中,于恒温摇床中进行培养(30 ℃,220 r/min),培养过程中每24 h测量OD600,待菌株生长至平稳期后,将处理后的琼脂用去离子水清洗3次,于电热鼓风干燥箱中烘干,烘干后测量琼脂的硫含量及凝胶强度进行分析比较。
1.3.3 菌株对琼脂的连续转接培养
将菌株接种于琼脂条硫源M9培养基中,于恒温振荡摇床中进行摇瓶培养(37 ℃或30 ℃,220 r/min),发酵过程中每天测定生长OD600值,待菌株生长至平稳期后,将培养基中的液体倒掉,加入新的M9液体培养基及种子液,重复此步骤至菌株不再明显生长[18]。将连续转接处理后的琼脂用去离子水清洗3次,于电热鼓风干燥箱中烘干,烘干后测量琼脂的硫含量及凝胶强度。
1.3.4 琼脂中硫酸基含量的测定
采用BaCl2-明胶比浊法[11],具体方法如下:取0.2~0.3 g琼脂样品于50 mL 1 mol/L HCl溶液中,于高压灭菌锅中在115 ℃下酸解240 min,酸解后加入4.0 g活性炭并混匀,室温下静置1 h脱色,取脱色后的液体用0.45 μm孔径的水系滤膜进行过滤除去杂质,取1 mL滤液与3 mL明胶-氯化钡溶液混合均匀,静置10 min后于354 nm波长下测定其吸光值,并计算含硫率。
1.3.5 琼脂凝胶强度性能的测定
称取0.15 g的琼脂样品于10 mL去离子水中,以微波炉加热溶解,取3 mL溶解液于直径2 cm、高1.5 cm的圆柱形容器中,于室温下冷却至凝固后置于4 ℃冰箱中过夜老化,次日取出使用质构仪测量琼脂的凝胶强度,检测参数为(检测速度:60 mm/min;穿刺深度:5 mm;探针半径:3 mm)[20]。凝胶强度的计算如公式(1)所示:
凝胶强度![]()
(1)
式中:F,将琼脂挤压至破裂的最大力,N;g,重力加速度,9.8 N/kg;S,探针的截面积,cm2。
1.3.6 琼脂凝胶核酸电泳方法
制备凝胶方法:称量1 g琼脂加入于100 mL的1×TAE溶液中(50×TAE稀释50倍),加入5 μL的Redsafe染液,于微波炉中进行加热至完全溶解后取出摇匀,将溶解液缓慢倒入插好样品梳的制胶板中,等待20 min左右使其凝固,然后轻轻拔出样品梳。
核酸电泳方法:将制好的胶放置于核酸电泳槽中,每孔用移液器加入10 μL样品,盖好核酸电泳槽盖子,设定核酸电泳程序为150 V,400 mA,15 min,待电泳结束后取出凝胶置于紫外灯下或凝胶成像系统中进行观察并记录。
1.4 数据处理
数据使用Excel软件进行整理及分析,数据图使用Origin软件进行制作。
2 结果与分析
2.1 解脂耶氏酵母脱硫可行性分析
为了保证微生物脱硫后的琼脂可安全应用于食品中,并为了方便后续对脱硫菌株进行代谢工程改造,本研究使用本实验室现存菌株解脂耶氏酵母来进行脱硫尝试,相比于其他菌株,解脂耶氏酵母具备公认的安全性,且分子操作技术成熟。首先对其进行了脱硫可行性验证,如图1所示,解脂耶氏酵母Y.lipolytica PO1 h-URA在以琼脂为唯一碳源的培养基中不生长,在以琼脂为唯一硫源的培养基中可以生长,且在发酵的第1天菌株的OD600就显著提高(P<0.05),说明其可作为脱硫菌株应用于琼脂脱硫中。
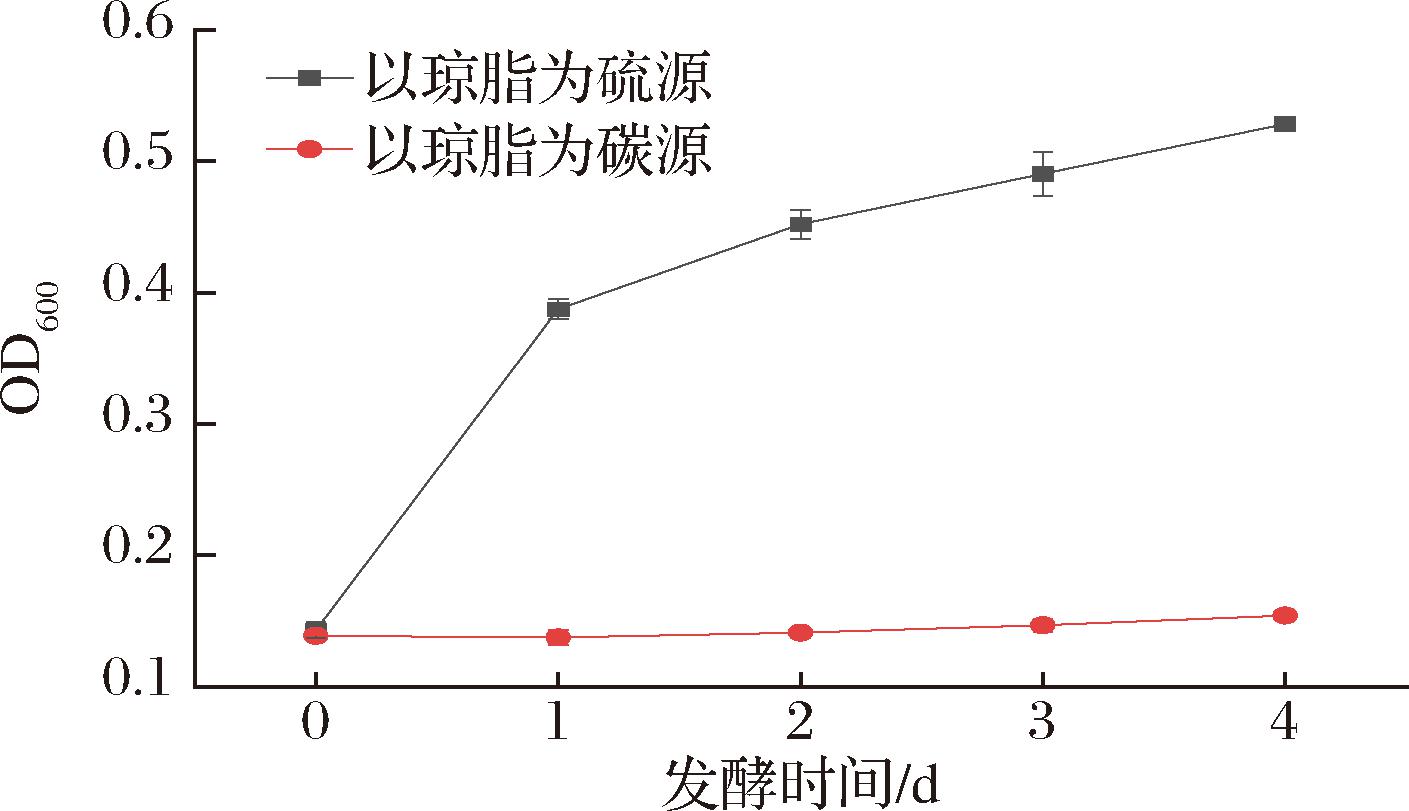
图1 解脂耶氏酵母以琼脂为硫源及碳源的生长情况
Fig.1 Growth of Y.lipolytica PO1 h-URA with agar as sulfur source or carbon source
2.2 琼脂脱硫形态的确定
分别采取琼脂粉及琼脂条的形式进行脱硫,以确定最合适的脱硫形态。结果如图2所示,采用琼脂粉形态进行发酵脱硫,其硫含量从1.18%降低至0.72%,降低了39.36%,凝胶强度从362.02 g/cm2提升至471.81 g/cm2,提升了30.33%;而采用琼脂条形态进行发酵脱硫,硫含量从1.18%降低至0.58%,显著降低了50.59%,凝胶强度从362.02 g/cm2提升至565.09 g/cm2,相比于原始琼脂显著提升了56.09%(P<0.05)。说明琼脂条形态更有利于解脂耶氏酵母的发酵脱硫,因此后续选择琼脂条形态进行研究。
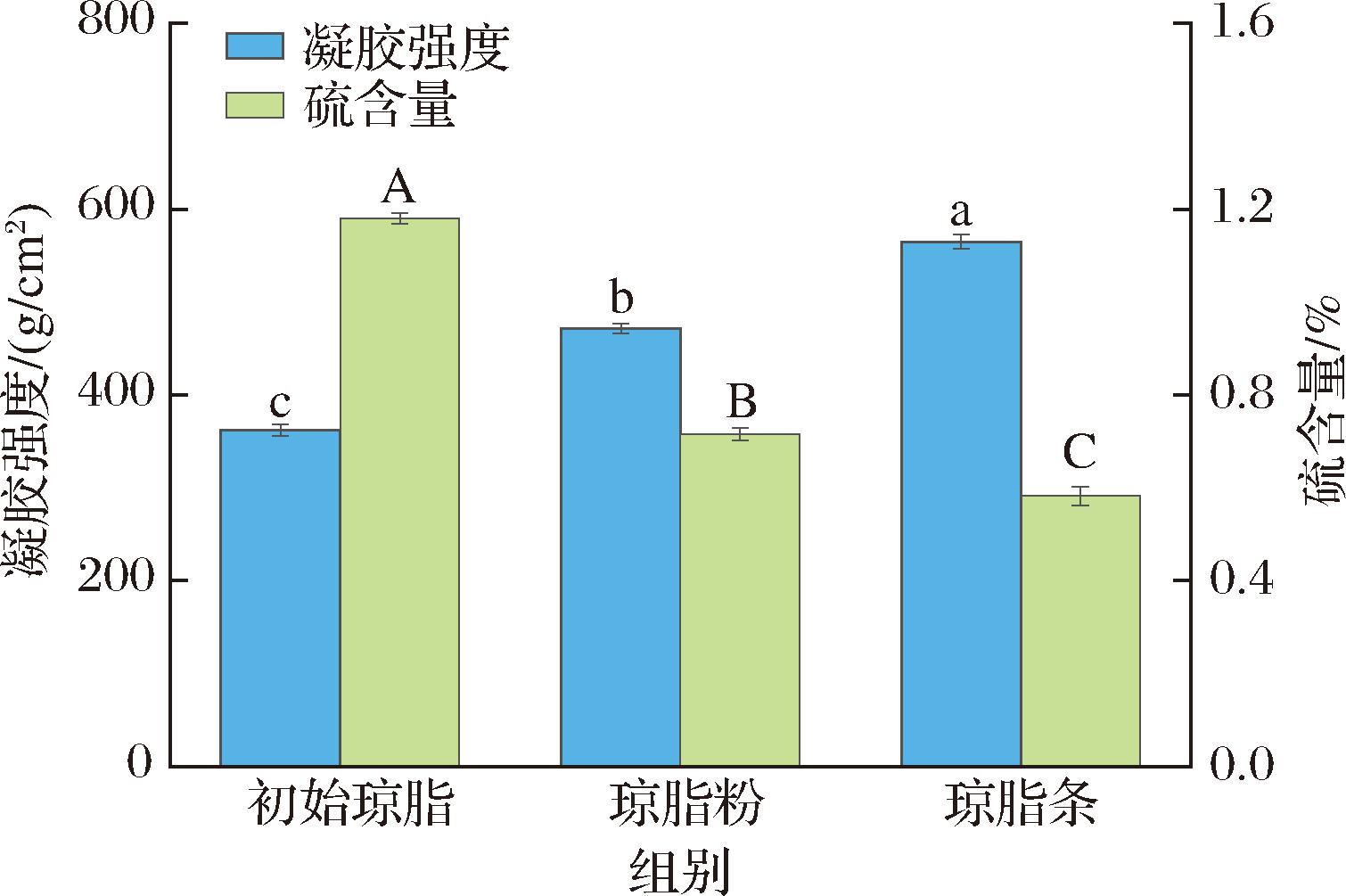
图2 不同脱硫形态的脱硫效果
Fig.2 Desulfation effect of different desulfation forms
注:不同小写及大写字母表示差异显著(P<0.05)(下同)。
2.3 解脂耶氏酵母对琼脂的连续转接脱硫
菌株一次脱硫后的琼脂质量还不够高,为了进一步提升脱硫率进而提升琼脂的质量,使得脱硫后的琼脂接近于琼脂糖的性质,能够在生物技术等领域得到有效应用,本研究采取连续转接的方式继续脱硫,菌株在一次脱硫后,培养基中的营养成分被消耗掉且菌株的生长进入衰亡期,此时将处理后的琼脂转入新的培养基溶液中并接入具有生长活力的新鲜种子液,可实现菌株对琼脂的二次脱硫继而提升琼脂质量。使用解脂耶氏酵母采取连续转接的方式对琼脂进行脱硫,其脱硫效果如图3所示,发酵1次时,OD600值最高为0.51,而发酵4次时OD600值为0.31,相比于发酵1次显著降低(P<0.05)。随着发酵次数的增加,解脂耶氏酵母的生长OD600值在依次降低,说明琼脂中的硫在不断地被菌株所消耗掉。解脂耶氏酵母处理4次后,琼脂的硫含量由1.12%降低至0.04%,相比于原始琼脂显著降低了96.19%(P<0.05),凝胶强度由362.02 g/cm2提升至959.63 g/cm2,显著提升了165.08%,解脂耶氏酵母的连续转接脱硫使得琼脂的性质得到了有效提升。在近几年的化学法脱硫研究中,采用氢氧化钙使得琼脂的硫含量降至0.25%[21], 使用过氧化氢对琼脂的脱硫率达76.7%,而琼脂的凝胶强度仅提升了13.3%[22]。相比于碱法脱硫,微生物法脱硫具备环境友好的特点,其在脱硫过程中会分泌脱硫酶从而去除碱法脱硫无法去除的硫酸基团[15],使得脱硫更加彻底,无需进行琼脂胶及琼脂糖的分离纯化即可得到接近于琼脂糖品质的琼脂。
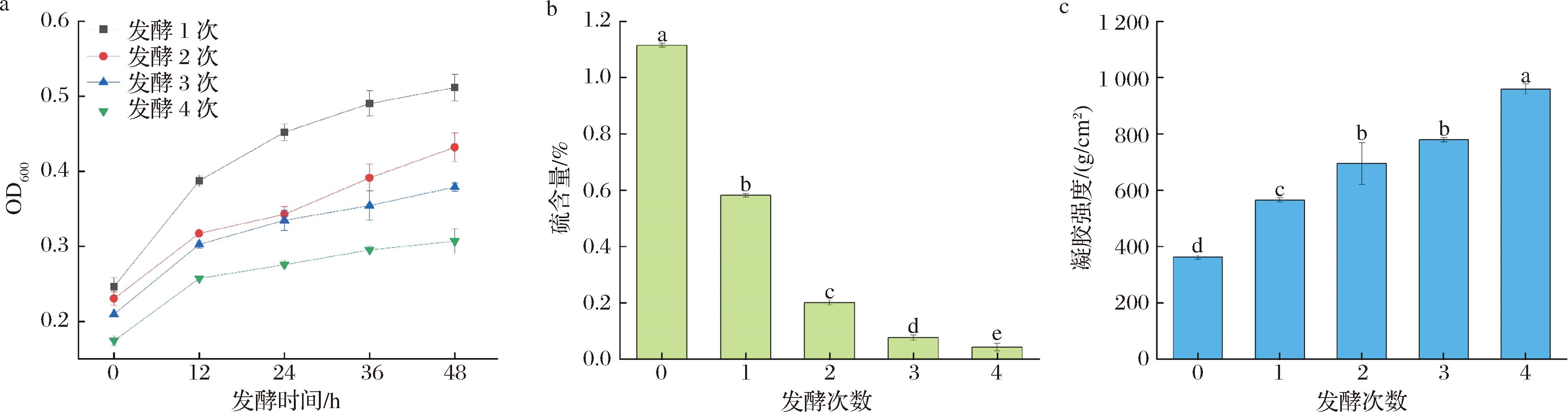
a-解脂耶氏酵母连续转接脱硫的生长OD600值;b-解脂耶氏酵母连续转接对琼脂硫含量的影响;c-解脂耶氏酵母连续转接对琼脂凝胶强度的影响
图3 解脂耶氏酵母对琼脂的连续转接脱硫效果
Fig.3 Continuous transfer desulfation effect of Y.lipolytica PO1 h-URA on agar
2.4 巨大芽孢杆菌对琼脂的连续转接效果
巨大芽孢杆菌是本团队前期以琼脂为唯一硫源筛选出的菌株,目前其对于琼脂的脱硫率达74.67%,是可以有效提升琼脂质量的菌株。为了进一步验证连续转接脱硫方法的有效性,本研究以巨大芽孢杆菌采用连续转接的方法对琼脂进行脱硫。硫是微生物生长的必需元素[23],因此在硫源缺乏的条件下,菌株的细胞密度越高,说明其所利用的硫源越多,对于琼脂中硫酸基团的去除也就越多。由图4所示,发酵1次时,OD600值最高为0.73,而发酵4次时OD600值仅为0.19,相比于发酵1次显著降低(P<0.05)。随着发酵次数的增加,巨大芽孢杆菌的生长OD600值在依次降低,说明琼脂中的硫在不断地被菌株所消耗掉。P.megaterium WMX处理4次后,琼脂的硫含量由1.12% 降低至0.13%,显著降低了88.04%,在本团队前期的研究中使用巨大芽孢杆菌处理后的琼脂硫含量降低至0.29%[17];凝胶强度由362.02 g/cm2提升至1 067.78 g/cm2,显著提升了194.95%(P<0.05),相比于前期的研究提升了4.25%[17],接近于琼脂糖的水平(凝胶强度≥1 200 g/cm2)。脱硫率低于解脂耶氏酵母对琼脂的连续转接,但凝胶强度高于解脂耶氏酵母,说明不同微生物处理琼脂脱硫,对琼脂不同性质的影响有差异。
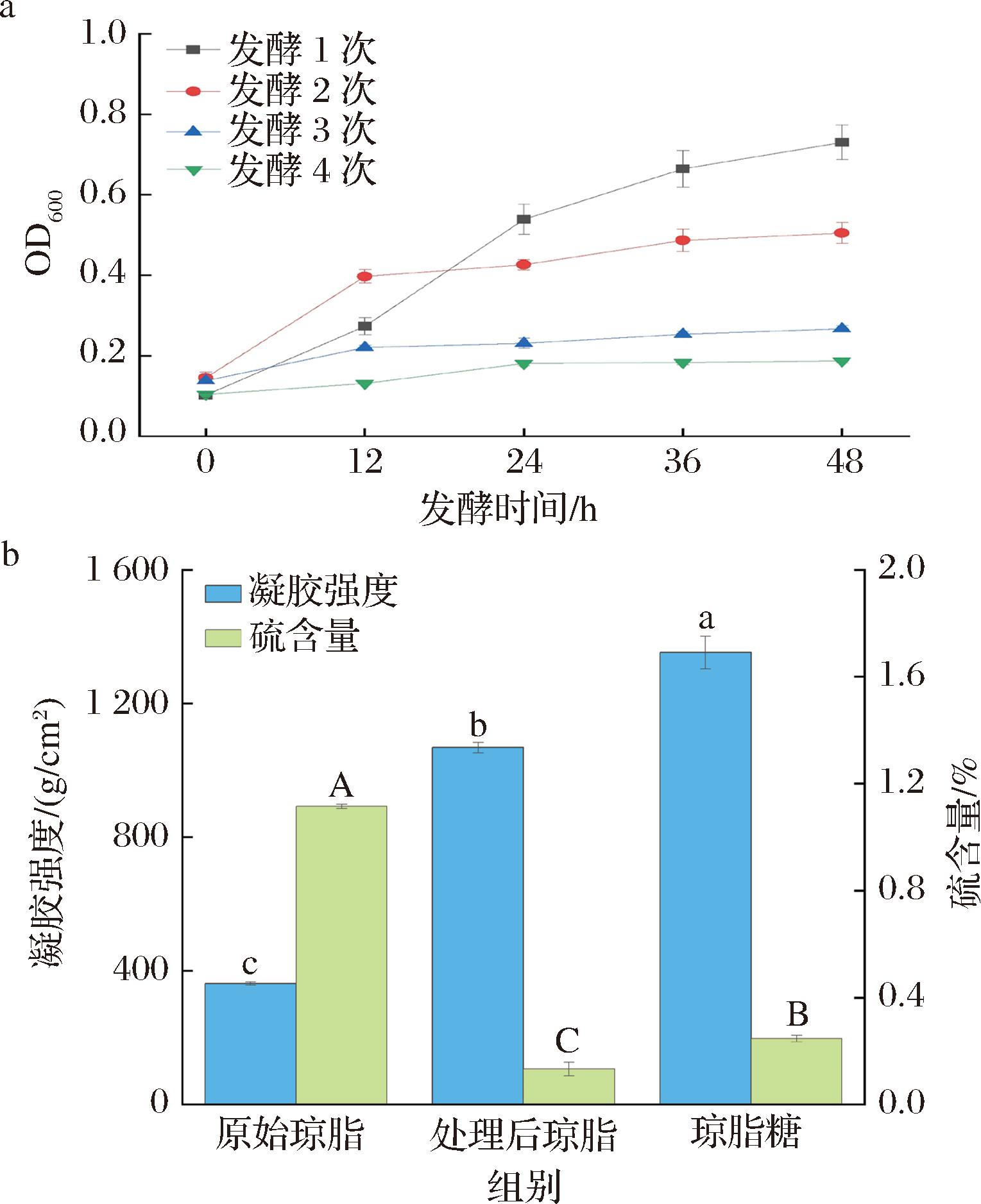
a-巨大芽孢杆菌连续转接脱硫的生长OD600值;b-巨大芽孢杆菌连续转接脱硫对琼脂性质的影响
图4 巨大芽孢杆菌连续转接脱硫生长情况及对琼脂性质的影响
Fig.4 Growth of P.megaterium WMX by continuous transfer desulfation and its effect on agar properties
2.5 解脂耶氏酵母处理后琼脂凝胶电泳结果
将解脂耶氏酵母发酵脱硫后的琼脂用于核酸电泳(脱硫后的琼脂经水洗5次以上后所含菌落含量很低,无需再经过灭菌处理过程,可直接用于制作核酸电泳凝胶),结果如图5所示。从核酸电泳的清晰度和迁移率来看,琼脂糖的效果最好,其清晰度最高,相同时间下的迁移距离最长。经解脂耶氏酵母菌株发酵脱硫之后的琼脂,其清晰度和迁移距离具有与琼脂糖相近的水平,比原始琼脂的清晰度更高,迁移速度更快,这是因为琼脂上硫酸基被脱除后,离子含量减少,使得其电内渗降低[24]。以上结果表明,解脂耶氏酵母菌株生物法脱硫对琼脂中硫酸基团的脱除具有良好的效果,脱硫后的琼脂接近于琼脂糖的水平,相比于化学法制备琼脂糖,不需要进行分离纯化,节省工艺流程及成本,对于推动生物法制备琼脂糖具有重要意义,具有很大的研究价值和发展前景。
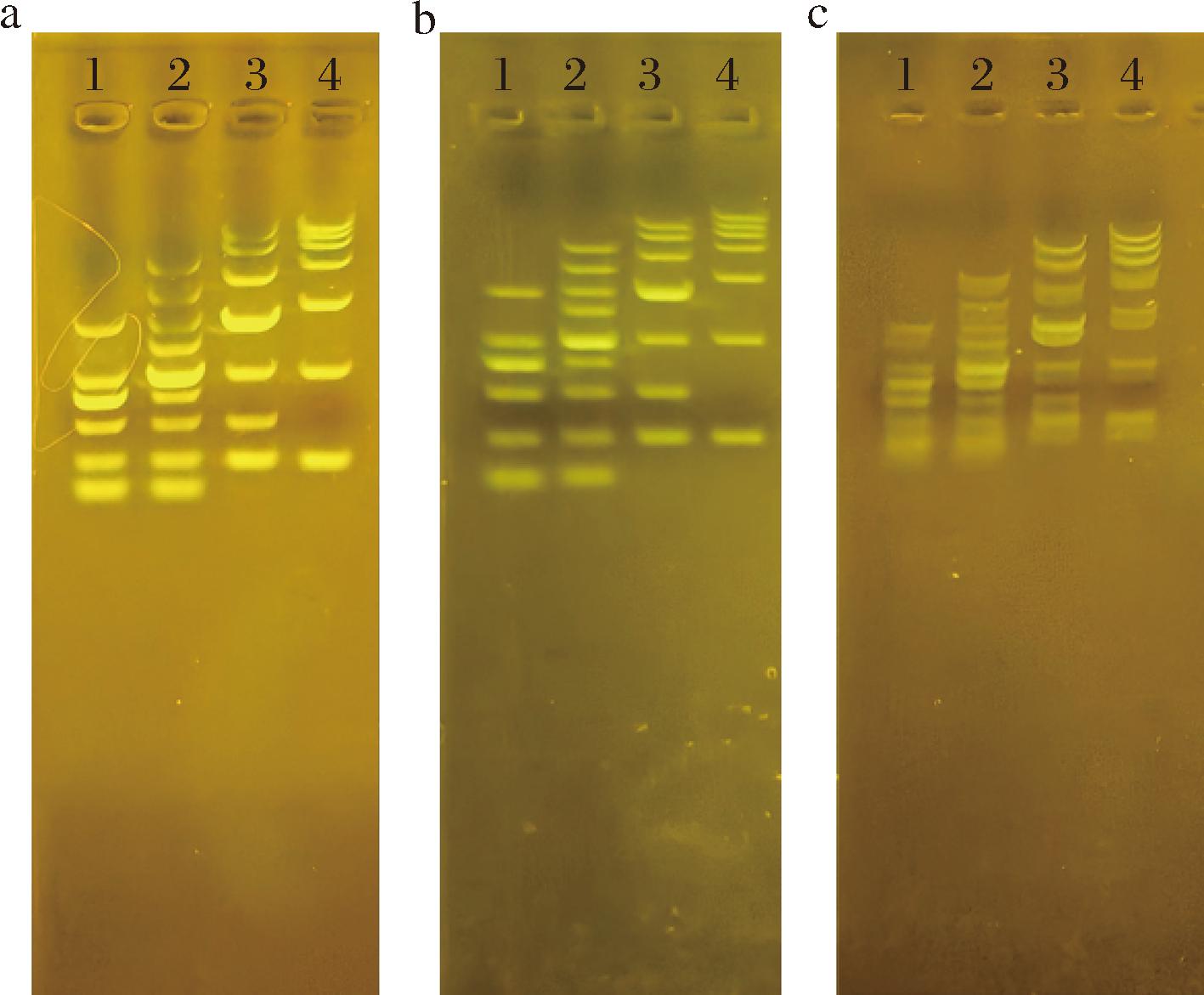
a-琼脂糖凝胶;b-解脂耶氏酵母连续转接后琼脂凝胶;c-原始琼脂凝胶
图5 解脂耶氏酵母处理后琼脂凝胶电泳结果
Fig.5 Agar gel electrophoresis results after Y.lipolytica PO1 h-URA treatment
注:图中标记1、2、3、4分别为2 000、5 000、10 000、15 000 bp长度的maker。
3 结论与讨论
在本研究中,为了提升微生物脱硫琼脂的安全性,采取本实验室保藏菌株解脂耶氏酵母进行脱硫尝试,经验证其可以琼脂为唯一硫源生长,而不能以琼脂为碳源生长。采用解脂耶氏酵母对所要脱硫琼脂的形态进行了筛选,其中,对于琼脂粉的脱硫率达39.36%,其凝胶强度提升了30.33%;对于琼脂条的脱硫率达50.59%,凝胶强度提升了56.09%,因此采用琼脂条进行后续的脱硫工作。为了进一步提升脱硫效果以实现生物法制备琼脂糖,使用解脂耶氏酵母对琼脂进行连续转接处理,其硫含量降低至0.04%,脱硫率为96.16%,凝胶强度提升至959.63 g/cm2,提升了165.08%,硫含量达到琼脂糖标准,凝胶强度接近于琼脂糖水平(硫含量≤0.15%,凝胶强度≥1 200 g/cm2)。将解脂耶氏酵母脱硫后的琼脂应用于核酸电泳,结果表明其核酸电泳的清晰度和迁移率相比于原始琼脂明显提高,接近于琼脂糖的水平。采用巨大芽孢杆菌对琼脂进行了连续转接处理,其对于琼脂的脱硫率达到88.04%,琼脂的凝胶强度提升了194.95%,说明连续转接的方法适用于不同的脱硫微生物。本研究基于生物法使用解脂耶氏酵母及巨大芽孢杆菌通过连续转接方法推进了微生物脱硫法的应用,对于脱硫工业的绿色转型及生物法制备琼脂糖提供了一定的思路。
[1] ZHANG C, AN D, XIAO Q, et al.Preparation, characterization, and modification mechanism of agar treated with hydrogen peroxide at different temperatures[J].Food Hydrocolloids, 2020, 101:105527.
[2] CREGUT M, RONDAGS E.New insights in agar biorefinery with arylsulphatase activities[J].Process Biochemistry, 2013, 48(12):1861-1871.
[3] LEE W K, LIM Y Y, LEOW A T, et al.Factors affecting yield and gelling properties of agar[J].Journal of Applied Phycology, 2017, 29(3):1527-1540.
[4] NISHINARI K, FANG Y P.Relation between structure and rheological/thermal properties of agar.A mini-review on the effect of alkali treatment and the role of agaropectin[J].Food Structure, 2017, 13:24-34.
[5] ZHANG C H, JIANG Z D, LI H B, et al.Preparation of immobilized arylsulfatase on magnetic Fe3O4 nanoparticles and its application for agar quality improvement[J].Food Science &Nutrition, 2021, 9(9):4952-4962.
[6] ZHU Y B, YIN X Q, LIU H, et al.Substitution of His260 residue alters the thermostability of Pseudoalteromonas carrageenovora arylsulfatase[J].Acta Oceanologica Sinica, 2019, 38(6):75-82.
[7] XIAO Q, AN D, ZHANG C, et al.Agar quality promotion prepared by desulfation with hydrogen peroxide[J].International Journal of Biological Macromolecules, 2020, 145:492-499.
[8] ZHU Y B, LIU H, QIAO C C, et al.Characterization of an arylsulfatase from a mutant library of Pseudoalteromonas carrageenovora arylsulfatase[J].International Journal of Biological Macromolecules, 2017, 96:370-376.
[9] ZHU Y B, LIANG M F, LI H B, et al.A mutant of Pseudoalteromonas carrageenovora arylsulfatase with enhanced enzyme activity and its potential application in improvement of the agar quality[J].Food Chemistry, 2020, 320:126652.[10] GAO C, JIN M, YI Z W, et al.Characterization of a recombinant thermostable arylsulfatase from deep-sea bacterium Flammeovirga pacifica[J].Journal of Microbiology and Biotechnology, 2015, 25(11):1894-1901.
[11] XIAO Q, WANG X Y, ZHANG J B, et al.Pretreatment techniques and green extraction technologies for agar from Gracilaria lemaneiformis[J].Marine Drugs, 2021, 19(11):617.
[12] CALLAWAY E.Lab staple agar hit by seaweed shortage[J].Nature, 2015, 528(7581):171-172.
[13] WANG L J, SHEN Z P, MU H M, et al.Impact of alkali pretreatment on yield, physico-chemical and gelling properties of high quality agar from Gracilaria tenuistipitata[J].Food Hydrocolloids, 2017, 70:356-362.
[14] KIM Y W, SHIN H J.Introduction of alkali soaking and microwave drying processes to improve agar quality of Gracilaria verrucosa[J].Korean Journal of Chemical Engineering, 2017, 34(12):3163-3169.
[15] WANG X Y, DUAN D L, FU X T.Enzymatic desulfation of the red seaweeds agar by Marinomonas arylsulfatase[J].International Journal of Biological Macromolecules, 2016, 93:600-608.
[16] XIAO Q, YIN Q, NI H, et al.Characterization and immobilization of arylsulfatase on modified magnetic nanoparticles for desulfation of agar[J].International Journal of Biological Macromolecules, 2017, 94:576-584.
[17] SONG Y, WU M X, LIU Z, et al.Quality improvement of agar through desulfation with microorganisms[J].Green Chemistry, 2023, 25 (17):6739-6747.
[18] 宋阳, 刘振, 毛相朝.巨大芽孢杆菌对江蓠植株琼脂直接脱硫工艺的建立及优化[J].食品研究与开发, 2024, 45(2):177-184.SONG Y, LIU Z, MAO X Z.Establishment and optimization of technique for direct desulfation from Gracilaria plant’s agar by Priestia megaterium[J].Food Research and Development, 2024, 45(2):177-184.
[19] MAMAEV D, ZVYAGILSKAYA R.Yarrowia lipolytica:A multitalented yeast species of ecological significance[J].FEMS Yeast Research, 2021, 21(2):foab008.
[20] YE S Y, ZHANG Y H, CHEN J, et al.Synthesis and properties of maleic anhydride-modified agar with reversibly controlled gel strength[J].International Journal of Biological Macromolecules, 2022, 201:364-377.
[21] XIAO Q, YIN X L, AN D, et al.Development of a novel agar extraction method using calcium hydroxide and carbon dioxide[J].Algal Research, 2023, 69:102933.
[22] ZHANG C, AN D, XIAO Q, et al.Convenient agarose preparation with hydrogen peroxide and desulfation process analysis[J].Marine Drugs, 2021, 19(6):297.
[23] YU G H, KUZYAKOV Y.Fenton chemistry and reactive oxygen species in soil:Abiotic mechanisms of biotic processes, controls and consequences for carbon and nutrient cycling[J].Earth-Science Reviews, 2021, 214:103525.
[24] 刘力, 苑全云, 李智恩.低电内渗琼脂糖研究进展[J].海洋科学, 2001, 25(6):31-34.LIU L, YUAN Q Y, LI Z E.Review on low electroendosmosis agarose studies[J].Marine Sciences, 2001, 25(6):31-34.