随着社会经济的发展人们的饮食结构发生了显著变化。传统饮食模式逐渐被高脂肪、高糖、高热量的饮食所取代,导致能量摄入过剩,进而引发一系列代谢紊乱问题,如脂质异常堆积、血脂水平升高、胰岛素抵抗、慢性炎症等代谢异常[1],进而诱导心血管疾病、2型糖尿病以及非酒精性脂肪肝疾病等疾病的病发[2]。脂质过度积累不仅会产生脂毒性的中间产物,引起肝细胞的代谢紊乱,进一步还可导致细胞凋亡坏死[3-4]、肝硬化或癌变[5]。
黄酮类化合物具有抗氧化、抗炎、调节代谢紊乱等功效。桑色素能够通过下调脂肪生成基因的表达,有效缓解脂肪生成[6]。水飞蓟素则通过增强胰高血糖素样肽1的分泌来改善胰岛素抵抗和血脂异常[7],川陈皮素[8]以及橙皮苷[9]也具有改善脂质代谢的作用。槲皮素可以通过激活过氧化物酶体增殖物激活受体α/胆固醇调节元件结合蛋白(peroxisome proliferator-activated receptor α/sterol regulatory element-binding protein, PPARα/SREBP1)信号通路,减少脂肪积累[10],其中PPARα是脂肪酸β氧化的调节因子,在肝脏、棕色脂肪以及肾脏等脂肪酸氧化率高的组织中富集[11],是调节脂质代谢过程中的一个关键靶点。以上研究表明黄酮类化合物在改善脂质代谢方面具有潜在的健康益处。
花旗松素(taxifolin, TAX)又名二氢槲皮素,是一种常见于橄榄油、葡萄、柑橘类水果和洋葱中的二氢黄酮[12]。体外实验证实,TAX对H9C2细胞氧化应激的保护作用[13],能激活小胶质细胞TREM2保护多巴胺神经元损伤[14]。动物实验结果表明,TAX对四氯化碳所致小鼠急性肝损伤具护作用[15],增强高脂肪饮食(high fat diet, HFD)小鼠肝脏中超氧化物歧化酶(superoxide dismutase, SOD)活性,从而保护肝脏免受脂质过氧化损伤[16],同时抑制SREBP1的表达和上调PPARα水平来调节脂质合成[17]。郑今花[18]的研究表明,TAX通过腺苷酸活化蛋白激酶(adenosine monophosphate-activated protein kinase, AMPK)通路抑制脂肪合成同时促进脂肪氧化过程来改善酒精性脂肪肝。以上体内实验证实TAX对脂代谢有调节作用,但是通过构建高脂HepG2细胞验证TAX通过PPARα信号通路对脂代谢的影响目前没有相关的研究。因此本研究通过棕榈酸钠(ammonium palmitate, PA)诱导HepG2细胞构建高脂模型,探讨TAX对脂代谢的作用及其可能机制,为改善脂代谢异常提供理论依据。
1 材料与方法
1.1 材料与试剂
花旗松素(RO94466),上海易恩化学技术有限公司;苏木素染液(G1140)、活性氧(reactive oxygen species, ROS)检测试剂盒(CA1410)、甘油三酯(triglyceride, TG)检测试剂盒(BC0625)、二甲基亚砜(D8371)、CCK8试剂盒(CA1210)、棕榈酸钠(sodium palmitate, PA)(P9830)、北京索莱宝科技有限公司;高糖培养基(C11995500BT),赛默飞世尔科技公司;胎牛血清(fetal bovine aerum, FBS)(P30-3302),德国PAN-Bitech GmbH;SteadyPure快速RNA提取试剂盒(AG21023)、Evo M-MLV反转录预混型试剂盒(AG11728)、SYBR Green Pro Taq HS预混型qPCR试剂盒(AG11701),湖南艾科瑞生物工程有限公司;快速封闭液(PS108P)、一抗稀释液(P0256)、聚偏二氟乙烯膜(FFP32),上海碧云天生物技术股份有限公司;牛血清蛋白(bovine serum albumin, BSA)(MB0094),磷酸盐缓冲液(MA0091)、高效化学发光(ECL)PLUS试剂盒(MA0186)、TBST缓冲液(MA0091)、PAGE凝胶超快速制备试剂盒(MA0382)、蛋白电泳缓冲液(MA0012)、Western快速转膜液(MA0121),大连美仑生物技术有限公司;HRP-山羊抗小鼠IgG(H+L)(BF03001)、HRP-山羊抗兔IgG(H+L)(BF03008)、彩色预染蛋白Marker(BF06198S)、AMPK兔单克隆抗体(RM8273),苏州博奥龙免疫技术有限公司;CD36兔单克隆抗体(BS-1100R),北京博奥森生物技术有限公司;PPARα兔单克隆抗体(340843)、pAMPK兔单克隆抗体(R26252),成都正能生物技术有限责任公司;脂肪酸合酶(fatty acid synthase, FAS)兔单克隆抗体(ET1701-91)、Tubulin(ET1602-4),杭州华安生物技术有限公司;RNA转染试剂RNAFit(HB-RF-1000),上海汉恒生物科技有限公司。
1.2 仪器与设备
A51119700DPC酶标仪、840-317500超微量分光光度仪器,赛默飞生物科技有限公司;1658025电泳仪、1703935电转仪、CFX connect实时荧光定量PCR(real-time quantitative reverse transcription PCR, RT-qPCR)仪、T100 PCR扩增仪,伯乐生命医学产品有限公司;JC-M6多功能成像系统,上海清华科技仪器有限公司;Axio ScoPe.A1荧光倒置显微镜,卡尔蔡司光学科技有限公司。
1.3 实验方法
1.3.1 细胞培养及试验分组
HepG2细胞在37 ℃,5%(体积分数)CO2的细胞培养箱中,采用含有10%(体积分数)FBS以及1%(体积分数)青霉素-链霉素双抗溶液的高糖培养基(dulbecco’s modified eagle medium, DMEN)培养。使用小干扰RNA(small interfering RNA, si RNA)对PPARα进行基因沉默处理后,6~8 h后可以进行后续实验。
细胞同时加入对应浓度PA与TAX处理12 h,测定相应指标。空白对照组(Control):完全培养基(完培);模型(PA组):完培+450 μmol/L PA;低浓度TAX干预组:完培+450 μmol/L PA+50 μmol/L TAX;中浓度TAX干预组:完培+450 μmol/L PA+100 μmol/L TAX;高浓度TAX干预组:完培+450 μmol/L PA+150 μmol/L TAX;空白沉默组:完培+50 mmol/L PPARα siRNA;药物沉默组:完培+50 mmol/L PPARα siRNA+450 μmol/L PA+150 μmol/L TAX。
1.3.2 CCK8法检测细胞活力
细胞铺板于96孔板中,实验药物处理前改用无血清的基础培养基进行饥饿处理,加入含有药物的DMEM处理12 h,每孔加入10 μL的CCK8试剂1 h后测量OD450值。
1.3.3 油红O染色以及TG的测定
参考田高强[19]的方法配制油红O储备液,工作液按3∶2的体积比用蒸馏水进稀释,现配现用。使用4%(体积分数)多聚甲醛固定细胞20 min后,用60%(体积分数)异丙醇浸润15 s,加入油红O工作液染色20 min。苏木素染料复染3~5 min,PBS缓冲液洗去多余染料后在显微镜下观察染色情况。
TG测定按照北京索莱宝科技有限公司TG检测试剂盒说明书操作。
1.3.4 ROS水平
按照试剂盒说明,使用荧光染料H2DCFDA染色来检测细胞内ROS水平。每孔加入500 μL染色液37 ℃孵育20 min,使用荧光显微镜成像。
1.3.5 免疫荧光
细胞经4%(体积分数)多聚甲醛固定后用0.5%(体积分数)Triton X-100处理5 min,用5% BSA封闭细胞,PBS洗涤后-4 ℃加入一抗孵育过夜,更换为二抗孵育1 h后用DAPI溶液标记细胞核,染色10 min,荧光显微镜成像。
1.3.6 RT-qPCR
按照试剂盒说明,使用RNA快速纯化试剂盒提取HepG2细胞的mRNA,测定提取RNA的纯度和浓度并使用Evo M-MLV逆转录预混试剂盒合成cDNA,-20 ℃保存。使用SYBR Green Pro Taq HS qPCR试剂盒对目的基因进行实时定量检测。通过标准化为GAPDH的2-ΔΔCT方法计算相对mRNA表达,引物序列见表1。
表1 引物序列
Table 1 Primers sequence
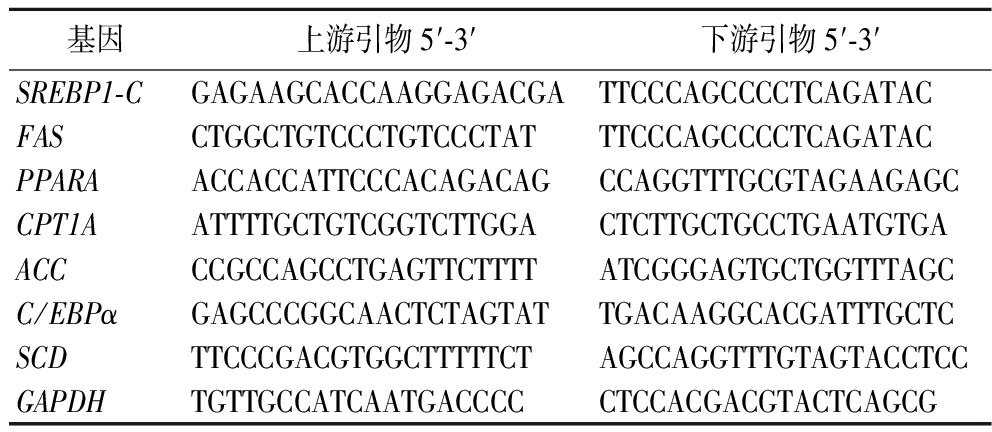
基因上游引物5′-3′下游引物5′-3′SREBP1-CGAGAAGCACCAAGGAGACGATTCCCAGCCCCTCAGATACFASCTGGCTGTCCCTGTCCCTATTTCCCAGCCCCTCAGATACPPARAACCACCATTCCCACAGACAGCCAGGTTTGCGTAGAAGAGCCPT1AATTTTGCTGTCGGTCTTGGACTCTTGCTGCCTGAATGTGAACCCCGCCAGCCTGAGTTCTTTTATCGGGAGTGCTGGTTTAGCC/EBPαGAGCCCGGCAACTCTAGTATTGACAAGGCACGATTTGCTCSCDTTCCCGACGTGGCTTTTTCTAGCCAGGTTTGTAGTACCTCCGAPDHTGTTGCCATCAATGACCCCCTCCACGACGTACTCAGCG
1.3.7 蛋白免疫印迹
用RIPA裂解液提取细胞蛋白,测定蛋白浓度后进行蛋白变性处理,用10% SDS聚丙烯酰胺凝胶电泳分离,转移至PVDF膜上。快速封闭液处理15 min后加入用一抗-4 ℃孵育过夜。二抗孵育1 h后,使用成像仪显影,并通过Image J软件对光密度进行定量分析。
1.4 数据分析
实验重复3次,结果采用“平均值±标准差”,用GraphPad Prism软件统计分析并作图,采用单因素方差分析(one-way ANOVA)和Turkey’s多重比较检验。
2 结果与分析
2.1 不同浓度PA或TAX对HepG2细胞活力的影响
为选择建立HepG2细胞脂代谢异常模型的最佳浓度,用不同浓度的PA(0、150、300、450、600、750、1 050 μmol/L)处理HepG2细胞12 h,并使用CCK8试剂盒进行细胞活力检测,结果如图1-A所示。与对照组相比,较低浓度的PA会促进细胞生长,随着PA浓度的增加,逐渐呈现出抑制效果,750 μmol/L时HepG2细胞的活性已经下降至53.93%。当PA为300~450 μmol/L时,细胞仍然保持较高的活力。
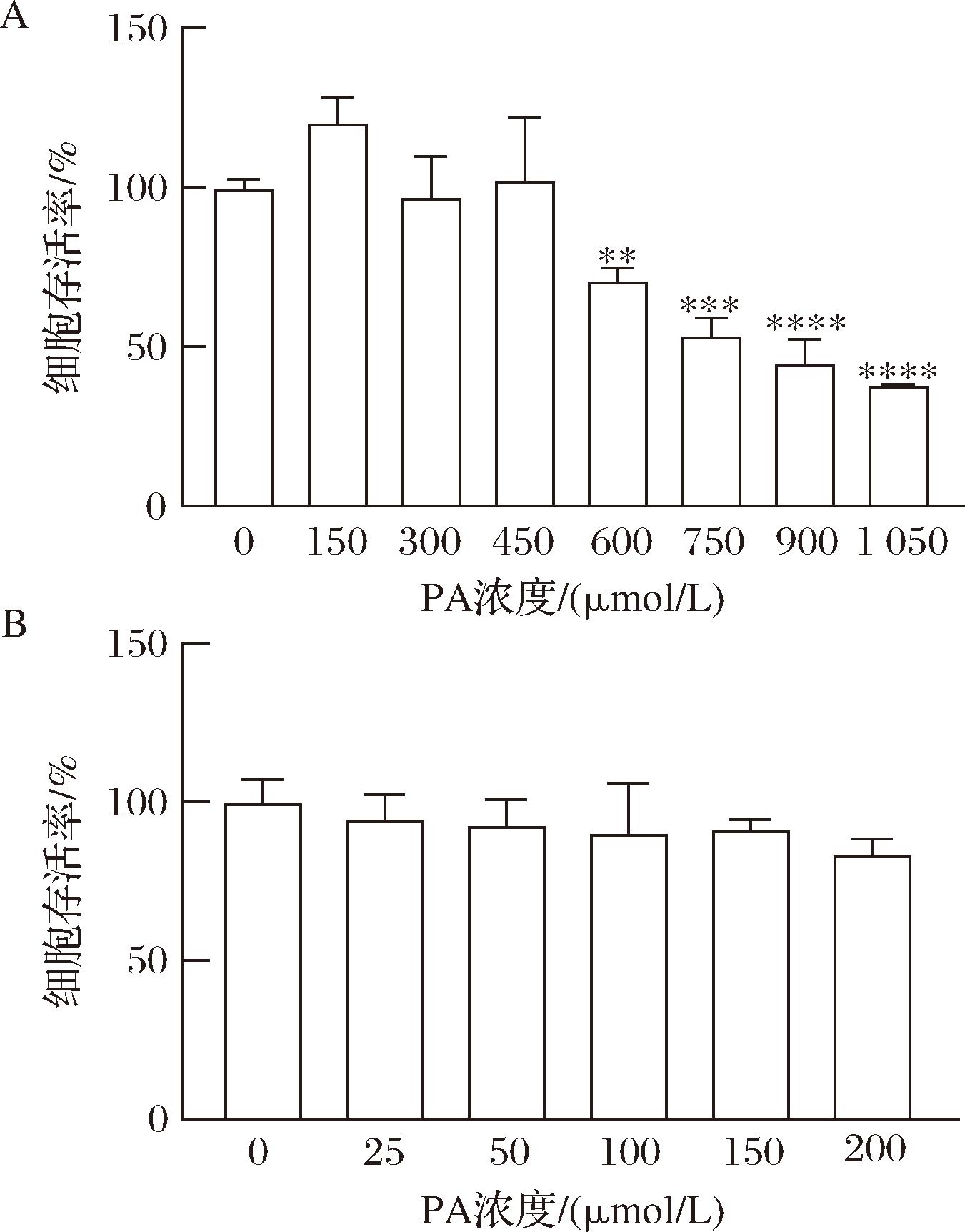
A-PA对细胞活力的影响;B-TAX对细胞活力的影响
图1 不同浓度PA或TAX对HepG2细胞活力的影响
Fig.1 Effects of different concentrations of PA or TAX on HepG2 cell viability
注:与对照组相比,**P< 0.01,***P<0.001,****P<0.000 1(下同)。
为选出合适的TAX对脂代谢紊乱模型进行干预,采用了不同浓度的TAX(0、25、50、100、150、200 μmol/L)处理HepG2细胞24 h,结果如图1-B所示,所有浓度的TAX对细胞的活性影响均较小。说明在200 μmol/L浓度以下时,TAX对细胞基本无毒性。
2.2 不同浓度PA及TAX处理对HepG2细胞油红O染色及TG的影响
为进一步验证脂代谢异常模型是否构建成功,分别用0、150、300、450、600、750 μmol/L的PA处理细胞12 h后,进行油红O染色。如图2-A所示,在不添加TAX组中,无明显脂滴堆积,随着PA添加浓度的增大,细胞形态更加圆润,脂滴开始出现且数量与PA浓度呈正相关。当PA浓度高于600 μmol/L时,脂滴明显增加,细胞数量与低浓度相比也更少,这一结果与上述CCK-8的试验结果趋势一致,从而验证了模型建立成功。

A-不同浓度PA处理细胞油红O染色效果(200×);B-TAX对PA诱导HepG2细胞油红O染色效果(200×);C-不同浓度TAX对PA处理后细胞中TG含量的影响
图2 不同浓度PA和TAX对HepG2细胞脂质积累的影响
Fig.2 Effects of different concentrations of PA and TAX on lipid accumulation in HepG2 cells
注:TG的含量表示为相对含量,即各个实验组组测定所得的TG含量与对照组的TG含量的比值;与对照组相比,*P<0.05;与PA组相比,##P<0.01;—代表未添加(下同)。
固定PA对细胞的作用浓度为450 μmol/L,研究TAX添加浓度(0、50、100、150 μmol/L)对细胞脂质积累的影响。如图2-B所示,与对照组相比,PA处理细胞明显增加了细胞中脂滴(红色)的分布。添加TAX后能有效改善脂滴的积累。同时由图2-C可知,PA处理显著增加了细胞中TG的含量,TAX可以有效降低细胞中TG的含量,其中150 μmol/L浓度时效果最好,降低了50.62%,表明TAX对PA引起的细胞脂质积累具有缓解效果。
2.3 TAX对PA处理HepG2细胞脂ROS的影响
如图3所示,与对照组相比,PA处理的细胞中细胞内ROS水平显著升高。相反,添加50、100、150 μmol/L的TAX显著降低了PA处理后细胞中ROS水平,分别降低了130.49%、176.71%、189.96%。这表明TAX可以抑制PA处理的细胞中ROS的产生,并且呈现浓度依赖性。
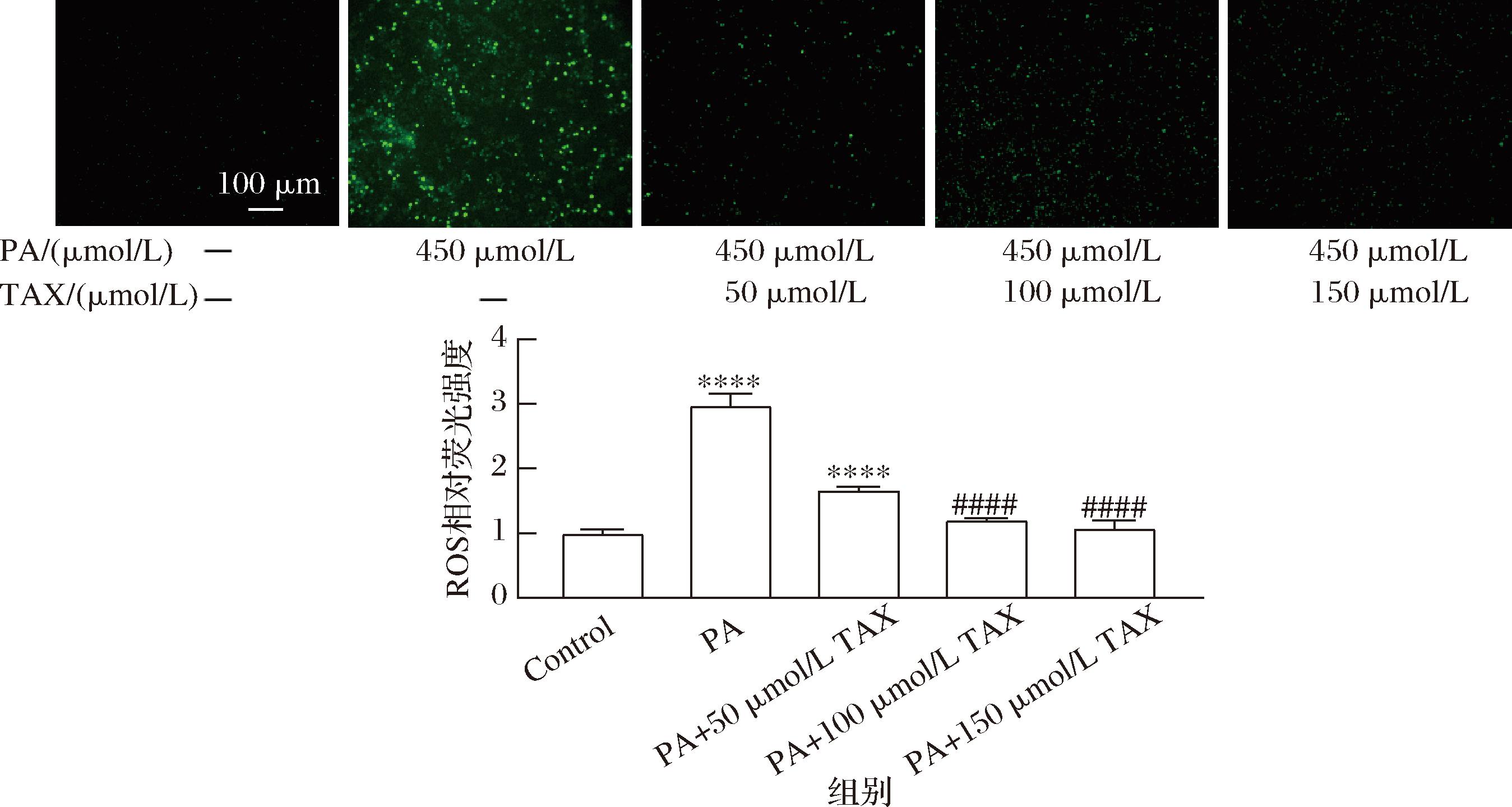
图3 不同浓度TAX对PA处理后细胞ROS的影响(200×)
Fig.3 Effects of different concentrations of TAX on ROS in cells treated with PA (200×)
注:ROS的含量表示为相对荧光强度,即各个实验组测定所得的ROS荧光强度与对照组的ROS荧光强度的比值;较对照组,****P<0.000 1;较PA组####P小于0.000 1(下同)。
2.4 TAX对PA处理HepG2细胞FAS、PPARα免疫荧光的影响
为探究TAX调节脂代谢的机制,通过免疫荧光对FAS和PPARα进行了检测。结果如图4所示,PA处理使得FAS的荧光强度增加了55.40%,PPARα的荧光强度降低了37.41%。

A-PPARα免疫荧光蛋白染色代表性图(200×);B-PPARα免疫荧光蛋白染色分析;C-FAS免疫荧光蛋白染色代表性图;D-FAS免疫荧光蛋白染色分析
图4 TAX对PA处理HepG2细胞FAS、PPARα免疫荧光的影响
Fig.4 The influence of TAX on the immunofluorescence of FAS and PPARα in HepG2 cells treated by PA
注:Merge表示各组所有发光颜色的组合,图DAPI代表核荧光染色(蓝色);FAS代表蛋白质FAS荧光染色(绿色);较PA组,##表示P<0.01(下同)。
而TAX处理可以有效缓解这一趋势,其中150 μmol/L的效果最显著,FAS降低了36.61%,PPARα增加了44.74%。
2.5 TAX对PA处理HepG2细胞脂代谢相关因子基因表达的影响
基于以上实验结果,中高浓度的效果要优于低浓度,故后续试验选择100、150 μmol/L 2个添加浓度验证TAX对脂代谢相关因子基因表达的影响。由图5可知,50 μmol/L和100 μmol/L PA处理会导致PPARα的mRNA表达下调,A羧化酶(acetyl-coA carboxylase, ACC)、硬脂酰辅酶A去饱和酶(stearoyl-coA desaturase, SCD)、CCAAT增强子结合蛋白α(CCAAT enhancer binding protein α, C/EBP-α)、SREBP-1C、PPARα的mRNA表达增加,TAX可以有效减缓这一趋势。其中,PPARα的表达分别上调了61.10%和101.80%,SREBP1C的表达分别下调了10.27%和19.22%,ACC分别下调了78.41%和74.21%,C/EBPα分别下调94.76%和80.72%,SCD分别下调65.70%和116.44%。这些结果表明,对于PA诱导的HepG2细胞脂质积累,TAX处理可通过激活脂质氧化相关调节因子PPARα来缓解脂质积累,同时抑制脂质合成相关调节因子来进一步发挥功效。
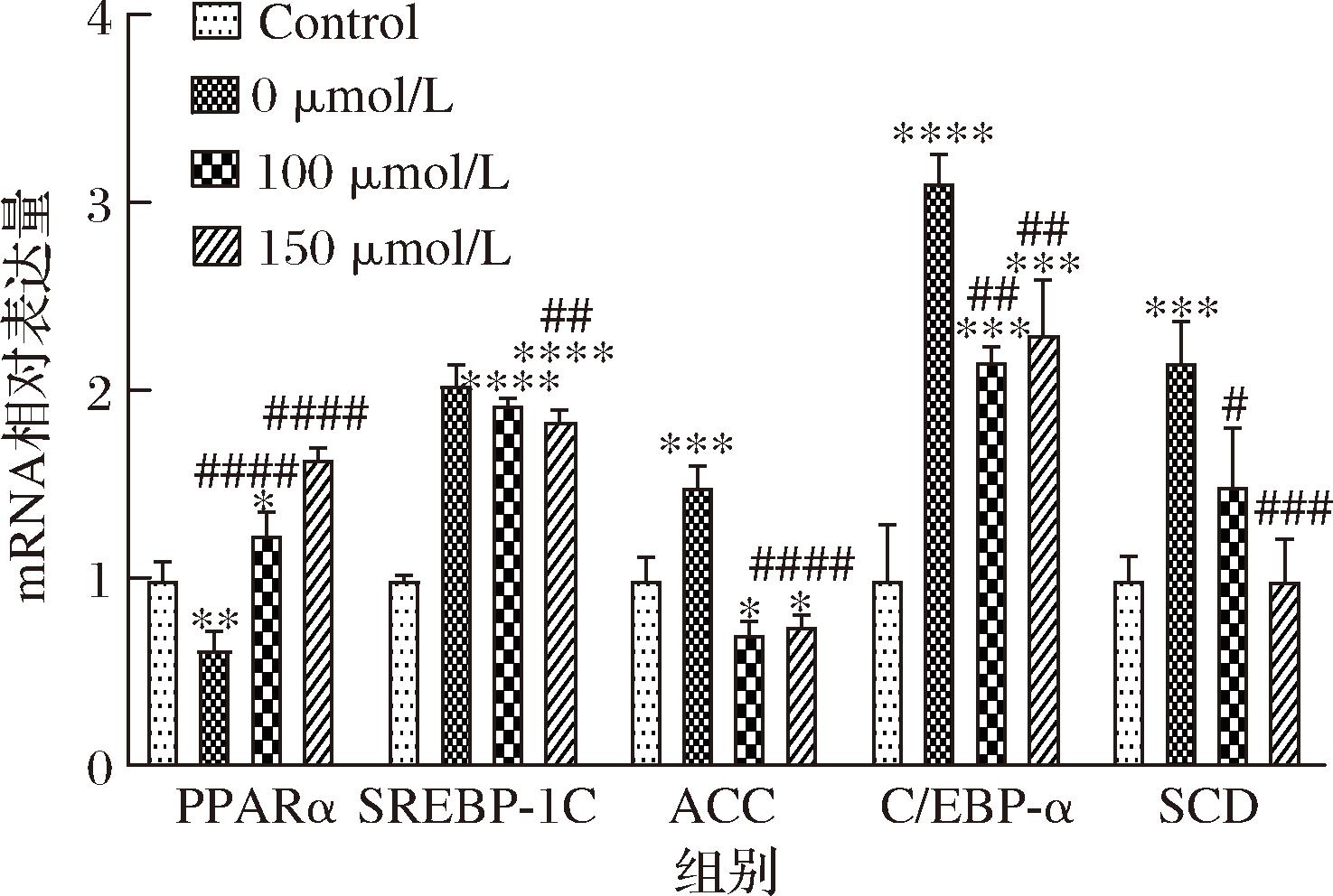
图5 TAX对PA处理HepG2细胞脂肪生成及分解因子的mRNA水平的影响
Fig.5 Effect of TAX on mRNA levels of lipogenesis and decomposition factors in HepG2 cells treated by PA
注:较PA组,#表示P<0.05,###表示P<0.001(下同)。
2.6 TAX对PA处理HepG2细胞脂代谢因子相关蛋白的影响
蛋白免疫印迹(Western blot, WB)结果显示,与仅PA处理的模型组相比,100 μmol/L和150 μmol/L TAX处理后FAS的表达下调了27.10%和60.22%,血小板糖蛋白Ⅳ(thrombospondin receptor, CD36)的表达下调了80.08%和42.99%。AMPK的磷酸化比值上调了21.02%和16.93%,PPARα的表达上调12.41%和12.31%(图6)。

A-FAS、CD36、p-AMPK/AMPK、PPARα和Tubulin WB代表性图片;B-FAS、CD36、p-AMPK/AMPK、PPARα和Tubulin WB量化图
图6 TAX对PA处理HepG2细胞中脂肪生成和分解因子L蛋白表达的影响
Fig.6 Effect of TAX on the expression of lipogenic and decomposing factor proteins in HepG2 cells treated by PA
2.7 沉默PPARα处理验证TAX对HepG2细胞脂代谢相关基因的影响
为了进一步验证TAX影响脂质代谢的作用机制,通过si RNA对PPARα进行基因沉默处理,图7显示,在PPARα siRNA处理后,PPARα的表达明显受到抑制,表达量较对照组下降了77.06%,说明小干扰RNA成功沉默了PPARα。同时可以发现沉默处理后,TAX处理仍然会引起PPARα表达量上调,但由原来对照组的137.77%降低为50.03%(P<0.000 1)。沉默处理对FAS的影响相对较小,TAX组和沉默组表达量相差33.8%(P<0.05)。
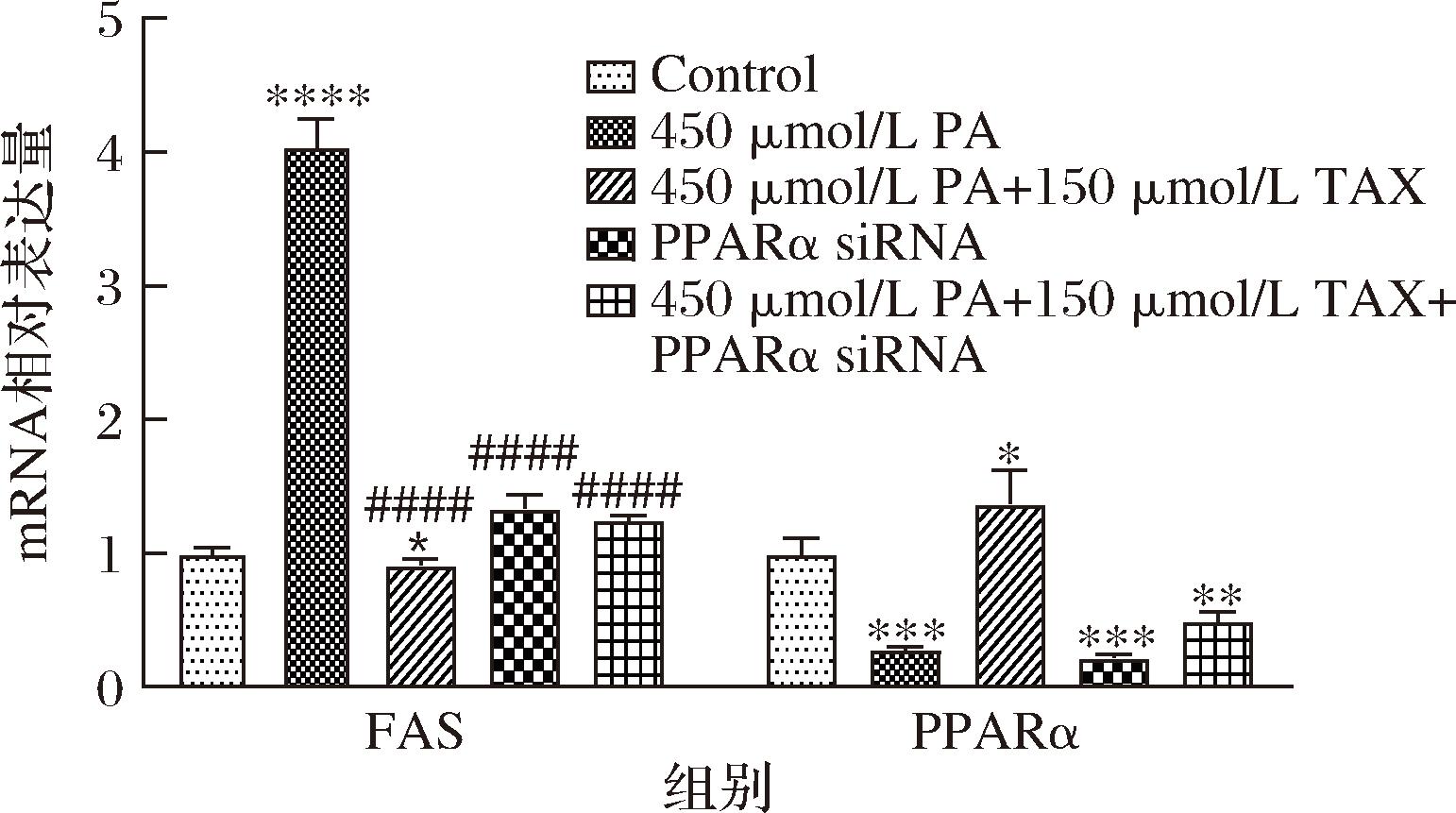
图7 PPARα siRNA处理验证TAX对HepG2细胞脂肪生成及分解因子mRNA水平的影响
Fig.7 PPARα siRNA treatment verified the effects of TAXD on mRNA levels of lipogenesis and decomposing factors in HepG2 cells
2.8 沉默PPARα处理验证TAX对HepG2细胞脂代谢相关蛋白的影响
由图7-A和图7-B免疫荧光的结果显示,PA处理会导致PPARα的表达下降,TAX可以改善这一趋势。与对照组相比,沉默处理会导致PPARα的水平下降21.83%,同时减弱TAX的改善效果,荧光强度从90.46%降至86.15%。蛋白免疫印迹的结果也显示出相同的趋势,如图8-C和图8-D所示,沉默处理会导致HepG2细胞中PPARα表达下调26.61%,药物组的表达量也从103.00%降低至76.82%;FAS的表达量在沉默后降低91.55%。

A-PPARα免疫荧光蛋白染色代表性图(200×);B-PPARα免疫荧光蛋白染色分析;C-FAS、PPARα和Tubulin WB代表性图;D-WB分析
图8 PPARα siRNA处理验证TAX对脂肪生成和分解基因蛋白表达的影响
Fig.8 PPARα siRNA treatment verified the effect of TAX on the expression of lipogenesis and decomposition gene protein
3 结论
过量的能量摄入会诱发肥胖、糖尿病等慢性代谢疾病,是影响人类健康的重要因素[20]。肝脏中过量脂质堆积导致肝脏脂肪变性,同时会引起脂毒性、氧化应激、内质网应激和炎症反应等[21]。多种黄酮类化合物被证明具有护肝以及改善脂代谢紊乱的作用,可通过AMPK、PPAR、SREBP1-C、CEBPα、FAS等信号通路影响胆固醇代谢,进而抑制脂质吸收[22]。柚皮苷可显著改善HFD小鼠肝脏内的脂质蓄积,转录组测序KEGG富集分析显示其可能影响了相关基因的表达,从而减少了脂质摄取、合成,加快脂质氧化[23]。金合欢多酚通过上调PPARα的mRNA表达,降低了HFD小鼠的血糖含量和胰岛素水平,从而抑制了HFD饮食引起的肥胖的发生[24]。儿茶素通过活化AMPK从而抑制PPARα的表达,最终导致下游的脂质合成相关因子的表达下调[25]。TAX现有的研究大多集中其抗氧化以及抗炎功效方面,如KHADRAWY等[26]发现TAX可通过降低氧化应激、炎症和调节凋亡基因和蛋白来减轻肝损伤。苏其利等[27]发现TAX可能介导Nrf2/HO-1/HIF1α/Autophagy信号通路促进自噬及抗氧化应激,从而发挥心肌保护作用。TAX与脂代谢相关的研究相对较少,WANG等[28]检测到TAX可以通过改善HFD小鼠肠道微生物群落来潜在地改善脂质代谢异常。MURAMATSU等[29]使用富含TAX的落叶松提取物处理脂肪细胞,能降低ROS含量,抑制了细胞中的脂质积累。SU等[16]的研究表明TAX可以减少高脂肥胖小鼠体重以及肝脏脂质堆积,增强小鼠体内的抗氧化酶活性,减少脂质过氧化损伤。因此本文进一步通过高脂细胞在分子机制层面验证TAX改善PA引起的脂代谢紊乱的作用机制。
PPARα是脂质分解代谢中最关键的调节因子之一,PPARα激活后,多种参与脂质代谢的酶相关基因都会上调,从而促进脂肪的β氧化[30]。在NAFLD小鼠中,促脂肪生成的SREBP-1C/FAS通路活性显著增加,抑制其活性能够有效防止肝脂肪发生变性[31]。充分证实了抑制PPARα/SREBP-1C/FAS通路能够减缓肝脏脂质合成。AMPK是一种参与脂代谢的重要能量传感器。激活AMPK可以抑制脂代谢异常[32],可以增强PPARα的活性,进而促使脂肪氧化,减少TG的合成。
本研究显示,PA浓度在450 μmol/L以下时,对细胞的毒性可以忽略不计,TAX则在200 μmol/L以下无明显细胞毒害作用,该范围与王瑞娟等[33]以及李亚菊等[34]的结果基本相同。油红O染色结果显示450 μmol/L的浓度能明显产生脂质堆积,这与CUI等[35]实验所用浓度相似。油红O染色以及TG测定的结果表明,TAX呈浓度依赖的方式有效缓解PA引起的脂质积累,150 μmol/L时效果最显著,同时减少细胞中ROS的含量,缓解脂质过氧化带来的损伤,预防脂肪变性导致的炎症,TG的结果验证了这一点。TAX降低促进脂质合成的酶相关因子ACC、SCD、C/EBPα、SREBP-1C的mRNA的表达,上调了PPARα的表达。同时免疫荧光以及WB结果显示,在TAX处理后FAS的表达受到了明显抑制,增加了PPARα的蛋白表达。WB结果显示,PA处理后脂代谢发生紊乱,AMPK磷酸化受到抑制,促进脂质摄入和合成的CD36表达增加,TAX能够有效改善这一趋势。为进一步探讨TAX改善脂质代谢的作用机制,对PPARα进行沉默处理,发现PPARα在沉默后在蛋白以及基因水平的表达均显著下降,同时抑制了TAX介导PPARα影响脂代谢的作用,说明TAX通过PPARα对脂代谢进行干预。而FAS在沉默处理后反而也出现了表达下调,可能是RRARα siRNA使脂质氧化进程受到抑制,导致脂质代谢紊乱,负调控机制使细胞下调了FAS的表达以期缓解脂代谢紊乱,或是其他信号通路的活性变化对FAS的表达产生了调控作用。
本研究深入探讨了TAX对脂代谢紊乱的改善作用及其分子机制。TAX能够有效缓解由PA诱导的脂质积累,其作用机制主要通过激活PPARα信号通路,进而促进脂肪酸的β氧化,抑制脂质合成相关因子的表达。此外,TAX还通过调节AMPK信号通路,增强细胞的抗氧化能力,减少脂质过氧化损伤,从而发挥对脂代谢的保护作用。这些发现不仅为TAX作为潜在的治疗脂代谢紊乱的药物提供了科学依据,也为进一步开发黄酮类化合物在代谢性疾病治疗中的应用奠定了基础。未来的研究可以进一步探索TAX与其他信号通路的相互作用,以及其在不同代谢紊乱模型中的应用潜力,以期为临床治疗提供更有效的策略。
[1] PAN X F, WANG L M, PAN A.Epidemiology and determinants of obesity in China[J].The Lancet Diabetes &Endocrinology, 2021, 9(6):373-392.
[2] CHEN M, GUO W L, LI Q Y, et al.The protective mechanism of Lactobacillus plantarum FZU3013 against non-alcoholic fatty liver associated with hyperlipidemia in mice fed a high-fat diet[J].Food &Function, 2020, 11(4):3316-3331.
[3] SAMUEL V T, SHULMAN G I.Mechanisms for insulin resistance:Common threads and missing links[J].Cell, 2012, 148(5):852-871.
[4] PERRY R J, SAMUEL V T, PETERSEN K F, et al.The role of hepatic lipids in hepatic insulin resistance and type 2 diabetes[J].Nature, 2014, 510(7503):84-91.
[5] LIU W S, BAKER R D, BHATIA T, et al.Pathogenesis of nonalcoholic steatohepatitis[J].Cellular and Molecular Life Sciences, 2016, 73(10):1969-1987.
[6] VENKATEISH P V, RAJAMANIKANDAN S, PERUMAL M K.Morin inhibits the activity of pancreatic lipase and adipogenesis[J].European Journal of Pharmacology, 2024, 977:176705.
[7] CHANG K J, LIN J A, CHEN S Y, et al.Silymarin protects against high fat diet-evoked metabolic injury by induction of glucagon-like peptide 1 and sirtuin 1[J].Journal of Functional Foods, 2019, 56:136-144.
[8] MORROW N M, TRZASKALSKI N A, HANSON A A, et al.Nobiletin prevents high-fat diet-induced dysregulation of intestinal lipid metabolism and attenuates postprandial lipemia[J].Arteriosclerosis, Thrombosis, and Vascular Biology, 2022, 42(2):127-144.
[9] XIAO Y C, SU D L, HU X, et al.Neohesperidin dihydrochalcone ameliorates high-fat diet-induced glycolipid metabolism disorder in rats[J].Journal of Agricultural and Food Chemistry, 2022, 70(30):9421-9431.
[10] 乔舒, 杨佳敏, 张富强, 等.槲皮素联合Plin1基因敲除对MAFLD模型小鼠脂代谢的影响[J].营养学报, 2024, 46(6):592-598.QIAO S, YANG J M, ZHANG F Q, et al.Effects of quercetin combined with plin1 gene knockout on lipid metabolism in mafld mice[J].Acta Nutrimenta Sinica, 2024, 46(6):592-598.
[11] PAWLAK M, LEFEBVRE P, STAELS B.Molecular mechanism of PPARα action and its impact on lipid metabolism, inflammation and fibrosis in non-alcoholic fatty liver disease[J].Journal of Hepatology, 2015, 62(3):720-733.
[12] MIN H Y, JANG H J, PARK K H, et al.The natural compound gracillin exerts potent antitumor activity by targeting mitochondrial complex Ⅱ[J].Cell Death &Disease, 2019, 10:810.
[13] 曾志辉, 王晓莉, 叶艳琼, 等.花旗松素对H9C2细胞氧化应激保护作用机制研究[J].中国全科医学, 2019, 22(15):1794-1799.ZENG Z H, WANG X L, YE Y Q, et al.Oxidative stress protection mechanism of taxifolin in H9C2 cells[J].Chinese General Practice, 2019, 22(15):1794-1799.
[14] 杨熔. 二氢槲皮素激活小胶质细胞TREM2保护6-OHDA诱导的多巴胺神经元损伤[D].贵阳:遵义医科大学, 2023.YANG R.Dihydroquercetin alleviates dopamine neuron loss via regulating microglial TREM2 activati[D].Guiyang:Zunyi Medical University, 2023.
[15] YANG C L, LIN Y S, LIU K F, et al.Hepatoprotective mechanisms of taxifolin on carbon tetrachloride-induced acute liver injury in mice[J].Nutrients, 2019, 11(11):2655.
[16] SU H, WANG W J, ZHENG G D, et al.The anti-obesity and gut microbiota modulating effects of taxifolin in C57BL/6 J mice fed with a high-fat diet[J].Journal of the Science of Food and Agriculture, 2022, 102(4):1598-1608.
[17] ZHAN Z Y, WU M, SHANG Y, et al.Taxifolin ameliorate high-fat-diet feeding plus acute ethanol binge-induced steatohepatitis through inhibiting inflammatory caspase-1-dependent pyroptosis[J].Food &Function, 2021, 12(1):362-372.
[18] 郑今花. 二氢槲皮素基于NLRP3炎症小体通路调控酒精性脂肪肝与炎症的机制研究[D].延吉:延边大学, 2017.ZHENG J H.Dihydroquercetin alleviates alcoholic fatty liver and inflammation via inhibition of NLRP3 inflammasome[D].Yanji:Yanbian University, 2017.
[19] 田高强. 类固醇激素对昆明小鼠宫颈和宫体细胞脂滴形成的影响[D].泰安:山东农业大学, 2015.TIAN G Q.The effects of steroid hormones on the formation of lipid droplets in cervical and uterus body cells of kunming mice[D].Taian:Shandong Agricultural University, 2015.
[20] 董洪旺, 綦文涛, 彭文婷,等.谷物膳食纤维通过肠道菌群-胆汁酸途径调控糖脂代谢的研究进展[J].粮油食品科技, 2025, 33(1):129-137.DONG H W, QI W T,PENG W T, et al.Research advances in the role of cereal dietary fiber in modulating glucose and lipid metabolism via the gut microbiota-bile acid[J].Science and Technology of Cereals, Oils and Foods, 2025,33(1):129-137.
[21] FRIEDMAN S L, NEUSCHWANDER-TETRI B A, RINELLA M, et al.Mechanisms of NAFLD development and therapeutic strategies[J].Nature Medicine, 2018, 24(7):908-922.
[22] 张子微, 段子渊, 程卯生.多酚类化合物对脂代谢的影响[J].中国食品工业, 2024(14):87-89.ZHANG Z W, DUAN Z Y, CHENG M S.Effects of polyphenols on lipid metabolism[J].China Food Industry, 2024(14):87-89.
[23] 贾纪会, 张译之, 林静, 等.柚皮苷调节NAFLD小鼠脂代谢紊乱机制研究[J].实用肝脏病杂志, 2024, 27(6):816-819.JIA J H, ZHANG Y Z, LIN J, et al.Down-regulation of hepatic SREBP1 and PPAR-α expression by naringin in mice with high-fat diet-induced NAFLD[J].Journal of Practical Hepatology, 2024, 27(6):816-819.
[24] IKARASHI N, TODA T, OKANIWA T, et al. Anti-obesity and anti-diabetic effects of Acacia polyphenol in obese diabetic KKAy mice fed high-fat diet[J]. Evidence-Based Complementary and Alternative Medicine, 2011, 2011:952031.
[25] 李芳. EGCG减脂作用及其机理研究[D].长春:吉林大学, 2017.LI F.The molecular mechanism of EGCG on weight losing[D].Changchun:Jilin University, 2017.
[26] KHADRAWY S M, ALTOOM N G, ALOTAIBI A G, et al.Hepatoprotective potential of taxifolin in type 2 diabetic rats:Modulation of oxidative stress and Bcl2/Bax/Caspase-3 signaling pathway[J].Molecular Biology Reports, 2024, 51(1):897.
[27] 苏其利, 王晓莉, 谭小华, 等.花旗松素通过激活Nrf2/HO-1/HIF1α/Autophagy信号通路对H2O2所致H9C2细胞氧化应激保护作用的研究[J].生命科学研究, 2017, 21(3):233-238.SU Q L, WANG X L, TAN X H, et al.Taxifolin protects H2O2 -induced myocardial oxidative stress via activation of Nrf2/HO-1/HIF1α/autophagy pathway in H9C2 cells[J].Life Science Research, 2017, 21(3):233-238.
[28] WANG M Y, HAN H, WAN F, et al. Dihydroquercetin supplementation improved hepatic lipid dysmetabolism mediated by gut microbiota in high-fat diet (HFD)-fed mice[J]. Nutrients, 2022, 14(24):5214.
[29] MURAMATSU D, UCHIYAMA H, KIDA H, et al.In vitro anti-inflammatory and anti-lipid accumulation properties of taxifolin-rich extract from the Japanese larch, Larix kaempferi[J].Heliyon, 2020, 6(12):e05505.
[30] 陈森, 高敏, 杨佳雯, 等.饲料EPA和ALA激活PPARα在吉富罗非鱼脂代谢中的降脂作用[J].水产学报, 2024, 48(9):24-37.CHEN S, GAO M, YANG J W, et al.Lipid-lowering effect of PPARα activated by feed EPA and ALA in GIFT Oreochromis niloticus[J].Journal of Fisheries of China, 2024, 48(9):24-37.
[31] JIAO Y, ZHAO J J, ZHANG Z J, et al.SRY-Box containing gene 4 promotes liver steatosis by upregulation of SREBP-1c[J].Diabetes, 2018, 67(11):2227-2238.
[32] LI Y P, LIU Y, CHEN Z W, et al.Protopanaxadiol ameliorates NAFLD by regulating hepatocyte lipid metabolism through AMPK/SIRT1 signaling pathway[J].Biomedicine &Pharmacotherapy, 2023, 160:114319.
[33] 王瑞娟, 李超, 段丽娟, 等.花旗松素调节MCP-1/CCR2轴对急性淋巴细胞白血病细胞恶性进展的影响[J].现代肿瘤医学, 2024, 32(5):799-804.WANG R J, LI C, DUAN L J, et al.Impact of taxifolin on the malignant progression of acute Lymphoblastic leukemia cells by regulating the MCP-1/CCR2 axis[J].Journal of Modern Oncology, 2024, 32(5):799-804.
[34] 李亚菊, 郭闪, 魏飞力.花旗松素对转化生长因子β1诱导肝星状细胞的激活作用及基因表达谱分析[J].中国肝脏病杂志, 2023, 15(3):34-42.LI Y J, GUO S, WEI F L.Effect of taxifolin on transforming growth factor-β1 induced hepatic stellate cell activation and gene expression profile analysis[J].Chinese Journal of Liver Diseases, 2023, 15(3):34-42.
[35] CUI W Y, XU B, CHEN F C, et al.Effects of grape peel phenolics on lipid accumulation in sodium palmitate-treated HepG2 cells[J].Journal of Functional Foods, 2024:112:105923.