据世界卫生组织报道,全世界15岁及以上的人群中,超过一半的人年均饮酒超过1次。中国人均纯酒精消费量从2005年的4.1 L上涨到了2016年的7.2 L。在全球层面上,每年大约有300万人死于酒精摄入过量,酒精已攀升为第七大致死因素。过量饮酒不仅会引起许多健康问题,同样是交通事故、暴力、犯罪等社会问题的一大诱因[1]。酒精的体内分解主要依赖于肝脏内乙醇脱氢酶(alcohol dehydrogenase,ADH)氧化为乙醛,然后再由乙醛脱氢酶(aldehyde dehydrogenase,ALDH)转化为乙酸盐[2]。此外,细胞色素P4502E1(CYP2E1)在氧气和NADPH存在下将酒精代谢为乙醛,是酒精氧化的另一种次要途径。乙醛通过与蛋白质结合,导致线粒体微管结构和功能改变,包括通过呼吸链产生ATP减少、活性氧(reactive oxygen species,ROS)的产生和ALDH活性降低等。活性氧可以直接作用于DNA,对其造成损坏,并导致脂质过氧化,形成丙二醛等有害的脂质过氧化产物,线粒体受损导致分解脂肪酸的功能下降,脂肪酸在体内堆积,酯化成甘油三酯,最终导致脂肪肝的形成[3]。脂肪肝进一步发展,会演变为酒精性肝炎和肝纤维化,最终导致肝硬化和肝癌。目前,酒精性肝病(alcoholic liver disease,ALD)因其高病发率和高死亡率已成为世界第二大肝脏疾病[4]。因此,深入研究和寻求安全且有效的相关抗酒精性肝损伤产品,对于积极预防和治疗ALD具有重要的研究意义和广阔的应用前景。
目前,针对ALD的有效治疗方法主要有戒酒、药物治疗、营养治疗以及联合治疗等。营养治疗依赖于天然活性成分,具有温和不刺激、毒副作用小、安全性高等独特优势[5]。当前,国内外天然提取物中的护肝有效活性成分大体上可以分为两大类:植物天然组分和动植物活性多肽。从植物中提取出具有明确的保肝效果的成分有葛根素和水飞蓟宾等,主要通过提高ADH激活率和增加机体抗氧化能力来达到解酒护肝的作用[6-7]。而生物活性肽如玉米肽[8]、鸡肉肽[9]和东海乌参肽[10]等一般通过多种途径协同减少肝损伤,如通过提高乙醇代谢酶系ADH和ALDH的活性、提高体内多种抗氧化酶含量来清除酒精代谢产生的过剩自由基、与酒精代谢过程中产生的醛类结合而减少对肝脏的损伤等。小分子活性肽常以完整的形态被小肠直接吸收进入血液循环,因此具有见效快的优势。不过,并不是所有的肽类都有效,它们的活性很大程度上依赖于原料中的蛋白含量及其类型。动物蛋白源氨基酸组成全面、比例结构合理、生物利用度高,从原料角度评价,动物蛋白源具备诸多优势,特别是源自深海且无污染的动物蛋白源产品[11-12]。海洋生物因资源种类繁多、数量众多且生存在低温高盐等极端环境中,从中提取的活性肽在氨基酸组合和排列上有着显著的特异性,从而让海洋生物提取的活性肽拥有了其独有的生物学优势。目前海洋生物活性肽已被证实具有抗氧化、抗菌、抗癌和降压等功能,但是在解酒护肝的作用研究上还不够深入[13]。
因此,本实验通过文献调研选择了8种海洋生物:海参[14]、牡蛎[15]、麻虾[16]、鱿鱼[17]、虾胰扇贝[18]、三角帆蚌[19]、海蜇[20]、沙丁鱼[21]。其中,从海参、鱿鱼、虾夷扇贝和三角帆蚌中提取的活性肽具有一定的解酒护肝功效,而从牡蛎、麻虾、海蜇和沙丁鱼中提取的活性肽则具有抗氧化作用,即潜在的解酒护肝活性。选择了7种常用的商业蛋白酶:碱性蛋白酶、中性蛋白酶、风味蛋白酶、胃蛋白酶、胰蛋白酶、木瓜蛋白酶和菠萝蛋白酶,其中风味蛋白酶为外切酶,其余则为内切酶。为了探究这8种海洋生物的解酒护肝活性与最优的酶组合,通过双酶分步酶解,充分水解海洋生物,从而得到336种小分子活性肽混合物。以氨基酸组成、分子质量分布和胃肠道消化稳定性为指标筛选出综合效果最好的酶解物,并通过动物实验验证其解酒护肝效果。
1 材料与方法
1.1 材料
1.1.1 实验原料
海参(Stichopus japonicus),产自山东日照;牡蛎(Ostreidae),产自广东湛江;麻虾(Metapenaeus affinis),产自广东茂名;鱿鱼(Teuthida),产自山东威海;虾胰扇贝(Patinopecten yessoensis),产自辽宁大连;三角帆蚌(Hyriopsis cumingii),产自湖南常德;海蜇(Rhopilema esculentum),产自辽宁大连;沙丁鱼(Sardina pilchardus),产自山东青岛。以上8种原料取肉后储存于-20 ℃备用。海王金樽片,深圳海王集团股份有限公司;红星二锅头(56%vol),北京红星股份有限公司;酒精液体饲料,南通特洛菲饲料科技有限公司。
1.1.2 实验试剂
碱性蛋白酶(200 U/mg)、中性蛋白酶(100 U/mg)、胃蛋白酶(15 U/mg)、胰蛋白酶(250 U/mg)、木瓜蛋白酶(800 U/mg)、风味蛋白酶(20 U/mg)、菠萝蛋白酶(300 U/mg),上海源叶生物科技有限公司;Pierce BCA蛋白检测试剂盒,赛默飞世尔科技(中国)有限公司;乙醇脱氢酶,美国Sigma公司;谷丙转氨酶(alanine aminotransferase,ALT)试剂盒、谷草转氨酶(aspartate aminotransferase,AST)试剂盒、甘油三酯(triglyceride,TG)测定试剂盒、总胆固醇(total cholesterol,TC)测定试剂盒、ADH测试盒、ALDH测试盒、过氧化物歧化酶(superoxide dismutase,SOD)活性检测试剂盒、谷胱甘肽(glutathione,GSH)测定试剂盒,南京建成生物工程研究所;丙二醛(malondialdehyde,MDA)检测试剂盒,上海碧云天生物科技有限公司;17种氨基酸标准品、5种分子质量标准品,美国Sigma公司。
1.1.3 仪器与设备
T-25型高速分散均质机,艾卡(中国)仪器设备有限公司;DSHZ-300A水浴恒温振荡器,太仓市强文实验设备有限公司;SCIENTZ-48高通量组织研磨器,宁波新芝生物科技股份有限公司;Varioskan Flash型全自动酶标仪,赛默飞世尔科技(中国)有限公司;CR22 N冷冻离心机,日本Hitachi公司;Agilent1100高效液相色谱系统,美国安捷伦公司;Waters 2695高效液相色谱仪,美国Waters公司。
1.1.4 实验动物
C57BL/6 J雄性小鼠114只,SPF级,8周龄,体重(20±2) g,购自北京维通利华实验动物技术有限公司。饲养条件:温度(23±2) ℃,湿度50%~60%,昼夜交替(12 h∶12 h),食水自由。动物使用许可证SYXK(苏)2021-0056,来自江南大学实验动物中心;动物实验的伦理审批单位为江南大学动物实验伦理审查委员会,批号:JN.No20230615c1280723[260]。
1.2 目标酶解物的制备与筛选
1.2.1 酶解流程
分别称取100 g的8种海洋生物肉,按照料液比1∶3(g∶mL)加入蒸馏水,破碎匀浆(7 000 r/min,5 min),沸水浴20 min灭活内源酶,冷却至室温后,调节匀浆液pH值,按照底物酶活比1∶1 000(g∶U)加入对应的第1种蛋白酶,搅拌均匀,在相应温度下水浴振荡酶解3 h,沸水浴10 min灭活,冷却至室温后,调节匀浆液pH值,按照底物酶活比1∶1 000(g∶U)加入对应的第2种蛋白酶,重复上述操作,沸水浴10 min灭活,冷却至室温后4 500 r/min离心15 min,取上清液,经蒸发浓缩及冷冻干燥处理,最终制成粉状物质,储存于-20 ℃备用。表1展示了不同商业用酶最佳的酶水解作用条件。
表1 各商业酶的最适酶解条件
Table 1 Optimum catalytic conditions for the commercial enzymes
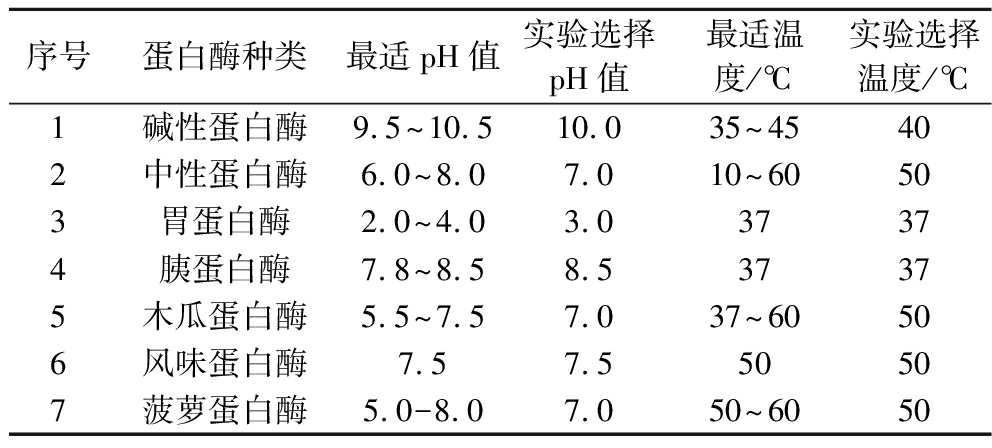
序号蛋白酶种类最适pH值实验选择pH值最适温度/℃实验选择温度/℃1碱性蛋白酶9.5~10.510.035~45402中性蛋白酶6.0~8.07.010~60503胃蛋白酶2.0~4.03.037374胰蛋白酶7.8~8.58.537375木瓜蛋白酶5.5~7.57.037~60506风味蛋白酶7.57.550507菠萝蛋白酶5.0-8.07.050~6050
1.2.2 ADH激活率测定
依据XIAO等[22]的方法进行稍加调整,按照ADH试剂盒说明书的操作步骤进行,调节样品和阳性对照的蛋白质量浓度为1 mg/mL。将50 μL样品与150 μL的工作液混合,置于37 ℃环境中稳定5 min,然后加入50 μL 的ADH溶液(酶活力为1 U/mL)以激发化学反应,并从此刻开始计时。使用酶标仪于340 nm处测定吸光度,每隔10 s记录1次OD340nm,连续测量10 min。同时设立蒸馏水作阴性对照,对所得的曲线进行拟合,计算拟合曲线在0 min处的一阶导数,用以量化NADH的产生率,即初始反应速率。所有实验重复3次,ADH激活率的计算如公式(1)所示:
ADH激活率![]()
(1)
式中:VS,样品的初始反应速率;V0,阴性对照的初始反应速率。
1.2.3 氨基酸组成测定
采用邻苯二甲醛(o-phthalaldehyde,OPA)柱前衍生反相高效液相色谱-紫外检测法测定氨基酸,色谱柱为Agilent Hypersil ODS(5 μm,40 mm×250 mm),流动相A为V(醋酸钠)∶V(三乙胺)∶V(四氢喃)=500∶0.11∶2.5,流动相B为V(醋酸钠)∶V(甲醇)∶V(乙晴)=1∶2∶2,洗脱程序为:0 min,8% B;17 min,50% B;20 min,100% B;24 min,0% B,流速为1 mL/min,柱温40 ℃,检测波长338 nm,脯氨酸以262 nm检测,以外标法定量,共检测17种氨基酸。
1.2.4 分子质量分布测定
采用高效液相色谱法测定分子质量分布。色谱柱为TSKgel 2000 SWXL(10 μm,300 mm×7.8 mm),流动相V(乙腈)∶V(水)∶V(三氟乙酸)=40∶60∶0.1,流速0.5 mL/min,柱温30 ℃,检测波长220 nm。
标准品分别为细胞色素C、抑肽酶、杆菌肽、乙氨酸-乙氨酸-酪氨酸-精氨和乙氨酸-乙氨酸-乙胺酸。以分子质量的对数作为Y轴,保留时间作为X轴,作图得到校正曲线方程(R2=0.998)。
1.2.5 体外胃肠道消化稳定性
按照MINEKUS等[23]的方法配制模拟胃肠道消化液。具体操作如下:将待消化样品溶于蒸馏水中,质量浓度为1 mg/mL,与模拟胃液电解质原液混合,按照2 000 U/mL加入胃蛋白酶,然后加入CaCl2,使最终消化混合物中的Ca2+浓度为0.075 mmol/L,调节pH值为3.0。最后,加水使得混合溶液与模拟胃液的最终体积比为50∶50。在37 ℃下水浴振荡消化2 h,沸水浴10 min灭酶。分出50%进行模拟肠道消化,另外50%在4 500 r/min下离心15 min,取上清液经蒸发浓缩、冷冻干燥后保存在-20 ℃冰箱待用。模拟肠道消化:胃消化液与模拟肠液电解质原液混合,按照100 U/mL加入胰蛋白酶,然后加入CaCl2,使最终消化混合物中的Ca2+浓度达到0.3 mmol/L,调节pH值为7.0。最后,在混合物中加水使得胃消化液与模拟肠液的最终体积比为50∶50。在37 ℃下水浴振荡消化2 h,以相同的步骤处理后待用。
1.2.6 ADH体外动力学
检测在不同单位蛋白质量浓度的目标酶解物参与下ADH激活率的变化,以质量浓度为横坐标,ADH激活率为纵坐标建立拟合曲线,探究ADH的体外动力学。
1.3 海参水解物(Stichopus japonicus peptides,SJPs)对急性酒精中毒小鼠的解酒作用
1.3.1 动物分组与给药
雄性C57BL/6 J小鼠60只,在经过7 d的饲养适应期,随机分为6组,空白对照组、酒精模型组、阳性对照组、SJPs低、中和高剂量组,每组10只。实验前禁食不禁水12 h,阳性对照组、SJPs低、中和高剂量组分别依次灌胃400 mg/kg BW海王金樽(根据海王金樽推荐剂量换算)以及200、400、600 mg/kg BW SJPs,空白对照组和酒精模型组分别给予等体积的生理盐水。30 min后,除空白组外各组小鼠依次灌胃9.8 mL/kg BW 56°红星二锅头,空白对照组灌胃等体积生理盐水。
1.3.2 翻正反射实验
小鼠灌酒后立刻开始计时,以“翻正反射试验”观察小鼠饮后行为表现,当小鼠行走摇摆或迟缓时,将其仰卧并计时,假如小鼠仰卧持续时间超过30 s,则认为翻正反射消失,记录翻正反射消失时间(醉酒潜伏期)与醉酒只数。当小鼠能够在60 s内自行翻身两次,即视为翻正反射恢复,记录小鼠恢复至此状态的时长(醒酒时间)。
1.4 SJPs对小鼠早期ALD的保护作用与机制研究
1.4.1 动物分组与建模
参考BERTOLA等[24]建立慢性酒精喂养加急性酒精灌胃的小鼠早期ALD模型(NIAAA模型)。实验选用雄性C57BL/6 J小鼠54只,在经过7 d的饲养适应期,随机分为6组,即空白对照组、酒精模型组、阳性对照组、SJPs低、中和高剂量组,每组9只。第8~14天为酒精液体饲料适应期,从0%过渡到5%,第15~24天给予5%的酒精液体饲料(除空白组外)建立小鼠早期ALD模型。在此期间每天记录摄食量,通过计算平均实验组小鼠的最少摄入卡路里量来调整给予各组小鼠的液体饲料,使得各组小鼠摄取等量的热量。每天在固定时间(下午4~5点)按照400 mg/kg BW海王金樽以及200、400、600 mg/kg BW SJPs分别灌胃各组小鼠,空白组和酒精模型组则施以相等剂量的生理盐水进行灌胃,固定时间(下午5~6点)更换液体饲料。
1.4.2 样本采集
在第25天早上(7~9点)按照400 mg/kg BW海王金樽以及200、400、600 mg/kg BW SJPs依次灌胃给各组小鼠。30 min后,除空白组外各组小鼠依次灌胃12 mL/kg BW 45%乙醇溶液,空白组则接受了等热量的麦芽糖糊精灌胃,随后实行了9 h的禁食。9 h后对小鼠异氟烷麻醉,随后摘眼球采血,处死小鼠。取肝脏,称重后分为两部分,一部分采用4%(体积分数)多聚甲醛固定后续肝脏切片,一部分液氮冻存进行后续生化指标测定。
1.4.3 血清相关生化指标的测定
将全血样本于4 ℃下静置8 h后,以2 000 r/min在同温度条件下离心20 min,取出上清液即血清部分,按试剂盒说明书测定小鼠血清的肝功能酶学相关指标(ALT和AST活力)。
1.4.4 肝脏相关生化指标的测定
称取100 mg左右肝脏组织,按照1∶9(mg∶μL)比例加入4 ℃生理盐水,在冰浴条件下制成10%的肝组织匀浆,3 000 r/min、4 ℃条件下离心10 min,取上清液,按照试剂盒说明书测定小鼠肝脏ADH、ALDH、MDA、SOD、GSH、TG、TC及总蛋白浓度,结果统一以蛋白浓度表示。
1.4.5 组织病理学分析
先将肝组织用4%中性缓冲多聚甲醛溶液进行固定,石蜡进行包埋,然后切成5 μm薄片,使用苏木素-伊红染色液(H&E)染色,染色好的切片置于载玻片上,在光学显微镜下放大200倍进行观察。
1.5 数据与分析
结果以“X±SD”表示,采用SPSS 25.0软件进行数据统计分析,样本比较采用单因素方差分析(One-way ANOVA),然后进一步用Duncan多重比较法进行显著性分析,P<0.05则具有显著性差异。使用GraphPad Prism 5.0软件和Origin 2017软件进行绘图。
2 结果与分析
2.1 目标酶解物的制备与筛选
2.1.1 目标酶解物初筛
8种海洋生物通过7种蛋白酶进行双酶分步酶解,得到336种水解产物,测定其单位蛋白质量浓度的ADH激活率。以ADH激活率进行排序,选择前36种进行重复验证实验,并以海王金樽作为阳性对照,结果如表2所示。
表2 36种样品的ADH激活率
Table 2 ADH activation rates of 36 samples

序号名称ADH激活率/%序号名称ADH激活率/%1阳性对照96.42±5.39d20扇贝木/中101.04±1.81cd2麻虾风/碱122.40±3.69a21扇贝胃/风100.47±1.73cd3海参碱/风118.86±1.53ab22扇贝菠/胰98.26±0.66d4海参胰/风117.86±2.86ab23沙丁鱼木/中93.33±3.27de5鱿鱼碱/中117.79±2.37ab24扇贝胰/木91.27±4.26de6鱿鱼中/胰116.88±2.83ab25扇贝木/碱92.24±7.42de7麻虾风/中112.90±10.79b26海参风/木90.70±3.43de8扇贝中/木112.04±1.78b27扇贝木/胃90.48±5.71e9鱿鱼菠/胃112.04±2.24b28鱿鱼胃/中88.44±11.35e10扇贝中/胰110.87±4.06bc29三角帆蚌风/中88.20±3.15e11沙丁鱼碱/胃108.13±5.22bc30扇贝胃/中87.60±1.37ef12海参碱/木106.57±4.31bc31鱿鱼中/风83.91±1.56ef13扇贝胰/中106.50±6.3bc32扇贝胃/碱82.47±1.40ef14沙丁鱼菠/碱106.08±1.06bc33沙丁鱼菠/胃80.20±1.75f15麻虾风/胰104.45±8.18c34海参胰/木78.53±0.85f16鱿鱼菠/胰103.61±3.75cd35扇贝中/胃76.93±1.95f17扇贝胰/碱103.48±3.63cd36海参碱/中75.67±4.84f18鱿鱼木/中103.10±5.03cd37鱿鱼胃/风75.14±4.66f19鱿鱼木/胃101.84±7.29cd
注:碱代表碱性蛋白酶、风代表风味蛋白酶、胃代表胃蛋白酶、胰代表胰蛋白酶、木代表木瓜蛋白酶、中代表中性蛋白酶、菠代表菠萝蛋白酶,以“/”分隔出两种酶的先后顺序(下同);样品组按从大到小排序;同列数据肩标不同字母表示差异显著(P<0.05)。
由表2可知,阳性对照组海王金樽的ADH激活率为96.42%,36种样品中有14种样品的ADH激活率显著高于阳性对照组(P<0.05),最高的一种为麻虾风/碱,ADH激活率为122.40%。ADH激活率最高的5种样品:麻虾风/碱、海参碱/风、海参胰/风、鱿鱼碱/中和鱿鱼中/胰,主要依赖于风味蛋白酶和碱性蛋白酶的水解作用。风味蛋白酶同时具有内部和外部切割肽键的活性,能够在蛋白质内部割断肽链,产生小分子肽链,也可以从蛋白质的—COOH或—NH2端逐个切割,产生游离氨基酸。碱性蛋白酶作为目前最常用的蛋白酶,具有较强的分解蛋白质的能力,且作用位点较为广泛。因此,风味蛋白酶和碱性蛋白酶在一定程度上可以更充分地水解蛋白质。
2.1.2 氨基酸组成分析
以ADH激活率最高的前5种海洋生物水解物作为研究主体,使用高效液相色谱法分析其氨基酸组成,结果如表3所示。
表3 五种海洋生物水解物的氨基酸组成 单位:g/100 g
Table 3 Amino acid composition of 5 hydrolysates of marine organisms

氨基酸种类麻虾风/碱海参碱/风海参胰/风鱿鱼碱/中鱿鱼中/胰天冬氨酸(Asp)5.15±0.22b4.17±0.06c3.57±0.05d5.95±0.33a5.70±0.18a谷氨酸(Glu)8.62±0.39b6.24±0.04c5.31±0.05d9.68±0.44a9.78±0.29a丝氨酸(Ser)1.70±0.10b1.75±0.04b1.50±0.04c2.11±0.12a1.97±0.09a组氨酸(His)0.85±0.02b0.48±0.03c0.43±0.02c1.57±0.03a1.55±0.06a甘氨酸(Gly)#4.45±0.12c6.03±0.17a5.00±0.18b2.72±0.09d2.52±0.07d苏氨酸(Thr)2.02±0.05c2.06±0.02c1.80±0.02d2.49±0.10a2.24±0.02b精氨酸(Arg)5.10±0.21a3.13±0.03c2.65±0.02d4.33±0.22b4.46±0.17b丙氨酸(Ala)#2.93±0.14b2.75±0.02b2.32±0.02c3.33±0.18a3.27±0.13a酪氨酸(Tyr)1.21±0.08a0.95±0.01b0.83±0.07bc1.01±0.14ab0.65±0.18c胱氨酸(Cys)0.21±0.02b0.18±0.02bc0.15±0.01c0.27±0.03a0.22±0.02b缬氨酸(Val)#2.46±0.08b1.91±0.01c1.67±0.03d2.79±0.12a2.56±0.06b蛋氨酸(Met)1.46±0.03c0.72±0.01d0.61±0.02e1.87±0.03a1.75±0.03b苯丙氨酸(Phe)#2.14±0.10b1.25±0.02d1.10±0.02e2.27±0.10a1.96±0.05c异亮氨酸(Ile)#2.39±0.10b1.55±0.03c1.34±0.01d2.80±0.14a2.47±0.07b亮氨酸(Leu)#3.88±0.17b2.00±0.05c1.74±0.02c4.77±0.25a4.56±0.18a赖氨酸(Lys)4.18±0.12b1.57±0.01c1.41±0.02d5.17±0.06a5.25±0.11a脯氨酸(Pro)#0.61±0.28b2.59±0.68a2.51±0.36a0.54±0.17b0.66±0.32b氨基酸总量(∑TAA)49.37±2.02c39.34±0.61d33.93±0.57e53.69±2.21a51.56±1.49ab疏水性氨基酸(∑HAA)18.86±0.97a18.09±0.76a15.67±0.53b19.23±1.01a18.00±0.88aHAA与TAA比值/%38.19±0.44b45.97±1.22a46.17±0.81a35.81±0.43c34.89±0.71c
注:#表示疏水性氨基酸;同行数据肩标不同字母表示差异显著(P<0.05)。
由表3可知,鱿鱼碱/中和鱿鱼中/胰的氨基酸总量最高,分别为53.69%和51.56%;海参胰/风的氨基酸含量最低,为33.93%。此外,在5种海洋生物水解物中,海参胰/风和海参碱/风的疏水性氨基酸含量占比最高,分别为46.17%和45.97%。各种研究表明,ADH可以通过增加细胞质溶液疏水性而被激活,疏水氨基酸可能导致肝细胞细胞质疏水性增加,从而激活ADH[25]。海参碱/风中甘氨酸和脯氨酸含量显著高于其他样品(P <0.05),分别为6.03 g和2.59 g。甘氨酸可防止缺氧引起的肝损伤,降低内毒素引起的死亡率,并通过减少血液乙醇来最大限度地减少酒精性肝损伤[26];脯氨酸可以激活肝脏中IL-6/STAT-3通路,并通过再生反应抑制大量炎症[27]。
2.1.3 分子质量分布
使用高效液相色谱法检测5种海洋生物水解物的分子质量分布,结果如表4所示。
表4 五种海洋生物水解物的分子质量分布 单位:g/100 g
Table 4 Molecular weight distribution of 5 hydrolysates of marine organisms

分子质量/Da麻虾风/碱海参碱/风海参胰/风鱿鱼碱/中鱿鱼中/胰>10 0000.11±0.04a0.00±0.00c0.01±0.01c0.00±0.00c0.07±0.01b10 000~6 5001.08±0.03a0.00±0.00c0.40±0.39b0.01±0.02c0.81±0.06a6 500~3 0001.65±0.02ab1.11±0.11bc0.50±0.10c1.49±1.13abc2.23±0.01a3 000~1 00018.70±0.07cd17.84±0.22d19.70±0.23c30.73±1.16b39.05±0.16a1 000~50036.18±0.26d37.90±0.18c38.77±0.19c56.82±0.93a47.04±0.04b<50042.28±0.24b43.14±0.14a40.62±0.54c10.29±0.25d10.86±0.13d小分子肽(<1 000)78.46±0.03b81.04±0.20a79.39±0.71b67.11±1.18c57.91±0.16d
注:同行数据肩标不同字母表示差异显著(P<0.05)。
5种海洋生物经过两步水解后分子质量基本都在3 000 Da以下,其中海参碱/风的分子质量分布在1 000 Da以下的占比显著高于其他组别(P<0.05),达到81.04%。研究表明,小分子活性肽(<1 000 Da)具有结构简单、生物活性强、毒副作用小和稳定性好等优势,能够完整的通过小肠壁,并且被迅速地摄入体内,特别是二肽与三肽,而肽链增长会导致吸收效率降低。此外,小肽比游离氨基酸更快地被吸收到肠细胞中,从而在血液循环中提供更平衡的氨基酸模式[28]。因此,海参碱/风可能在体内发挥作用的速度上具有一定优势。此外,通过与其他文献相比,海洋生物经单酶酶解后小分子肽(<1 000 Da)的含量通常在40%~50%,而经过双酶分步酶解后可以达到80%[16, 19]。进一步说明双酶酶解可以更充分地水解蛋白质,获得小分子活性肽含量更多的酶解物。
2.1.4 体外胃肠道消化稳定性
人体胃肠道内含有大量水解酶,水解物经口服后需要抵抗胃肠道酶的完全水解,并能够通过肠壁进入血液,同时保持其生物活性,才能在肝脏内发挥作用。因此本研究中采用一种标准化的两阶段体外消化模型对5种海洋生物水解物进行模拟胃肠道消化,其分子质量分布变化和ADH激活率变化如图1所示。
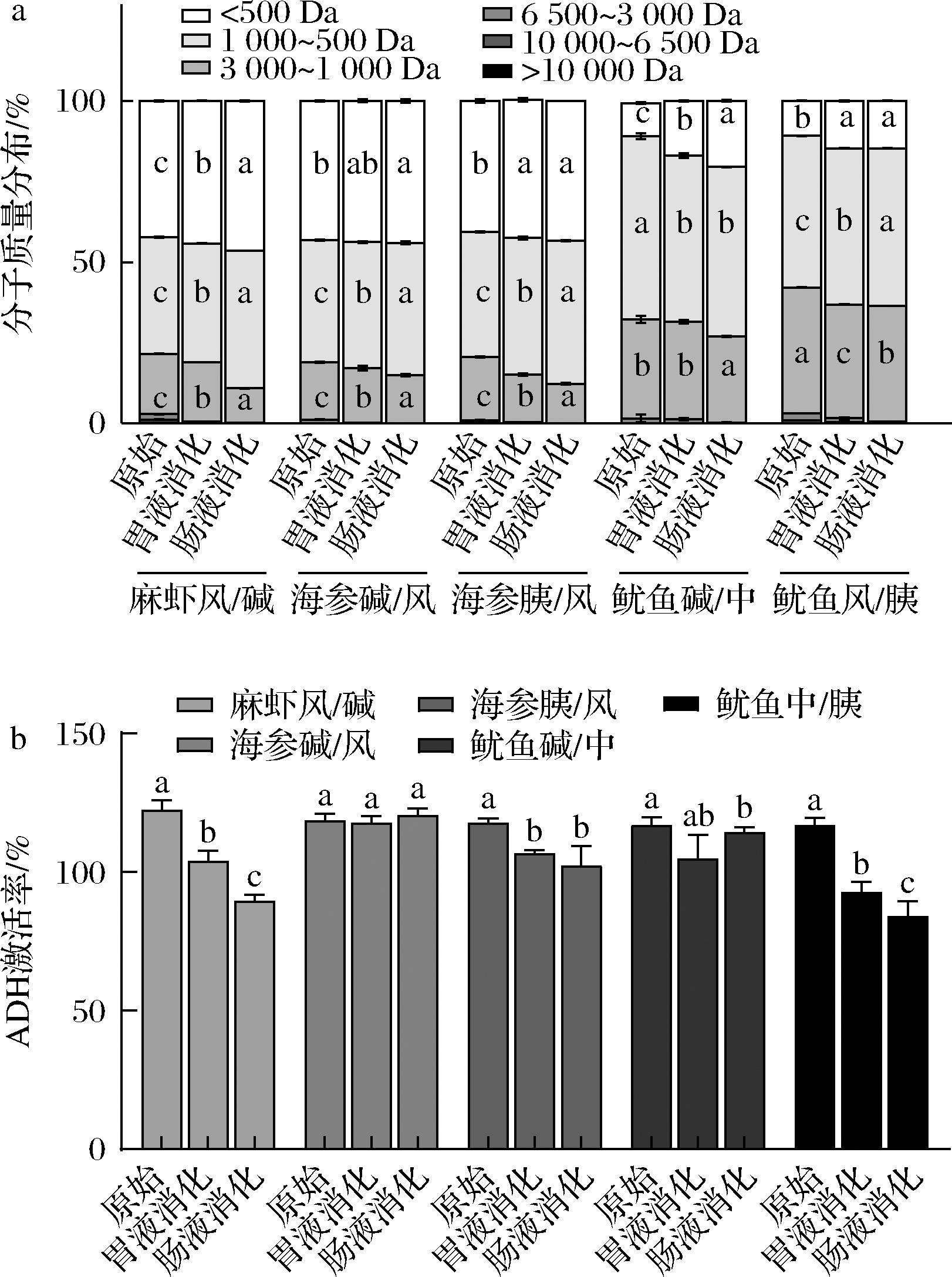
a-分子质量分布;b-ADH激活率
图1 胃肠道消化对5种海洋生物水解物分子质量分布与ADH激活率的影响
Fig.1 Effect of gastrointestinal digestion on molecular weight distribution and ADH activation rate of 5 hydrolysates of marine organisms
注:同组数据肩标不同字母表示差异显著(P<0.05)(下同)。
胃中酸性环境和胃蛋白酶的存在促进了蛋白质分解的初始步骤,胃蛋白酶可随机水解蛋白质序列中的肽键以产生相对较大的肽,随后在肠内消化过程中,释放出链长为2~8的小分子肽链和少量游离氨基酸的寡肽[29]。5种海洋生物水解物经胃液消化后,大分子蛋白质被不同程度地水解成小分子肽链。因此,ADH激活率也会发生不同程度的变化。经胃肠道消化后,海参碱/风的分子质量分布变化程度最小,而且ADH激活率没有显著变化(P<0.05),维持了较高的水平。这可能是因为海参碱/风的主要分子质量集中在1 000 Da以下(占81.04%),较小分子质量可能导致其对胃蛋白酶和胰蛋白酶不敏感,活性肽段未被降解,其活性因而得以保持。而麻虾风/碱在经过胃肠道消化后,ADH激活率经历了两阶段显著的降低(P<0.05),可能是因为胃蛋白酶导致麻虾风/碱中原本具有活性的大分子多肽发生水解,在胰酶的作用下被进一步水解,部分活性多肽可能被降解而导致失活。鱿鱼中/胰和海参胰/风由于已经在制备阶段被胰蛋白酶酶解过,因此在小肠消化阶段ADH激活率变化不显著(P>0.05),但是胃消化阶段胃蛋白酶的作用会导致其ADH激活率下降明显(P<0.05)。
2.1.5 SJPs的ADH体外动力学
通过对这5种海洋生物水解物在氨基酸组成、分子质量分布和胃肠道消化稳定性3个方面的综合考虑,海参碱/风(SJPs)由于其疏水性氨基酸含量较多、小分子肽占比较多且经胃肠道消化后保持高ADH激活率的优点,将其确定为后续解酒护肝产品开发的最佳方案。分别采用不同单位蛋白质量浓度(0、0.01、0.05、0.1、0.3、0.5、0.8、1.0 mg prot/mL)SJPs干预ADH催化酒精的反应动力学如图2-a所示。
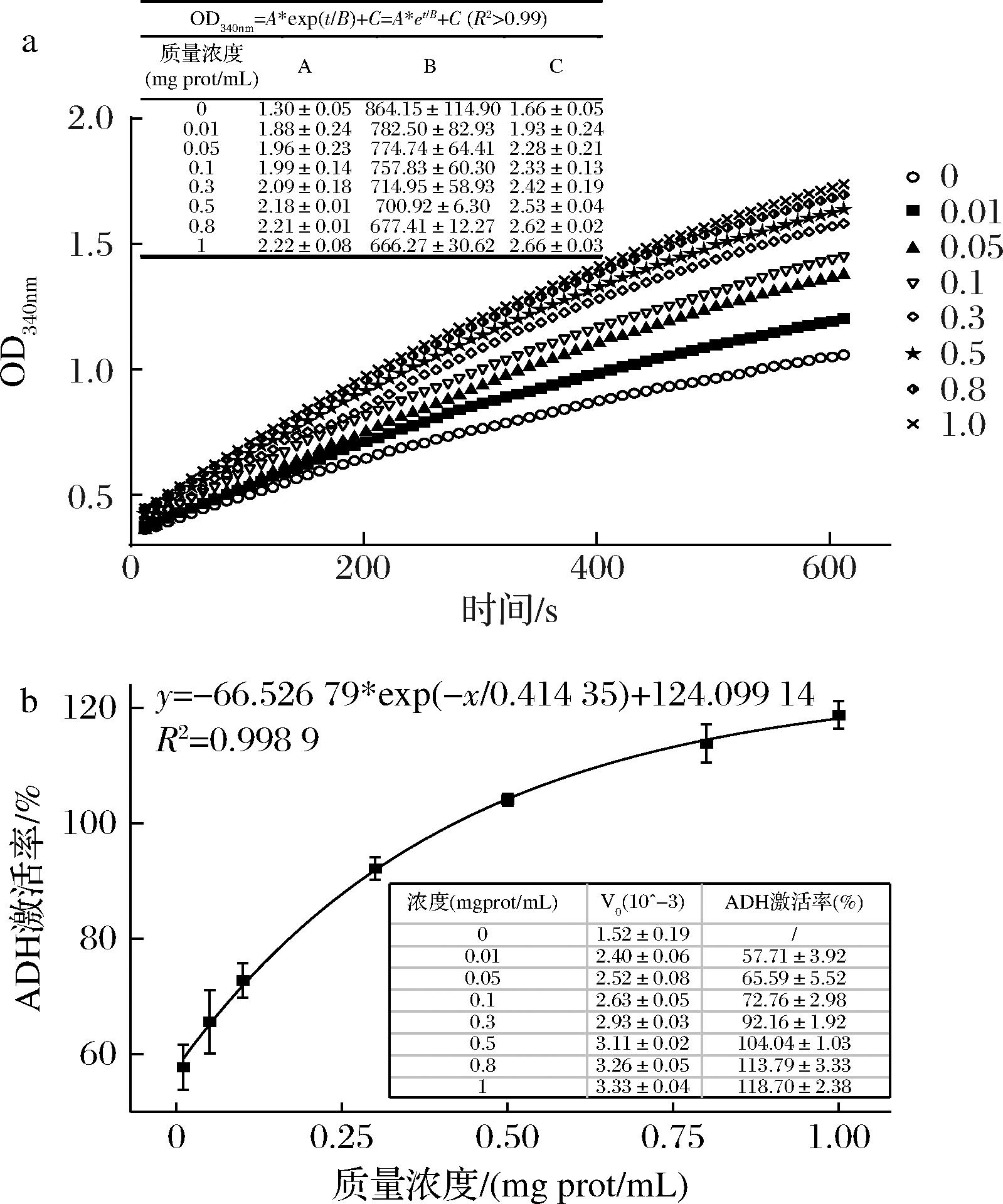
a-ADH催化酒精代谢的反应动力学曲线;b-SJPs的量效关系曲线
图2 SJPs的体外动力学
Fig.2 Reaction curves of sea cucumber hydrolysates
可以看到,随着SJPs质量浓度的增加,340 nm处的OD值增加速率更快,在所监测的10 min内,其反应曲线可由方程(2)进行拟合:
(2)
不同质量浓度SJPs干预下反应曲线拟合方程的参数如图2-b中表格所示,对其相对应的ADH激活率进行拟合,结果如图2-b曲线所示,SJPs的量效关系可由如下方程(3)拟合:
(3)
可以看出,ADH激活率随SJPs质量浓度升高而上升,呈现良好的量效关系,表明SJPs确实有效干预ADH催化酒精氧化的过程。以1 mg prot/mL SJPs干预时ADH激活率提高了118.70%,可以有效加快酒精代谢速率。对方程(4)求极限,可以得到海参碱/风激活ADH理论效能为124.10%。
2.2 SJPs对急性酒精中毒小鼠的解酒作用探究
摄入大量酒精后,酒精会通过胃肠道吸收迅速到达血液,同时抑制大脑兴奋性神经介质,导致小鼠进入酒精性昏迷状态,也就是翻正反射消失(lost of righting reflex,LORR)。本实验采用9.8 mL/kg BW 56°红星二锅头灌胃小鼠,诱导小鼠急性酒精中毒,考察SJPs对急性中毒小鼠的行为特性,结果如表5所示。
表5 SJPs摄入对小鼠LORR的影响
Table 5 Effect of ingestion of SJPs on LORR in mice
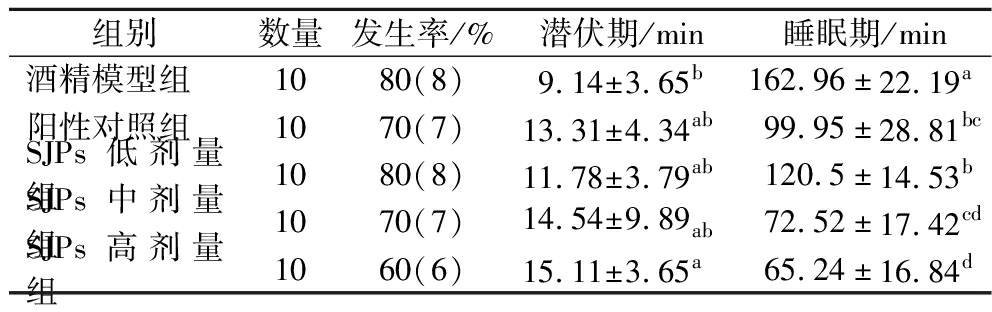
组别数量发生率/%潜伏期/min睡眠期/min酒精模型组1080(8)9.14±3.65b162.96±22.19a阳性对照组1070(7)13.31±4.34ab99.95±28.81bcSJPs低剂量组1080(8)11.78±3.79ab120.5±14.53bSJPs中剂量组1070(7)14.54±9.89ab72.52±17.42cdSJPs高剂量组1060(6)15.11±3.65a65.24±16.84d
注:同列数据肩标不同字母表示差异显著(P<0.05);发生率为10只小鼠醉酒的概率。
将灌胃酒精到LORR产生的时间定义为潜伏期,用于表征从饮酒到醉酒所需时间;将LORR产生到消失的时间定义为睡眠期,用于表征醉酒到醒酒所需时间。潜伏期越长、睡眠期越短,表示小鼠对急性酒精中毒的耐受性越强。急性酒精摄入导致模型组小鼠80%发生LORR,平均潜伏时间9.14 min,持续时间162.96 min。这表明酒精摄入成功引起小鼠急性酒精中毒。在灌胃白酒前30 min灌胃小鼠不同剂量的SJPs和阳性对照,不同程度降低LORR发生率、延长LORR潜伏时间并缩短持续时间。其中高剂量SJPs将潜伏期从9.14 min延长至15.11 min,将睡眠期从162.96 min缩短至65.24 min,显著缩短了一半以上的时间(P<0.05)。这些结果表明,摄入SJPs可达到增加睡眠潜伏期,减少睡眠时间,加速醒酒的效果。
2.3 SJPs对小鼠早期ALD的保护作用与机制研究
2.3.1 SJPs对小鼠肝脏酒精代谢酶系的影响
ADH是肝脏中催化酒精氧化代谢的主要酶系,大约80%的乙醇通过此途径转化为乙醛,然后在ALDH作用下进一步氧化为乙酸,氧化分解为CO2和水排出体外[30]。测定早期ALD小鼠肝脏ADH和ALDH活力,结果如图3所示。

a-ADH;b-ALDH
图3 SJPs摄入对小鼠肝脏酒精代谢酶系ADH和ALDH活力的影响
Fig.3 Effect of SJPs intake on the activity of alcohol metabolism enzymes ADH and ALDH in mice liver
与空白对照组相比,酒精模型组小鼠ADH和ALDH活力下降,这是由于乙醛与蛋白质等小分子结合导致肝脏线粒体功能障碍,而使得位于线粒体的ADH和ALDH活力受损[3]。与酒精模型组相比,SJPs各干预组ADH和ALDH活力显著上升(P<0.05),且其活性的增强程度与SJPs给药量成正比关系。其中,SJPs高剂量组小鼠肝脏ADH和ALDH活力分别提高了55.28%和110.31%。此外,SJPs在体内和体外均表现出对ADH的激活效果,且呈现较好的量效关系,两者具有一定相关性。这也验证了本文以体外ADH激活活性为指标来评价和筛选活性肽的合理性。
ADH和ALDH是催化酒精代谢的关键标志物,在酒精代谢过程中发挥重要作用。SJPs的干预能够显著提高小鼠肝脏ADH和ALDH活力,在高活力ADH的催化作用下乙醇加速氧化生成乙醛,ALDH催化乙醛进一步氧化成乙酸,减缓乙醇及其代谢产物对肝脏的伤害。乙醛具有剧毒和致癌性,它通过与蛋白质结合,导致线粒体和微管结构的功能改变并产生ROS等有害物质。在乙醛的分解过程中,所利用的酶与大脑合成通常氨基酸类神经传递物质时所需求的酶相同,从而乙醛的分解过程与此相冲突,竞争性地阻碍了大脑中正常神经介质的生成。因此,过量饮酒导致的酒精中毒性昏厥,其本质是兴奋型神经介质被抑制的结果[3]。因此,减少乙醛在肝脏内的堆积不仅可以缓解小鼠肝脏蛋白质功能紊乱,修复小鼠受损肝细胞膜,在一定程度上恢复AST和ALT水平,而且还可以减少小鼠酒精性昏迷时间,加速醒酒。
2.3.2 SJPs对血清肝功能酶系相关指标的影响
正常动物AST和ALT主要存在于肝脏中,在血液中含量较低。当过度饮酒或疲劳时,肝细胞受到损伤可导致这些转氨酶释放进入血液。因此,血液AST和ALT是检测肝细胞功能的灵敏指标[31]。检测不同干预组小鼠血清中的AST和ALT含量,结果如图4所示。相对于空白对照组,酒精模型组中小鼠血清ALT和AST活力均显著升高(P<0.05),说明小鼠肝细胞受损严重,提示造模成功。与酒精模型组相比,SJPs高剂量组的AST活力和ALT活力较酒精模型组分别减少了45.47%和45.73%,并且与空白对照组比较,它们的活性差异并不显著(P<0.05)。结果表明,SJPs中、高剂量组的干预均对小鼠肝脏细胞膜的通透性和完整性均具有较好的修复作用,尤以SJPs高剂量组的效果最为显著(P<0.05)。有研究表明,口服甘氨酸可以显著降低血清AST、ALT的活性,并使肝脏和脑脂肪酸组成正常化[32]。而SJPs中甘氨酸含量较高(15.56%),可能对修复小鼠肝脏细胞膜,降低血清AST和ALT活性有帮助。
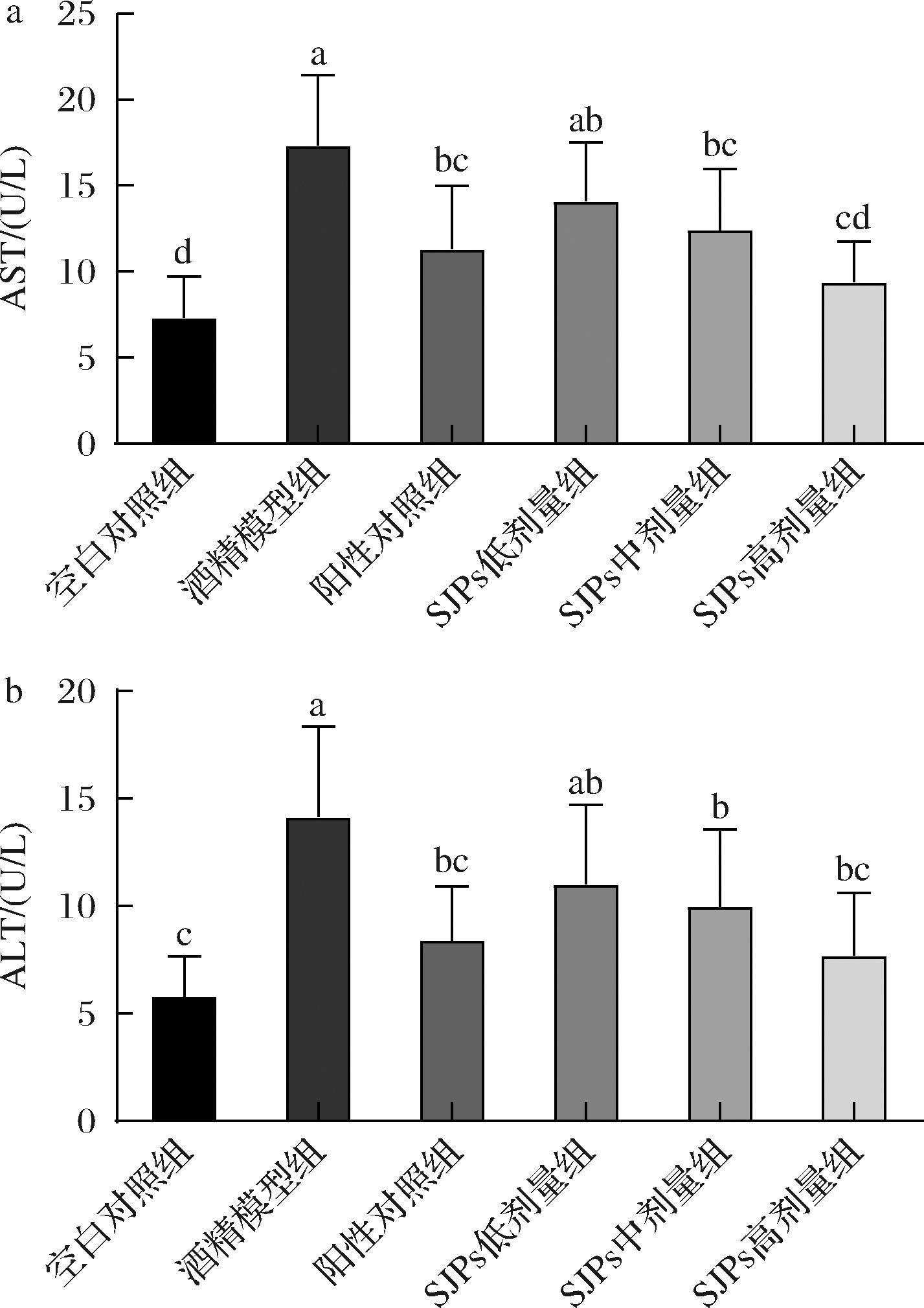
a-AST;b-ALT
图4 SJPs摄入对小鼠血清肝功能酶系AST和ALT活力的影响
Fig.4 Effect of SJPs intake on the activity of liver function enzymes AST and ALT in mice serum
2.3.3 SJPs对小鼠肝脏氧化应激相关指标的影响
在经常性并大量摄入酒精的情形中,20%左右的酒精会通过微粒体乙醇氧化系统(microsomal ethanol oxidizing system,MEOS)氧化为乙醛,这一过程主要依赖于CYP2E1,同时会产生大量的活性氧自由基。作为体内至关重要的自由基清除剂之一,GSH肩负着维持氧化平衡的重任。MDA的量可反映机体内脂质过氧化的程度,SOD活力反映了机体抗氧化能力[33]。测定小鼠肝脏MDA、SOD和GSH含量,结果如图5所示。
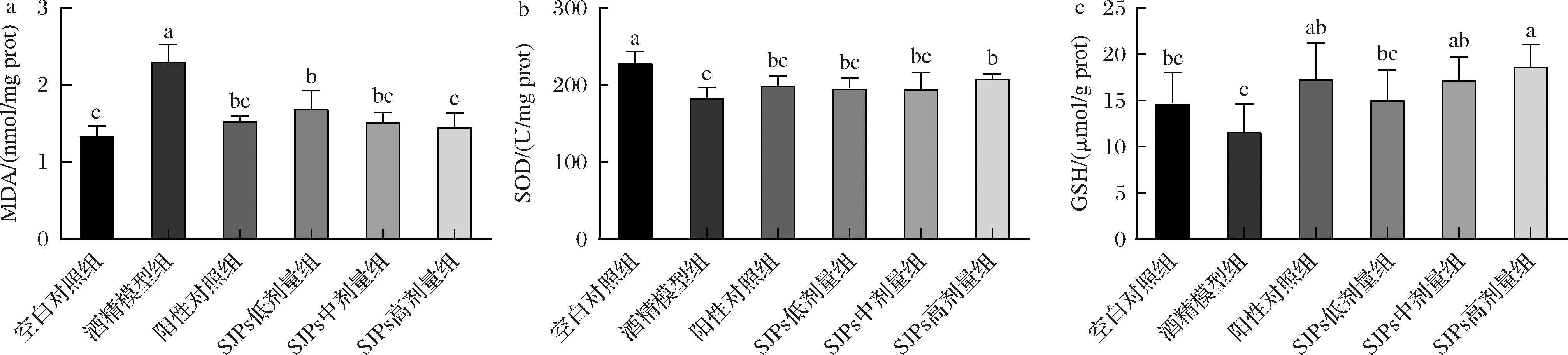
a-MDA;b-SOD;c-GSH
图5 SJPs摄入对小鼠肝脏氧化应激相关指标MDA、SOD和GSH的影响
Fig.5 Effect of SJPs intake on oxidative stress-related indicators MDA、SOD and GSH in mice liver
结果显示,与空白对照组相比,酒精模型组中小鼠肝脏SOD活力显著下降了19.69%(P<0.05),同时MDA的浓度显著增加了71.64%(P<0.05)。这一系列的生化指标反映出小鼠的肝脏遭受到了严重损害,明显伴随着其抗氧化能力减弱以及脂质过氧化水平的提高,说明肝损伤模型建立成功。与酒精模型组相比,阳性对照组和经不同剂量SJPs处理的组别显示出的肝脏损伤程度均有一定的改善。其中,SJPs高剂量组的SOD活力和GSH含量相较于酒精模型组分别显著提高了13.52%和60.31%,MDA含量显著降低了36.52%(P<0.05)。即SJPs的干预均可在一定程度上通过提高肝脏SOD活力、促进肝内GSH合成,增强小鼠肝脏的抗氧化能力,同时调节肝脏的脂质代谢,减轻肝脏内由急性酒精介导的氧化应激反应,减少脂质过氧化物MDA的产生和脂肪大量的堆积。已知SJPs可以通过激活ADH和ALDH活力来加速酒精代谢,在此过程中CYP2E1有可能因为酒精含量减少而得到抑制,从而减少活性氧自由基的产生。同时,活性氧的另一个产生途径:乙醛,也在SJPs的作用下及时氧化为乙酸。此外,SJPs含有较为丰富的酸性氨基酸(Glu和Asp)和疏水性氨基酸(Gly和Pro等),酸性氨基酸的蛋白质水解物可以作为自由基的有效清除剂或金属阳离子的还原剂,疏水性氨基酸则通过电子的直接转移发挥强大的自由基清除活性[34-36]。说明SJPs可能通过从源头减少和有效清除自由基协同发挥作用,在加速酒精代谢的同时,提升了小鼠肝脏抗氧化水平,有效地抑制了小鼠肝细胞内的脂质过氧化,缓解了肝细胞氧化损伤,从而下调血清中AST和ALT等转氨酶的活性。
2.3.4 SJPs对小鼠肝脏脂肪化的影响
在ADH的催化作用下,乙醇经氧化作用转化为乙醛,在此过程中氧化型辅酶NAD+还原成NADH,抑制脂肪酸β氧化和增加生物合成,脂肪酸在肝脏内大量累积,这是早期ALD的典型症状,也被称为酒精肝[37]。大量脂肪酸堆积会酯化成TG并增加肝脏内TC含量,为了进一步了解脂肪酸在早期ALD小鼠肝脏堆积情况,测定了肝脏组织TG和TC含量。结果如图6所示。
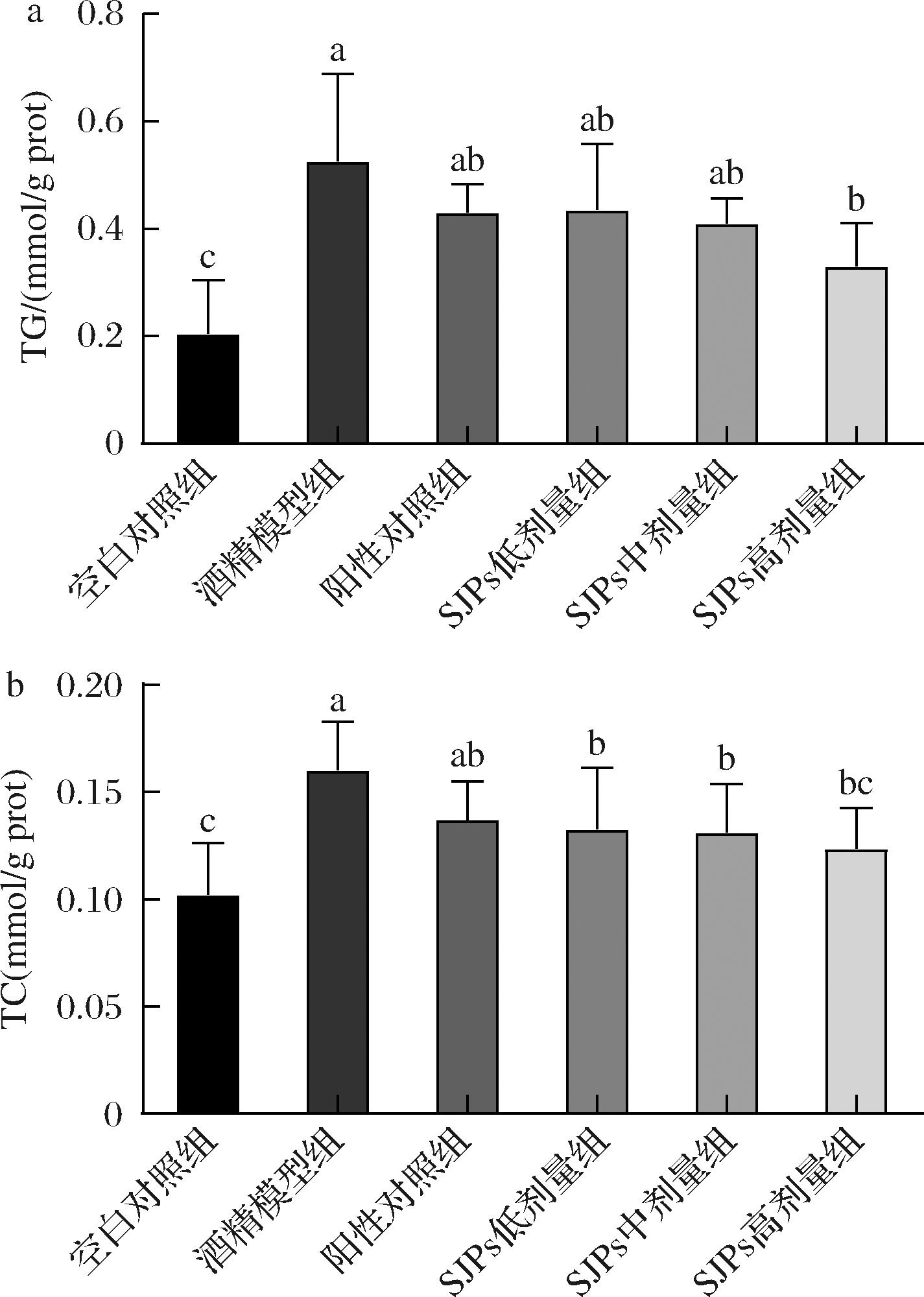
a-TG;b-TC
图6 SJPs摄入对小鼠肝脏TG和TC含量的影响
Fig.6 Effect of SJPs intake on TG and TC content in mice liver
与对照组相比,酒精模型组小鼠肝脏TG含量从0.21 mmol/mg显著提高至0.53 mmol/mg(P<0.05),TC含量也从0.10 mmol/mg显著提高至0.17 mmol/mg(P<0.05),显示脂肪酸在小鼠肝脏堆积,早期ALD造模成功。而摄入不同剂量SJPs和阳性对照海王金樽后,小鼠肝脏TG和TC含量较酒精模型组有了不同程度的降低。其中SJPs高剂量组较酒精模型组TG和TC含量显著降低了37.74%和29.41%(P<0.05),TC含量与空白对照组无显著差异(P>0.05),其效果优于海王金樽。该结果进一步验证了上述结论。
早期酒精肝的表现为酒精性脂肪肝,也就是脂肪在肝脏内堆积,表现为脂肪变性,即肝细胞内积蓄的甘油三酯将细胞核挤向一侧。为进一步观察小鼠肝脏细胞形态的变化,对小鼠的肝脏切片进行观察,结果如图7所示。
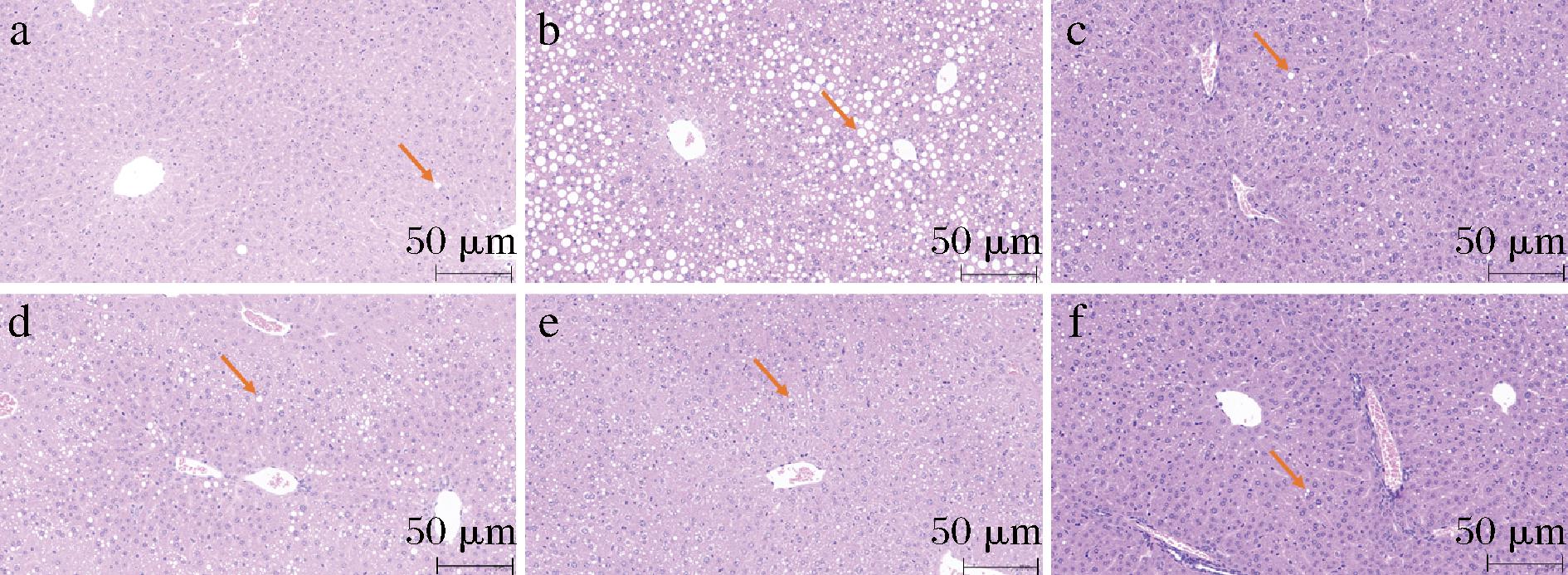
a-空白对照组;b-酒精模型组;c-阳性对照组;d-SJPs低剂量组;e-SJPs中剂量组;f-SJPs高剂量组
图7 肝脏组织 HE 染色切片图(×200)
Fig.7 Histological section of liver tissue stained with Hematoxylin and Eosin (H&E) (×200)
可见空白对照组肝脏被膜清晰,无明显增生。酒精模型组肝脏实质内可以看到大量肝细胞发生了脂肪变性(箭头),其胞浆中充斥着大小不一的圆形空泡,说明出现了早期酒精肝的症状,造模成功。而同时摄入不同剂量的SJPs和海王金樽,小鼠酒精肝的症状可以得到不同程度的缓解。其中SJPs高剂量组肉眼观察到的圆形空泡明显减少,说明摄入高剂量SJPs可以明显减少脂质在肝脏中的堆积。
综上所述,SJPs进入机体后首先通过激活酒精代谢酶系ADH和ALDH活性而加快酒精代谢,减少酒精代谢中间产物乙醛的含量,从而达到保护肝脏细胞和加速醒酒的功效。同时减少因乙醛堆积而导致的氧化损伤。产生氧化损伤的另一条途径微粒体乙醇氧化系统有可能因为酒精被及时代谢而被抑制。在此过程中,SJPs通过激活抗氧化酶SOD与增加GSH的含量来及时清理过剩的自由基,并协同减少肝脏内脂质的堆积,维持机体的平衡。
3 结论
本研究将海参先经碱性蛋白酶酶解再经风味蛋白酶酶解,制得了一种海参水解物(SJPs),其体外ADH激活率理论效能达到124.10%,统一蛋白质量浓度下(1 mg/mL)其ADH激活率为118.86%,显著高于阳性对照组(海王金樽)的96.42%(P<0.05)。此外,SJPs具有较高的疏水性氨基酸含量(45.97%)、小分子肽含量(81.04%)以及胃肠道消化稳定性。分别通过急性灌胃建立酒精中毒模型和NIAAA法建立小鼠早期ALD模型评价其解酒护肝功效,结果表明:与酒精模型组相比,高剂量SJPs摄入将小鼠睡眠潜伏期延长65.32%,睡眠期缩短60.00%,增强了小鼠对急性酒精毒性的耐受性;此外,SJPs通过上调酒精代谢酶系活力(ADH和ALDH),加速酒精及其中间代谢产物乙醛的清除,降低其直接损伤;另一方面,高剂量SJPs摄入提高SOD酶活力(13.52%)和GSH含量(60.31%),脂质过氧化程度降低36.52%(MDA),肝脏TG和TC堆积分别减少37.74%和29.41%,肝功能AST和ALT分别恢复45.47%和45.73%,对早期肝损伤具有良好保护作用。本项工作为后续鉴定SJPs中发挥解酒护肝活性的关键肽组分和序列、采用计算机模拟等技术解析ADH激活肽构效关系、应用化学反应或生物合成方式探索ADH激活肽的高效制备及产业化应用奠定了前期理论基础,对于开发预防或改善急性酒精性肝损伤的营养保健食品具有指导意义。
[1] AXLEY P D, RICHARDSON C T, SINGAL A K.Epidemiology of alcohol consumption and societal burden of alcoholism and alcoholic liver disease[J].Clinics in Liver Disease, 2019, 23(1):39-50.
[2] LIEBER C S, RUBIN E, DECARLI L M.Hepatic microsomal ethanol oxidizing system (MEOS):Differentiation from alcohol dehydrogenase and NADPH oxidase[J].Biochemical and Biophysical Research Communications, 1970, 40(4):858-865.
[3] SEITZ H K, STICKEL F.Molecular mechanisms of alcohol-mediated carcinogenesis[J].Nature Reviews.Cancer, 2007, 7(8):599-612.
[4] WILLIAMS R, AITHAL G, ALEXANDER G J, et al.Unacceptable failures:The final report of the Lancet Commission into liver disease in the UK[J].The Lancet, 2020, 395(10219):226-239.
[5] ARGEMI J, VENTURA-COTS M, RACHAKONDA V, et al.Alcoholic-related liver disease:Pathogenesis, management and future therapeutic developments[J].Revista Espanola de Enfermedades Digestivas, 2020, 112(11):869-878.
[6] HE H, PENG S W, SONG X, et al.Protective effect of isoflavones and triterpenoid saponins from Pueraria lobata on liver diseases:A review[J].Food Science &Nutrition, 2021, 10(1):272-285.
[7] GIORDANO M, LUONGO G, DAVINELLI S, et al.Silybum marianum:Not just silymarin and flavonolignans[J].Records of Natural Products, 2021, 15(4):243-253.
[8] YU Y L, GUAN S Y, FENG M M, et al.Hepatoprotective effect of albumin peptide fractions from corn germ meal against alcohol-induced acute liver injury in mice[J].Foods, 2023, 12(6):1183.
[9] XIAO C Q, ZHAO M M, ZHOU F B, et al.Data on bioactive peptides derived from chicken hydrolysate with potential alcohol dehydrogenase stabilizing activity and in silico analysis of their potential activity and applicability[J].Data in Brief, 2020, 29:105163.
[10] 阙凡迪, 王娇燕, 王琼芬, 等.东海乌参肽对小鼠酒精性肝损伤及肠道菌群的调节作用[J].食品科学, 2023, 44(7):29-38.QUE F D, WANG J Y, WANG Q F, et al.Regulatory effect of Acaudina leucoprocta peptides on alcoholic liver injury and intestinal flora in mice[J].Food Science, 2023, 44(7):29-38.
[11] MAHGOUB S, ALAGAWANY M, NADER M, et al.Recent development in bioactive peptides from plant and animal products and their impact on the human health[J].Food Reviews International, 2023, 39(1):511-536.
[12] XIANG Z D, XUE Q, GAO P, et al.Antioxidant peptides from edible aquatic animals:Preparation method, mechanism of action, and structure-activity relationships[J].Food Chemistry, 2023, 404:134701.
[13] CUNHA S A, PINTADO M E.Bioactive peptides derived from marine sources:Biological and functional properties[J].Trends in Food Science &Technology, 2022, 119:348-370.
[14] SAIWONG S, AUTSAVAPROMPORN N, SIRIWOHARN T, et al.Enzymatic hydrolysis optimization for preparation of sea cucumber (Holothuria scabra) hydrolysate with an antiproliferative effect on the HepG2 liver cancer cell line and antioxidant properties[J].International Journal of Molecular Sciences, 2023, 24(11):9491.
[15] 刘文颖, 冯晓文, 李国明, 等.牡蛎低聚肽的结构表征及体外抗氧化作用[J].中国食品学报, 2021, 21(12):261-269.LIU W Y, FENG X W, LI G M, et al.Structure characterization and antioxidant effects in vitro of oyster oligopeptides[J].Journal of Chinese Institute of Food Science and Technology, 2021, 21(12):261-269.
[16] 刘钧发. 麻虾多肽制备及其抗氧化、抗疲劳的活性研究[D].广州:华南理工大学, 2015.LIU J F.Study on the preparation of shrimp peptide (Metapenaeus affinis) and its antioxidant and anti-fatigue activities[D].Guangzhou:South China University of Technology, 2015.
[17] 温庆仕, 魏荷芬, 周精卫, 等.一种高纯度小分子解酒护肝肽的制备[J].食品与发酵工业, 2023, 49(7):174-180.WEN Q S, WEI H F, ZHOU J W, et al.Preparation of a high purity small molecule anti-alcoholic liver protecting peptide[J].Food and Fermentation Industries, 2023, 49(7):174-180.
[18] 裴继伟. 扇贝高F值寡肽的制备及与中药材联合解酒护肝的体内外功效研究[D].烟台:鲁东大学, 2023.PEI J W.Preparation of scallop oligopeptides with high Fisher ratio and study on its effect in vivo and in vitro of anti-alcoholism and liver protection combined with traditional Chinese medicine[D].Yantai:Ludong University, 2023.
[19] 钟佳佳. 三角帆蚌肉护肝肽的制备及其抗小鼠急性酒精性肝损伤活性研究[D].湛江:广东海洋大学, 2020.ZHONG J J.Preparation of hepatoprotective peptide from Hyriopsis cumingii and its anti acute alcohol-induced liver injury in mice[D].Zhanjiang:Guangdong Ocean University, 2020.
[20] RANASINGHE R A S N, WIJESEKARA W L I, PERERA P R D, et al.Nutritional value and potential applications of jellyfish[J].Journal of Aquatic Food Product Technology, 2022, 31(5):445-482.
[21] PAN M F, LIU K X, YANG J Y, et al.Advances on food-derived peptidic antioxidants:A review[J].Antioxidants, 2020, 9(9):799.
[22] XIAO C Q, ZHOU F B, ZHAO M M, et al.Chicken breast muscle hydrolysates ameliorate acute alcohol-induced liver injury in mice through alcohol dehydrogenase (ADH) activation and oxidative stress reduction[J].Food &Function, 2018, 9(2):774-784.
[23] MINEKUS M, ALMINGER M, ALVITO P, et al.A standardised static in vitro digestion method suitable for food - an international consensus[J].Food &Function, 2014, 5(6):1113-1124.
[24] BERTOLA A, MATHEWS S, KI S H, et al.Mouse model of chronic and binge ethanol feeding (the NIAAA model)[J].Nature Protocols, 2013, 8(3):627-637.
[25] SIREGAR A S, NYIRAMANA M M, KIM E J, et al.Oyster broth concentrate and its major component taurine alleviate acute alcohol-induced liver damage[J].Food Science &Nutrition, 2022, 10(7):2390-2399.
[26] HASEBA T, DUESTER G, SHIMIZU A, et al.In vivo contribution of Class III alcohol dehydrogenase (ADH3) to alcohol metabolism through activation by cytoplasmic solution hydrophobicity[J].Biochimica et Biophysica Acta (BBA) - Molecular Basis of Disease, 2006, 1762(3):276-283.
[27] YIN M, IKEJIMA K, ARTEEL G E, et al.Glycine accelerates recovery from alcohol-induced liver injury[J].The Journal of Pharmacology and Experimental Therapeutics, 1998, 286(2):1014-1019.
[28] OBAYASHI Y, ARISAKA H, YOSHIDA S, et al.Proline protects liver from D-galactosamine hepatitis by activating the IL-6/STAT3 survival signaling pathway[J].Amino Acids, 2012, 43(6):2371-2380.
[29] HOU Y Q, WU Z L, DAI Z L, et al.Protein hydrolysates in animal nutrition:Industrial production, bioactive peptides, and functional significance[J].Journal of Animal Science and Biotechnology, 2017, 8:24.
[30] SULTAN S, HUMA N, BUTT M S, et al.Therapeutic potential of dairy bioactive peptides:A contemporary perspective[J].Critical Reviews in Food Science and Nutrition, 2018, 58(1):105-115.
[31] CABALLER A J.Current concepts in alcohol metabolism[J].Annals of Hepatology, 2003, 2(2):60-68.
A J.Current concepts in alcohol metabolism[J].Annals of Hepatology, 2003, 2(2):60-68.
[32] CHANG Y N, LI H, REN H, et al.Misclassification of chronic hepatitis B natural history phase:Insight from new ALT, AST, AKP, and GGT reference intervals in Chinese children[J].Clinica Chimica Acta, 2019, 489:61-67.
[33] SENTHILKUMAR R, NALINI N.Effect of Glycine on tissue fatty acid composition in an experimental model of alcohol-induced hepatotoxicity[J].Clinical and Experimental Pharmacology and Physiology, 2004, 31(7):456-461.
[34] TESCHKE R.Alcoholic liver disease:Alcohol metabolism, cascade of molecular mechanisms, cellular targets, and clinical aspects[J].Biomedicines, 2018, 6(4):106.
[35] KETNAWA S, WICKRAMATHILAKA M, LICEAGA A M.Changes on antioxidant activity of microwave-treated protein hydrolysates after simulated gastrointestinal digestion:Purification and identification[J].Food Chemistry, 2018, 254:36-46.
[36] CHEN J H, CUI C, ZHAO H F, et al.The effect of high solid concentrations on enzymatic hydrolysis of soya bean protein isolate and antioxidant activity of the resulting hydrolysates[J].International Journal of Food Science &Technology, 2018, 53(4):954-961.
[37] LIN Y L, TAI S Y, CHEN J W, et al.Ameliorative effects of pepsin-digested chicken liver hydrolysates on development of alcoholic fatty livers in mice[J].Food &Function, 2017, 8(5):1763-1774.