近年寻求绿色可再生能源成为一种热点,乙醇作为一种可再生能源物质备受关注[1]。乙醇生产主要以酵母发酵为主,而酵母菌株在糖浓度高于一定条件的情况下,倾向于酒精发酵,因此可以提高发酵体系的糖浓度,来保持较高的糖醇转化率[2]。而为了提高产酒率,工厂通过高浓度发酵生产乙醇,需要通过搅拌来保持物料均质,而酵母在有氧条件下亦可以发酵糖,这就保证其具有较高的发酵效率[3]。目前全球生产乙醇的大型工厂主要集中在国外,例如美国以玉米,甜菜等原料加工生产乙醇,巴西则以甘蔗为主。而发酵的方式主要集中在以蔗糖糖水发酵,并加入相关营养元素生产乙醇[4]。相关文献报道目前采用高浓度酒精发酵技术,发酵终点酒精度一般为13%左右,最高可达18%以上,且高浓度酒精的发酵不仅可以节约用水,还可以提高发酵效率,最终提高酒精产量[5-6]。但工厂高浓度发酵存在一定的缺点,较高的糖浓度影响了菌株的活性,且在发酵过程中温度波动范围较大,发酵终点乙醇大量积累影响酵母活性,进而影响糖醇转化率[7]。因此通过育种手段选育多耐性高产乙醇酿酒酵母,提高发酵效率,成为目前工业育种的一种潜在选择。
目前报道的菌株改良策略包括随机诱变、基因工程、代谢工程等手段[8],通过这些策略的应用,可获得一系列多耐性酵母从而提高乙醇产量,但工业应用较少。近年来,常温常压等离子诱变基因具有突变率高,且突变后不易恢复等特点,越来越多地被应用于工业诱变育种[9]。本文以酿酒酵母单倍体为出发菌株,通过常温常压等离子诱变(atmospheric and room temperature plasma mutagenesis,ARTP),经氯化三苯基四氮唑(2,3,5-triphenyltetrazolium chloride,TTC)显色初筛,温度压力复筛,最后经高糖发酵培养基三级筛选,获得了发酵性能较高的酿酒酵母单倍体菌株。并对其进行杂交,并模拟目前工厂生产乙醇的发酵方式,经发酵验证,最终获得在高糖和高温条件下,发酵性能较高的突变体杂交双倍体酿酒酵母菌株。
1 材料与方法
1.1 材料试剂及设备
实验菌株:二倍体酿酒酵母AE2、M和S,单倍体酿酒酵母,AE2α、AE2a、Mα、Ma、Sα和Sa,菌株均保存于湖北安琪酵母生物技术有限公司,微生物工业育种与酿酒技术中心。
常用试剂:2×Fine Taq PCR Super Mix、DL5000Marker,武汉有度生物科技公司;MAT-F:5′-AGTCACATCAAGATCGTTTATGG-3′、MAT-a:5′-ACT-CCACTTCAAGTAAGAGTTTG-3′、MAT-α:5′-GCACGGAATATGGGACTACTTCG-3′,擎科生物科技公司;百钻蔗糖,安琪酵母股份有限公司;FM888酵母抽提物、营养盐,湖北宜昌安琪酵母生物技术有限公司;胰蛋白胨,苏州瑞诺德生物科技有限公司;KH2PO4,分析纯,科密欧试剂公司;MgSO4,分析纯,西陇科学公司;琼脂粉,北京奥博星生物技术有限公司。
主要实验设备:Foss酒度分析仪,福斯中国公司;Centrifuge 5910R高速离心机,德国艾本德公司;酶标仪,美国BioTek仪器公司;ARTP-P常温常压等离子诱变仪,天木生物;实时生物生长曲线分析系统,杰灵科学仪器公司;abi SimpliAmp PCR仪,上海旦鼎国际贸易有限公司;1600照胶仪,Tanon公司;EPS300恒温恒压电泳仪,Tanon公司。
1.2 培养基
一级种子培养基(g/L):蔗糖20,胰蛋白胨20,酵母抽提物10(固态加入琼脂粉20)。
二级种子培养基(g/L):蔗糖60,胰蛋白胨22,酵母抽提物18。
TTC上层培养基(g/L):TTC 0.05,葡萄糖5.0,琼脂粉15.0,水1 000 mL。(待冷却到60 ℃左右,再加入TTC)。
TTC下层培养基(g/L):葡萄糖20.0,胰蛋白胨8,酵母抽提物5,KH2PO4 1.0,MgSO4 0.4,琼脂粉30.0,蒸馏水定容1 000 mL[10]。
发酵筛选培养基(g/L):蔗糖300,蛋白胨22,酵母抽提物18。
复合糖水发酵培养基(g/L):蔗糖糖水300,营养盐8。
1.3 实验方法
1.3.1 单倍体ARTP诱变
取10 μL菌悬液于直径5 mm的无菌不锈钢载片上,常温常压等离子诱变仪分别处理0、20、50、70、100、125、150 s,每次诱变结束后将不锈钢载片置于含990 μL无菌生理盐水的1.5 mL,EP管中,在漩涡器上振荡洗涤1 min,将诱变菌洗脱下来。分别对上述菌液进行梯度稀释,均匀涂布固态一级种子培养基平板,30 ℃,倒置培养2~3 d,确定最佳诱变时间,绘制诱变致死曲线[11-12]。
1.3.2 单倍体耐高温生长实验
6株单倍体,菌液OD600值约为0.9,接种量1%,一级种子培养基,分别在37、39、41、42、43 ℃,200 r/min条件下,培养18 h,酶标仪测OD600值,每组3个平行,计算均值和标准差。
1.3.3 单倍体诱变筛选
1.3.3.1 TTC法初筛
将最佳诱变时间的菌液,无菌生理盐水稀释至10-8,均匀涂布TTC下层培养基,35 ℃条件下,培养2~3 d,待TTC上层培养基冷却至60 ℃左右,加入TTC,倒入TTC下层平板,30 ℃显色2~3 h,挑选颜色为深红色菌株作为下一步筛选菌株[13-14]。
1.3.3.2 高温复筛
挑选深红色菌株,接种96孔板,每孔400 μL,一级种子培养基,放置在40、41 ℃环境下振荡培养2 d,酶标板中每孔加入100 μL菌液,测OD600值,挑选OD600值较原始菌株较大菌株,活化并接种发酵筛选培养基[15]。
1.3.3.3 发酵筛选培养基三级筛选
经TTC初筛,40、41 ℃复筛,挑选优势单倍体,接种发酵培养基,菌液初始OD600值约为0.9,接种量2%,35 ℃,转速200 r/min,发酵4 d,测发酵终点酒精度及残糖。
1.3.4 优势单倍体杂交及倍型鉴定实验
1.3.4.1 优势单倍体杂交
将筛选获得的优势单倍体菌株按照不同配型,不同亲本来源,接种一级种子培养基进行组合杂交,均匀涂布固体一级种子培养基平板,35 ℃培养2 d,挑选菌落直径较大拟双倍体菌株验证其倍型。
1.3.4.2 杂交拟双倍体菌落PCR验证
菌落DNA模板提取参照高温破壁提取法并做优化,PCR小管加入20 μL NaOH溶液(0.5 mmol/L),直接挑取适量单菌落菌体与NaOH均匀混合,100 ℃沸水浴,10 min,离心收集上清液作为DNA模板[16]。单倍体配型鉴定参照封冰等[17]三引物PCR实验方法,经20 g/L琼脂糖凝胶电泳,PCR产物仅有一条544 bp条带的为a型单倍体酵母细胞,PCR产物仅有一条404 bp条带的为α型单倍体酵母细胞,两条产物都有的为二倍体细胞[18]。
1.3.5 杂交双倍体发酵筛选实验
1.3.5.1 酵母乳制备
500 mL摇瓶,200 mL二级种子培养基,接种量2%,35 ℃,200 r/min过夜培养,4 500 r/min,离心8 min收集菌体,等比例无菌水稀释得到酵母乳。
1.3.5.2 复合糖水发酵培养基筛选实验
250 mL摇瓶中加入100 mL 300 g/L蔗糖水,加入0.8 g营养盐,接种酵母乳4 g,35 ℃,200 r/min,振荡培养4 d,用酒度分析仪测发酵终点酒精度及残糖,与亲本双倍体进行比较,挑选酒精度较高且总残糖较低的菌株保种留存。
1.3.6 优势双倍体与亲本双倍体耐受性实验
1.3.6.1 耐高温生长实验
48孔板,每孔一级种子培养基1 000 μL,菌液OD600值约为0.9,接种量1%,分别在38、40、41、42 ℃条件下,全自动生长仪,振荡培养3 d,记录OD680数值,绘制生长曲线图[19]。
1.3.6.2 耐乙酸生长实验
配制乙酸体积分数为0.4%的一级种子培养基,48孔板,每孔培养基1 000 μL,菌液OD600值约为0.9,接种量1%,30 ℃条件下,全自动生长仪,振荡培养3 d,记录OD680数值,绘制生长曲线图。
1.3.6.3 耐乙醇生长实验
配制乙醇体积分数为10%的一级种子培养基,48孔板,每孔培养基1 000 μL,菌液OD600值约为0.9,接种量1%,30 ℃条件下,振荡全自动生长仪,培养3 d,记录OD680数值,绘制生长曲线图。
1.3.6.4 耐乳酸生长实验
配制乳酸体积分数为5%的一级种子培养基,48孔板,每孔培养基1 000 μL,菌液OD600值约为0.9,接种量1%,30 ℃条件下,全自动生长仪,振荡培养3 d,记录OD680数值,绘制生长曲线图。
1.3.6.5 耐乳酸乙酸生长实验
配制乙酸体积分数为0.1%,乳酸体积分数为4%的一级种子培养基,48孔板,每孔培养基1 000 μL,菌液OD600值约为0.9,接种量1%,30 ℃条件下,全自动生长仪,振荡培养3 d,记录OD680数值,绘制生长曲线图。
1.3.7 优势杂交双倍体与亲本不同温度复合糖水发酵培养基发酵实验
500 mL摇瓶中加入400 mL 300 g/L蔗糖糖水,加入3.2 g营养盐,接种酵母乳9 g,分别在30、35 ℃条件下静止发酵5 d,期间记录单日失重,绘制发酵失重曲线,用酒度分析仪测发酵终点酒精度及残糖。
1.3.8 统计分析
实验数据采用Microsoft Excel 2019,Origin 2021等数据处理系统进行分析
2 结果与分析
2.1 单倍体ARTP诱变结果及分析
由图1分析可知单倍体菌株AE2α、AE2a、Mα、Ma、Sα、Sa,在诱变时间分别为120、100、80、50、100、120 s时,致死率均达到85%以上。研究表明,诱变育种致死率在80%~90%,育种正突变率高[20]。因此,本研究确定上述时间为后续诱变时间。
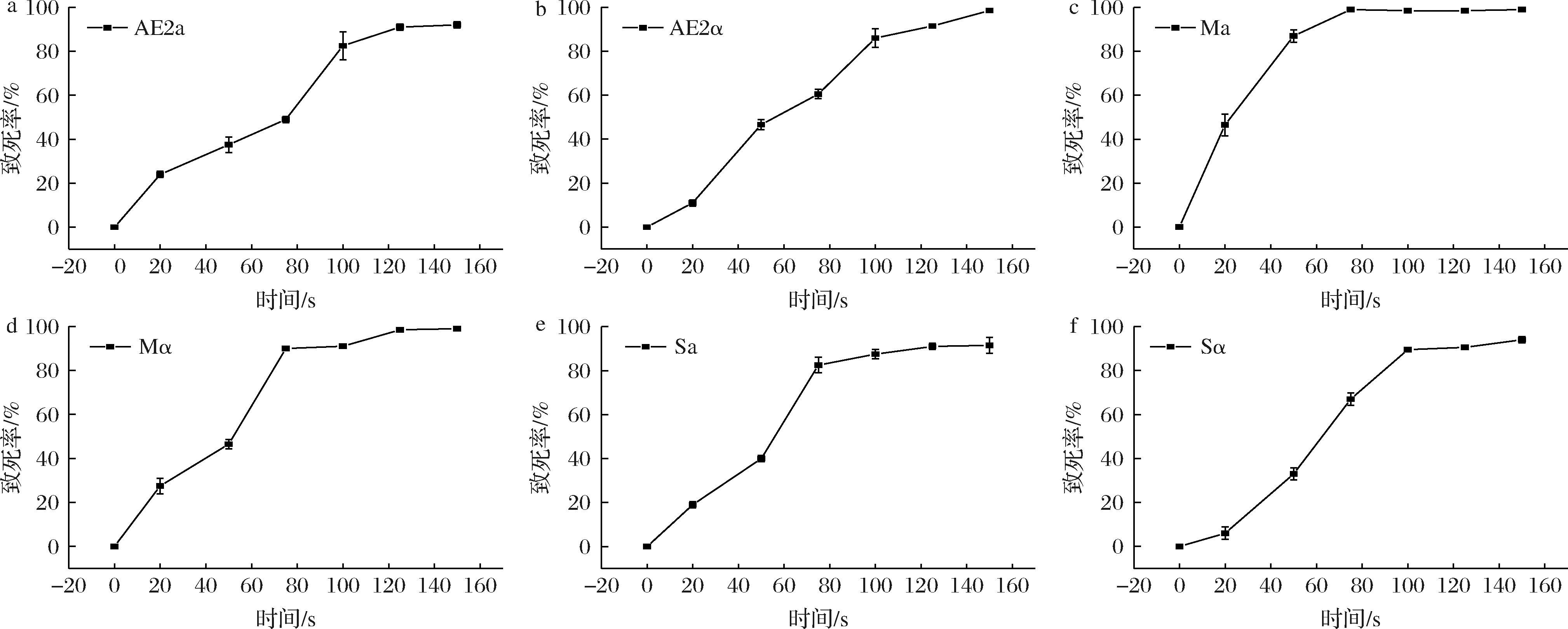
a-单倍体AE2a致死曲线;b-单倍体AE2α致死曲线;c-单倍体Mα致死曲线;d-单倍体Ma致死曲线;e-单倍体Sa致死曲线;f-单倍体Sα致死曲线
图1 六株单倍体ARTP致死率曲线图
Fig.1 Lethal rate curve of six haploid strains induced by ARTP
2.2 六株单倍体耐高温实验结果及分析
如图2所示,不同菌株的耐高温差异较大,37 ℃时,AE2a、AE2α、Ma、Mα、Sa、Sα,OD600值分别为1.13、1.0、0.98、0.98、1.0、1.0。以37 ℃为参照,菌株OD600值减少过半,此温度对菌株生长抑制较为明显,因此AE2a、AE2α、Ma、Mα、Sa、Sα的复筛温度分别选择为41、41、40、40、41、41 ℃。
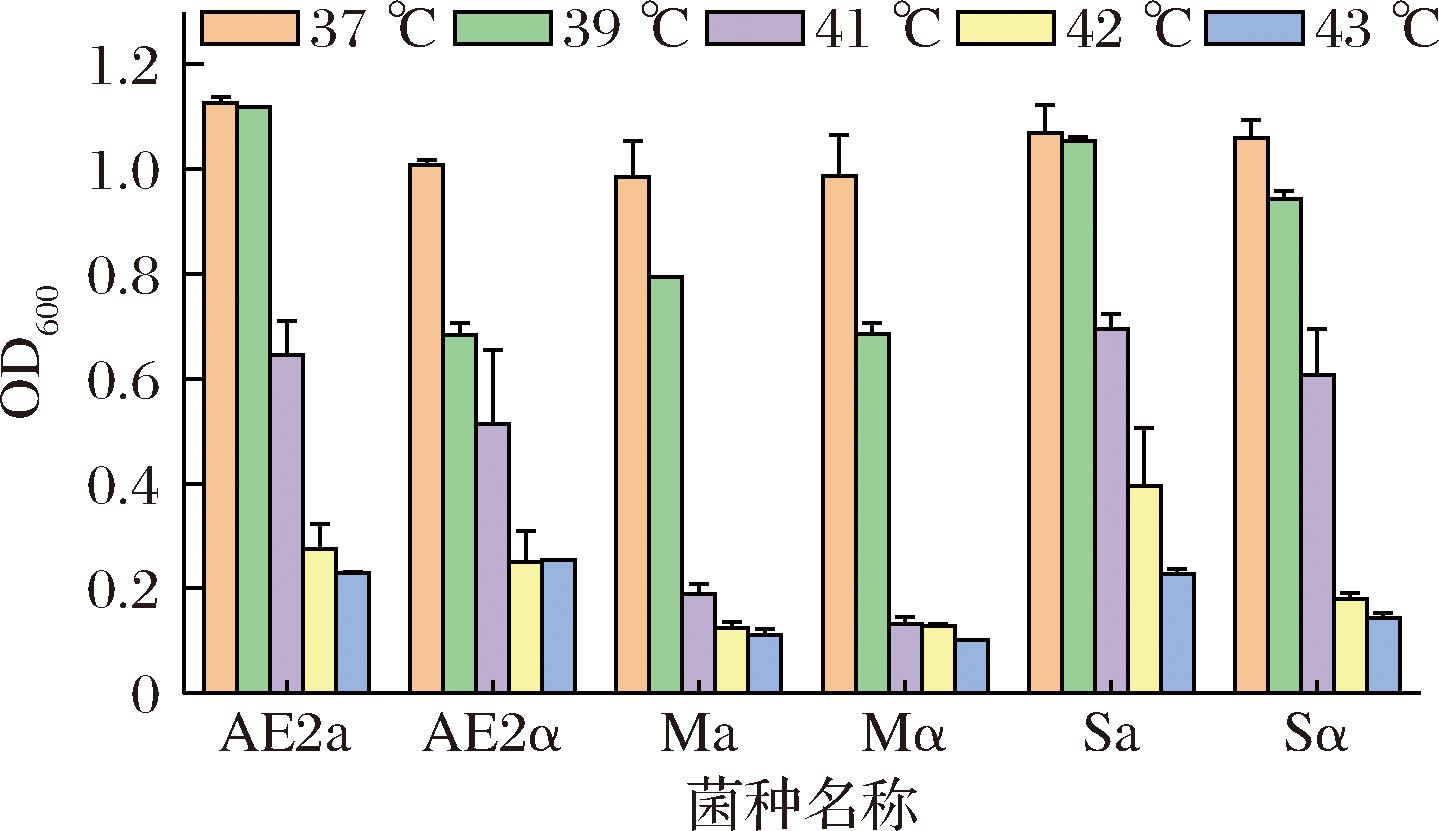
图2 六株单倍体不同温度生长状况柱状图
Fig.2 Column chart of growth conditions at different temperatures for six haploid strains
2.3 TTC初筛及高温复筛筛选实验结果及分析
为筛选潜在高产乙醇突变体单倍体菌株,对诱变单倍体菌株经TTC下层培养基培养,再进行TTC菌落显色,挑选深红色单菌落,及潜在高产乙醇单倍体菌株。结果如图3所示,菌株显色具有明显差异,其中颜色深红色菌株做标记,作为下一步筛选实验菌株。
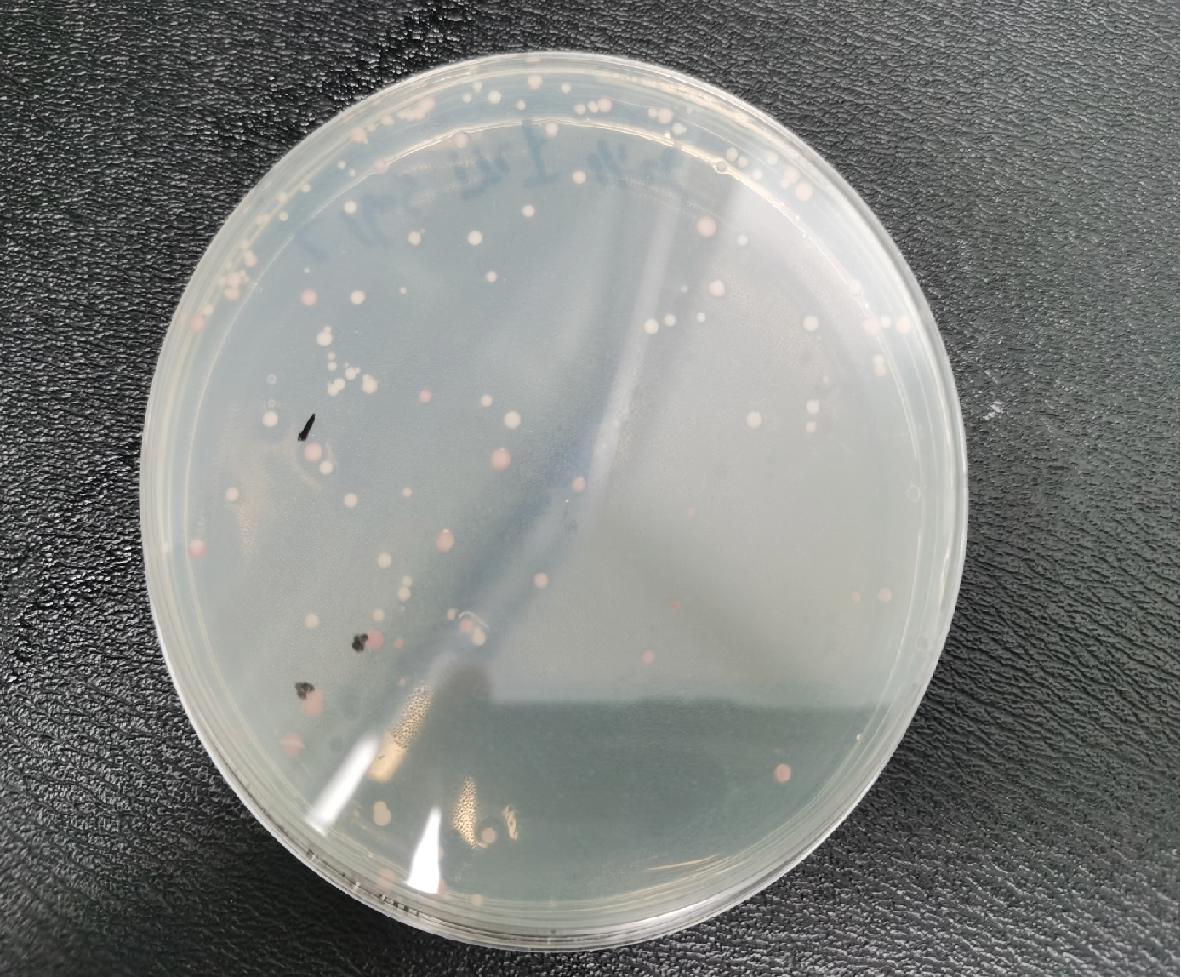
图3 TTC平板显色结果
Fig.3 Coloration results of TTC plates
在高产乙醇菌株的基础上,为筛选出耐温性能突出菌株,对TTC初级筛选菌株进行耐温生长实验,对比与原始菌株生长差异,结果如图4所示,酶标板96孔板,竖列编号为A~H,横排编号为1~12,横竖交错正好为96孔,每孔数值大小分别反应菌株在温度压力条件下生长状况。深黄色背景为原始菌株,对比OD600值差异,经诱变的菌株在耐温性能方面得到了一定程度的提升,表格红色背景标记菌株被确定为下一步实验菌株。
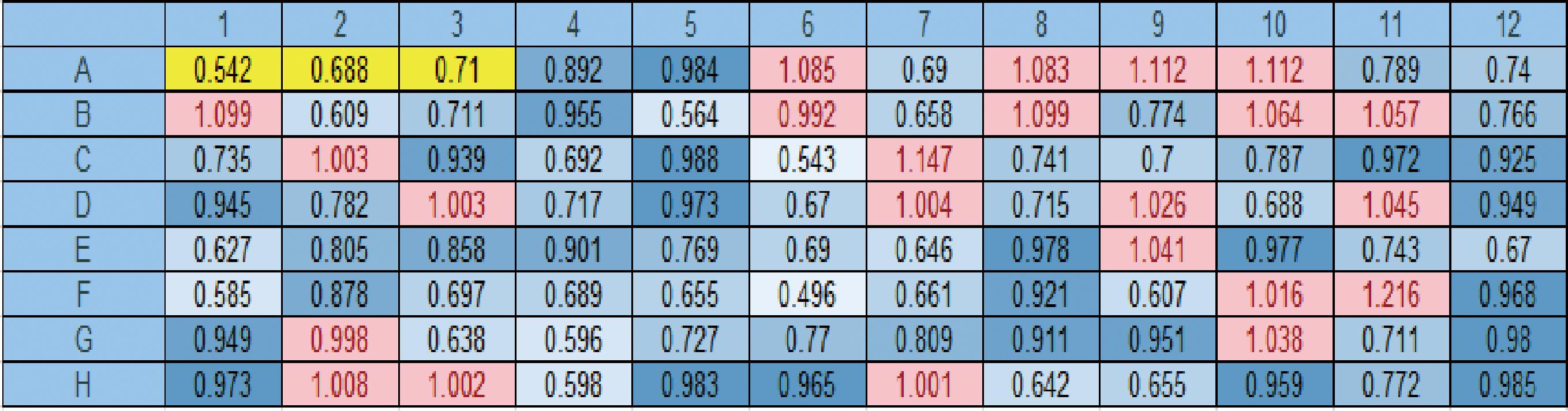
图4 高温复筛酶标仪OD600值差异结果
Fig.4 Differential results of OD600 values in high-temperature rescreening enzymatic analyzer
2.4 发酵筛选培养基三级筛选实验结果及分析
诱变单倍体菌株经TTC法显色初筛,温度压力复筛,两级筛选获得的良性突变株菌株经发酵筛选培养基经三级筛选发酵,结果如图5所示,获得9株优势突变体单倍体菌株,其中酒精度提高率在6%~16%,总残糖降幅较高在23%~96%,诱变筛选获得的菌株相比于出发菌株均有较高发酵产乙醇能力。以9株优势突变体单倍体菌株为杂交出发菌株,采用(Aα4,Aα5)×(MaD4,MaD5),(Aα4,Aα5)×(Sa5,Sa7),(MαD2,MαD12)×(MaD4,MaD5),(MαD2,MαD12)×(Sa5,Sa7),(Sα6)×(MaD4,MaD5),(Sα6)×(Sa5,Sa7)6种组合方式,进一步开展优势突变单倍体酿酒酵母的杂交实验。
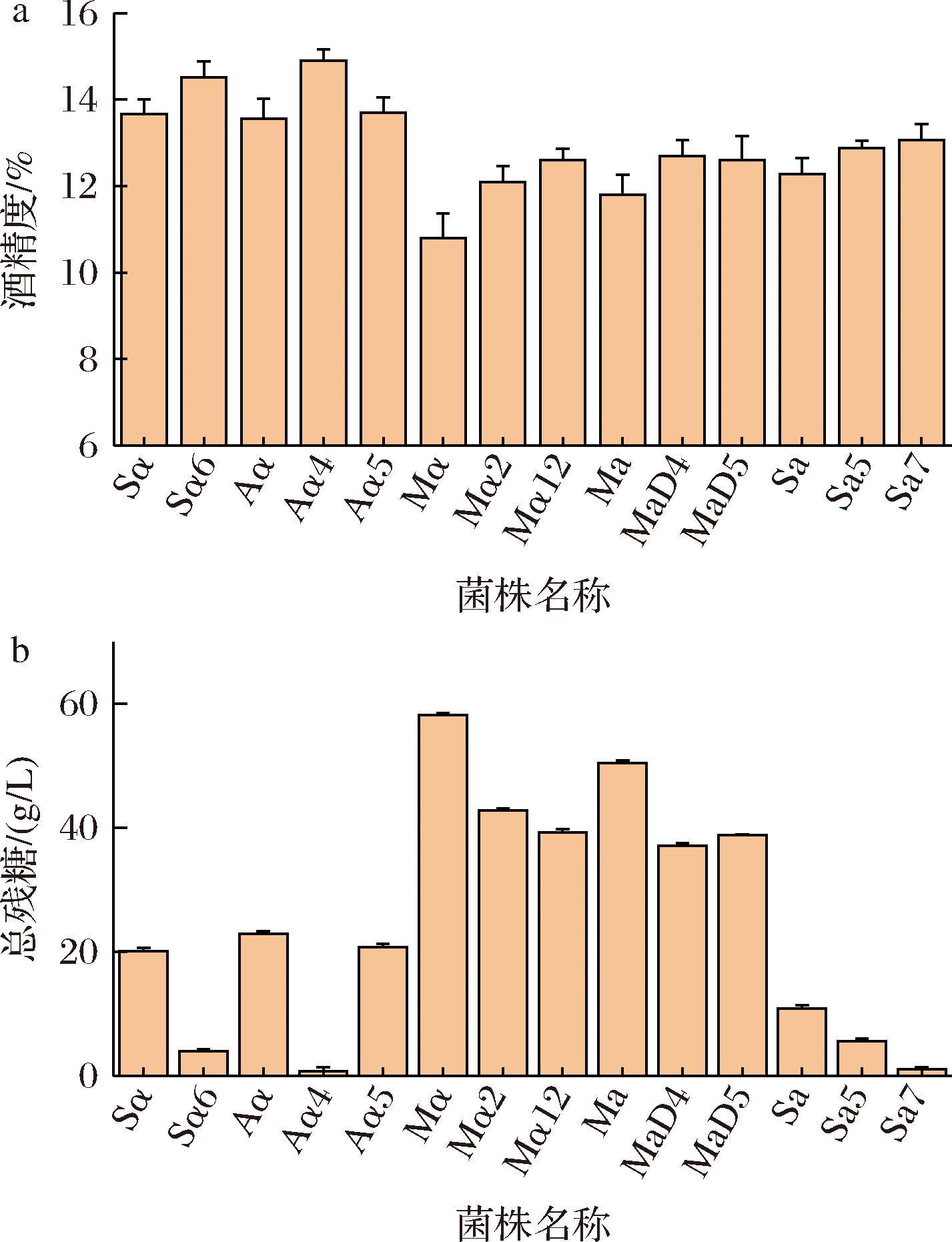
a-发酵终点酒度;b-发酵终点总残糖
图5 优势突变单倍体及出发菌株,发酵筛选培养基发酵终点酒度及总残糖对比柱状图
Fig.5 Comparative column chart of final alcohol content and total residual sugar in fermentation screening medium for dominant mutated haploid and parental strains
注:原始菌株编号为分别为Aα、Mα、Ma、Sα、Sa,对应产酒精效率较高突变体菌株,分别编号为Aα4、Aα5、MαD2、MαD12、MaD4、MaD5、Sα6、Sa5、Sa7。
2.5 优势突变单倍体杂交实验及鉴定结果分析
经三引物PCR扩增菌株DNA条带,2%琼脂糖凝胶电泳,对挑选的杂交菌株进行倍性验证,如图6所示,在1~48泳道中,3、8~17、23~27、34~36、45泳道条带为两条,其余泳道均显示为一条带,且两条条带位置分别在400、550 bp附近,在鉴定的48株双倍体中,最终20株被确定为双倍体。
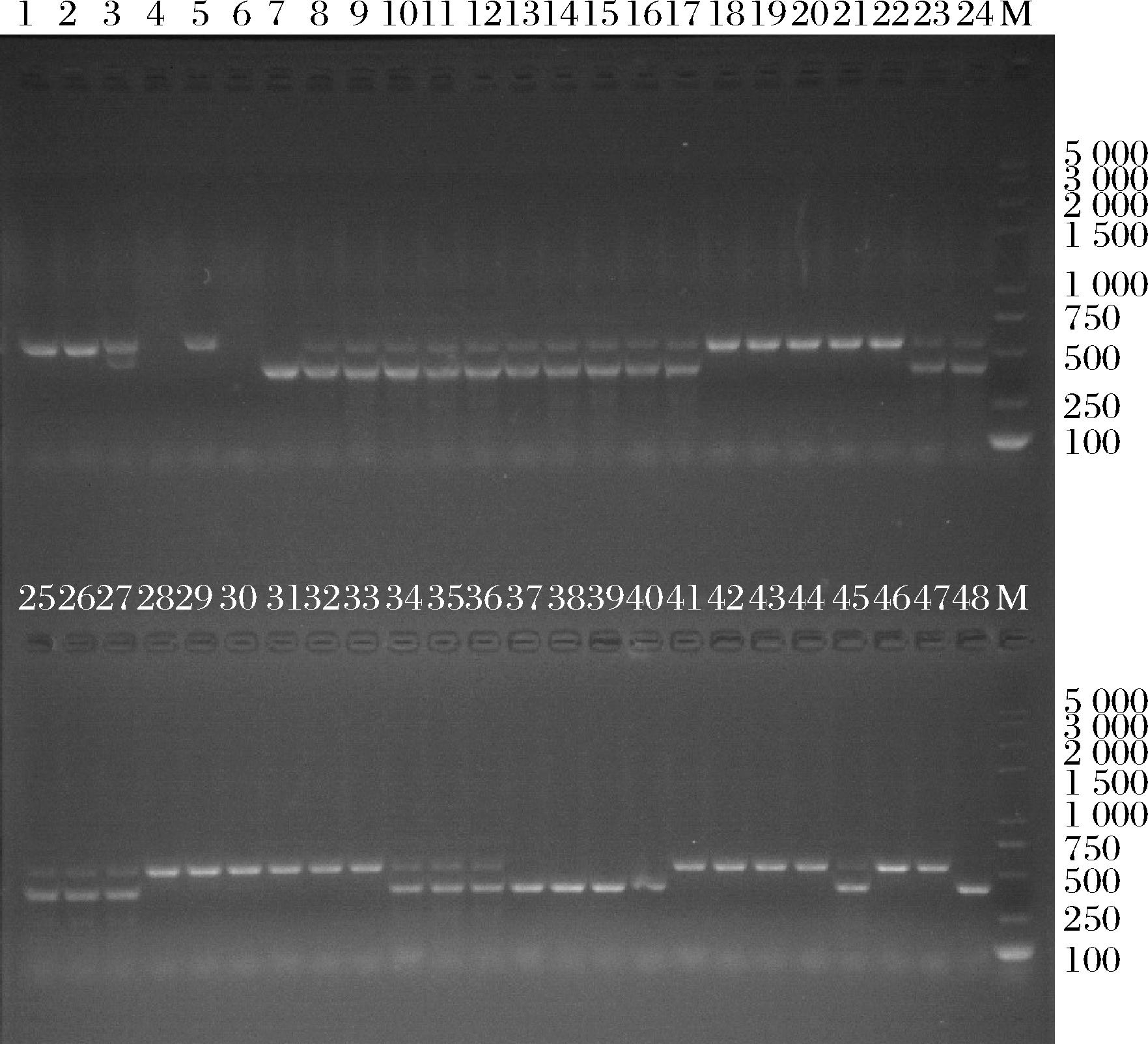
图6 琼脂糖凝胶电泳DNA条带图
Fig.6 Agarose gel electrophoresis DNA banding pattern
注:1~48泳道为拟双倍体DNA总量,M为DL5000 Marker,DNA总量。
2.6 杂交双倍体发酵筛选实验结果与分析
如图7所示,通过对20株双倍体进行复合糖水发酵培养基发酵筛选,最终获得一株产酒效率较高,且发酵终点残糖较低的杂交双倍体菌株,此菌株为AE2菌株α型单倍体与M菌株a型单倍体杂交而来,菌株编号为C6。在35 ℃、100 mL体系,复合糖水发酵培养基,150 r/min发酵条件下,菌株C6发酵终点酒精度及总残糖分别15.9%、8.4 g/L,相比于亲本菌株AE2和M,发酵终点酒精及总残糖(12.65%、58.1 g/L和14.61%、30.5 g/L),酒精度分别提升25.7%和8%,总残糖降幅分别为5.9、2.6倍。
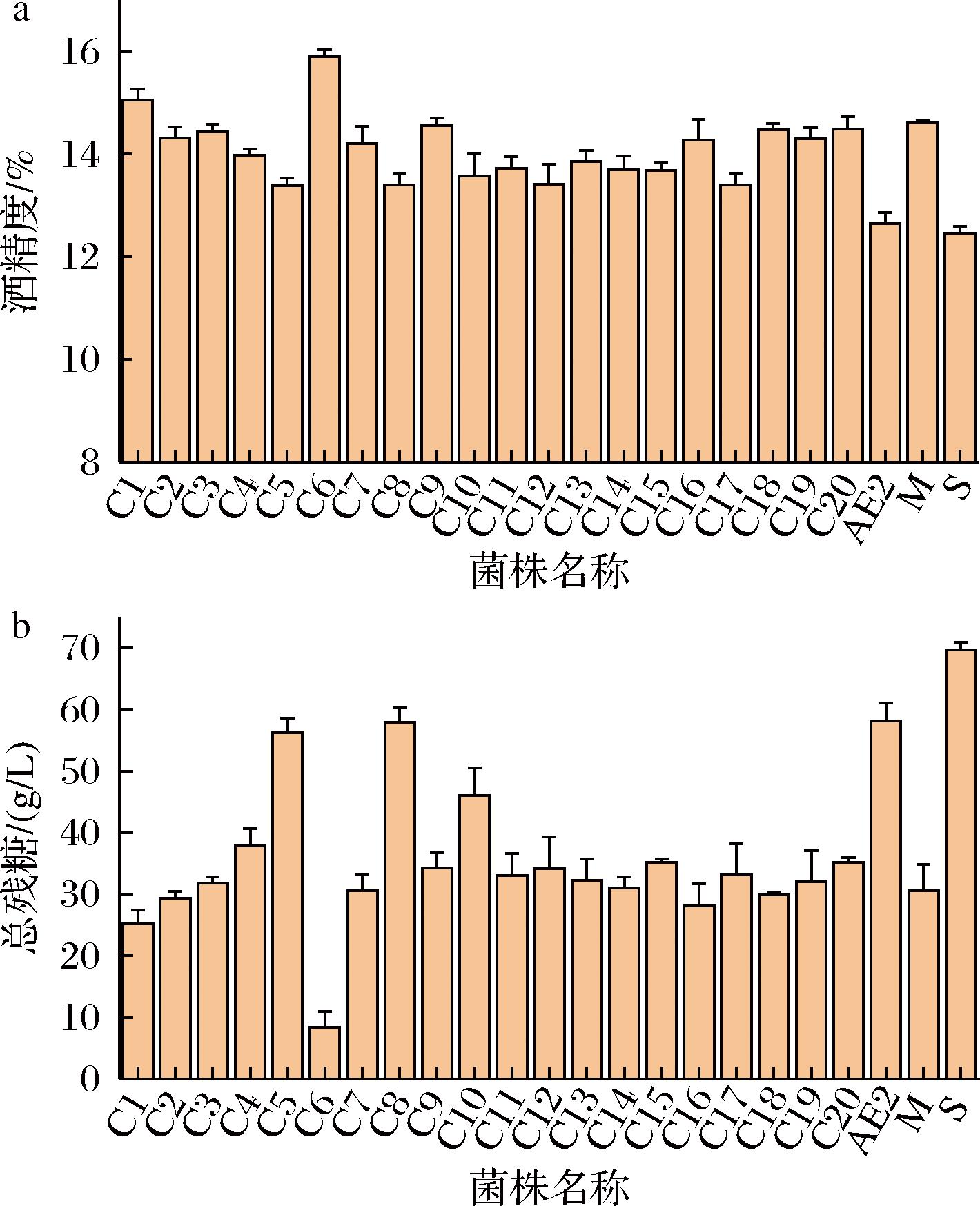
a-发酵终点酒度;b-发酵终点总残糖
图7 杂交双倍体与亲本复合糖水发酵培养基发酵终点酒度及总残糖柱状图
Fig.7 Column chart of final alcohol content and total residual sugar in fermentation of hybrid diploids and parental composite sugar wort medium
2.7 优势双倍体与亲本双倍体菌株耐受性对比实验及分析
如图8所示,菌株C6在高温条件下耐受性得到显著提高,38、40、41、42 ℃时,C6菌株生长速率,最终生物量均高于亲本菌株,生物量增幅在1.2~12倍,其中40 ℃条件下增幅较为明显,C6、AE2、M菌株平稳期OD680值分别为为4.12、0.35、1.15。

a-38 ℃生长曲线;b-40 ℃生长曲线;c-41 ℃生长曲线;d-42 ℃生长曲线
图8 杂交双倍体与亲本双倍体菌株不同温度生长曲线
Fig.8 Growth curves at different temperatures for hybrid diploids and parental diploids strains
通过不同培养基对菌株C6、AE2、M进行耐受性生长性能评估。如图9所示,C6菌株在10%乙醇、4%乳酸+0.1%乙酸、5%乳酸、0.4%乙酸4种胁迫条件下均能生长,且生长状况均优于亲本菌株。特别是对醇的耐受性提高较为明显。C6、AE2、M菌株在10%乙醇压力条件下,平稳期OD680值分别为4.99、4.39、1.3,相比亲本菌株平稳期生物量分别提高1.36、2.8倍。

a-10%乙醇;b-0.4%乙酸;c-5%乳酸;d-4%乳酸+0.1%乙酸
图9 杂交双倍体与亲本双倍体菌株30 ℃条件下不同压力一级种子培养基生长曲线图
Fig.9 Growth curves of hybrid diploids and parental diploid strains in primary seed medium under different pressures at 30 ℃
2.8 优势杂交双倍体复合糖水发酵培养基发酵实验结果及分析
如图10所示,C6菌株发酵性能优于亲本菌株。在35 ℃条件下,C6菌株最终酒精度为14.6%,亲本菌株AE2和M的酒精度分别为12.82%和13.72%,酒精度分别较亲本菌株提高13.8%和6.4%;菌株AE2、M、C6发酵终点总残糖分别57.5、49.5、38 g/L,相较于亲本总残糖下降;质量损失部分主要以CO2为主,而CO2的产生量与乙醇产率呈正相关;分析发酵质量损失曲线,菌株AE2、M、C6第1天CO2产生速率分别为1.33、1.16、1.29 g/h,第2天则分别为0.48、0.61、0.62 g/h,C6菌株相比亲本菌株AE2发酵后期具有较高的乙醇产率,相比于亲本M则发酵前期具有较高的遗传产率,发酵的3~5 d,随着酒度积累乙醇产率都有所降低。AE2、M、C6菌株5 d累积质量损失分别为49.21、51.14、53.82 g。30 ℃条件下,C6菌株复合糖水发酵培养基发酵酒精度可达17.9%;AE2和M菌株酒精度分别为17.38%和17.56%,发酵终点总残糖均低于3 g/L;C6、AE2和M菌株5 d累计质量损失分别为59.64、59.36、58.62 g。相比35 ℃同等条件下,C6菌株相比于亲本菌株发酵效率更高。
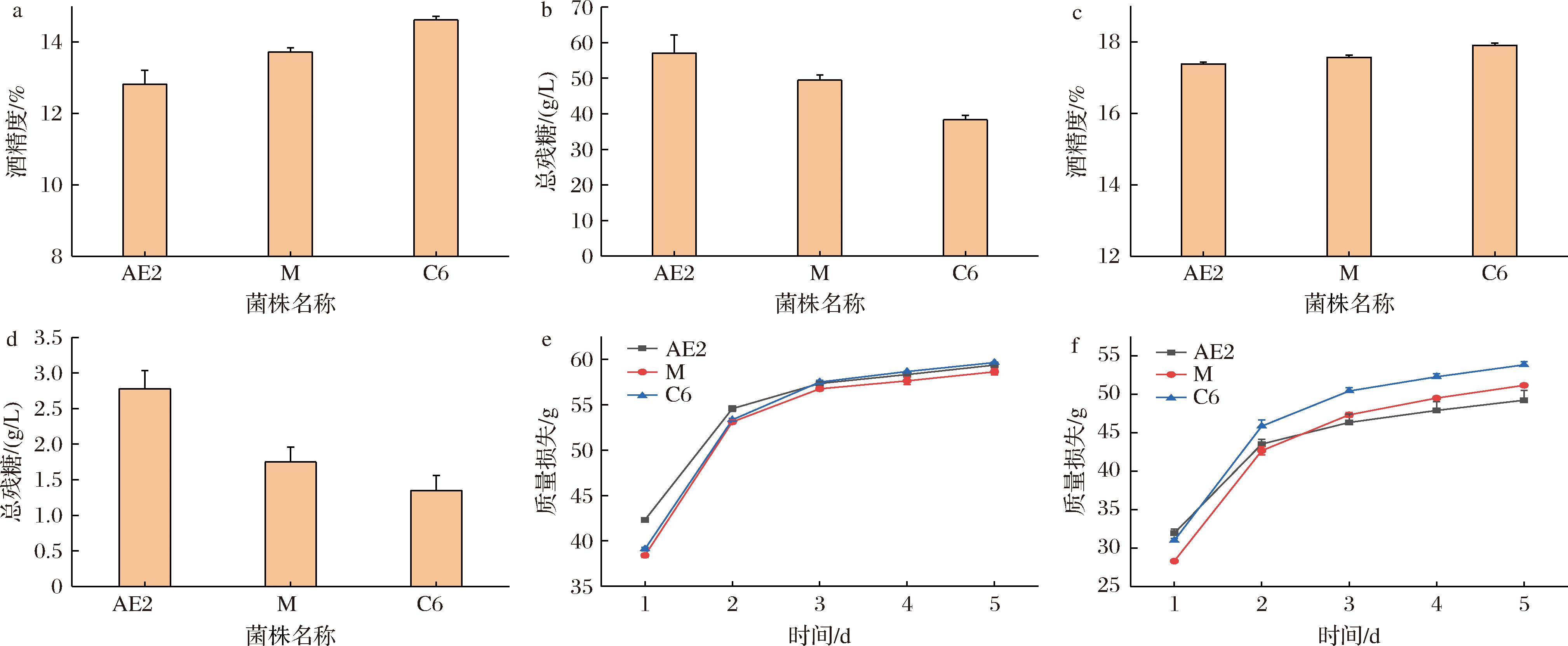
a-35 ℃发酵终点酒精度;b-35 ℃发酵终点总残糖;c-30 ℃发酵终点酒精度;d-30 ℃发酵终点总残糖;e-30 ℃发酵质量损失曲线;f-35 ℃发酵质量损失曲线
图10 杂交双倍体复合糖水发酵培养基发酵酒精度,总残糖,失重曲线图
Fig.10 Curves of alcohol content, total residual sugar, and weight loss during fermentation in hybrid diploids composite sugar wort medium
3 结论
传统诱变以二倍体酿酒酵母为出发菌株,但二倍体菌株稳定性较高,基因组经外界压力不易产生突变,难以筛选到良性突变,而单倍体酵母菌株稳定性较低,易受外界压力影响产生突变,经诱变筛选易获得良性突变体。
本研究以单倍体酿酒酵母为出发菌株,进行常温常压等离子诱变,并建立筛选体系,最终获得不同配型高产乙醇单倍体酿酒酵母共9株。其中a型单倍体4株,α型单倍体5株,并对9株高产乙醇单倍体酿酒酵母菌株进行组合杂交实验,经三引物法鉴定,最终获得20株成功杂交为双倍体的菌株。经复合糖水发酵培养基发酵对比,最终筛选出1株产酒较高的菌株,编号为C6。C6菌株与亲本菌株AE2和M分别进行耐温、耐酸、耐醇性能的评估,在41 ℃以内,C6菌株相比亲本菌株具有较高的耐温性能,其中40 ℃条件下增幅较为明显,C6、AE2和M菌株平稳期OD680值分别为为4.12、0.35、1.15。同时耐酸,耐醇性能均能得到一定程度的提升。整体而言,经诱变杂交的C6菌株,在高产乙醇的同时,具有较高的耐酸、耐醇性能。C6菌株在35 ℃,500 mL体系复合糖水发酵培养基发酵条件下酒精度为14.6%,在同等条件下,亲本菌株AE2和M,酒精度分别为12.82%和13.72%,分别提高了13.8%和6.4%,且总残糖,均低于亲本菌株,分析质量损失曲线可知,C6菌株具有较高的酒精生产速率,在30 ℃条件下发酵酒精度可达17.9%,表明C6菌株具有较高的发酵效率。
工业化发酵产乙醇过程中温度波动较大,同时工业发酵过程中酵母存在酸胁迫压力,可能影响最终产酒率,而本研究获得的菌株C6,具有较高的耐温性能,且在耐酸性能方面亦得到提升,可以维持较高的发酵效率,发酵后期乙醇的积累也会对酵母活性产生影响,C6菌株同时具有较高的乙醇耐受性。目前国外酒厂主要以复合糖水的发酵方式生产酒精,本研究模拟工厂的发酵条件进行高浓度酒精发酵,具有很高的实际应用价值。后期会对其进行不同糖质原料的发酵性能评估,并结合实验室驯化手段进一步提升性能,从而实现工业化生产。
[1] 夏苗, 胡猛, 黄益平, 等.生物燃料乙醇脱水渗透汽化膜改性方法研究进展[J].当代化工研究, 2022(13):43-45.XIA M, HU M, HUANG Y P, et al.Research progress on modification methods of bio-ethanol dehydration pervaporation membrane materials[J].Modern Chemical Research, 2022(13):43-45.
[2] MALAIRUANG K, KRAJANG M, SUKNA J, et al.High cell density cultivation of Saccharomyces cerevisiae with intensive multiple sequential batches together with a novel technique of fed-batch at cell level (FBC)[J].Processes, 2020, 8(10):1321.
[3] WU B, WANG Y W, DAI Y H, et al.Current status and future prospective of bio-ethanol industry in China[J].Renewable and Sustainable Energy Reviews, 2021, 145:111079.
[4] JACOBUS A P, GROSS J, EVANS J H, et al.Saccharomyces cerevisiae strains used industrially for bioethanol production[J].Essays in Biochemistry, 2021, 65(2):147-161.
[5] CHU-KY S, PHAM T H, BUI K L T, et al.Simultaneous liquefaction, saccharification and fermentation at very high gravity of rice at pilot scale for potable ethanol production and distillers dried grains composition[J].Food and Bioproducts Processing, 2016, 98:79-85.
[6] 张强. 高浓度酒精发酵技术研究进展[J].酿酒科技, 2019(3):102-106.ZHANG Q.Research progress in high-gravity ethanol fermentation technology[J].Liquor-Making Science &Technology, 2019(3):102-106.
[7] 王卫国, 张仟伟, 赵永亮, 等.酿酒酵母的选育及其应用研究进展[J].河南工业大学学报(自然科学版), 2015, 36(6):104-112.WANG W G, ZHANG Q W, ZHAO Y L, et al.Progress on the research of Saccharomyces cerevisiae’s breeding and its applications[J].Journal of Henan University of Technology (Natural Science Edition), 2015, 36(6):104-112.
[8] ADEBAMI G E, KUILA A, AJUNWA O M, et al.Genetics and metabolic engineering of yeast strains for efficient ethanol production[J].Journal of Food Process Engineering, 2022, 45(7):e13798.
[9] 陆欢, 沈玲, 尚晓冬, 等.常压室温等离子体技术在微生物诱变育种中的研究进展[J].生物学杂志, 2023, 40(4):92-97.LU H, SHEN L, SHANG X D, et al.Application of atmospheric and room temperature plasma mutagenesis in microbial and edible fungi mutation breeding[J].Journal of Biology, 2023, 40(4):92-97.
[10] 王犁烨, 王浩臣, 马珊, 等.常压室温等离子体选育高产酒精及酸的酿酒酵母[J].食品与机械, 2019, 35(5):26-31.WANG L Y, WANG H C, MA S, et al.Breeding of Saccharomyces cerevisiae high-yield of alcohol and acid by atmospheric room temperature plasma[J].Food &Machinery, 2019, 35(5):26-31.
[11] 孙可澄, 尹花, 赵鑫锐, 等.多轮ARTP诱变快速筛选低产乙醛工业啤酒酵母[J].食品与发酵工业, 2021, 47(15):56-62.SUN K C, YIN H, ZHAO X R, et al.Rapid screening of industrial brewer’s yeast with low acetaldehyde yield by multi-round ARTP mutagenesis[J].Food and Fermentation Industries, 2021, 47(15):56-62.
[12] 洪霞, 苟敏, 汤岳琴.基于常压室温等离子体诱变提高马克斯克鲁维酵母的乙醇耐受性[J].当代化工研究, 2022(24):60-63.HONG X, GOU M, TANG Y Q.ARTP mutagenesis to improve ethanol tolerance of Kluyveromyces marxianus[J].Modern Chemical Research, 2022(24):60-63.
[13] 黄庆, 苏圆媛, 左勇, 等.耐受高浓度乙醇酿酒酵母的定向驯化及其在桑葚果酒中的应用初探[J].食品与发酵工业, 2023, 49(12):166-178.HUANG Q, SU Y Y, ZUO Y, et al.Directional domestication of Saccharomyces cerevisiae tolerant to high concentration ethanol and its application in mulberry wine brewing[J].Food and Fermentation Industries, 2023, 49(12):166-178.
[14] 徐俊, 雍晓雨, 费文斌, 等.基于TTC染色法的高活力酵母细胞定量筛选[J].食品与发酵工业, 2014, 40(7):1-5.XU J, YONG X Y, FEI W B, et al.A rapid and dynamic quantitative screening method based on TTC staining of high activity yeast cells[J].Food and Fermentation Industries, 2014, 40(7):1-5.
[15] 冯俏. 耐高温酵母菌株的构建及其应用的研究[D].天津:天津科技大学, 2022.FENG Q.Research on the construction and application of high temperature resistant yeast strain[D].Tianjin:Tianjin University of Science and Technology, 2022.
[16] 刘微, 戴凌燕, 苗青, 等.一种经济高效的酵母菌落PCR模板DNA制备方法的建立[J].中国生物制品学杂志, 2022, 35(7):848-852.LIU W, DAI L Y, MIAO Q, et al.Development of a cost-effective method for preparation of template DNA for yeast colony PCR[J].Chinese Journal of Biologicals, 2022, 35(7):848-852.
[17] 封冰, 张翠英, 肖冬光.耐高糖面包酵母单倍体的分离筛选[J].酿酒科技, 2014(11):10-13.FENG B, ZHANG C Y, XIAO D G.Isolation and screening of haploid of baker’s yeast with high sugar tolerance[J].Liquor-Making Science &Technology, 2014(11):10-13.
[18] 曹喜涛, 陈凯, 李扬, 等.酿酒酵母单倍体菌株分离筛选及其产腺苷甲硫氨酸的初步研究[J].工业微生物, 2015, 45(3):36-40.CAO X T, CHEN K, LI Y, et al.Isolation and screening of S-adenosyl-L-methionine yielding haploid strain from Saccharomyces cerevisiae[J].Industrial Microbiology, 2015, 45(3):36-40.
[19] 卜文静, 段秋虹, 杜金宇, 等.耐高温酿酒酵母菌株的选育[J].河南农业大学学报, 2016, 50(2):235-240.BU W J, DUAN Q H, DU J Y, et al.Breeding of thermotolerant yeast strains Saccharomyces cerevisiae for bioethanol production[J].Journal of Henan Agricultural University, 2016, 50(2):235-240.
[20] WANG L, LI B, WANG S P, et al.Improving multiple stress-tolerance of a flocculating industrial Saccharomyces cerevisiae strain by random mutagenesis and hybridization[J].Process Biochemistry, 2021, 102:275-285.