全球人口正在稳步增长,人口老龄化趋势日益加深,这导致人们对饮食中高质量蛋白质的需求增加,以维持增长和各种身体机能[1]。然而,环境污染和有限的农业用地面积制约着畜牧业的发展,单纯依赖动物蛋白已不能满足日益增长的蛋白质需求[2]。需要探索合适的蛋白质来源来弥补动物蛋白质的供应缺口,随着食品加工技术的进步,开发出如植物、藻类、真菌和其他创新的蛋白质来源[3]。
食用菌具有独特的鲜味,富含优质蛋白质(15%~34.7%)、维生素、矿物质和几丁质等必需营养物质[4]。此外,它们易于培养,加工简单和便于保存的特性允许每年持续生产,能够解决蛋白质供应短缺的问题[5]。然而,食用菌在栽培过程中可能会发生菌种退化,导致生长速度缓慢、产量下降、蛋白质含量降低等问题,对养殖户造成不可预估的经济损失[6]。优良菌种的选育不仅可以提高食用菌的品质,降低栽培成本,还可以从源头提高农户收益,助力乡村振兴[7]。因此,选育高产优质的菌株对于促进大规模生产食用菌蛋白产业发展至关重要[8]。
在食用菌产业中,为满足蛋白质产量需求的提高,通过物理、化学和生物诱变等方法筛选培育优质高产菌株,筛选出有益的菌株,对生产周期、成本和整体质量产生重大影响[9-10]。尽管食用菌蛋白质的研究和开发正在蓬勃发展,但仍缺乏对最大化菌丝体蛋白质产量针对性的育种研究。桃红侧耳(Pleurotus djamor)是一种具有丰富营养的食用菌,是一种低脂肪、高蛋白的健康食品[11]。本研究通过原生质体细胞融合的方法,重点研究了P. djamor原生质体制备和融合的最佳条件,在此之后,对融合菌株进行了严格的筛选过程,这个筛选过程包括测定菌丝体生长速率、生物量和蛋白质含量等,筛选出具有高产菌丝体蛋白特征的融合菌株。
1 材料与方法
1.1 供试菌株
P. djamor,菌株号GXGD-13-1,南京高新工大生物技术研究院有限公司。
1.2 仪器与设备
SX-700蒸汽灭菌器,日本TOMY KOGYO公司;ARTP-M常压室温等离子体诱变机,无锡源清天木生物科技有限公司;K9860全自动凯氏定氮仪,山东海能科学仪器有限公司;SH220F石墨消解仪,山东海能科学仪器有限公司;L580R大容量冷冻离心机,上海卢湘仪离心仪器有限公司;ZQZY-CT振荡培养箱,上海知楚仪器有限公司;SW-CJ-2FD洁净工作台,苏州安泰空气技术有限公司;MLR-352H-PC植物培养箱,松下健康医疗器械株式会社;UV1000D紫外可见分光光度计,上海翱艺仪器有限公司;5E-MAC6710全自动工业分析仪,长沙开元仪器有限公司;XH-C漩涡混合器,常州朗越仪器制造有限公司。
1.3 材料与试剂
溶壁酶(≥200 units/mg),阿拉丁生化科技股份有限公司;几丁质酶(酶活力10万),广东翁江化学试剂有限公司;牛血清蛋白(96%),阿拉丁生化科技股份有限公司;蜗牛酶(BR,破壁率90%),上海源叶生物科技有限公司;崩溃酶(Protein, ≥10% biuret)默克;Lysing enzymes(≥10 units/g)Sigma-Aldrich;Yatalase(酶活力1万),日本Takara公司;β-glucuronidase(80 U/mg),德国默克公司;果胶酶(BR,50 000 U/g),上海源叶生物科技有限公司;纤维素酶(酶活力10万),山东隆科特酶制剂有限公司;PEG4000(average Mn 4000),阿拉丁生化科技股份有限公司;CaCl2(AR≥96%),国药集团化学试剂有限公司;甘露醇(AR,98%),阿拉丁生化科技股份有限公司;甘氨酸(99%),生工生物工程股份有限公司;DMSO(99.7%),国药集团化学试剂有限公司。
1.4 培养基与溶液
稳定剂:10 mmol/L NaH2PO4+0.8 mol/L NaCl,pH 6.0
组合酶体系:M1(酶质量浓度6.7 g/L、pH 5.0~6.0):融壁酶Lywallzyme 150 mg、几丁质酶50 mg、稳定剂30 mL。M2(酶质量浓度21.7 g/L、pH 5.0~6.0):牛血清白蛋白50 mg、蜗牛酶50 mg、崩溃酶50 mg、Lysing enzymes 50 mg、Yatalase 50 mg、β-glucuronidase 100 μL、果胶酶100 mg、纤维素酶200 μL、稳定剂30 mL。M3(酶质量浓度18.3 g/L、pH 5.0~6.0):牛血清白蛋白50 mg、蜗牛酶50 mg、崩溃酶50 mg、Lysing enzymes 50 mg、Yatalase 50 mg、果胶酶100 mg、纤维素酶200 μL、稳定剂30 mL。
融合剂1:150 g/L 聚乙二醇(polyethylene glycol,PEG)4000、65 mmol/L CaCl2、25 mmol/L 甘露醇、25 mmol/L甘氨酸和100 mL/L DMSO,用NaHCO3调pH值至8.0~8.2。
融合剂2:250 g/L PEG 4000、65 mmol/L CaCl2、25 mmol/L 甘露醇、25 mmol/L甘氨酸和100 mL/L DMSO,用NaHCO3调pH值至8.0~8.2。
再生平板:抗生素50 mg/250 mL青霉素钾盐;0.6 mol/L蔗糖+抗生素+PDA;
PDA培养基(g/L):土豆200、葡萄糖20、磷酸二氢钾3、七水硫酸镁1.5、琼脂粉20、维生素B1 0.1。
液体培养基(g/L):黄豆粉30、酵母膏3、葡萄糖30、无水硫酸镁0.5、七水硫酸亚铁0.18、磷酸二氢钾0.5、维生素B1 0.01。
1.5 试验方法
1.5.1 桃红侧耳菌丝体生长旺盛期测定
菌种活化:在超净工作台中用无菌铲从保菌管中取出约1 g菌球接种到PDA培养基中,26 ℃静置培养7 d,待菌丝长满平板,备用。
菌丝体液体培养:将活化的GXGD-13-1接种于液体培养基中,控制接种量,每瓶种子液转接5个直径为5 mm大小的菌块,26 ℃、150 r/min摇床培养10 d。一级种子液26 ℃、150 r/min摇床培养第4天开始,每隔1 d下样1瓶,3个平行,测糖转化率,确定生长旺盛期。
1.5.2 桃红侧耳菌丝体的制备
菌丝体液体培养:将活化后的GXGD-13-1,控制接种量,每瓶接5个直径为5 mm大小的菌块,接种于装有150 mL液体培养基的500 mL三角瓶中,放入振荡培养箱26 ℃、150 r/min培养7 d,备用。
1.5.3 原生质体的制备
酶解时间与酶体系的确定:酶解时间与酶体系是决定原生质体释放数量的主要因素,本实验采用单因素试验来确定GXGD-13-1菌丝体的酶体系与最佳酶解时间。酶体系分别为M1、M2、M3,对其酶解时间分别设定为1、2、3 h,筛选出最优酶体系及酶解时间。将上述酶用稳定剂溶解后,离心后用黄色水系滤膜过膜除菌。菌液用mircloth神奇滤布过滤掉液体培养基,刮去1~2 g菌丝体,用稳定剂冲洗1~2遍,置于酶解液中30 ℃、200 r/min酶解。采用血球计数法对酶解产生的原生质体进行观察,计数并计算(个/mL),并记录结果。
原生质体纯化:酶液用神奇滤布过滤,除去没有酶解完全的菌丝体,滤液8 000 r/min、离心10 min,倒去上清液,用稳定剂重悬1遍,8 000 r/min、离心10 min,倒去上清液,最后用稳定剂重悬至0.5 mL,备用。
1.5.4 原生质体细胞融合
细胞融合:原生质体的重悬数量需为106~107个/mL,将原生质体与不同PEG浓度的融合剂(融合剂1、融合剂2)按照1∶4的比例置于2 mL离心管中(无菌操作),30 ℃、100 r/min低速轻轻摇晃,避光培养30 min后得到融合后的产物;在显微镜下检查其细胞融合情况。
细胞融合重悬:将融合细胞以4 000 r/min离心1 min,弃上清液,分1~3次边缓慢摇动边加入1 mL清洗液(去除PEG),30 ℃静置1~2 min,低速4 000 r/min离心收集沉淀物,备用。
融合子再生:吸取200 μL细胞融合悬液涂布于再生平板,26 ℃静置培养。待平板上长出单菌落后,观察其形态特征将单菌落挑选转接至PDA平板上,转接3次,保证稳定遗传后进行验证,并按照公式(1)计算其融合率:
原生质体融合率/%
(1)
1.5.5 高产菌丝蛋白菌株的筛选
初筛:细胞融合后,计算再生菌株菌丝在平板PDA培养基上的日平均生长速度,筛选出生长较快的菌株,并与出发菌株做拮抗实验,在一块PDA上同时接种再生菌株和出发菌株,静置放在26 ℃恒温培养箱中培养,待菌丝满板,筛选出具有明显拮抗线的再生菌株。
复筛:将初筛得到的再生菌株在超净工作台中用打孔器取5块5 mm的菌种块接种于装有150 mL液体培养基的500 mL锥形瓶中,置于26 ℃、150 r/min的摇床中培养7 d,观察再生菌株的菌球形态,并用凯氏测氮仪测蛋白质含量,每个菌株设3个重复,取平均值,挑选出菌丝蛋白含量提高较大的菌株。
1.5.6 成分测定
菌丝体干重:菌丝体培养7 d后,将菌丝体溶液放入冷冻离心机中4 000 r/min离心10 min,倒掉上清液。将菌丝体固体残渣放入100 ℃恒温空气干燥箱中,干燥24 h后称取样品干重。
菌丝体蛋白质含量测定:将干燥后的样品研磨成粉末状,每份样品称取0.1 g于消化管中。同时在Graphite消解仪中加入2片消解片和10 mL浓硫酸。设置三级曲线加热,第1段目标温度150 ℃的预置时间为30 min,第2段目标温度300 ℃的预置时间为30 min,第3段目标温度420 ℃的预置时间为2 h。消化结束后测定样品的粗蛋白质含量。标准酸浓度为0.1 mol/L,蛋白系数为6.25,硼酸25 mL,稀释水20 mL,碱液40 mL,样品蒸馏5 min。
菌液还原糖含量测定:将菌液放入冷冻离心机中4 000 r/min离心10 min,上清液稀释一定倍数后取0.5 mL加入试管中,再加入0.5 mL DNS试剂混匀,空白对照为0.5 mL水加0.5 mL DNS试剂混匀,同时在沸水中煮沸5 min,冷却至室温后加水稀释至9 mL。放入紫外可见分光光度计,采用波长540 nm处用空白管校零,测定其吸光值后代入葡萄糖标准曲线,算出还原糖含量和糖转化率。
1.5.7 分子生物学鉴定
将融合菌株菌丝体送北京睿博兴生物技术有限公司进行测序,利用Internal Transcribed Spacer(ITS)引物ITS1:5′-TCCGTAGGTGAACCTGCGG-3′,引物ITS4:5′-TCCTCCGCTTATTGATATGC-3′对其DNA进行PCR扩增,PCR扩增条件:94 ℃预变性3 min,94 ℃变性30 s,54 ℃退火30 s,72 ℃延伸45 s,30个循环,72 ℃延伸10 min,终止温度4 ℃。将测得的ITS序列在GenBank中进行BLAST比对分析,并下载与其同源性相关序列,使用MEGA11软件构建系统发育树,从而确定菌株的分类地位。
2 试验结果与分析
2.1 原生质体细胞融合育种
原生质体融合育种是近年来新的育种方法,关键流程如图1-a所示,通过生物技术去除细胞壁获得原生质体,原生质体融合基因重组,能克服细胞壁和交配系统对育种的壁垒,实现远缘杂交,以其可行性高、易于推广、有效性强,在研发育种中起到重要作用。
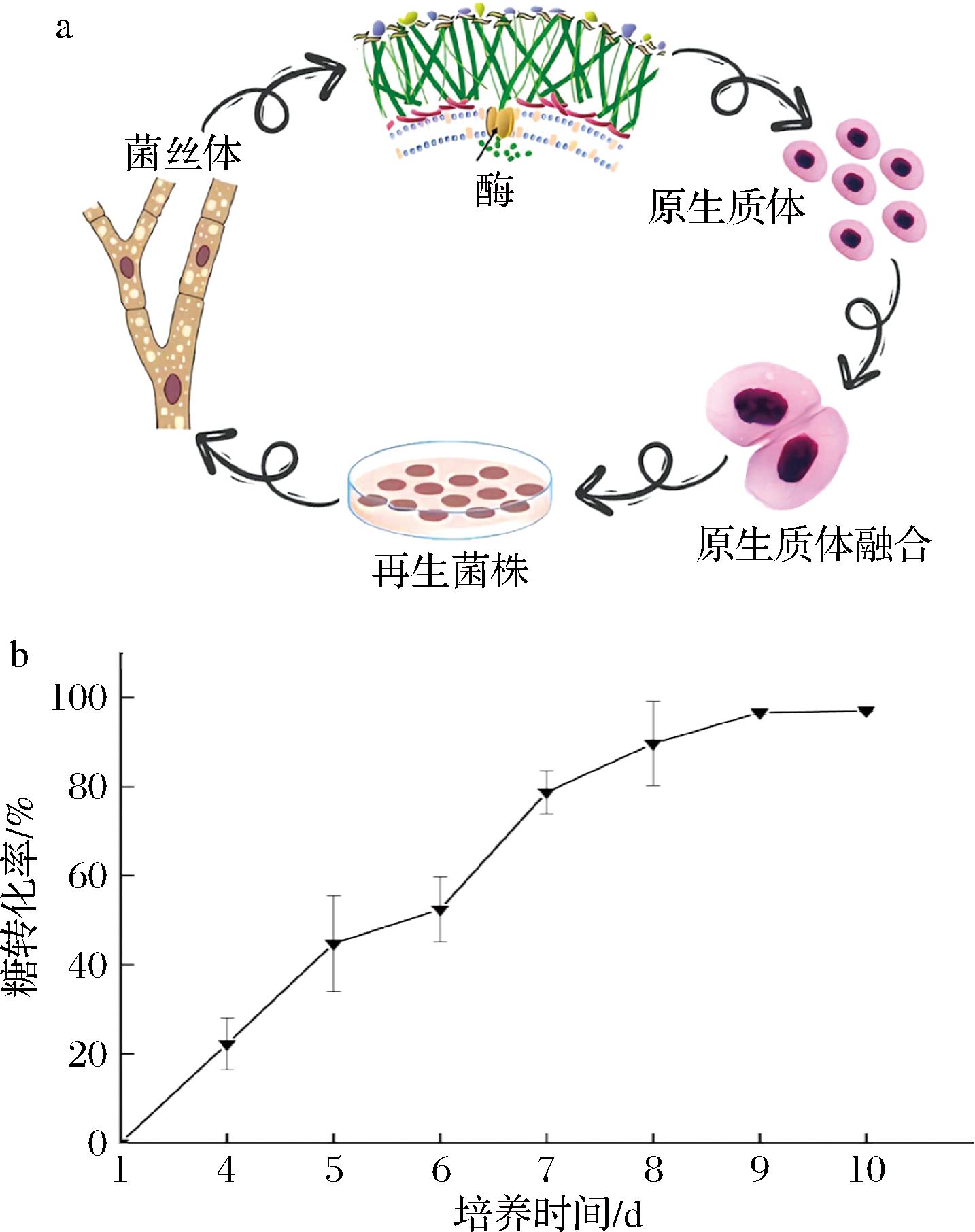
a-原生质体细胞融合流程图;b-GXGD-13-1菌丝体糖转化率
图1 原生质体细胞融合原理及菌株GXGD-13-1菌丝体糖转化
Fig.1 The principle of protoplasmic cell fusion and mycelium sugar transformation of the strain GXGD-13-1
酶解法是制备原生质体的主要方法,细胞壁是酶解的底物,根据不同的细胞壁结构和化学组成选用不同种类的酶以达到最佳的酶解效果[12]。酶解后释放的原生质体可以在种内、种间和属间通过PEG或电场促使细胞接触聚集进行融合,融合后的原生质体具有全能性,可再生成新的菌株,通过有目的的筛选,可获得高产优质菌种[13]。
2.2 桃红侧耳生长旺盛期测定
菌丝体的不同生长状态影响细胞壁结构及原生质体释放,菌龄对于原生质体的制备来说是至关重要的,菌丝体生长旺盛期即对数生长期,细胞壁较薄,容易酶解,是原生质体释放的最佳菌龄[14]。处于生长旺盛期的菌丝体生长速度快,糖转化率会快速提高,还原糖的利用率也会提高[15]。如图1-b测得1~10 d P. djamor菌丝体的糖转化率,1~9 d糖转化率每天都有所提升,第9天以后液体培养基里的还原糖几乎转化完,在第7天的时候糖转化率有快速的提升,由此可以确定P. djamor菌丝体生长旺盛期为在液体培养基中的第7天。
2.3 释放原生质体的最佳酶解条件测定
合适的酶解时间和酶组合对菌丝体细胞壁酶解,释放原生质体起到关键作用。真菌的细胞壁结构复杂,担子菌细胞壁的主要成分为葡聚糖和几丁质,选择几种酶组合在一起使用能达到较好的酶解效果[16]。本次实验设计了3种组合酶体系,分别为M1、M2、M3,由表1可得3种组合酶体系都能起到酶解细胞壁,释放原生质体的作用,但是M2组合酶体系对P. djamor菌丝体的酶解效果最好,其数量可达4.65×107个/mL[17]。为了确定M2组合酶最佳的酶解时间,将酶解时间分别设定为1、2、3 h,观察记录原生质体释放数量如表1所示,可得经过3 h的酶解所释放的原生质体数量最多,可达到4.58×107个/mL。由此可得P. djamor菌丝体以M2组合酶,酶解时间3 h可达到最佳的酶解条件。
表1 不同酶组合和酶解时间下原生质体的释放情况
Table 1 Release of protoplasts under different enzyme combinations and enzymolysis time
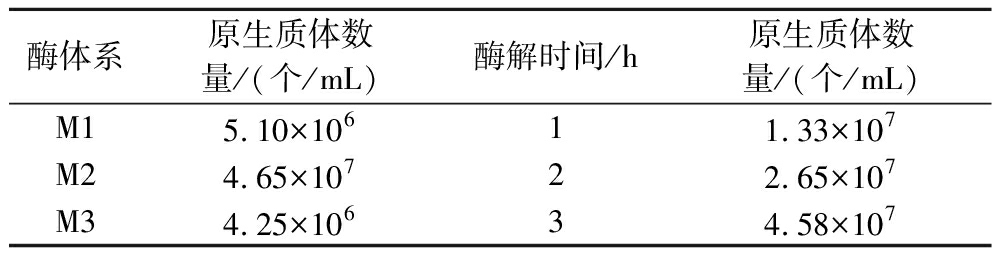
酶体系原生质体数量/(个/mL)酶解时间/h原生质体数量/(个/mL)M15.10×10611.33×107M24.65×10722.65×107M34.25×10634.58×107
2.4 最适PEG浓度测定
PEG法融合简单方便且具有较高的融合率,不同的PEG质量浓度对细胞融合率有直接影响,不同种类的细胞最适宜的PEG质量浓度也不同[18]。为了得到较多的融合菌株,将PEG质量浓度分别设定为150 g/L和250 g/L,对酶解后得到的P. djamor原生质体之间进行细胞融合,镜检观察发现当PEG质量浓度为150 g/L时(图2-a)原生质体较为分散,相互融合的细胞较少。而当PEG质量浓度提高至250 g/L时(图2-b)原生质体较为聚集,相互融合的细胞较多,故选择PEG质量浓度为250 g/L的融合剂进行融合实验更适合。

a-150 g/L PEG;b-250 g/L PEG
图2 在不同PEG质量浓度下的细胞融合情况
Fig.2 Cell fusion at different PEG mass concentrations
P. djamor属于双因子控制的四极性异宗结合的有性生殖,亲和率(可孕率)为25%[19]。通过实验方法1.3.4节以及公式(1),当PEG质量浓度为250 g/L的融合剂进行原生质体融合时,计算其融合率为53%,克服了一定的交配系统壁垒。
2.5 高产菌丝体蛋白融合菌株的筛选
2.5.1 融合菌株的初筛
本次原生质体细胞融合实验的目的是筛选出蛋白产量更高的融合菌株,将筛选过程分为初筛和复筛两个步骤,拮抗试验是鉴别菌株间遗传差异的一种有效初筛方法。菌丝体之间的相互作用,特别是在交叉点处形成明显的拮抗线,表明菌株之间存在明显的遗传分化。这往往会导致新性状的出现,便于筛选具有明显遗传特征的菌株[20]。通过拮抗作用对融合菌株进行了筛选,得到16株融合菌株。
在初筛中选择菌丝生长速度快的菌株,可以加快整个育种进程。生长速度快于原始菌株的融合菌株被初步鉴定具有正突变的基因,而生长速度较慢的负突变菌株被淘汰[21]。如图3-a所示从16株融合菌株中又筛选得到9株生长速度快于原始菌株的融合菌株,R-1至R-9的生长速度分别是(4.33±0.24)、(9.94±1.86)、(9.19±1.15)、(9±0.18)、(19.5±3.54)、(25.25±1.06)、(4.08±1.53)、(11.63±0.53)和(4.83±0.94) mm/d。其中R-5和R-6生长速度最快,约为原始菌株的5~6倍,说明原生质体细胞融合的育种方法对P. djamor菌丝体的生长速度有促进作用。

a-P. djamor原生质体融合后菌丝体的生长速度;b-菌丝体液体培养7天的生物量;c-蛋白含量;d-蛋白得率
图3 P. djamor原生质体融合后菌丝体的生长速度、生物量、蛋白含量、蛋白得率的指标情况
Fig.3 Indicators of growth rate, biomass, protein content, and protein yield of P. djamor mycelium after protoplast fusion
2.5.2 融合菌株的复筛
为了测定初筛得到的9株融合菌株的菌丝体蛋白质含量,将每株菌株转移到液体培养基中进行扩大培养,遵循1.3.5节中的复筛方法,采用凯氏定氮仪测定蛋白质含量,每种测定设置3个平行。如图3-c所示,9株融合菌株的菌丝体蛋白质含量超过原始菌株,但菌丝体生物量和蛋白质含量差异显著。融合菌株R-2、R-3、R-4、R-5、R-8、R-9 的菌丝生物量比出发菌株[(18.50±1.54) g/L]低,但蛋白质含量较高。相反,融合菌株R-7的菌丝体生物量最高,为(19.96±1.03) g/L,比出发菌株提高了7.9%,但菌丝体蛋白含量仅为(23.69±2.55)%。这种差异表明菌丝生物量与蛋白质含量之间不存在直接的正相关关系;较高的生物量并不一定能保证较高的蛋白质含量。
菌丝体的蛋白产量如图3-d所示,与原始菌株相比,R-1、R-4和R-7的蛋白产量提高了20%以上。其中,R-1融合菌株的蛋白产量最高,为(4.74±0.24) g/L,比原始菌株提高了(23.48±6.30)%。以蛋白质产量为指标,筛选出一株蛋白质产量较高的优良菌株R-1,该融合菌株菌丝体生长速度为(4.33±0.24) mm/d,生物量为(19.43±0.55) g/L,蛋白质含量为(24.43±1.93)%,蛋白质产量为(4.74±0.24) g/L。
2.6 选育菌株的分子生物学鉴定
通过测序获得原始菌株GXGD-13-1和融合菌株R-1的rDNA-ITS序列,进一步构建系统发育进化树(图4)。分子鉴定结果表明,菌株GXGD-13-1和R-1的rDNA-ITS序列长度分别为681、680 bp,这2株与GenBank中HM770895.1 Pleurotus djamor的同源性分别为85.24%、91.37%,表明GXGD-13-1和R-1都属于P. djamor,但是原始菌株GXGD-13-1与HM770895.1 P. djamor基因序列相差较大,遗传距离较远,这是由于种植过程中和传代过程的菌株退化所导致的[22]。此外,选育菌株R-1与HM770895.1 P. djamor基因序列基本一致,遗传距离更近,说明原生质体细胞融合选育优良菌株的育种方法适用于P. djamor的菌株筛选,从而得到产蛋白含量更高的菌株,这与前文的筛选结果一致[23]。

图4 融合菌株ITS区系统发育进化树
Fig.4 Phylogenetic evolutionary tree of ITS region of fusion strains
3 结论
原生质体融合育种技术已被证明能有效提高菌株内的目标产物,DAS等[24]通过侧耳(Pleurotus sajor-caju)与印度丽蘑属间原生质体融合,获得的杂交菌株具有高蛋白,低脂肪的营养特性。本研究利用原生质体细胞融合育种技术对桃红侧耳菌株进行选育,以期获得高产蛋白的新菌株。在原生质体细胞融合育种过程中,测定了桃红侧耳(P. djamor)菌丝体生长旺盛期为在液体培养基中的第7天,优化了不同酶体系以及最佳酶解时间,确定酶组合为M2,最佳酶解时间为3 h,可获得足够数量的原生质体。之后又对PEG质量浓度进行筛选,实验发现当融合剂2中PEG质量浓度为250 g/L时更适合桃红侧耳(P. djamor)原生质体细胞的融合,融合率达到53%。融合后再生的菌株又经过初筛和复筛两个步骤,初筛从得到的16株融合菌株中,筛选9株优势菌株,表现出比原始菌株更快的生长速度。复筛中以蛋白质产量为指标,从9株生长较快的菌株中筛选出蛋白质产量较高的优良融合菌株R-1,其菌丝体生长速度为(4.33±0.24) mm/d,生物量为(19.43±0.55) g/L,蛋白质含量为(24.43±1.93)%,蛋白质产量为(4.74 ±0.24) g/L。最终,通过原生质体细胞融合育种获得菌株R-1的菌丝体蛋白产量比出发菌株提高了约23%。这一结果证明了该育种方法的有效性,并为食用菌蛋白质产业的发展提供了基础参考。
[1] PARTRIDGE L, DEELEN J, SLAGBOOM P E.Facing up to the global challenges of ageing[J].Nature, 2018, 561(7721):45-56.
[2] S NCHEZ C.Cultivation of Pleurotus ostreatus and other edible mushrooms[J].Applied Microbiology and Biotechnology, 2010, 85(5):1321-1337.
NCHEZ C.Cultivation of Pleurotus ostreatus and other edible mushrooms[J].Applied Microbiology and Biotechnology, 2010, 85(5):1321-1337.
[3] SURYA ULHAS R, RAVINDRAN R, MALAVIYA A, et al.A review of alternative proteins for vegan diets:Sources, physico-chemical properties, nutritional equivalency, and consumer acceptance[J].Food Research International, 2023, 173:113479.
[4] ASSEMIE A, ABAYA G.The effect of edible mushroom on health and their biochemistry[J].International Journal of Microbiology, 2022, 2022(1):8744788.
[5] ZHANG Y, VENKITASAMY C, PAN Z L, et al.Recent developments on umami ingredients of edible mushrooms:A review[J].Trends in Food Science &Technology, 2013, 33(2):78-92.
[6] JYOTHI K R, THARA S S.Development of improved strain in species of Pleurotus by gamma irradiation[J].Journal of Food Science and Technology, 2021, 58(9):3540-3547.
[7] HERN NDEZ A S, VALENZUELA COBOS J D, MART
NDEZ A S, VALENZUELA COBOS J D, MART NEZ J H, et al.Characterization of Pleurotus djamor neohaplonts recovered by production of protoplasts and chemical dedikaryotization[J].3 Biotech, 2019, 9(1):24.
NEZ J H, et al.Characterization of Pleurotus djamor neohaplonts recovered by production of protoplasts and chemical dedikaryotization[J].3 Biotech, 2019, 9(1):24.
[8] DONG Y T, MIAO R Y, FENG R C, et al.Edible and medicinal fungi breeding techniques, a review:Current status and future prospects[J].Current Research in Food Science, 2022, 5:2070-2080.
[9] ZHANG Y, CHEN S T, YANG L, et al.Application progress of CRISPR/Cas9 genome-editing technology in edible fungi[J].Frontiers in Microbiology, 2023, 14:1169884.
[10] ZHANG Q, MIAO R Y, FENG R C, et al.Application of atmospheric and room-temperature plasma (ARTP) to microbial breeding[J].Current Issues in Molecular Biology, 2023, 45(8):6466-6484.
[11] W ODARCZYK A, KRAKOWSKA A, SU
ODARCZYK A, KRAKOWSKA A, SU KOWSKA-ZIAJA K, et al.Pleurotus spp.mycelia enriched in magnesium and zinc salts as a potential functional food[J].Molecules, 2020, 26(1):162.
KOWSKA-ZIAJA K, et al.Pleurotus spp.mycelia enriched in magnesium and zinc salts as a potential functional food[J].Molecules, 2020, 26(1):162.
[12] 骈永茹, 李婧怡, 李勤奋, 等.巨大侧耳原生质体制备条件的优化[J].广西植物, 2023, 43(7):1308-1316.PIAN Y R, LI J Y, LI Q F, et al.Optimization of protoplast preparation conditions of Pleurotus giganteus[J].Guihaia, 2023, 43(7):1308-1316.
[13] LI S F, ZHAO R, YE T W, et al.Isolation, purification and PEG-mediated transient expression of mesophyll protoplasts in Camellia oleifera[J].Plant Methods, 2022, 18(1):141.
[14] ZHANG C, ZONG H, ZHUGE B, et al.Protoplast preparation and polyethylene glycol (PEG)-mediated transformation of Candida glycerinogenes[J].Biotechnology and Bioprocess Engineering, 2016, 21(1):95-102.
[15] 毛亚玲, 李俊娥, 于静, 等.酒酒球菌和酿酒酵母共接种发酵动力学模型建立[J].食品科学, 2023, 44(2):156-164.MAO Y L, LI J E, YU J, et al.Kinetic modelling of mixed culture fermentation of Oenococcus oeni and Saccharomyces cerevisiae[J].Food Science, 2023, 44(2):156-164.
[16] HE P X, YU M, WANG K, et al.Interspecific hybridization between cultivated morels Morchella importuna and Morchella sextelata by PEG-induced double inactivated protoplast fusion[J].World Journal of Microbiology &Biotechnology, 2020, 36(4):58.
[17] 应汉杰, 魏荷芬, 潘晶, 等.一株红平菇高产真菌及其在产纤维素酶中的应用:中国.CN115927017A[P].2023-04-07.YING H J,WEI H F,PAN J,et al.A high-yield fungus of Pleurotus ostreatus and its application in cellulase production:China.CN115927017A[P].2023-04-07.
[18] PATIL N S, PATIL S M, GOVINDWAR S P, et al.Molecular characterization of intergeneric hybrid between Aspergillus oryzae and Trichoderma harzianum by protoplast fusion[J].Journal of Applied Microbiology, 2015, 118(2):390-398.
[19] JAMES T Y, LIOU S R, VILGALYS R.The genetic structure and diversity of the A and B mating-type genes from the tropical oyster mushroom, Pleurotus djamor[J].Fungal Genetics and Biology, 2004, 41(8):813-825.
[20] CAO S, ZHOU X, JIN W B, et al.Improving of lipid productivity of the oleaginous microalgae Chlorella pyrenoidosa via atmospheric and room temperature plasma (ARTP)[J].Bioresource Technology, 2017, 244:1400-1406.
[21] ZHANG H N, JIANG F C, QU D H, et al.Employment of ARTP to generate Phellinus baumii (Agaricomycetes) strain with high flavonoids production and validation by liquid fermentation[J].International Journal of Medicinal Mushrooms, 2019, 21(12):1207-1221.
[22] LIU Y, CHEN X, WEI D, et al. Breeding a novel chlorophyll-deficient mutant of Auxenochlorella pyrenoidosa for high-quality protein production by atmospheric room temperature plasma mutagenesis[J]. Bioresource Technology, 2023, 390:129907.
[23] XIE F X, ZHANG F F, ZHOU K, et al.Breeding of high protein Chlorella sorokiniana using protoplast fusion[J].Bioresource Technology, 2020, 313:123624.
[24] DAS P, SIKDAR S R, SAMANTA A.Nutritional analysis and molecular characterization of hybrid mushrooms developed through intergeneric protoplast fusion between Pleurotus sajor-caju and Calocybe indica with the purpose to achieve improved strains[J].World Journal of Microbiology &Biotechnology, 2021, 37(4):69.