生物活性肽是一种可以发挥超出其预期营养价值的生物活性物质,可通过蛋白酶解、微生物发酵、人工合成等方法制得。其中,单一蛋白酶酶解制备多肽的成本较高[1],而采用微生物发酵和蛋白酶酶解相结合的方式制备多肽,不仅可以降低商业酶的使用量[2],还能促进蛋白质的充分酶解,进而提高多肽的生物活性,如胰蛋白酶抑制活性、抗氧化活性等[3]。已有研究表明,一些益生菌,包括副干酪乳杆菌、干酪乳杆菌、保加利亚乳杆菌等不仅有利于机体健康,而且可以发酵蛋白原料,产生具有降血压、抗氧化的活性多肽[4]。张子健[5]研究进一步发现,副干酪乳杆菌的发酵性能和蛋白水解活力最高,可显著提高产肽效率。
弹性蛋白是一种水不可溶性的弹性纤维蛋白,存在于牛、猪等动物的韧带、主动脉、皮肤或者鱼类的动脉球,主要由成纤维细胞和角质形成细胞产生[6],研究表明弹性蛋白除了表观营养价值外,还具有抗高血压、抗菌、抗氧化和抗衰老等功能活性,已成为营养产品的候选活性成分[7]。而弹性蛋白肽(elastin peptide, EP)是弹性蛋白的水解产物,克服了弹性蛋白不溶于水的限制,拥有较好的应用前景。丁刘刚等[8]以牛颈韧带为原料,利用多种酶的协同作用制备具有美容作用的EP。刘洋[9]以牛动脉、鱼动脉球制备了具有抗皮肤衰老的EP。HINEK等[10]指出,EP具有抑制弹性蛋白酶活性、改善皮肤老化程度的功效。目前国内外关于EP的研究主要集中在利用蛋白酶酶解制备EP并进行相应的活性评价,关于微生物发酵协同蛋白酶酶解制备EP以及探究其功能特性的研究鲜有报道。
综上所述,本研究首先利用益生菌副干酪乳杆菌YYS-K1发酵牛心管,进一步结合碱性蛋白酶酶解制备EP,接着探究其发酵前后的理化性质及功能特性变化,包括糖胺聚糖含量、氨基酸组成、分子质量分布及其在抗炎、降脂、抗糖化和增加皮肤弹性方面可能存在的生物活性,以期为EP相关功能产品的开发和利用提供数据支持。
1 材料和方法
1.1 试验材料
副干酪乳杆菌YYS-K1(1.5×109 CFU/mL,保藏编号:CGMCC No.26405),厦门元之道生物科技有限公司;牛心管,河北省廊坊市大厂回族自治区;地衣芽孢杆菌碱性蛋白酶(40万U/g),诺维信生物技术有限公司;胰蛋白酶(25万U/g),南宁庞博生物工程有限公司;硫酸软骨素,北京万佳首化生物科技有限公司;阿利新蓝,成都化夏化学试剂有限公司;17种混标氨基酸,阿尔塔科技有限公司;芴甲氧羰酰氯,成都西亚化工股份有限公司;三氟乙酸、乙腈、邻苯二甲醛,上海阿拉丁生化科技股份有限公司;乙氨酰-乙氨酰-乙氨酸、乙氨酰-乙氨酰-酪氨酰-精氨酸、细胞色素C,中国计量科学院;DPPH、ABTS,山东西亚化学有限公司;α-淀粉酶(9 U/mg)、胰脂肪酶,合肥博美生物科技有限责任公司;DNS试剂,北京索莱宝科技有限公司;透明质酸酶,上海源叶生物科技有限公司;弹性蛋白酶、硼酸、显色底物N-succinyl-Ala-Ala-Ala-pNa,上海麦克林生化科技股份有限公司;其他化学试剂均采用分析纯。
1.2 仪器与设备
FE28 pH计,梅特勒-托丽多(常州)测量技术有限公司;HH-4B磁力搅拌恒温水浴锅,国华(常州)仪器制造;Multiskan Spectrum酶标仪,赛默飞世尔科技(中国)公司;HC-3016高速冷冻离心机,安徽中科中佳科学仪器有限公司;LC-16高效液相色谱,岛津仪器(苏州)有限公司;UV-5100紫外可见分光光度计,上海元析仪器有限公司;恒温培养箱,北京市永光明医疗仪器有限公司。
1.3 实验方法
1.3.1 EP制备工艺及其理化性质测定
1.3.1.1 EP的制备
1)样品前处理:取2 kg牛心管洗净绞碎,加入6 kg的0.3%(质量分数)NaHCO3溶液,在60 ℃保温1 h后用纯水洗净;向清洗后的牛心管碎肉中加入6 kg的水,利用盐酸调pH值为3,于85 ℃保温2 h后洗净备用;
2)发酵过程:取1 kg前处理后的牛心管碎肉,加入5 kg水进行均质,得到牛心管均质液,95 ℃灭菌30 min后,加入30 g副干酪乳杆菌YYS-K1(CGMCC No.26405)于37 ℃条件下发酵24 h。发酵结束后,采用过滤去除牛心管发酵液表面所聚集的油脂,于95 ℃灭菌30 min后,得到脱脂牛心管发酵液;
3)酶解过程:待脱脂牛心管发酵液降温至55 ℃,加入30 g地衣芽孢杆菌碱性蛋白酶(酶的添加量为前处理完的牛心管质量的3%)进行第一次酶解,酶解pH值为8.0,酶解2 h,于90 ℃灭酶30 min。随后降温至55 ℃,加入7 g的胰蛋白酶(酶的添加量为前处理完的牛心管质量的0.7%)进行第二次酶解,酶解pH值为7.50,酶解2 h,90 ℃灭酶20 min;
4)制取弹性蛋白肽:加入75 g活性炭,55 ℃下保温1 h后,板框过滤,得到弹性蛋白肽滤出液;将滤出液经过5 000 Da超滤膜处理,得到分子质量低于5 000 Da的牛心管弹性蛋白溶液,再进行喷雾干燥即可得到弹性蛋白肽(elastin peptide by enzymolysis combined with microbial fermentation,EMEP)。
5)未经过发酵EP的制备工艺去除了加入菌种发酵这一步骤,其余操作与工艺与上述步骤相同。
1.3.1.2 糖胺聚糖(glycosaminoglycans, GAGs)含量测定
为测定EP糖胺聚糖含量,利用硫酸软骨素建立GAGs定量标准曲线,即首先配制1.4 mg/mL的阿利新蓝溶液(用0.5 mol/L的乙酸钠溶液配制)和10 mg/mL的硫酸软骨素溶液,然后分别取0.01、0.02、0.04、0.06、0.08 mL的硫酸软骨素溶液置于2 mL离心管中,加去离子水补足总体积为1 mL作为标准溶液,取0.2 mL的标准溶液加3 mL阿利新蓝染液,摇匀室温静置10 min,于480 nm处测定OD值并绘制标准曲线。
测定方法:取0.2 mL的EP样品加3 mL阿利新蓝染液,摇匀室温静置10 min,于480 nm处测定OD值,利用标准曲线计算EP中GAGs含量。
1.3.1.3 氨基酸含量测定
参考GB 5009.124—2016《食品安全国家标准 食品中氨基酸的测定》测定EP中氨基酸组成。
1.3.1.4 相对分子质量测定
配制EP多肽溶液进行相对分子质量测定,采用HPLC方法分析相对分子质量分布,方法参照GB/T 22492—2008《大豆肽粉》。多肽样品充分溶解混匀后加超纯水稀释,过0.22 μm水系滤膜。流动相为体积分数0.05%三氟乙酸、40%乙腈和60%水溶液,流量为0.5 mL/min,柱温为室温,进样量为10 μL,紫外检测波长为220 nm,检测时间为等度洗脱30 min。利用乙氨酰-乙氨酰-乙氨酸(相对分子质量189)、乙氨酰-乙氨酰-酪氨酰精氨酸(相对分子质量451)、细胞色素C(相对分子质量12 500)、抑肽酶(相对分子质量6 500)和杆菌酶(相对分子质量1 450)的标准物质建立标准曲线,计算EP的相对分子质量分布。
1.3.2 EP抗氧化活性评价
1.3.2.1 DPPH自由基清除率
为测定EP的DPPH自由基清除能力,反应分为试验组、空白组和对照组。在试验组管中加3 mL DPPH溶液和1 mL样品溶液;在对照组管中加3 mL无水乙醇溶液和1 mL样品溶液;在空白组管中加3 mL DPPH溶液和1 mL样品溶剂溶液;各组分别充分混合均匀,室温避光反应30 min,于517 nm条件下用酶标仪测定吸光度值,每个实验至少做3组平行,DPPH自由基清除率的计算如公式(1)所示:
DPPH自由基清除率![]()
(1)
式中:As、Ab和Ac分别为样品溶液、空白对照液与反应液混合液和样品溶液本底的吸光度值。
1.3.2.2 ABTS阳离子自由基清除率
为测定EP的ABTS阳离子自由基清除能力,取200 mg ABTS,34.4 mg过硫酸钾,溶于50 mL蒸馏水,摇匀,室温避光放置24 h,作为ABTS母液。做ABTS阳离子自由基清除试验时,用95%乙醇稀释ABTS母液至吸光度值在0.70±0.02内(OD734),作为ABTS测定溶液用。反应分为试验组、空白组、对照组和空白对照组。在试验组管中加3.6 mL ABTS溶液和0.4 mL样品;在空白组管中加3.6 mL ABTS和0.4 mL样品溶剂水溶液;在对照组管中加3.6 mL 95%乙醇和0.4 mL样品溶剂水溶液;在空白对照组管中加3.6 mL 95%乙醇和0.4 mL纯水;分别充分混合均匀,室温避光反应5 min后离心,于734 nm条件下用酶标仪测定吸光度值,ABTS阳离子自由基清除率的计算如公式(2)所示:
ABTS阳离子自由基清除率![]()
(2)
式中:As、Ab、Ac和A0分别为样品溶液、空白对照液与反应液混合液、样品溶液本底和空白对照液的吸光度值。
1.3.2.3 超氧阴离子自由基清除率
为测定EP的超氧阴离子自由基清除能力,将4.5 mL的0.05 mol/L的Tris-HCl缓冲液(pH 8.20)和1 mL EP样品混合,在25 ℃下反应5 min,向混合物中加入0.4 mL的0.025 mol/L邻苯三酚溶液,25 ℃反应5 min,最后加入1 mL 8 mmol/L浓盐酸终止反应,记录在299 nm处的吸光值,超氧阴离子自由基清除率的计算如公式(3)所示:
超氧阴离子自由基清除率![]()
(3)
式中:A1代表样品对照组,反应体系中Tris-HCl缓冲液代替邻苯三酚;A2代表样品反应组;A3代表空白对照组反应体系中蒸馏水代替样品,Tris-HCl缓冲液代替邻苯三酚;A4代表空白组,反应体系中蒸馏水代替样品。
1.3.3 EP功能活性评价
1.3.3.1 对白蛋白变性的抑制作用
将25 μL卵清蛋白、350 μL磷酸盐缓冲溶液(0.1 mol/L,pH 7.20)与250 μL的EP样品混合后在37 ℃水浴孵育15 min,然后在70 ℃水浴孵育5 min。在冰水浴中冷却5 min后,在660 nm处测得的吸光值记为A样品,将磷酸盐缓冲溶液代替卵清蛋白测得的吸光值记为A对照,将超纯水代替样品测得的吸光值记为A空白。白蛋白抑制率的计算如公式(4)所示:
白蛋白变性抑制率![]()
(4)
1.3.3.2 对AGEs生成的抑制作用
首先建立BSA-葡萄糖/D-果糖体系,利用0.2 mol/L磷酸盐缓冲液(pH 7.40),配制0.5 mol/L葡萄糖/D-果糖和4 mg/mL BSA溶液,将上述试剂和不同质量浓度的多肽样品过0.45 μm滤膜。设置样品组F1、样品对照组F2、空白组F3和空白对照组F4,按照顺序将样品、试剂等体积添加至96孔酶标板中:
样品组:100 μL BSA+100 μL葡萄糖/D-果糖溶液+100 μL多肽样品
样品对照组:100 μL PBS+100 μL葡萄糖/D-果糖溶液+100 μL多肽样品
空白组:100 μL BSA+100 μL葡萄糖/D-果糖溶液+100 μL样品溶剂溶液。
空白对照组:100 μL PBS+100 μL葡萄糖/D-果糖溶液+100 μL样品溶剂溶液。
加完样品后,于37 ℃恒温培养箱下孵育7 d。测定其经360 nm激发光激发后,在453 nm处的荧光强度,激发和发射狭缝宽度为5 nm。其中AGEs抑制率的计算如公式(5)所示:
AGEs抑制率![]()
(5)
式中:F1、F2、F3和F4分别为样品组、样品对照组、空白组和空白对照组的吸光度值。
1.3.3.3 对胰脂肪酶活性的抑制作用
根据GB/T 23535—2009《脂肪酶制剂》的方法,测定EP的胰脂肪酶抑制活性,配制2 mg/mL的胰脂肪酶溶液作为酶反应液,取2个100 mL三角瓶分别于空白瓶(A)和样品瓶(B)中各加入底物溶液4 mL和磷酸缓冲液500 mL,再于A瓶中加人95%乙醇15 mL,于40 ℃水浴中预热5 min,然后于A、B瓶中各加待测酶液1 mL,立即混匀计时,准确反应15 min后于B瓶中立即补加95%乙醇15 mL终止反应,取出;于空白和样品溶液中各加酚酞指示液2滴,用NaOH标准溶液滴定,直至微红色并保持30 s不褪色为滴定终点,通过记录消耗NaOH标准溶液的体积表示样品对胰脂肪酶抑制作用。
1.3.3.4 弹性蛋白酶抑制活性
参照BODE等[11]的方法,在96孔板上加入200 μL待测样品,空白对照为Tris-HCl缓冲液(50 mmol/L,pH 8.0),迅速加入50 μL弹性蛋白酶溶液(60 mU/mL)和50 μL显色底物N-succinyl-Ala-Ala-Ala-pNa溶液(0.5 mg/mL),测定未反应时混合液在410 nm下的吸光度,在酶标仪中温育5 min后测试第二次,弹性蛋白酶抑制率的计算如公式(6)所示:
弹性蛋白酶抑制率![]()
(6)
式中:As0和As分别代表反应前和反应5 min后样品组410 nm的吸光度;Ac0和Ac分别代表反应前和反应5 min后对照组410 nm的吸光度值。
1.3.4 数据统计分析
采用Excel 2019进行数据处理,用GraphPad Prism 8.0绘图软件进行绘图。实验均做3个平行,所有数据均以平均值±标准差表示,以Duncan和ANOVA法检验不同样品之间的差异显著性,*表示具有显著性差异(P<0.05)。
2 结果与分析
2.1 EP的理化性质
2.1.1 GAGs含量分析
GAGs是广泛存在于动物组织中的特征性多糖类化合物,具有抗炎、抗肿瘤、调节肠道菌群等多种生物活性[12-13],在药物治疗、营养保健食品中有广泛的应用,且不同来源的GAGs结构不均一,从而表现出不同的生理活性[14]。牛心管提取制备EP的GAGs含量结果如图1所示。结果显示,在质量浓度为1.25~40 mg/mL时,EP和EMEP的GAGs含量分别由0.46%和0.82%提高到8.67%和15.02%。样品质量浓度为40 mg/mL时,EMEP中GAGs含量较EP提高了约1.73倍,表现出显著性差异(P<0.05),说明副干酪乳杆菌YYS-K1发酵可显著提高EP中GAGs的含量,同时多种研究也已证实微生物可利用简单的营养基经过一系列酶催化过程合成目标产物GAGs[15]。
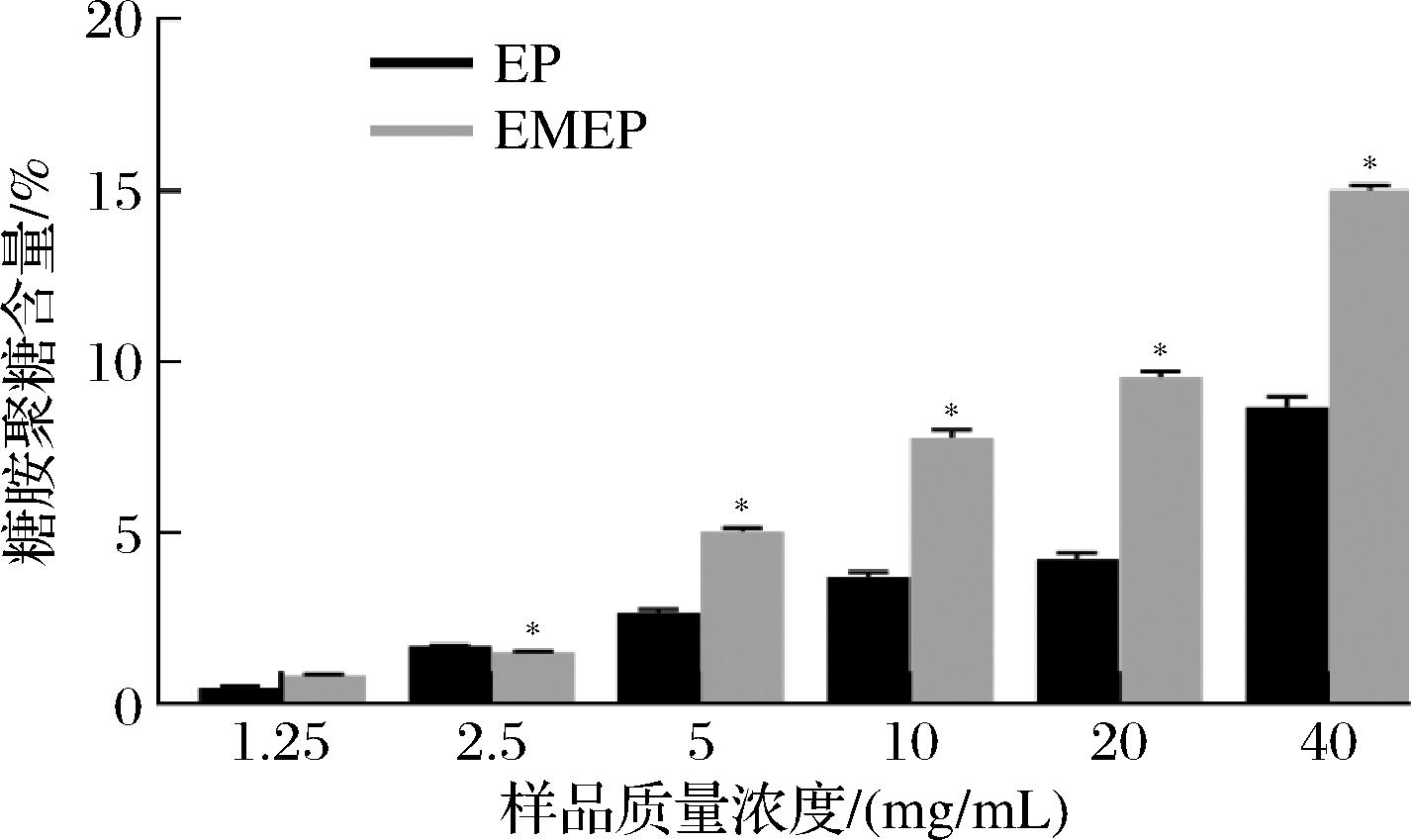
图1 EP和EMEP的糖胺聚糖含量
Fig.1 GAGs content of EP and EMEP
注:*表示具有显著性差异(P<0.05),下同。
2.1.2 氨基酸组成分析
两种制备方式得到的EP的氨基酸组成结果见表1。结果表明,EP和EMEP的氨基酸组成和含量差异不大,其中Gly、Pro、Glu、Arg、Tyr含量占比较高,分别占总氨基酸含量的14.82%、13.76%、13.81%、11.51%、11.65%和15.52%、13.18%、13.75%、12.52%、10.58%,Cys未检出。EP和EMEP中必需氨基酸分别占比21.20%和21.80%,疏水性氨基酸分别占比16.80%和17.61%,而与抗氧化活性密切相关的芳香族氨基酸[16]Phe和Tyr占比分别为13.90%和12.57%,两者没有明显差异。而值得注意的是,经酶解联合微生物发酵协同制备的EP中含量较高的Gly、Leu被报道与弹性蛋白酶有很好的亲和力[17],这为研究其对于弹性蛋白酶的抑制作用奠定基础。
表1 EP和EMEP的氨基酸组成
Table 1 Amino acid composition of EP and EMEP
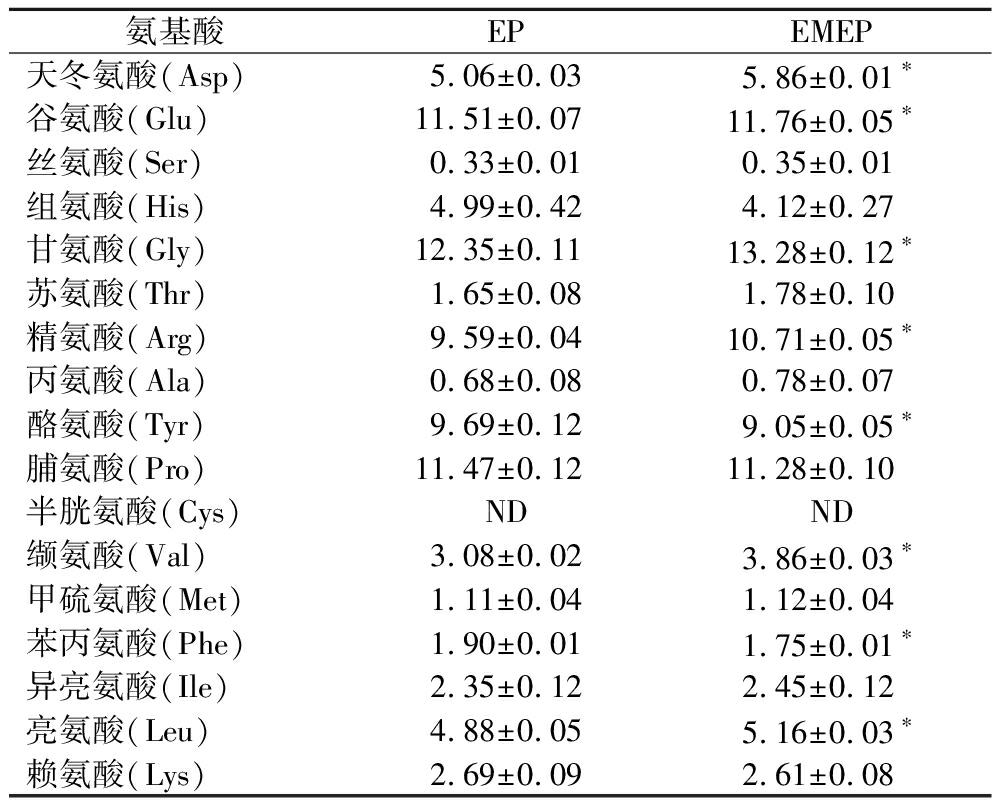
氨基酸EPEMEP天冬氨酸(Asp)5.06±0.035.86±0.01∗谷氨酸(Glu)11.51±0.0711.76±0.05∗丝氨酸(Ser)0.33±0.010.35±0.01组氨酸(His)4.99±0.424.12±0.27甘氨酸(Gly)12.35±0.1113.28±0.12∗苏氨酸(Thr)1.65±0.081.78±0.10精氨酸(Arg)9.59±0.0410.71±0.05∗丙氨酸(Ala)0.68±0.080.78±0.07酪氨酸(Tyr)9.69±0.129.05±0.05∗脯氨酸(Pro)11.47±0.1211.28±0.10半胱氨酸(Cys)NDND缬氨酸(Val)3.08±0.023.86±0.03∗甲硫氨酸(Met)1.11±0.041.12±0.04苯丙氨酸(Phe)1.90±0.011.75±0.01∗异亮氨酸(Ile)2.35±0.122.45±0.12亮氨酸(Leu)4.88±0.055.16±0.03∗赖氨酸(Lys)2.69±0.092.61±0.08
注:ND表示未检测出,*表示具有显著性差异(P<0.05)。
2.1.3 相对分子质量分布
发酵是比较古老的加工食品的方法之一,利用微生物菌株发酵,有利于生产富含活性的物质,增强食品的营养和功能。由表2可以看出,EP超过3 000 Da的分子质量占比为1.35%,低于1 000 Da的分子质量占比为89.19%,而通过结合副干酪乳杆菌YYS-K1发酵后,EMEP中大于3 000 Da的多肽占比进一步下降,小于1 000 Da的低分子质量肽占比略有上升,占总体的89.37%,根据文献报道[18],小分子多肽更容易被人体消化吸收,也具有较好的生理活性。上述结果表明,经微生物发酵结合酶解后,弹性蛋白肽的活性片段增加,可极大提高其生理活性。
表2 EP和EMEP的分子质量分布
Table 2 Molecular weight distribution of EP and EMEP

分子质量范围/Da>10 0005 000~10 0003 000~5 0001 000~3 000<1 000EP含量/%00.111.249.4789.19EMEP含量/%00.050.849.7389.37
2.2 EP的抗氧化性活性变化
2.2.1 DPPH自由基清除能力
DPPH是一种较为稳定的自由基,它是以氮元素为中心,通过消耗受试物中的自由基间接反映不同物质的抗氧化能力。图2显示了2种EP的DPPH自由基清除活性。可以看出,EP和EMEP均具有一定的DPPH自由基清除能力,且清除能力随着质量浓度提高逐渐增强。但在相同的质量浓度下,EMEP对DPPH自由基清除能力显著高于EP(P<0.05),当质量浓度为40 mg/mL时,与单一酶解的EP 48.93%的DPPH自由基清除率相比,EMEP清除率高达78.52%,提高了1.60倍,以上结果说明酶解联合微生物发酵协同制备较单一酶解得到的EP具有更好的抗氧化活性。谷洁洁[19]以鸡胚蛋多肽为试验原料,发现经发酵后多肽的DPPH自由基清除能力比未发酵时提高近3倍,与本研究结果趋势一致。
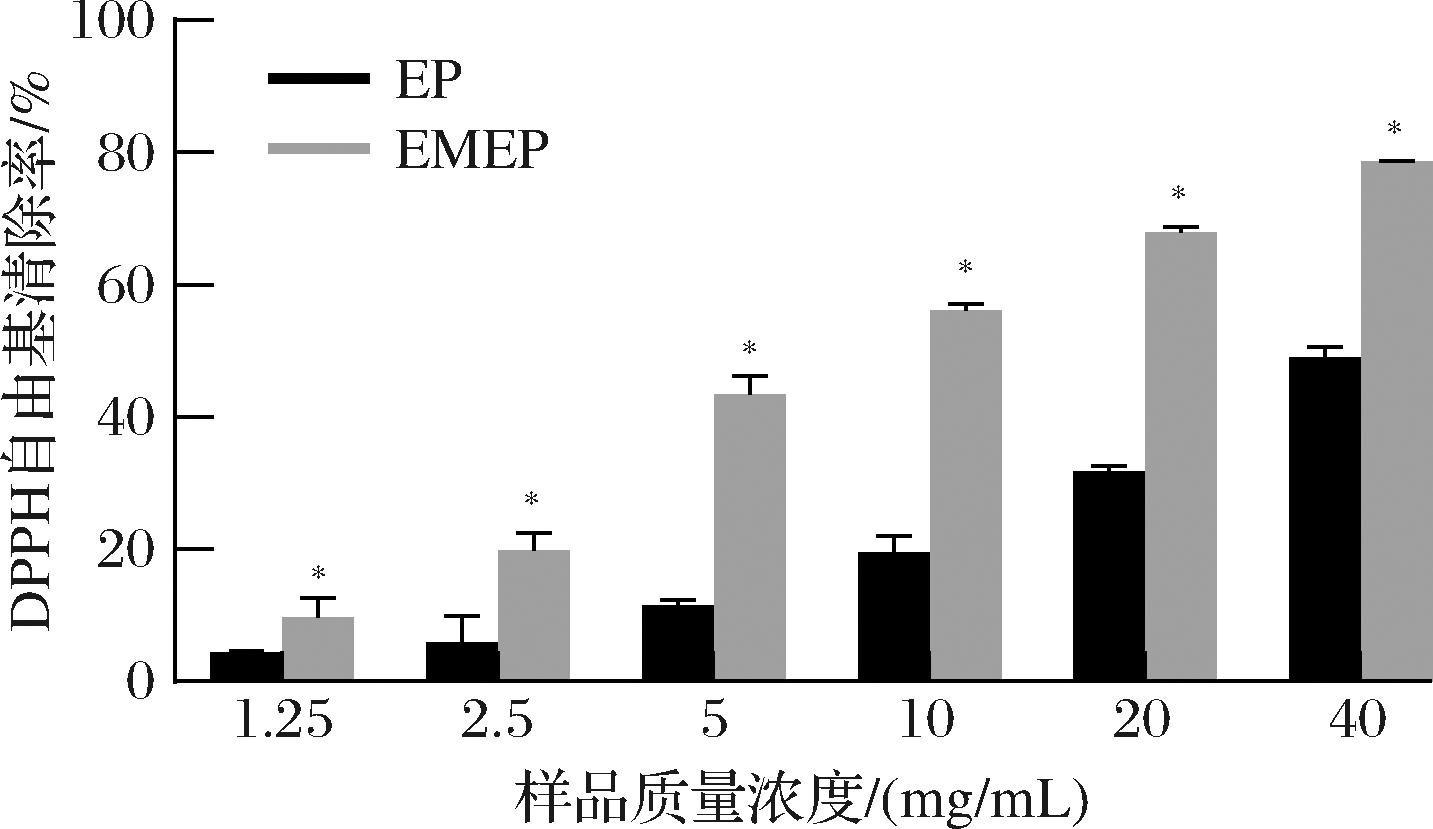
图2 EP和EMEP的DPPH自由基清除率
Fig.2 The scavenging rate of EP and EMEP on DPPH free radical
2.2.2 ABTS阳离子自由基清除能力
ABTS是判定反应物抗氧化能力高低的重要指标。如图3所示,2种EP清除ABTS阳离子自由基能力呈浓度依赖关系,当质量浓度为40 mg/mL时,EMEP清除ABTS阳离子自由基的效率达到98.93%,而EP为96.19%,且EP和EMEP的IC50值分别为2.63 mg/mL和2.55 mg/mL,由此可见,EP具有较高的ABTS阳离子自由基清除能力,且EMEP的自由基清除能力更强。有研究指出,通过菌酶协同发酵处理后,体系中含有多种生物活性物质,可以有效提高物质的ABTS阳离子自由基清除能力[20]。
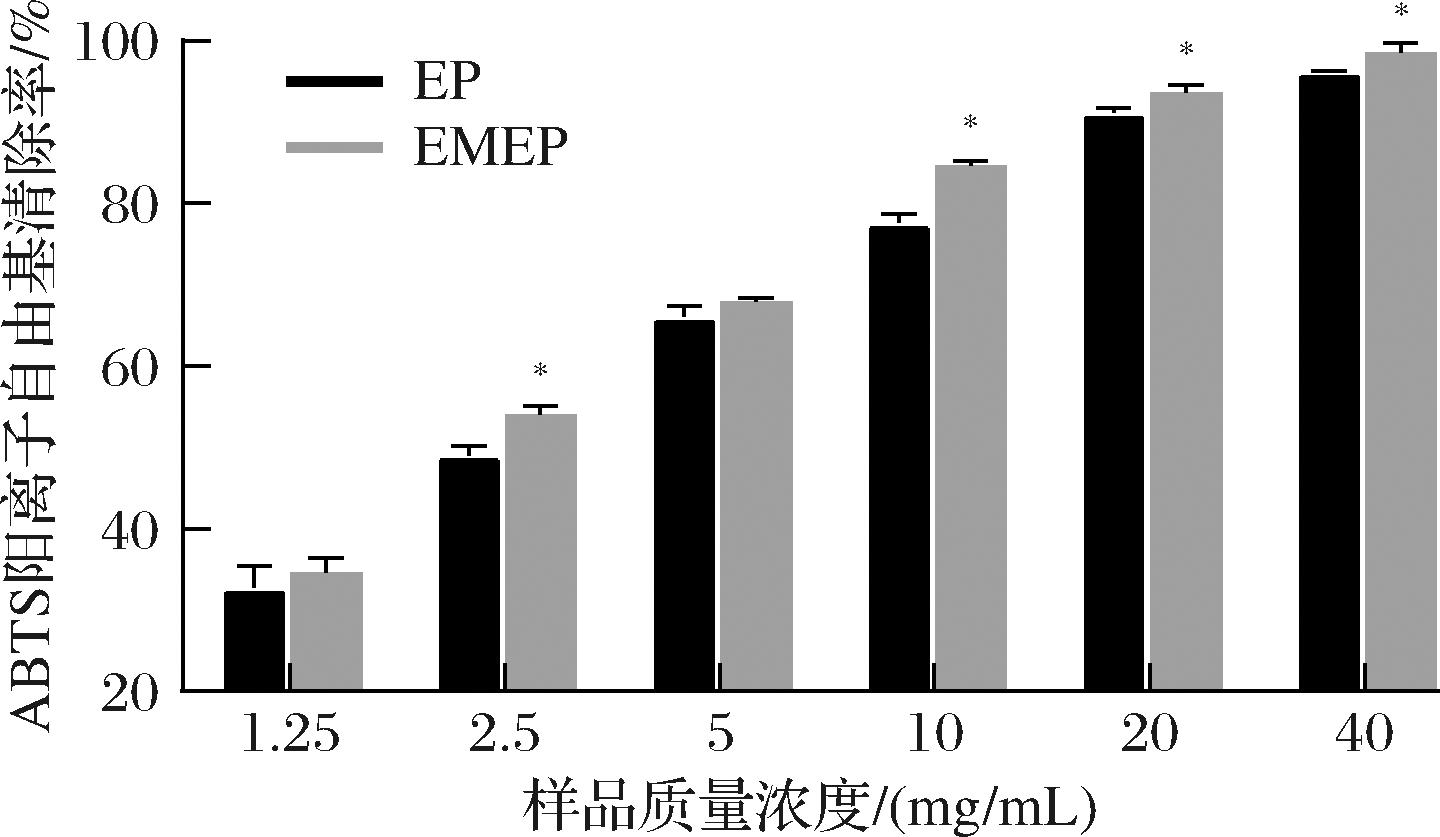
图3 EP和EMEP的ABTS阳离子自由基清除率
Fig.3 The scavenging rate of EP and EMEP on ABTS cation free radical
2.2.3 超氧阴离子自由基清除能力
超氧阴离子可导致机体器官和功能的破坏,通过清除超氧阴离子,可在一定程度上减轻对机体的损伤。图4显示了两种方法制备EP的超氧阴离子自由基清除能力的变化情况,结果显示,EP具有一定的超氧阴离子清除活性,且随着质量浓度增加,超氧阴离子清除能力逐渐增强。当质量浓度为40 mg/mL时,EMEP的超氧阴离子清除率为48.43%,比单一蛋白酶解制备EP提高8.45%,表明发酵处理可提高多肽的超氧阴离子清除活性。
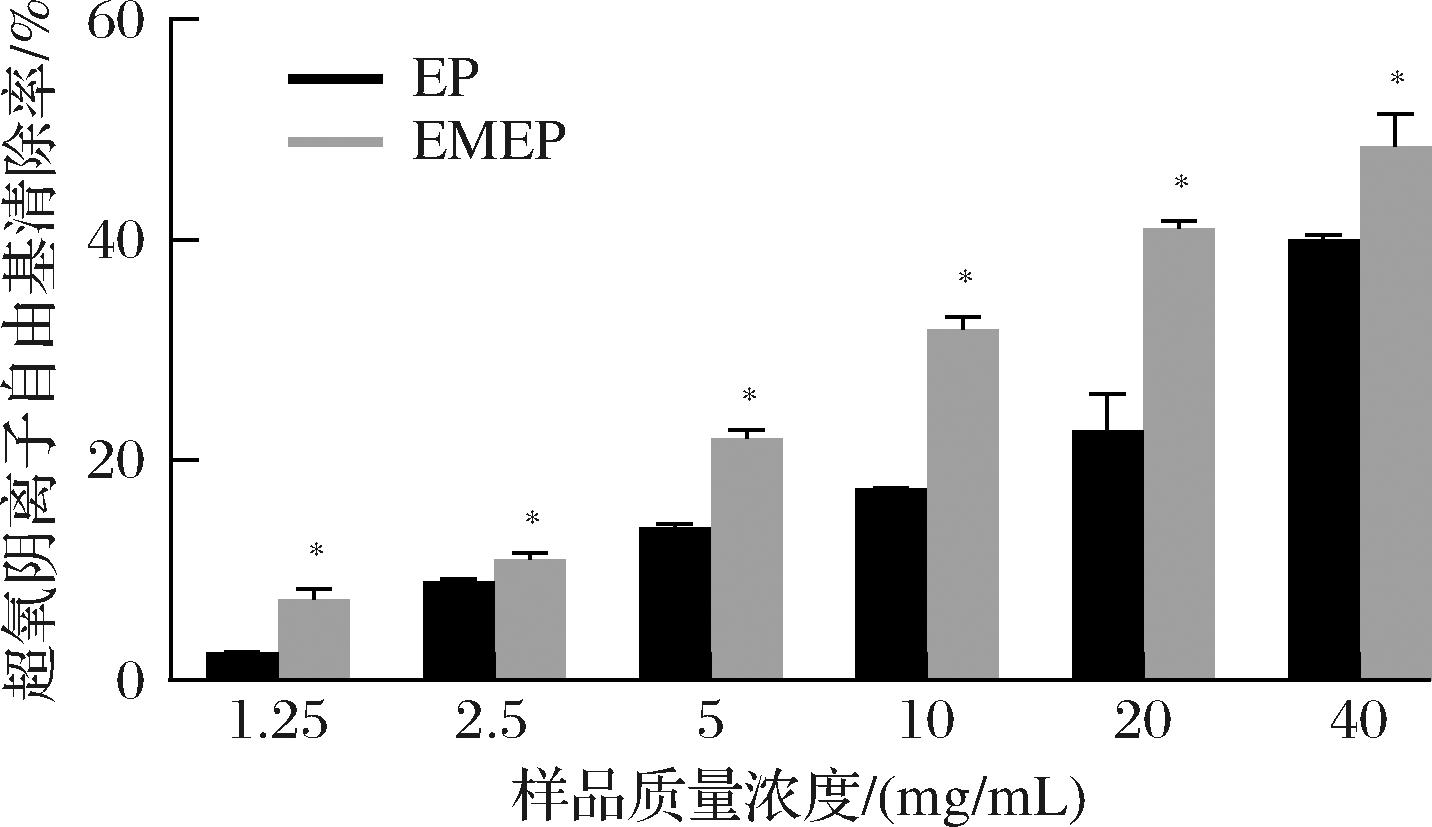
图4 EP和EMEP的超氧阴离子自由基清除率
Fig.4 The scavenging rate of EP and EMEP on superoxide anion free radical
2.3 EP的功能活性变化
2.3.1 白蛋白变性抑制活性
炎症是机体受到刺激引起的一系列天然防御反应,研究表明,生物活性肽表现出良好的抗炎活性,可用于调节机体炎症[21]。白蛋白变性抑制活性是衡量物质抗炎活性的一个重要指标,如图5所示,EP均表现出良好的炎症抑制活性,且呈现一定的浓度依赖性。质量浓度为1.25~40 mg/mL时,单一蛋白酶解的EP则由1.67%提高到71.68%,EMEP对白蛋白变性抑制率由4.42%提高到92.11%,两者的IC50值分别为8.69 mg/mL和13.38 mg/mL,且质量浓度为2.50~40 mg/mL时,EP与EMEP具有显著差异(P<0.05)。以上结果说明经微生物发酵处理制得的EMEP的抗炎活性明显高于只经酶解处理制得的EP,原因可能在于菌酶发酵过程中微生物分泌多种蛋白酶促进原料蛋白降解为具有较高生物活性的小分子多肽,进而发挥抗炎作用。
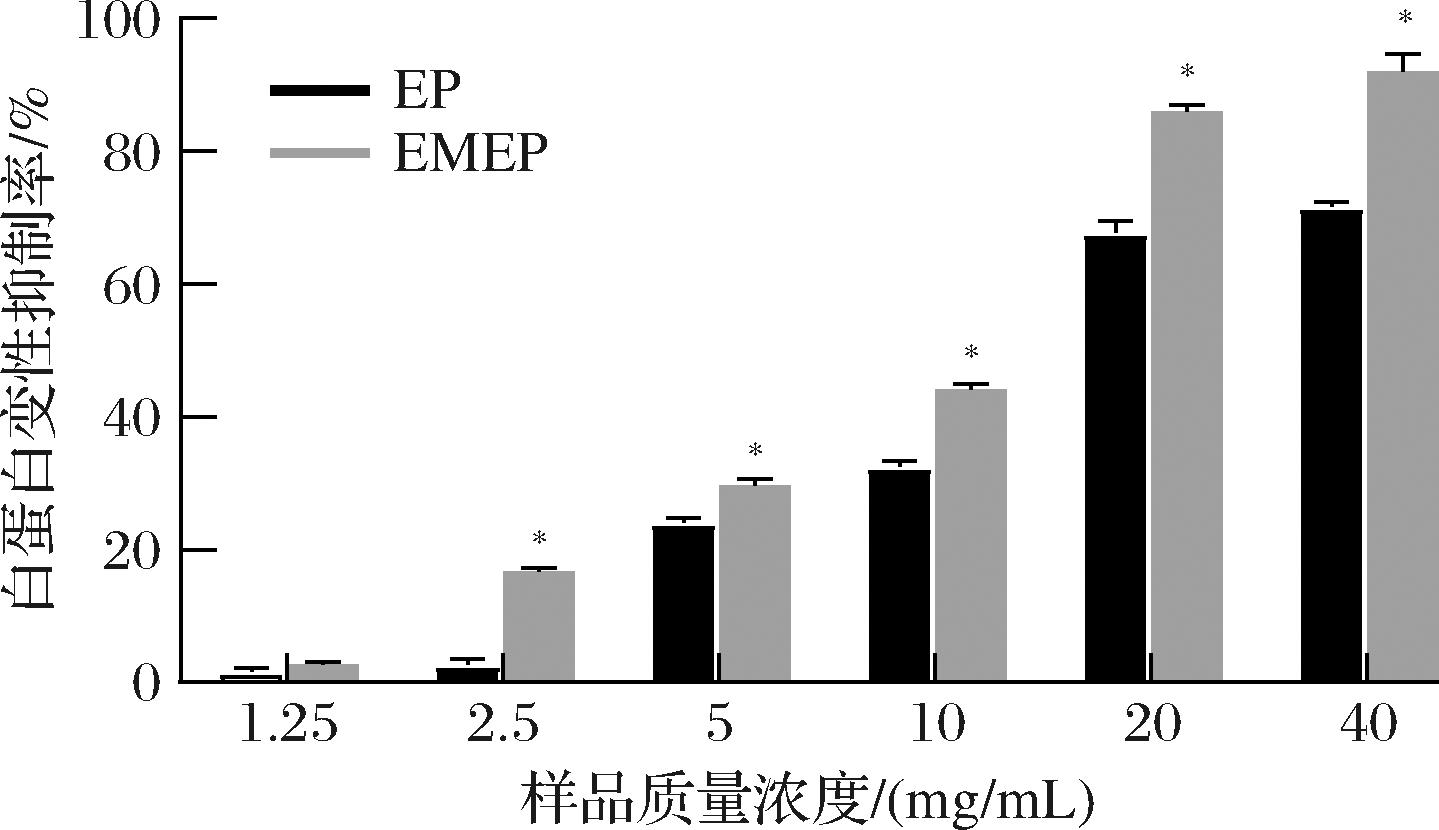
图5 EP和EMEP的白蛋白变性抑制率
Fig.5 The inhibition rate of EP and EMEP on albumin
2.3.2 晚期糖基化终末产物(advanced glycation end products, AGEs)生成抑制活性
蛋白质、脂质和核酸类的氨基和还原糖中的羰基结合发生缓慢非酶促反应,先生成不稳的中间产物,再经分子重排形成最终产物,又称AGEs。研究表明,AGEs与多种疾病相关,如动脉粥样化、糖尿病等[22]。本研究采用体外BSA-葡萄糖/D-果糖还原糖体系模型,对比EP和EMEP对AGEs生成的影响。结果如图6所示,两种EP均表现出一定的AGEs活性抑制作用,EMEP和EP对AGEs生成抑制率分别为7.04%~70.14%和4.79%~57.48%,IC50值分别为11.70 mg/mL和35.20 mg/mL,EMEP显示出更好的AGEs抑制活性。吴优等[23]研究报道经发酵后高蛋白食品豆乳中部分晚期糖基化产物含量下降,通过抑制AGEs生成表现更强的抗糖化作用,这与本研究结果基本一致。
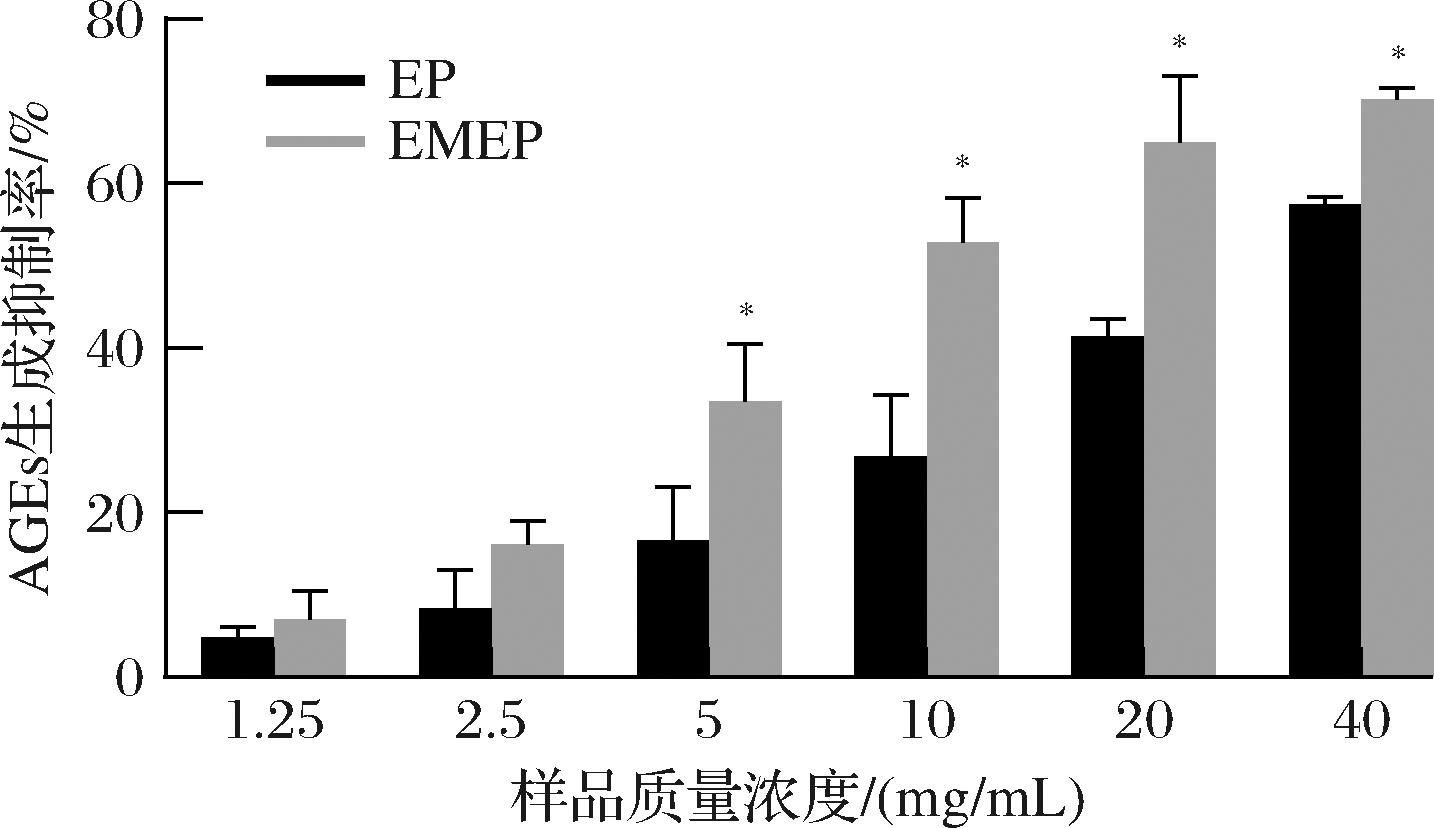
图6 EP和EMEP的AGEs生成抑制率
Fig.6 The inhibitory rate of EP and EMEP on AGEs production
2.3.3 胰脂肪酶抑制活性
胰脂肪酶在脂肪水解过程中起关键作用,控制脂肪酶活性可有效抑制机体脂肪的吸收利用,进而避免肥胖[24]。EP对胰脂肪酶抑制的活性作用如图7所示,只经酶解得到的EP未表现出对胰脂肪酶的抑制作用,而结合微生物发酵制备的EMEP表现出明显的胰脂肪酶抑制活性,且与质量浓度呈正相关。当质量浓度为40 mg/mL时,EMEP抑制脂肪酶能力可达81.14%,IC50值为9.41 mg/mL,说明酶解联合微生物发酵制备的EMEP可表现出一定的降脂作用。益生菌具有调节肠道菌群、改善脂质代谢、提高机体免疫力的功能,因此,EMEP表现出较高的抑制胰脂肪酶作用可能是与微生物发酵后产生的多种活性成分有关。

图7 EP和EMEP的胰脂肪酶抑制率
Fig.7 The inhibitory rate of EP and EMEP on pancreatic lipase
2.3.4 弹性蛋白酶抑制活性
弹性蛋白酶是一种基质金属酶,其不仅降解胞外基质蛋白,还会激活其他金属酶活性进而加速真皮层细胞外基质(包括胶原蛋白等)的降解,因此抑制弹性蛋白酶活性可在一定程度上起到抗皮肤老化、美容的功效[25]。由图8可知,EP对弹性蛋白酶的抑制率呈浓度依赖性,且在未发酵的条件下,EP抑制活性较高,抑制率可达62.50%,IC50值为10.83 mg/mL,而联合微生物发酵后,EMEP对弹性蛋白酶抑制活性显著增强(P<0.05),抑制率高达83.33%,IC50值为8.49 mg/mL。由于一些特殊氨基酸如Gly和Leu可与弹性蛋白酶结合抑制其活性[17],因此EMEP中较高水平的Gly、Leu可能是其发挥弹性蛋白酶抑制作用的关键,同时这也从侧面验证了氨基酸的结果。
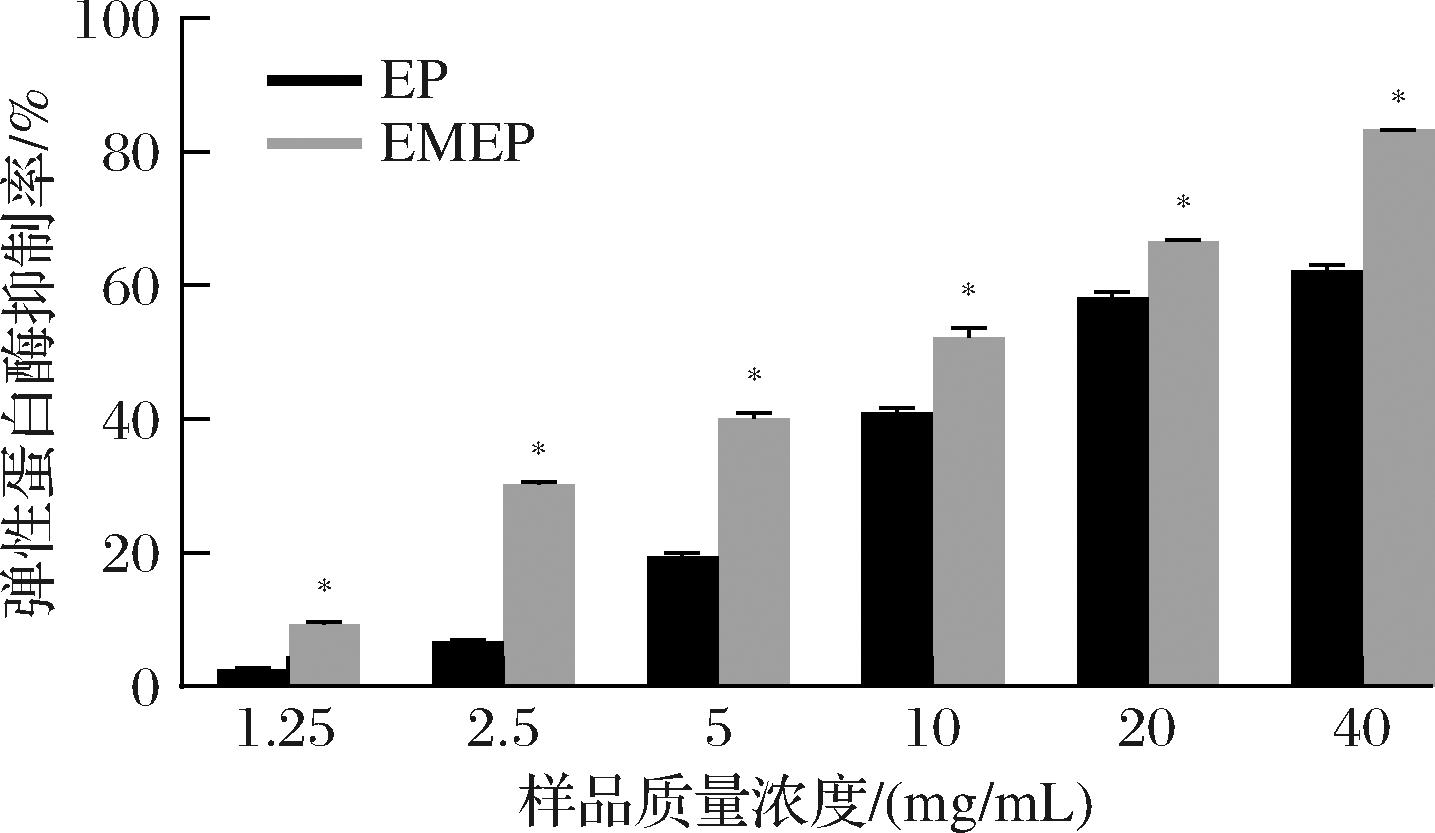
图8 EP和EMEP的弹性蛋白酶抑制率
Fig.8 The inhibitory rate of EP and EMEP on elastase
3 结论
本研究以单一酶解和酶解联合微生物发酵两种方式制备的EP为研究对象,通过分析其GAGs含量、氨基酸组成和相对分子质量分布等理化性质以及抗氧化、抗炎、抗糖化、降脂和增强皮肤弹性等功能特性,探究制备工艺对EP生物活性的影响。结果表明,微生物发酵结合蛋白酶解可显著提高EMEP中GAGs的含量,较单一酶解EP提高了约1.75倍;两种制备方式得到的EP中氨基酸组成差异不大,其中必需氨基酸占比高达21.80%,而EMEP中的Gly和Leu含量占比明显高于EP;分子质量分布结果表明EMEP中<1 000 Da活性肽的占比为89.37%,高于单一酶解得到的EP。
功能活性评价结果表明,两种EP均具有抗氧化活性,其中EMEP较EP表现出更显著的DPPH自由基、ABTS阳离子自由基和超氧阴离子自由基清除能力,在质量浓度为40 mg/mL时,清除率分别为78.52%、98.93%和48.43%,提高了29.59%、2.74%和8.45%;EP与EMEP均表现出良好的抗炎活性,EMEP对白蛋白变性抑制率高于EP;经微生物发酵,EMEP抑制AGEs生成效果提高,质量浓度为40 mg/mL时抑制率达到70.14%,是单一蛋白酶解制备EP的1.22倍;胰脂肪酶抑制试验表明,微生物发酵可能激活EP产生某些有效生物活性物质,从而起到对胰脂肪酶的抑制作用,当质量浓度为40 mg/mL时,EMEP抑制脂肪酶能力可达81.14%;弹性蛋白酶抑制试验结果表明,酶解联合微生物发酵EP可有效抑制弹性蛋白酶降解皮肤基质蛋白的作用,抑制率高达83.33%,与单一蛋白酶解相比抑制率提高20.85%。
综合以上结果,EMEP在抗氧化活性和抑制白蛋白变性、AGEs生成、胰脂肪酶以及弹性蛋白酶活性方面表现出积极作用,说明其在辅助缓解身体炎症、减肥美容方面可能具有潜在功效。然而后期还需分析发酵对EP中营养成分的影响以及通过动物试验进一步验证其功能作用机理。总之,酶解联合微生物发酵提高了EP利用率,可利用发酵联合蛋白酶酶解生产EP开发新型功能型食品。
[1] MAO X Z, LIU P, HE S, et al.Antioxidant properties of bio-active substances from shrimp head fermented by Bacillus licheniformis OPL-007[J].Applied Biochemistry and Biotechnology, 2013, 171(5):1240-1252.
[2] 杜昕, 李诚, 肖岚, 等.酶解牦牛血发酵液制备抗氧化肽工艺优化[J].核农学报, 2017, 31(2):325-333.DU X, LI C, XIAO L, et al.Optimization of hydrolysis conditions for production of antioxidant peptides from yak blood fermented by Bacillus subtilis[J].Journal of Nuclear Agricultural Sciences, 2017, 31(2):325-333.
[3] ZHENG L, DUARTE M E, SEVAROLLI LOFTUS A, et al.Intestinal health of pigs upon weaning:Challenges and nutritional intervention[J].Frontiers in Veterinary Science, 2021, 8:628258.
[4] 惠翌昕. 发酵羊乳产抗氧化肽乳杆菌的筛选及产肽条件优化[D].西安:陕西科技大学, 2016.HUI Y X.Screening and optimization of Lactobacillus fermenting goat milk for production of antioxidant peptides[D].Xi’an:Shaanxi University of Science and Technology, 2016.
[5] 张子健. 干酪乳杆菌D400产ACE抑制肽的研究[D].保定:河北农业大学, 2010.ZHANG Z J.Production of ACE-inhibitory peptides by Lactobacillus casei D400[D].Baoding:Hebei Agricultural University, 2010.
[6] ANTONICELLI F, BELLON G, DEBELLE L, et al.Elastin-elastases and inflamm-aging[J].Current Topics in Developmental Biology, 2007, 79:99-155.
[7] AGRAWAL H, JOSHI R, GUPTA M.Isolation, purification and characterization of antioxidative peptide of pearl millet (Pennisetum glaucum) protein hydrolysate[J].Food Chemistry, 2016, 204:365-372.
[8] 丁刘刚, 梁明, 郭晓蕾, 等.一种弹性蛋白肽及其制备方法、应用:中国, CN106381323A[P].2017-02-08.DING L G, LIANG M, GUO X L, et al.The invention relates to elastin peptide, preparation method and application thereof:China, CN106381323A[P].2017-02-08.
[9] 刘洋. 弹性蛋白肽的抗皮肤光老化功效及其作用机制研究[D].广州:华南理工大学, 2019.LIU Y.Study on protective effect of bovine elastin peptides against skin photoaging and its action mechanism[D].Guangzhou:South China University of Technology, 2019.
[10] HINEK A, WANG Y T, LIU K L, et al.Proteolytic digest derived from bovine Ligamentum Nuchae stimulates deposition of new elastin-enriched matrix in cultures and transplants of human dermal fibroblasts[J].Journal of Dermatological Science, 2005, 39(3):155-166.
[11] BODE W, FERNANDEZ-CATALAN C, GRAMS F, et al.Insights into MMP-TIMP interactions[J].Annals of the New York Academy of Sciences, 1999, 878:73-91.
[12] VALCARCEL J, NOVOA-CARBALLAL R, PÉREZ-MART N R I, et al.Glycosaminoglycans from marine sources as therapeutic agents[J].Biotechnology Advances, 2017, 35(6):711-725.
N R I, et al.Glycosaminoglycans from marine sources as therapeutic agents[J].Biotechnology Advances, 2017, 35(6):711-725.
[13] HOSSAIN A, DAVE D, SHAHIDI F.Northern sea cucumber (Cucumaria frondosa):A potential candidate for functional food, nutraceutical, and pharmaceutical sector[J].Marine Drugs, 2020, 18(5):274.
[14] 赵思惟, 秦勇, 王淼, 等.中华白玉蜗牛来源糖胺聚糖的提取、分离及其抗氧化活性分析[J].山东化工, 2023, 52(4):42-45.ZHAO S W, QIN Y, WANG M, et al.Extraction, isolation and antioxidant activity analysis of glycosaminoglycan from Chinese white jade snail[J].Shandong Chemical Industry, 2023, 52(4):42-45.
[15] CHAVAROCHE A A E, VAN DEN BROEK L A M, EGGINK G.Production methods for heparosan, a precursor of heparin and heparan sulfate[J].Carbohydrate Polymers, 2013, 93(1):38-47.
[16] 李清岚, 刘颖, 崔春.弹性蛋白肽的制备工艺优化及其理化性质分析[J].中国调味品, 2023, 48(6):189-194;220.LI Q L, LIU Y, CUI C.Optimization of preparation process of elastin peptides and analysis of their physicochemical properties[J].China Condiment, 2023, 48(6):189-194;220.
[17] QIAN B J, ZHAO X, YANG Y, et al.Antioxidant and anti-inflammatory peptide fraction from oyster soft tissue by enzymatic hydrolysis[J].Food Science &Nutrition, 2020, 8(7):3947-3956.
[18] REN D Y, WANG M S, SHEN M H, et al.In vivo assessment of immunomodulatory activity of hydrolysed peptides from Corylus heterophylla Fisch[J].Journal of the Science of Food and Agriculture, 2016, 96(10):3508-3514.
[19] 谷洁洁. 菌酶联合制备鸡胚蛋抗氧化肽及其抗氧化活性的研究[D].洛阳:河南科技大学, 2022.GU J J.Study on the preparation and antioxidant activity of antioxidant peptides from chicken embryo eggs by fermentation-enzymolysis strategy[D].Luoyang:Henan University of Science and Technology, 2022.
[20] 樊磊, 刘晓兰, 郑喜群.菌酶协同发酵玉米蛋白粉制备高可溶性蛋白饲料的研究[J].饲料研究, 2023, 46(21):47-53.FAN L, LIU X L, ZHENG X Q.Study on preparation of high soluble protein feed with corn gluten meal by co-fermented with bacteria and enzyme[J].Feed Research, 2023, 46(21):47-53.
[21] ROSSI J F, LU Z Y, MASSART C, et al.Dynamic immune/inflammation precision medicine:The good and the bad inflammation in infection and cancer[J].Frontiers in Immunology, 2021, 12:595722.
[22] WEI Q Y, LIU T, SUN D W.Advanced glycation end-products (AGEs) in foods and their detecting techniques and methods:A review[J].Trends in Food Science &Technology, 2018, 82:32-45.
[23] 吴优, 马夏吟, 刘永乐, 等.豆乳乳酸发酵过程中晚期糖化终末产物及氨基酸组分的变化规律[C].中国食品科学技术学会第十八届年会摘要集.2022.WU Y, MA X Y, LIU Y L, et al.Effects of lactic acid fermentation on the amounts of advanced glycation end-products and amino acid profile of soymilk[C].Abstracts of the 18th Annual Meeting of CIFST.2022.
[24] YUN J W.Possible anti-obesity therapeutics from nature:A review[J].Phytochemistry, 2010, 71(14-15):1625-1641.
[25] LIU M Z, SUN H J, WANG X F, et al.Association of increased expression of macrophage elastase (matrix metalloproteinase 12) with rheumatoid arthritis[J].Arthritis and Rheumatism, 2004, 50(10):3112-3117.