食品包装被用于食品运输、储存、销售过程中维持食品质量稳定性,延长食品的货架期。目前,食品包装主要来源于不可再生的化石能源,不仅会导致环境污染,还可能因塑料中的添加剂向食品中迁移影响人体健康[1]。可食用速溶包装作为一种新型包装,因其安全性和可降解性引起广泛关注[2]。
普鲁兰多糖是一种广泛应用于食品、医药和化妆品等行业的线性非离子多糖[3]。普鲁兰多糖膜具有透明度高、可印刷和可热封等优点,但由于价格昂贵且柔韧性差,限制了其在包装工业上的应用。可溶性大豆多糖膜具有良好的溶解性、柔韧性、抗黏结性和抗氧化性[4]。普鲁兰多糖与可溶性大豆多糖复配,不仅可以降低生产成本,还可一定程度上改善普鲁兰多糖膜的柔韧性。然而,多糖膜作为潜在碳源,易滋生微生物,影响食品品质[5]。例如,申志翔[6]采用玉米-小麦淀粉复合膜包装豆奶粉,在贮藏过程中观察到包装外表面有发霉现象。因此,有必要提高普鲁兰多糖-可溶性大豆多糖(pullulan-soluble soybean polysaccharide,PS)膜的抗菌性能。
ε-聚赖氨酸盐酸盐(ε-polylysine hydrochloride,ε-PL)是微生物代谢生产的一种小分子肽,具有广谱抗菌性,可以通过静电吸引力破坏细胞膜并干扰基因表达,最终导致微生物死亡[7]。鲍若晗等[8]研究表明添加ε-PL的海藻酸钠膜可有效抑制蓝莓贮藏过程中腐败菌的生长;YONG等[9]将ε-PL添加到大豆分离蛋白/海藻酸钠膜中,将牛肉的保质期延长了3 d。可见将ε-PL添加至可食用膜中提高膜的抗菌活性是可行的。
目前,关于添加ε-PL提高PS膜安全性和应用性的研究还鲜有报道。本研究将ε-PL添加到PS膜中,制备PS抗菌膜,分析ε-PL添加量对PS抗菌膜结构特征、物理性质和抗菌活性的影响,探究PS抗菌膜对大肠杆菌和金黄色葡萄球菌的抗菌活性,筛选出最适的ε-PL添加量,并评价其包装蛋白肽粉的应用效果,为新型绿色食品包装研发提供理论和技术支撑。
1 材料与方法
1.1 材料与仪器
普鲁兰多糖,上海阿拉丁生化科技股份有限公司;可溶性大豆多糖,山东聚源生物科技有限公司;甘油,国药集团化学试剂有限公司;ε-聚赖氨酸盐酸盐,浙江新银象生物工程有限公司;蛋白肽粉,采用脱脂南极磷虾粉(Euphausia superba)酶解制备;大肠杆菌(ATCC25922)和金黄色葡萄球菌(ATCC25923),中国工业微生物菌种保藏中心;LB培养基,海博生物技术有限公司。
XS105DU电子天平,上海梅特勒-托利多仪器有限公司;GZX-9140MBE鼓风干燥箱、BSC-150恒温恒湿箱、YXQ-LS-75立式高压蒸汽灭菌锅,上海博讯实业有限公司医疗设备厂;CR-400色差仪,日本Minolta公司;Iraffinity-1 s傅里叶红外光谱仪、UV-2600紫外分光光度计,日本Shimadzu公司;MiniFlex 600 X-射线衍射仪,日本Rigaku公司;SDC-100光学接触角测定仪,东莞盛鼎精密仪器有限公司;OS20-PRO搅拌器,北京大龙兴创实验仪器股份公司;ZQ-990LA电动拉力试验机,东莞市智取精密仪器有限公司;CV-RF热封试验仪,东莞西瓦卡精密量仪有限公司;SYA-7045 JY测厚规,德清盛泰芯电子科技有限公司;Sigma 300扫描电子显微镜,德国ZEISS公司;SW-CJ-2FD超净工作台,苏净集团苏州安泰空气技术有限公司;DH600BII电热恒温培养箱,天津泰斯特仪器有限公司。
1.2 实验方法
1.2.1 PS抗菌膜的制备
称取3 g普鲁兰多糖和3 g可溶性大豆多糖分别溶于100 mL去离子水中,270 r/min搅拌3 h,得到30 g/L普鲁兰多糖溶液和30 g/L可溶性大豆多糖溶液。将普鲁兰多糖溶液与可溶性大豆多糖溶液按9∶1(体积比)的比例混合,加入20%(质量分数)的甘油,分别添加0%、0.1%、0.2%、0.3%、0.4%和0.5%(质量分数)的ε-PL到混合溶液中,270 r/min搅拌3 h,得到成膜液。取20 mL成膜液倒入方形塑料皿(10 cm×10 cm),在25 ℃、40% RH下干燥24 h成膜。揭膜后置于25 ℃、50% RH的环境中平衡48 h,得到PS抗菌膜。将不同ε-PL添加量的抗菌膜分别命名为PS-0,PS-0.1,PS-0.2,PS-0.3,PS-0.4和PS-0.5。
1.2.2 膜的表征
1.2.2.1 微观形貌
将膜裁成20 mm×20 mm,采用扫描电子显微镜拍摄膜放大2 000倍的表面和截面形貌,截面采用液氮脆断并喷金处理。
1.2.2.2 傅里叶变换红外光谱(Fourier transform infrared spectroscopy,FTIR)
膜样品进行干燥处理,加入KBr充分研磨混匀,压片制成透明薄片,以KBr薄片作为空白对照,采用FTIR仪在波数范围4 000~ 600 cm-1下扫描32次。
1.2.2.3 X-射线衍射(X-ray diffraction,XRD)
采用XRD仪分析膜样品,扫描衍射角范围为5°~60°,扫描速率为2 °/min。
1.2.3 膜的物理性质
1.2.3.1 厚度
膜上随机选取5个位置,采用测厚规测量厚度,结果取平均值。
1.2.3.2 色差
采用色差仪测量膜颜色参数,以标准白板为对照,每个样品随机测量3个点。总色差(ΔE)按公式(1)计算:
(1)
式中:L*,样品亮度;a*,样品红绿度;b*,样品黄蓝度;L0,标准白板亮度;a0,标准白板红绿度;b0,标准白板黄蓝度。
1.2.3.3 水接触角
将膜(10 mm×20 mm)贴在载玻片表面,滴上10 μL去离子水,采用光学接触角测定仪测量膜的水接触角。
1.2.3.4 水分含量
将称量瓶在105 ℃鼓风干燥箱中烘干至恒重。称取1 g膜放入称量瓶中,在105 ℃的鼓风干燥箱中再次烘干至恒重。水分含量的计算方法按公式(2)计算:
水分含量![]()
(2)
式中:m1,膜的初始质量,g;m2,膜干燥后的质量,g。
1.2.3.5 机械性能
根据GB/T 1040.3—2006《塑料 拉伸性能的测定 第3部分:薄塑和薄片的试验条件》的方法,将膜裁成20 mm×80 mm,放入电动拉力试验机夹具中,设置夹具初始距离40 mm、试验速度50 mm/min,记录最大载荷和断裂变形。拉伸强度与断裂伸长率分别按公式(3)、公式(4)计算:
拉伸强度![]()
(3)
断裂伸长率![]()
(4)
式中:F,膜断裂瞬间所承受的最大负荷,N;S,膜的横截面积,m2;L,膜断裂时的长度,mm;L0,膜的原长,mm。
1.2.3.6 阻隔性能
水蒸气透过率[10]:膜裁成40 mm×40 mm,干燥恒重的称量瓶中放入3 g无水硅胶后将膜附在瓶口并用蜂蜡和石蜡的混合物密封。将称量瓶放入装有蒸馏水(100% RH)的干燥器中每24 h记录称量瓶的质量,持续一周。水蒸气透过率的计算方法按公式(5)计算:
水蒸气透过率![]()
(5)
式中:Δm/t,单位时间内称量瓶增加的质量,g/s;x,膜的厚度,cm;S,膜的试验面积,cm2;ΔP,膜两侧的蒸汽压差,Pa。
氧气透过率[11]:膜裁成40 mm×40 mm,附在装有3 g FeSO4·7H2O的称量瓶上并用橡胶和石蜡密封。将称量瓶放入含有饱和NaCl溶液(75% RH)的干燥器中每24 h记录称量瓶的质量,持续1周。氧气透过率的计算方法按公式(6)计算:
氧气透过率![]()
(6)
式中:Δm/t,单位时间内称量瓶增加的质量,g/s;x,膜的厚度,cm;S,膜的试验面积,cm2。
透光率:膜裁成5 mm×40 mm,放入分光光度计的测试池中。在200~800 nm波长范围内扫描,记录紫外可见透射光谱。
1.2.3.7 热封强度
根据LIU等[12]的方法,将膜裁成15 mm×80 mm,两张膜面对面对齐,使用热封试验仪对膜进行热封,热封参数为热封温度150 ℃,热封时间4 s,热封压力0.2 MPa。热封后的样品以180°展开,两端分别固定在电动拉力试验机的夹具上,设置夹具初始距离60 mm、试验速度300 mm/min,读取试样断裂时的最大载荷。热封强度按公式(7)计算:
热封强度![]()
(7)
式中:F,最大载荷,N;W,膜宽度,mm。
1.2.3.8 溶解时间
参考ZHAO等[13]的方法,称取1 g膜加入30 mL去离子水中,200 r/min搅拌至完全溶解,记录溶解时间。
1.2.4 膜的抗菌活性
参照LIAO等[14]的方法将膜裁成直径6 mm的圆片,紫外灯下膜两面各照射30 min。取100 μL的待测菌液在LB固体培养基上涂布均匀后,将圆片膜放在培养基上,以无菌滤纸作为对照。37 ℃培养24 h后测抑菌圈直径。
1.2.5 肽粉包装应用研究
1.2.5.1 肽粉包装和贮藏
将膜裁成9 cm×9 cm大小,对折并对长边和底部热封后得到热封袋,称取1 g肽粉加入热封袋中并进行封口,得到包装肽粉。将包装肽粉置于托盘中,在25 ℃、50% RH条件下的恒温恒湿箱中贮存60 d,分别于第0、5、10、15、20、25、30、60天取样。
1.2.5.2 外观
取包装肽粉置于光线良好、平整的桌面上进行拍照。
1.2.5.3 溶解时间
参考LIU等[12]的方法测定包装肽粉的溶解时间,将包装肽粉投入65 ℃水中并用玻璃棒搅拌(模拟食用过程)至完全溶解,记录溶解时间。
1.2.5.4 吸湿率
取包装肽粉进行称重,吸湿率计算方法如公式(8)所示:
吸湿率![]()
(8)
式中:m1,第0天包装肽粉质量,g;m2,储存一段时间后包装肽粉的质量,g。
1.2.5.5 菌落总数
参考GB 4789.2—2022 《食品安全国家标准 食品微生物学检验 菌落总数测定》方法测定包装膜及肽粉的菌落总数。将包装膜与肽粉分离,分别称取1 g膜样品和肽粉样品置于盛有9 mL无菌生理盐水的无菌离心管内,涡旋混合制成样品匀液,然后选择合适稀释度的样品匀液,吸取100 μL加入培养基中,涂匀。在培养箱中37 ℃培养48 h后记录菌落数量。
1.3 数据处理与分析
每个实验至少重复3次,结果以“平均值±标准差”表示。采用SPSS 26.0软件对数据进行单因素方差分析(ANOVA)和Tukey显著性检验,P<0.05为差异显著。采用Origin 2021软件绘图。
2 结果与分析
2.1 膜的表征
2.1.1 微观形貌
如图1所示,PS-0、PS-0.1、PS-0.2、PS-0.3和PS-0.4表面光滑平整,无空隙或裂纹,表明ε-PL和普鲁兰多糖、可溶性大豆多糖之间具有良好相容性;截面均匀致密,高度基本一致,与表1中PS抗菌膜厚度测量结果一致。此外,在PS-0.5的表面和截面观察到颗粒状物质,主要是由于过量的ε-PL趋于聚集,破坏了膜的均匀网络结构[14],同时这也是PS-0.5抗菌膜水蒸气透过率和氧气透过率有所提高的原因。
表1 膜的厚度、颜色、水接触角和水分含量
Table 1 Thickness, color, water contact angle, and moisture content of films
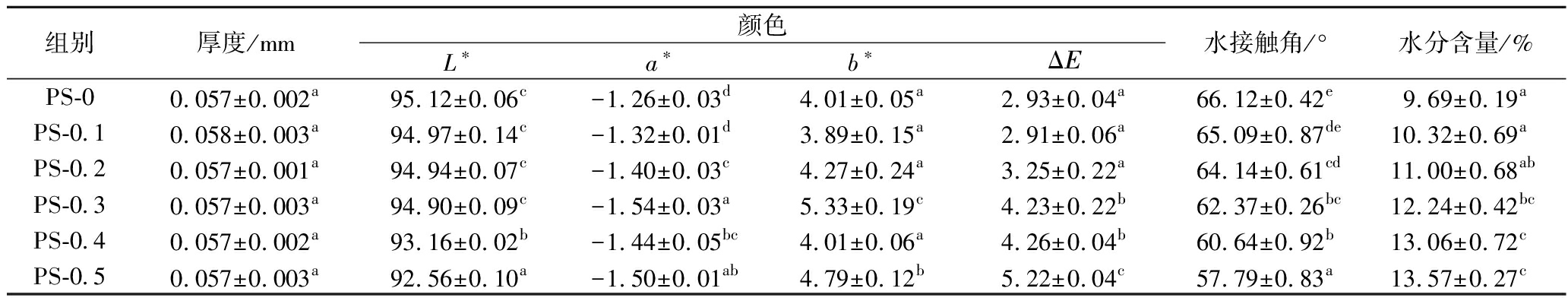
组别厚度/mm颜色L∗a∗b∗ΔΕ水接触角/°水分含量/%PS-00.057±0.002a95.12±0.06c-1.26±0.03d4.01±0.05a2.93±0.04a66.12±0.42e9.69±0.19aPS-0.10.058±0.003a94.97±0.14c-1.32±0.01d3.89±0.15a2.91±0.06a65.09±0.87de10.32±0.69aPS-0.20.057±0.001a94.94±0.07c-1.40±0.03c4.27±0.24a3.25±0.22a64.14±0.61cd11.00±0.68abPS-0.30.057±0.003a94.90±0.09c-1.54±0.03a5.33±0.19c4.23±0.22b62.37±0.26bc12.24±0.42bcPS-0.40.057±0.002a93.16±0.02b-1.44±0.05bc4.01±0.06a4.26±0.04b60.64±0.92b13.06±0.72cPS-0.50.057±0.003a92.56±0.10a-1.50±0.01ab4.79±0.12b5.22±0.04c57.79±0.83a13.57±0.27c
注:同一列中不同小写字母表示差异显著(P<0.05)(下同)。

图1 膜的微观形貌
Fig.1 Microscopic morphology of films
2.1.2 FTIR
如图2所示,未添加ε-PL的PS-0膜在3 691~3 013 cm-1处的特征峰归因于羟基的O—H键伸缩振动[15],随着ε-PL添加量的增加,该峰逐渐向更低波数移动,表明ε-PL与PS膜基质间发生相互作用,形成了氢键[14]。波数1 626 cm-1和1 050 cm-1处的峰分别对应乙酰基中的C![]() O和多糖分子中的鼠李糖半乳糖醛酸分子[16]。添加ε-PL后没有新的特征峰生成,表明ε-PL与PUL/SSPS之间具有很好的相容性。
O和多糖分子中的鼠李糖半乳糖醛酸分子[16]。添加ε-PL后没有新的特征峰生成,表明ε-PL与PUL/SSPS之间具有很好的相容性。
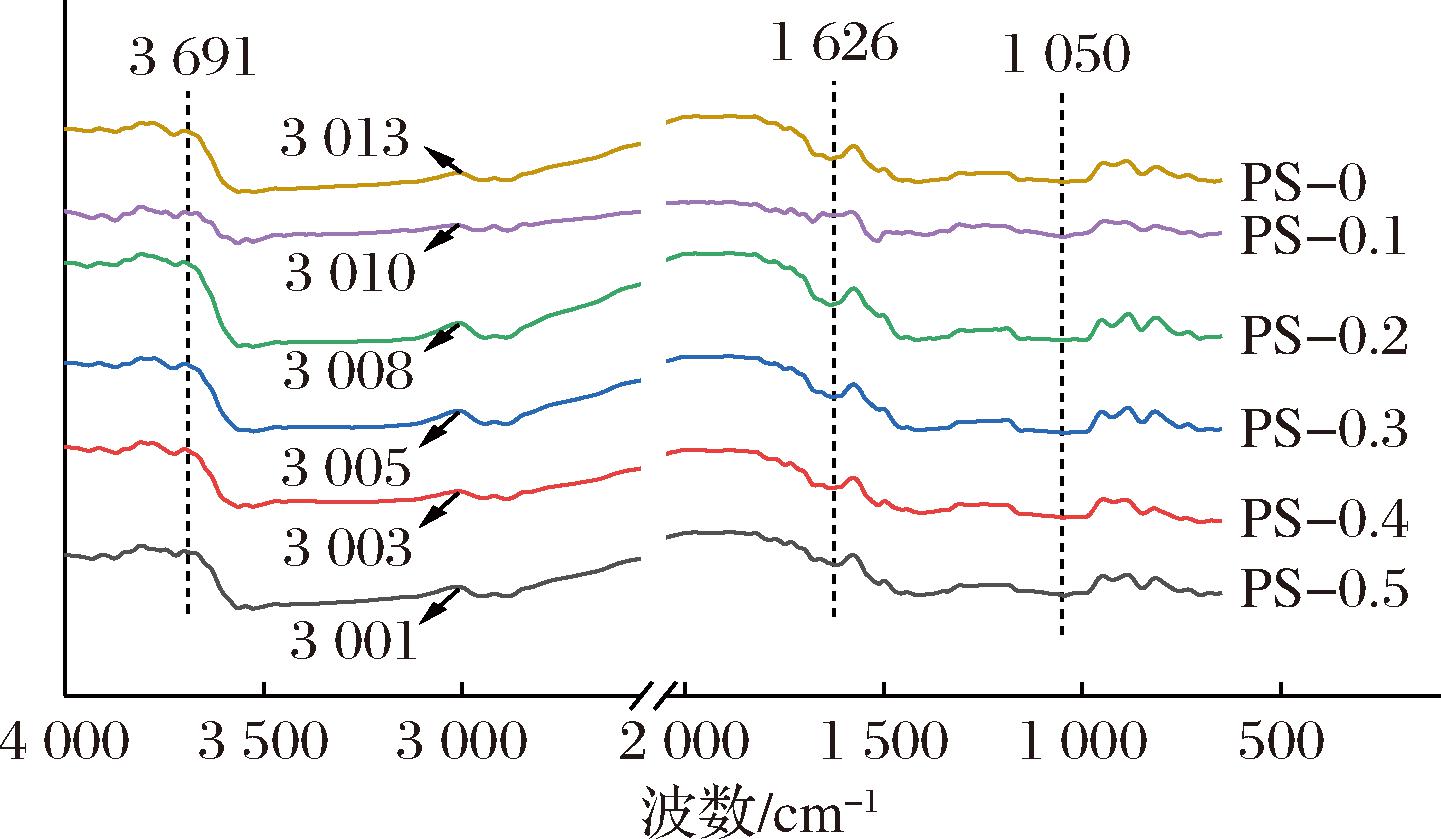
图2 膜的FTIR光谱
Fig.2 FTIR spectra of films
2.1.3 XRD
如图3所示,PS抗菌膜的XRD图谱在2θ为20°时出现衍射峰,表明抗菌膜具有无定形结构。此外,随着ε-PL添加量增加,PS抗菌膜对应的衍射峰强度有所降低,表明PS抗菌膜的结晶度降低,这种现象可能是由于ε-PL与PUL及SSPS基质之间形成了氢键[17],与FTIR结果一致。加入ε-PL后PS抗菌膜衍射峰位置没有发生明显变化,表明ε-PL与基质之间具有良好相容性,HE等[18]在羧甲基纤维素/ε-PL功能化明胶膜中也观察到相似的结果。
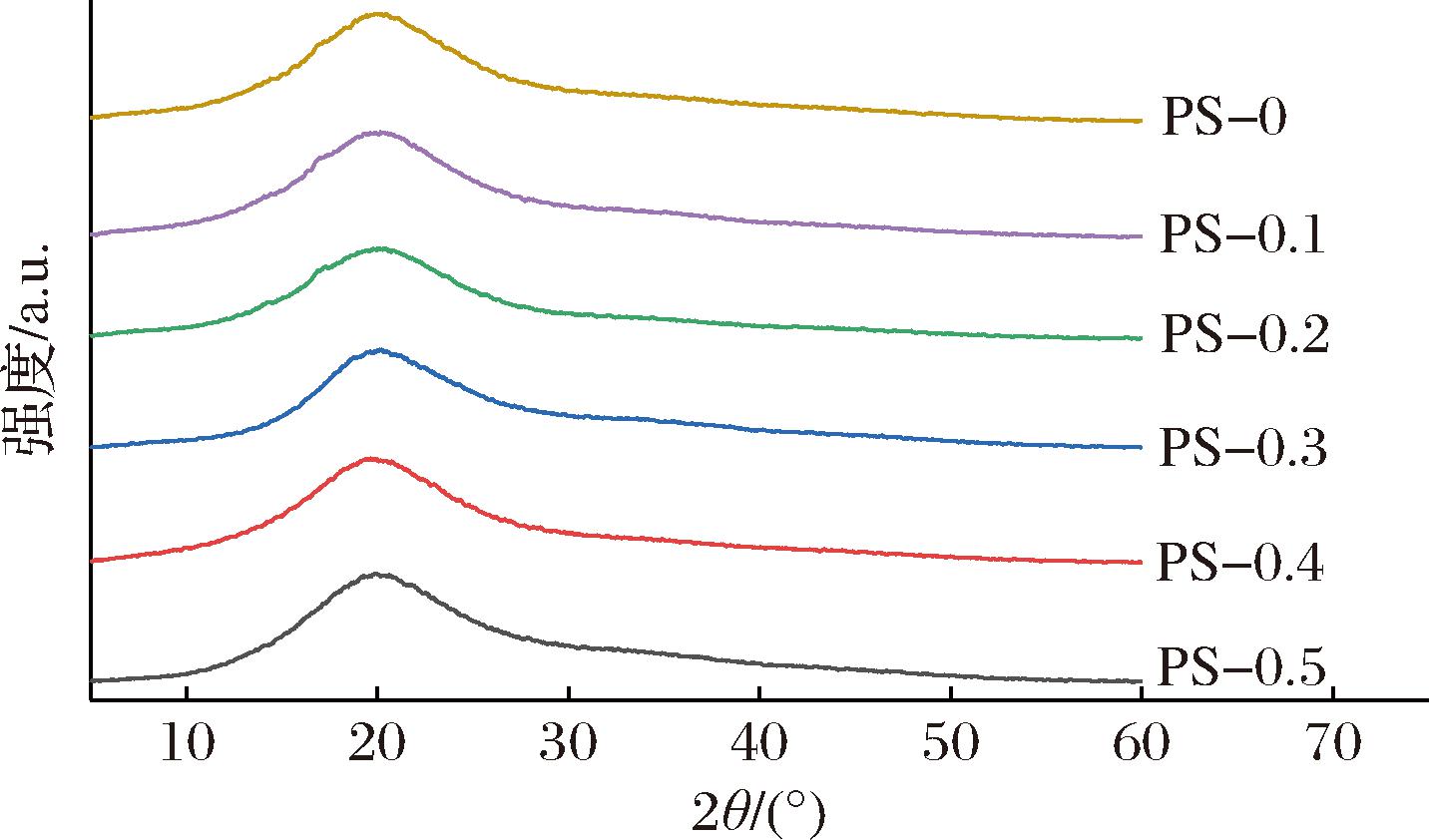
图3 膜的XRD图谱
Fig.3 XRD patterns of films
2.2 膜的物理性质
2.2.1 厚度、颜色、水接触角和水分含量
如表1所示,PS-0厚度为0.057 mm,添加ε-PL后膜的厚度没有显著变化(0.057~ 0.058 mm)(P>0.05),这可能是由于ε-PL添加量较少,不足以引起膜厚度的变化[18]。
L*、a*、b*和ΔE结果表明添加ε-PL显著降低了膜的亮度并使膜偏向黄绿色(P<0.05),随着ε-PL添加量增加,趋势更加明显,这主要是由于ε-PL本身为浅黄色[18]。PS-0.5膜ΔE值最大(5.22>5),表明此时膜的颜色变化可被肉眼识别[19]。
不同ε-PL添加量的PS抗菌膜水接触角均<90°,表明膜为亲水膜[20]。随着ε-PL添加量从0%增加到0.5%,膜的水接触角由66.12°降低至57.79°,这是由于ε-PL是一种亲水性物质,可以提高PS膜的表面亲水性[9]。此外,由于ε-PL自身的亲水性,进一步增强了膜与水分子之间的相互作用[21],进而导致PS膜的水分含量随ε-PL的添加逐渐增加。
2.2.2 机械性能
如图4所示,PS-0的拉伸强度为35.22 MPa,断裂伸长率为9.50%。加入ε-PL后,膜的拉伸强度显著降低(P<0.05),断裂伸长率显著增加(P<0.05),PS-0.5的拉伸强度降低至28.87 MPa,断裂伸长率增加至16.20%。这可能是由于ε-PL的加入与基质之间形成氢键,削弱了膜基质内部的相互作用强度,进而降低了膜的拉伸强度,同时ε-PL的加入提高了膜的水分含量(表1),水作为增塑剂提高了膜的断裂伸长率,加强了膜的柔韧性[22],与FTIR结果一致。ZHUANG等[23]研究发现,添加ε-PL后羧甲基壳聚糖/明胶膜的拉伸强度降低,断裂伸长率提高,与本研究结果趋势相同。因此,添加ε-PL可显著提高PS膜的柔韧性,有利于膜在食品包装时保持包装完整性。
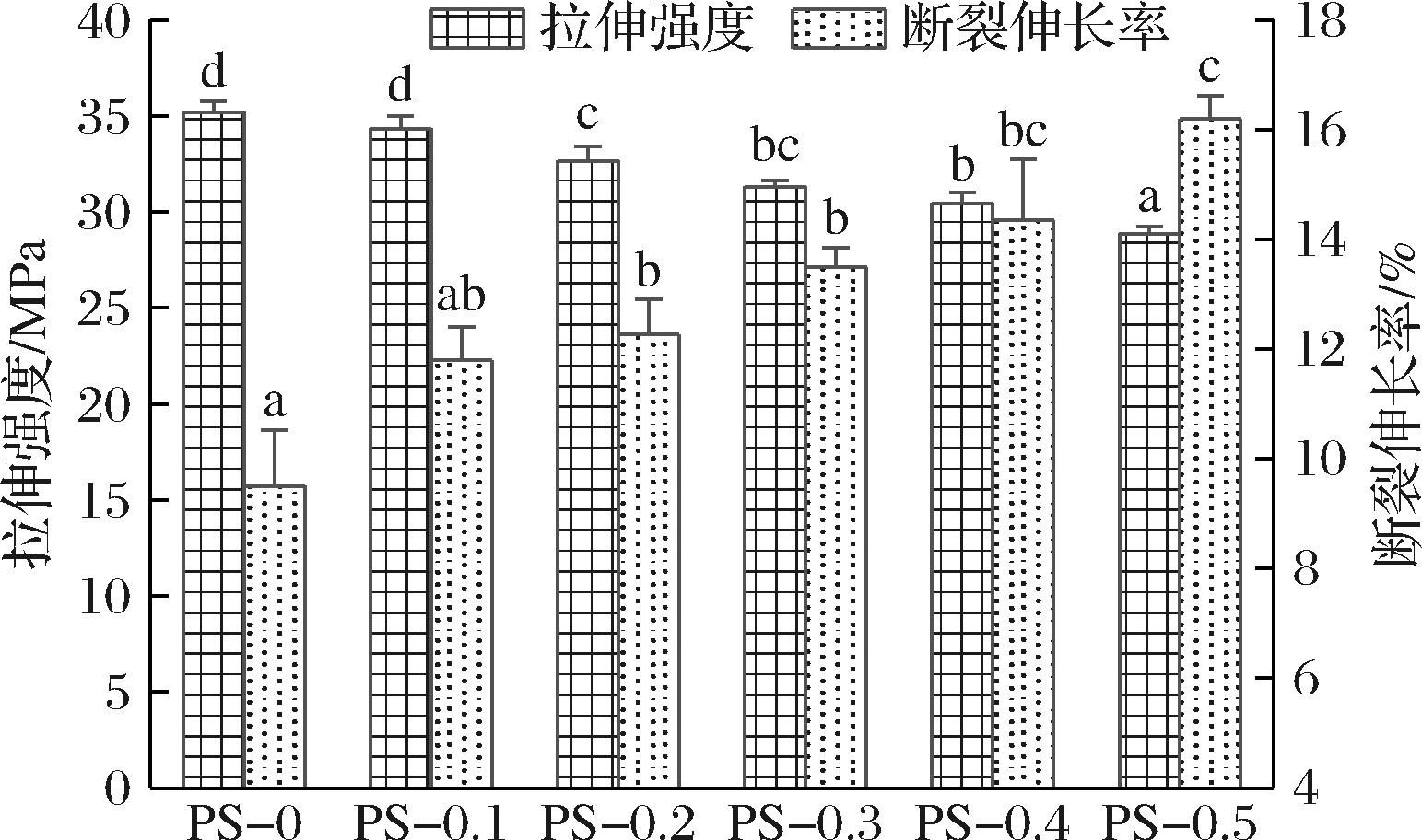
图4 膜的机械性能
Fig.4 Mechanical properties of films
注:同一指标的不同小写字母表示差异显著(P<0.05)(下同)。
2.2.3 阻隔性能
如图5所示,PS-0水蒸气透过率和氧气透过率分别为1.24×10-12 g·cm/(cm2·Pa·s)和0.66×10-10 g·cm/(cm2·s),随着ε-PL添加量增加,膜的水蒸气透过率和氧气透过率呈先降低后升高的趋势,当ε-PL添加量为0.4%时,PS-0.4膜的水蒸气透过率和氧气透过率达到最低,这是由于适量的ε-PL与成膜基质之间存在氢键相互作用,促成了网络结构的形成并抑制水分子和氧气的渗透[13],可以减少食品在包装过程中由于吸湿导致结块现象的出现。当ε-PL过多时会发生聚集并破坏PS抗菌膜的均匀性,缩短水分子和氧气在膜网络中的扩散路径,从而导致水蒸气透过率和氧气透过率上升[24]。
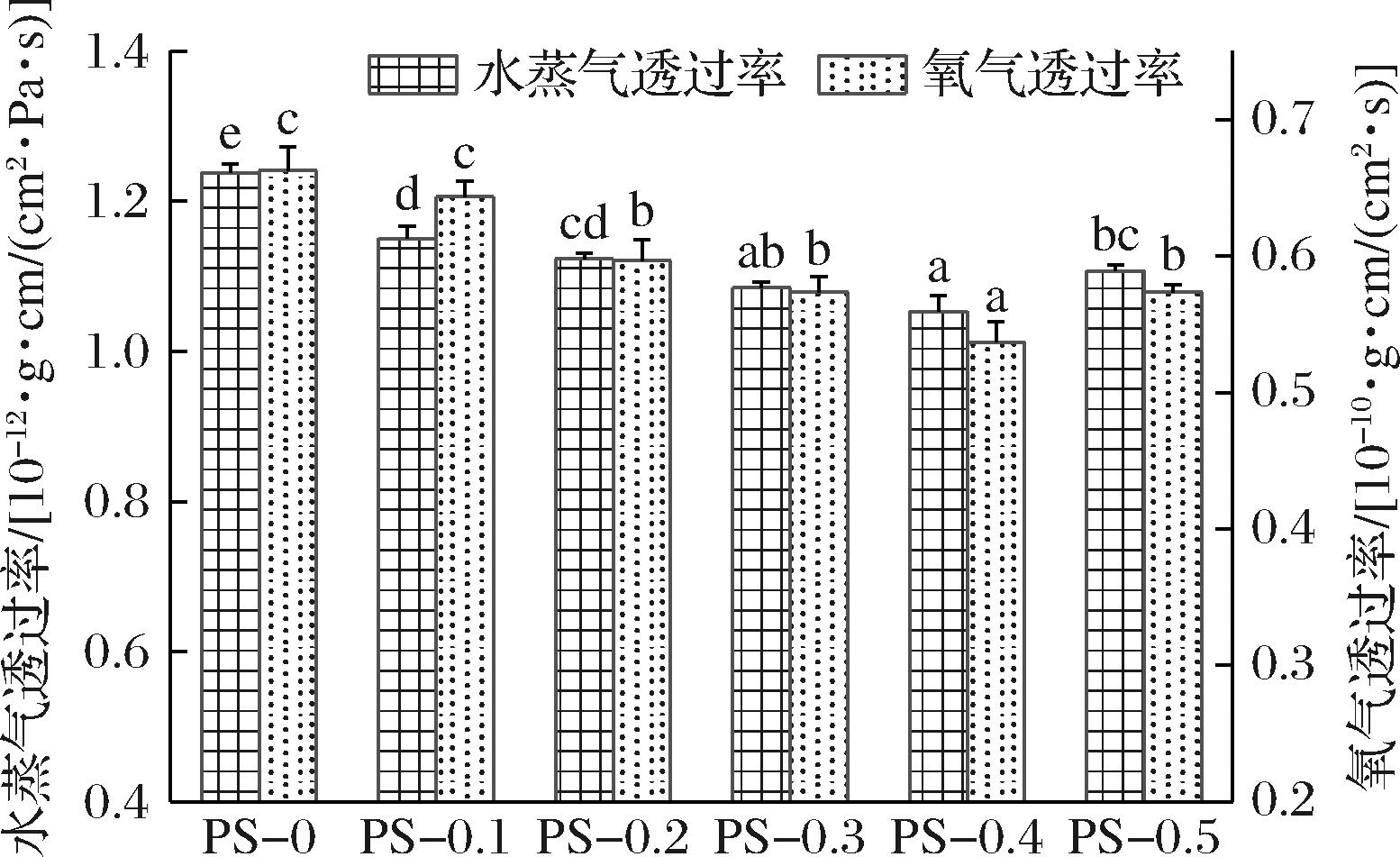
图5 膜的水蒸气透过率和氧气透过率
Fig.5 Water vapor permeability and oxygen permeability of films
透光率是食品包装材料的重要性能指标之一,直接决定包装材料的紫外阻隔性能并影响包装食品的外观。如图6所示,添加ε-PL的PS抗菌膜透光率降低,这与PS抗菌膜的颜色加深有关(表1),其中在紫外光谱范围(200~400 nm)的透光率下降明显,可能是ε-PL中的不饱和键吸收紫外光导致[7]。因此,ε-PL的加入提高了膜对紫外线的阻隔性能,有利于食品的储存。
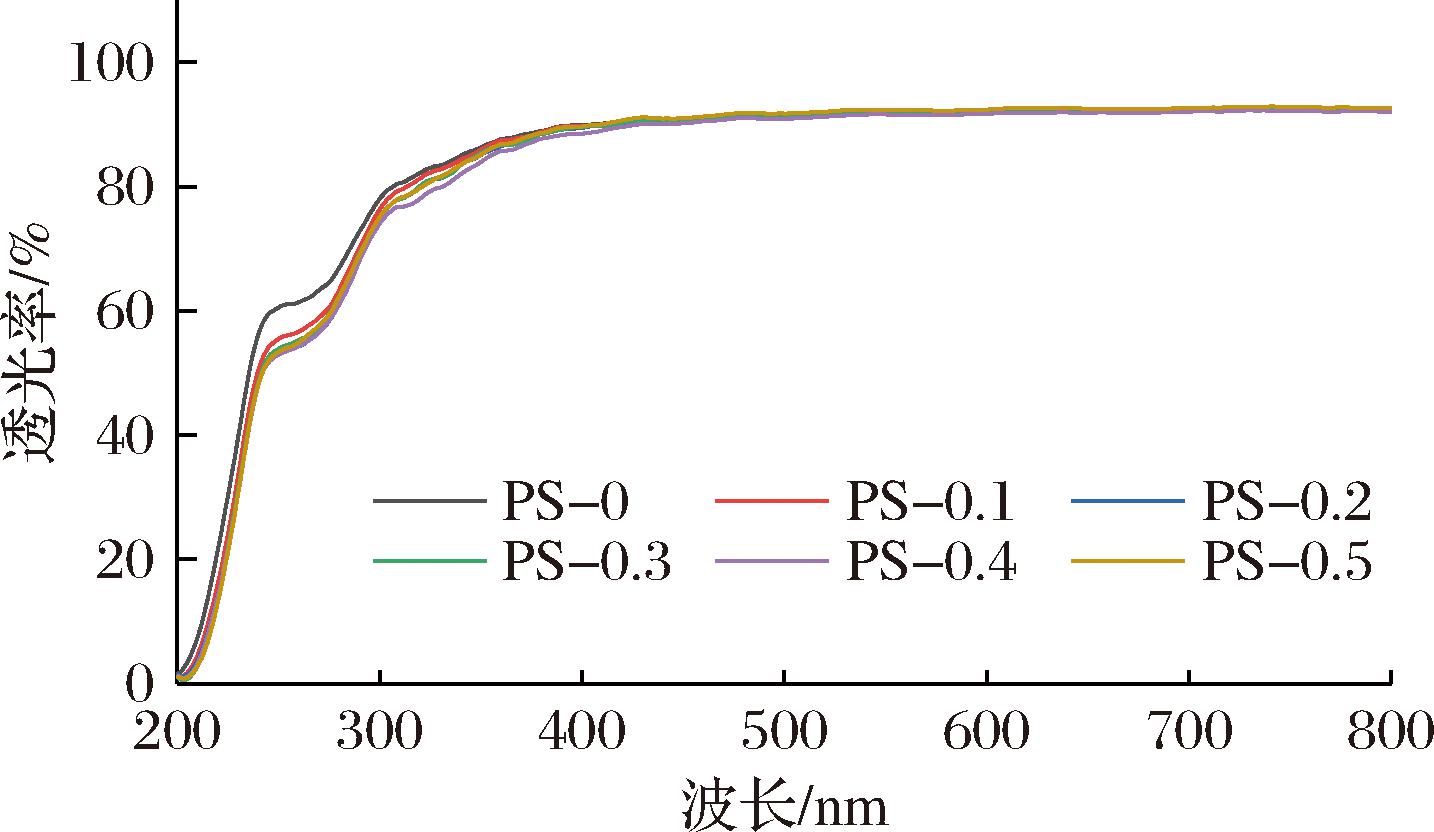
图6 膜的透光率
Fig.6 Transmittance of films
2.2.4 热封强度和溶解时间
热封强度是膜材料实现封闭式包装效果的关键性能指标,当膜的热封强度高于2.25 N/15 mm时,可满足膜密封的要求[25]。如图7所示,PS-0膜的热封强度为2.73 N/15 mm,随着ε-PL添加量增加,膜的热封强度保持在2.62~2.69 N/15 mm,与PS-0膜之间无显著差异(P>0.05)。李庆祥[26]研究鱼明胶/ε-PL/香芹酚抗菌复合膜的热封强度时观察到类似的现象。因此,ε-PL的添加对PS膜的热封强度无明显影响,可满足其作为食品热封包装的要求。
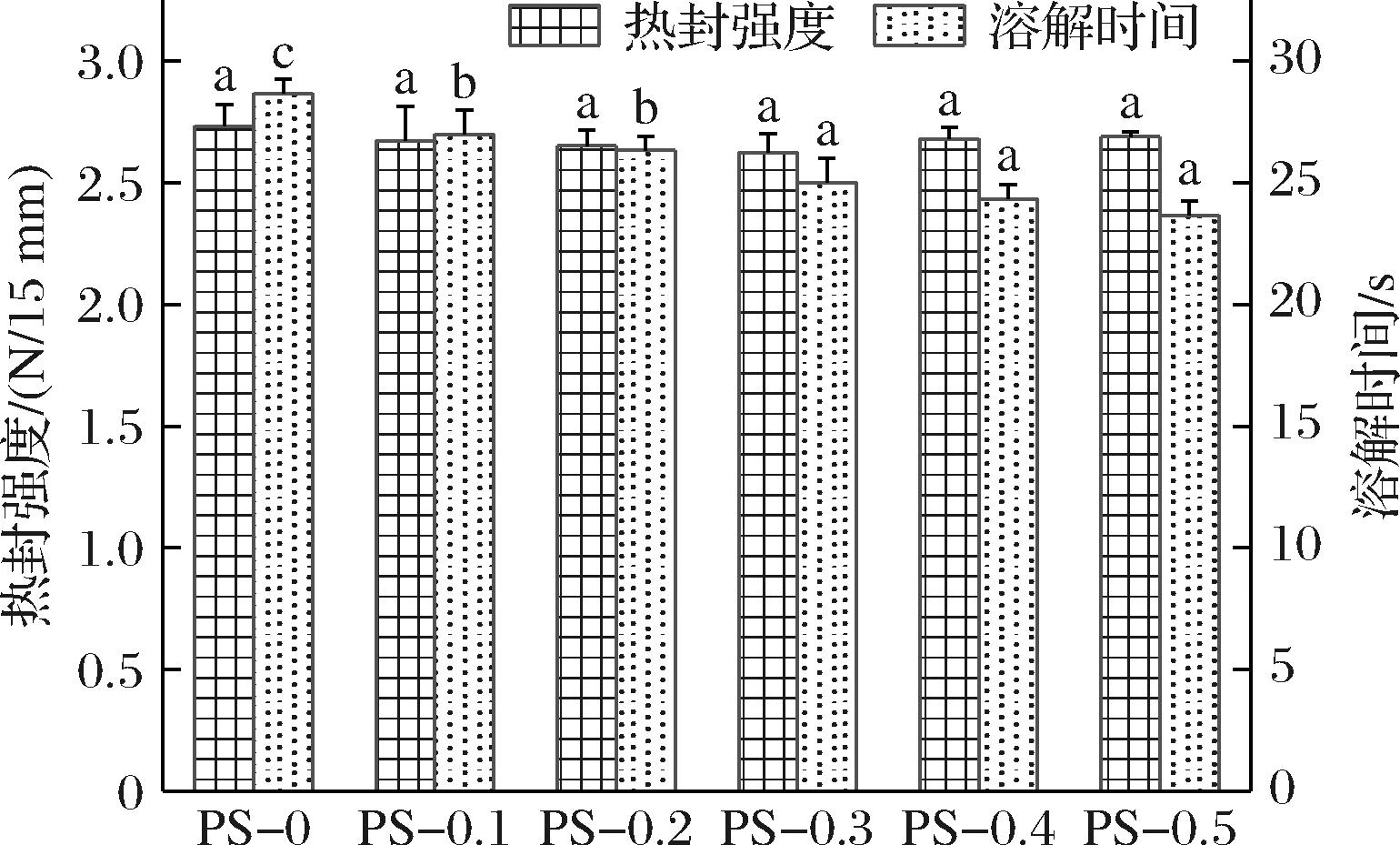
图7 膜的热封强度和溶解时间
Fig.7 Heat-seal strength and dissolution time of films
溶解性是衡量膜是否适合作为速溶食品包装的关键指标之一。如图7所示,不同ε-PL添加量的膜均可在30 s内溶解,且随着ε-PL添加量增加,膜溶解时间缩短,这可能是由于ε-PL的加入提高了PS膜的表面亲水性,增强了膜与水分子之间的相互作用进而提高膜的溶解性[13]。LIU等[12]研究发现,可溶性大豆多糖/明胶膜可在30 s内溶解于95 ℃的热水;LI等[27]研究发现,决明子胶/乙基纤维素膜在沸水中5 min的溶解率超过80%。本研究中添加ε-PL有助于提高PS膜的溶解性,其中,PS-0.4膜和PS-0.5膜可在25 s内完全溶解,表现出优异的速溶效果,具有作为速溶包装的应用潜力。
2.3 膜的抗菌活性
如图8-a所示,对照组和PS-0均未观察到抑菌圈,表明不具有抗菌活性。随着ε-PL添加量的增加,膜对大肠杆菌和金黄色葡萄球菌的抗菌活性逐渐增强,当ε-PL添加量由0.1%增加至0.4%时,膜对大肠杆菌的抑菌圈直径由6.61 mm增加到10.17 mm,对金黄色葡萄球菌的抑菌圈直径由6.03 mm增加到8.07 mm;继续增加ε-PL添加量,膜的抗菌效果无明显变化(P>0.05),方春姗等[28]在大豆分离蛋白改性膜中也发现了类似现象。此外,PS抗菌膜对大肠杆菌的抑制效果优于金黄色葡萄球菌,与汤秋冶等[29]对海藻酸钠抗菌复合膜的研究结果一致。结果表明,添加ε-PL可以提高PS膜的抗菌活性,当ε-PL添加量为0.4%时,PS-0.4抗菌效果最佳,有利于保证速溶食品在包装贮藏过程中的食用安全性。

a-抑菌圈照片;b-抑菌圈直径
图8 膜的抗菌活性
Fig.8 Antimicrobial activity of films
2.4 PS-0和PS-0.4包装蛋白肽粉的应用效果
2.4.1 包装外观及溶解时间
如表2所示,第0天时,PS-0组和PS-0.4组肽粉包装均密封性良好,包装肽粉颜色为白色,将肽粉连同包装投入水中,PS-0组在28 s左右溶解完全,而PS-0.4组可在23 s左右溶解完全,表明PS-0.4组速溶效果更好。贮藏30 d时,PS-0组的包装肽粉颜色为浅黄色,PS-0.4组外观没有发生明显改变,可能是因为PS组的包装肽粉吸湿较为严重。贮藏60 d时,PS-0组肽粉出现结块,PS-0.4组颜色略微发黄、无结块。申志翔[6]在玉米-小麦淀粉膜包装豆奶粉应用研究中也有类似发现。在贮藏期间,同一组中包装肽粉溶解时间无显著变化(P>0.05)。因此,与PS-0膜包装相比,PS-0.4速溶效果更佳,且可保持良好的包装和肽粉外观形态。
表2 贮藏过程中肽粉包装的外观及溶解时间
Table 2 Appearance and dissolution time of packaged peptide powder during storage

贮藏时间组别溶解时间/s外观0 dPS-028.33±0.48aPS-0.423.33±1.53a30 dPS-028.67±0.58aPS-0.424.33±0.58a60 dPS-028.33±1.15aPS-0.424.00±1.00a
2.4.2 吸湿率
如图9所示,PS-0组和PS-0.4组包装肽粉在贮藏过程中的吸湿率呈上升趋势。贮藏5 d时,PS-0组和PS-0.4组的包装肽粉质量发生细微变化,吸湿率分别为0.17%和0.15%。PS-0组肽粉包装从第15天开始吸湿率显著增加(P<0.05),第60天时达到4.20%。与PS-0组相比,PS-0.4组的肽粉包装吸湿率较为缓慢,在第60天时为2.06%。这可能是由于添加ε-PL后降低了抗菌膜的水蒸气透过率及透氧率,阻止了更多的水分子进入肽粉包装内部。结果表明,PS-0.4组比PS-0组具有更好的阻湿性能。
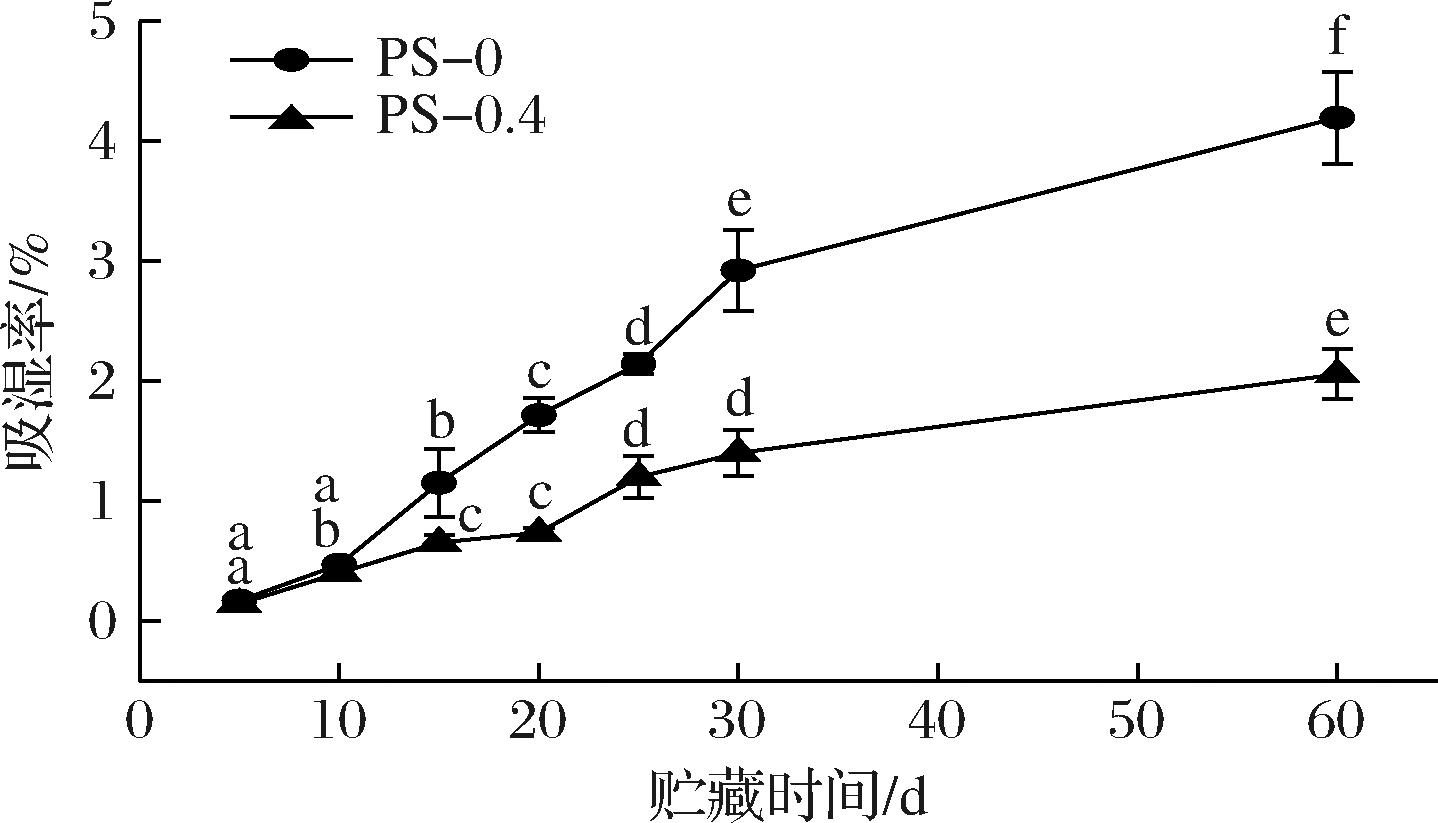
图9 包装肽粉在贮藏过程中的吸湿率
Fig.9 Moisture absorption rate of packaged peptide powder during storage
2.4.3 菌落总数
如图10所示,第0天时,PS-0组和PS-0.4组中膜和肽粉菌落总数均为0。在贮藏过程中,PS-0组的膜和包装肽粉分别在第5天和第15天检测到微生物,随后菌落总数逐渐上升,第60天分别达到3.94 lg CFU/g和3.39 lg CFU/g,这可能是由于PS-0组无抗菌活性,且其高吸湿率有利于微生物生长。与PS-0组相比,PS-0.4组的膜和包装肽粉分别在第25天和第60天检测到微生物,第60天的菌落总数分别为2.68 lg CFU/g和2.05 lg CFU/g,均低于PS-0组。因此,PS-0.4膜可有效降低包装本身及包装物滋生微生物的风险。
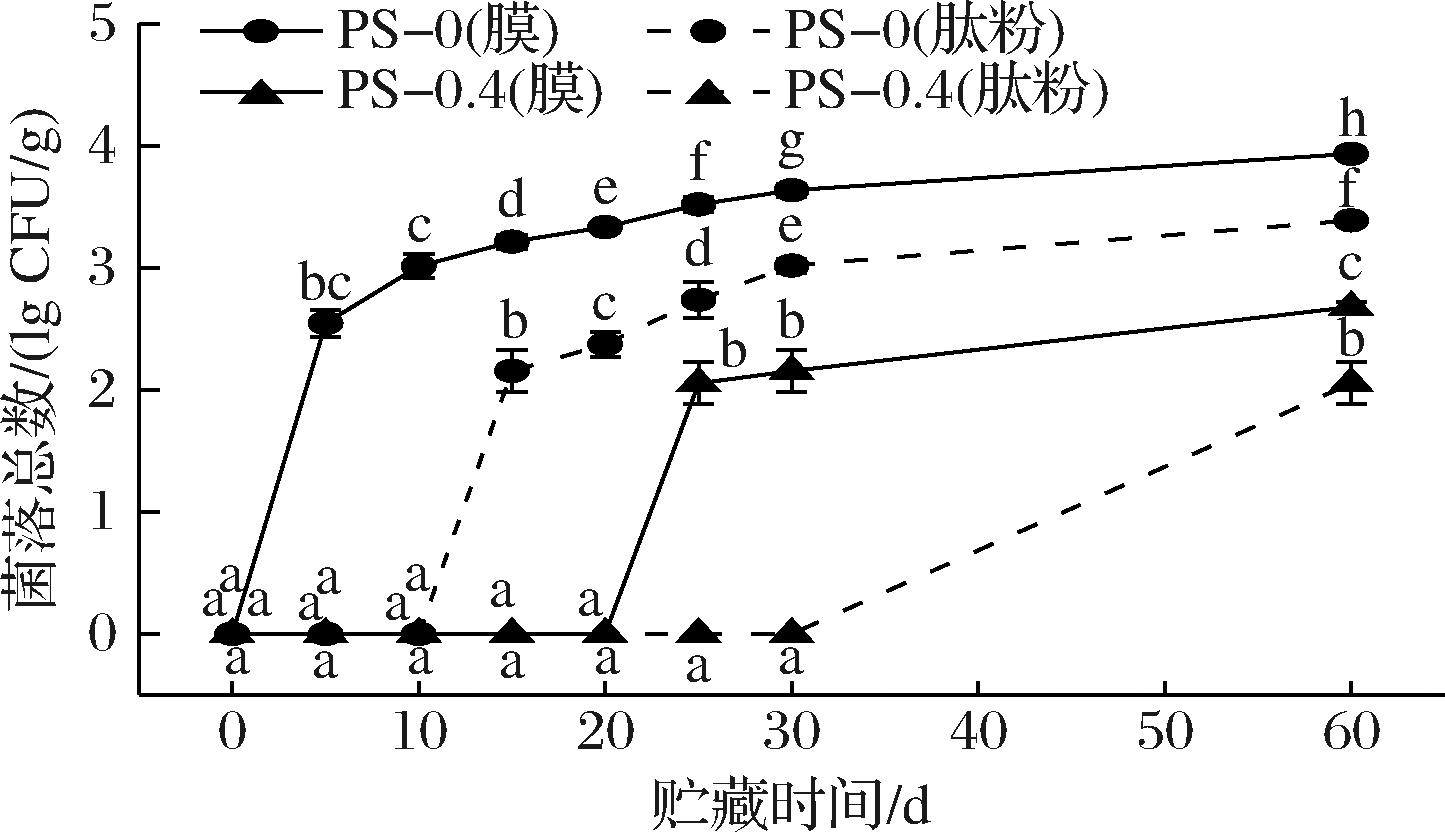
图10 包装肽粉和包装膜在贮藏过程中的菌落总数
Fig.10 The total plate count of packaged peptide powder and films during storage
3 结论与讨论
目前,大多数方便食品都采用由不可再生化石资源生产的塑料包装,导致环境污染并对消费者健康带来威胁。此外,塑料包装的机械强度和热封强度较高,在食用时封口难以撕开,食用时无法完全取出造成食物浪费。多糖基可食膜具有良好的水溶性、降解性、热封性、阻隔性等优点,但多糖易作为微生物碳源滋生病菌,进而影响食品品质[5]。ε-PL是微生物代谢生产的一种具有广谱抗菌性的肽,可以通过静电吸引力导致微生物死亡,在食品包装上得到广泛应用[7]。如RASHID等[30]将ε-PL添加到普鲁兰多糖/壳聚糖膜中,可以有效延长冷鲜牛肉的货架期。
本文探究了ε-PL添加量对PS膜性能的影响,并评价了其在肽粉包装上的应用效果。由于ε-PL添加量较少,未显著改变PS膜的厚度,这一结果与HE等[18]研究结果一致;FTIR和XRD图谱表明,ε-PL与成膜基质之间存在氢键相互作用,进而提高了阻隔性能,这可以有效减少食品贮藏过程中出现结块现象;作为一种亲水性物质,ε-PL的添加提高了PS膜的断裂伸长率、水分含量、表面亲水性及溶解性,具有良好的柔韧性及速溶性,可以作为速溶包装进行应用。PS-0.4和PS-0.5具有相似的热封强度、溶解性和抗菌活性,但PS-0.5因ε-PL添加量过高导致表面和截面出现颗粒状聚集,相比之下PS-0.4的微观结构光滑致密,对水蒸气和氧气的阻隔性能更强,更具速溶食品包装的应用潜力。应用实验结果进一步表明,PS-0.4包装肽粉可在25 s内溶解,与PS-0膜相比,PS-0.4膜在60 d贮藏时间内可有效降低包装的吸湿率,且有效抑制包装膜及肽粉被微生物污染。综上所述,PS-0.4膜更具有作为速溶食品包装的应用潜力,可以延缓肽粉在贮藏期间的品质变化。本研究拓展了PS膜的应用潜力,并为多糖基抗菌包装在速溶食品中的应用提供了重要参考。作为一种便携式速溶包装,PS抗菌膜在调味品内包装、载药口腔速溶膜及方便速食包装方面具有一定应用潜力。在后续实验中将探究PS抗菌膜在粉状食品及油脂类食品包装上的应用研究,并尝试对药品进行负载,测试其缓释效率,对PS抗菌膜的应用进行深入研究,拓宽应用范围。
[1] MENG W K, SUN H, SU G Y.Plastic packaging-associated chemicals and their hazards-An overview of reviews[J].Chemosphere, 2023, 331:138795.
[2] 马佳波, 戴静, 廖庭霞, 等.柠檬皮/聚乙烯醇/细菌纤维素复合膜的制备及性能研究[J].食品与发酵工业, 2024, 50(15):104-111.MA J B, DAI J, LIAO T X, et al.Preparation and properties of lemon peel/polyvinyl alcohol/bacterial cellulose composite membrane[J].Food and Fermentation Industries, 2024, 50(15):104-111.
[3] 郑稳, 庄文静, 宫萱, 等.普鲁兰多糖/壳聚糖/黄原胶/胶原蛋白复合膜的制备及保鲜效果研究[J].食品与发酵工业, 2023, 49(22):156-164.ZHENG W, ZHUANG W J, GONG X, et al.Preparation and preservation effect of pullulan polysaccharide/chitosan/xanthan gum/collagen composite coating[J].Food and Fermentation Industries, 2023, 49(22):156-164.
[4] 于上富, 李柏良, 刘文慧, 等.可溶性大豆多糖的功能特性与应用研究进展[J].中国食品添加剂, 2024, 35(1):296-302.YU S F, LI B L, LIU W H, et al.Research progress on functional characteristics and application of soluble soybean polysaccharides[J].China Food Additives, 2024, 35(1):296-302.
[5] 赵玉韩, 王涵, 张宇, 等.生物基可降解抑菌食品包装膜的研究进展[J].食品工业科技, 2024, 45(6):362-371.ZHAO Y H, WANG H, ZHANG Y, et al.Research progress of bio-based biodegradable antibacterial food packaging films[J].Science and Technology of Food Industry, 2024, 45(6):362-371.
[6] 申志翔. 玉米—小麦淀粉复合可食用膜的研究与应用[D].郑州:河南工业大学, 2018.SHEN Z X.Research and application of corn-wheat starch composite edible film[D].Zhengzhou:Henan University of Technology, 2018.
[7] GAO S, ZHAI X S, WANG W T, et al.Material properties and antimicrobial activities of starch/PBAT composite films incorporated with ε-polylysine hydrochloride prepared by extrusion blowing[J].Food Packaging and Shelf Life, 2022, 32:100831.
[8] 鲍若晗, 刘一帆, 孟岳成.海藻酸钠/ε-聚赖氨酸层层自组装可食膜对蓝莓保鲜效果的研究[J].中国食品添加剂, 2023, 34(6):271-280.BAO R H, LIU Y F, MENG Y C.Preservation effect of sodium alginate/ε-polylysine layer-by-layer self-assembly edible film on blueberry[J].China Food Additives, 2023, 34(6):271-280.
[9] YONG Y Y, GU Y Y, NABEEL AHMAD H, et al.Design and characterization of tannic acid/ε-polylysine biocomposite packaging films with excellent antibacterial and antioxidant properties for beef preservation[J].Food Chemistry, 2024, 439:138155.
[10] YANG J, FAN Y L, CUI J Y, et al.Colorimetric films based on pectin/sodium alginate/xanthan gum incorporated with raspberry pomace extract for monitoring protein-rich food freshness[J].International Journal of Biological Macromolecules, 2021, 185:959-965.
[11] ZHANG L M, LIU Z L, WANG X Y, et al.The properties of chitosan/zein blend film and effect of film on quality of mushroom (Agaricus bisporus)[J].Postharvest Biology and Technology, 2019, 155:47-56.
[12] LIU C, HUANG J, ZHENG X J, et al.Heat sealable soluble soybean polysaccharide/gelatin blend edible films for food packaging applications[J].Food Packaging and Shelf Life, 2020, 24:100485.
[13] ZHAO Y K, LI H, CHEN J, et al.A novel high water-soluble antibacterial films-based guar gum incorporated with Aloe vera gel and ε-polylysine[J].Food Chemistry, 2023, 427:136686.
[14] LIAO W Y, LIU X L, ZHAO Q, et al.Physicochemical, antibacterial and food preservation properties of active packaging films based on chitosan/ε-polylysine-grafted bacterial cellulose[J].International Journal of Biological Macromolecules, 2023, 253:127231.
[15] LIAN R Z, CAO J X, JIANG X H, et al.Physicochemical, antibacterial properties and cytocompatibility of starch/chitosan films incorporated with zinc oxide nanoparticles[J].Materials Today Communications, 2021, 27:102265.
[16] YU Z L, SUN L, WANG W, et al.Soy protein-based films incorporated with cellulose nanocrystals and pine needle extract for active packaging[J].Industrial Crops and Products, 2018, 112:412-419.
[17] THANGAVELU M, KULANDHAIVELU S V.Development and characterization of pullulan-carboxymethyl cellulose blend film for packaging applications[J].International Journal of Polymer Science, 2022, 2022(1):e9649726.
[18] HE B B, WANG Y F, JIANG Z X, et al.Physical properties and antibacterial activity of the composited films based on carboxymethyl cellulose and gelatin functionalized with ε-polylysine[J].International Journal of Biological Macromolecules, 2021, 191:1126-1136.
[19] PRIETTO L, MIRAPALHETE T C, PINTO V Z, et al.pH-sensitive films containing anthocyanins extracted from black bean seed coat and red cabbage[J].LWT, 2017, 80:492-500.
[20] 向飞, 李冲, 夏玉婷, 等.纳米TiO2对魔芋葡甘聚糖/玉米醇溶蛋白复合膜结构和性能的影响[J].食品工业科技, 2021, 42(9):221-227.XIANG F, LI C, XIA Y T, et al.Effect of nano titanium dioxide on the structure and properties of KGM/zein blend films[J].Science and Technology of Food Industry, 2021, 42(9):221-227.
[21] ZHENG T T, TANG P P, YANG C K, et al.Development of active packaging films based on collagen/Gallic acid-grafted chitosan incorporating with ε-polylysine for pork preservation[J].Food Hydrocolloids, 2023, 140:108590.
[22] CHEN M M, LI L L, XIA L, et al.Preparation of PLGA/ε-polylysine nanofibers and their application for pork preservation[J].Food Packaging and Shelf Life, 2023, 35:101031.
[23] ZHUANG D, LI R, WANG S C, et al.Reinforcing effect of ε-polylysine-carboxymethyl chitosan nanoparticles on gelatin-based film:Enhancement of physicochemical, antioxidant, and antibacterial properties[J].International Journal of Biological Macromolecules, 2024, 255:128043.
[24] JOMLAPEERATIKUL P, POOMSA-AD N, WISET L.Effect of drying temperatures and plasticizers on the properies of konjac flour film[J].Journal of Food Process Engineering, 2017, 40(3):e12443.
[25] QUILEZ-MOLINA A I, MAZZON G, ATHANASSIOU A, et al.A novel approach to fabricate edible and heat sealable bio-based films from vegetable biomass rich in pectin[J].Materials Today Communications, 2022, 32:103871.
[26] 李庆祥. 鱼明胶/ε-聚赖氨酸/香芹酚抗菌复合膜的制备与性能研究[D].福州:福州大学, 2021.LI Q X.Preparation and properties of fish gelatin/ε-polylysine/carvacrol antibacterial composite membrane[D].Fuzhou:Fuzhou University, 2021.
[27] LI T T, MENG F S, CHI W R, et al.An edible and quick-dissolving film from Cassia gum and ethyl cellulose with improved moisture barrier for packaging dried vegetables[J].Polymers, 2022, 14(19):4035.
[28] 方春姗, 姜维, 胡艺, 等.基于美拉德反应的大豆分离蛋白改性膜的制备及应用研究[J].食品安全质量检测学报, 2023, 14(7):241-249.FANG C S, JIANG W, HU Y, et al.Preparation and application of soybean protein isolate modified film based on Maillard reaction[J].Journal of Food Safety &Quality, 2023, 14(7):241-249.
[29] 汤秋冶, 潘道东, 孙杨赢, 等.ε-聚赖氨酸/海藻酸钠抗菌复合膜的制备及性能研究[J].中国食品学报, 2016, 16(12):101-107.TANG Q Y, PAN D D, SUN Y Y, et al.Preparation and performance study of ε-polylysine/sodium alginate antimicrobial composite film[J].Journal of Chinese Institute of Food Science and Technology, 2016, 16(12):101-107.
[30] RASHID A, QAYUM A, LIANG Q F, et al.Exploring the potential of pullulan-based films and coatings for effective food preservation:A comprehensive analysis of properties, activation strategies and applications[J].International Journal of Biological Macromolecules, 2024, 260:129479.