中国的饮食文化中,猪肉始终都占据着举足轻重的地位。早在《诗经》中“豚鱼吉”的记载,猪肉就成为人们饮食的一部分[1]。猪肉蛋白质含量高,还有丰富的脂肪、矿物质和维生素,营养价值高,在全球肉类消费量排名中居第一[2]。过油/油炸是中餐烹饪中非常受欢迎的一种加工方式,这种短时间高温加热方法会产生许多化合物,使肉类具有良好的颜色、特有的风味和口感[3],也会使肉质更加酥脆,锁住肉类食材的原始味道和口感,如炸猪排、软炸里脊、炸酥肉等,均是人民喜爱的菜肴种类。油炸温度和时间可以影响肉类食材的风味品质,也会形成杂环胺等风险因子,是近年来的研究热点。
目前,油炸肉类产品的油炸温度主要为150~200 ℃。一些学者主要研究了油炸温度对油炸肉类产品的理化品质[4]、油脂氧化劣变程度[5]以及产品中杂环胺生成[6-9]的影响。当加热温度超过100 ℃时,富含蛋白质的食物中会产生有害化合物,如丙烯酰胺、杂环胺(heterocyclic aromatic amines,HAA)。HAA是一种加工污染物,在热处理肉制品过程中发生的美拉德反应会诱导致癌致突变的杂环胺类化合物产生。HAA的含量和类型受许多因素影响,包括加工方法[10]、烹饪温度和持续时间[11]。油炸因其高温热加工属性,通常会促进HAA的形成[12]。热加工中烹饪温度和持续时间是影响HAA形成的主要因素[13],根据加热温度将杂环胺分为热反应杂环胺和热降解杂环胺[14]。HAA的存在会对人体健康造成巨大威胁,国际癌症研究机构(International Agency for Research on Cancer,IRAC)于1993年将2-氨基-3,4-二甲基-3H-咪唑并[4,5-f]喹啉(2-amino-3,4-dimethylimidazo[4,5-f]quinolonem, MeIQ)、2-氨基-3,8-二甲基吲哚并[4,5-f]喹喔啉(2-amino-3,8-dimethylimidazo[4,5-f]quinoxaline, 8-MeIQx)、2-氨基-1-甲基-6-苯基-咪唑并[4,5-b]吡啶(2-amino-1-methyl-6-phenylimidazo[4,5-b]pyridine, PhIP)、2-氨基-9H-吡啶[2,3-b]吲哚(2-amino-9H-pyrido[2,3-b]indole, AαC)等定义为潜在致癌物(2B级),将2-氨基-3-甲基咪唑并[4,5-f]喹啉(2-amino-3-methylimidazo[4,5-f]quinolin, IQ)定义为可能致癌物(2A级)。据报告,HAA的致突变性分别比黄曲霉毒素B1和苯并芘高100倍和2 000倍[15]。流行病学研究表明,癌症发病率与HAA的摄入量呈正相关[16-17]。HAA可导致啮齿动物某些器官的癌症,包括乳腺癌、结肠癌和前列腺癌。HAA还会引起毒性作用,如唾液腺萎缩和心肌变性[18]。尽管1-甲基-9H-吡啶并[2,3-b]吲哚(1-methyl-9H-pyrido[3,4-b]indole, Harman)和9H-吡啶并[2,3-b]吲哚(9H-pyrido[3,4-b]indole, Norharman)没有被列为致癌物,但它们是共诱变剂或诱变剂、神经毒素和致癌物的前体[19-21],IARC建议减少HAA的每日摄入量。因此,有必要控制油炸猪肉中HAA的产生。
近几年油炸的加工方式受到了消费者的青睐,油炸食品的安全性也受到了广泛关注,但大多数猪肉中HAA的生成研究都集中在卤制、烘烤和煎炸[3,11,13,22-24]的加工方式上,同时,对于温度和时间变化对油炸猪肉中HAA的动态生成影响及其与品质变化的相关性研究鲜有报道,对于消费者或餐饮机构来说,没有关于热处理条件的建议,以确保油炸猪肉产品的高质量和安全性。因此,本研究拟考察油炸猪里脊的油炸温度(150~190 ℃)和时间(1~5 min)对猪里脊品质和HAA形成的影响,获得合理的油炸工艺以减少HAA对人体健康的威胁。
1 材料与方法
1.1 材料与试剂
三元杂交猪里脊肉(雄性大白猪,7~9月龄,宰后排酸成熟12 h),重庆市北碚区天生丽街超市提供,置于4 ℃冰箱待用。
13种HAA混标:2-氨基-二吡啶[1,2-a:3′2′-d]咪唑(2-amino-dipyrido[1,2-a:3′2′-d]imidazole, GIu-P-2)、2-氨基-3-甲基-咪唑并[4,5-f]-喹喔啉(2-amino-3-methylimidazo[4,5-f]quinoxaline, IQx)、2-氨基-6-甲基二吡啶[1,2-a:3′2′-d]咪唑(2-amino-6-methyldipyrido[1,2-a:3′2′-d]imidazole, GIu-P-1)、2-氨基-3,4,8-三甲基-咪唑并[4,5-f]-喹喔啉(2-amino-3,4,8-trimethylimidazo[4,5-f]quinoline, 4,8-DiMeIQx)、2-氨基-3,7,8-三甲基-咪唑并[4,5-f]-喹喔啉(2-amino-3,7,8-trimethylimidazo[4,5-f]quinoline, 7,8-DiMeIQx)、2-氨基-3,4,7,8-四甲基-3H-咪唑[4,5-f]-喹喔啉(2-amino-3,4,7,8-tetramethylimidazo[4,5-f]quinoline, 4,7,8-TriMeIQx)、3-氨基-1,4-二甲基-5H-吡啶并[4,3-b]吲哚(3-amino-1,4-dimethyl-5H-pyrido[4,3-b]indole, Trp-P-1)、MeIQ、PhIP、AαC、8-MeIQx、Norharman、Harman,天津阿尔塔科技有限公司;菜籽油,四川省天府好粮油有限公司;乙腈、甲醇为色谱纯,冰乙酸、盐酸、无水硫酸镁、无水醋酸钠、乙酸铵均为分析纯,阿拉丁生化科技股份有限公司。
1.2 仪器与设备
35A电炸锅,中山市斯乐得电器有限公司;030700全自动测色色差仪,美国HunterLab公司;TA.XT Plus990000质构仪,英国SMS公司;LCMS-8060 NX010502超高效液相色谱-三重四极杆质谱联用仪,日本岛津公司;PHS-25数显酸度计,杭州雷磁分析仪器厂;C3-X红外热成像仪,特励达菲力尔有限责任公司;MesoMR23-060H-1低频核磁共振仪(low-field nuclear magnetic resonance,LF-NMR),苏州纽迈分析仪器股份有限公司;FB09B小型研磨机,浙江苏泊尔股份有限公司;SS-95切条机,永康市我趣工贸有限公司。
1.3 实验方法
1.3.1 样品的制备
从冰箱中取出猪里脊,沥干表面附着水分,将肉放入切条机中切条(1.5 cm×1.5 cm×5 cm),将切分后的里脊条分装并称重。
油炸时间和温度的影响:电炸锅提前预热10 min并用红外热成像仪进行检测,达到设定温度后,在设定的油炸温度下(150、160、170、180、190 ℃)油炸猪里脊3 min,考察油炸温度的影响;在油炸温度170 ℃下分别油炸1、2、3、4、5 min,考察油炸时间的影响。将油炸好的里脊条冷却至室温并称重,部分样品用料理机打成粉末后于-80 ℃冰箱保存,用于相关指标的测定。
1.3.2 油炸猪里脊品质的测定
1.3.2.1 温度动态变化的测定
将接入温度采集器的热电偶探头分别置于油炸锅中心,另一只插入猪里脊中心,再将猪里脊放入已经预热好的油中,油炸时每隔1 s记录1次温度读数,煎炸至180 s结束。每个温度检测3次。
1.3.2.2 水分含量及烹饪损失的测定
分别称量油炸前后猪里脊样品质量,按公式(1)计算烹饪损失;取油炸后的粉碎样品2 g,在105 ℃烘箱中烘干24 h,按照公式(2)计算水分含量:
烹饪损失![]()
(1)
水分含量![]()
(2)
式中:m0为油炸前猪里脊质量,g;m1为油炸后猪里脊质量,g;m2油炸后粉碎样品的质量,g;m3为粉碎样品烘干后的质量,g。
1.3.2.3 pH的测定
称取搅碎肉样2 g,加入20 g的KCl溶液,磁力搅拌均匀后用pH计测试,每个样品平行测定3次。
1.3.2.4 色泽的测定
采用全自动测色色差仪进行测量油炸后猪肉里脊条的色泽,将样品放置于测量室,读取并记录样品内部和外部的a*、b*、L*值,每个样品平行测定5次。
1.3.2.5 质构的测定
采用配有P/36探头的质构仪测定油炸样品的全质构,包括硬度、弹性、内聚性、胶黏性以及咀嚼性。将沥油并冷却至室温的样品切成1 cm×1 cm×1 cm小方块,置于载物台上,每个样品平行测定5次。
1.3.2.6 LF-NMR测定水分以及油脂分布
从里脊样品中心处切质量约为0.8 g的长方体样品,移入1.5 mL小型离心管中,分别置于永磁场中心位置的射频线圈的中心进行测定,磁体-探头为MesoMR23-060H-Ⅰ-15 mm,质子共振频率设置为21 MHz。利用CPMG(Caarr-PurceⅡ-Meieiboom-Gill)脉冲序列测定样品的自旋-自旋弛豫时间(T2)。其他参数设置如下:采集点数TD=40 016,谱宽SW=100 kHz,TW=4 000 ms, NS=8,T=0.100 ms,回波个数NECH=4 000,RFD=0.400 ms,O1=278 027.50 Hz,P1=6.00 μs,RG1=20.0 db,DRG1=3,P2=12.00 μs。
1.3.3 油炸猪里脊中HAA的测定
参考NY/T 3904—2021《肉及肉制品中杂环胺检测 液相色谱-串联质谱法》进行。称取试样2.000 0 g放入50 mL离心管中,加入陶瓷均质子和10 mL超纯水,立即涡旋1 min后加入10 mL体积分数1%乙酸-乙腈溶液,涡旋5 min,室温下超声30 min提取。加入4 g无水硫酸镁,1 g无水醋酸钠,涡旋混合1 min。混合物在4 ℃,10 000 r/min下离心10 min,取上层有机溶液6 mL移入15 mL离心管中,加入0.9 g MgSO4、0.3 g乙二胺-N-丙基硅烷和0.3 g End Capped-C-18EC固相萃取填料后2 800 r/min均质1 min。再4 ℃、10 000 r/min离心5 min;取上清液1 mL,30 ℃氮吹,在干物质中加入0.50 mL甲醇复溶,涡旋溶解。通过0.22 μm PVDF过滤膜过滤,得到的溶液用于UHPLC-MS/MS分析。
液相色谱条件:Zorbax SB-C18色谱柱(2.1 mm×50 mm, 1.8 μm);流动相,A为乙酸-乙酸按缓冲液,B为乙腈;梯度洗脱程序:0~0.5 min,95%~95%A;0.5~5 min,95%~85%A;5~7 min,85%~73%A;7~8 min,73%~45%A;8~8.5 min,45%~73%A;8.5~9 min,73%~95%A;9~10 min,95%~95%A。流速0.4 mL/min;柱温30 ℃;进样量2.0 μL。质谱条件为:采用电喷雾离子源,正离子模式(ESI+)进行电离和多反应监测进行质谱数据采集。ESI+参数如下:干燥气温度200 ℃;干燥气流量10 L/min;雾化气压力40 V;鞘气温度260 ℃;鞘气流量11 L/min;毛细管电压,正电压4 000 V;喷嘴电压,正电压0 V。
1.3.4 油炸猪里脊的感官评价
参考WANG等[13]的方法稍作修改。待油炸猪里脊样品冷却后,由10名经过感官培训的评定人员组成的小组对不同油炸条件下的10组油炸猪里脊样本进行了评价。每个小组成员都被要求对样品的颜色、气味、味道、口感和总体可接受性进行评级。每个项目采用1~9分的评分标准。通过将每个小组成员确定的平均分相加,计算出5个项目中每个项目的每个样本的总分。具体感官评价标准如表1所示。
表1 油炸猪里脊感官评价表
Table 1 Sensory evaluation table for fried pork tenderloin
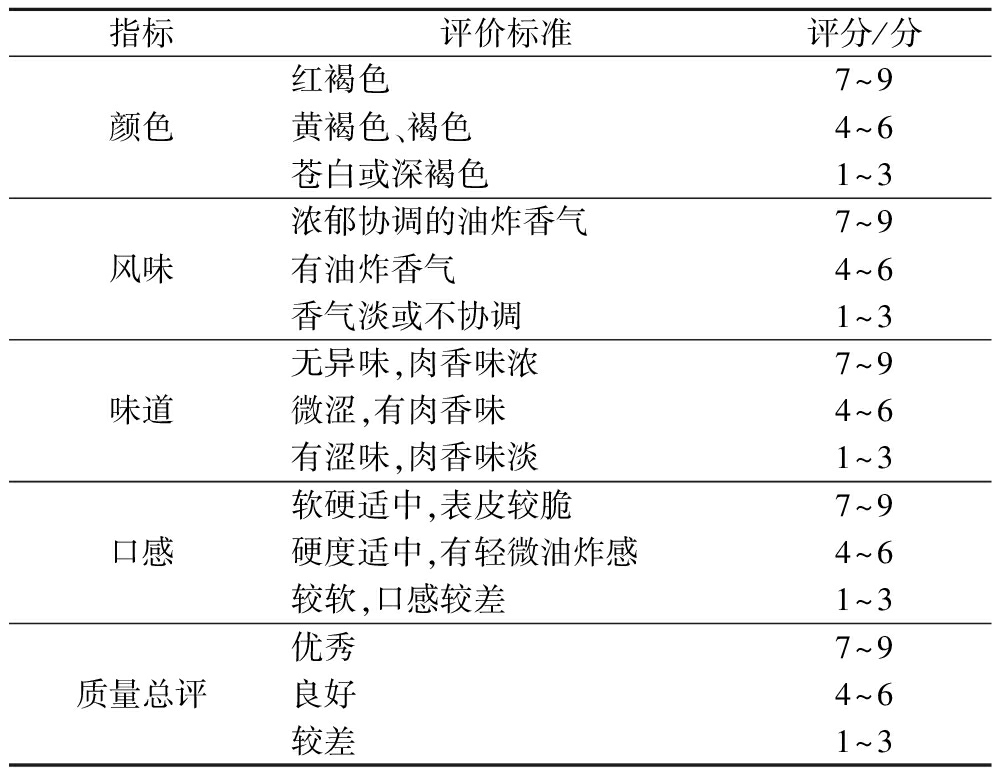
指标评价标准评分/分颜色红褐色7~9黄褐色、褐色4~6苍白或深褐色1~3风味浓郁协调的油炸香气7~9有油炸香气4~6香气淡或不协调1~3味道无异味,肉香味浓7~9微涩,有肉香味4~6有涩味,肉香味淡1~3口感软硬适中,表皮较脆7~9硬度适中,有轻微油炸感4~6较软,口感较差1~3质量总评优秀7~9良好4~6较差1~3
1.3.5 数据分析
数据采用SPSS 26进行单因素方差分析(ANOVA)。经Tukey检验,差异有统计学意义(P<0.05)。结果以平均值±标准偏差表示。相关性分析(Pearson)通过Origin 2021 Pro中correlation plot功能计算,结果以图片形式呈现。采用Origin 2021 Pro、Prism 9.0绘图。
2 结果与分析
2.1 不同油炸温度和时间对猪里脊理化指标的影响
如表2所示,在相同油炸时间条件下(3 min),温度达到160 ℃后pH显著增加,且随温度升高后趋于平稳,而烹饪损失随温度升高而增大,在达到180 ℃后表现出显著差异。油炸猪肉样品中的水分含量随温度升高而降低,温度升高促进了物质交换,导致样品失水加快。烹饪损失与水分呈负相关,推测水分是烹饪损失的主要成分。在加热过程中,里脊条中的营养成分会通过美拉德反应发生降解,使肉样多孔,促进水分流失,加剧烹饪损失。在固定油炸温度条件下(170 ℃),延长油炸时间并没有导致pH的显著变化,表明在温度一定时,油炸过程中反应环境pH较稳定。但随油炸时间增加,烹饪损失显著增大而样品水分显著减少,说明油炸温度越高或油炸时间越长,样品内部的物质交换越多,烹饪损失越大。
表2 油炸温度和时间对里脊条理化指标的影响
Table 2 Effects of frying different temperatures and times on the physicochemical properties of pork loin strips
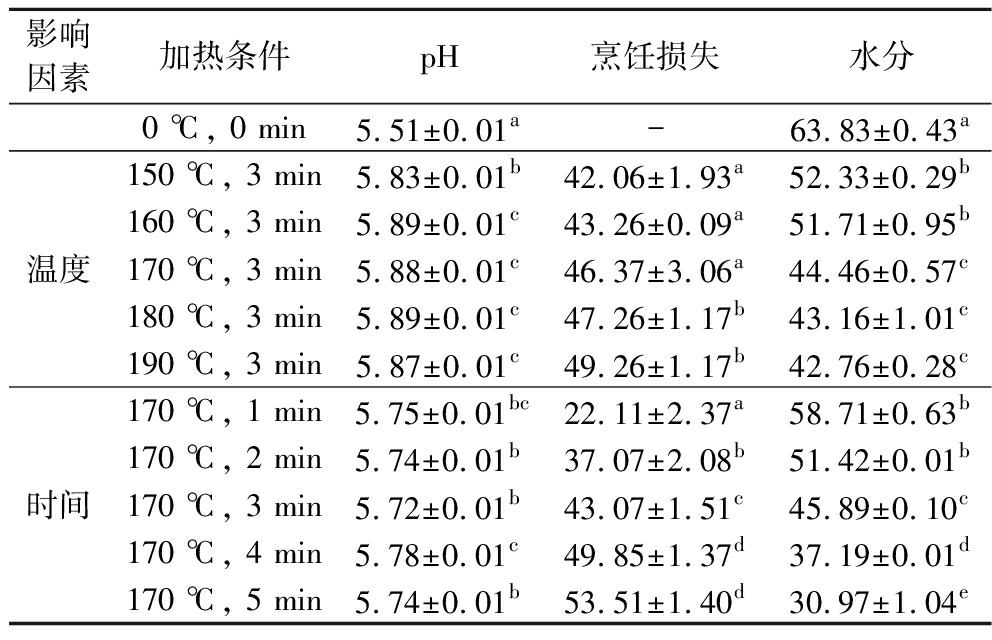
影响因素加热条件pH烹饪损失水分0 ℃, 0 min5.51±0.01a-63.83±0.43a温度150 ℃, 3 min5.83±0.01b42.06±1.93a52.33±0.29b160 ℃, 3 min5.89±0.01c43.26±0.09a51.71±0.95b170 ℃, 3 min5.88±0.01c46.37±3.06a44.46±0.57c180 ℃, 3 min5.89±0.01c47.26±1.17b43.16±1.01c190 ℃, 3 min5.87±0.01c49.26±1.17b42.76±0.28c时间170 ℃, 1 min5.75±0.01bc22.11±2.37a58.71±0.63b170 ℃, 2 min5.74±0.01b37.07±2.08b51.42±0.01b170 ℃, 3 min5.72±0.01b43.07±1.51c45.89±0.10c170 ℃, 4 min5.78±0.01c49.85±1.37d37.19±0.01d170 ℃, 5 min5.74±0.01b53.51±1.40d30.97±1.04e
注:—表示无数据;不同小写字母表示每列差异显著(P<0.05)(下同)。
2.2 不同油炸温度和时间对猪里脊色泽的影响
因油炸条件的不同,样品的颜色对应的样品照片如图1-a和图1-b所示。温度和时间因素影响下,其内部颜色无明显变化,而样品外部因发生美拉德反应,颜色随时间的延长和温度的升高逐渐加深。如图1-a所示,在较低油炸温度(150、160 ℃)下油炸3 min的猪里脊的表面呈浅棕色棕色(未熟),而随着温度升高至180 ℃时变为棕红色。图1-b显示在170 ℃的油炸温度下,样品在2~3 min熟透,在5 min时明显焦化。一般来说,熟肉的颜色取决于未变性肌红蛋白(含氧肌红蛋白)的量和珠蛋白血红素原的形成[25]。
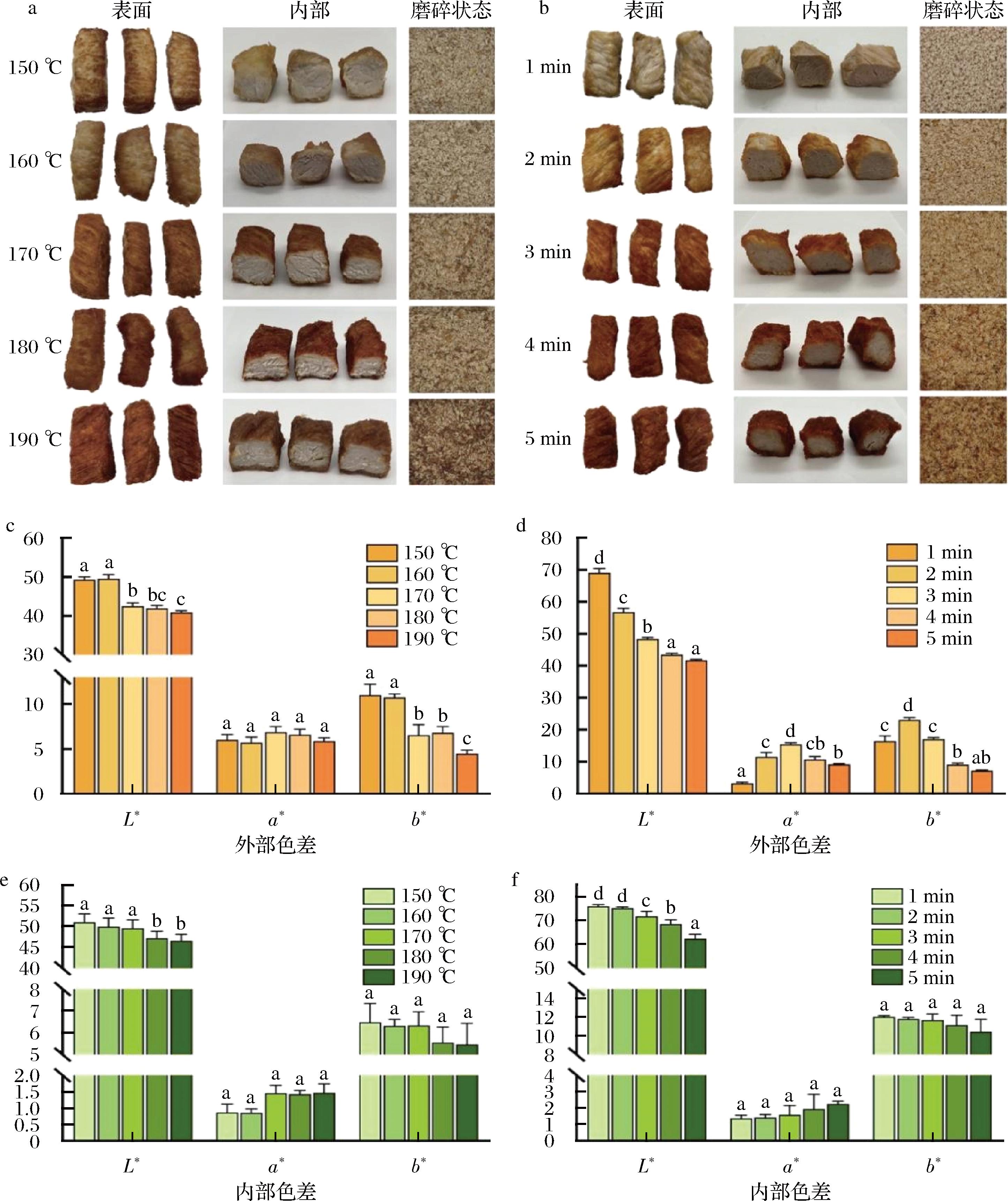
a, c, e-不同温度下油炸3 min的猪里脊照片及色差值变化;b, d, f-170 ℃下油炸不同时间猪里脊照片及色差值变化
图1 油炸时间和温度对猪里脊色泽的影响
Fig.1 The influence of different frying times and temperatures on the color of pork tenderloin
注:不同小写字母表示差异显著(P<0.05)(下同)。
在油炸过程中,样品的色泽动力学可反映表面温度,表面反应速率受表面温度的影响[26]。图1-c和1-d显示了在不同油炸温度和时间下油炸里脊条表面的亮度(L*)、红色(a*)和黄色(b*)的颜色参数变化,油炸温度升高,油炸时间延长都能使里脊条的L*值降低,不同样品之间L*值的差异可能归因于其水分含量差异。ZHANG等[2]证明含水量较低的样品具有较低的L*值。含水量的减少可能会导致光的反射减少,而在高温下长时间加热时水分很容易蒸发[27]。a*值是颜色测量中最敏感的参数,表征红色和颜色稳定性。当猪里脊在油炸时间相同时,油炸温度170 ℃时a*值最大,但随着油炸温度继续升高无明显差异(P<0.05)。在170 ℃下油炸1、2和3 min的猪里脊的a*值随着油炸时间的增加而显著增加(P<0.05)。油炸猪里脊的b*值随着油炸温度和时间的增加而显著减少(P<0.05),这与烤猪肉中的变化相反[7]。
由图1-e和图1-f可知,当油炸时间超过2 min后,样品内部颜色L*明显降低;继续升高温度和延长油炸时间对油炸里脊条内部颜色影响较小,而在两种影响因素下,a*和b*都没有表现出明显差异。综上所述,在170 ℃下油炸2~3 min和150~170 ℃油炸3 min的油炸猪里脊样品的外观颜色相对较好。
2.3 不同油炸温度和时间对猪里脊质构的影响
经过高温油炸处理,原料组织中产生的许多物理(传热、传质)、化学(美拉德反应、蛋白质变性)和结构变化使得样品质构发生变化。如图2-a~图2-c所示,当油炸时间相同时(3 min),随着油炸温度升高,里脊条的硬度、胶黏性和咀嚼性都表现出明显差异(P<0.05),呈逐渐升高的趋势。这是由于温度升高,水分损失更多,蛋白质变性程度加快,使得里脊条表面出现硬壳,导致硬度值、胶黏性和咀嚼性增加。由于里脊条烹饪损失都达到了40%以上,整个肉条都处于紧实的状态,所以弹性、内聚性变化不显著(P>0.05)。由图2-d可知,同一油炸温度下(170 ℃),油炸时间越长,蛋白质氧化程度越严重导致样品硬度显著升高(P<0.05);由图2-e和2-f可知,样品的弹性和内聚性差异不大,整体变化呈相反趋势,油炸时间越长,样品失水越多,样品内部结构更紧密,弹性升高,内聚性趋于稳定(0.5~0.6),而咀嚼性随弹性和胶黏性升高而显著增加,在油炸时间5 min时达到最大值,咀嚼性受物质的胶黏性和弹性影响,并呈正相关[28]。

a, b, c-油炸温度对猪里脊质构的影响;d, e, f-油炸时间对猪里脊质构的影响
图2 不同油炸温度和时间下猪里脊的质构变化
Fig.2 The impact of different frying temperatures and times on the texture of pork tenderloin
注:不同大写字母表示差异显著(P<0.05)。
2.4 不同油炸温度和时间对里脊条的水分分布和油脂的影响
由弛豫图谱(图3)可看出,从150~190 ℃温度梯度下,弛豫图谱均出现了4个弛豫主峰。其弛豫时间分别定义为T2b(<0.5 ms)、T21(0.5~5 ms)、T22(5~100 ms)和T23(40~400 ms)。油炸食品的横向弛豫时间T2分别代表着不同的物理意义:T2b表示与蛋白质紧密结合的水,其通过化学反应严格按照比例关系牢固地同纤维间体结合,只有在强烈的热处理或特定化学作用下才可除去;T21表示不易流动的吸附结合水,在物料外表面及肌原纤维内部通过分子吸附作用结合在一起(截留于肌原纤维网络中的);T22表示内部自由水分,它与油炸食品内部非水组分的结合力几乎为零,主要依靠表面附着和毛细管作用等吸附力而存在于产品中,这部分水因其流动性强而易被微生物或酶利用,从而导致变质;T23表示油炸食品本身的脂肪成分或炸用油脂[4]。
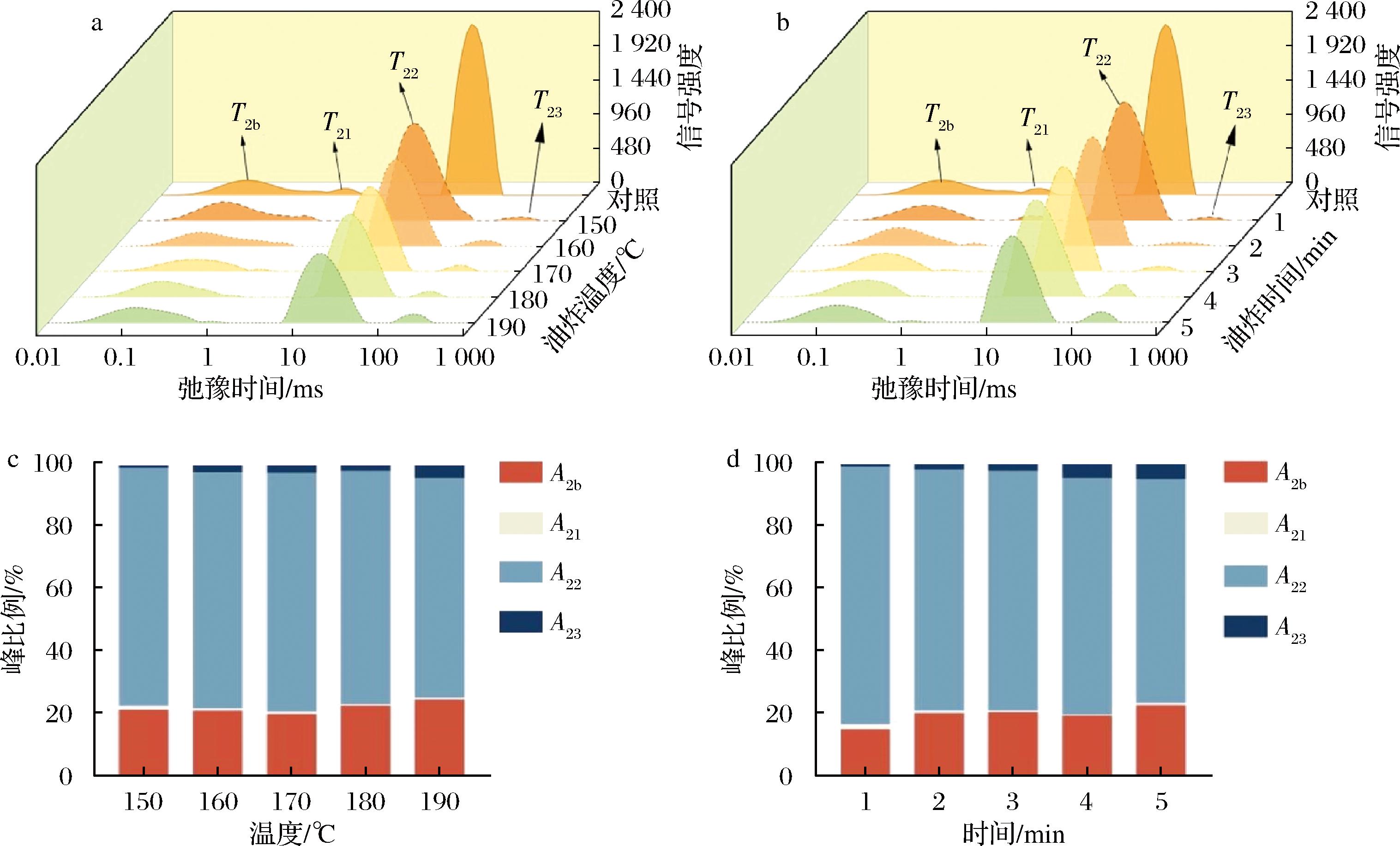
a-不同油炸温度下猪里脊LF-NMR T2弛豫时间分布的变化;b-不同油炸时间下猪里脊LF-NMR T2弛豫时间分布的变化;c-不同油炸温度下猪里脊T2弛豫时间峰面积的变化;d-不同油炸时间下猪里脊T2弛豫时间峰面积的变化
图3 不同油炸温度和时间下猪里脊LF-NMR T2弛豫时间分布及峰面积的变化
Fig.3 Changes in distribution of the LF-NMR T2 relaxation times and peak area in pork tenderloin under different frying temperatures and times
由图3-a可看出,弛豫时间T21、T22随煎炸温度升高向左移动,并且T2b与T21的融合面积越来越少,说明油炸过程会提升里脊条原结合水的作用力,并且随着自由水分的溢出,产品的束缚力增大,部分吸附结合水变为与蛋白质紧密结合水,参与化学反应;T23显示原料中几乎不含油脂,各温度油炸组相对于150 ℃组均左偏明显,但是随着煎炸时间的进行左移几乎停滞,表明油炸产品中的油脂较最低加热温度中的油脂结合更牢固,而这种牢固程度不随煎炸条件波动太大;T2b中亦是对照组弛豫时间最长,但是各煎炸组变化不规律,可能由于油炸操作会一定程度加强蛋白质结合水的强度,但是这种结合强度随煎炸条件的波动性较大。由图3-b可看出,T21和T22的峰面积随油炸温度升高均降低,且T22的降低幅度明显高于T21,说明油炸过程会使得里脊条结合水和自由水均从内部基质物料中迁移,使产品含水量不断减少[13],与前期测得的水分含量变化相对应。T23的峰面积随时间延长和温度增大而不断增加,说明油炸是一个不断吸油的过程并且吸油速率在一开始便达到了最高;T2b没有表现出明显变化规律,可能由于油炸会一定程度增加蛋白质结合水的比例,但是增加幅度随煎炸条件的波动性较大。
由图3-c和3-d可知,随温度增大、时间延长A23对应的油脂所占峰面积比例逐渐增大,这是油炸吸油和水分蒸发双重作用的结果,而吸附结合水(A21)所占比例始终处于较小值,将A2b与A21合并分析可观察到随着温度的升高、时间的延长,结合水峰面积比例逐渐增大,说明油炸操作会一定程度增加结合水的含量。其余值的变化没有明显规律,可能受油炸条件的波动性影响较大。
2.5 油炸猪里脊的感官评价
随着油炸温度和时间的增加,油炸猪里脊的感官品质的变化如表3所示。在150 ℃和190 ℃下油炸3 min的油炸猪里脊感官质量得分显著较低(P<0.05),可能是美拉德反应不完全或是反应过度,导致未出现理想的颜色。在170 ℃下油炸1、5 min的油炸猪里脊感官质量得分显著较低(P<0.05)这可能是因为油炸猪里脊没有完全成熟,样品颜色苍白,有涩味;油炸较久质量下降,水分大量丧失,样品难嚼,美拉德反应剧烈导致颜色较深。值得注意的是在170 ℃下油炸3 min获得了理想的感官质量,在此基础上降低温度和缩短时间,感官质量下降,但仍保持较好的感官质量。根据颜色、风味、味道和口感,在170 ℃下油炸2~3 min得分最高。
表3 油炸条件对油炸猪里脊感官评价的影响
Table 3 The influence of frying conditions on the sensory evaluation of fried pork tenderloin
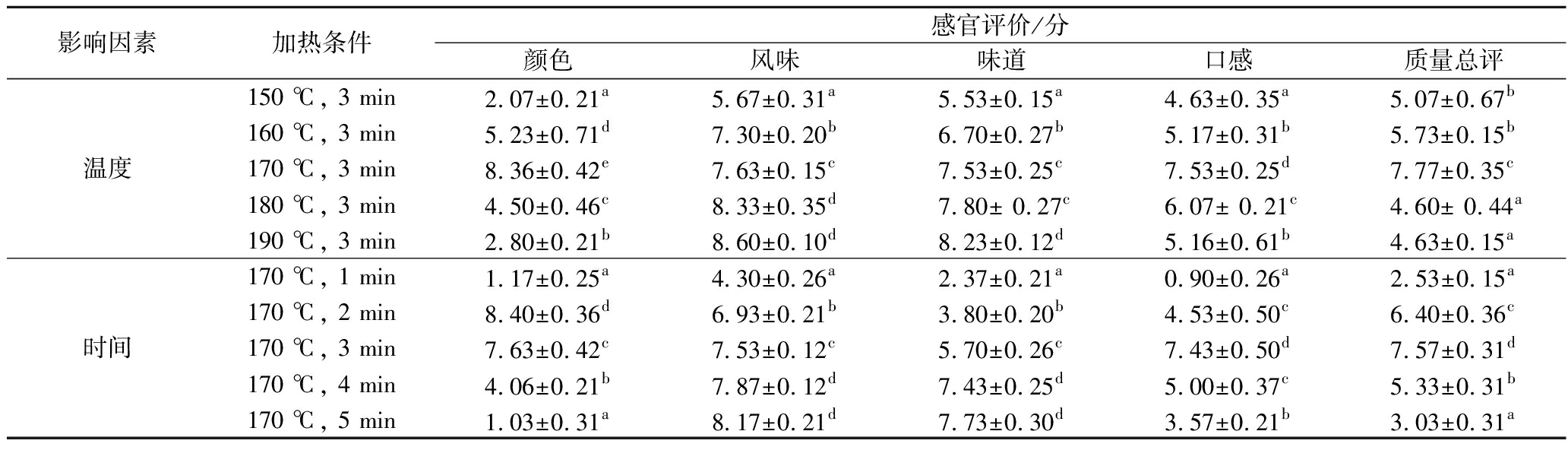
影响因素加热条件感官评价/分颜色风味味道口感质量总评温度150 ℃, 3 min2.07±0.21a5.67±0.31a5.53±0.15a4.63±0.35a5.07±0.67b160 ℃, 3 min5.23±0.71d7.30±0.20b6.70±0.27b5.17±0.31b5.73±0.15b170 ℃, 3 min8.36±0.42e7.63±0.15c7.53±0.25c7.53±0.25d7.77±0.35c180 ℃, 3 min4.50±0.46c8.33±0.35d7.80± 0.27c6.07± 0.21c4.60± 0.44a190 ℃, 3 min2.80±0.21b8.60±0.10d8.23±0.12d5.16±0.61b4.63±0.15a时间170 ℃, 1 min1.17±0.25a4.30±0.26a2.37±0.21a0.90±0.26a2.53±0.15a170 ℃, 2 min8.40±0.36d6.93±0.21b3.80±0.20b4.53±0.50c6.40±0.36c170 ℃, 3 min7.63±0.42c7.53±0.12c5.70±0.26c7.43±0.50d7.57±0.31d170 ℃, 4 min4.06±0.21b7.87±0.12d7.43±0.25d5.00±0.37c5.33±0.31b170 ℃, 5 min1.03±0.31a8.17±0.21d7.73±0.30d3.57±0.21b3.03±0.31a
2.6 不同油炸温度和时间对里脊条的HAA生成和含量的影响
2.6.1 温度动态变化
油炸与烧烤、煎炸、卤煮不同,油炸是以煎炸用油为加热介质的烹调方法,油炸过程用油的温度会因为原料的存在降低,并随着原料的熟化发生波动,而温度变化会直接影响HAA的形成,因此需要监测油炸锅的油温变化情况。本实验通过恒定控温装置控制油炸锅中油温,并实时检测油温的变化,150、160、170、180、190 ℃油炸温度下的油温变化如图4-a所示。在恒定温度下油炸,油温基本处于有轻微波动,但保持着较稳定的状态。油温从开始的设置温度在加入猪里脊时迅速降低,之后又回升至初始设置的油炸温度。该图反应了油炸过程中经历的3个阶段,分别为表面沸腾、降速和气泡消失。在第1个阶段中猪里脊中的水分大量溢出,进入煎炸油中,因此油温迅速降低10~20 ℃,之后随着猪里脊的逐渐成熟,油温回升至最初状态[29]。
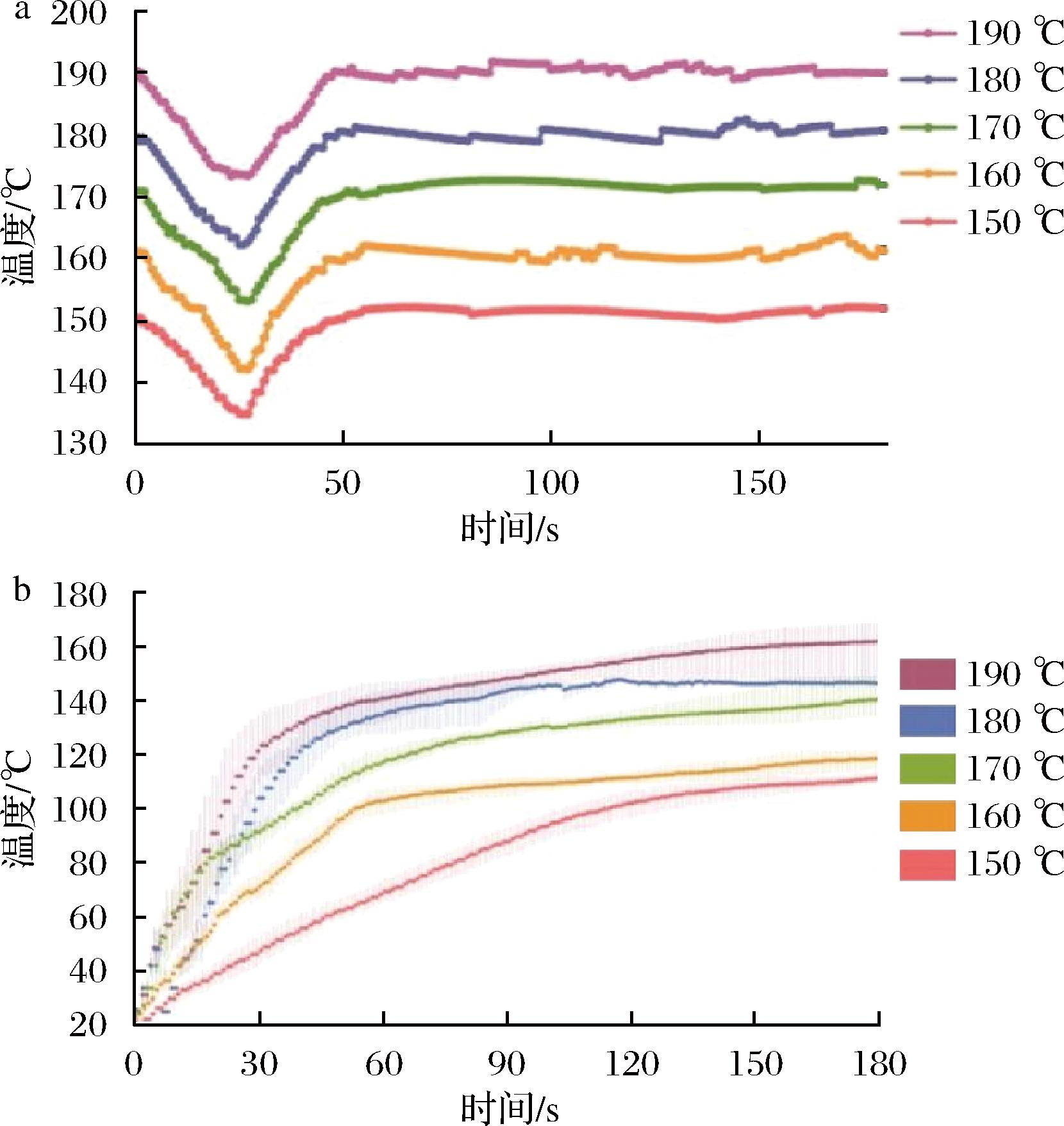
a-不同温度下油炸油温度变化;b-不同油炸温度下猪里脊中心温度变化
图4 油炸油和猪里脊的温度动态变化
Fig.4 Dynamic temperature changes in frying oil and pork tenderloin
图4-b反映了油炸过程中猪里脊中心温度的变化,油温越高,升温越快,且升温速率转折点对应的温度越高,时间越小,提高油温可以在一定程度上减少猪里脊的熟制时间,但发生化学反应的温度和时间也相应提高和增加。
2.6.2 油炸温度和时间对里脊条的HAA生成和含量的影响
由表4可看出,在同样的油炸时间(3 min)下,随着油炸温度的增加,生成的HAA的数量和种类逐渐增加,呈正相关关系,170 ℃时HAA总量是150 ℃时的3倍。油炸里脊条中共检出8种HAA,其中8-MeIQx、Norharman、Harman、AαC检出量较多,大部分HAA(IQx、MeIQ、8-MeIQx、Norharman、4,8-DiMeIQx、Harman、PhIP)在温度达到150 ℃时就能生成,这些HAA主要与美拉德反应中的Strecker降解形成的中间产物有关[29]。8-MeIQx、AɑC需要在170 ℃下才能生成,这是由于氨基咔啉或非IQ型HAA是通过氨基酸和蛋白质在高温下的热解反应形成的,这两种HAA的生成需要一定的温度条件。随着温度继续升高,8-MeIQx、AɑC的生成速度加快,在190 ℃时产生的AαC含量为180 ℃的1.98倍。在整个升温过程中MeIQ的含量增幅不大,没有显著变化。与其他β-咔啉类HAA相比Norharman、Harman在低温下就可生成,主要由色氨酸和葡萄糖生成,且生成量随温度升高呈倍数增长,160和170 ℃时的Norharman含量分别是150 ℃时的2.2和3.1倍,占HAA的绝大部分;180和190 ℃时的Harman含量分别是170 ℃时的1.6和2.3倍。
表4 不同油炸温度下猪里脊HAA的含量变化 单位:μg/kg
Table 4 Changes of heterocyclic aromatic amines content in frying at different temperatures
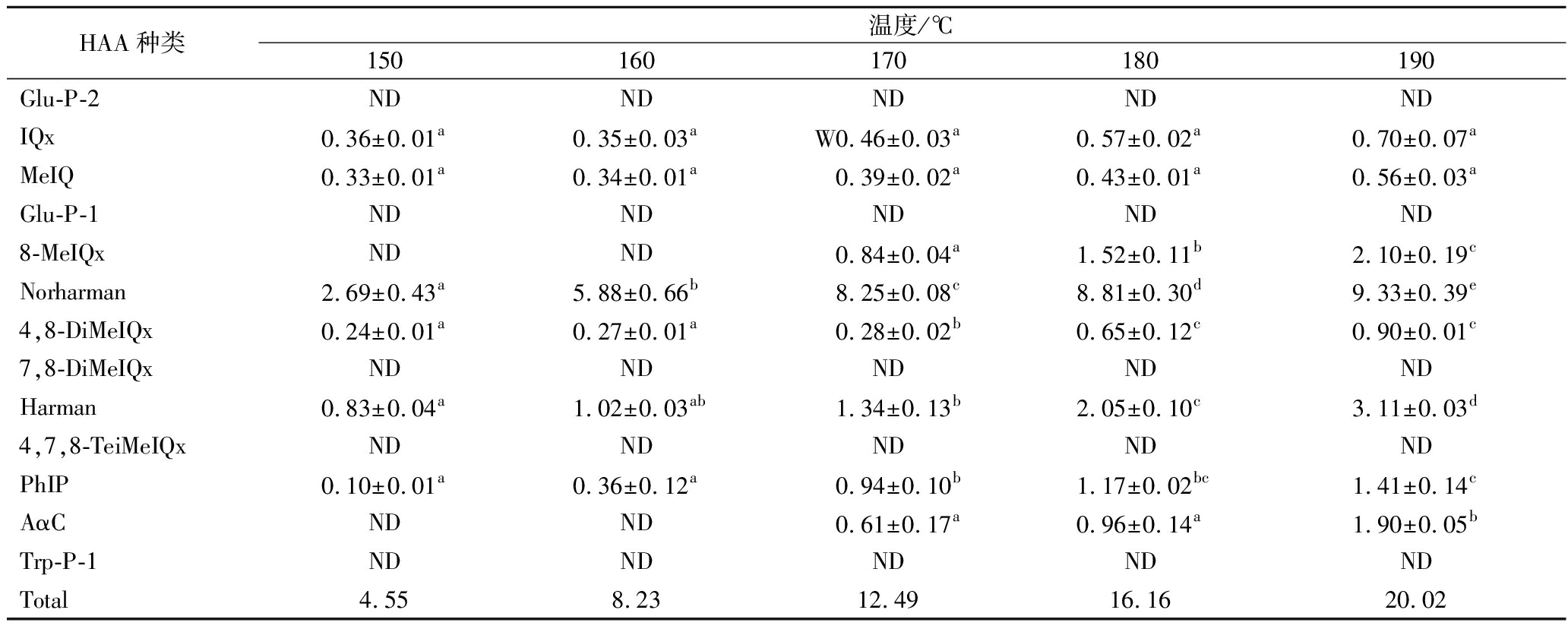
HAA种类温度/℃150160170180190Glu-P-2NDNDNDNDNDIQx0.36±0.01a0.35±0.03aW0.46±0.03a0.57±0.02a0.70±0.07aMeIQ0.33±0.01a0.34±0.01a0.39±0.02a0.43±0.01a0.56±0.03aGlu-P-1NDNDNDNDND8-MeIQxNDND0.84±0.04a1.52±0.11b2.10±0.19cNorharman2.69±0.43a5.88±0.66b8.25±0.08c8.81±0.30d9.33±0.39e4,8-DiMeIQx0.24±0.01a0.27±0.01a0.28±0.02b0.65±0.12c0.90±0.01c7,8-DiMeIQxNDNDNDNDNDHarman0.83±0.04a1.02±0.03ab1.34±0.13b2.05±0.10c3.11±0.03d4,7,8-TeiMeIQxNDNDNDNDNDPhIP0.10±0.01a0.36±0.12a0.94±0.10b1.17±0.02bc1.41±0.14cAαCNDND0.61±0.17a0.96±0.14a1.90±0.05bTrp-P-1NDNDNDNDNDTotal4.558.2312.4916.1620.02
注:ND表示未检出;同行数据间不同字母表示差异显著(P<0.05)(下同)。
油炸时间是影响HAA生成的重要因素之一,如表5所示,在170 ℃下,随着油炸时间增加,生成的HAA数量和种类越多。随油炸时间的增加,Norharman的增长呈现出先快速增长后趋于平缓的趋势,在同一时间下,其生成量最大,占HAA总量的绝大部分;Harman的含量随油炸时间增加而含量增加,温度越高,生成速度越快;8-MeIQx在油炸时间达到3 min时的生成量达到了2.11 μg/kg,仅次于Norharman,并且油炸时间4 min后的含量为3 min的2.9倍,但在油炸时间为5 min时其含量下降,这可能是高温长时间加热下发生了降解或者与其他组分反应从而消耗了8-MeIQx[23];IQx在油炸时间达到3 min时才能生成,且生成含量较低,油炸时间5 min时IQx的含量为4 min的2.1倍;PhIP在油炸2 min时才生成,并随时间增加含量增大,生成速度较稳定;AαC在油炸时间达到3 min时生成量达到1.03 μg/kg,但随时间延长生成速度减慢,其含量没有显著差异。在HAA的形成过程中,氨基酸和糖这两种前体物质会迅速发生Strecker降解产生中间体醛和杂环类化合物(如吡嗪等),再经历一步与肌酸酐发生缩合反应产生各类的HAA,使得HAA的形成有一定的延后[14]。
表5 不同油炸时间猪里脊HAA含量变化 单位:μg/kg
Table 5 Changes of heterocyclic aromatic amines content in frying at different times

HAA种类时间/min12345Glu-P-2NDNDNDNDNDIQxNDND0.32±0.02a0.41±0.04a0.85±0.03bMeIQ0.33±0.02a0.47±0.03a0.48±0.02a0.58±0.06a3.77±0.09bGlu-P-1NDNDNDNDND8-MeIQxNDND 2.11±0.13a6.08±0.21b1.42±0.09cNorharman3.42±0.10a6.05±0.27b8.38±0.40c8.90±0.58d9.67±0.14e4,8-DiMeIQxNDND0.29±0.03a0.44±0.04a0.49±0.02a7,8-DiMeIQxNDNDNDNDNDHarman0.70±0.04a1.19±0.34b1.23±0.06bc2.01±0.01c3.53±0.55d4,7,8-TeiMeIQxNDNDNDNDNDPhIPND0.58±0.06a0.90±0.03a1.34±0.03b1.84±0.08cAαCNDND1.03±0.02a1.19±0.12a1.28±0.04aTrp-P-1NDNDNDNDNDTotal4.458.3014.7520.9622.85
对比含量的动态变化,温度对HAA类型和含量的影响更大,这与WANG等[13]在考察温度和时间对烤猪肉中HAA形成的影响得出的结论一致。以上研究表明加工温度和加工时间是影响油炸猪里脊HAA形成的重要因素,并且在一定的热加工范围内,随着温度和时间的增加,HAA的含量和种类也显著增加。
2.7 相关性分析
油炸猪里脊样品的HAA、理化指标、质构和色差之间的相关性如图5所示。在油炸体系中,检出的HAA与pH值相关性不大,与烹饪损失呈正相关(P<0.01),IQx和PhIP的相关性系数分别为0.86和0.82,与水分呈显著负相关(P<0.001),其中IQx、Norharman和AɑC显著相关(P<0.01),PhIP与水分极显著相关(P<0.001),相关性系数达-0.96。表面中心温度显著影响着样品中的HAA,特别是Norharman、Harman、PhIP和AαC(P<0.001),相关系数最高有0.98,表明这4种HAA的生成条件与温度变化关系更密切[30];MeIQ与样品的硬度、胶黏性和咀嚼性都呈显著相关(P<0.01),相关系数分别为0.81、0.78和0.78,Norharman和PhIP与样品的弹性极显著相关(P<0.001),PhIP还与硬度、胶黏性、咀嚼性显著相关(P<0.01),相关系数分别为0.79、0.82和0.85。各HAA与样品外部的ΔE呈负相关关系,其中IQx的相关系数为-0.89(P<0.001),在高温油炸条件下样品表面发生剧烈的美拉德反应使得颜色变暗,内部由于没有直接接触油脂,颜色变化不大,与HAA的生成没有表现出明显的相关性。样品的水分与质构表现出极显著负相关(P<0.001),这是因为样品在高温条件下水分流失,破坏了样品内部结构,使得硬度、弹性、胶黏性和咀嚼性都不同程度上升。

图5 油炸猪里脊中HAA与品质的相关性分析
Fig.5 Correlation analysis between heterocyclic aromatic amines and quality of fried pork tenderloin strips
注:*P≤0.05,**P≤0.01,***P≤0.001。
3 结论
在测试温度(150~190 ℃)油炸猪里脊一段时间(1~5 min),猪里脊的品质和HAA含量发生了显著变化(P<0.05)。油炸时间的延长以及温度的升高都对猪里脊的品质造成了不利影响,较高的油炸温度和较长的油炸时间导致L*值显著降低,a*值、b*值、烹饪损失和HAA含量增加。在该油炸体系中,猪里脊中生成的IQx、MeIQ、8-MeIQx、Norharman、4,8-DiMeIQx、Harman、PhIP和AαC这8种HAA与温度和时间表现出显著相关性,过长的时间和较高的温度会产生大量HAA,对消费者食用安全危害大。综上,建议在不超过160~170 ℃的温度下油炸2~3 min,以保证形成少量的HAA和较高的感官质量。后期可以研究油炸用油的裂变程度与猪里脊中HAA生成的相关性,以探究油炸的热加工方式对HAA生成影响机制,进一步优化加工参数。
[1] 林义光. 诗经通解[M].上海:中西书局, 2012.LIN Y G.General Explanation of the Book of Songs[M].Shanghai:Zhongxi Book Company, 2012.
[2] ZHANG L, DU H Z, ZHANG P, et al.Heterocyclic aromatic amine concentrations and quality characteristics of traditional smoked and roasted poultry products on the northern Chinese market[J].Food and Chemical Toxicology, 2020, 135:110931.
[3] MOREIRA M J, OLIVEIRA I, SILVA J A, et al.Safety and quality assessment of roasted pork loin obtained by cook-chill system and packed in modified atmosphere[J].LWT, 2019, 101:711-722.
[4] 陈康明. 油炸公干鱼品质变化规律及其煎炸油的复配研究[D].无锡:江南大学, 2020.CHEN K M.Research on quality variation of fried Stolephorus commersonnii and its mixture of frying oil[D].Wuxi:Jiangnan University, 2020.
[5] ZHAO T P, ZHANG C X, MA Y X, et al.Effect of simultaneous application of antioxidants in oil and in chicken on heterocyclic aromatic amine formation in deep-fat fried chicken breast[J].LWT, 2023, 187:115287.
[6] XU Y, LI H X, LIANG J, et al.High-throughput quantification of eighteen heterocyclic aromatic amines in roasted and pan-fried meat on the basis of high performance liquid chromatography-quadrupole-orbitrap high resolution mass spectrometry[J].Food Chemistry, 2021, 361:130147.
[7] WANG H J, CHU X R, DU P F, et al.Unveiling heterocyclic aromatic amines (HAAs) in thermally processed meat products:Formation, toxicity, and strategies for reduction-A comprehensive review[J].Food Chemistry:X, 2023, 19:100833.
[8] LU F, KUHNLE G K, CHENG Q F.The effect of common spices and meat type on the formation of heterocyclic amines and polycyclic aromatic hydrocarbons in deep-fried meatballs[J].Food Control, 2018, 92:399-411.
[9] 赵电波, 韩雪, 李可, 等.不同加工工序对鸡腿品质特性及杂环胺形成的影响[J].中国调味品, 2021, 46(9):22-27.ZHAO D B, HAN X, LI K, et al.Effects of different processing technologies on quality characteristics and formation of heterocyclic amines in chicken drumstick[J].China Condiment, 2021, 46(9):22-27.
[10] OLSSON V, SKOG K, LUNDSTRÖM K, et al.Colour photographs for estimation of heterocyclic amine intake from fried pork chops of different RN genotypes indicate large variations[J].Food Quality and Preference, 2005, 16(2):91-101.
[11] GIBIS M.Heterocyclic aromatic amines in cooked meat products:Causes, formation, occurrence, and risk assessment[J].Comprehensive Reviews in Food Science and Food Safety, 2016, 15(2):269-302.
[12] POUZOU J G, COSTARD S, ZAGMUTT F J.Probabilistic estimates of heterocyclic amines and polycyclic aromatic hydrocarbons concentrations in meats and breads applicable to exposure assessments[J].Food and Chemical Toxicology, 2018, 114:346-360.
[13] WANG B, LI H J, HUANG Z B, et al.Dynamic changes in the qualities and heterocyclic aromatic amines of roasted pork induced by frying temperature and time[J].Meat Science, 2021, 176:108457.
[14] DONG H, XIAN Y P, LI H X, et al.Potential carcinogenic heterocyclic aromatic amines (HAAs) in foodstuffs:Formation, extraction, analytical methods, and mitigation strategies[J].Comprehensive Reviews in Food Science and Food Safety, 2020, 19(2):365-404.
[15] OZ E, AOUDEH E, MURKOVIC M, et al.Heterocyclic aromatic amines in meat:Formation mechanisms, toxicological implications, occurrence, risk evaluation, and analytical methods[J].Meat Science, 2023, 205:109312.
[16] AEENEHVAND S, TOUDEHROUSTA Z, KAMANKESH M, et al.Evaluation and application of microwave-assisted extraction and dispersive liquid-liquid microextraction followed by high-performance liquid chromatography for the determination of polar heterocyclic aromatic amines in hamburger patties[J].Food Chemistry, 2016, 190:429-435.
[17] BELLAMRI M, WALMSLEY S J, TURESKY R J.Metabolism and biomarkers of heterocyclic aromatic amines in humans[J].Genes and Environment, 2021, 43(1):29.
[18] KANG H J, LEE S Y, LEE D Y, et al.Main mechanisms for carcinogenic heterocyclic amine reduction in cooked meat by natural materials[J].Meat Science, 2022, 183:108663.
[19] BELLAMRI M.Heterocyclic aromatic amines (HAA), exposure, metabolism, macromolecular adducts, and cancer risk[J].Encyclopedia of Toxicology.Amsterdam:Elsevier, 2024:187-206.
[20] NASEHI M, KETABCHI M, KHAKPAI F, et al.The effect of CA1 dopaminergic system in harmaline-induced Amnesia[J].Neuroscience, 2015, 285:47-59.
[21] NASEHI M, MESKARIAN M, KHAKPAI F, et al.Harmaline-induced Amnesia:Possible role of the amygdala dopaminergic system[J].Neuroscience, 2016, 312:1-9.
[22] BU A M, PRZYBYLSKI W, JAWORSKA D, et al.Formation of heterocyclic aromatic amines in relation to pork quality and heat treatment parameters[J].Food Chemistry, 2019, 276:511-519.
A M, PRZYBYLSKI W, JAWORSKA D, et al.Formation of heterocyclic aromatic amines in relation to pork quality and heat treatment parameters[J].Food Chemistry, 2019, 276:511-519.
[23] YAN Y, YOU F H, ZENG M M, et al.Evaluating the effects of temperature and time on heterocyclic aromatic amine profiles in roasted pork using combined UHPLC-MS/MS and multivariate analysis[J].Food Research International, 2021, 141:110134.
[24] LI W W, WAN X, CHEN C L, et al.Effects of soy protein and its hydrolysates on the formation of heterocyclic aromatic amines in roasted pork[J].Meat Science, 2023, 204:109236.
[25] TOMASEVIC I, DJEKIC I, FONT-I-FURNOLS M, et al.Recent advances in meat color research[J].Current Opinion in Food Science, 2021, 41:81-87.
[26] YANG B, ZHANG Y L, JIANG S T, et al.Effects of different cooking methods on the edible quality of crayfish (Procambarus clarkii) meat[J].Food Chemistry Advances, 2023, 2:100168.
[27] LI L, WANG P, XU X L, et al.Influence of various cooking methods on the concentrations of volatile N-nitrosamines and biogenic amines in dry-cured sausages[J].Journal of Food Science, 2012, 77(5):C560-C565.
[28] 李艳红, 王稳航.低温热处理对牦牛肉理化性质及感官特性的影响[J].食品与发酵工业, 2021, 47(2):145-152.LI Y H, WANG W H.Effects of low-temperature cooking on physicochemical properties and sensory of yak meat[J].Food and Fermentation Industries, 2021, 47(2):145-152.
[29] SKOG K, J GERSTAD M.Incorporation of carbon atoms from glucose into the food mutagens MeIQx and 4, 8-DiMeIQx using 14C-labelled glucose in a model system[J].Carcinogenesis, 1993, 14(10):2027-2031.
GERSTAD M.Incorporation of carbon atoms from glucose into the food mutagens MeIQx and 4, 8-DiMeIQx using 14C-labelled glucose in a model system[J].Carcinogenesis, 1993, 14(10):2027-2031.
[30] MODZELEWSKA-KAPITU A M, D
A M, D![]() BROWSKA E, JANKOWSKA B, et al.The effect of muscle, cooking method and final internal temperature on quality parameters of beef roast[J].Meat Science, 2012, 91(2):195-202.
BROWSKA E, JANKOWSKA B, et al.The effect of muscle, cooking method and final internal temperature on quality parameters of beef roast[J].Meat Science, 2012, 91(2):195-202.