面条作为许多文化中常见的传统主食,在全球拥有巨大的市场[1]。中国的鲜湿面有几千年的历史,至今仍是中国北方大部分地区的主食。面条有很多种类,包括干挂面、油炸方便面、鲜湿面等。与干挂面相比,鲜湿面因其口感顺滑,质地有嚼劲,风味好而广受欢迎。然而,由于鲜湿面的含水量高且营养物质丰富,因此在其储存过程中容易滋生微生物[2]。市面上的一些合成防腐剂可能会产生有害的副产品,对环境造成破坏,且导致了耐抗生素病原体的增加。近年来,由于食品安全事故频发,消费者对食品安全问题越来越关注,一些合成的食品添加剂如人工防腐剂和人工色素含有不安全的因素[3],因此天然食品添加剂因其安全性高而广受消费者欢迎。目前市场上的天然抑菌剂通常来源于植物、动物或者微生物[4]。它们涵盖了各种化合物,如酚类、多肽、萜烯、酯类、细菌素和有机酸等。香芹酚、肉桂醛、丁香酚和百里香酚是天然植物源性精油的主要成分。它们被证明具有多种生物活性,如抑菌、改善肥胖、调节肠道菌群、抑制过氧化物等[5]。这4种天然抑菌剂的抑菌机理比较复杂,尚未得到充分证实,且对面条中腐败菌的抑制机理研究较少。在之前的研究中,发现它们通过生物膜基质分散并破坏其结构[6]。
在中国,大多数顾客在市场上购买鲜湿面,中国市场上鲜湿面最常用的保存方法是用湿纱布覆盖面条以保持其湿润[7]。有些研究将鲜湿面条保存在25 ℃环境下的无菌密封袋中[8];有些将鲜湿面条储存在4 ℃环境下的无菌密封袋中[9-10];也有些将面条密封保存10 ℃、湿度为60%的恒温恒湿箱中[11]。这些与市场不同的储存方法可能会导致鲜湿面出现不同的腐败菌种类。有许多研究针对大肠杆菌和金黄色葡萄球菌等致病菌的抑菌剂开展[12-13],但很少有针对模拟市场条件下鲜湿面的主要腐败细菌种类的研究。
本研究对鲜湿面进行模拟市场的储存方式,并对此鲜湿面的腐败菌群种类进行了分析鉴定。此外,还研究了这些天然抑菌剂对鲜湿面中腐败菌的抑制作用。采用激光共聚焦显微镜对细菌的细胞膜损伤机制进行了探讨。为了与鲜湿面的实际市场储存方式相匹配,在原料加工过程中直接添加香芹酚、肉桂醛、丁香酚和百里香酚,并在此基础上研究鲜湿面的货架期和品质变化。
1 材料与方法
1.1 材料
小麦面粉(水分含量13.0%,蛋白质含量12.1%),山东滨州中裕食品有限公司;用营养肉汤培养基分离、培养细菌,用马铃薯葡萄糖琼脂培养基(国药化学试剂有限公司,上海,中国)培养霉菌;分离培养鲜湿面中的菌落,加入甘油保存在-80 ℃;在下次实验前,将菌株置于营养肉汤培养基中,在37 ℃、150 r/min的振动培养箱中培养;食品级天然香芹酚、肉桂醛、丁香酚、百里香酚,东方天然香料油厂;其他溶剂和化学试剂均为分析纯,国药化学试剂有限公司。
1.2 设备与仪器
LSM710共聚焦激光扫描显微镜、CM1950冷冻切片机,德国徕卡公司;TA-XTC-18质构分析仪,上海博圣科技有限公司;CR8+分光色差宝,中国3nh公司。
1.3 鲜湿面的制备和储存
将小麦粉(100 g)、水(36 g)、NaCl(1 g)、抑菌剂混合均匀,在搅面机中搅拌10 min,将面絮团置于25 ℃静置30 min。将面团在DP35-S压面机(烽创机械制造有限公司)上檊压从5.0 mm至1.0 mm,每种厚度重复2次。将最终厚度为1.0 mm的生面片切成面条(2 mm×1 mm)。测定鲜湿面的含水量为(32.67±0.21)%。制成的鲜湿面在类似的市场条件下储存,用湿纱布覆盖,并在食品级实验室恒温(25 ℃)下储存。
1.4 微生物分析
细菌和霉菌总数分别按GB 4789.2—2022和GB 4789.15—2016确定。测定微生物计数时,首先称取粉碎后的样品25 g,与225 mL无菌生理盐水混合,均质1 min,用无菌水将均质后的样品稀释至梯度浓度。将1 mL稀释液转移到无菌板上,与平板计数琼脂培养基混合。37 ℃孵育48 h后,计数总板数。采用马铃薯葡萄糖琼脂平板进行霉菌计数试验,培养条件为28 ℃,培养5 d,分别计算总平板数和霉菌数。
1.5 抑菌剂对鲜湿面货架期的影响
研究了4种天然抑菌剂对鲜湿面货架期的影响。综合考虑到面条的风味和货架期,将抑菌剂的最终质量分数设定为0.1%(以小麦粉为基础)。各试验组均按1.1节制备面条。以不含任何抑菌剂的鲜湿面为对照,根据GB 19640—2016(霉菌<2.00 lg CFU/g)和NY/T 1512—2021(细菌<6.00 lg CFU/g)的限值确定鲜湿面的货架期。
1.6 16S rRNA分析
当细菌数量达到腐败阈值(保存13 h)时,对面条的腐败菌株进行分析,从鲜湿面中随机抽取样品,分离纯化3个平行样品中的腐败菌,然后对纯化菌落进行鉴定和分析。采用DNA提取盒(碧云天,上海,中国)按照提供的操作说明提取细菌DNA。提取的DNA用27F/1492R引物进行PCR扩增。PCR产物经DNA凝胶电泳纯化后测序(苏州金唯智生物科技有限公司,苏州,中国)。在NCBI中Blast鉴定了微生物的16S rRNA序列。
1.7 最低抑制浓度(minimum inhibitory concentration, MIC)的测定
由于这几种酚、醛类物质微溶于水,测定过程中酚类物质与培养基溶液可能不稳定,因此采用试管稀释法测定MIC值[14]。将4种天然抑菌剂稀释到含有营养肉汤培养基的试管中,抑菌剂质量浓度分别为4.0、2.0、1.0、0.5、0.25、0.125、0.062 5 mg/mL。将细胞悬浮液转移到试管中,细菌浓度保持在105~106 CFU/mL。
将含菌液的试管在37 ℃、150 r/min条件下孵育24 h,孵育后,将试管内的每个细胞悬液在37 ℃条件下于营养肉汤中培养48 h。
1.8 激光共聚焦显微镜(confocal laser scanning microscope, CLSM)检测细胞膜完整性
用荧光探针碘化丙啶(PI,红色,Sigma-Aldrich,德国)标记细胞膜和细胞壁的完整性,然后用CLSM观察。首先将8株菌株培养4~5 h至生长对数期,然后在营养肉汤培养基(108 CFU/mL)中重悬。在两组菌悬液中分别添加抑菌剂,使其最终浓度分别为0×MIC(等量PBS缓冲液代替抑菌剂)和2×MIC,37 ℃孵育12 h。4 000×g(4 ℃)离心15 min,每次离心后用0.1 mol/L PBS洗涤,重复3次。随后,将悬浮液中收获的细菌细胞用终探针浓度为2 μmol/mL的PI标记,30 ℃避光保存15 min。采用共聚焦激光扫描显微镜对样品进行观察。
1.9 质构分析(texture profile analysis, TPA)
用质构分析仪测定了熟制鲜湿面的质构特性。约10 g鲜湿面煮3 min(最佳蒸煮时间,即面条白芯完全消失的时间)。每组鲜湿面在烹饪后10 min内进行质构测量。采用P36/R探针检测煮熟面条样品的硬度、弹性、咀嚼性、胶着性和内聚性,并根据TPA计算。在测试过程中,三股面条被平行放置在一个平台上,然后同时测量。参数设置为预测速度2.0 mm/s,测试速度0.8 mm/s,后测速度1.0 mm/s,应变为70%。所有分析均进行8次重复。
1.10 颜色的测定
鲜湿面的L*、a*、b*值由分光色差宝测定,其中L*代表亮度,a*代表绿红值,b*代表蓝黄值。L*值越大,亮度越高,反之越暗;a*值越大,面条越红。b*值越高,面条越黄,反之越蓝。在面条制作完成后10 min内,取3个直径为5 cm的面片,记录此时的颜色值。对3个平行面片样品进行测试,每一次圆片的正面和背面都需要测量。取3个圆片的平均值作为实验结果。
1.11 蒸煮损失的测定
测定鲜湿面蒸煮损失的方法改编自美国谷物化学家协会方法。将450 mL去离子水在不锈钢碗中煮沸,然后放入约10 g生鲜湿面样品,面条煮制3 min。然后,将面条取出后的面汤水冷却到室温,定容至500 mL。取1/5的溶液并将其放入烧杯中,通过红外炉加热蒸发大部分的面汤,然后,将烧杯及剩余的面汤放入105 ℃的热风干燥箱中蒸发,恒重至质量保持不变,称量残留固体质量。蒸煮损失的计算如公式(1)所示:
蒸煮损失![]()
(1)
1.12 CLSM分析面筋网络结构
将鲜湿面切成小条,用OCT胶包埋后在-20 ℃保存12 h。冷冻后的样品用冷冻切片机切成20 μm厚的薄片。切片用罗丹明b和荧光素5-异硫氰酸酯(fluorescein isothiocyanate, FITC)的混合溶液染色。在黑暗中染色1 min后,用去离子水清洗样品,去除探针,并用盖玻片封住样品。用激光共聚焦显微镜观察染色后的样品。
1.13 感官评价
鲜湿面在沸水中煮3 min,然后用凉水冲洗面条。面条汤底是用油、盐和酱油制作的,这是中国江苏省最常见的烹饪面条的方法之一。煮熟的鲜湿面感官评价参照LS/T 3202—1993所描述的方法进行。感官评估在人工日光的感觉室中进行。所有的样本都用一个3位数的随机数来识别,并提供给16名未经训练的小组成员。
小组成员被要求在样品之间用矿泉水漱口,并根据每个煮熟样品的色泽、外观、适口性、韧性、黏性、光滑性和味道来评估他们的喜好。
1.14 统计分析
所有实验重复进行3次分析,结果以均数±标准差报告。采用SPSS软件21.0进行方差分析和Duncan分析,以P<0.05为差异有统计学意义。
2 结果与分析
2.1 鲜湿面的微生物和16S rRNA分析
鲜湿面在货架期的微生物变化主要取决于面条的原料和储存环境[15]。贮藏24 h后,鲜湿面中细菌数量达到6.562 3 lg CFU/g,超过了细菌标准上限,而霉菌数量均在0.477 1 lg CFU/g以内,远低于霉菌的安全标准范围。因此,可以推断细菌是鲜湿面的主要腐败微生物。
以往对鲜湿面的抑菌剂研究均基于密封的储存方式,目前没有针对模拟商业面条的储存方法的研究,对于这2种不同的储存方式,需要进行深入的研究。为了更准确地抑制市面售卖鲜湿面的腐败奠定基础,本文对这些腐败细菌的具体种类进行了探究。
对面条中的腐败细菌进行16S rRNA测序,经鉴定得到的细菌在鲜湿面条中的分布以及进化树如图1所示。细菌以泛菌属(Pantoea)最多,占76.2%,是鲜湿面腐败菌中最值得关注的属之一,其次为芽孢杆菌属(Bacillus)、葡萄球菌属(Staphylococcus)和科萨克氏菌属(Kosakonia)。该结果与以往的研究结果略有不同,GUO等[1]的研究结果显示,25 ℃时鲜湿面的优势腐败菌属数量由高到低分别为Bacillus、Pantoea、Staphylococcus和乳杆菌属(Lactobacillus)。其检测到的细菌种属与本文大致相同,但是菌株占总细菌的比例不一致。推测这种差异的原因是本研究采用的储存方法和储存环境与之前的研究有所不同。所占比例最大的Pantoea是食品原料和加工中常见的菌属。研究表明[16],Pantoea可以从不同农业气候下生长的小麦和玉米中分离出来,也有研究发现,Pantoea可以从配方奶粉的生产环境中分离出来[17]。此研究结果可为鲜湿面的靶向抑菌以及生产具有稳定货架期的面条提供一定的指导。
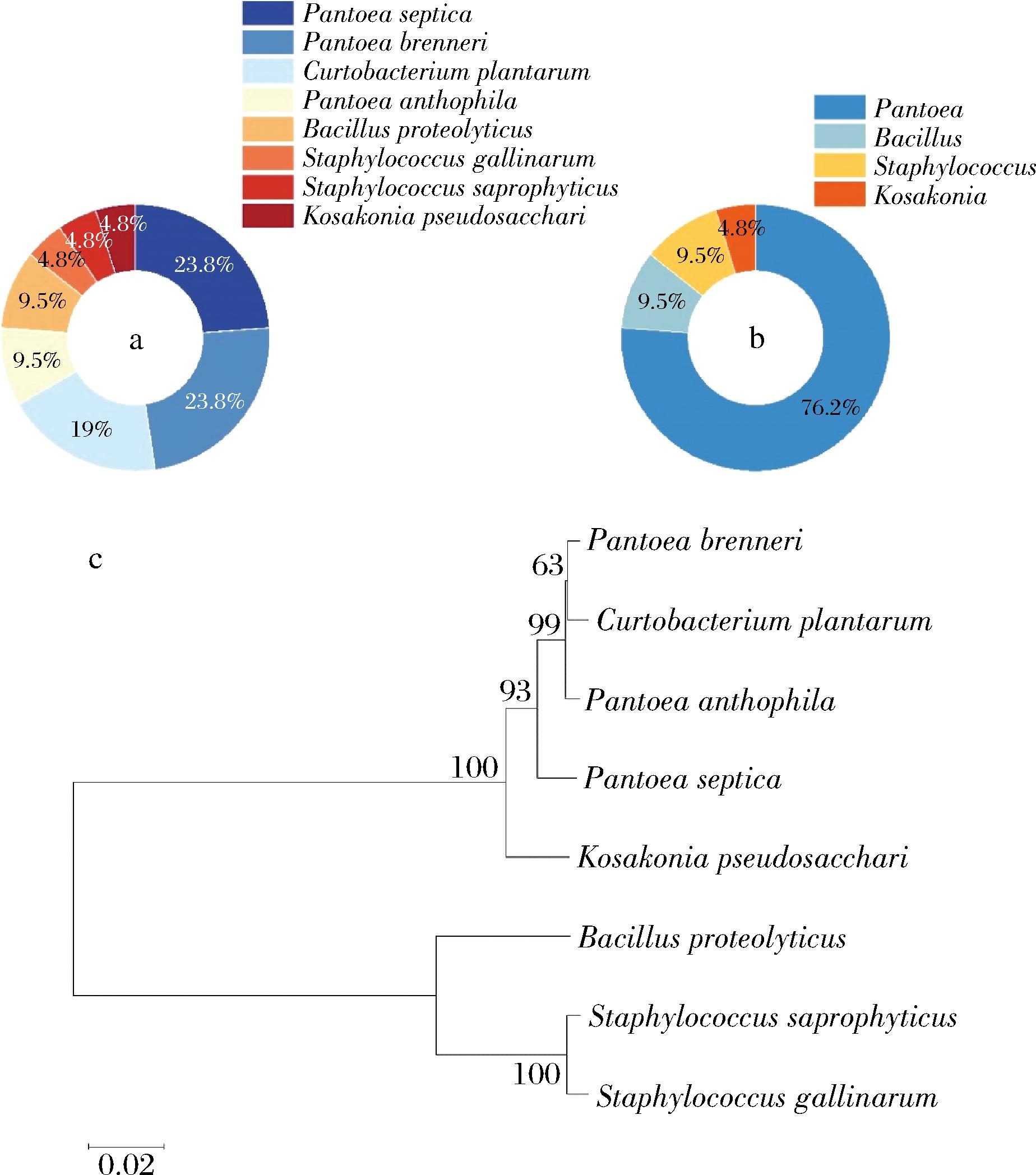
a-菌种分布;b-菌种在属水平上的分布;c-从FWNs分离的8种细菌的进化树
图1 FWNs中的微生物分布
Fig.1 Microbial distribution in FWNs
2.2 不同抑菌剂对鲜湿面分离细菌的MIC
结果如表1所示。百里香酚的MIC普遍低于其他抑菌剂,多在0.25 mg/mL左右。肉桂醛和香芹酚的MIC值大致相似,在0.5左右,而丁香酚的MIC值普遍高于其他3种抑菌剂。结果表明,百里香酚对这8种腐败菌的抑制作用优于肉桂醛和香芹酚,而丁香酚对这8种腐败菌的抑制作用最差。MIC值与以往对不同菌株的研究结果有一定差异。这可能是由于不同菌株对药物的特异性敏感性不同[18-19]。此外,由于MIC的测定没有标准的测量方法,这也会导致不同的结果。
表1 四种抑菌剂对鲜湿面条中分离的8种细菌的MIC
Table 1 MICs of 4 antimicrobials against eight species isolated from FWNs
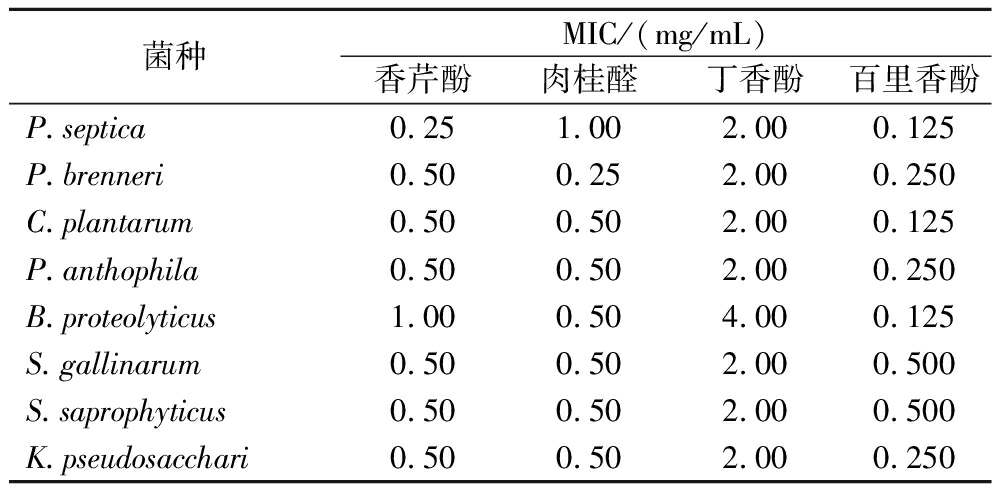
菌种MIC/(mg/mL)香芹酚肉桂醛丁香酚百里香酚P.septica0.251.002.000.125P.brenneri0.500.252.000.250C.plantarum0.500.502.000.125P.anthophila0.500.502.000.250B.proteolyticus1.000.504.000.125S.gallinarum0.500.502.000.500S.saprophyticus0.500.502.000.500K.pseudosacchari0.500.502.000.250
2.3 抑菌剂对细胞膜通透性的影响
研究表明,酚类物质的主要作用机制是引起微生物膜通透性的改变、细胞内物质的渗漏以及膜的结构和功能损伤[20]。荧光探针PI是一种核酸染料,它不能进入完整的细胞结构,但一旦细胞膜被破坏,就会对细胞受损泄露的核酸进行染色[21]。选择2株占鲜湿面分离属比例较大的菌株进行CLSM试验,其中包括了革兰氏阳性和革兰氏阴性菌株。如图2所示,未经抑菌剂处理的对照组细菌释放少量的微弱红色荧光,表明其细胞结构完整,几乎未发生核酸泄露。而香芹酚、肉桂醛、丁香酚和百里香酚处理后,红色荧光明显增强,表明这4种天然植物源抑菌剂对细菌细胞膜有损伤作用。
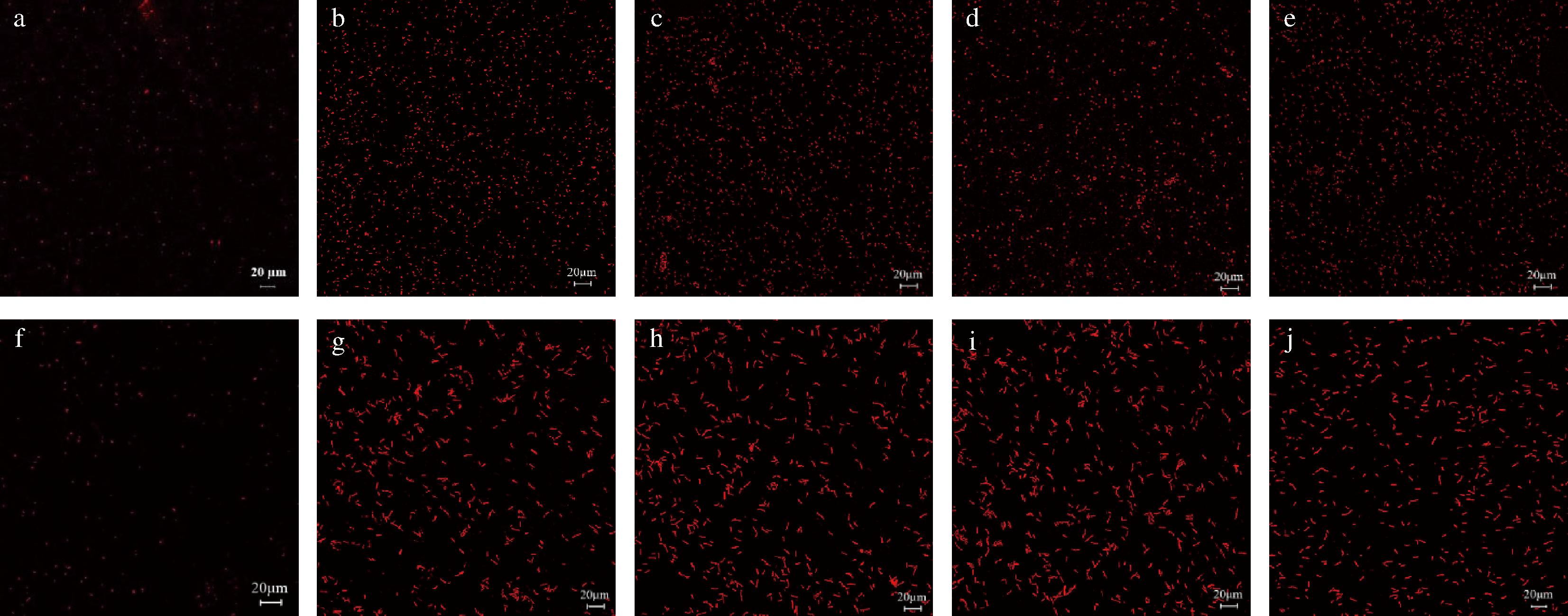
a~e分别为未经处理、2MIC百里香酚处理、2MIC丁香酚处理、2MIC肉桂醛处理、2MIC香芹酚处理的P.septica;f~j分别为未经处理、2MIC百里香酚处理、2MIC丁香酚处理、2MIC肉桂醛处理、2MIC香芹酚处理的B.proteolyticus
图2 CLSM观察抑菌剂处理的菌株
Fig.2 Effects of antimicrobials on cell membrane integrity of bacteria
同样,有报道称[18-19],经百里香酚和丁香酚处理后,细胞膜去极化,细胞内ATP浓度降低,pH值降低。这一现象提示发生了细胞膜不完整和细胞内环境塌陷。结果证实,这4种抑菌剂对鲜湿面具有显著的抑菌性能。
2.4 抑菌剂对鲜湿面货架期的影响
之前的实验可以证明这4种抑菌剂对鲜湿面条的腐败菌均存在抑制作用,但这些结果不能反映其在鲜湿面条中的实际应用效果。现有的许多研究都使用这4种抑菌剂进行气相抑制[22],但由于市场上鲜湿面以非密封状态储存,因此无法实现气态抑制。本研究将这4种抑菌剂在生产过程中直接添加进鲜湿面条,并在25 ℃条件下用湿纱布覆盖,尽可能模拟其实际的生产和销售过程,以进一步探索这些抑菌剂在鲜湿面实际生产和销售过程中的抑菌活性。添加抑菌剂的面条货架期如图3所示,所测定的保质期按照规定标准(<6.00 lg CFU/g)计算,其中对照组的保质期仅仅13 h,小于24 h,而添加百里香酚的面条保质期大于48 h,保质期延长率高达100%。同时,添加香芹酚、肉桂醛和丁香酚的面条保质期均在36 h以上。此外,添加抑菌剂后,鲜湿面的保质期呈现出与MIC值基本一致的趋势。有研究发现[1],在25 ℃、无菌保存的条件下,添加0.2%天然ε-聚赖氨酸后,鲜湿面的保质期小于24 h,而添加0.05%的醋酸脱氢钠时,鲜湿面的保质期约为48 h。可以看出,与其他一些天然抑菌剂相比,这4种天然抑菌剂仍有出色的抑菌效果。综合考虑其安全性以及具有的其他天然生物活性,可以认为这是一种高效可行的天然防腐剂。
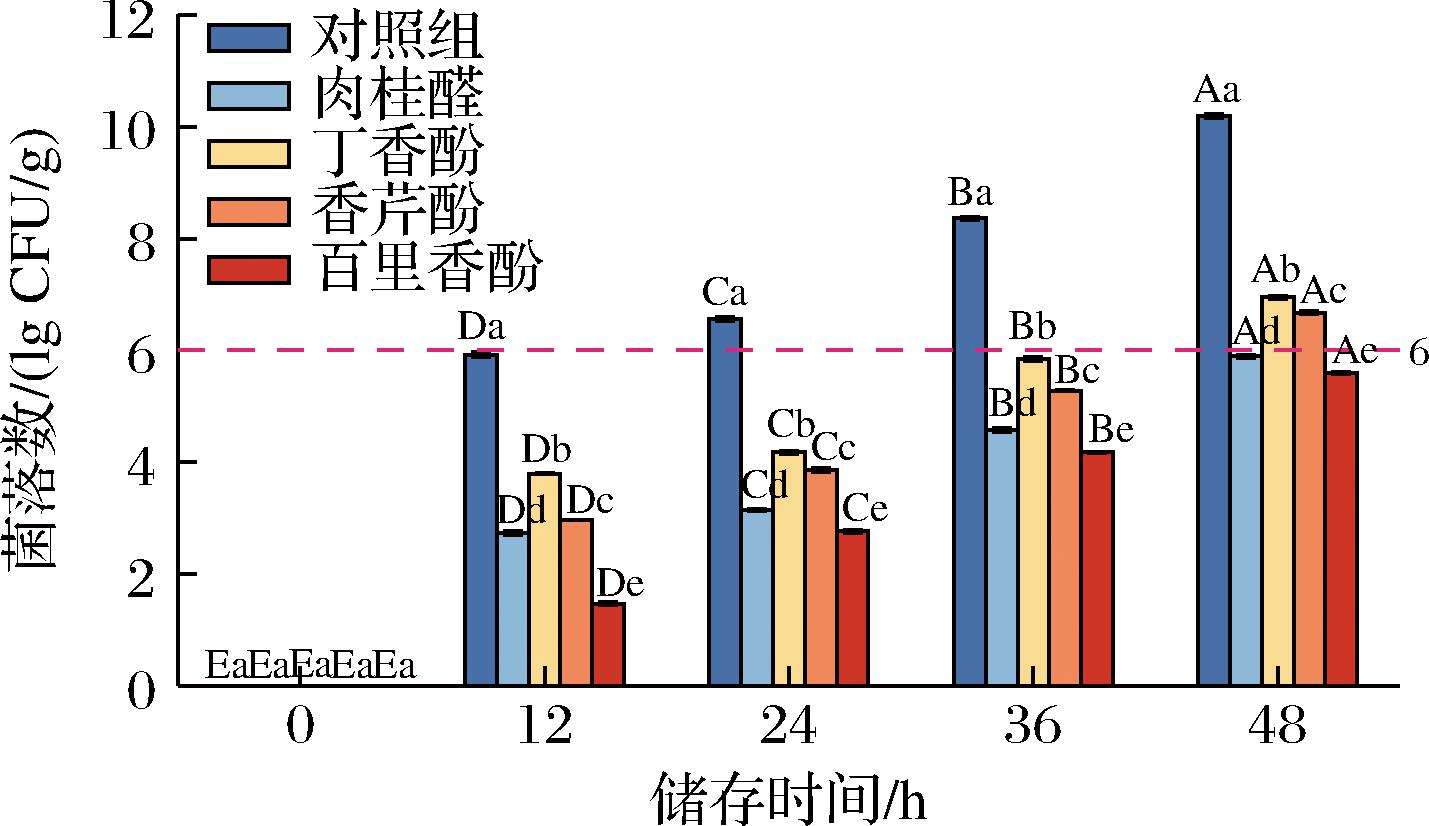
图3 鲜湿面条菌落总数变化
FIg.3 Changes of microbial count in FWNs
注:分别于0、12、24、36、48 h取出进行计数分析;每列数据后不同字母表示显著性(P<0.05);不同大写字母在不同保存时间同一种抑菌剂间差异显著(P<0.05);不同小写字母表示同一时间不同抑菌剂间差异显著(P<0.05)。
2.5 天然酚醛类抑菌剂对鲜湿面品质的影响
2.5.1 质构分析
质构特性是评价食品品质的重要指标,影响面条质构特性的因素包括面筋网络的质量和面条中淀粉的性质等。测定烹饪后的鲜湿面的质构特性如表2所示。
表2 鲜湿面条的质构分析、蒸煮损失以及色差值。
Table 2 Texture analysis, cooking loss and color of FWNs

组别蒸煮损失/%质构特性色差硬度/N弹性/mm咀嚼性/N回复性ΔL∗Δa∗Δb∗对照组4.51±0.24a2661.61±47.19d0.74±0.14bcd1461.68±97.11abcde0.65±0.09b73.56±0.03d0.01±0.01c10.78±0.04d0.1%香芹酚4.03±0.15b2765.03±63.11bc0.71±0.03d1351.43±63.51de0.51±0.02ab84.42±0.06bc0.94±0.01a14.13±0.33a0.1%肉桂醛4.01±0.13b2876.30±55.26a0.73±0.05bcd1422.41±98.89bcde0.46±0.01de85.72±0.26a0.05±0.01c11.83±0.21c0.1%丁香酚4.03±0.1b2795.20±62.99ab0.71±0.02cd1320.53±41.00e0.46±0.02de84.43±0.18bc-0.02±0.07c13.29±0.19b0.1%百里香酚4.29±0.15ab2666.33±8.29d0.78±0.06ab1462.32±23.45abcde0.59±0.18bc84.68±0.08b0.75±0.09b13.62±0.38b
注:各列不同字母表示差异显著(P<0.05)。
硬度指标代表了面条的抗压能力。添加肉桂醛、丁香酚和香芹酚的样品的硬度显著高于添加百里香酚和空白样品,结合其蒸煮损失的结果以及这3种酚类的油性状态等,推测是这3种酚类物质,可以使鲜湿面条的面筋网络结构更紧密。而添加了百里香酚的样品硬度较低,是由于百里香酚是固体状态,难以参与面条中面筋网络结构的形成。对于这些推测,后续进行了对面筋网络结构的进一步实验来验证。而对照组和添加了抑菌剂的面条弹性和咀嚼性差异较小,对照组以及添加香芹酚、百里香酚的面条回复性高于其余2组。综上所述,抑菌剂的加入可以影响面条的质地,推测其可能是通过影响面筋和淀粉的理化性质来影响鲜湿面的质地。有研究发现植物多酚可以与面筋蛋白形成交联[23],推测鲜湿面的质构形成因此受到影响。然而,这种效果并不显著,推测是因为添加的量较少不足以以使面条的质地产生很大的不同。
2.5.2 蒸煮损失以及颜色变化
蒸煮损失是指面筋包裹淀粉的能力,也能反映面条在沸水中煮熟后是否能保持结构完整,是评价面条品质的重要性质之一。结果表明(表2),对照组的蒸煮损失最高(4.51%),添加抑菌剂后蒸煮损失显著降低(P<0.05)。添加肉桂醛的面条蒸煮损失最小,仅为4.01%,其次是香芹酚和丁香酚,而添加百里香酚的鲜湿面面条蒸煮损失最高。研究证实,紧密的面筋网络可以限制淀粉在蒸煮过程中的溶解,乳化剂或油可以减少面条的蒸煮损失[24]。因此,推测香芹酚、肉桂醛和丁香酚可能有助于形成面筋网络,从而减少烹饪过程中的淀粉损失,最终减少鲜湿面中的烹饪损失。这一结果将为提高鲜湿面的质量提供新的途径。
抑菌剂的添加对面条的颜色有一定影响(表2)。添加百里香酚面条的颜色变化与以往研究文章中百里香酚米粉的颜色变化一致[25]。各抑菌剂组鲜湿面的亮度和黄度均显著升高(P<0.05)。加入香芹酚和百里香酚和肉桂醛的面条颜色更红,加入丁香酚的面条颜色更绿。添加肉桂醛的面条亮度增加幅度最大。含有香芹酚和百里香酚的面条在所有样品中最黄。
2.5.3 面筋网络结构分析
研究表明,多酚可以影响面筋网络的结构[26-27]。由于蒸煮损失和质构分析结果表明面筋网络可能受到不同类型天然抑菌剂的影响,因此有必要对面筋蛋白网络的结构进行深入研究。用CLSM对面筋网络和淀粉颗粒进行观察(图4)。对照组和百里香酚组面筋蛋白网络结构相对疏松,分布不规则,淀粉颗粒明显。而添加香芹酚、肉桂醛和丁香酚的鲜湿面蛋白网络结构的完整性明显提高。添加肉桂醛的面条面筋蛋白网络结构最规则,宽度较大。推测百里香酚对面筋蛋白的影响不明显的原因是百里香酚是固体颗粒,加入时不能很好地融入面团,而丁香酚、肉桂醛和香芹酚都是液体,可以更好地分散。这一现象表明丁香酚、肉桂醛和香芹酚均可以改善鲜湿面的面筋网络结构。这个结果与许多研究的结论一致,WANG等[28]的研究发现,单宁可以促进面筋蛋白之间的非共价相互作用,促进了面筋蛋白的聚集,改变了面筋网络的微观结构,也有研究发现,添加低聚原花青素会与小麦面团形更致密的面筋网络微观结构[29]。本研究结果为面条天然品质改良剂的研究提供了新的思路。
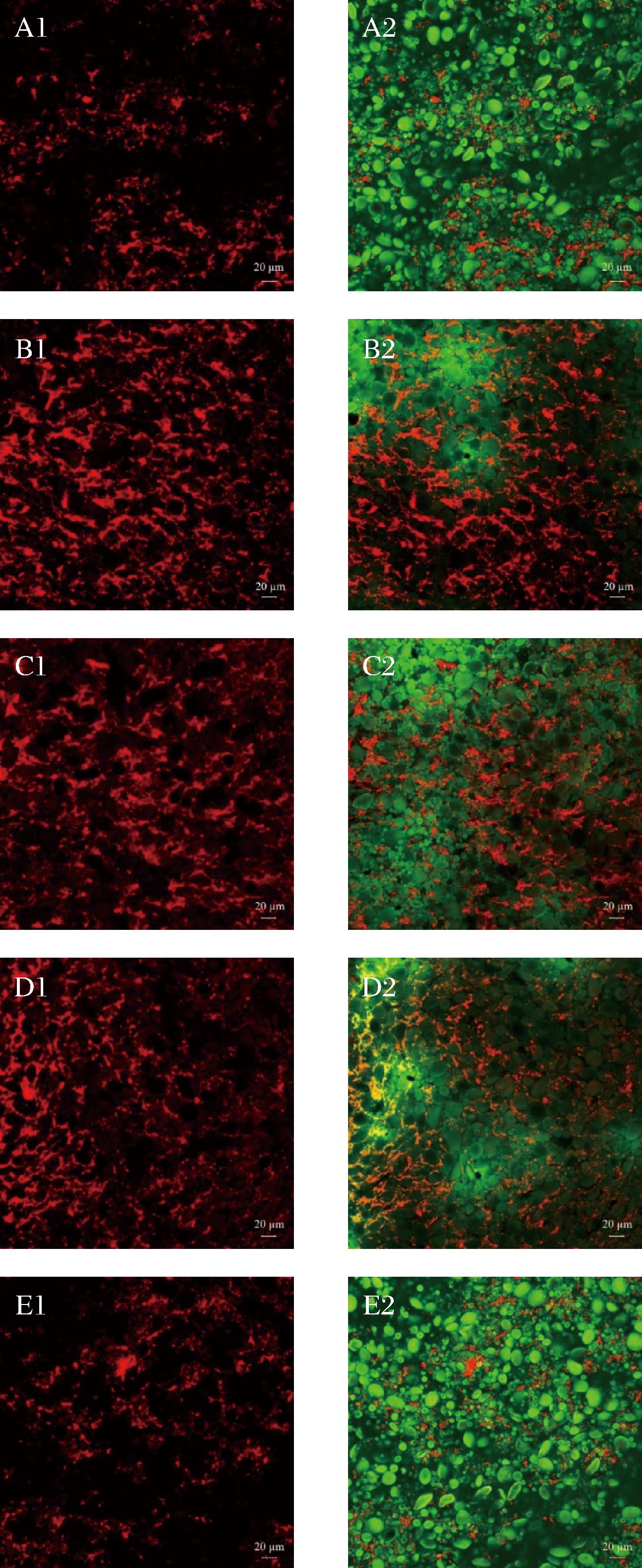
a-对照组;b-肉桂醛;c-丁香酚;d-香芹酚;e-百里香酚(1:面筋蛋白(红色荧光)CLSM,2:面筋蛋白和淀粉(绿色荧光)CLSM)
图4 面筋蛋白和淀粉CLSM图
Fig.4 CLSM micrographs of gluten and starch
2.5.4 感官分析
由于这4种天然抑菌剂在鲜湿面上的应用相对较少,因此有必要进行感官评估。感官特性是消费者评价鲜湿面的重要特征,并直接关系到他们的消费体验。结果如图5所示。
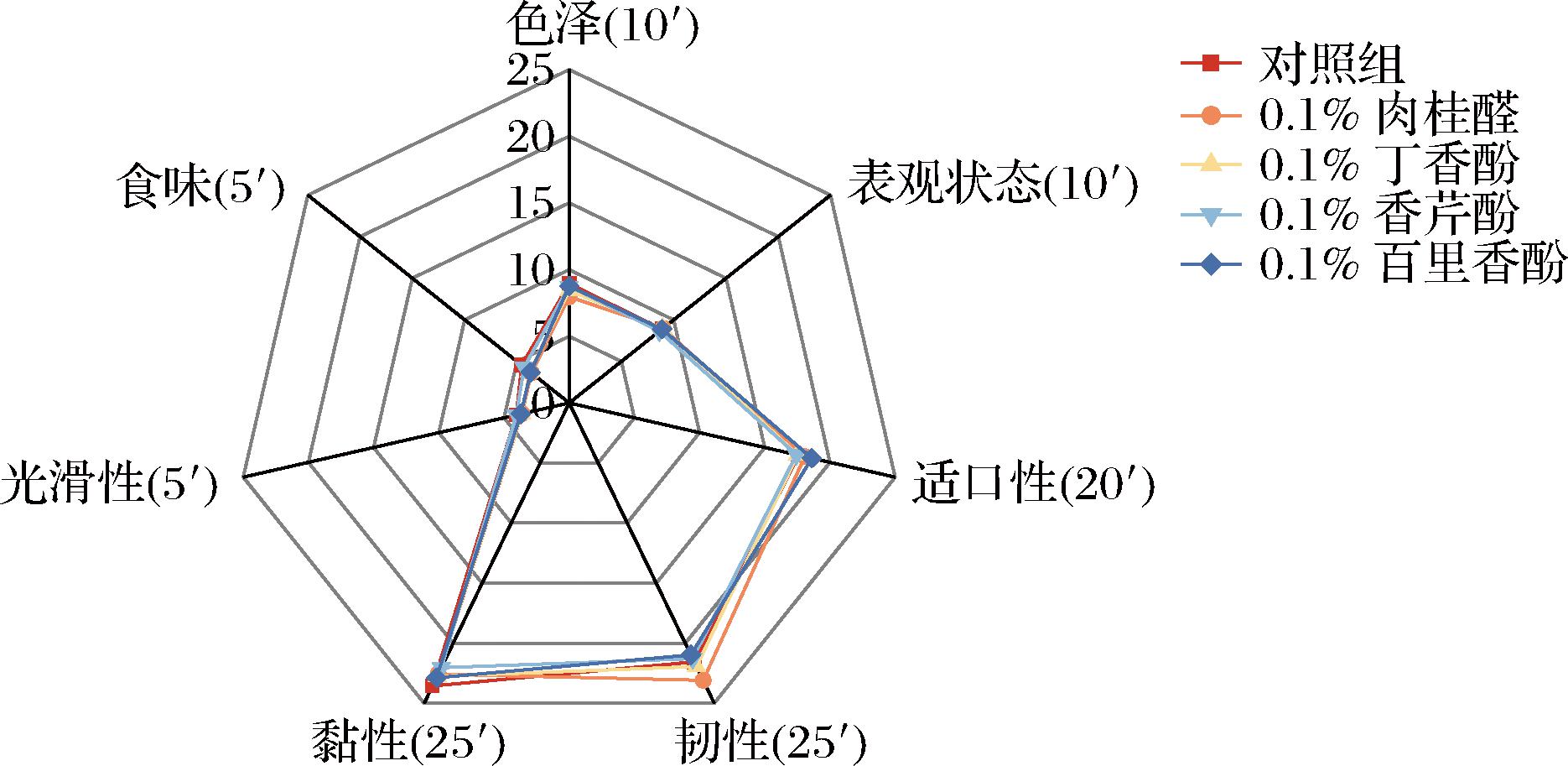
图5 添加抑菌剂后熟面条的感官分析
Fig.5 Sensory analysis of cooked noodles with the addition of antimicrobials
注:图中所示的分数为平均值。
添加0.1%肉桂醛和0.1%丁香酚的面条的颜色略低于对照组和添加0.1%香芹酚和0.1%百里香酚的面条。添加0.1%肉桂醛和0.1%百里香酚的面条最硬,其次是对照组和添加0.1%丁香酚和0.1%香芹酚的面条。与对照组相比,添加0.1%香芹酚弹性最低。几种面条的风味差异较大,但在消费者可接受的范围内。对照组和香芹酚的面条味道最好,但0.1%肉桂醛和0.1%百里香酚的面条感官得分最低。综合评价5项感官评价指标,消费者普遍可以接受含0.1%抑菌剂的鲜湿面。
3 结论
本研究调查了市场上最常见的面条储存方法下细菌种类的分布,测序结果对今后鲜湿面条的抑菌研究具有指导意义。4种抑菌剂通过破坏细菌细胞膜,对鲜湿面中各种腐败菌均有不同程度的抑制作用,能不同程度地有效抑制微生物的生长,可用于延长鲜湿面的货架期。香芹酚、丁香酚以及肉桂醛还可以提高鲜湿面的品质,包括减少蒸煮损失,增加面条硬度,改善面筋网络的微观结构。综上所述,香芹酚、丁香酚、肉桂醛和百里香酚作为天然抑菌剂质量改进剂是可行和有效的。这些研究结果可用于鲜湿面的实际保存和加工,期望这些发现有助于未来的市场上出现稳定保质期和高质量的鲜湿面。
[1] GUO Q, CAI J H, REN C W, et al.A new strategy for the shelf life extension of fresh noodles by accurately targeting specific microbial species[J].Food Control, 2022, 138:109037.
[2] LI M, ZHU K X, SUN Q J, et al.Quality characteristics, structural changes, and storage stability of semi-dried noodles induced by moderate dehydration Understanding the quality changes in semi-dried noodles[J].Food Chemistry, 2016, 194:797-804.
[3] FAN X T, NGO H, WU C Q.Natural and Bio-Based Antimicrobials:A review[M].DC:American Chemical Society, 2018:1-24.
[4] 张庆霞. 植物源防腐剂的抑菌机理及其在生鲜湿面保鲜中的应用[J].食品与发酵工业, 2020, 46(21):310-316.ZHANG Q X.Antimicrobial mechanism and application of plant preservatives in fresh wet noodles preservation[J].Food and Fermentation Industries, 2020, 46(21):310-316.
[5] LI L Y, ZHOU W H, WU A Q, et al.Effect of Ginkgo biloba powder on the physicochemical properties and quality characteristics of wheat dough and fresh wet noodles[J].Foods, 2022, 11(5):698.
[6] DI PASQUA R, BETTS G, HOSKINS N, et al.Membrane toxicity of antimicrobial compounds from essential oils[J].Journal of Agricultural and Food Chemistry, 2007, 55(12):4863-4870.
[7] 曹涵, 刘伯业, 陈复生, 等.鲜湿面防腐保鲜技术的研究进展[J].粮食与油脂, 2020, 33(3):28-30.CAO H, LIU B Y, CHEN F S, et al.Research progress on antisepsis preservation technology of fresh wet noodles[J].Cereals &Oils, 2020, 33(3):28-30.
[8] ZHAO Y, HUANG Z H, ZHOU H M, et al.Preventing the browning of fresh wet noodle sheets by aqueous ozone mixing:Browning and physicochemical properties[J].Journal of Cereal Science, 2022, 104:103428.
[9] CHEN H, GUO X N, ZHU K X.The effect of chitosan oligosaccharides on the shelf-life and quality of fresh wet noodles[J].Carbohydrate Polymers, 2023, 309:120704.
[10] HAN T Y, YANG Z, YU C, et al.Effect of acidity regulators on the shelf life, quality, and physicochemical characteristics of fresh wet noodles[J].Journal of Cereal Science, 2022, 103:103409.
[11] XING J J, JIANG D H, GUO X N, et al.Effect of dough mixing with slightly acidic electrolyzed water on the shelf-life and quality characteristics of fresh wet noodles[J].Food Control, 2021, 124:107891.
[12] SHI Y N, LI Y F, YANG K, et al.A novel milk-derived peptide effectively inhibits Staphylococcus aureus: Interferes with cell wall synthesis, peptidoglycan biosynthesis disruption reaction mechanism, and its application in real milk system[J].Food Control, 2023, 144:109374.
[13] ZHAO G, KEMPEN P J, ZHENG T, et al.Synergistic bactericidal effect of nisin and phytic acid against Escherichia coli O157:H7[J].Food Control, 2023, 144:109324.
[14] GAO C Y, TIAN C R, LU Y H, et al.Essential oil composition and antimicrobial activity of Sphallerocarpus gracilis seeds against selected food-related bacteria[J].Food Control, 2011, 22(3-4):517-522.
[15] XING J J, JIANG D H, YANG Z, et al.Effect of humidity-controlled dehydration on microbial growth and quality characteristics of fresh wet noodles[J].Foods, 2021, 10(4):844.
[16] SUN X Y, BU Z W, QIAO B Q, et al.The effects of wheat cultivar, flour particle size and bran content on the rheology and microstructure of dough and the texture of whole wheat breads and noodles[J].Food Chemistry, 2023, 410:135447.
[17] POPP A, CLEENWERCK I, IVERSEN C, et al.Pantoea gaviniae sp.nov.and Pantoea calida sp.nov., isolated from infant formula and an infant formula production environment[J].International Journal of Systematic and Evolutionary Microbiology, 2010, 60(Pt 12):2786-2792.
[18] ASHRAFUDOULLA M, MIZAN M F R, HA A J W, et al.Antibacterial and antibiofilm mechanism of eugenol against antibiotic resistance Vibrio parahaemolyticus[J].Food Microbiology, 2020, 91:103500.
[19] TIAN L, WANG X Y, LIU R J, et al.Antibacterial mechanism of thymol against Enterobacter sakazakii[J].Food Control, 2021, 123:107716.
[20] TROMBETTA D, CASTELLI F, SARPIETRO M G, et al.Mechanisms of antibacterial action of three monoterpenes[J].Antimicrobial Agents and Chemotherapy, 2005, 49(6):2474-2478.
[21] BOULOS L, PRÉVOST M, BARBEAU B, et al.LIVE/DEAD® BacLightTM:Application of a new rapid staining method for direct enumeration of viable and total bacteria in drinking water[J].Journal of Microbiological Methods, 1999, 37(1):77-86.
[22] ZHOU S Y, SHEEN S, PANG Y H, et al.Antimicrobial effects of vapor phase thymol, modified atmosphere, and their combination against Salmonella spp.on raw shrimp[J].Journal of Food Science, 2013, 78(5):M725-M730.
[23] STRAUSS G, GIBSON S M.Plant phenolics as cross-linkers of gelatin gels and gelatin-based coacervates for use as food ingredients[J].Food Hydrocolloids, 2004, 18(1):81-89.
[24] MA M, SUN Q J, LI M, et al.Deterioration mechanisms of high-moisture wheat-based food: A review from physicochemical, structural, and molecular perspectives[J].Food Chemistry, 2020, 318:126495.
[25] BAI-NGEW S, CHUENSUN T, WANGTUEAI S, et al.Antimicrobial activity of a crude peptide extract from Lablab bean (Dolichos lablab) for semi-dried rice noodles shelf-life[J].Quality Assurance and Safety of Crops &Foods, 2021, 13:25-33.
[26] KREKORA M, MI A, NAWROCKA A.Molecular interactions between gluten network and phenolic acids studied during overmixing process with application of FT-IR spectroscopy[J].Journal of Cereal Science, 2021, 99:103203.
A, NAWROCKA A.Molecular interactions between gluten network and phenolic acids studied during overmixing process with application of FT-IR spectroscopy[J].Journal of Cereal Science, 2021, 99:103203.
[27] WANG C C, SHENG Z, ZHANG Y H, et al.Effects of epigallocatechin-3-gallate on the structural hierarchy of the gluten network in dough[J].Food Hydrocolloids, 2023, 142:108803.
[28] WANG Q, LI Y, SUN F S, et al.Tannins improve dough mixing properties through affecting physicochemical and structural properties of wheat gluten proteins[J].Food Research International, 2015, 69:64-71.
[29] LIU R, SHI C Y, SONG Y S, et al.Impact of oligomeric procyanidins on wheat gluten microstructure and physicochemical properties[J].Food Chemistry, 2018, 260:37-43.