薏米(Coix lacryma-jobi var. ma-yuen (Romanet du Caillaud) Stapf)为禾本科薏米属一年生或多年生草本植物,起源于东南亚,在中国、日本、泰国和缅甸广泛种植[1],是一种古老的粮食和经济作物。薏米富含蛋白质、矿物质、糖类和脂类等营养成分,还含薏苡素、黄酮和多酚类化合物等功能性成分[2],是一种优质的粮食作物。
淀粉是薏米的主要成分,占干重的54.26%~58.15%[3]。薏米具有难糊化、难消化的特性,研究薏米淀粉的改性有助于改良薏米的食用品质。研究表明,萌发是一种廉价且高效的改善谷物营养和理化特性方法,萌发谷物相关产品已在全球范围内被广泛认可。萌发显著降低水稻淀粉的分子大小,直链淀粉含量,相对结晶度和糊化温度,提高了淀粉的发泡能力和支链淀粉的短链比例,可用于改善面包的品质[4]。萌发降低了小麦、大麦、燕麦淀粉的相对结晶度、峰值黏度和热焓值,但增加了淀粉膜的伸长率,有助于淀粉膜在包装工业中的应用以及拓宽水解淀粉在食品工业或其他工业中的用途[5-8]。萌发可以增强薏米种子营养价值和保健效益[9]。然而,目前关于萌发对薏米淀粉的结构和理化性质影响的文献报道较少,其作用机制尚不清楚。因此,本研究旨在探讨萌发过程中薏米淀粉结构和功能特性的变化,为薏米淀粉资源的开发、加工和利用提供理论依据。
1 材料与方法
1.1 材料与设备
薏米,贵州省兴仁市;猪胰腺α-淀粉酶(12 U/mg)、淀粉转葡萄糖苷酶(103 U/mg)、异淀粉酶、玉米支链淀粉、马铃薯直链淀粉,美国Sigma公司。
S-3400N扫描电子显微镜(scanning electron microscopy,SEM),日本HITACHI公司;Bettersize 2600激光粒度分析仪,中国丹东百特仪器有限公司;Q2000 TA差示扫描量热仪,美国TA Instruments公司;Empyrean锐影X射线衍射仪,荷兰PANalytical B.V.公司;Nicolet iS50傅里叶变换红外光谱仪、ICS500+高效阴离子交换色谱和脉冲安培,美国Thermo Fisher Scientific公司;Super 4快速黏度分析仪,美国Newport Scientific公司;CT3 Texture Analyzer质构分析仪,美国Brookfield公司。
1.2 实验方法
1.2.1 薏米萌发处理
参照XU等[9]的方法,稍作修改,选择谷粒饱满无病害的薏米籽粒,去掉苞片后用0.1%(体积分数)的NaClO溶液消毒处理30 min,去离子水冲洗后,将薏米在25 ℃的蒸馏水中浸泡12 h充分吸水。充分吸水的薏米平铺于双层纱布之间,于25 ℃避光萌发,每隔12 h洒水1次,并清洗纱布和薏米防止污染。萌发时间为0~6 d,每天取1次,共采集7次,将其标记为G0~G6,冷冻干燥后保存于4 ℃冰箱中。
1.2.2 淀粉提取
将萌发不同天数的薏米分别置于榨汁机中加水打碎成匀浆,使用四层纱布过滤,收集滤液后依次通过100、200、400目筛。再次收集的滤液于5 000 r/min离心10 min,弃去上清液,并刮除沉淀表面黄褐色杂质。重复离心和刮除杂质的操作,直至沉淀表面为光洁白色。收集沉淀平铺于洁净的培养皿,并于40 ℃下烘干至恒重,研磨,过100目筛,4 ℃下密封保存备用。
1.2.3 淀粉粒形貌观察
使用导电双面胶将适量淀粉粉末固定在在金属台上,真空下溅射镀金。随后于SEM下观察淀粉粒形貌特征。放大倍数为1 000和3 000倍,电压20 kV。
1.2.4 粒度分布测定
使用激光粒度分析仪测定淀粉粒粒度分布。将约30 mg淀粉添加到专用量杯中,添加10 mL的蒸馏水,使用磁力搅拌器搅拌1 min以制备淀粉悬浮液。将分散好的悬浮液倒入旋转容器中,分析淀粉粒的粒度分布。水和淀粉的折射率(dn/dc)分别设置为1.33和1.60,遮光率为8%~15%。
1.2.5 直链淀粉含量测定
称取淀粉10 mg溶于5 mL 90%(体积分数)二甲基亚砜(dimethyl sulfoxide,DMSO)水溶液,95 ℃水浴30 min,得到澄清溶液,冷却至室温。取1 mL该淀粉-DMSO溶液至50 mL容量瓶中,立即加入蒸馏水至接近50 mL,加入1 mL碘液(0.2% I2, 2% KI,w/v),定容,摇匀,暗处静置30 min。通过测定620 nm处的吸光度并参考标准曲线计算出直链淀粉含量,使用玉米支链淀粉和马铃薯直链淀粉制作标准曲线。
1.2.6 支链淀粉链长分布测定
按照NISHI等[10]的方法,用异淀粉酶对淀粉进行脱支。支链淀粉的链长分布采用高效阴离子交换色谱和脉冲安培检测进行分析。由三黍生物技术有限公司(中国,上海)提供支链淀粉链长分析技术支持。
1.2.7 结晶特性测定
测试前所有淀粉样品置于盛有饱和NaCl水溶液的密闭容器(保持恒定湿度)中吸水1 周。使用X射线衍射仪进行测定。测试条件:电压40 kV,电流40 mA,衍射角(2θ)的旋转范围力5°~40°,扫描速度1.2 /min,步长0.02°。
1.2.8 傅里叶红外光谱测定
使用傅里叶变换红外光谱测定淀粉的短程有序结构。称量50 mg淀粉于2 mL离心管中,加入50 μL蒸馏水,搅拌均匀。扫描范围为4 000~800 cm-1,使用OMNIC进行图谱分析,解卷积处理参数为:半峰宽度为19 cm-1,增强因子为1.9。依据1 045、1 022、995 cm-1的峰值计算1 045/1 022、995/1 022比值。
1.2.9 膨胀势(swelling power,SP)和溶解度(solubility,SOL)测定
称取待测淀粉样品30 mg(记为m)置于预先称质量(记为m1)的离心管中,加蒸馏水至2 mL,立即涡旋混匀,于金属浴95 ℃(800 r/min)下加热30 min,待冷却至室温,8 000 r/min离心10 min。将上清液小心转移至预先称质量(记为m2)的离心管内,立即称量含沉淀物的离心管质量(记为m3);将装有上清液的离心管在105 ℃下干燥24 h,称质量(记为m4)。淀粉样品的SP和SOL的计算如公式(1)和公式(2)所示:
(1)
(2)
1.2.10 吸水性和吸油性的测定
将淀粉样品(100 mg)置于1 mL离心管中,加入1 mL蒸馏水或大豆油充分搅拌20 min,4 000 r/min离心15 min。倒出上清液,用滤纸倒出剩余的蒸馏水和油。当滤纸上不再滴有水或油时即可称质量,吸收能力的计算如公式(3)所示:
吸收能力![]()
(3)
式中:m湿,湿沉淀物的质量,g;m干,样品的干重,g。
1.2.11 热力学性质测定
使用差示扫描量热仪测定淀粉的热力学性质。精确称量3 mg淀粉于铝坩埚中,加入9 μL超纯水。密封后置于4 ℃冰箱中过夜。室温下平衡1 h后,将样品以10 ℃/min的加热速率从25 ℃加热至130 ℃,用空坩埚作对照。
1.2.12 糊化特性测定
参考GB/T 24852—2010《大米及米粉糊化特性测定 快速黏度仪法》,使用快速黏度分析仪测量淀粉样品的黏度特性。
1.2.13 淀粉凝胶质构特性测定
将380 g/L薏米淀粉乳倒入1 cm×1 cm×1 cm的模具容器中,沸水浴糊化40 min,冷却至室温后,4 ℃保存24 h以形成固体凝胶,将其从模具取出,使用质构分析仪测试其质构性质。测量参数如下:测试模式TPA,圆柱形探头P/50,测试速度1 mm/s,变形率30%,触发力0.2 N,力传感元件量程25 N,压缩次数2。
1.2.14 体外特性测定
参考ENGLYST等[11]的方法,稍作修改。称取0.3 mg猪胰腺α-淀粉酶于4 mL 0.02 mol/L(pH值为6.9)磷酸钠缓冲液中,涡旋振荡溶解20 min,8 000 r/min离心10 min,取上清酶液。称取10 mg淀粉葡糖苷酶于1 mL 0.02 mol/L(pH值为4.8)醋酸缓冲液中,将上述2种酶液转移至新离心管内混匀备用。称取100 mg淀粉于10 mL离心管中,加入4 mL 0.5 mol/L(pH值为5.2)磷酸缓冲液和1 mL混合酶液,再加入5颗玻璃珠,将其密封后置于恒温培养振荡器中孵育并计时(37 ℃,200 r/min)。分别于20、120 min取出离心管,8 500 r/min离心5 min,取0.1 mL上清液于离心管中,加入1 mL 80%(体积分数)乙醇,加入1 mL 3,5-二硝基水杨酸(3, 5-dinitrosalicylic acid,DNS)显色液,95 ℃加热5 min,以测定20、120 min的淀粉降解率,并记为G20、G120。通过不同浓度的葡萄糖溶液制得标准曲线。快速消化淀粉(rapidly digestible starch,RDS)、缓慢消化淀粉(slowly digestible starch,SDS)和抗性淀粉(resistant starch,RS)的计算如公式(4)~公式(6)所示:
RDS/%=G20(%)
(4)
SDS/%=G120(%)-G20(%)
(5)
RS/%=100%-RDS(%)-SDS(%)
(6)
1.2.15 数据分析
使用SPSS 26进行数据统计分析,使用Origin 2018作图。
2 结果与分析
2.1 淀粉粒的形态特征分析
薏米淀粉颗粒呈多角形或球形,表面有少量凹痕或孔洞(图1-a)。萌发导致淀粉粒表面产生更多孔洞,部分淀粉粒被瓦解成碎片(图1-b~图1-g)。以往研究发现,在萌发过程中不同谷物淀粉粒表面也会产生孔洞[5],这与本研究结果一致。淀粉粒在萌发过程中的形貌变化过程:淀粉酶吸附在淀粉粒表面,淀粉分子迅速分解,颗粒表面产生凹痕,然后扩大形成孔洞,酶分子深入到淀粉粒中心,继而由内而外水解淀粉粒,从而将淀粉粒水解成碎片[5, 12]。

a-G0;b-G1;c-G2;d-G3;e-G4;f-G5;g-G6
图1 萌发过程中薏米淀粉颗粒的形貌特征
Fig.1 Morphological characteristics of adlay starch granules during germination 注:图中a为孔洞,b为碎片。
2.2 淀粉粒的粒度分布分析
萌发0~6 d,薏米淀粉颗粒的中值粒径(D50)从13.68 μm减少到12.54 μm,体积平均径(D[4, 3])和比表面积平均径(D[3, 2])降低(表1),这表明萌发降低了淀粉粒粒径,其原因可能是萌发促进了薏米中相关淀粉酶活性的增强,导致淀粉粒的水解程度加剧,淀粉粒变小[6]。LI等[6]和WU等[13]研究发现,萌发使得水稻的淀粉粒粒径降低,与本研究结果一致。萌发薏米淀粉具有更大的比表面积(表1),可能是萌发过程中薏米淀粉粒表面出现孔洞所导致的(图1)。
表1 萌发过程中薏米淀粉的粒度分布
Table 1 Particle size of adlay starch during germination
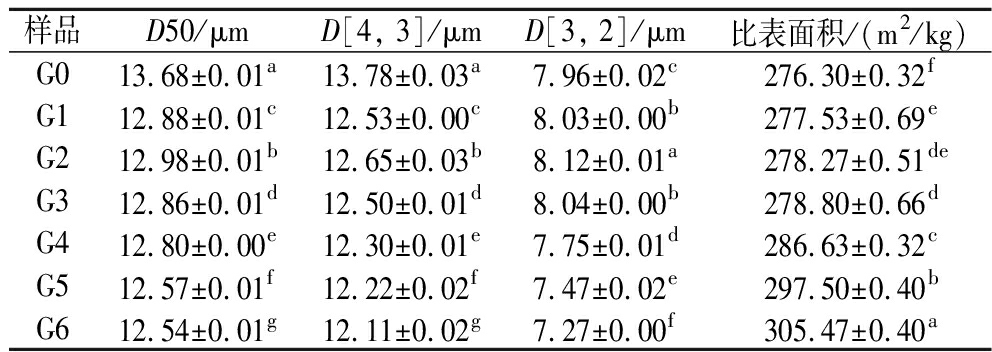
样品D50/μmD[4, 3]/μmD[3, 2]/μm比表面积/(m2/kg)G013.68±0.01a13.78±0.03a7.96±0.02c276.30±0.32fG112.88±0.01c12.53±0.00c8.03±0.00b277.53±0.69eG212.98±0.01b12.65±0.03b8.12±0.01a278.27±0.51deG312.86±0.01d12.50±0.01d8.04±0.00b278.80±0.66dG412.80±0.00e12.30±0.01e7.75±0.01d286.63±0.32cG512.57±0.01f12.22±0.02f7.47±0.02e297.50±0.40bG612.54±0.01g12.11±0.02g7.27±0.00f305.47±0.40a
注:同列中不同字母表示具有差异显著(n=3,P<0.05)(下同)。
2.3 直链淀粉含量分析
直链淀粉含量是影响淀粉性质的重要指标。WU等[13]和MA等[14]研究发现,萌发使玉米和水稻的直链淀粉含量降低,而本研究发现,萌发0~2 d,直链淀粉含量增加;萌发3 d,直链淀粉含量降低(表2)。直链淀粉含量的增加可能是因为萌发0~2 d淀粉酶先水解无定形片层中的支链淀粉侧链,产生小分子直链淀粉[15];萌发3 d,水解酶进入淀粉粒内部无定形区,直链淀粉被降解为糊精和单糖等可溶性分子,并从淀粉颗粒中逸出,故直链淀粉含量降低。
表2 萌发过程中薏米淀粉的直链淀粉含量、溶解度、膨胀势、吸水性和吸油性
Table 2 Amylose content, swelling power (SP), solubility (SOL) and absorption of water and oil during germination
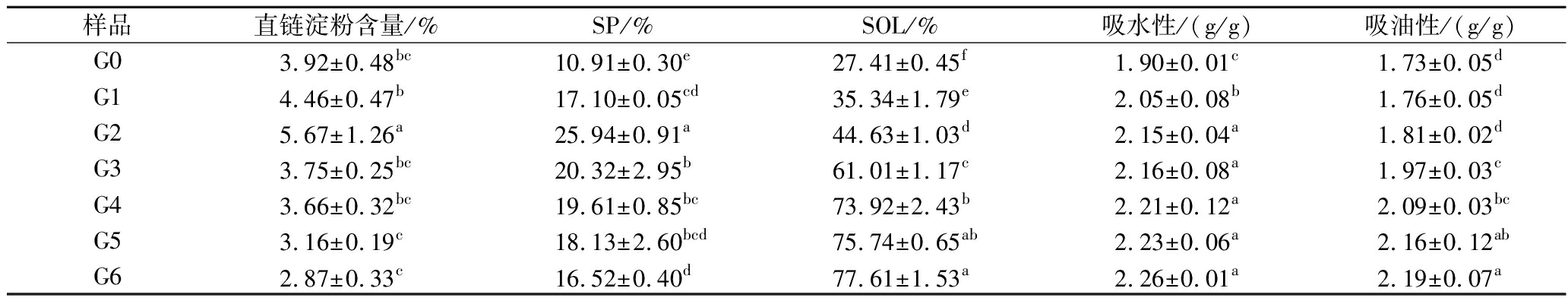
样品直链淀粉含量/%SP/%SOL/%吸水性/(g/g)吸油性/(g/g)G03.92±0.48bc10.91±0.30e27.41±0.45f1.90±0.01c1.73±0.05dG14.46±0.47b17.10±0.05cd35.34±1.79e2.05±0.08b1.76±0.05dG25.67±1.26a25.94±0.91a44.63±1.03d2.15±0.04a1.81±0.02dG33.75±0.25bc20.32±2.95b61.01±1.17c2.16±0.08a1.97±0.03cG43.66±0.32bc19.61±0.85bc73.92±2.43b2.21±0.12a2.09±0.03bcG53.16±0.19c18.13±2.60bcd75.74±0.65ab2.23±0.06a2.16±0.12abG62.87±0.33c16.52±0.40d77.61±1.53a2.26±0.01a2.19±0.07a
2.4 支链淀粉链长分布分析
HIZUKURI[16]将支链淀粉分支链分为4种类型:A链为DP(6~12),B1链为DP(13~24),B2链为DP(25~36),B3链为DP≥37。所有薏米淀粉的支链淀粉链长分布相似,萌发后短A链、B2链比例略有降低,平均链长![]() 和B3链增加(图2)。类似的现象也出现在萌发后的燕麦、高粱和小米淀粉中[6, 12],短A链、B2链比例的降低可能是因为部分支链淀粉分子被酶降解为低聚糖[12]。
和B3链增加(图2)。类似的现象也出现在萌发后的燕麦、高粱和小米淀粉中[6, 12],短A链、B2链比例的降低可能是因为部分支链淀粉分子被酶降解为低聚糖[12]。
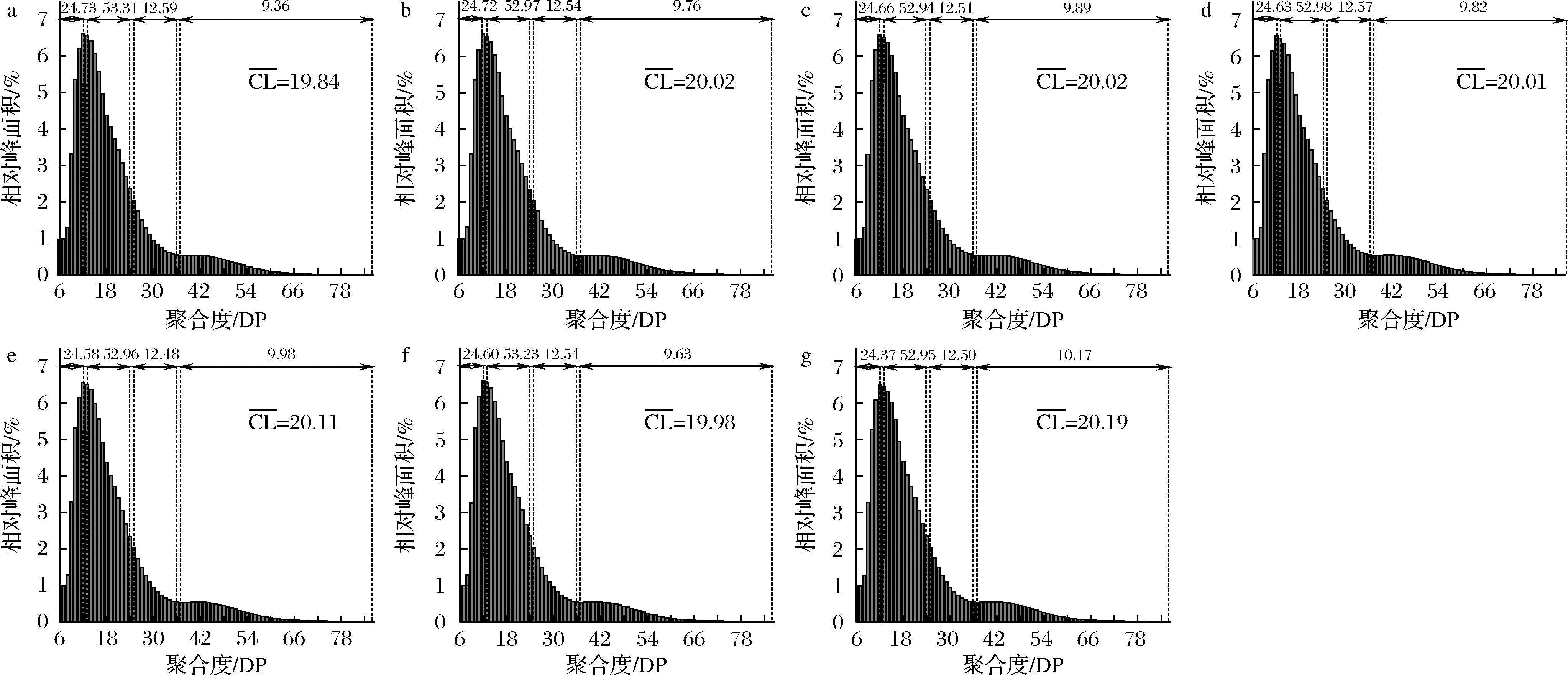
a-G0;b-G1;c-G2;d-G3;e-G4;f-G5;g-G6
图2 萌发过程中薏米淀粉支链淀粉链长分布变化
Fig.2 Amylopection chain length distribution of adlay starch during germination
2.5 结晶特性分析
所有薏米淀粉在15°和23°附近显示出强烈单衍射峰,17°和18°显示出强烈的双衍射峰(图3),属于A型晶体结构,这表明萌发并未改变薏米淀粉的晶体类型。XU等[12]在研究萌发对水稻淀粉性质的影响时也发现,萌发并未改变淀粉的晶体类型。萌发薏米淀粉结晶度呈现升高-降低-升高的变化(表3),其原因可能是淀粉粒生长环中半晶环层和无定形环层交替分布,萌发产生的α-淀粉酶可以同时攻击半晶环层和无定形环层[17],这将导致结晶度不表现为持续性的升高或降低。
表3 萌发过程中薏米淀粉的相对结晶度、FTIR去卷积波谱的1 045/1 022和995/1 022的峰强度比值
Table 3 Relative crystallinity and IR ratio of the absorbances 1 045/1 022 and 995/1 022 for deconvoluted FTIR spectra of adlay starch during germination
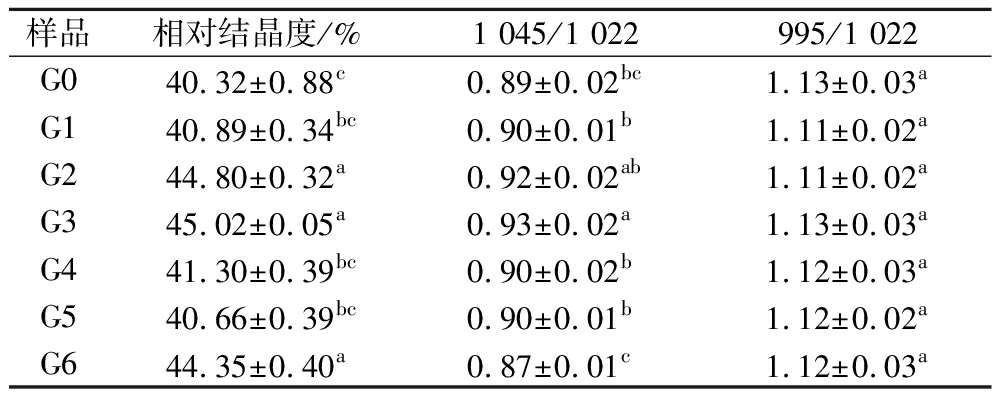
样品相对结晶度/%1 045/1 022995/1 022G040.32±0.88c0.89±0.02bc1.13±0.03aG140.89±0.34bc0.90±0.01b1.11±0.02aG244.80±0.32a0.92±0.02ab1.11±0.02aG345.02±0.05a0.93±0.02a1.13±0.03aG441.30±0.39bc0.90±0.02b1.12±0.03aG540.66±0.39bc0.90±0.01b1.12±0.02aG644.35±0.40a0.87±0.01c1.12±0.03a
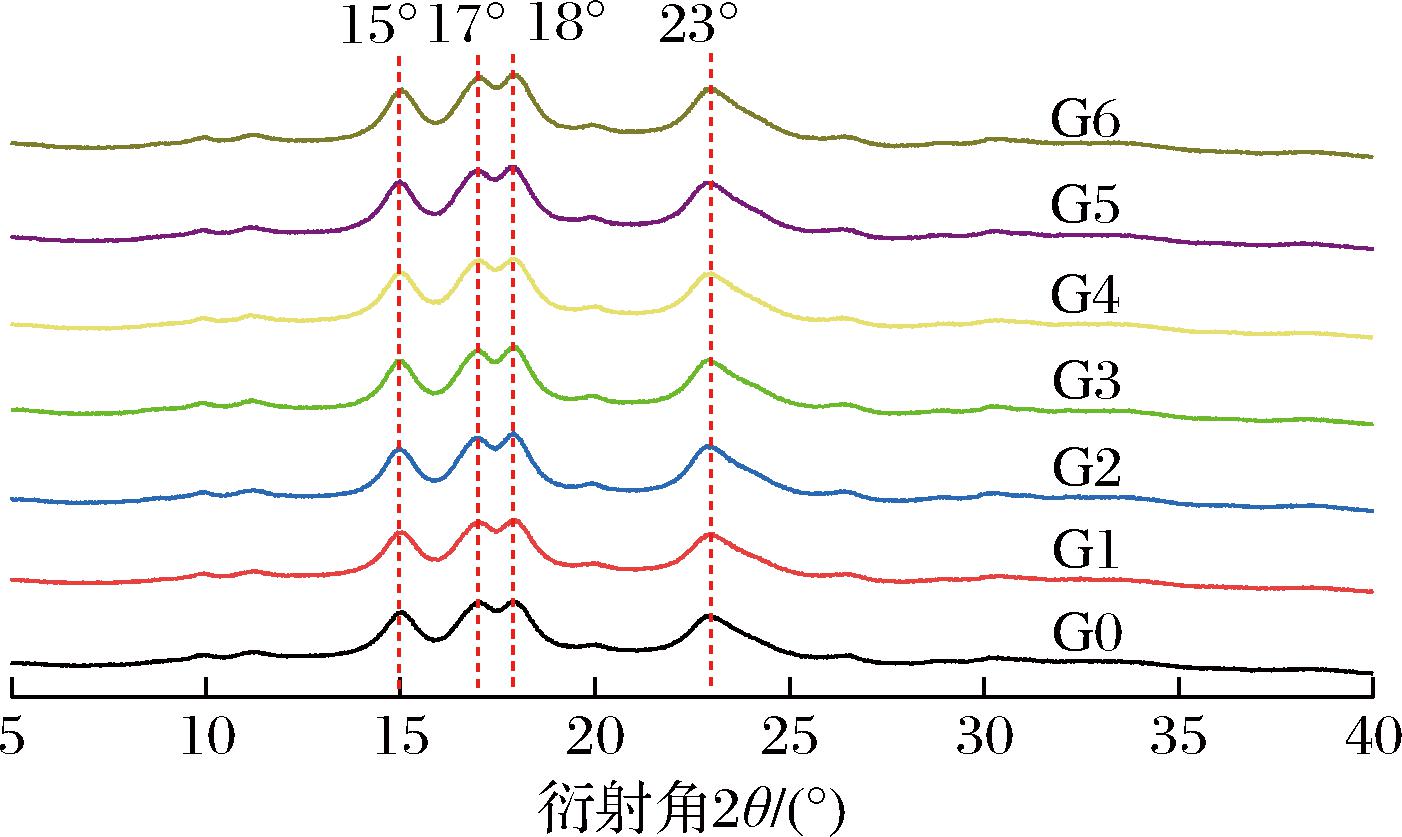
图3 萌发过程中薏米淀粉的XRD图谱
Fig.3 XRD patterns of adlay starch during germination
2.6 表面短程有序结构分析
直链淀粉和支链淀粉中的短链部分可以形成双螺旋结构,即短程有序结构。全衰减傅里叶红外光谱(attenuated total re ectance-Fourier transform infrared,ATR-FTIR)对双螺旋结构的变化十分敏感,可用来研究淀粉粒表面短程有序结构。在1 022 cm-1和1 045 cm-1处的吸收带分别对无序和有序区域敏感。在995 cm-1处的吸收带与双螺旋结构有关,1 045/1 022和995/1 022的值分别用于表示有序度和双螺旋度[18]。本研究发现所有的淀粉样品都表现出相似的红外光谱(图4)。萌发薏米淀粉的995/1 022的峰强度比无显著性差异(表3),说明淀粉颗粒表层双螺旋度无明显变化;萌发0~3 d,1 045/1 022 增加,可能是水解酶先破坏淀粉粒表面由较短葡萄糖链和具有不规则拖尾的螺旋结构部分组成的双螺旋,导致颗粒结构的晶体组装更加有序[19],萌发4~6 d,1 045/1 022 的峰强度比降低,其原因可能是萌发持续进行,水解酶使淀粉粒表面孔洞逐渐增大(图1),破坏了双螺旋结构,分子间相互作用减弱,有序度降低。萌发不仅改变了淀粉颗粒的表面形态,也改变了淀粉分子的结构,使得淀粉颗粒以及淀粉分子更易与其他物质结合,从而影响淀粉的功能特性。
ectance-Fourier transform infrared,ATR-FTIR)对双螺旋结构的变化十分敏感,可用来研究淀粉粒表面短程有序结构。在1 022 cm-1和1 045 cm-1处的吸收带分别对无序和有序区域敏感。在995 cm-1处的吸收带与双螺旋结构有关,1 045/1 022和995/1 022的值分别用于表示有序度和双螺旋度[18]。本研究发现所有的淀粉样品都表现出相似的红外光谱(图4)。萌发薏米淀粉的995/1 022的峰强度比无显著性差异(表3),说明淀粉颗粒表层双螺旋度无明显变化;萌发0~3 d,1 045/1 022 增加,可能是水解酶先破坏淀粉粒表面由较短葡萄糖链和具有不规则拖尾的螺旋结构部分组成的双螺旋,导致颗粒结构的晶体组装更加有序[19],萌发4~6 d,1 045/1 022 的峰强度比降低,其原因可能是萌发持续进行,水解酶使淀粉粒表面孔洞逐渐增大(图1),破坏了双螺旋结构,分子间相互作用减弱,有序度降低。萌发不仅改变了淀粉颗粒的表面形态,也改变了淀粉分子的结构,使得淀粉颗粒以及淀粉分子更易与其他物质结合,从而影响淀粉的功能特性。
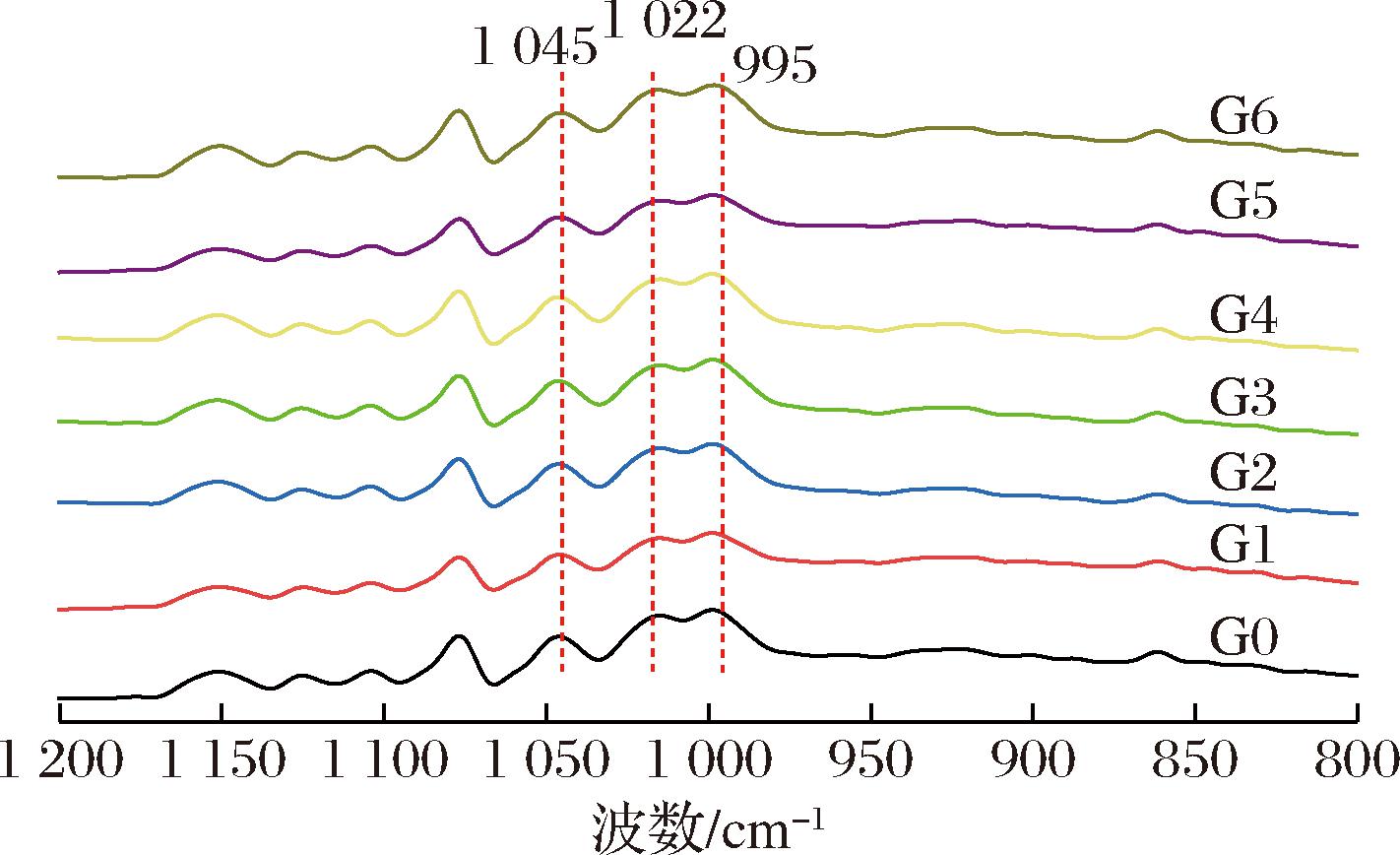
图4 萌发过程中薏米淀粉的ATR-FTIR解卷积图谱
Fig.4 Deconvoluted FTIR spectra of adlay starch during germination
2.7 SP和SOL分析
SP和SOL反映了淀粉颗粒的无定形区和结晶区内淀粉链之间相互作用的大小。在本研究中,萌发增加了薏米淀粉的SP和SOL(表2),表明萌发增强了薏米淀粉的水结合能力,XU等[12]在研究稻米萌发时发现,萌发增加了糙米淀粉的SP和SOL,LIU等[20]还发现萌发显著增加了绿豆淀粉的SP,这与本研究结果一致。萌发过程中淀粉粒出现孔洞(图1)使得水分更易进入淀粉颗粒,加热过程中结晶区域内氢键暴露,渗透到内部的水分子更容易与淀粉分子相互作用,这将导致SP的增加;萌发过程中产生的孔洞增加,直链淀粉更易溶出,导致SOL增加。此外,SOL越高,说明萌发使薏米淀粉具有更好的孔隙结构,水分子容易进入颗粒内部导致淀粉颗粒膨胀并释放可溶性物质[21]。
2.8 吸水性和吸油性分析
薏米萌发过程中淀粉粒的吸水能力和吸油能力均增加(表2)。萌发是一个酶促过程,酶解后淀粉粒具有多孔结构,内部中空,表面有小蜂窝孔,比表面积增加,粒径变小。淀粉粒的吸附力不仅仅依靠表面吸附,更多的是依靠多孔结构的强吸附能力来吸附目标物质,表面吸附与孔吸附相结合,被吸附的物质从颗粒表面的孔洞进入颗粒内部,与淀粉结合紧密,稳定性较高,不易脱离[22]。
2.9 热力学性质分析
DSC测试中,起始温度(To)、峰值温度(Tp)、结束温度(Tc)是淀粉颗粒双螺旋完善程度的指标,糊化焓(ΔH)反映了淀粉糊化时双螺旋结构被破坏时所需能量[23]。由表4可知,随着萌发时间的延长,薏米淀粉的To、Tp和Tc显著变化(P<0.05),但并非持续地升高或降低,本研究结果与XU等[9]的研究结果一致。糊化温度的变化可归因于颗粒形状和大小、直链淀粉含量、相对结晶度和支链淀粉链长的不同。ΔH受双螺旋结构分解的影响,薏米萌发前4 d,ΔH增大,可能是萌发过程中淀粉颗粒结构的破坏使得淀粉吸水性增加,淀粉粒中水分增加,氢键重新排布,双螺旋分子链之间的氢键数量增加,加热时需要更多的能量来破坏氢键[23],而萌发5 d后ΔH减小,这代表破坏双螺旋结构所需能量减少,可能是由于萌发过程中淀粉酶的持续水解使淀粉粒双螺旋结构被破坏[24]。
表4 萌发过程中薏米淀粉热力学性质
Table 4 Thermal characteristics of adlay starch during germination
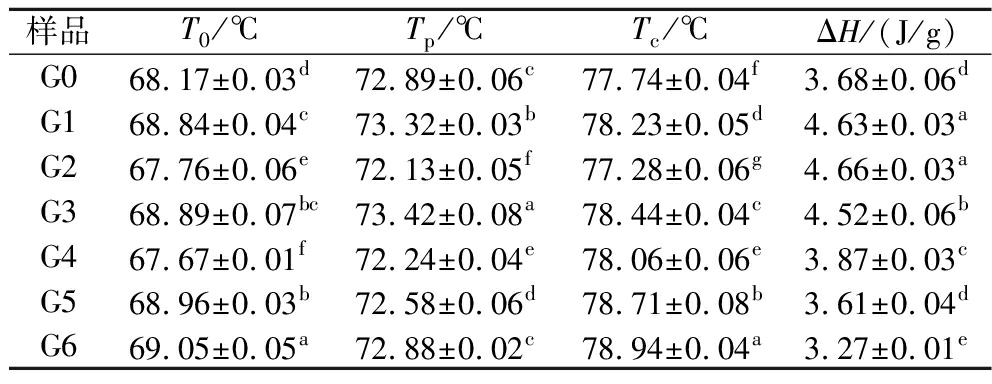
样品T0/℃Tp/℃Tc/℃ΔH/(J/g)G068.17±0.03d72.89±0.06c77.74±0.04f3.68±0.06dG168.84±0.04c73.32±0.03b78.23±0.05d4.63±0.03aG267.76±0.06e72.13±0.05f77.28±0.06g4.66±0.03aG368.89±0.07bc73.42±0.08a78.44±0.04c4.52±0.06bG467.67±0.01f72.24±0.04e78.06±0.06e3.87±0.03cG568.96±0.03b72.58±0.06d78.71±0.08b3.61±0.04dG669.05±0.05a72.88±0.02c78.94±0.04a3.27±0.01e
2.10 糊化特性分析
淀粉在过量水存在的情况下加热时,淀粉粒在特定温度范围内发生分子有序排列的瓦解(氢键断裂),称为糊化。糊化温度是淀粉黏度开始增加时的温度,糊化温度可以反映淀粉凝胶糊化的难易程度。萌发改变了薏米淀粉的糊化温度,不同萌发时间薏米淀粉的糊化温度不同。萌发使水稻、绿豆和藜麦淀粉糊化温度显著增加[19-20, 25],这与本研究不同,该差异可能与直链淀粉含量、淀粉颗粒大小和支链淀粉的精细结构有关。萌发后薏米淀粉的糊化曲线明显下降(图5),淀粉糊的峰值黏度、谷值黏度、最终黏度、崩解值降低(图5),这可能是萌发过程中淀粉酶活性增强,淀粉颗粒出现孔洞及碎片(图1),粒径减小(表1),形成疏松结构,淀粉分子之间的距离变大,使淀粉分子难以重新缠结,造成淀粉颗粒易崩解,黏度降低[26]。崩解值可以反映淀粉的热糊稳定性,崩解值越小,热糊稳定性越好,说明萌发可以改善淀粉的热糊稳定性。XING等[25]发现,随着萌发时间的延长,藜麦淀粉的峰值黏度降低,绿豆淀粉的峰值黏度随着发芽时间延长至72 h呈下降趋势[20],这与本研究结果一致。随着萌发的进行,回生值逐渐降低,可能是淀粉-水之间的氢键数量增加,而链内和链间的氢键数量减少,导致淀粉链之间相互作用力的减弱,回生值可以反映淀粉糊的回生能力和形成凝胶的能力,回生值越小说明淀粉越不易回生和形成凝胶[27]。
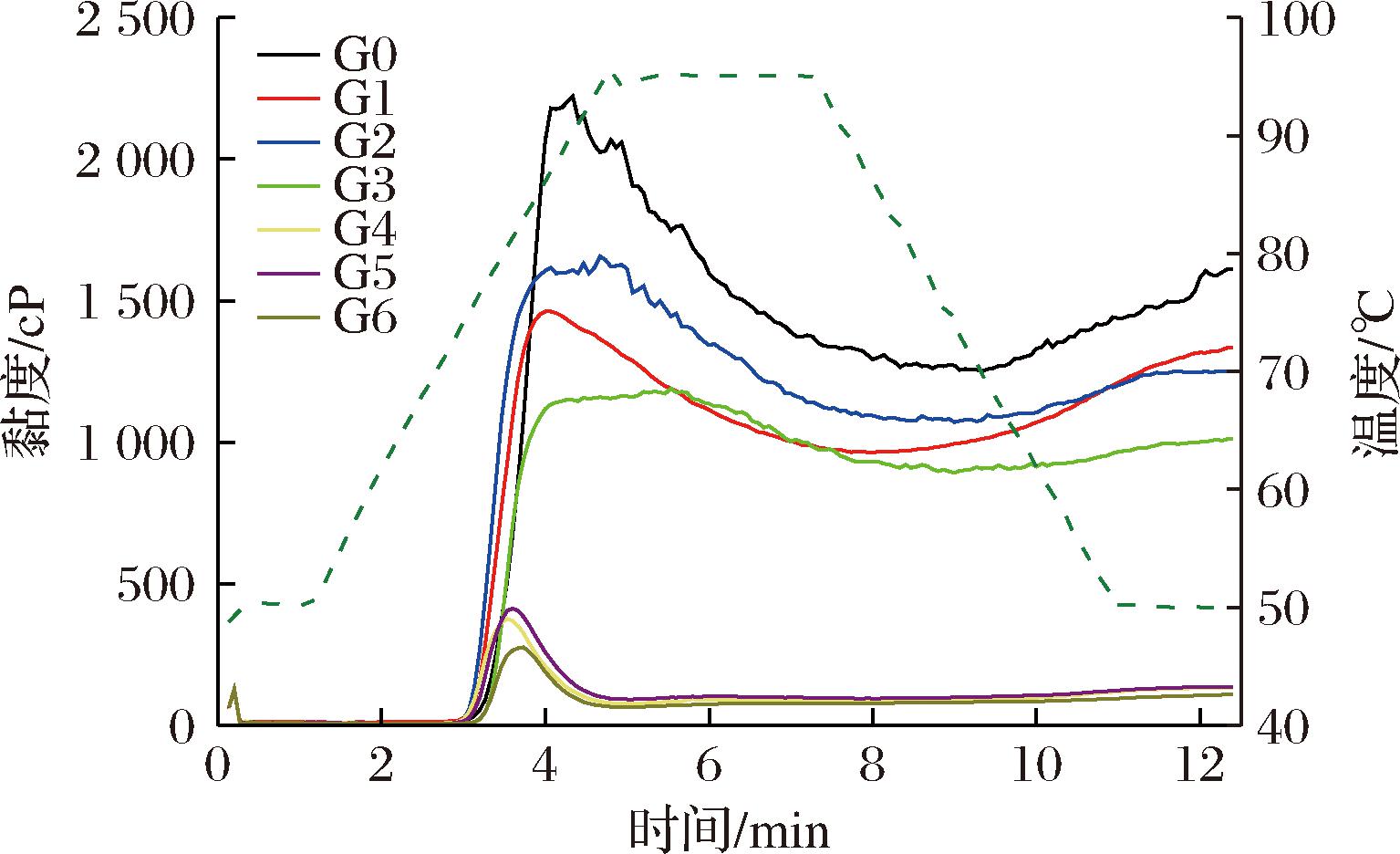
图5 萌发过程中薏米淀粉的RVA曲线
Fig.5 RVA gelatinization curves of adlay starch during germination
2.11 淀粉凝胶质构特性分析
糊化淀粉冷却后,形成凝胶网络。淀粉凝胶的质构特性包括硬度、黏附性、弹性、内聚性和胶黏性等。萌发薏米淀粉的凝胶的硬度显著下降(表5),这可能与萌发过程中直链淀粉含量降低有关。内聚性是淀粉凝胶根据其在第1次变形中的行为抵抗第2次变形的程度的量度[28]。萌发使薏米淀粉凝胶的内聚性降低,表明萌发薏米淀粉凝胶具有更高的可塑性和更强的抗质构损伤能力,这意味着它可以经历强烈的质地变化并且适合作为咀嚼食物材料[29]。弹性衡量淀粉凝胶恢复其原始位置的能力[28]。萌发0~3 d,淀粉凝胶弹性有所增加,萌发4~6 d,淀粉凝胶物性突变,不易成型,不具备弹性测试条件,其原因可能是从萌发第4天开始,淀粉粒结构破坏严重(图1)以及直链淀粉含量降低(表2)。胶着性可以表征将半固体食物咀嚼成吞咽时的稳定状态所需的能量[28]。萌发降低了薏米淀粉的胶着性,说明萌发后将薏米淀粉凝胶咀嚼成至能吞咽所需能量较少。黏附性在食品领域是指黏牙性口感[28]。萌发使薏米淀粉凝胶黏附性增加,萌发造成淀粉水解产生淀粉碎片可能是黏附性增加的原因。萌发处理对薏米淀粉凝胶质构特性有显著影响,可根据实际生产要求进行不同的萌发改性处理。
表5 萌发过程薏米淀粉的凝胶质构特性
Table 5 Textural parameters of adlay starch during germination
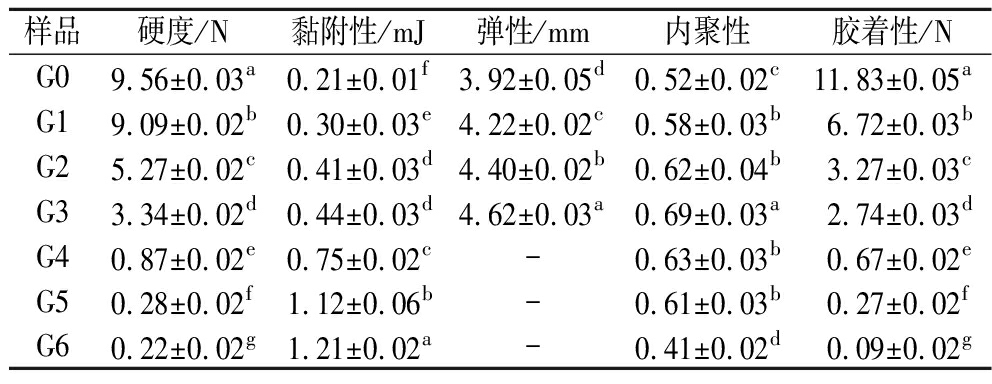
样品硬度/N黏附性/mJ弹性/mm内聚性胶着性/NG09.56±0.03a0.21±0.01f3.92±0.05d0.52±0.02c11.83±0.05aG19.09±0.02b0.30±0.03e4.22±0.02c0.58±0.03b6.72±0.03bG25.27±0.02c0.41±0.03d4.40±0.02b0.62±0.04b3.27±0.03cG33.34±0.02d0.44±0.03d4.62±0.03a0.69±0.03a2.74±0.03dG40.87±0.02e0.75±0.02c-0.63±0.03b0.67±0.02eG50.28±0.02f1.12±0.06b-0.61±0.03b0.27±0.02fG60.22±0.02g1.21±0.02a-0.41±0.02d0.09±0.02g
2.12 体外消化特性分析
萌发后,薏米淀粉RDS含量显著增加,而SDS和RS含量显著降低(表6)。CHUNG等[30]研究发现,萌发使水稻淀粉的RDS增加,SDS和RS降低,这与本研究结果一致。萌发导致淀粉颗粒产生孔洞(图1),这能促进消化酶对淀粉的水解作用[13];萌发过程中被淀粉酶水解的淀粉链变得更易于消化[30];此外,萌发处理后淀粉SP和SOL的增加(表2)也促进了消化酶对淀粉的水解作用,导致RDS升高,SDS和RS降低。
表6 萌发过程中薏米淀粉的体外消化特性
Table 6 In vitro digestion properties of adlay starch during germination
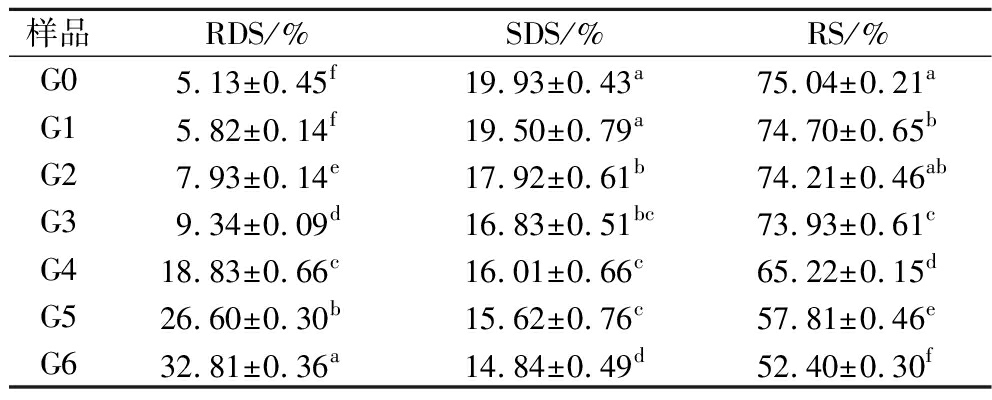
样品RDS/%SDS/%RS/%G05.13±0.45f19.93±0.43a75.04±0.21aG15.82±0.14f19.50±0.79a74.70±0.65bG27.93±0.14e17.92±0.61b74.21±0.46abG39.34±0.09d16.83±0.51bc73.93±0.61cG418.83±0.66c16.01±0.66c65.22±0.15dG526.60±0.30b15.62±0.76c57.81±0.46eG632.81±0.36a14.84±0.49d52.40±0.30f
3 结论
薏米萌发过程中,淀粉粒形态结构、晶体结构、分子结构发生变化,进而影响了淀粉的功能特性。萌发过程淀粉粒孔洞增多是导致吸水性、吸油性及消化率增加的因素。萌发后A链比例略有降低,直链淀粉含量先增加后减小,结晶度变化规律不明确,有序度先增加后减小,糊化焓先增加后减小。萌发处理降低了薏米淀粉糊的黏度以及淀粉凝胶的硬度、内聚性及胶着性,增加了薏米淀粉的应用潜力。本研究表明,萌发是一种有效的淀粉改性方式,具有改善薏米淀粉品质的潜力。
[1] LIM T K.Davidsonia pruriens[M].Dordrecht:Springer Netherlands, 2012:132-135.
[2] 金黎明, 刘垠孜, 赵晓蕾, 等.薏苡仁有效成分研究进展[J].安徽农业科学, 2011, 39(10):5734;5750.JIN L M, LIU Y Z, ZHAO X L, et al.Research progress on effective constituents in Coix seed[J].Journal of Anhui Agricultural Sciences, 2011, 39(10):5734;5750.
[3] CHEN J C, CHEN Y Z, GE H F, et al.Multi-scale structure, pasting and digestibility of adlay (Coixlachryma-jobi L.) seed starch[J].Food Hydrocolloids, 2019, 89:885-891.
[4] WUNTHUNYARAT W, SEO H S, WANG Y J.Effects of germination conditions on enzyme activities and starch hydrolysis of long-grain brown rice in relation to flour properties and bread qualities[J].Journal of Food Science, 2020, 85(2):349-357.
[5] GUTIÉRREZ-OSNAYA L J, HERN NDEZ-URIBE J P, CASTRO-ROSAS J, et al.Influence of germination time on the morphological, morphometric, structural, and physicochemical characteristics of Esmeralda and Perla barley starch[J].International Journal of Biological Macromolecules, 2020, 149:262-270.
NDEZ-URIBE J P, CASTRO-ROSAS J, et al.Influence of germination time on the morphological, morphometric, structural, and physicochemical characteristics of Esmeralda and Perla barley starch[J].International Journal of Biological Macromolecules, 2020, 149:262-270.
[6] LI C, OH S G, LEE D H, et al.Effect of germination on the structures and physicochemical properties of starches from brown rice, oat, Sorghum, and millet[J].International Journal of Biological Macromolecules, 2017, 105:931-939.
[7] BARANZELLI J, KRINGEL D H, MALLMANN J F, et al.Impact of wheat (Triticum aestivum L.) germination process on starch properties for application in films[J].Starch - Stärke, 2019, 71(7-8):1800262.
[8] OSEGUERA-TOLEDO M E, CONTRERAS-JIMÉNEZ B, HERN NDEZ-BECERRA E, et al.Physicochemical changes of starch during malting process of Sorghum grain[J].Journal of Cereal Science, 2020, 95:103069.
NDEZ-BECERRA E, et al.Physicochemical changes of starch during malting process of Sorghum grain[J].Journal of Cereal Science, 2020, 95:103069.
[9] XU L, CHEN L, ALI B, et al.Impact of germination on nutritional and physicochemical properties of adlay seed (Coixlachryma-jobi L.)[J].Food Chemistry, 2017, 229:312-318.
[10] NISHI A, NAKAMURA Y, TANAKA N, et al.Biochemical and genetic analysis of the effects of amylose-extender mutation in rice endosperm[J].Plant Physiology, 2001, 127(2):459-472.
[11] ENGLYST H N, KINGMAN S M, CUMMINGS J H.Classification and measurement of nutritionally important starch fractions[J].European Journal of Clinical Nutrition, 1992, 46(Suppl 2):S33-S50.
[12] XU J, ZHANG H, GUO X N, et al.The impact of germination on the characteristics of brown rice flour and starch[J].Journal of the Science of Food and Agriculture, 2012, 92(2):380-387.
[13] WU F F, CHEN H Y, YANG N, et al.Effect of germination time on physicochemical properties of brown rice flour and starch from different rice cultivars[J].Journal of Cereal Science, 2013, 58(2):263-271.
[14] MA X H, LIU Y, LIU J S, et al.Changes in starch structures and in vitro digestion characteristics during maize (Zea mays L.) germination[J].Food Science &Nutrition, 2020, 8(3):1700-1708.
[15] NOWAK E, KRZEMINSKA-FIEDOROWICZ L, KHACHATRYAN G, et al.Comparison of molecular structure and selected physicochemical properties of spelt wheat and common wheat starches[J].Journal of Food and Nutrition Research, 2014, 53(1):31-38.
[16] HIZUKURI S.Relationship between the distribution of the chain length of amylopectin and the crystalline structure of starch granules[J].Carbohydrate Research, 1985, 141(2):295-306.
[17] SHRESTHA A K, BLAZEK J, FLANAGAN B M, et al.Molecular, mesoscopic and microscopic structure evolution during amylase digestion of maize starch granules[J].Carbohydrate Polymers, 2012, 90(1):23-33.
[18] MA Z, MA M X, ZHOU D T, et al.The retrogradation characteristics of pullulanase debranched field pea starch:Effects of storage time and temperature[J].International Journal of Biological Macromolecules, 2019, 134:984-992.
[19] WANG H W, XIAO N Y, DING J T, et al.Effect of germination temperature on hierarchical structures of starch from brown rice and their relation to pasting properties[J].International Journal of Biological Macromolecules, 2020, 147:965-972.
[20] LIU Y, SU C Y, SALEH A S M, et al.Effect of germination duration on structural and physicochemical properties of mung bean starch[J].International Journal of Biological Macromolecules, 2020, 154:706-713.
[21] CHEN Y, DAI G F, GAO Q Y.Preparation and properties of granular cold-water-soluble porous starch[J].International Journal of Biological Macromolecules, 2020, 144:656-662.
[22] HAN X Y, WEN H L, LUO Y, et al.Effects of α-amylase and glucoamylase on the characterization and function of maize porous starches[J].Food Hydrocolloids, 2021, 116:106661.
[23] COOKE D, GIDLEY M J.Loss of crystalline and molecular order during starch gelatinisation:Origin of the enthalpic transition[J].Carbohydrate Research, 1992, 227:103-112.
[24] WANG H W, XIAO N Y, DING J T, et al.Effect of germination temperature on hierarchical structures of starch from brown rice and their relation to pasting properties[J].International Journal of Biological Macromolecules, 2020, 147:965-972.
[25] XING B, TENG C, SUN M H, et al.Effect of germination treatment on the structural and physicochemical properties of quinoa starch[J].Food Hydrocolloids, 2021, 115:106604.
[26] SWEEDMAN M C, TIZZOTTI M J, SCH FER C, et al.Structure and physicochemical properties of octenyl succinic anhydride modified starches:A review[J].Carbohydrate Polymers, 2013, 92(1):905-920.
FER C, et al.Structure and physicochemical properties of octenyl succinic anhydride modified starches:A review[J].Carbohydrate Polymers, 2013, 92(1):905-920.
[27] COPELAND L, BLAZEK J, SALMAN H, et al.Form and functionality of starch[J].Food Hydrocolloids, 2009, 23(6):1527-1534.
[28] 韩晓翠. 麻糬凝胶质构特性与老化特性的影响因素研究[D].郑州:河南工业大学, 2023.HAN X C.Study on the influence factors of texture and aging characteristics of mochi gel[D].Zhengzhou:Henan University of Technology, 2023.
[29] ROOPA B S, BHATTACHARYA S.Mango gels:Characterization by small-deformation stress relaxation method[J].Journal of Food Engineering, 2014, 131:38-43.
[30] CHUNG H J, CHO D W, PARK J D, et al.In vitro starch digestibility and pasting properties of germinated brown rice after hydrothermal treatments[J].Journal of Cereal Science, 2012, 56(2):451-456.