植物多糖由于其抗氧化、抗肿瘤、抗炎和益生元活性,成为近年来研究的热点[1]。研究人员从不同植物中提取到具有益生活性的多糖,这些多糖大多含有半乳糖、阿拉伯糖、葡萄糖、鼠李糖和半乳糖醛酸等,少部分含有木糖和果糖[2-3]。一般来说植物多糖不能被直接消化,但可作为益生元被肠道菌群分解利用,生成具有生物活性的产物,这些产物可降低肠道内的pH值,抑制肠道内有害菌的生长[4]。此外,研究人员发现多糖的抗氧化活性与分子量、单糖组成、糖链构象等多种因素显著性相关[1]。由于多糖形态众多,其生物活性机制复杂,因此多糖的生物活性与结构特征之间的构效关系成为研究的热点。
黄皮[Clausena lansium (Lour.) Skeels]是芸香科热带、亚热带常绿果树,主要分布在亚洲、非洲和大洋洲[5]。黄皮原产于中国,已有上千年的栽培历史,我国南方地区栽培广泛,尤其是海南、广东、广西、福建等地。研究证明黄皮具有抗氧化、降糖降脂、抗肿瘤的作用[6],其根、茎、叶和种子已被广泛应用于中药和民间医药中。黄皮因其独特的风味和富含生物活性物质,受到了消费者好评,但是黄皮成熟于湿热季节,采后极易腐烂变质,严重限制了黄皮产业的发展,目前黄皮以鲜食为主,加工比例低。此外,在黄皮生长过程中,受气温、雨水等环境因素的影响,容易产生大量的裂果,造成资源浪费。
黄皮含有维生素、多糖、有机酸、咔唑生物碱和类黄酮等营养成分,其中黄皮中的多糖已被证明具有多种生物活性,不同黄皮部位多糖含量也不尽相同,其中果皮中多糖含量略高于果肉[7-8]。目前,有关黄皮多糖的研究主要集中在整果或果皮中,如SONG等[1]从带籽的黄皮果实中提取纯化得到具有肠道微生物调节和吞噬增强活性的同型半乳糖醛酸型果胶多糖;PENG等[7]用不同有机酸从黄皮果皮中提取出具有抗氧化和益生活性的果胶多糖。近年来,黄皮果肉、籽中多糖的研究也有少量报道,如WU等[8]从贵妃黄皮果肉中分离出酸性多糖,发现其具有开发成改善血栓形成的功能食品的潜在价值;WU等[9]从黄皮籽中分离出具有抗氧化活性的酸性多糖。黄皮品种不同,但多糖结构不相同;不同提取方法对多糖的结构及活性也有影响。目前,不同提取方法对无核黄皮果肉多糖的结构及活性影响尚未见报道。
本研究以极具地方特色的无核黄皮为原料,采用热水、热酸和热碱法从黄皮裂果的果肉中分离得到3种多糖,分析多糖的结构特征,并评价其抗氧化活性和益生活性。研究结果不仅可以将资源利用合理化,延长黄皮的产业链,也为黄皮精深加工及黄皮多糖在功能食品和食品配料中的应用提供科学依据。
1 材料与方法
1.1 材料与仪器
无核黄皮,采摘于广东省云浮市郁南县富赢田田圈生态农业有限公司无核黄皮基地;三氟乙酸(色谱纯)、甲醇(分析纯),上海安谱实验科技股份有限公司;1,1-二苯基苦基苯肼(DPPH)、2,2′-联氮基双(3-乙基苯并噻唑啉-6-磺酸)二铵盐(ABTS)(分析纯),天津市科密欧化学试剂有限公司;单糖标准品:鼠李糖、阿拉伯糖、木糖、葡萄糖、半乳糖(色谱纯),上海源叶生物科技有限公司。
JW-1042离心机,安徽嘉文仪器装备有限公司;EVO18扫描电子显微镜(scanning electron microscope,SEM),德国蔡司光学仪器设备有限公司;D8 Advance X射线衍射(X-ray diffraction,XRD)仪、Vertex 33傅里叶红外光谱(Fourier transform infrared spectroscopy,FTIR)仪,德国布鲁克科技有限公司;ICS 5000+离子色谱,美国赛默飞世尔科技公司。
1.2 实验方法
1.2.1 黄皮多糖的提取
黄皮预处理:选取带裂痕的黄皮,清洗、晾干、手动去皮去核,果肉置于60 ℃热泵干燥至水分含量低于5%,粉碎后过40目筛,4 ℃贮藏备用。黄皮多糖提取预处理参照PENG等[7]的方法,稍作修改。称取50 g黄皮果粉,以1∶10料液比加入体积分数为95%乙醇溶液,磁力搅拌分散10 min,抽滤后取滤渣重复上述步骤两次;再以1∶10的料液比向滤渣加入丙酮溶液,磁力搅拌分散10 min,重复洗涤3次,抽滤后滤渣置于40 ℃烘箱干燥至恒重,得到醇不溶物质。
热水提取:参考吕夏清[10]的方法,稍作修改。取20 g上述醇不溶物,按1∶30的料液比加入超纯水,混合物90 ℃水浴震荡1.5 h,处理液放至室温后5 000 r/min离心15 min取上清液,向上清液中加入3倍体积的无水乙醇,4 ℃孵化过夜。孵化结束后5 000 r/min离心15 min,收集多糖沉淀,用300 mL超纯水溶解粗多糖,置于40 ℃旋转蒸发去除无水乙醇,然后用超纯水透析(透析袋截留分子质量3 500 Da)48 h,每6 h换水1次,最后用冷冻干燥机干燥,所得热水提取多糖WPP-W。
热酸提取:取20 g上述醇不溶物,按1∶30的料液比加入pH值为2.0的柠檬酸溶液,其余步骤与热水提取一致,所得热酸提取多糖WPP-A。
热碱提取:取20 g上述醇不溶物,按1∶30的料液比加入pH值为9.0的NaOH溶液,其余步骤与热水提取一致,所得热碱提取多糖WPP-AL。
1.2.2 多糖得率
多糖得率![]()
(1)
1.2.3 多糖结构表征
1.2.3.1 分子质量分布
参考CHEN等[11]方法,稍作修改。称取5 mg多糖溶于5 mL NaNO3溶液(含质量分数为0.02%的NaN3,下同),过0.45 μm滤膜,备用。色谱条件参数:色谱柱Ohpak SB-805 HQ(300 mm×8 mm)和Ohpak SB-803 HQ(300 mm×8 mm),柱温45 ℃,流动相含0.02% NaN3的0.1 mol/L NaNO3,进样量100 μL,流速0.6 mL/min,等度洗脱75 min,示差检测器。
1.2.3.2 单糖组成
参考ZHU等[12]的方法,稍作修改。色谱条件参数:色谱柱DionexTM CarboPacTM PA20(150 mm×3.0 mm,10 μm),进样量5 μL。流动相A(H2O),流动相B(0.1 mol/L NaOH),流动相C(0.1 mol/L NaOH,0.2 mol/L NaAc),流速0.5 mL/min,柱温30 ℃,洗脱梯度:0~42 min,95%~85%A,5%~5%B,0~10%C;42~42.1 min,85%~60%A, 5%~0 B,10%~40%C;42.1~52 min,60%~60%A,0~40%B,40%~0 C;52~60 min,60%~95%A,40%~5%B, 0~0 C。
1.2.3.3 FTIR分析
采用FTIR仪对 WPP-W、WPP-A和WPP-AL 3个样品进行表征,分析其特征化学键和官能团的信息。测试前,称取1 mg样品与100 mg干燥的KBr粉末充分混合后压片,在4 000~400 cm-1波数下进行扫描。
1.2.3.4 XRD分析
采用XRD法测定3种黄皮多糖的结晶性能,设置样品的衍射角(2θ)范围为5°~60°,电压40 kV,电流 30 mA,采用分次扫描模式。
1.2.3.5 SEM分析
采用SEM观察黄皮多糖微观结构,小心夹取冻干后的样品用双面导电胶固定在样品台上,喷金处理后置于SEM观察台上进行微观结构观察。放大500倍,电压5 kV。
1.2.4 热重(thermogravimetric,TG)分析
通过TG分析来测定多糖的热性能。称取10 mg 样品置于铂盘中,载气N2,气体流量40 mL/min,以 10 ℃/min 的速率从室温加热至 600 ℃,测定样品TG和热重微分(thermogravimetric differential,DTG)曲线。
1.2.5 多糖粒径、聚合物分散性指数(polymer dispersity index,PDI)和电位测定
将3种黄皮多糖分别溶于超纯水中,配成3 mg/mL的多糖溶液,测试前用超纯水稀释50倍,用马尔文纳米粒度电位仪进行测定。
1.2.6 多糖持水力(water holding capacity,WHC)和持油力(oil holding capacity,OHC)测定
将1 g样品与10 mL蒸馏水混合,室温放置12 h,4 000 r/min离心10 min除去上清液,称取沉淀的重量。
将1 g样品与10 mL大豆油混合,室温放置12 h,4 000 r/min离心10 min除去上清液,称取沉淀的重量。计算如公式(2)所示:
持水力/持油力![]()
(2)
式中:m1,冻干样品的质量,g;m2,处理后沉淀的质量,g。
1.2.7 多糖乳化性能
参考PENG等[7]的方法,稍作修改。测定多糖的乳化活性指数(emulsifying activity index,EAI)和乳化稳定性指数(emulsifying stability index,ESI)。取8 mL多糖乳液(0.1%,质量分数)和2 mL大豆油置于离心管中,通过高速剪切机在20 000 r/min下均质3 min形成乳液。在第0和第10 min时取底层50 μL乳液加入5 mL十二烷基硫酸钠溶液(0.1%,质量分数)中,涡旋振荡30 s,测定500 nm波长下的吸光度。EAI和ESI计算如公式(3)和(4)所示:
(3)
(4)
式中:φ,乳液中油相分数;c,10 000 g/m3;D,稀释因子100倍;L,比色皿光程0.01 m;A0,第0 min的吸光度;A10,第10 min的吸光度。
1.2.8 多糖抗氧化活性
1.2.8.1 DPPH自由基清除能力
参考常相娜等[13]的方法,稍作改动。取稀释后的多糖溶液(0~10 mg/mL)50 μL,加入150 μL DPPH溶液(0.2 mmol/L),混匀后室温避光反应20 min,用酶标板测定波长517 nm处的吸光度,实验同时设计试剂空白组(无水乙醇)、对照组(等体积甲醇代替样品)、样品空白组(等体积无水乙醇代替DPPH溶液),每个处理重复3次实验。DPPH自由基清除率计算如公式(5)所示:
DPPH自由基清除率![]()
(5)
式中:A1,对照组吸光度;A0,试剂空白组吸光度;Ai,样品组吸光度;Aj,样品空白组吸光度。
1.2.8.2 ABTS阳离子自由基清除率测定
参考ZHAO等[14]的方法,稍作修改。取稀释后的多糖溶液(0~10 mg/mL)10 μL,加入200 μL ABTS溶液,混匀后室温避光反应6 min,用酶标板测定波长734 nm处的吸光度,实验同时设计试剂空白组(无水乙醇)、对照组(等体积甲醇代替样品)、样品空白组(等体积无水乙醇代替ABTS溶液),每个处理重复3次。ABTS阳离子自由基清除率计算如公式(6)所示:
ABTS阳离子自由基清除率![]()
(6)
式中:A1,对照组吸光度;A0,试剂空白组吸光度;Ai,样品组吸光度;Aj,样品空白组吸光度。
1.2.9 多糖益生活性
参考王秀丽等[15]的方法测定多糖的益生活性。培养基配制:无碳源MRS基础培养基作阴性对照;将质量分数为1%的多糖样品加到无碳源 MRS培养基中作为样品组;将质量分数为1%的菊粉作阳性对照组1,将质量分数为1%的葡萄糖作阳性对照组2。
菌种活化:本实验使用了植物乳杆菌、发酵乳杆菌、肠膜明串珠菌和鼠李糖乳杆菌4种益生菌。将1 mL益生菌分别接种到10 mL MRS培养基中,37 ℃下培养 12 h,再将MRS培养基中的益生菌接种到新的MRS培养基中培养12 h进行二次活化。
生长曲线测定:按5%的接菌量将菌液接入相应的培养基中并置于生长曲线分析仪中37 ℃低速摇晃培养48 h,每间隔2 h测定培养液的OD600nm。以培养时间为横坐标,以OD600nm为纵坐标测定益生菌的生长状况,绘制益生菌的生长曲线。
1.3 数据处理
每个试验进行3次测定,结果以“平均值±标准差”表示。采用SPSS 26.0 进行显著性分析,样品间的显著性差异检验用Waller-Duncan法。使用Excel 2021和Origin 2022进行数据统计分析和绘图。
2 结果与分析
2.1 多糖的得率
由图1可知,不同提取方法所得多糖得率存在显著性差异(P<0.05),WPP-A的提取率(13.2%±0.27% DW)远高于WPP-W(9.7%±0.40% DW)和WPP-AL(8.4%±0.22% DW)。HUANG等[16]研究认为酸提法有利于细胞膨胀并破坏细胞壁结构,使更多多糖从中释放,具有提取率高、纯度高的优点,与本文研究结果一致。赵晨淏等[17]利用水提法、酶提法、碱提法、酸提法、超声波法5种方法来提取龙眼多糖,发现5种方法中酶法提取率最高,碱法提取率最低,表明碱提取可能不利于多糖释放,提取率相对较低。
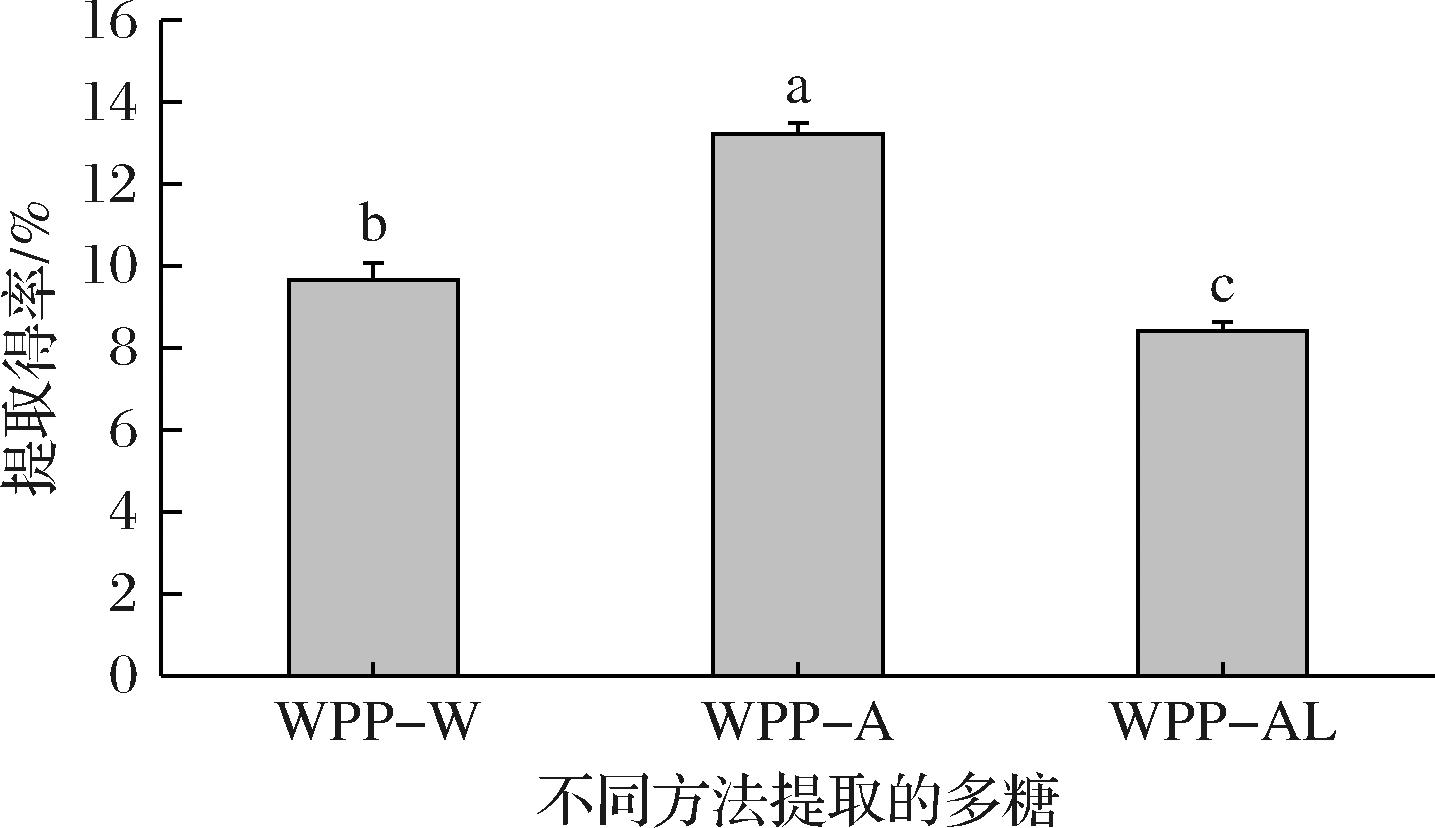
图1 不同方法提取黄皮多糖得率比较
Fig.1 The yields of WPPs extracted by different methods
注:不同小写字母表示差异显著(P<0.05)(下同)。
2.2 多糖结构表征
2.2.1 分子量分析
多糖的重均分子量(Mw)、数均分子量(Mn)和多分散指数(Mw/Mn)结果如表1所示,Mw值的差异与糖组成,糖苷键及支链的连接方式相关[18],热酸和热碱处理可能会破坏多糖分子结构使多糖发生降解,因此WPP-A和WPP-AL的分子质量比WPP-W低。此外,Mw/Mn用于衡量分子质量分布的宽度,指数越小,多糖的均一性越好。结果表明,WPP-W和WPP-A的多分散指数小于WPP-AL,说明它们具有更好的均匀性。
表1 WPPs的分子质量
Table 1 Molecular weight of WPPs
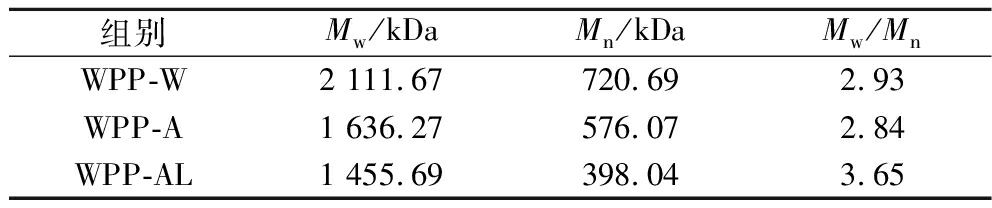
组别Mw/kDaMn/kDaMw/MnWPP-W2 111.67720.692.93WPP-A1 636.27576.072.84WPP-AL1 455.69398.043.65
2.2.2 单糖组成分析
在本研究中,采用离子色谱系统对单糖组分进行检测分析。由图2可知,3种WPP均由不同摩尔比的7种单糖组成,分别是鼠李糖(Rha)、阿拉伯糖(Arb)、半乳糖(Gal)、葡萄糖(Glc)、木糖(Xyl)、半乳糖醛酸(Gal-UA)和葡萄糖醛酸(Glc-UA),其中阿拉伯糖、半乳糖和半乳糖醛酸占87%~92%。WU等[8]在贵妃黄皮果肉中检测出鼠李糖、阿拉伯糖、半乳糖和半乳糖醛酸4种单糖,其中阿拉伯糖、半乳糖和半乳糖醛酸是摩尔占比相对较高的单糖;SONG等[1]研究发现,黄皮果实果胶多糖的单糖有5种,分别是甘露糖、鼠李糖、阿拉伯糖、半乳糖和半乳糖醛酸,其中阿拉伯糖、半乳糖和半乳糖醛酸含量最高,本研究结果与以上研究结果一致,阿拉伯糖、半乳糖和半乳糖醛酸是黄皮多糖中主要的单糖。不同的提取方法和黄皮品种对主要单糖的种类影响不大,但提取方法的差异会显著影响单糖的比例和多糖的生物活性。
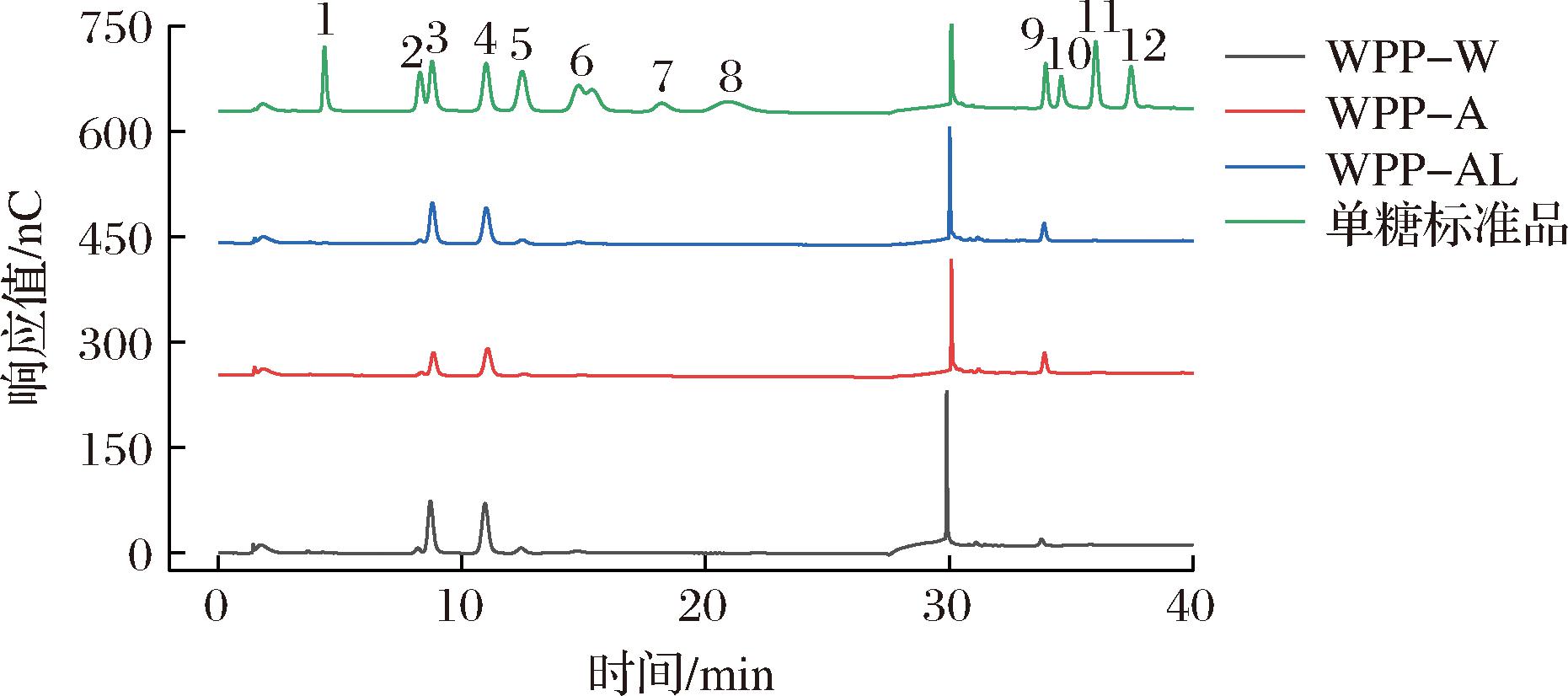
图2 标准品及样品离子色谱图
Fig.2 Standard and sample ion chromatograms
注:1为岩藻糖;2为鼠李糖;3为阿拉伯糖;4为半乳糖;5为葡萄糖;6为木糖;7为果糖;8为核糖;9为半乳糖醛酸;10为古罗糖醛酸;11为葡萄糖醛酸;12为甘露糖醛酸。
2.2.3 FTIR分析
在图3中,3 400 cm-1附近的强吸收峰是O—H伸缩振动吸收峰;2 900~2 800 cm-1处的弱带是C—H拉伸振动,包括CH、CH2和CH3的伸缩振动和弯曲振动,表明WPP具有典型的多糖化合物结构[19];1 700~1 600 cm-1范围内的吸收峰与C![]() O有关,表明样品中存在糖醛酸,与单糖组成研究结果一致。1 527 cm-1吸收峰与游离羧基(—COO-)的羰基(C
O有关,表明样品中存在糖醛酸,与单糖组成研究结果一致。1 527 cm-1吸收峰与游离羧基(—COO-)的羰基(C![]() O)伸缩振动密切相关[20]。此外,1 107 cm-1处的吸收峰是吡喃糖环醚键(C—O—C)的吸收峰,912 cm-1是β-D吡喃糖环的特征吸收峰[21]。红外光谱分析结果表明,WPP是一种结构上含有β-D糖苷键的吡喃环多糖,不同提取方法不影响黄皮多糖的一级结构和糖环类型。
O)伸缩振动密切相关[20]。此外,1 107 cm-1处的吸收峰是吡喃糖环醚键(C—O—C)的吸收峰,912 cm-1是β-D吡喃糖环的特征吸收峰[21]。红外光谱分析结果表明,WPP是一种结构上含有β-D糖苷键的吡喃环多糖,不同提取方法不影响黄皮多糖的一级结构和糖环类型。
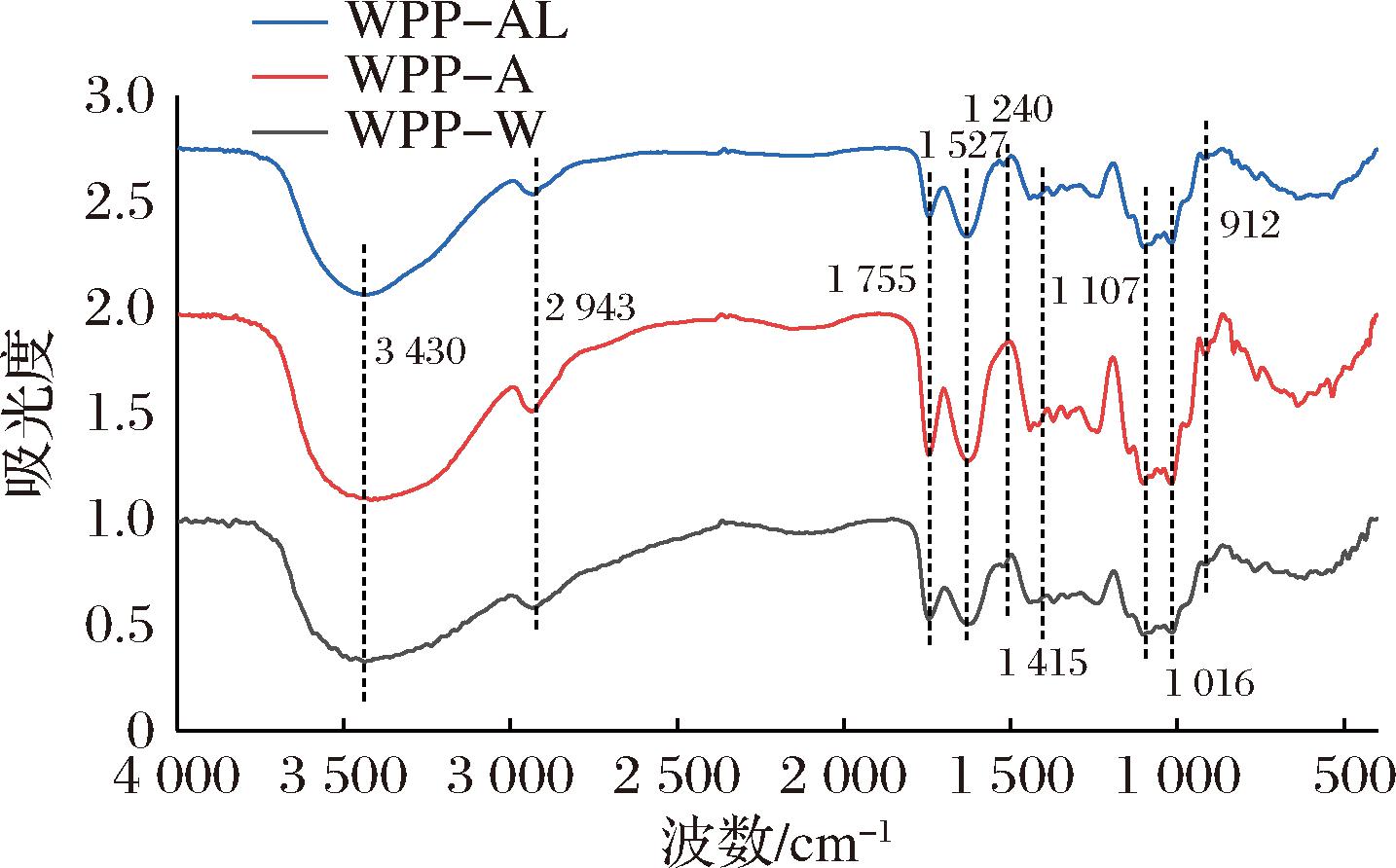
图3 WPPs的红外光谱
Fig.3 Fourier transform infrared spectrum of WPPs
2.2.4 XRD分析
通过XRD可以检测多糖的结晶类型和结晶指数,从谱图上看晶体状态表现为尖锐的窄衍射峰,非晶体状态表现为宽峰[22]。由图4可知3个WPP样品仅在12 °(2θ)和20 °(2θ)附近有宽的衍射峰,且不同处理的样品特征峰强度存在差异,WPP-A峰的衍射强度高于其他样品,表明WPP-A的结晶度最高[7],中性和碱性环境会削弱分子间氢键作用力,多糖的定形结构被破坏,导致结晶度降低。XRD结果表明,3种多糖均为非晶体结构,不同提取方法不会改变多糖的无定形状态。
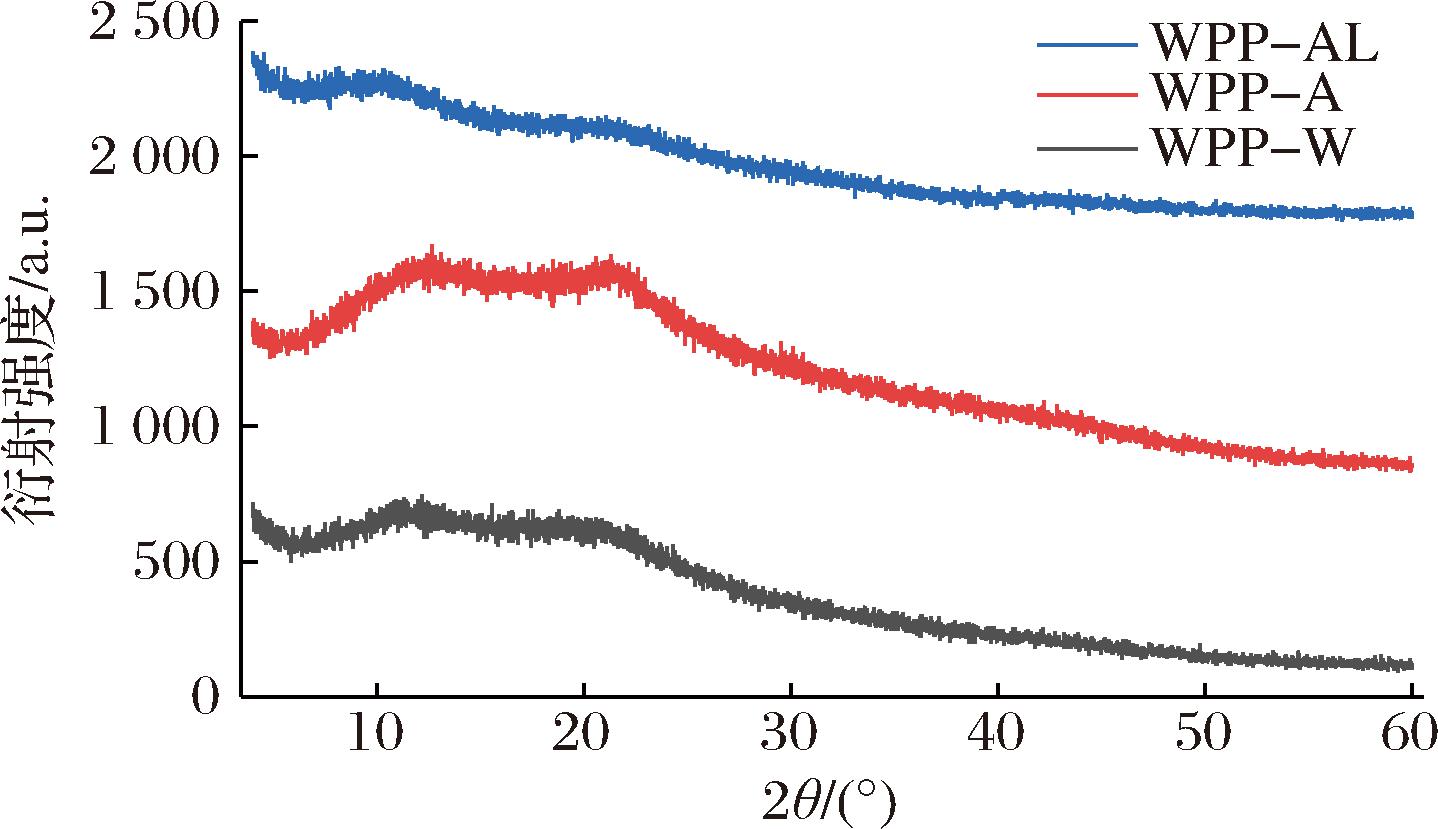
图4 WPPs的XRD图
Fig.4 X-ray diffraction pattern of WPPs
2.2.5 SEM分析
SEM是检测多糖微观形态特征的重要方法,WPP-W、WPP-A、WPP-AL的SEM结果如图5所示,在500倍率下可以观察到3种多糖有较大的差异,WPP-W呈现的是不规则的、平滑致密的薄膜状,这可能是由于WPP-W多糖含量高,多糖内分子交联程度高,结构紧密;WPP-A呈现的是树枝状和不规则粗糙的片状交织结构;WPP-AL呈现的是疏松的线网状和光滑薄膜状交织结构,同时含有少量不同形状的小颗粒,吕夏清[10]在热碱提取的黑木耳多糖中也发现了类似结构。SUN等[23]通过水、酸和碱提取海带多糖发现水提取的多糖表面均匀、光滑,整体呈现大片状,而酸、碱提取的多糖表面粗糙,带有不同大小的颗粒。

a-WPP-W;b-WPP-A;c-WPP-AL
图5 WPPs SEM图(500倍)
Fig.5 Scanning electron microscope graph of WPPs(500×)
2.3 TG分析
根据TG曲线图6-a,可知3种多糖的TG曲线基本一致,尤其是 WPP-A 和 WPP-AL二者的曲线几乎重合,说明不同的提取方法对黄皮多糖的 TG 曲线无显著影响。黄皮多糖的质量损失可以大致归纳为3个阶段:第一阶段是常温升温至100 ℃的过程,3种多糖的质量损失率约为13%,WPP-A和WPP-AL质量损失>WPP-W,说明WPP-A和WPP-AL残留的结合水更高[24];第二个阶段为105~400 ℃,在这个阶段3种多糖质量损失明显,质量损失率约为60%,与多糖的热分解反应相关,大量半乳糖醛酸链降解,糖苷键被打断,羧酸基团发生脱羧反应,生成气态和固态焦化物[10];第三个阶段为400~600 ℃,该阶段多糖分解速度逐步平稳,质量损失率最小,大约为6%。DTG曲线图6-b反映的是样品重量相对于温度的损失率,3种多糖的DTG曲线几乎相同,且均有较大单尖峰,说明多糖纯度较高,最大热分解速率的温度范围为246.4~251.6 ℃。以上结果表明黄皮多糖热稳定性较好,可添加到各类食品体系中。
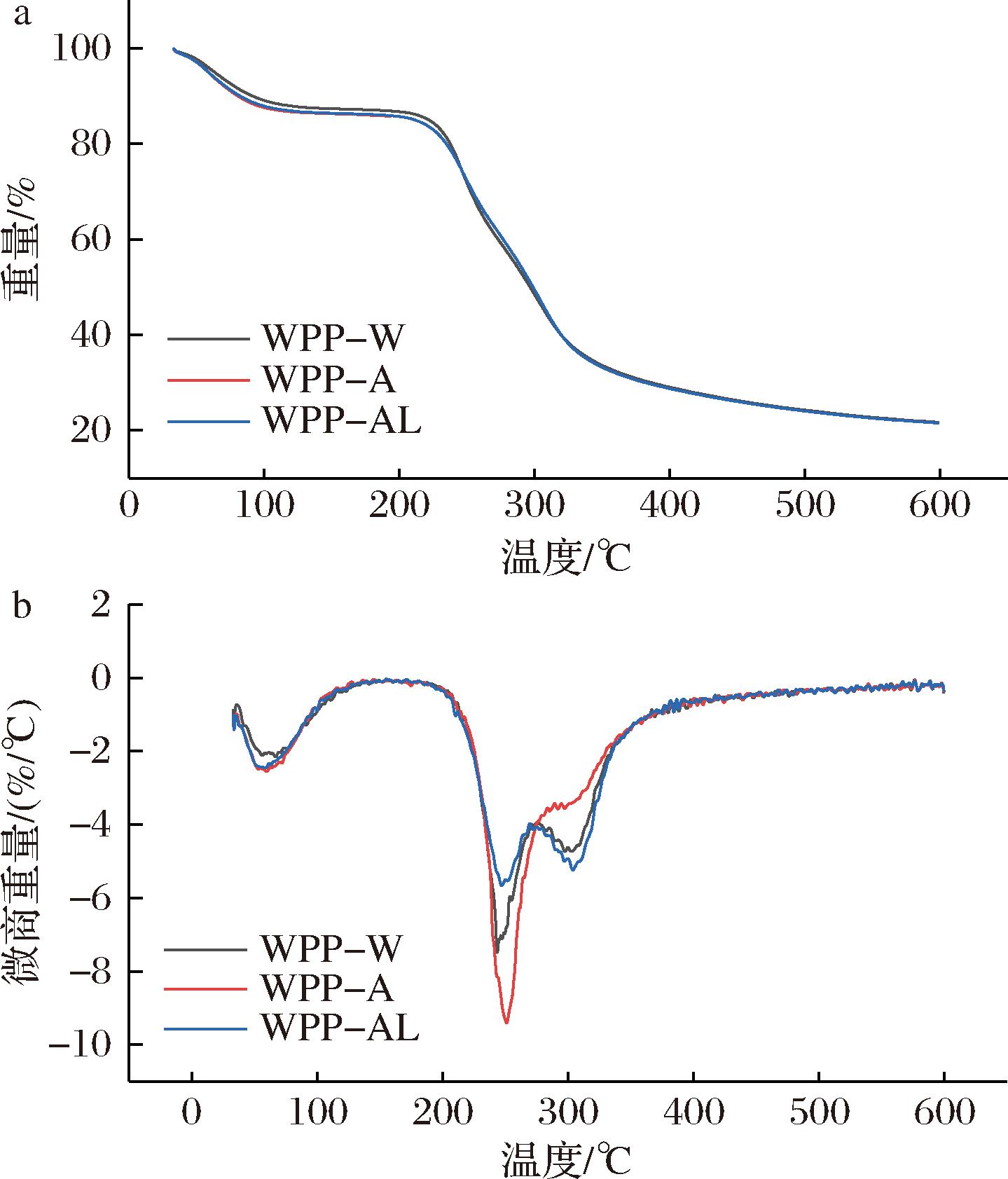
a-TG;b-DTG
图6 WPPs的TG分析
Fig.6 Thermogravimetric analysis of WPPs
2.4 粒径、分散系数、zeta电位分析
多糖的生物利用度与其粒径大小密切相关[25],3种多糖粒径的测定结果如表2所示。PDI是衡量颗粒尺寸分布均匀程度的重要指标,可用于表征多糖分子量的分布情况,PDI值越小,多糖分子质量分布越均匀。WPP-W和WPP-A的PDI值
表2 WPPs的粒径、电位与PDI
Table 2 Particle size, zeta potential and PDI of WPPs

组别平均粒径/nmPDI平均zeta电位/mVWPP-W793.90±24.5ab0.57±0.01c-33.56±1.30bWPP-A874.33±19.8a0.65±0.03b-29.73±0.90aWPP-AL766.07±79.8b0.75±0.03a-31.33±1.25ab
注:同一列不同字母代表显著性差异(P<0.05)(下同)。
表3 WPPs的持水性和持油性
Table 3 Water-and oil-holding capacities of WPPs
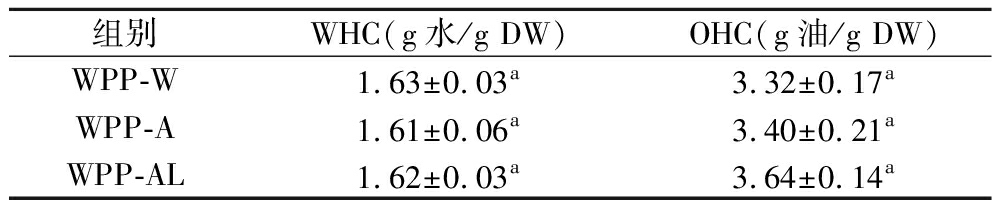
组别WHC(g水/g DW)OHC(g油/g DW)WPP-W1.63±0.03a3.32±0.17aWPP-A1.61±0.06a3.40±0.21aWPP-AL1.62±0.03a3.64±0.14a
2.5 WHC、OHC分析
WHC和OHC是表征多糖工艺特性和功能特性的重要指标。如表3所示,不同提取方法所得多糖的WHC和OHC无显著性差异(P>0.05),SILA等[27]认为WHC和OHC与官能团组成密切相关,由红外结果可知,3种多糖官能团基本一致,研究还发现果渣和谷物的WHC在1.6~2.7范围内,高WHC多糖可作为质地改良剂,用于改变食品的黏度、硬度等,此外,高WHC多糖还能作为功能成分用于食品中,增加粪便量和促进排便,并减少脂肪的吸收。本研究中WPP的OHC在3.32~3.64,高于其他研究中报道橙子、桃子和芒果的OHC,更适合作为稳定剂,用于稳定高脂肪食物和乳液。
2.6 乳化性能分析
EAI和ESI一般用于表征样品的乳化能力和乳化稳定性。WPP的EAI和ESI值如图7所示,WPP-W的EAI和ESI显著高于其他两种多糖,WPP-A的ESI值显著低于WPP-W和WPP-AL,研究还发现ESI和EAI的值不呈现一一对应趋势。WANG等[20]认为小分子质量和高甲氧基的样品有利于界面吸附和表面张力下降,从而获得高EAI值,与本研究WPP-W分子质量最大,EAI值最高的结果相反;而PENG等[7]发现不同有机酸提取的黄皮果胶,分子质量不同,但EAI和ESI无显著性差异,认为EAI与蛋白和乙酰基程度相关,ESI与侧链空间结构相关。因此,多糖的EAI值与分子质量的关系,还需要进一步深入研究。
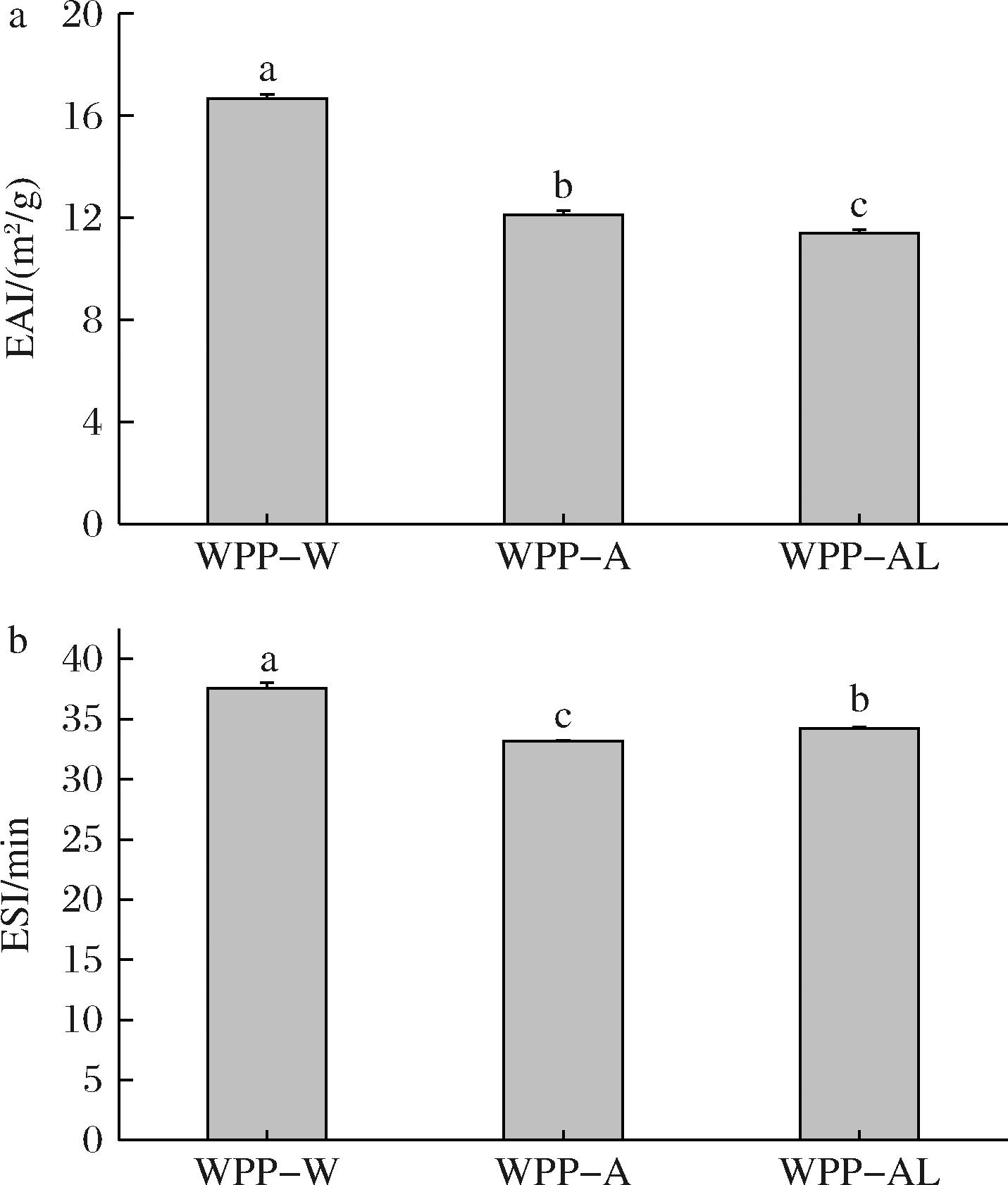
a-EAI;b-ESI
图7 WPPs的乳化稳定性
Fig.7 Emulsifying activity of WPPs
2.7 抗氧化活性分析
WPP清除DPPH自由基能力结果如图8-a所示,3种多糖的DPPH自由基清除率都明显低于阳性对照,且清除率在质量浓度为0~8 mg/mL时平稳增长,8~10 mg/mL时增加缓慢,趋于稳定。WPP的DPPH自由基清除率呈浓度依赖性增加,且相同质量浓度下,WPP-A的DPPH自由基清除率显著高于WPP-W和WPP-AL(P<0.05)。

a-DPPH自由基清除率;b-ABTS阳离子自由基清除率
图8 WPPs的体外抗氧化活性
Fig.8 Antioxidant activities of WPPs in vitro
注:相同质量浓度字母不同表示差异显著(P<0.05)。
WPP清除ABTS阳离子自由基能力结果如图8-b所示,3种多糖的ABTS阳离子自由基清除率趋势与DPPH自由基清除率趋势一致,质量浓度4~6 mg/mL时增长迅速,当质量浓度>6 mg/mL时增长逐步平缓。以往的研究认为低分子质量的多糖具有更强的抗氧化活性[28],但本研究中发现分子质量最低的WPP-AL抗氧化活性并非最强。
研究表明,多糖的抗氧化活性不是受单一因素影响,而是与单糖组成、分子质量、糖苷键类型和链构象等因素相关[22]。根据清除DPPH自由基能力和清除ABTS阳离子自由基能力结果可知,分子质量、PDI和单糖组成共同作用影响WPP的抗氧化活性。研究认为单糖中的鼠李糖、阿拉伯糖、葡萄糖和半乳糖与抗氧化活性相关。本研究中WPP-W分子质量最大,PDI最小,鼠李糖、阿拉伯糖、葡萄糖和半乳糖的摩尔比最高(85.17 mol%),显著高于WPP-A的71.0 mol%和WPP-AL的73.77 mol%(P<0.05),抗氧化能力最差;WPP-A分子质量
2.8 益生活性分析
益生菌可利用大分子碳水化合物代谢产生短链脂肪酸,这些产物可以降低肠道内的pH值,抑制肠道内有害菌的生长[29]。近年来,多糖的益生活性备受关注,具有益生活性的多糖大多含有半乳糖、阿拉伯糖、葡萄糖、鼠李糖、半乳糖醛酸和甘露糖,少量含有木糖和果糖[4]。本实验以菊粉和葡萄糖作为阳性对照,无碳源培养基为阴性对照,探究不同提取方法对多糖益生活性的影响,结果如图9所示。不管是何种提取方法所得的多糖对益生菌的促增殖作用均优于无碳源的空白组,其中对发酵乳杆菌、肠膜明串珠菌、鼠李糖乳杆菌促增殖效果最好的是WPP-AL,对植物乳杆菌促增殖效果最好的是WPP-A。

a-植物乳杆菌;b-发酵乳杆菌;c-肠膜明串珠菌;d-鼠李糖乳杆菌
图9 四种菌的生长曲线
Fig.9 Growth curves of the four species
3 结论
在本研究中,采用了3种方法(热水提取法、热酸提取法、热碱提取法)制备黄皮多糖,研究其得率、分子质量、单糖组成、乳化特性、抗氧化活性及益生活性。结果表明,热酸提取法制备的黄皮多糖WPP-A得率最高(13.2%),分子质量测定结果表明3种多糖的平均分子质量在1 455.69 k~2 111.67 kDa之间;单糖结果显示3种多糖主要由鼠李糖、阿拉伯糖、半乳糖、葡萄糖、木糖、半乳糖醛酸和葡萄糖醛酸组成;WPP-W微观上表现出光滑致密的薄膜状,WPP-A表现的是树枝状和不规则粗糙的片状交织结构,WPP-AL表现的是疏松的线网状和光滑薄膜状交织结构;热重结果表明黄皮多糖热稳定性好;黄皮多糖具有较高的持水、持油能力和较好的乳化能力。此外,黄皮多糖还具有一定的抗氧化活性和益生活性。实验研究不同提取方法所得多糖的理化性质、抗氧化活性和益生活性,表明黄皮多糖可用作功能食品配料、食品质地改良剂,在功能性食品开发等方面有着巨大应用潜力。
[1] SONG C, HUANG F H, LIU L Y, et al.Characterization and prebiotic properties of pectin polysaccharide from Clausena lansium (Lour.) Skeels fruit[J].International Journal of Biological Macromolecules, 2022, 194:412-421.
[2] WU D T, FU Y, GUO H, et al.In vitro simulated digestion and fecal fermentation of polysaccharides from loquat leaves:Dynamic changes in physicochemical properties and impacts on human gut microbiota[J].International Journal of Biological Macromolecules, 2021, 168:733-742.
[3] CUI F, SHI C L, ZHOU X J, et al.Lycium barbarum polysaccharide extracted from Lycium barbarum leaves ameliorates asthma in mice by reducing inflammation and modulating gut microbiota[J].Journal of Medicinal Food, 2020, 23(7):699-710.
[4] 杨斯惠, 向月, 曹亚楠, 等.植物多糖的益生作用及其影响因素研究进展[J].食品科学, 2022, 43(11):301-310.YANG S H, XIANG Y, CAO Y N, et al.Progress in research on the prebiotic effects of plant polysaccharides and the factors influencing them[J].Food Science, 2022, 43(11):301-310.
[5] LIN X, SHI Y S, WEN P, et al.Free, conjugated, and bound phenolics in peel and pulp from four wampee varieties:Relationship between phenolic composition and bio-activities by multivariate analysis[J].Antioxidants, 2022, 11(9):1831.
[6] PRASAD K N, HAO J, YI C, et al.Antioxidant and anticancer activities of wampee (Clausena lansium (lour.) skeels) peel[J].BioMed Research International, 2009, 2009(1):612805.
[7] PENG J, BU Z B, REN H Y, et al.Physicochemical, structural, and functional properties of wampee (Clausena lansium (Lour.) Skeels) fruit peel pectin extracted with different organic acids[J].Food Chemistry, 2022, 386:132834.
[8] WU J Y, ZHENG W Y, LUO P, et al.Structural characterization of a water-soluble acidic polysaccharide CSP-IV with potential anticoagulant activity from fruit pulp of Clausena lansium (Lour.) Skeels Guifei[J].International Journal of Biological Macromolecules, 2024, 254:128029.
[9] WU H, MIN T, LI X F, et al.Physicochemical properties and antioxidant activities of acidic polysaccharides from wampee seeds[J].International Journal of Biological Macromolecules, 2013, 59:90-95.
[10] 吕夏清. 黑木耳多糖乳化特性及其对β-胡萝卜素包埋稳态性能的影响[D].泰安:山东农业大学, 2023.LYU X Q.Emulsification characteristics of Auricularia auricula polysaccharide and its effect on the steady-state performance of β-carotene embedding[D].Taian:Shandong Agricultural University, 2023.
[11] CHEN P L, YOU Q X, LI X, et al.Polysaccharide fractions from Fortunella margarita affect proliferation of Bifidobacterium adolescentis ATCC 15703 and undergo structural changes following fermentation[J].International Journal of Biological Macromolecules, 2019, 123:1070-1078.
[12] ZHU M Q, HUANG R M, WEN P, et al.Structural characterization and immunological activity of pectin polysaccharide from kiwano (Cucumis metuliferus) peels[J].Carbohydrate Polymers, 2021, 254:117371.
[13] 常相娜, 陈雪峰, 龚频, 等.盐胁迫环境下发菜胞外多糖抗氧化作用及镇痛抗炎活性[J].食品科学, 2020, 41(17):133-138.CHANG X N, CHEN X F, GONG P, et al.Antioxidant, analgesic and anti-inflammatory activities of extracellular polysaccharide of Nostoc flagelliforme under salt stress[J].Food Science, 2020, 41(17):133-138.
[14] ZHAO W J, ZHANG W Y, LIU L, et al.Fractionation, characterization and anti-fatigue activity of polysaccharides from Brassica rapa L[J].Process Biochemistry, 2021, 106:163-175.
[15] 王秀丽, 薛登萍, 易良, 等.果胶酶提取西番莲果皮多糖的抗氧化和益生菌增殖活性[J].食品与发酵工业, 2024, 50(18):194-200.WANG X L, XUE D P, YI L, et al.Antioxidant and probiotic growth activities of polysaccharide extracted from Passiflora edulis peel by using pectinase[J].Food and Fermentation Industries, 2024, 50(18):194-200.
[16] HUANG H L, HUANG G L.Extraction, separation, modification, structural characterization, and antioxidant activity of plant polysaccharides[J].Chemical Biology &Drug Design, 2020, 96(5):1209-1222.
[17] 赵晨淏, 刘钧发, 冯梦莹, 等.不同提取方法对龙眼多糖性质的影响[J].现代食品科技, 2012, 28(10):1298-1301;1305.ZHAO C H, LIU J F, FENG M Y, et al.Effect of different extraction methods on the properties of Longan polysaccharides[J].Modern Food Science and Technology, 2012, 28(10):1298-1301;1305.
[18] BIDHENDI A J, GEITMANN A.Relating the mechanics of the primary plant cell wall to morphogenesis[J].Journal of Experimental Botany, 2016, 67(2):449-461.
[19] LI S, HU N N, ZHU J Y, et al.Influence of modification methods on physicochemical and structural properties of soluble dietary fiber from corn bran[J].Food Chemistry:X, 2022, 14:100298.
[20] WANG Z, SONG W C, SONG H Z, et al.Effects of extraction methods on the physicochemical properties and functionalities of pectic polysaccharides from burdock (Arctium lappa L.)[J].International Journal of Biological Macromolecules, 2024, 257:128684.
[21] YANG W J, HUANG G L.Extraction, structural characterization, and physicochemical properties of polysaccharide from purple sweet potato[J].Chemical Biology &Drug Design, 2021, 98(6):979-985.
[22] 张婷. 山楂果胶改性、结构表征及抗氧化和益生活性研究[D].泰安:山东农业大学, 2022.ZHANG T.Modification, structural characterization and antioxidant and probiotic activities of hawthorn pectin[D].Taian:Shandong Agricultural University, 2022.
[23] SUN Y J, HOU S T, SONG S, et al.Impact of acidic, water and alkaline extraction on structural features, antioxidant activities of Laminaria japonica polysaccharides[J].International Journal of Biological Macromolecules, 2018, 112:985-995.
[24] 徐雅琴, 刘柠月, 李大龙, 等.蓝靛果多糖功能特性、结构及抗糖基化活性[J].食品科学, 2020, 41(2):8-14.XU Y Q, LIU N Y, LI D L, et al.Functional properties, structure and anti-glycosylation activity of polysaccharide from blue honeysuckle fruit(Lonicera caerulea L.)[J].Food Science, 2020, 41(2):8-14.
[25] 崔欣. 石花菜多糖的提取纯化、理化性质和生物活性研究[D].南京:南京农业大学, 2019.CUI X.Extraction, isolation, purification, physicochemical properties and bioactivity of polysaccharides from Gelidiu mamansii[D].Nanjing:Nanjing Agricultural University, 2019.
[26] ZHU Z B, WEN Y, YI J H, et al.Comparison of natural and synthetic surfactants at forming and stabilizing nanoemulsions:Tea saponin, Quillaja saponin, and tween-80[J].Journal of Colloid and Interface Science, 2019, 536:80-87.
[27] SILA A, BAYAR N, GHAZALA I, et al.Water-soluble polysaccharides from agro-industrial by-products:Functional and biological properties[J].International Journal of Biological Macromolecules, 2014, 69:236-243.
[28] 赵泽素, 南木加, 刘双平, 等.西藏凹乳芹多糖的分离纯化、结构表征及抗氧化活性研究[J].食品与发酵工业, 2024, 50(1):163-169.ZHAO Z S, NANMUJIA, LIU S P, et al.Isolation, purification, structure characterization, and antioxidant activity of polysaccharides from Vicatia thibetica de Boiss[J].Food and Fermentation Industries, 2024, 50(1):163-169.
[29] 孔秋红, 张瑞芬, 曾新安, 等.不同方法提取的羊栖菜多糖理化性质及益生活性[J].现代食品科技, 2021, 37(5):123-129.KONG Q H, ZHANG R F, ZENG X A, et al.Physicochemical properties and prebiotic activity of Sargassum fusiforme polysaccharides obtained by different extraction methods[J].Modern Food Science and Technology, 2021, 37(5):123-129.