木瓜[Chaenomeles speciose(Sweet) Nakai],又名皱皮木瓜,是蔷薇科植物贴梗海棠的干燥成熟果实[1],属于药食同源物品。宣木瓜为安徽道地药材,据《本草纲目》记载:“木瓜处处有之,而宣城者为佳”,故有宣木瓜之称。宣木瓜不仅含有多糖、黄酮类、有机酸、三萜类、酚类、精油、生物碱等有效活性成分[2],还含有丰富的氨基酸、维生素和矿物微量元素等营养物质[3]。这些活性成分和营养物质具有降血压、降血糖、抗肿瘤、抗菌、抗炎、抗氧化等作用[4-6]。
目前国内外对木瓜抗炎活性成分的研究众说纷纭,如胡付侠[7]的研究中,皱皮木瓜多酚提取物通过抑制相关蛋白的磷酸化而抑制炎症基因的表达达到抗炎效果,研究认为原花青素B1、儿茶素和绿原酸为3种关键化合物;顾正位[8]通过干预RA模型大鼠,观察到不同剂量的木瓜醇提物能不同程度地降低大鼠足跖肿胀度,具抗炎疗效的主要为有机酸类、黄酮类、三萜类成分,且中剂量组和高剂量的抗炎效果最佳;薛丹[9]研究发现,皱皮木瓜多糖具有较好的抗类风湿关节炎活性,通过体内实验揭示了其是通过抑制免疫系统发挥抗炎作用;KANG等[10]通过体内实验证明了木瓜的醇提物能抑制促炎酶和细胞因子的表达。但具体的抗炎功效成分还未见报道。
本研究拟通过对宣木瓜进行醇提、水提醇沉,利用小鼠耳肿胀模型[11]筛分宣木瓜中起抗炎作用的成分,为宣木瓜的药物利用提供理论依据。
1 材料与方法
1.1 材料与仪器
1.1.1 材料与试剂
宣木瓜,安徽宣城宣海堂生物科技公司;GF254硅胶板,山东烟台芝罘化工厂;DEAE-纤维素色谱柱、HW-55F色谱柱,日本TOSOH公司;SephacryI S-400色谱柱,瑞典Pharmaeia公司;Ultrahydrogel TMLinear色谱柱,美国Waters公司;雄性KM小鼠,体重(20±2) g,北京维通利华实验动物技术有限公司,许可证号为SYXK(苏)2021-0056,动物实验通过江南大学实验动物管理与动物福利伦理委员会批准,伦理编号JN.No20230415k1000524[137],JN.NO20231018k1201130[490];肿瘤坏死因子-α(tumor necrosis factor-alpha, TNF-α)、白细胞介素-6(interleukin-6, IL-6)、白细胞介素-1β(interleukin-1β, IL-1β)酶联免疫吸附(enzyme-linked immunosorbent,ELISA)试剂盒,上海酶联生物科技有限公司。
1.1.2 仪器与设备
RAT-100型萃取罐,无锡申科仪器有限公司;SYB106-100型恒流泵,天津市科器高新技术公司;UV-2450型紫外分光光度计,日本岛津公司;Avance500MHz型核磁共振仪,Bruke公司。
1.2 试验方法
1.2.1 宣木瓜不同提取物的制备
称取7.5 kg宣木瓜,先剖成两半去籽,再切成2 mm厚的薄片,先用75 L体积分数为95%乙醇室温浸泡1周,过滤,滤液减压浓缩后即为宣木瓜醇提物(A),宣木瓜薄片再用破碎机破碎成匀浆,置于100 L萃取罐内,再加入75 L去离子水提取,提取温度为60 ℃,以150 r/min的速度匀速搅拌2 h,静置2 h,过滤,收集滤液,重复上述步骤一次。合并2次滤液,减压浓缩至一定体积,收集浓缩液,此滤液即为宣木瓜的水提物,在搅拌的过程中缓慢加入体积为原液体积3倍量的无水乙醇,搅拌均匀后静置12 h,过滤,得到宣木瓜醇沉部分,经真空干燥后得宣木瓜醇沉物(B),水提醇溶部分浓缩成浸膏,再经真空干燥后得水提醇溶物(C),置于-20 ℃下冷冻保存。
分别取适量宣木瓜醇提物A、水提醇沉物B和水提醇溶物C,用去离子水配制成10 mg/g的溶液,用于抗炎活性的测定。
1.2.2 不同提取组分抗炎活性测定
小鼠耳肿胀度测定[12]:选取50只SPF级KM雄性小鼠,体重(20±2) g。在环境温度20~26 ℃,相对湿度40%~70%,动物照度15~20 Lux的标准条件下适应性饲养1周后,进行随机分组,设置模型组M1、地塞米松阳性对照组P1、试验组A、B、C五组,每组各10只。阳性组和试验组均以1.00 g/kg的给药剂量进行1周的灌胃,期间模型组灌以同等体积蒸馏水。在第8天给药30 min后,用移液枪准确吸取20 μL二甲苯均匀涂抹于小鼠右耳的正反两面,经过20 min后将其处死,随后分别沿着耳轮廓将小鼠左右耳剪下,使用打孔器(直径8 mm)在其相同部位打下耳片并迅速称量,各组小鼠的耳肿胀度[13]和耳肿胀抑制率[14]的计算如公式(1)和公式(2)所示:
耳肿胀度/mg=右耳片质量-左耳片质量
(1)
耳肿胀抑制率/%
(2)
1.2.3 具抗炎活性组分的分离
取适量组分A,上样至MCI柱(5 cm×100 cm),分别用去离子水、10%、30%、50%的乙醇水溶液进行梯度洗脱,每梯度洗脱5 L,洗脱速率为5 mL/min,自动收集器收集洗脱液,每管20 mL,收集10%、30%、50%乙醇洗脱物,取30%乙醇洗脱物浓缩压缩至适当体积,记为A1。
将组分A1上SephadexLH-20层析柱(5 cm×100 cm),依次用去离子水、5%、10%、20%、30%的乙醇水溶液进行梯度洗脱,每梯度洗脱1个柱体积,收集目标组分去溶剂后上样到ODS-AQ层析柱(3 cm×100 cm),用去离子水、体积分数为5%、10%、15%的乙醇进行梯度洗脱,每梯度洗脱1个柱体积,收集目标物纯化至单一组分,浓缩、干燥,记为组分N。
取适量组分B,上样DEAE-纤维素柱(6 cm×100 cm),分别用去离子水、0.3、0.5 mol/L的NaCl溶液进行梯度洗脱以进一步分离,洗脱速率为5 mL/min。洗脱时,利用自动收集器接收洗脱液,容量为10 mL/管,多糖浓度监测采用苯酚硫酸法[15],根据洗脱管数绘制洗脱曲线,横轴表示管数,纵轴表示吸光度值[16],根据吸收峰分段收集洗脱液,浓缩至合适体积,得到水洗脱液B1和盐洗脱液B2,将样品B2注入8 000 Da的透析袋中进行透析,外部渗透液为蒸馏水,透析12 h结束[17],样品冷冻保存。
组分B2上样至HW-55F凝胶柱(5 cm×100 cm)用去离子水洗脱,洗脱流速为5 mL/min,自动收集器接收洗脱液,容量为10 mL/管,多糖浓度监测及洗脱曲线绘制同1.2.3节,根据吸收峰分段收集水洗脱液,浓缩至一定体积,得到组分B21、B22,将组分B21、B22分别上样至SephacryI S-400凝胶色谱柱(3 cm×100 cm)进行反复分离纯化至得到单一对称峰,记为多糖PCC-1和多糖PCC-2。
1.2.4 组分N和多糖PCC-1、PCC-2抗炎活性研究
1.2.4.1 小鼠耳肿胀模型测定
设置动物实验4组,包括模型组M2、地塞米松阳性对照组P2及组分N和多糖PCC-1、PCC-2,每组10只。实验分组、给药剂量及灌胃剂量同1.2.2节。末次给药30 min后,于小鼠右耳均匀涂抹20 μL二甲苯,20 min后,眼球采血1 mL于1.5 mL离心管中,随后剪下小鼠的耳轮廓,其他实验操作同1.2.2节。
1.2.4.2 小鼠血清中TNF-α、IL-6、IL-1β水平的测定
将1.2.4.1节中小鼠的血液于4 ℃下冷藏静置3 h后,离心机设置温度为4 ℃,转数为5 000 r/min,离心5 min,上层清液即为小鼠血清。测定比较模型组和试验组小鼠血清中TNF-α、IL-6、IL-1β的水平,采用ELISA法进行测定,测定详细步骤依照试剂盒说明书操作。
1.2.5 多糖PCC-1纯度鉴定
取适量多糖PCC-1,加入去离子水稀释成1 mg/mL的溶液,利用紫外分光光度计在200~400 nm下的波长进行扫描[18]。
1.2.6 高效凝胶过滤色谱测定多糖PCC-1分子质量
由洗脱曲线可知,多糖PCC-1在SephacryI S-400凝胶树脂柱中的保留时间较短,说明该多糖的相对分子质量较大。取1.2.4节中的多糖溶液20 μL,上样UltrahydrogelTMLinear(7.8 mm×300 mm)测量其分子质量[19]。
1.2.7 组分N和多糖PCC-1结构鉴定
取适量组分N用重水溶解,多糖PCC-1减压干燥除去水分,重水(D2O)交换二次,再以重水为溶剂,利用核磁共振仪进行1H-NMR、13C-NMR、13DEPT-NRM波谱分析,分析其结构。
1.2.8 统计学方法
运用SPSS 26.0统计学软件,采用单因素方差对所得数据进行分析,比较不同组间差异,以“平均值±标准差![]() 的形式呈现试验数据,P<0.05表示有显著性差异,P<0.01表示极显著性差异。
的形式呈现试验数据,P<0.05表示有显著性差异,P<0.01表示极显著性差异。
2 结果与分析
2.1 宣木瓜不同提取组分抗炎活性研究结果
宣木瓜不同提取组分对二甲苯诱导的小鼠耳肿胀模型抑制作用见表1。与模型组M1比较,地塞米松阳性对照组P1对小鼠的耳肿胀具有明显的抑制效果,抑制率为68.69%;醇提物A组对小鼠耳肿胀抑制作用不明显,抑制率为23.39%;水提醇沉物B组对小鼠的耳肿胀度抑制效果显著(P<0.05),且抑制率达到60.02%;水提醇溶物C组对小鼠的耳肿胀度无显著差异(P>0.05),说明宣木瓜对小鼠耳肿胀具有抑制作用的主要活性成分存在于水提醇沉物B组分中。有相关研究报道,木瓜醇提物中主要成分为多酚类物质,具有抗炎作用,而本研究中醇提物没有抗炎活性,分析认为醇提物相关成分含量较低的缘故,因此需对醇提物A进一步分离。
表1 宣木瓜不同提取组分对小鼠耳肿胀的影响(n=10)
Table 1 Effects of different extract components ofChaenomeles on ear swelling in mice(n=10)
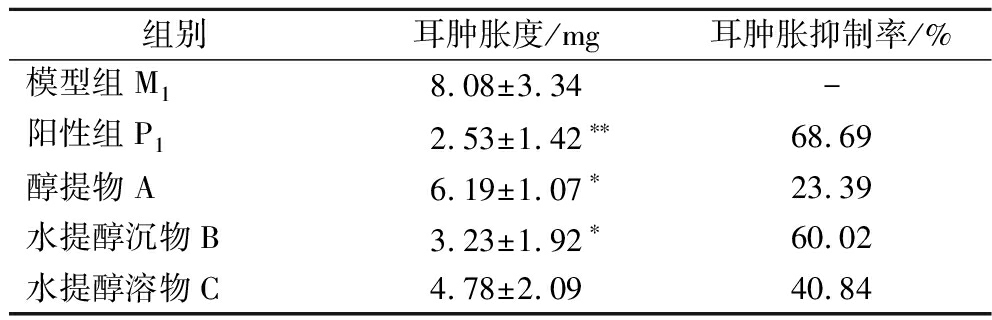
组别耳肿胀度/mg耳肿胀抑制率/%模型组M18.08±3.34-阳性组P12.53±1.42∗∗68.69醇提物A6.19±1.07∗23.39水提醇沉物B3.23±1.92∗60.02水提醇溶物C4.78±2.0940.84
注:与模型组比较,*P<0.05,**P<0.01。
2.2 组分A分离结果
组分A经MCI层析柱分离后,高效薄层层析色谱图如图1-a所示,10%乙醇洗脱物为低聚糖,不具抗炎活性;50%乙醇洗脱物含量较少且较杂无法继续研究;主要成分集中在30%乙醇洗脱物中,收集30%的乙醇水溶液洗脱部分,记为A1。

a-组分A分离过程高效薄层层析色谱图;b-组分N的高效薄层层析色谱图
图1 高效薄层层析色谱图
Fig.1 High performance thin layer chromatography
A1经SephadexLH-20层析柱,ODS-AQ层析柱分离纯化至单一组分,浓缩、干燥,得到无色无定形粉末,记为组分N,其高效薄层层析色谱图如图1-b所示。
2.3 组分B分离结果
组分B经DEAE-纤维素柱洗脱,洗脱曲线如图2,得到了两个洗脱峰,但水洗脱组分B1的峰面积很小,盐洗脱组分B2的峰面积大,由此推测多糖中的抗炎活性成分主要存在于盐洗脱组分B2中,故弃去不足以支撑进一步分离的水洗脱组分B1。
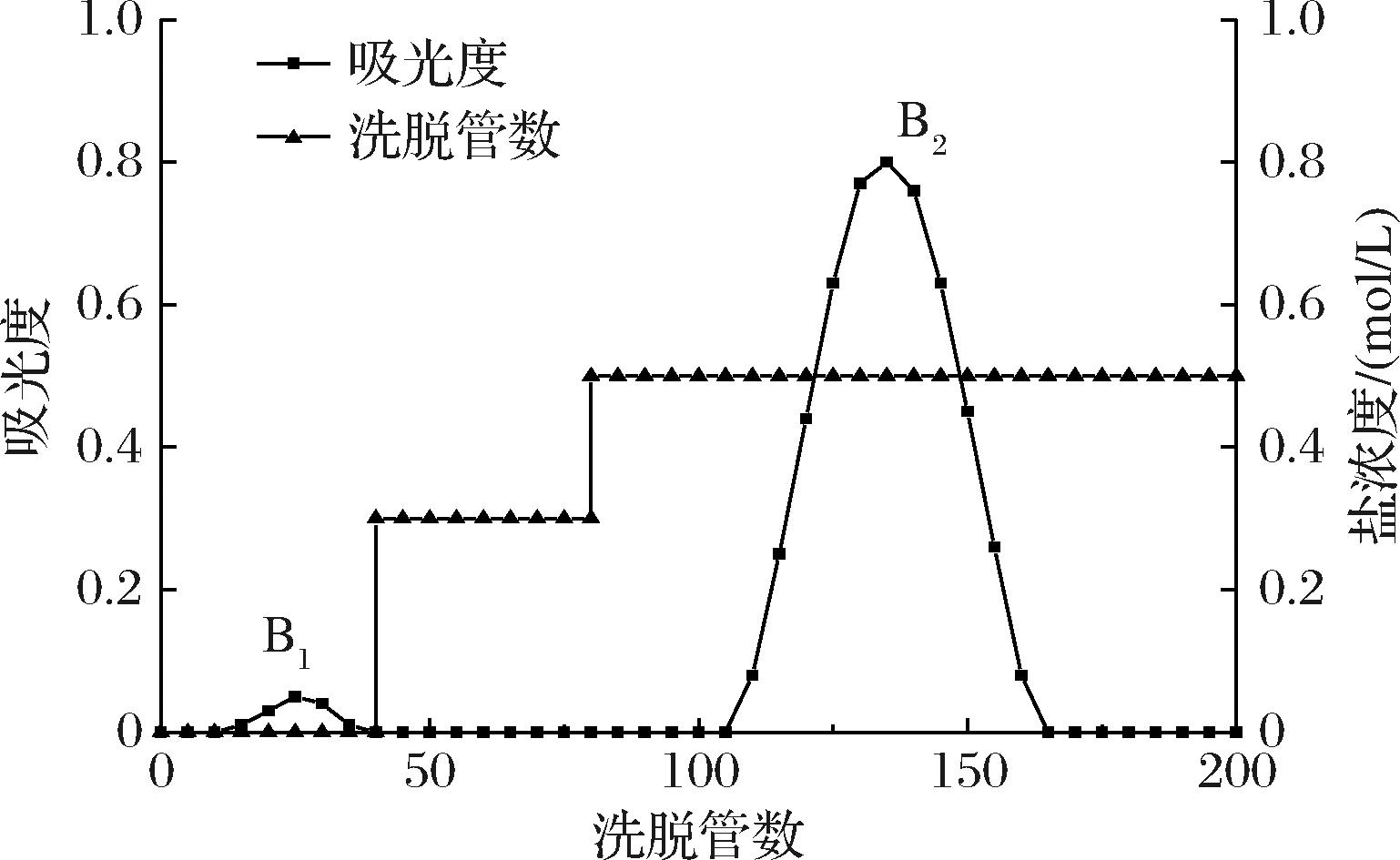
图2 DEAE-纤维素柱洗脱曲线
Fig.2 Elution curve of DEAE-cellulose column
组分B2上样至HW-55F凝胶柱进一步洗脱分离,洗脱曲线如图3,得到两组,分别记为组分B21、B22。
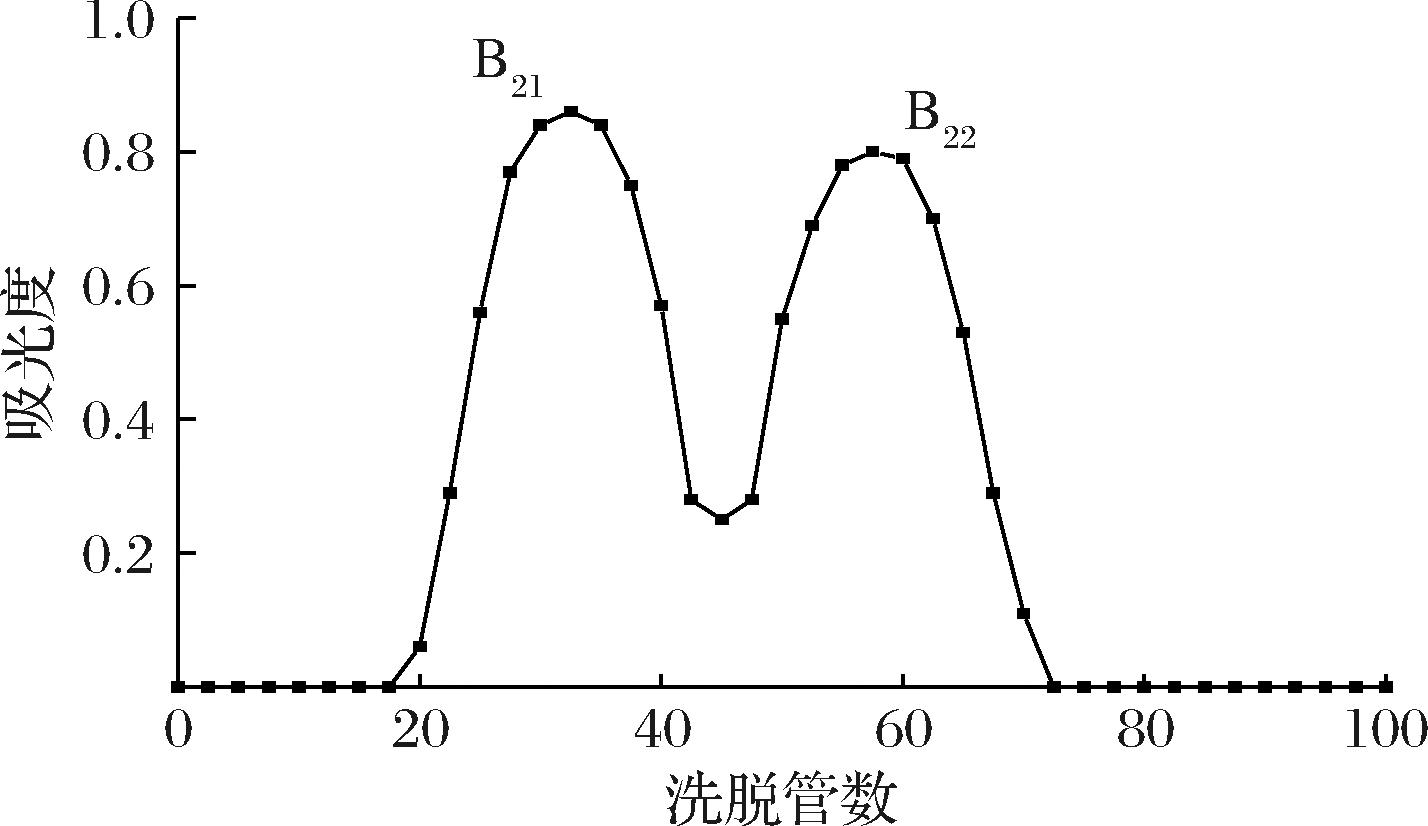
图3 HW-55F柱洗脱曲线
Fig.3 Elution curve of HW-55F column
将B21、B22分别上样至SephacryI S-400凝胶色谱柱所得洗脱曲线如图4所示,均出现了仅有的一对称峰,表明多糖PCC-1、多糖PCC-2为单一多糖。
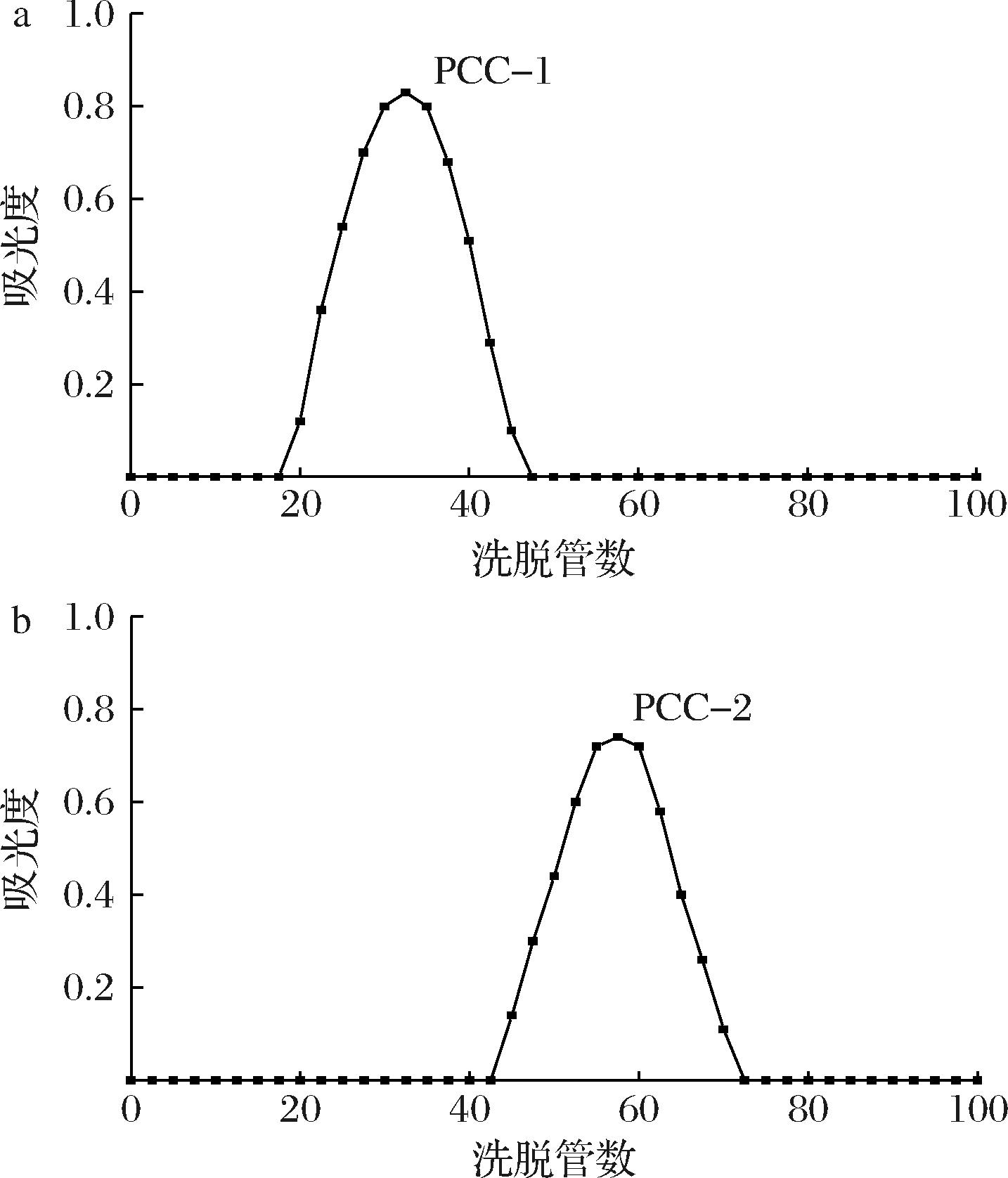
a-多糖PCC-1;b-多糖PCC-2
图4 SephacryI S-400 凝胶柱洗脱曲线
Fig.4 Elution curve of SephacryI S-400 gel column
2.4 组分N和多糖PCC-1、多糖PCC-2的抗炎活性
2.4.1 小鼠耳肿胀模型测定结果
组分N与多糖PCC-1、多糖PCC-2对二甲苯诱导的小鼠耳肿胀模型抑制作用如表2所示,与模型组相比,阳性组的耳肿胀抑制效果最为显著,抑制率为72.41%;组分N与模型组相比有抑制作用(P<0.05),抑制率为42.40%,与粗提物抑制率23.39%相比有很大的提高,推测是因为组分N在粗提物中的含量较低;多糖PCC-1的抑制作用更为显著,抑制率达63.22%,且有显著性差异(P<0.05);而多糖PCC-2的耳肿胀抑制率最低,仅为19.80%。根据结果分析,组分N和多糖PCC-1均有抗炎活性,但组分N的抗炎活性不如多糖PCC-1,发挥抗炎活性的主要功效成分是多糖PCC-1。
表2 宣木瓜不同分离组分对小鼠耳肿胀的影响(n=10)
Table 2 Effects of different separate components ofChaenomeles on ear swelling in mice(n=10)
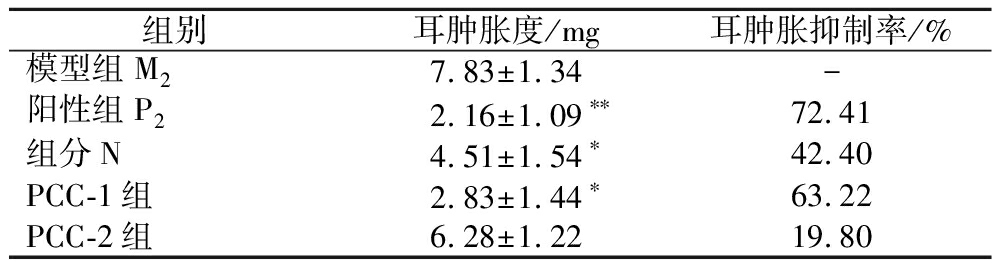
组别耳肿胀度/mg耳肿胀抑制率/%模型组M27.83±1.34-阳性组P22.16±1.09∗∗72.41组分N4.51±1.54∗42.40PCC-1组2.83±1.44∗63.22PCC-2组6.28±1.2219.80
注:与模型组比较,*P<0.05,**P<0.01。
2.4.2 小鼠血清中TNF-α、IL-6、IL-1β水平测定结果
如表3所示,与模型组比较,阳性组TNF-α、IL-6、IL-1β水平显著降低,说明地塞米松对炎症因子TNF-α、IL-6、IL-1β的分泌有良好的抑制效果;组分N和PCC-1组TNF-α、IL-6、IL-1β的含量均有所降低,具有极显著性差异(P<0.01),与阳性组对比差异不明显(P>0.05);PCC-2组TNF-α、IL-6、IL-1β的含量降低不明显,无显著性差异(P>0.05)。说明组分N和PCC-1组对小鼠体内TNF-α、IL-6、IL-1β的表达具有一定的调节作用,这与其抗炎机制有着密切联系。
表3 宣木瓜不同分离组分对小鼠血清中TNF-α、IL-6、IL-1β水平的影响(n=10) 单位:ng/L
Table 3 Effects of different separate components ofChaenomeles on serum levels of TNF-α, IL-6, and IL-1β in mice(n=10)
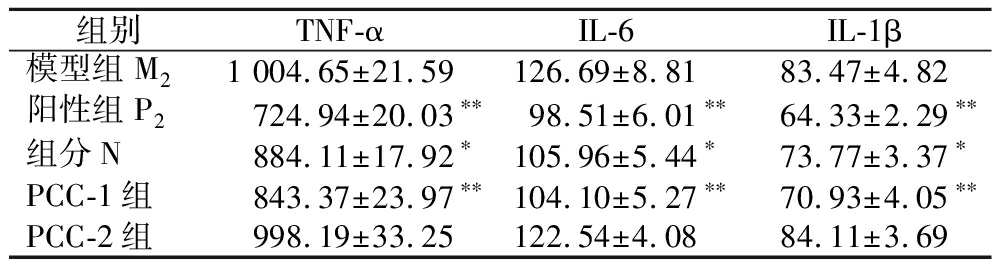
组别TNF-αIL-6IL-1β模型组M21 004.65±21.59126.69±8.8183.47±4.82阳性组P2724.94±20.03∗∗98.51±6.01∗∗64.33±2.29∗∗组分N884.11±17.92∗105.96±5.44∗73.77±3.37∗PCC-1组843.37±23.97∗∗104.10±5.27∗∗70.93±4.05∗∗PCC-2组998.19±33.25122.54±4.0884.11±3.69
注:与模型组比较,*P<0.05,**P<0.01。
2.5 多糖PCC-1纯度鉴定及其分子质量的测定结果
紫外分光光度计的扫描结果如图5所示,在260~280 nm下,多糖PCC-1无明显的吸收峰,表明该多糖不含蛋白质和核酸,是单一化合物。通过高效凝胶渗透色谱测得多糖PCC-1的相对分子质量为7.16×105Da。
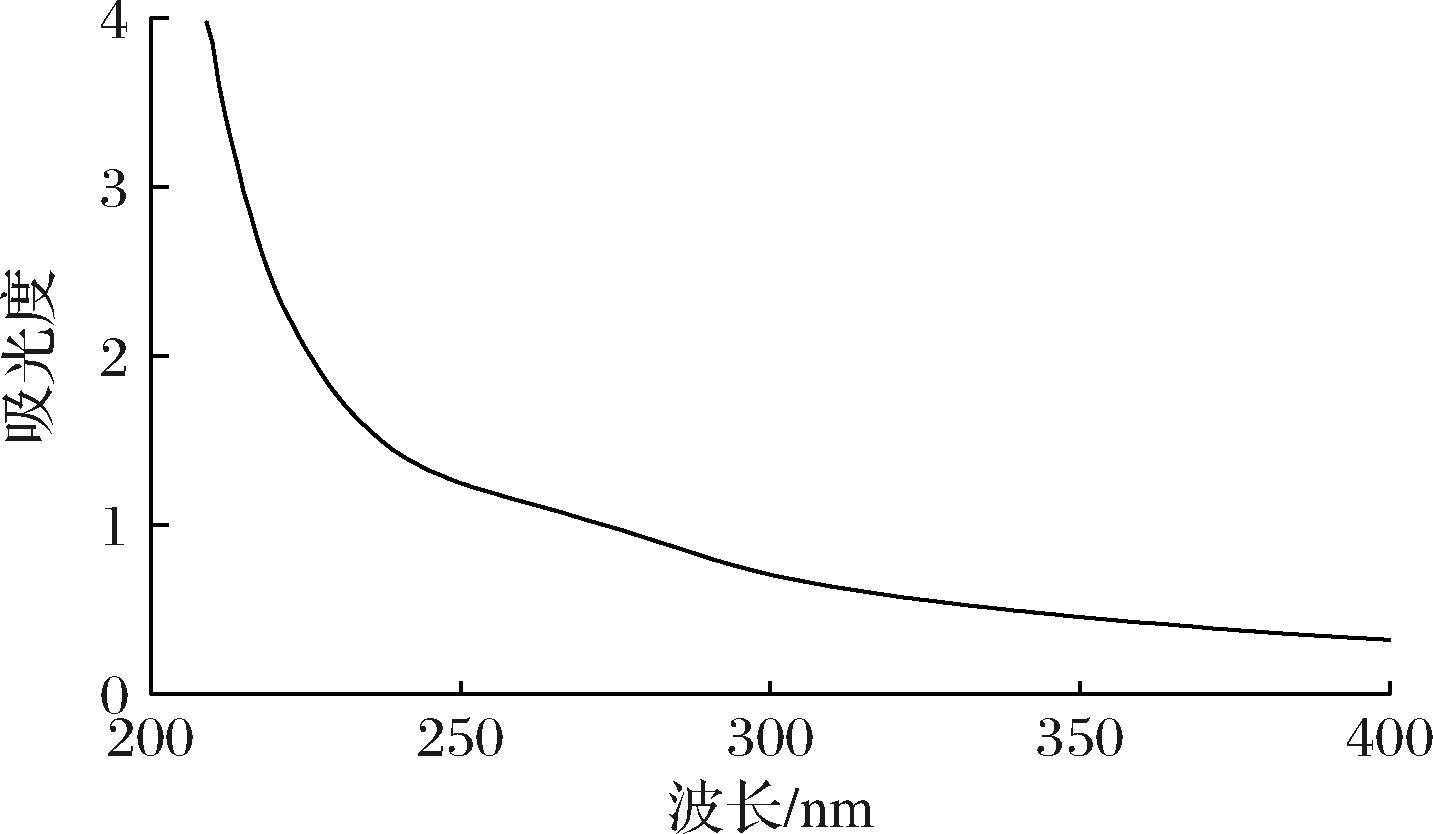
图5 多糖PCC-1的紫外光谱
Fig.5 UV spectra of polysaccharide PCC-1
2.6 核磁共振分析
化合物N:无色无定形粉末,核磁共振谱图见图6,核磁共振数据如下:
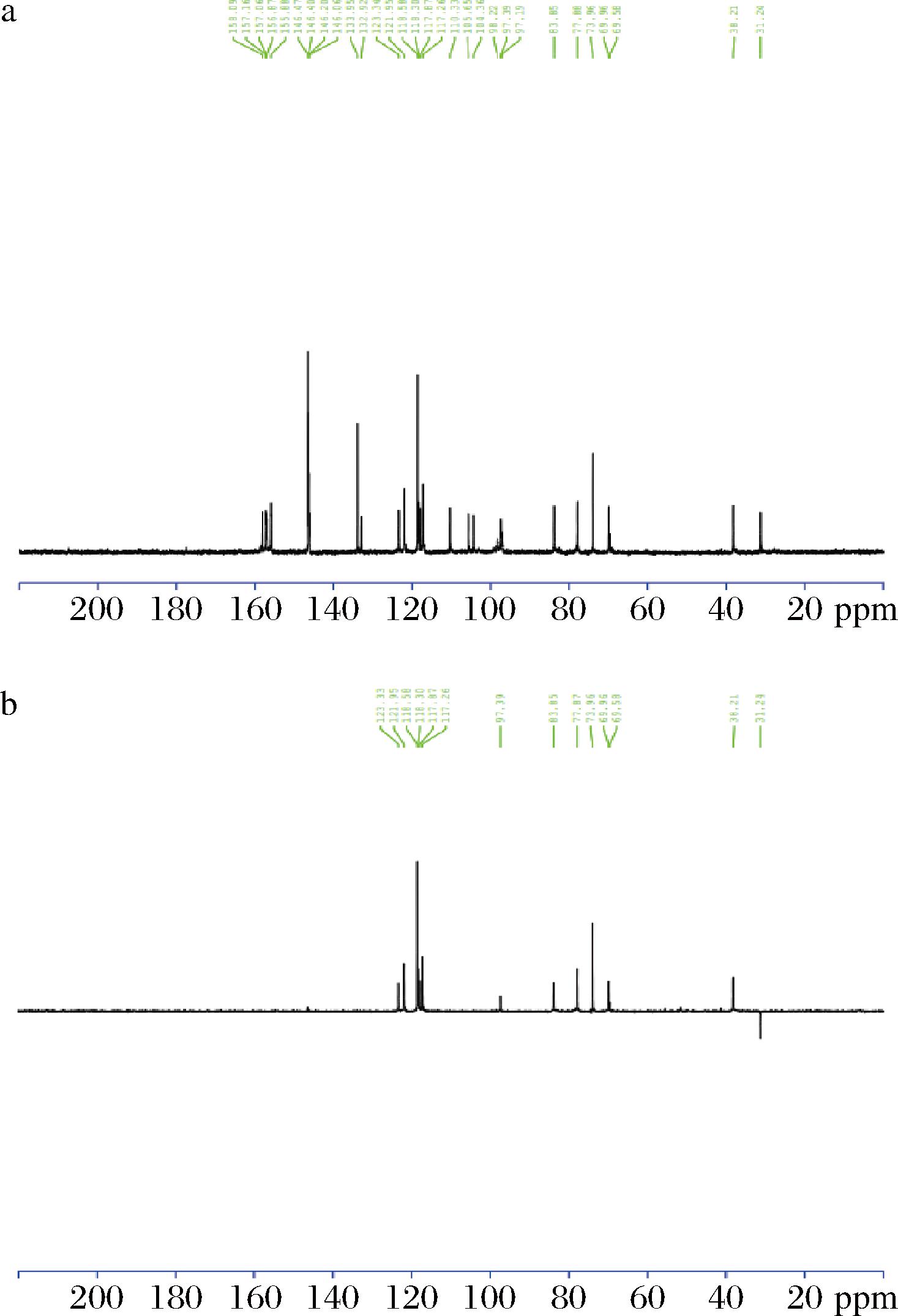
a-组分N的13CNMR谱图;b-组分N的135DEPT-NRM谱图
图6 组分N核磁共振谱图
Fig.6 NMR spectrum of component N
1H-NMR(500 MHz, D2O)δ 6.81 (1H, s,), 6.64(1H, d, J=8.5), 6.58(1H, d, J=6.5 s), 6.56(1H, d, J=8.5), 6.54(1H, d, J=6.5), 6.45(1H, s), 6.34 (1H, s), 4.96(1H, s).4.22 (1H, s), 3.77 (1H, s), 3.72 (1H, s), 2.80(1H, d, J=9.0).2.23 (1H, d, J=9.0);从H谱数据中可知化合物N含有7个芳香氢,4个连氧H。
13C-NMR(500 MHz, D2O)δ 158.1, 157.2, 157.0, 156.9, 155.9, 155.7, 146.5, 146.4, 146.2, 146.0, 133.9, 132.9, 123.3, 121.9, 118.6, 118.3, 117.9, 117.3, 110.3, 105.6, 104.4, 98.2, 97.4, 97.2, 83.9, 77.9, 73.9, 70.0, 38.2, 31.2。C谱数据显示,化合物N含30个碳信号,判断应为两个黄酮聚合的二聚体,经分析含有儿茶素和表儿茶素单元,从HMBC中可见δH 3.72与δC 110.3有相关,表明儿茶素和表儿茶素以C4—C″8相连,如果是这种连接C6,C″6应该是CH信号,从135dept谱中可得,δ98.2,97.2两个碳都为季碳,表明这两个碳也成键,进一步分析得出C6—C″6也相连,由于C6,C″6附近都是季碳,HMBC未能观察到相关信号。综合以上数据得出,该化合物是原花青素,为儿茶素并[6, 6″, 4, 8″]表儿茶素,这种结构的原花青素首次从木瓜中分离得到,其结构如图8-a所示。
多糖PCC-1:白色无定形粉末,记为多糖PCC-1。其核磁共振谱图见图7,1HNMR(500 MHz, D2O)中δ5.12,5.05,4.79,4.67有4个糖的端基信号,δ3.31处有1个甲氧基信号,δ4.17-3.46为其余糖信号(信号重迭,无法分辨)。13CNMR(125 MHz, D2O)中δ173.4为羧基信号,说明多糖为酸性多糖,这与DEAE-纤维素柱分离时用盐洗脱结果相吻合,δ112.0,110.1,106.2,103.4为4个糖的端基信号,说明有4类糖残基,这与1HNMR结果相吻合,δ86.5应是糖的1→3位成键的特征信号,84.15应是糖的1→2位成键的特征信号,79.3是糖的1→4位成键的特征信号,δ55.6为甲氧基信号说明有甲酯化存在。135DEPT谱中可见δ69.6,63.9处为两个CH2信号,δ63.9为糖的C6碳信号,δ69.6的CH2信号表明糖的碳6位成苷或酯化,结合δ55.6的甲氧基信号,表明有碳6位甲酯化。由碳信号丰度可以判断δ112.0,79.3,76.0,75.3,71.6,63.9为主链,δ79.3信号是糖的C4位成键特征信号,表明主链以β1→4键相连,主链上的C3,C2位有侧链相连,δ173.4的羧基信号说明有糖醛酸存在,碳谱中显示4个糖的端基信号,而135DEPT谱中只见2个CH2信号,说明一类端基糖的C6位有形成糖醛酸,一类糖的C6位被甲酯化。糖醛酸和甲酯化的数量具体位置还需要进一步研究。
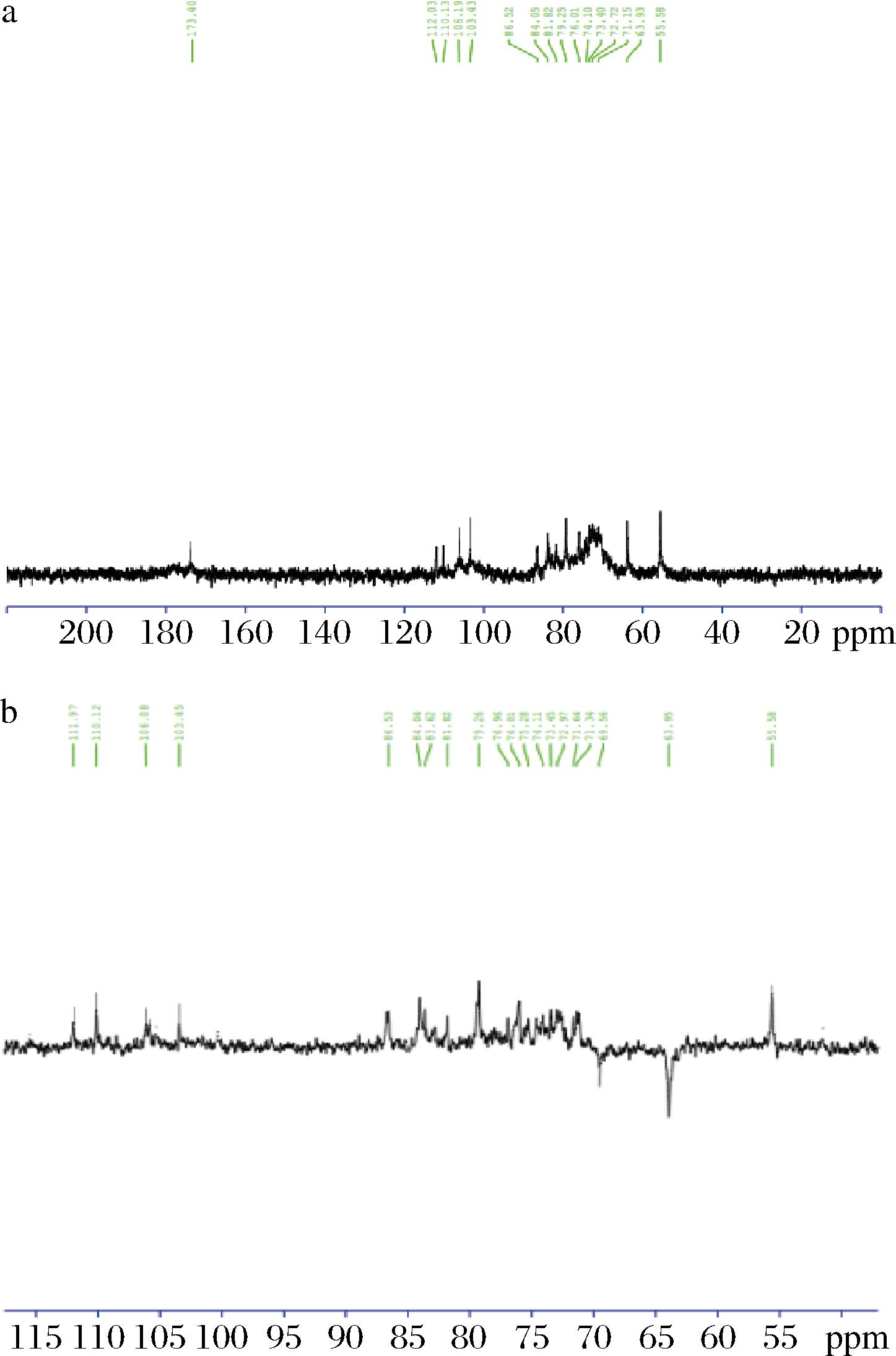
a-多糖PCC-1的13CNMR谱图;b-多糖PCC-1的135DEPT-NRM谱图
图7 多糖PCC-1核磁共振谱图
Fig.7 NMR spectrum of polysaccharide PCC-1
对以上数据分析得出多糖的基本结构,多糖由葡萄糖和葡萄糖醛酸组成,主链以β1→4键相连,主链上的C3,C2位有侧链相连,一部分C6位形成糖醛酸,一部分C6位被甲酯化。推断多糖PCC-1的片段结构如图8-b。
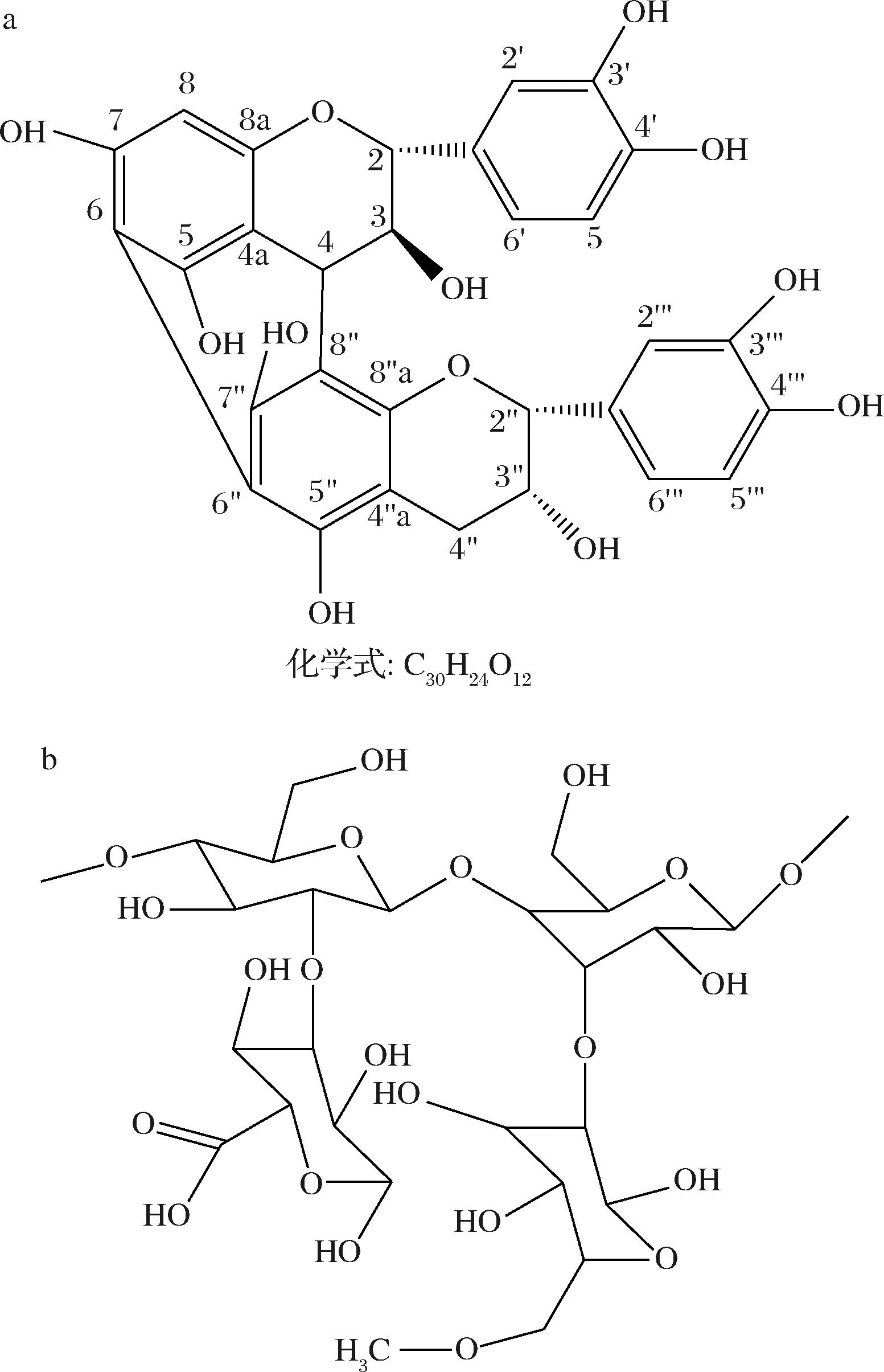
a-组分N的结构;b-多糖PCC-1的片段结构
图8 组分N和多糖PCC-1的结构
Fig.8 Structure of component N and polysaccharide PCC-1
多糖对免疫调节的作用较为明显,尤其是酸性杂多糖在具备磷酸取代基的作用下对机体免疫应答效果更为强烈[20];ZHANG等[21]研究发现,山药多糖的免疫调节效果随糖醛酸数量的增加而提高。本文从宣木瓜中得到的抗炎活性成分也是含糖醛酸的酸性多糖,与以上结论相吻合。多糖PCC-1是带有糖醛酸的酸性多糖,能显著降低二甲苯诱导的小鼠体内TNF-α、IL-6、IL-1β的含量,TNF-α、IL-6、IL-1β是调节自然免疫的炎症因子,均与巨噬细胞的分泌和活化有着密切联系[22],进一步确定该多糖是通过调节免疫系统发挥抗炎活性,且糖醛酸在此过程中发挥着极为重要的作用。
多糖具有抗氧化、抗肿瘤、抗癌、抗炎、增强免疫等生物活性,是中药重要的主要活性之一[23],又因为天然产物具有副作用小、性毒低等优点,在保健品和功能食品的应用中具有潜在的价值[24]。本研究在前人研究的基础上,进一步确定了宣木瓜的抗炎活性物质。目前研究表明,原花青素和多糖PCC-1能降低TNF-α、IL-6、IL-1β的水平,有增强免疫,调节炎症细胞释放的效果,从而体现出抗炎活性。但原花青素和多糖的抗炎功效并不完全相同,抗炎机理也不完全相同,多糖应是从多路径增强免疫调节,两者免疫调节差异还需进一步研究。
3 结论
宣木瓜是治疗关节炎常用中药,具有镇痛消炎作用,有关镇痛消炎的功效成分并不清楚。本文从宣木瓜中分离得到并明确了具抗炎活性的两种成分组分,分别为原花青素和带有糖醛酸的酸性多糖PCC-1,经活性筛选原花青素和多糖PCC-1均是宣木瓜的抗炎活性成分。
现有一些文献报道木瓜醇提物中原花青具有抗炎活性并认为原花青为抗炎活性成分,另有部分文献报道木瓜多糖具有很好的抗类风湿关节炎活性,是木瓜的主要抗炎功效成分,本文发现木瓜醇提物和水提取物都有抗炎活性,无论是抗炎活性强度还是含量水平,原花青素均远不如多糖PCC-1,因此,宣木瓜的抗炎活性功效成分主要是多糖PCC-1,原花青素只是辅助。本文首次在宣木瓜中分离得到结构清楚的原花青素和多糖PCC-1并明确了二者在宣木瓜的抗炎活性中的主次作用,但其抗炎活性机制还不清楚,后续将进一步探究各活性成分的作用机理,确定木瓜的抗炎作用途径,为木瓜的质量筛选、资源开发提供研究依据。
[1] 田冰梅. 宣木瓜提取物的抗氧化活性研究[D].合肥:安徽中医药大学, 2015.TIAN B M.Antioxidant activity of Chaenomelis Fructus extract[D].Hefei:Anhui University of Chinese Medicine, 2015.
[2] FANG Q Y, ZHENG H, FU G S, et al.Integrated untargeted metabolome, full-length sequencing, and transcriptome analyses reveal insights into the fruit quality at different harvest times of Chaenomeles speciosa[J].Food Research International, 2023, 164:112314.
[3] TURKIEWICZ I P, WOJDY O A, TKACZ K, et al.Carotenoids, chlorophylls, vitamin E and amino acid profile in fruits of nineteen Chaenomeles cultivars[J].Journal of Food Composition and Analysis, 2020, 93:103608.
O A, TKACZ K, et al.Carotenoids, chlorophylls, vitamin E and amino acid profile in fruits of nineteen Chaenomeles cultivars[J].Journal of Food Composition and Analysis, 2020, 93:103608.
[4] TURKIEWICZ I P, WOJDY O A, TKACZ K, et al.Comprehensive characterization of Chaenomeles seeds as a potential source of nutritional and biologically active compounds[J].Journal of Food Composition and Analysis, 2021, 102:104065.
O A, TKACZ K, et al.Comprehensive characterization of Chaenomeles seeds as a potential source of nutritional and biologically active compounds[J].Journal of Food Composition and Analysis, 2021, 102:104065.
[5] 索安迪, 吴彩娥, 范龚健, 等.宣木瓜糯米酒澄清工艺及品质评价[J].食品科学, 2020, 41(10):246-254.SUO A D, WU C E, FAN G J, et al.Clarification and quality evaluation of glutinous rice wine added with Chaenomeles sinensis juice[J].Food Science, 2020, 41(10):246-254.
[6] GAO R X, XIONG S Y, ZHANG T P, et al.Two new quinic acid derivatives from the fruits of Chaenomeles speciosa[J].Biochemical Systematics and Ecology, 2020, 93:104167.
[7] 胡付侠. 皱皮木瓜多酚的提取纯化、鉴定及抗氧化与抗炎活性研究[D].泰安:山东农业大学, 2022.HU F X.Extraction, purification and identification of polyphenols from Chaenomeles Speciosa(Sweet)Nakai and its antioxidant and anti-inflammatory activities[D].Taian:Shandong Agricultural University, 2022.
[8] 顾正位. 木瓜物质基础辨识与抗类风湿性关节炎作用机制研究[D].济南:山东中医药大学, 2020.GU Z W.Study on the identification of material basis and anti-rheumatoidarthritis mechanism of Chaenomelis Fructus[D].Jinan:Shandong University of Traditional Chinese Medicine, 2020.
[9] 薛丹. 皱皮木瓜多糖的制备及抗类风湿关节炎药理活性研究[D].上海:第二军医大学, 2015.XUE D.Preparation of Chaenomelis Fructus polysaccharides and anti-rheumatoid arthritis effect[D].Shanghai:Second Military Medical University, 2015.
[10] KANG J S, ZHAO X Y, LEE J H, et al.Ethanol extract of Chaenomeles sinensis inhibits the development of benign prostatic hyperplasia by exhibiting anti-oxidant and anti-inflammatory effects[J].Journal of Cancer Prevention, 2022, 27(1):42-49.
[11] CHEN J Y, SI M, WANG Y, et al.Ginsenoside metabolite compound K exerts anti-inflammatory and analgesic effects via downregulating COX2[J].Inflammopharmacology, 2019, 27(1):157-166.
[12] XU N, LEI H, LI X L, et al.Protective effects of Ginger Essential Oil (GEO) against chemically-induced cutaneous inflammation[J].Food Science and Technology, 2019, 39(suppl 2):371-377.
[13] 姚茹, 张锐虎, 王璐, 等.莲心碱对佛波酯所致耳肿胀炎症模型小鼠的抗炎作用及机制研究[J].中国药房, 2018, 29(17):2364-2368.YAO R, ZHANG R H, WANG L, et al.Anti-inflammatory effects of liensinine on TPA-induced ear edema inflammatory model mice and its mechanism study[J].China Pharmacy, 2018, 29(17):2364-2368.
[14] 王绍展, 朱青霞, 陈井霞, 等.异欧前胡素通过NF-κB和JAK1/STAT1信号通路抑制巨噬细胞M1极化发挥抗炎镇痛作用[J].中南药学, 2023, 21(8):1985-1990.WANG S Z, ZHU Q X, CHEN J X, et al.Anti-inflammation and analgesic effect of isoimperatorin on the polarization of macrophage M1 via NF-κB and JAK1/STAT1 signaling pathway[J].Central South Pharmacy, 2023, 21(8):1985-1990.
[15] XI X G, WEI X L, WANG Y F, et al.Determination of tea polysaccharides in Camellia sinensis by a modified phenol-sulfuric acid method[J].Archives of Biological Sciences, 2010, 62(3):669-676.
[16] 冯鑫, 夏宇, 陈贵堂, 等.生姜皮多糖的分离纯化及其结构组成分析[J].食品科学, 2017, 38(6):185-190.FENG X, XIA Y, CHEN G T, et al.Purification and structural analysis of polysaccharides from ginger peels[J].Food Science, 2017, 38(6):185-190.
[17] 刘涵, 张苗, 刘晓娟, 等.雨生红球藻多糖的分离纯化和免疫活性组分鉴定[J].食品科学, 2019, 40(2):52-58.LIU H, ZHANG M, LIU X J, et al.Isolation, purification and identification of immunologically active polysaccharides from Haematococcus Pluvialis[J].Food Science, 2019, 40(2):52-58.
[18] MOKNI GHRIBI A, SILA A, MAKLOUF GAFSI I, et al.Structural, functional, and ACE inhibitory properties of water-soluble polysaccharides from chickpea flours[J].International Journal of Biological Macromolecules, 2015, 75:276-282.
[19] 刘晓飞, 张宇, 王薇, 等.发芽糙米中粗多糖的纯化及分子量测定[J].食品工业科技, 2019, 40(2):19-24.LIU X F, ZHANG Y, WANG W, et al.Purification and molecular weight determination of polysaccharides in germinated brown rice[J].Science and Technology of Food Industry, 2019, 40(2):19-24.
[20] 周凯. 库尔勒香梨多糖结构鉴定及免疫调节活性与抗气道炎机制研究[D].乌鲁木齐:新疆医科大学, 2020.ZHOU K.Structure identification and immunoregulatory activity of polysaccharide from Pyrus sinkiangensis Yu.and its mechanism of anti-airway inflammation[D].Urumqi:Xinjiang Medical University, 2020.
[21] ZHANG Z S, WANG X M, LIU C B, et al.The degradation, antioxidant and antimutagenic activity of the mucilage polysaccharide from Dioscorea opposita[J].Carbohydrate Polymers, 2016, 150:227-231.
[22] 邵永斌, 郑一闯, 张竞怡, 等.益母草碱对LPS诱导小鼠子宫内膜炎的抗炎作用研究[J].中国畜牧兽医, 2023, 50(5):2149-2155.SHAO Y B, ZHENG Y C, ZHANG J Y, et al.Study on the anti-inflammatory effect of leonurine on LPS-induced endometritis in mice[J].China Animal Husbandry &Veterinary Medicine, 2023, 50(5):2149-2155.
[23] 王小兰, 段鹏飞, 杨梦, 等.生地黄多糖对环磷酰胺诱导的免疫抑制小鼠的免疫调节作用研究[J].上海中医药大学学报, 2021, 35(1):55-60; 92.WANG X L, DUAN P F, YANG M, et al.Study on immunomodulatory effects of Radix Rehmanniae Recens polysaccharide on cyclophosphamide-induced immunosuppression in mice[J].Academic Journal of Shanghai University of Traditional Chinese Medicine, 2021, 35(1):55-60; 92.
[24] 杨许花, 郭星晨, 陈红, 等.柳茶多糖对环磷酰胺诱导的免疫抑制小鼠的免疫调节及抗炎作用[J].动物营养学报, 2023, 35(3):2018-2029.YANG X H, GUO X C, CHEN H, et al.Immune regulation and anti-inflammatory effect of Sibiraea angustata polysaccharides on immunosuppressed mice induced by cyclophosphamide[J].Chinese Journal of Animal Nutrition, 2023, 35(3):2018-2029.