胡萝卜含有丰富的类胡萝卜素和功能活性物质,风味独特,是广大人民群众喜食的蔬菜之一[1]。脱水作为一种重要的加工工序被广泛应用于现代果蔬加工业,脱水胡萝卜片不仅耐贮藏可直接食用,也可作为二次加工的原料[2]。脱水胡萝卜片的质构及相关品质,如硬脆度、微观结构、复水特性、水分活度(water activity,Aw)及玻璃化转变温度等,是影响其品质和市场可接受度的重要因素。天然果胶是一种广泛存在于植物细胞壁和胞间层的重要功能物质,其结构特性与果蔬质构品质显著相关[3]。
加工操作单元会导致果胶特性的变化,进而影响胡萝卜片的质构品质。超高压(high hydrostatic pressure, HHP)处理技术,作为果蔬加工常用预处理技术,除具有钝酶、杀菌、保鲜等功能外,还能诱导果蔬中天然果胶物质组分和结构的转化。高压处理的芦笋中果胶组分之间相互转化,细胞壁中的果胶发生降解,果胶组分易与金属离子发生交联形成凝胶网状结构,增强细胞壁的强度[4]。果蔬物料中的果胶在超高压作用下会发生大量的酶促反应和非酶转化及结构降解,进而导致果蔬质构品质的变化[5]。研究表明,高压处理对质地的影响在很大程度上取决于植物类型、形态结构特征以及压力-温度-时间的组合,胡萝卜在100 MPa处理后硬度未发生显著变化,但当压力增大到200 MPa时硬度显著下降,压力在300 MPa时硬度最低,随后又呈上升趋势[6];草莓经高压250 MPa处理后细胞结构被直接破坏,呈现出不规则的结构[7]。目前,关于天然果胶对果蔬质构品质影响的研究多集中于新鲜果蔬、果蔬浆及果蔬汁等高含水量样品体系。超高压处理后的袋装黄桃在贮藏180 d后,果肉中的水溶性果胶(water soluble pectin,WSP)、碱溶性果胶(sodium carbonate soluble pectin,NSP)和总果胶含量下降,螯合性果胶(chelator soluble pectin,CSP)增加,果肉发生软化[8];超高压处理能够显著降低芒果浆中的WSP含量,从而导致芒果浆黏度、储存模量和损失模量的增加[9]。目前,关于果胶结构特性变化与脱水果蔬质构品质间的关系研究较少,XIAO等[10]研究了不同干燥温度和方式对果胶多糖的变化与脱水苹果片质构特性的影响,结果表明热脱水过程中导致WSP含量的下降,可提升样品干燥过程中黏弹性和可塑性,有助于形成稳定的多孔结构。上述研究虽能证明果胶组分变化与脱水果蔬质构之间存在相关性,但仍缺乏足够认知,相关机制亦不清楚。
本研究以胡萝卜为原料,探讨了不同超高压处理后热风脱水胡萝片质构及其相关品质变化,解析了超高压处理后热风脱水胡萝卜不同组分果胶相关特性,从果胶组分含量和结构特性变化的角度,探讨超高压诱导的脱水胡萝卜质构变化机制,以期为超高压调控热风脱水果蔬制品质构品质提供理论参考。
1 材料与方法
1.1 材料与试剂
市售新鲜胡萝卜(品种:黑田五寸,产地:山东),广东省广州市天河区农贸市场,4 ℃条件下贮存备用。
3-苯基苯酚(分析纯)、三氟乙酸,Sigma-Aldrich公司;乙醇氧化酶,上海源叶生物科技有限公司;溴化钾(光谱级), Pike Technologies Inc公司;2,4-戊二酮,Acros Organics 公司;3.5 kDa MWCO透析袋,湖南翊博生物科技有限公司;其他分析级试剂,中国国药集团化学试剂有限公司。
1.2 仪器与设备
SSH-57L超高压食品杀菌设备,山西三水河科技股份有限公司;InfiniteM200PRO 酶标仪,瑞士TECAN公司;SU8010电子扫描显微镜,日本日立公司;DSC8000差示量热扫描仪,美国PE公司;ICS5000+离子色谱、A-超高效聚合物色谱,美国赛默飞公司。
1.3 不同超高压-热风脱水胡萝卜片的制备
胡萝卜去皮后统一切成厚度10 mm,直径20 mm的圆片,装入聚乙烯袋中真空包装后置于超高压设备中,压力范围为100~500 MPa,处理时间5 min,压力间隔200 MPa。以未经超高压处理的胡萝卜样品为对照,所有样品于65 ℃、风速2.1 m/s条件下脱水至含水量低于8.0%。所有样品于4 ℃条件下避光保存。
1.4 基础理化指标的测定
1.4.1 水分含量和活度的测定
样品水分含量依据GB 5009.3—2016《食品安全国家标准 食品中水分的测定》测定;Aw采用水分活度仪测定,测前用饱和KCl溶液(Aw=0.843)单点校准。
1.4.2 硬度的测定
采用物性测定仪,P/36圆柱形探头,40%压缩测试,探头测试前、测试中、测试后速度分别为2.0、1.0、1.0 mm/s,其中样品压缩至40%时的最大值定义为样品硬度。
1.4.3 复水比的测定
参考孙鹏伟等[11]的方法,将10 g脱水胡萝卜片置于100 mL蒸馏水中,室温下复水30 min后取出,去除表面水分,称量。计算如公式(1)所示:
(1)
式中:RR,复水比;m0、mr,复水之前和之后的样品质量,g。
1.4.4 扫描电子显微镜
将鲜样及超高压处理后胡萝卜样品切成5 mm×5 mm×5 mm大小的正方体,置于体积分数4%的戊二醛溶液中固定6 h,真空抽气0.5 h,用0.2 mol/L 的磷酸钠缓冲溶液清洗3次后乙醇梯度脱水,用CO2临界干燥后将上述制备样品与热风脱水后样品用单刃刀片切取适当大小后置于有导电胶的载物台上,喷金后置于扫描电镜下观察胡萝卜组织微观结构。
1.4.5 玻璃化转变温度(Tg)的测定
采用差示扫描量热仪(differential scanning calorimeter,DSC)来测定胡萝卜的Tg,具体参考杨忻瑞等[12]的方法,将5~7 mg的样品置于坩埚中并用铝盖密封,以空坩埚作为对照。样品温度以10 ℃/min的速度由室温冷却至-70 ℃,平衡5 min后以10 ℃/min的速度加热至100 ℃。通过热分析获得样品玻璃化转变的起始(Tgi)、中间(Tgm)和结束(Tge)温度,以Tgm作为样品的Tg。
1.5 果胶甲酯酶(pectin methylesterase,PME)与多聚半乳糖醛酸酶(polygalacturonase,PG)活力的测定
1.5.1 PME活性测定
参考LY-NGUYEN等[13]的方法,将100 g新鲜的胡萝卜加入200 mL 0.2 mol/mL的Tris-HCL缓冲溶液打浆,4 ℃条件下提取12 h后抽滤,滤液于10 000 r/min离心20 min,即得PME酶液;脱水后的胡萝卜取10 g,按照相同步骤处理。通过在pH 7.5、30 ℃条件下测量酸的释放作时间函数来测定PME活力。采用滴定法,在60 mL质量浓度为10 mg/mL果胶溶液中加入0.5 mL酶液,置于30 ℃的水浴锅中水解,用0.01 mol/mL 的NaOH溶液滴定,维持在pH 7.5左右,记录15 min内NaOH溶液的消耗体积,以NaOH溶液随时间消耗的速率来表示酶活力,数值为对照样品百分比。
1.5.2 PG活力测定
参考BALOGH等[14]的方法,按1∶10的质量比加入0.2 mol/ L pH 8.0的Tris-HCl缓冲溶液(含1 mol/L NaCl)混合打浆,置于4 ℃冰箱中提取18 h,于10 000 r/min离心15 min,上清液即为粗酶液。采用3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS)比色法测定其酶活力,取两根相同的有刻度的试管,分别加入1 mL pH 5.5的醋酸钠缓冲溶液和1 mL质量分数1%的多聚半乳糖醛酸溶液作为底物,将0.5 mL粗酶液加入以多聚半乳糖醛酸作为底物的试管中,再加入0.5 mL醋酸钠缓冲溶液于另一个试管中作为对照,混匀,置于37 ℃水浴锅中1 h,后加入1.5 mL DNS溶液终止反应,沸水浴中反应5 min,放入冰块中降温,用蒸馏水在25 mL容量瓶中定容,于540 nm波长处测定吸光度值,以单位质量1 h释放1 mg D-半乳糖醛酸作为1个酶活力单位,按公式计算PG相对酶活力。
1.6 果胶特性分析
1.6.1 醇不溶物质(alcohol insoluble residue, AIR)的制备和果胶的提取
参考曹风等[15]的方法稍作修改,将不同超高压-热风脱水后的样品粉碎后过60目筛,准确称量3.0 g样品置于250 mL Schott瓶中,加入90 mL体积分数为95%乙醇并分散3 min,将悬浮液抽滤,向滤渣中再次加入90 mL体积分数为95%乙醇进行二次分散过滤。随后,向残渣中加入50 mL丙酮分散3 min后抽滤,所得残渣于40 ℃热风烘干箱至恒重,即制得AIR。
称取0.5 g AIR于250 mL Schott瓶中,加入90 mL 100 ℃蒸馏水,于沸水浴中搅拌提取5 min,冷却后抽滤,滤液采用3 500 Da透析袋蒸馏水透析72 h后冻干即得WSP;残渣溶解于0.05 mol/L的1,2-环己二胺四乙酸溶液,于28 ℃条件下水浴振荡6 h,滤液依次用0.1 mol/L NaCl和蒸馏水透析36 h,冻干即得CSP;剩余残渣溶解于100 mL 0.05 mol/L Na2CO3和0.02 mol/L NaBH4混合溶液中于4 ℃下保温16 h,随后于28 ℃水浴振荡6 h,滤液经蒸馏水透析72 h后,冻干得NSP。所得样品于干燥器中贮存备用。
1.6.2 半乳糖醛酸(galacturonic acid,GalA)含量的测定
根据何媛[16]的方法稍作修改,采用分光光度法测果胶样品中GalA含量。准确称量10 mg果胶样品于20 mL烧杯中,在冰浴条件下加入8 mL的浓硫酸和2 mL蒸馏水用磁力搅拌水解5 min,再加入2 mL蒸馏水水解60 min后定容到25 mL备用。取0.6 mL水解样品于玻璃试管中,在冰浴下加入3.6 mL 0.012 5 mol/L四硼酸钠-硫酸溶液,涡旋30 s,100 ℃水浴5 min,冰水降温后加入60 μL的3-苯基苯酚涡旋30 s,在520 nm处测定吸光值。以质量分数0.5%NaOH溶液代替3-苯基苯酚作空白,以GalA为标品绘制标曲,结果以 mg GalA/g AIR 表示。
1.6.3 中性糖的测定
参考ZHU等[17]的方法,称取3.0 mg果胶样品,加入1 mL 2 mol/L三氟乙酸溶液,121 ℃水解2 h后N2吹干,加入99.99%甲醇清洗再吹干,重复3次,加入无菌水溶解定容后转入色谱瓶中待测。采用Thermo ICS 5000+离子色谱系统进行检测,色谱柱DionexTM CarboPacTM PA20(150 mm×3.0 mm,10 μm),脉冲安培检测器,进样量5 μL,流动相A(H2O),流动相B(0.1 mol/L NaOH),流动相C(0.1 mol/L NaOH,0.2 mol/L NaAc),流速0.5 mL/min,柱温30 ℃。
1.6.4 酯化度(degree of methylation,DM)的测定
果胶DM定义为甲醇与半乳糖醛酸摩尔比值。甲醇含量参考SILA等[18]的方法测定,采用NaOH溶液对果胶样品酯键进行皂化水解。吸取1 mL水解样品与1 mL 1 U/mL乙醇氧化酶反应,旋涡30 s后于25 ℃水浴15 min,加入2 mL戊二酮溶液(20 mmol/L 2,4-戊二酮、2.0 mol/L乙酸铵和 50 mmol/L乙酸混合液),混匀后58 ℃水浴15 min,冷却旋涡后于412 nm下测定吸光度。标准曲线采用1.0~32 μg/mL甲醇制作,以甲醇浓度为横坐标,吸光度值为纵坐标,绘制标准曲线。
1.6.5 分子质量的测定
采用超高效聚合物色谱仪测定果胶分子质量。准确称量10 mg果胶样品,溶解于10 mL蒸馏水中,过0.22 μm膜后,色谱柱为ACQUITY APC AQ系列水溶性色谱柱,进样量20 μL,流动相为超纯水,流速1 mL/min。
1.7 统计分析
采用SPSS 2016和Origin 2022软件进行数据统计分析和绘图,样品间的差异检验采用Duncan法,P<0.05为差异显著;无特别说明,试验均重复3次,结果以“平均数±标准差”表示。
2 结果与讨论
2.1 不同超高压处理对胡萝卜质构及其相关品质的影响
不同超高压处理对热风脱水胡萝卜水分含量、Aw、Tg、复水比和硬度的影响如表1所示,不同超高压处理对热风脱水胡萝片水分含量、Tg及复水比的影响均不显著(P>0.05),但其Aw因水分含量的差异,表现出显著性差异(P<0.05),经100、500 MPa处理组胡萝卜样品Aw显著高于其他处理组,总体而言所有样品含量和Aw均控制在安全范围内。
表1 不同超高压热风脱水胡萝卜质构及其相关品质
Table 1 Texture and related characteristics of the dehydrated carrots pretreated with different high hydrostatic pressure
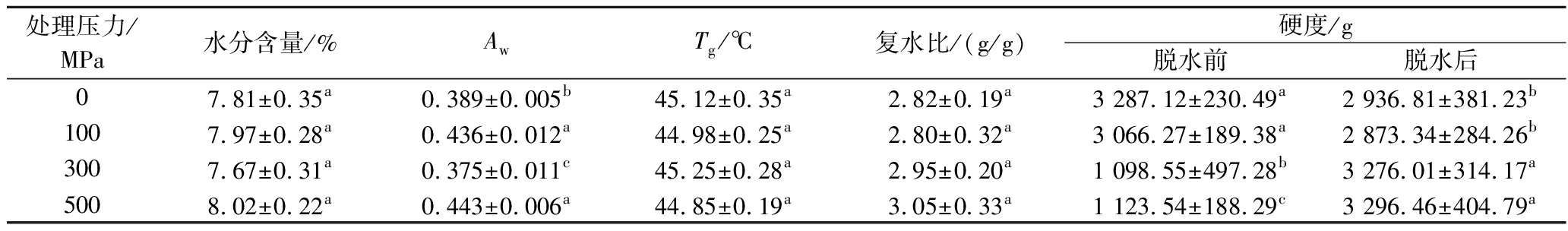
处理压力/MPa水分含量/%AwTg/℃复水比/(g/g)硬度/g脱水前脱水后07.81±0.35a0.389±0.005b45.12±0.35a2.82±0.19a3 287.12±230.49a2 936.81±381.23b1007.97±0.28a0.436±0.012a44.98±0.25a2.80±0.32a3 066.27±189.38a2 873.34±284.26b3007.67±0.31a0.375±0.011c45.25±0.28a2.95±0.20a1 098.55±497.28b3 276.01±314.17a5008.02±0.22a0.443±0.006a44.85±0.19a3.05±0.33a1 123.54±188.29c3 296.46±404.79a
注:同一列数据肩标不同小写字母表示差异显著(P<0.05)(下同)。
硬度方面,经超高压处理后胡萝卜片脱水前硬度整体呈下降趋势,经100 MPa处理组硬度损失不显著(P>0.05),经300、500 MPa处理组硬度分别下降至未处理组的33.42%和34.18%,这与孙雅馨等[6]在超高压对贮藏期胡萝卜软化机制中的研究结果基本一致。经热风脱水后胡萝卜片硬度整体呈上升趋势,300、500 MPa处理组样品硬度显著高于未经超高压处理组样品(P<0.05),分别上升了11.55%和12.25%;但300、500 MPa处理组之间,100 MPa和未处理组之间差异不显著(P>0.05)。谭宏渊等[19]在不同预处理对热风干燥山药片品质特性及微观结构的研究中发现,超高压预处理后导致热风干燥山药片硬度上升,与本研究结果类似。
2.2 不同超高压处理对胡萝卜组织微观结构的影响
如图1所示,经不同超高压处理胡萝卜微观组织结构在热风脱水前后均存在显著差异。脱水前,未经超高压处理胡萝卜组织细胞呈规则排列且细胞大小均匀,细胞壁清晰可见(图1-a);超高压处理后细胞组织在压力的作用后呈现不规则变化,部分细胞组织开始形变或塌陷,细胞壁黏合,形成大小不均,形状各异的细胞组织结构(图1-b和图1-c),随着压力增大,孔隙被不断压缩,经500 MPa超高压处理后胡萝卜组织明显较其他样品致密(图1-d)。热风脱水后胡萝卜样品微观结构较脱水前发生显著性变化,所有样品组织因脱水的过程会导致组织的收缩,变得更为致密;随着压力增大,胡萝卜样品微观结构致密程度增加,经300、500 MPa处理后的脱水胡萝卜样品中仅能观察到部分微小孔隙(图1-g和图1-h)。样品的微观结构特性与硬脆度显著相关,致密的微观结构是导致样品硬度升高的重要因素之一,这与前文样品硬度随超高压力的升高和增大结果一致。

a~d-脱水前经0、100、300、500 MPa处理样品;e~h-脱水后经0、100、300、500 MPa处理的样品
图1 不同超高压处理热风脱水前后胡萝卜组织的微观结构
Fig.1 Microstructure of the different high hydrostatic pressure pretreated carrot tissues before and after dehydration
2.3 不同压力处理对PG和PME的影响
PG和PME是作用于细胞壁中果胶物质的重要酶[20]。如图2-a所示,不同超高压处理胡萝卜在热风脱水前后PG活力呈先升后降趋势,300 MPa处理的胡萝卜中PG活力较未处理组提高18.76%;脱水后,未处理组样品PG活力降低至脱水前的70%,且经超高压处理样品PG活力下降幅度大于未处理组,这可能是因为PG具有一定程度的耐热性[21],但超高压处理后PG的耐热特性下降。不同压力处理的PME活力如图2-b所示,作为一种耐压酶,脱水前不同压力处理后样品PME活力均显著高于未处理样品(P<0.05),其中300 MPa处理的PME活力最高,较未处理组高28.36%,表明所选100~500 MPa压力对胡萝卜中PME均有激活作用;类似的研究结果同样在莴笋中有发现,采用100、300 MPa处理芦笋时,其PME活力略有升高但影响不显著,压力升至500 MPa时活力显著增加[22]。有研究发现,在芒果、木瓜和番茄成熟过程中PG能够分解CSP组分的主链,导致果实的软化[23];而PME能使果胶去甲酯化生成果胶酸,降低果胶脂化度,提升PG分解果胶的速率[20]。PME和PG活力的变化会引起细胞壁中果胶含量和酯化度的变化,细胞壁结构遭到破坏,导致超高压处理后的胡萝卜硬度变低,这种脱水前硬度的降低、组织的破坏以及细胞壁果胶物质的降解,这可能是热风脱水后胡萝卜硬度增加的重要原因。为证明推测,将对超高压处理后热风脱水胡萝卜果胶含量、组成比例和结构特性进行进一步解析。
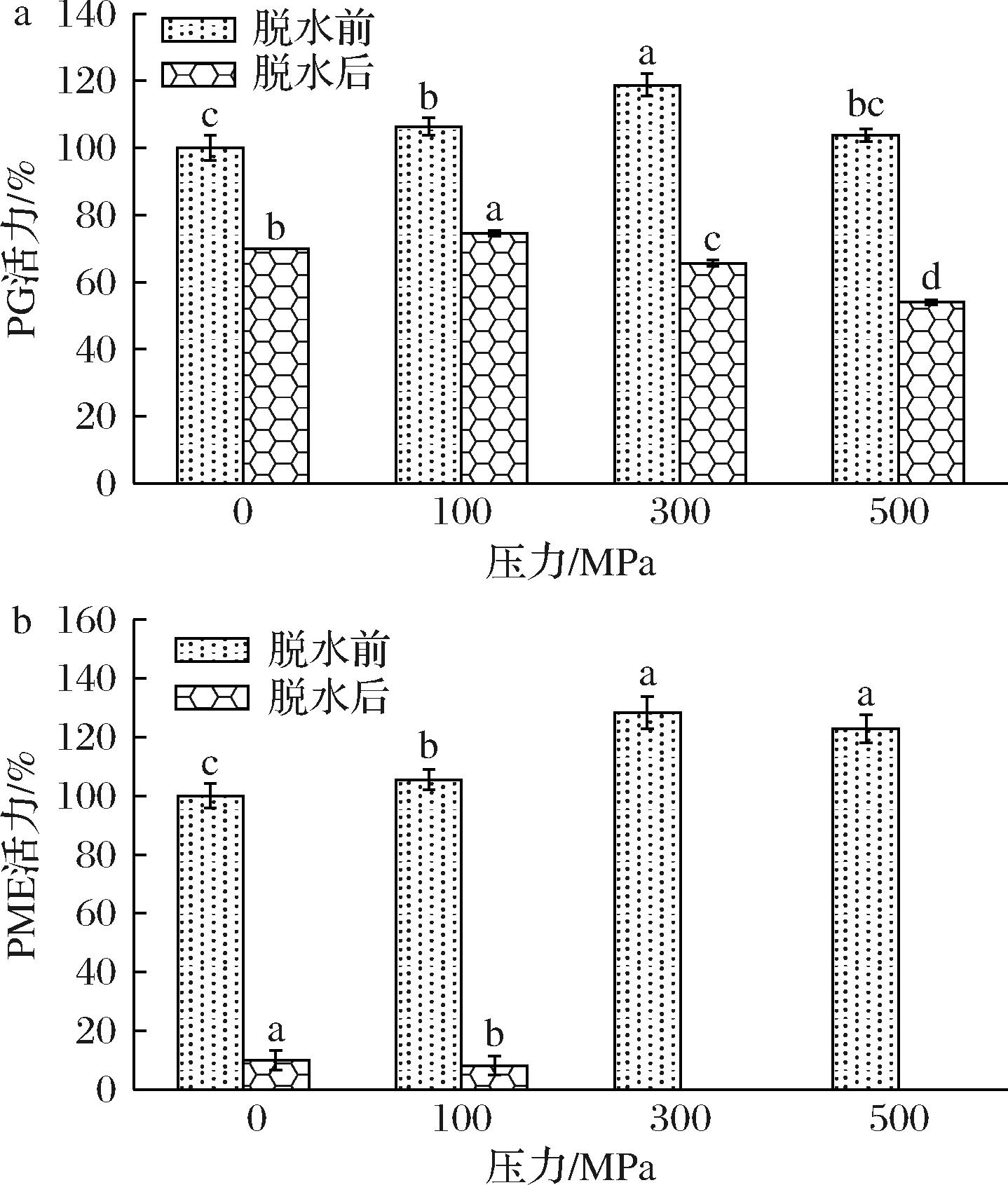
a-PG;b-PME
图2 不同超高压处理脱水前后胡萝卜PME和PG活力
Fig.2 PME and PG enzyme activities of the different high hydrostatic pressure pretreated carrots before and after dehydration
2.4 不同压力对GalA和中性糖含量的影响
超高压处理对热风脱水的胡萝卜果胶组分WSP、CSP和NSP中GalA含量影响显著(表2),3种果胶组分GalA含量随着压力的变化均呈现先升高后下降的趋势,在100 MPa处理组中含量最高。3种果胶组分中,NSP组分GalA含量最高,WSP组分GalA的含量最低,上述结果与作者前期关于不同组织部位胡萝卜果胶特性的研究结果一致[24]。总体而言,当压力≥300 MPa时,样品中GalA的显著降低,表明果胶物质发生了显著降解。
表2 不同超高压处理热风脱水后胡萝卜果胶单糖组成
Table 2 Monosaccharide composition of pectin extracted from the dehydrated carrot pretreated with different high hydrostatic pressure
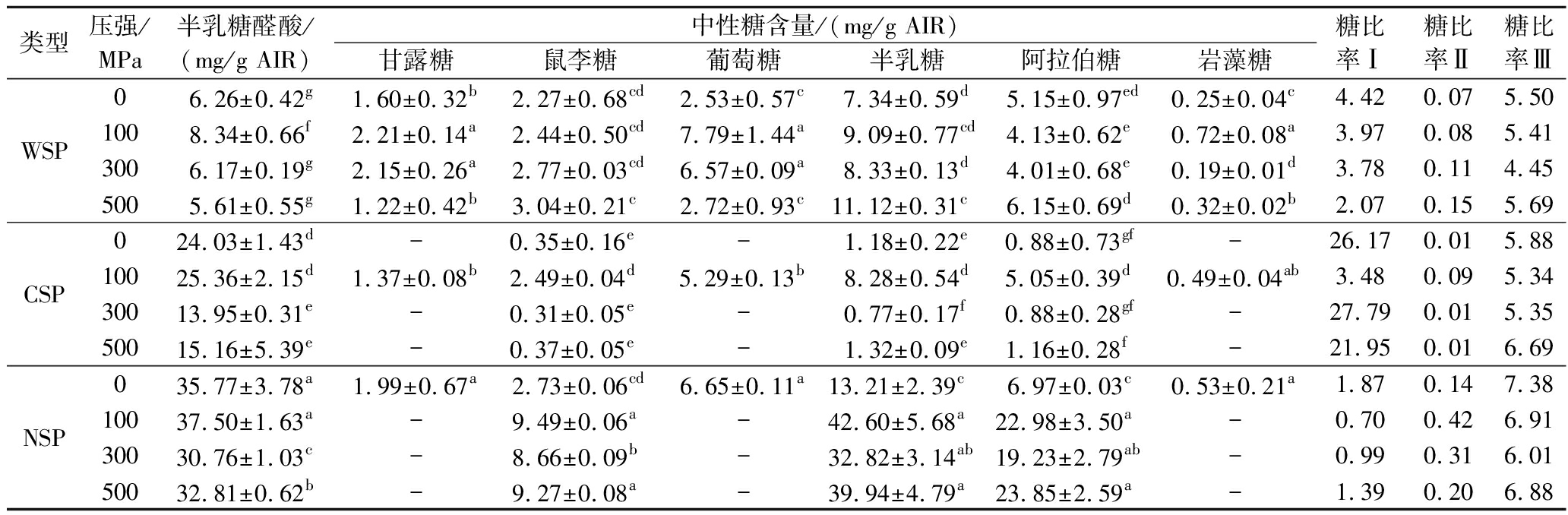
类型压强/MPa半乳糖醛酸/(mg/g AIR)中性糖含量/(mg/g AIR)甘露糖鼠李糖葡萄糖半乳糖阿拉伯糖岩藻糖糖比率Ⅰ糖比率Ⅱ糖比率ⅢWSP06.26±0.42g1.60±0.32b2.27±0.68cd2.53±0.57c7.34±0.59d5.15±0.97ed0.25±0.04c4.420.075.501008.34±0.66f2.21±0.14a2.44±0.50cd7.79±1.44a9.09±0.77cd4.13±0.62e0.72±0.08a3.970.085.413006.17±0.19g2.15±0.26a2.77±0.03cd6.57±0.09a8.33±0.13d4.01±0.68e0.19±0.01d3.780.114.455005.61±0.55g1.22±0.42b3.04±0.21c2.72±0.93c11.12±0.31c6.15±0.69d0.32±0.02b2.070.155.69CSP024.03±1.43d-0.35±0.16e -1.18±0.22e0.88±0.73gf-26.170.015.8810025.36±2.15d1.37±0.08b2.49±0.04d5.29±0.13b8.28±0.54d5.05±0.39d0.49±0.04ab3.480.095.3430013.95±0.31e-0.31±0.05e-0.77±0.17f0.88±0.28gf-27.790.015.3550015.16±5.39e-0.37±0.05e-1.32±0.09e1.16±0.28f-21.950.016.69NSP035.77±3.78a1.99±0.67a2.73±0.06cd6.65±0.11a13.21±2.39c 6.97±0.03c0.53±0.21a1.870.147.3810037.50±1.63a-9.49±0.06a-42.60±5.68a22.98±3.50a-0.700.426.9130030.76±1.03c-8.66±0.09b-32.82±3.14ab19.23±2.79ab-0.990.316.0150032.81±0.62b-9.27±0.08a-39.94±4.79a23.85±2.59a-1.390.206.88
注:糖比率Ⅰ:半乳糖醛酸/(岩藻糖+鼠李糖+阿拉伯糖+半乳糖+木糖);糖比率Ⅱ:鼠李糖/半乳糖醛酸;糖比率Ⅲ:(阿拉伯糖+半乳糖)/鼠李糖,-表示未检出。
果胶是以聚半乳糖醛酸为主链和各类中性糖为侧链组成的聚合物,不同组分中性糖含量的变化可表明其结构的变化。不同压力处理的3种果胶组分中性糖含量如表2所示,半乳糖、鼠李糖、阿拉伯糖是所有3组果胶组分中最主要的中性糖,这3种中性糖以侧链的形式连接在果胶的主链,形成“毛状区”。NSP组分中鼠李糖和阿拉伯糖含量均显著高于其他中性糖含量,表明NSP组分均含有更为丰富的以阿拉伯聚糖形式或鼠李半乳糖醛酸聚糖形式存在的果胶支链,且经超高压处理后,NSP组分中半乳糖、鼠李糖和阿拉伯糖含量显著高于未处理组(P<0.05),表明超高压处理明显增加了NSP组分的侧链数量;不同的是,经300、500 MPa处理样品中CSP组分中半乳糖、鼠李糖和阿拉伯糖含量较100 MPa处理组显著减少,表明较100 MPa处理组,300、500 MPa处理样品中CSP侧链发生了显著降解(P<0.05)。
通过糖比率可以了解部分果胶的结构特性,糖比率I表示果胶的线性度,糖比率Ⅱ代表支链结构(RG)对果胶组分的贡献度,糖比率Ⅲ是I型支链结构(RG-I)与鼠李糖的比例,可表示RG-I分支的程度,不同果胶组分糖比率结果见表3。3种果胶中CSP组分糖比率I最高,其次是WSP和NSP组分,表明CSP组分具有最高的线性度。随着压力的增大,WSP中糖比率I下降,CSP和NSP中则呈先下降后上升趋势,表明超高压处理后WSP线性度下降,CSP和NSP经100 MPa处理之后线性度下降,后随着压力的升高线性度回升。由糖比率Ⅱ可知,RG在NSP果胶组分的贡献度远高于WSP和CSP组分,且随着压力的增大,呈先上升后下降趋势。所有果胶组分中RG-I分支的程度普遍较高(糖比率Ⅲ),NSP组分中RG-I分支的程度略高于WSP和CSP组分,说明NSP组分中存在更多的RG-I结构。上述,由超高压引起的胡萝卜果胶链的结构变化,例如当压力超过300 MPa 时CSP和NSP组分RG支链程度的显著下降,更有利于果胶组分与金属离子等其他组分结合形成稳定结构[3],在胡萝卜脱水后失去果胶支链支撑起的弹性空间,而导致300、500 MPa处理后的胡萝卜片硬度高于未处理组和100 MPa处理组(表1)。
表3 不同超高压处理热风脱水胡萝卜果胶平均分子质量
Table 3 Average molecular weight of pectin extracted from the dehydrated carrot pretreated with different high hydrostatic pressure

压力/MPaWSPMw/kDaCSPMw/kDaNSPMw/kDa0356.2931.70336.53100257.0229.88343.30300170.5625.30301.4750015.4726.92299.05
2.5 不同压力处理对果胶含量的影响
不同超高压处理热风脱水后胡萝卜果胶含量为WSP、CSP和NSP果胶组分中半乳糖醛酸与其他中性糖的总和,结果如图3-a所示,未经超高压处理样品果胶含量最低为196.13 mg/g AIR,经100 MPa处理组中果胶组分含量最高达342.26 mg/g AIR;随着压力的增大,果胶含量呈先上升后降低再升高的趋势。进一步分析了不同超高压处理样品中果胶组分相对含量(图3-b),发现经300、500 MPa处理样品中,CSP比例出现显著下降,NSP比例出现显著上升,表明当处理压力≥300 MPa时,可能导致CSP与NSP之间发生转化,这与SUN等[25]发现采用400 MPa处理胡萝卜会导致NSP含量显著提升的研究结果一致。NSP组分是通过共价键与细胞壁结合的一类果胶物质[15],结合稳定紧密,超高压后NSP含量的上升,有助于胡萝卜细胞壁物质之间结合,从而导致脱水胡萝卜片硬度增加。
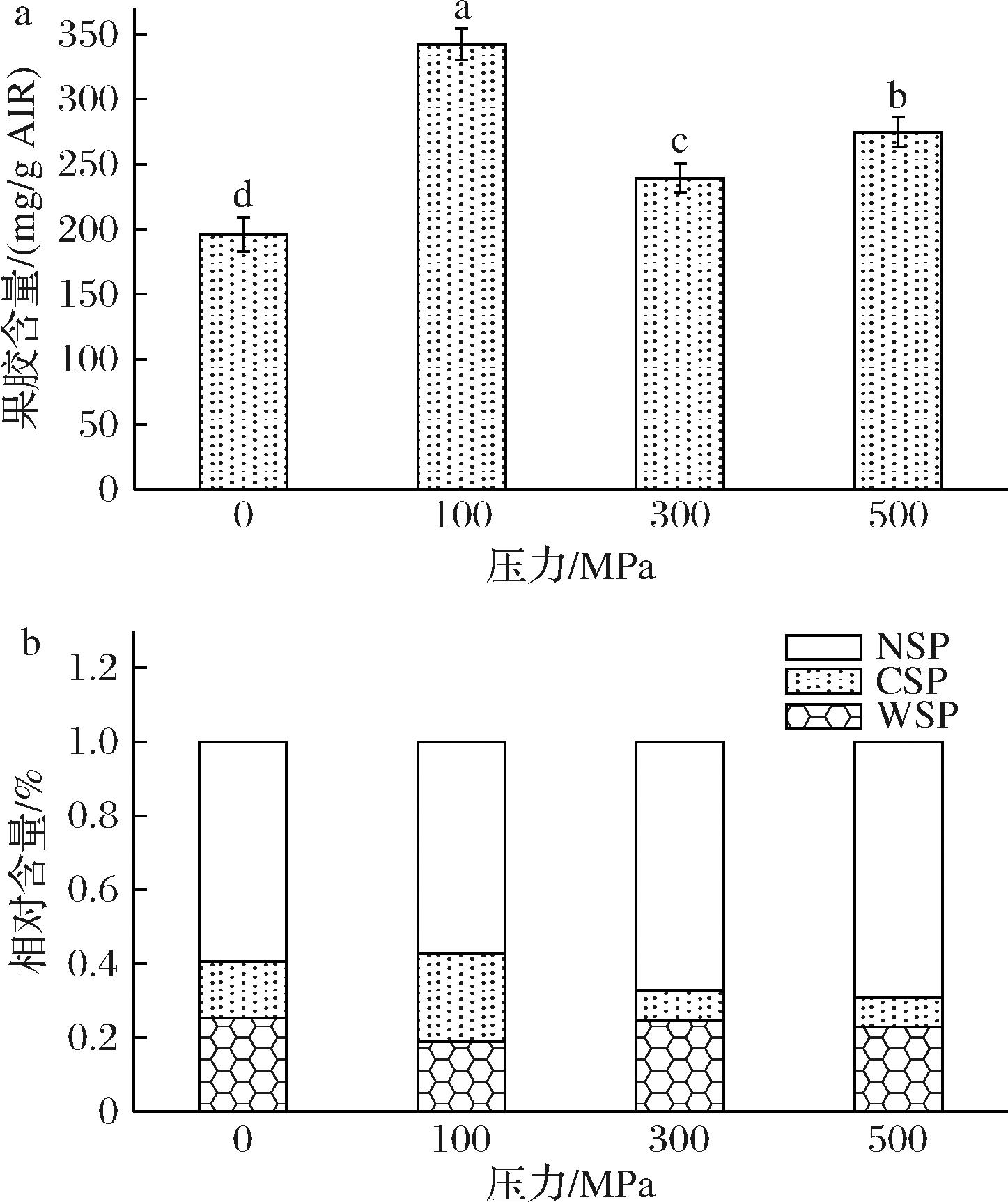
a-果胶含量;b-果胶组分的相对含量
图3 不同超高压力处理热风脱水胡萝卜果胶含量
Fig.3 Pectin content of the dehydrated carrot pretreated with different high hydrostatic pressure
2.6 不同压力处理对果胶DM的影响
果胶的DM直接影响果胶分子间的氢键作用,进而影响果蔬的质构特性[26]。在NSP提取过程中,其甲氧基被碱液破坏,因此仅测定WSP和CSP果胶组分的酯化度,结果如图4。未经超高压处理的WSP组分DM值为67.55%,属高甲氧基果胶;CSP组分DM值为49.24%,属低甲氧基果胶;随着超高压处理压力的增加,WSP和CSP组分DM值逐渐下降,当压力升至500 MPa时,DM分别降为53.10%和40.43%。在所选超高压条件下,果胶甲基酯酶被激活,导致果胶组分酯化度降低,低酯化度的条件下果胶和金属离子更容易发生交联形成稳定的网状结构[27],从而有利于维持胡萝卜的硬度。
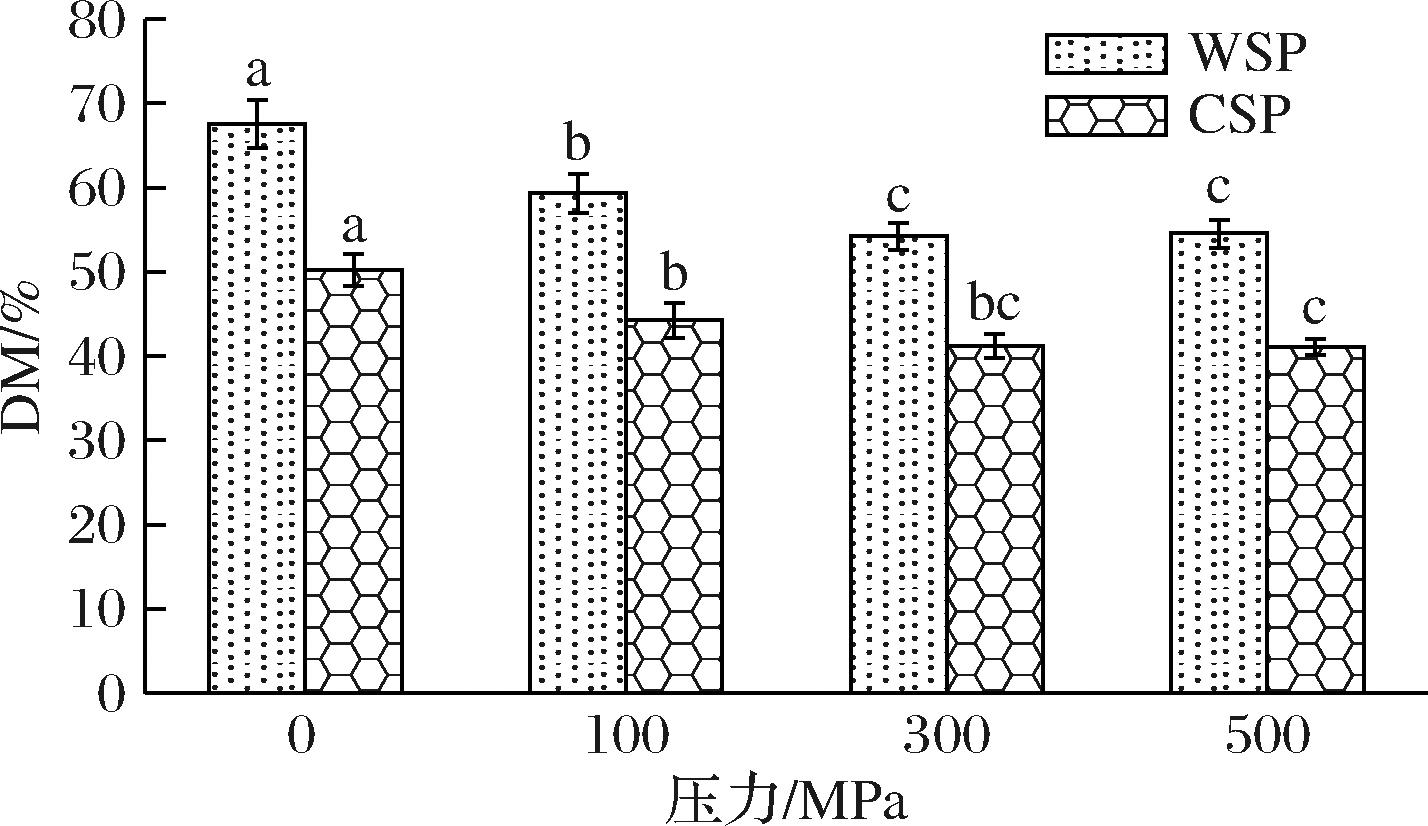
图4 不同超高压力处理对热风脱水胡萝卜果胶甲酯化度
Fig.4 Degree of methylation of pectin extracted from the dehydrated carrot pretreated with different high hydrostatic pressure
2.7 不同压力处理对果胶分子质量的影响
不同超高压处理热风脱水后胡萝卜果胶分子质量如图5所示,未经超高压处理组WSP平均分子质量为356.29 kDa,随着压力的增大,峰值发生了显著右移,经500 MPa处理后,其分子质量降低至15.47 kDa(表3),这主要是因为WSP通过非共价键和非离子键松散的结合在细胞壁上[28],在超高压作用下易发生键断裂,发生解聚,分子质量显著降低。CSP组分出峰时间在超高压处理后发生了部分右移,当超高压力≥ 300 MPa时,其平均分子质量明显<100 MPa和未处理组,表明较大压力下CSP发生了部分降解。与CSP类似,NSP组分在较大超高压作用下,同样也会发生一定程度的降解。果胶分子质量的下降会导致果胶与其他物质间的交联减弱,而导致超高压处理后的新鲜果蔬硬度的损失[29]。然而,在本文研究的胡萝卜样品中,果胶组分的降解,所产生的低分子多糖填充在胡萝卜组织细胞间隙,类似于低聚糖、果胶等物质渗透至物料中,经脱水后反而会导致样品硬度的增加[30]。

a-WSP;b-CSP;c-NSP
图5 不同超高压处理热风脱水胡萝卜果胶分子质量分布
Fig.5 Molar mass distribution of pectin extracted from the dehydrated carrot pretreated with different high hydrostatic pressure
3 结论
不同超高压预处理对胡萝卜片质构特性影响显著,当压力≥300 MP时,超高压预处理的胡萝卜片硬度较100 MPa和未处理组显著下降,而经热风干燥后则显著上升。通过微观结构分析,超高压导致的胡萝脱水前组织结构的塌陷和脱水后组织结构的收缩是导致样品硬度升高的重要因素之一。超高压预处理后胡萝卜中PME和PG活力呈先上升后下降趋势,酶活力的变化引起细胞壁中果胶酯化度和含量的下降,从而影响脱水后胡萝卜质构特性。超高压预处理脱水胡萝卜中,CSP和NSP组分中性糖含量及糖比率的变化显示其发生降解,支链比率减少;果胶组分间发生相互转化,在300、500 MPa预处理胡萝卜中NSP比例上升,WSP和CSP组分甲酯化度下降。上述超高压处理引起的胡萝卜果胶特性变化,会导致果胶组分与细胞壁物质、金属离子形成稳定共价结合,提高脱水胡萝卜片硬度。同时,超高压会引起果胶断链、分子量下降,形成低聚果胶多糖,填充在胡萝卜组织间隙,也会增加脱水胡萝卜片硬度。
[1] 巨浩羽, 邹燕子, 肖红伟, 等.相对湿度对胡萝卜热风干燥过程中水分迁移和蒸发的影响[J].农业工程学报, 2023, 39(1):232-240.JU H Y, ZOU Y Z, XIAO H W, et al.Effects of relative humidity on water diffusion and evaporation during hot air drying of carrot[J].Transactions of the Chinese Society of Agricultural Engineering, 2023, 39(1):232-240.
[2] 朱洪梅, 王禹心, 刘喻心, 等.胡萝卜脆片冻干过程中水分、微观结构及品质变化[J].食品研究与开发, 2022, 43(11):42-48.ZHU H M, WANG Y X, LIU Y X, et al.Changes in the moisture, microstructure and quality of carrot chips during freeze-drying[J].Food Research and Development, 2022, 43(11):42-48.
[3] 易建勇, 吕健, 毕金峰, 等.果胶分子结构与功能关系的研究进展[J].中国食品学报, 2017, 17(9):175-181.YI J Y, LYU J, BI J F, et al.Research process of structure and function relationship of pectin in processed fruits and vegetables[J].Journal of Chinese Institute of Food Science and Technology, 2017, 17(9):175-181.
[4] 冯海红. 高静压处理对绿芦笋生理特性和贮藏品质的影响研究[D].秦皇岛:河北科技师范学院, 2016.FENG H H.The study on the effect of high hydrostatic pressure processing on physiology and storage quality of green asparagus spears[D].Qinhuangdao:Hebei Normal University of Science &Technology, 2016.
[5] JOLIE R P, CHRISTIAENS S, DE ROECK A, et al.Pectin conversions under high pressure:Implications for the structure-related quality characteristics of plant-based foods[J].Trends in Food Science &Technology, 2012, 24(2):103-118.
[6] 孙雅馨, 康旭蕾, 梁栋, 等.超高压对鲜切胡萝卜硬度的影响及机制研究[J].食品工业科技, 2017, 38(11):200-204; 208.SUN Y X, KANG X L, LIANG D, et al.Study on effect and mechanism of high pressure processing on hardness of fresh-cut carrot[J].Science and Technology of Food Industry, 2017, 38(11):200-204; 208.
[7] ZHANG L H, QIAO Y, WANG C, et al.Influence of high hydrostatic pressure pretreatment on properties of vacuum-freeze dried strawberry slices[J].Food Chemistry, 2020, 331:127203.
[8] ZHANG F S, DONG P, FENG L, et al.Textural changes of yellow peach in pouches processed by high hydrostatic pressure and thermal processing during storage[J].Food and Bioprocess Technology, 2012, 5(8):3170-3180.
[9] LIU F X, WANG Y T, BI X F, et al.Comparison of microbial inactivation and rheological characteristics of mango pulp after high hydrostatic pressure treatment and high temperature short time treatment[J].Food and Bioprocess Technology, 2013, 6(10):2675-2684.
[10] XIAO M, YI J Y, BI J F, et al.Modification of cell wall polysaccharides during drying process affects texture properties of apple chips[J].Journal of Food Quality, 2018, 2018(1):4510242.
[11] 孙鹏伟, 刘娅妮, 高虹, 等.γ射线辐照对大米食用品质及淀粉理化特性的影响[J].食品科学, 2024, 45(13):210-219.UN P W, LIU Y N, GAO H, et al.Effect of γ-ray irradiation on eating quality of rice and physicochemical properties of rice starch[J].Food Science, 2024, 45(13):210-219.
[12] 杨忻瑞, 毕金峰, 陈芹芹, 等.无定形态小分子糖对枣粉水分吸附及玻璃化转变的影响[J].中国食品学报, 2022, 22(11):65-76.YANG X R, BI J F, CHEN Q Q, et al.Effect of amorphous small molecule sugars on water adsorption and glass transition of jujube powder[J].Journal of Chinese Institute of Food Science and Technology, 2022, 22(11):65-76.
[13] LY-NGUYEN B, VAN LOEY A M, FACHIN D, et al.Partial purification, characterization, and thermal and high-pressure inactivation of pectin methylesterase from carrots (Daucus carrota L.)[J].Journal of Agricultural and Food Chemistry, 2002, 50(19):5437-5444.
[14] BALOGH T, SMOUT C, NGUYEN B L, et al.Thermal and high-pressure inactivation kinetics of carrot pectinmethylesterase:From model system to real foods[J].Innovative Food Science &Emerging Technologies, 2004, 5(4):429-436.
[15] 曹风, 刘璇, 毕金峰, 等.均细化处理对苹果细胞壁多糖结构特性的影响[J].中国食品学报, 2020, 20(10):96-104.CAO F, LIU X, BI J F, et al.Effects of refining treatments on the structural characteristics of apple alcohol-insoluble residue[J].Journal of Chinese Institute of Food Science and Technology, 2020, 20(10):96-104.
[16] 何媛. 秋葵果胶多糖的降解、结构特征、生物活性及其体外粪便发酵特性的研究[D].绵阳:四川农业大学, 2022.HE Y.Degradation, structural characterization, bioactivity and in vitro fecal fermentation properties of okra pectin polysaccharides[D].Mianyang:Sichuan Agricultural University, 2022.
[17] ZHU M Q, HUANG R M, WEN P, et al.Structural characterization and immunological activity of pectin polysaccharide from kiwano (Cucumis metuliferus) peels[J].Carbohydrate Polymers, 2021, 254:117371.
[18] SILA D N, SMOUT C, ELLIOT F, et al.Non-enzymatic depolymerization of carrot pectin:Toward a better understanding of carrot texture during thermal processing[J].Journal of Food Science, 2006, 71(1):E1-E9.
[19] 谭宏渊, 凌玉钊, 黄丽琪, 等.不同预处理对热风干燥山药片品质特性及微观结构的影响[J].食品工业科技, 2023, 44(20):43-52.TAN H Y, LING Y Z, HUANG L Q, et al.Effects of different pretreatment on the quality characteristics and microstructure of hot air dried yam slices[J].Science and Technology of Food Industry, 2023, 44(20):43-52.
[20] 古佩娴, 刘声鹏, 黄超, 等.猕猴桃软化过程中细胞壁修饰酶活性与果胶理化特性[J].食品科学, 2023, 44(21):230-238.GU P X, LIU S P, HUANG C, et al.Variations in cell wall-modifying enzyme activities and physicochemical properties of pectin in kiwifruit during postharvest softening[J].Food Science, 2023, 44(21):230-238.
[21] VIVAR-VERA M A, SALAZAR-MONTOYA J A, CALVA-CALVA G, et al.Extraction, thermal stability and kinetic behavior of pectinmethylesterase from hawthorn (Crataegus pubescens) fruit[J].LWT-Food Science and Technology, 2007, 40(2):278-284.
[22] 姚佳. 超高压下莴笋质构的变化及机制研究[D].北京:中国农业大学, 2014.YAO J.Change and mechanism of asparagus lettuce texture under high pressuse pressuring[D].Beijing:China Agricultural University, 2014.
[23] ALI Z M, CHIN L H, LAZAN H.A comparative study on wall degrading enzymes, pectin modifications and softening during ripening of selected tropical fruits[J].Plant Science, 2004, 167(2):317-327.
[24] PENG J, BI J F, YI J Y, et al.Characterization of tissue-specific differences in cell wall pectic polysaccharides of carrot root[J].Journal of Food Processing and Preservation, 2021, 45(4):e15331.
[25] SUN Y X, KANG X L, CHEN F, et al.Mechanisms of carrot texture alteration induced by pure effect of high pressure processing[J].Innovative Food Science &Emerging Technologies, 2019, 54:260-269.
[26] LIU J N, BI J F, MCCLEMENTS D J, et al.Impacts of thermal and non-thermal processing on structure and functionality of pectin in fruit- and vegetable- based products:A review[J].Carbohydrate Polymers, 2020, 250:116890.
[27] SUN Y X, YAO J, ZHANG L, et al.New evidence on pectin-related instantaneous pressure softening mechanism of Asparagus lettuce under high pressure processing[J].Food Science and Technology International, 2019, 25(4):337-346.
[28] GUO Y T, WU B G, GUO X Y, et al.Effect of thermosonication on texture degradation of carrot tissue in relation to alterations in cell membrane and cell wall structure[J].Food Chemistry, 2022, 393:133335.
[29] BUERGY A, ROLLAND-SABATÉ A, LECA A, et al.Pectin modifications in raw fruits alter texture of plant cell dispersions[J].Food Hydrocolloids, 2020, 107:105962.
[30] LI X, BI J F, CHEN Q Q, et al.Texture improvement and deformation inhibition of hot air-dried apple cubes via osmotic pretreatment coupled with instant control pressure drop (DIC)[J].LWT, 2019, 101:351-359.