氨基甲酸乙酯(ethyl carbamate, EC)天然存在于面包、乳酪、黄酒、葡萄酒等发酵食品和酒精饮料中,具有较强的致癌性[1]。研究表明,EC在黄酒中有较高的含量,且主要来源于其前体物质尿素[2],这使得利用脲酶降解前体物质尿素,成为控制黄酒中EC含量的一种有效方法[3]。由于黄酒的酸性环境(pH 4.0左右),酸性脲酶更适合发挥作用。但目前酸性脲酶在我国还处于研究阶段,尚无商业化酸性脲酶产品,而国外商品化酸性脲酶的使用也受到一定的限制。由于获得成熟的酸性脲酶在国内较为困难,因而尚难以在黄酒中工业化应用[4]。我国市售的脲酶主要是植物来源的中性脲酶,来源广泛、价格便宜,但中性脲酶在酸性条件下其酶活受到极大抑制或失活,在黄酒环境中难以发挥作用[3]。如何利用现有的中性脲酶资源,改善其催化特性以满足黄酒工业应用需求,是目前面临的一个挑战。酶的固定化可以有效改善酶的催化特性,拓展酶的应用范围,还可重复使用、降低成本[5-6]。对中性脲酶进行固定化,可能是一种改善其特性并用于黄酒中尿素降解的可行方法。近年来,李童等[3]以壳聚糖为载体,通过共价结合法固定化中性脲酶用于黄酒的尿素降解,表明了这一方法的可行性。进一步开发新型的固定化中性脲酶以满足黄酒尿素降解的需求仍值得研究。
固定化酶载体除了常见的壳聚糖、硅藻土等,近年来,出现了一些新型载体材料进而产生了新的固定化方法。金属有机框架(metal-organicframeworks, MOFs)是由有机配体与无机金属离子或金属团簇通过配位键连接起来,从而形成无限延伸网状结构的多孔结晶有机-无机杂化材料,因其具有高比表面积与孔隙率、可调的孔径与结构以及部分MOFs良好的化学和热稳定性等优势逐渐被用于酶固定化领域[7-8]。由于大部分MOFs通常只能在高温高压下合成,合成条件严苛,因此,MOFs作为载体用于酶的固定化常采用物理吸附和化学结合法[9-10]。此外,有些金属有机框架还可以通过原位合成进行酶的固定化[11]。原位合成法是基于MOF材料开发的一种新的酶封装技术:MOF的前体分子与客体分子混合在一起,使得MOF自组装的同时完成客体分子的固定化[12]。此方法在简单、温和制备固定化酶的同时,又可使酶蛋白受限于MOF的框架结构,进而使其具有良好的稳定性和重复使用性[13]。目前,MOFs的子系列沸石咪唑酯骨架材料(zeolite imidazolate frameworks, ZIFs)因在室温水环境下即可合成,常被用于原位合成法固定化酶的研究中。有研究报道以ZIF-8为载体对urease进行固定化,制备得到的urease@ZIF-8表现出相较于游离酶更好的酸稳定性[14]。但近来也有一些研究表明ZIF-8的酸不稳定性[11,15],暗示ZIF-8难以应用于酸性环境。其他耐酸性的MOF载体进行原位合成固定化酶的报道目前很少见到。
MIL-100(Fe)是由Fe3+和均苯三甲酸(H3BTC)配位而成的一种Fe基MOF,它不仅具有高比表面积与孔隙率等MOFs的典型特点,还具有优异的热和化学稳定性以及生物安全性[16-18]。但是MIL-100(Fe)通常用三价铁盐和均苯三甲酸在强酸水溶液中,经高温高压长时间反应获得,严苛复杂的合成条件极大地限制了MIL-100(Fe)的应用[16,19]。近年来,GUESH等[20]以水为溶剂,采用Fe2+溶液与均苯三甲酸的盐溶液,在室温条件下快速制得MIL-100(Fe)。这为将其作为载体用于原位合成法固定化酶提供了可能,但尚未相关报道。
本研究首先对2种MOF载体ZIF-8与MIL-100(Fe)的稳定性进行比较,选择适当的MOF载体,通过原位合成法固定化中性脲酶,对制备得到的固定化中性脲酶进行结构与形貌表征,测定其酶学性质,并检验其在黄酒中的应用效果,为利用固定化中性脲酶降解黄酒尿素提供新的参考。
1 材料与方法
1.1 材料与仪器
1.1.1 材料与试剂
中性脲酶(来源于Canavalia ensiformis),Sigma公司;均苯三甲酸(H3BTC,99%),北京伊诺凯科技有限公司;其他试剂,国药集团化学试剂有限公司。
1.1.2 仪器与设备
DK-8D型水浴锅,上海精宏实验设备有限公司;HYL-C3型摇床,太仓市强乐实验设备有限公司;CJB-A型磁力搅拌器,上海越众仪器设备有限公司;BioTek酶标仪,赛默飞世尔科技公司;Concentrator plus型真空浓缩仪,德国艾本德股份公司;Bruker D8型X-射线衍射仪,德国布鲁克AXS有限公司;S-4800型扫描电子显微镜,日本日立高新技术公司;安捷伦1260 Infinity Ⅱ型高效液相色谱仪,美国安捷伦科技公司。
1.2 实验方法
1.2.1 ZIF-8的合成
参照LIANG等[14]的方法,并稍做修改。在室温下,将10 mL硝酸锌水溶液(50 mmol/L)与10 mL的2-甲基咪唑溶液(2 mol/L)混匀并静置24 h,6 000 r/min离心得到固体,经去离子水洗涤3次,室温真空干燥得到ZIF-8。
1.2.2 MIL-100(Fe)的合成
参照GUESH等[20]的方法,并稍作修改。溶液1为1.9 mmol H3BTC超声溶于5.99 g的NaOH溶液(1.27 mol/L)中。溶液2为3.04 mmol FeSO4·7H2O溶于24.3 g水中。在搅拌状态下将溶液2缓缓滴加到溶液1中,并持续搅拌24 h。5 000 r/min离心回收固体,将固体用去离子水洗涤3次,酒精洗涤2次,室温真空干燥得到MIL-100(Fe)。
1.2.3 以MIL-100(Fe)为载体的固定化中性脲酶[NU@MIL-100(Fe)]的制备
参照1.2.2节,将溶液2改为3.04 mmol FeSO4·7H2O溶于21.3 g水中,并加入3 mL中性脲酶酶液(1 mg/mL),其余方法不变,在载体MIL-100(Fe)自组装的同时,完成对中性脲酶固定化,原位合成制备得到以MIL-100(Fe)为载体的固定化中性脲酶NU@MIL-100(Fe)。
1.2.4 MOF载体的稳定性比较
分别称取制备得到的相同质量的ZIF-8与MIL-100(Fe),按照固液比1∶100分别置于pH 4.0、0.1 mol/L的乙酸乙酸钠缓冲液和酒精中,测定2种MOF在30 min内不同时间的剩余质量,比较二者在酸性条件和酒精环境下的稳定性。
1.2.5 MIL-100(Fe)与NU@MIL-100(Fe)的表征
使用X-射线衍射仪对制备得到的MIL-100(Fe)、NU@MIL-100(Fe)进行X-射线衍射(XRD)。XRD条件为:Cu靶,CuKα辐射,扫描角度5°~30°,扫描速度2 °/min,步长0.02°。从CCDC数据库中获取MIL-100(Fe)的标准结构,并通过mercury软件对其模拟,获得标准MIL-100(Fe)的模拟XRD图谱。
使用扫描电子显微镜对制备得到的MIL-100(Fe)、NU@MIL-100(Fe)进行形貌表征。样品真空喷金处理,在合适的放大倍数下拍摄相片。
1.2.6 中性脲酶活力的测定
中性脲酶酶活力采用靛酚蓝反应比色法进行测定[21]。一个酶活单位的定义为每分钟水解底物尿素产生1 μmol氨所需的酶量。
1.2.7 游离中性脲酶和NU@MIL-100(Fe)的酶学性质比较
研究方法主要参照李童等[3]报道的方法,部分实验参数有所调整,具体操作如下:
1.2.7.1 pH对脲酶活力和稳定性的影响
最适pH:将一定量的游离中性脲酶和NU@MIL-100(Fe)分别置于pH 3.5~8.0的缓冲体系中,测定不同pH下中性脲酶的酶活力,以最高酶活为100%,计算相对酶活力。
pH稳定性:分别将游离中性脲酶和NU@MIL-100(Fe)置于pH 3.5~7.0的缓冲液中,室温下放置12 h,中间定时取样测定中性脲酶的酶活力,以中性脲酶的初始酶活为100%,计算残余酶活力。
1.2.7.2 温度对脲酶活力和稳定性的影响
最适温度:称取一定量的游离中性脲酶和NU@MIL-100(Fe)于pH 7.0的缓冲液中,在10~80 ℃ 测定不同温度下中性脲酶的酶活力,以中性脲酶的最高酶活力为100%,计算相对酶活力。
温度稳定性:分别将游离中性脲酶和NU@MIL-100(Fe)置于pH值为7.0的缓冲液中,在不同的温度环境下保温12 h(4、30、50、70 ℃),中间定时取样测定中性脲酶的酶活力,以中性脲酶的初始酶活力为100%,计算残余酶活力。
1.2.7.3 酒精对脲酶活力和稳定性的影响
酒精对酶活力的影响:分别将一定量的游离中性脲酶和NU@MIL-100(Fe),置于酒精体积分数为0%~24%的pH 7.0的缓冲液中,测定游离中性脲酶和NU@MIL-100(Fe)在不同体积分数酒精下的酶活力,以最高酶活力为100%,计算相对酶活力。
酒精耐受性:分别将游离中性脲酶和NU@MIL-100(Fe)置于酒精体积分数为0%~30%的缓冲液中,室温放置12 h,中间定时取样测定中性脲酶的酶活力,以中性脲酶的初始酶活力为100%,计算残余酶活力。
1.2.8 NU@MIL-100(Fe)的可重复使用性
称取一定量的NU@MIL-100(Fe),在37 ℃、pH 4.0条件下进行酶活力测定反应,反应结束后,离心(9 000 r/min,2 min)将NU@MIL-100(Fe)与反应液分离,经去离子水洗涤两次后,随即用于下一次酶活力测定反应,以NU@MIL-100(Fe)第一次酶活力测定反应的酶活力为100%,考察其可重复使用性。
1.2.9 NU@MIL-100(Fe)处理黄酒
分别称取脲酶活力均为5 U(pH 7.0)的游离中性脲酶和NU@MIL-100(Fe),处理5 mL的黄酒酒样(30 ℃、200 r/min),并定时取酒样测定尿素含量,计算游离中性脲酶和NU@MIL-100(Fe)的尿素降解率。空白对照为不加酶的载体MIL-100(Fe)。同时按照参考文献[22]配制黄酒模拟酒样,其中尿素质量浓度为20 mg/L,测定NU@MIL-100(Fe)对黄酒模拟酒样的尿素降解率。
1.2.10 NU@MIL-100(Fe)批次处理黄酒
参照1.2.9节,将NU@MIL-100(Fe)用于处理黄酒4 h,处理3个批次,分析3个批次黄酒的尿素降解率。
2 结果与分析
2.1 ZIF-8与MIL-100(Fe)的载体稳定性比较
黄酒的酸性环境及其中的酒精对固定化酶的MOF载体是一大考验,因此,首先比较了两种MOF材料,ZIF-8与MIL-100(Fe)的酸稳定性及在酒精中的稳定性。结果如图1所示,常用的MOF载体ZIF-8在酒精中的稳定性良好,5 min后有约90%的ZIF-8稳定存在(图1-b),但其在酸性溶液中的稳定性极差,在1∶100固液比下,ZIF-8在pH 4.0的缓冲液中5 min内迅速溶解(图1-a),表明ZIF-8的酸稳定性较差,可能不适合在酸性环境下作为载体使用。近年来的一些研究也报道了类似现象[11,15]。而MIL-100(Fe)在酸性溶液和酒精中均表现出较好的稳定性。因此,后续研究选用MIL-100(Fe)作为固定化载体,制备固定化中性脲酶(neutral urease@MIL-100(Fe),NU@MIL-100(Fe))用于黄酒中降解尿素。
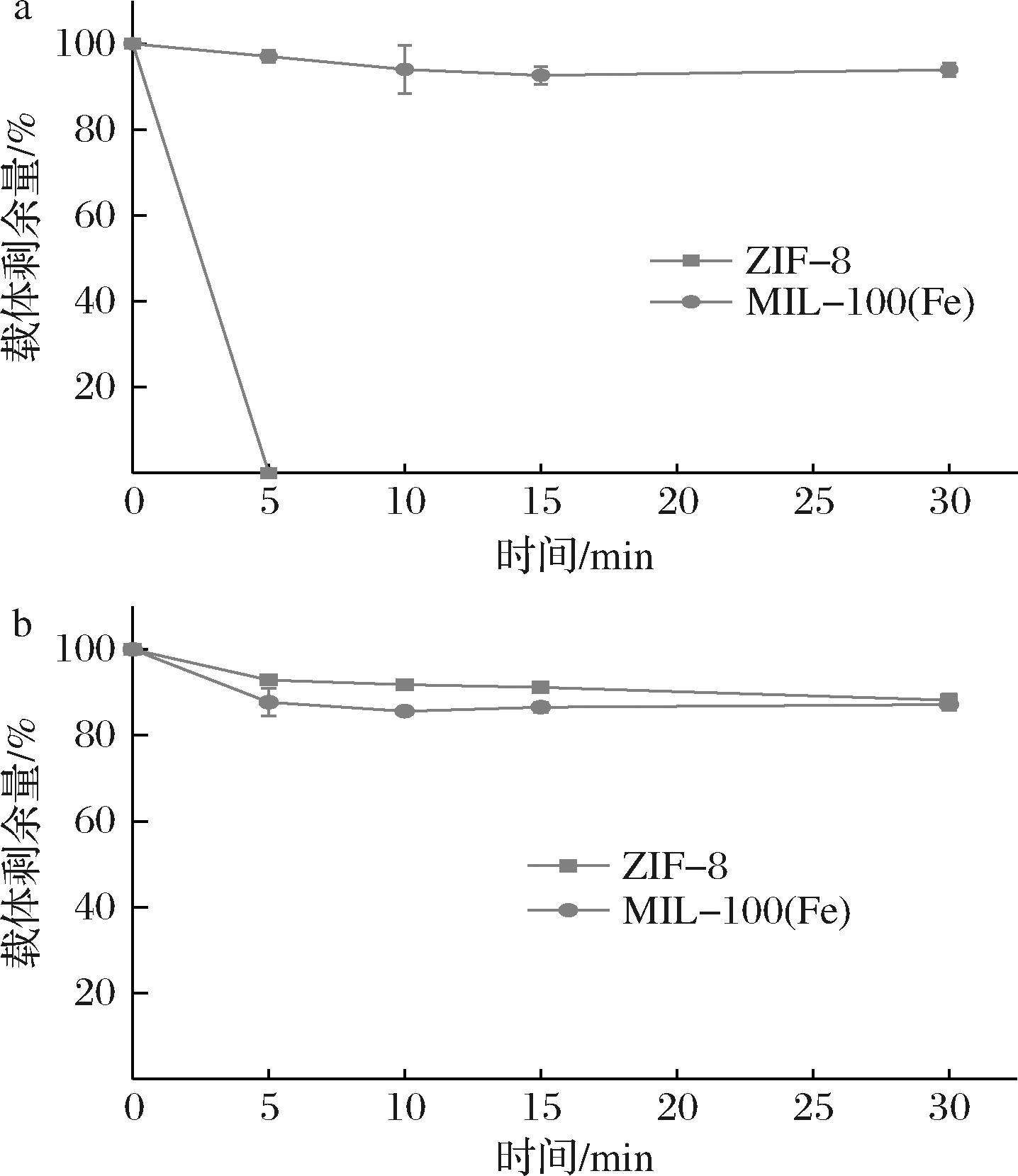
a-酸稳定性;b-酒精稳定性
图1 酸性环境和酒精对MOF载体ZIF-8与MIL-100(Fe)稳定性的影响
Fig.1 Effect of acidic environment and alcohol on the stability of ZIF-8 and MIL-100(Fe)
2.2 MOF固定化中性脲酶NU@MIL-100(Fe)的XRD和SEM表征
MOF的结构与形貌通常采用XRD和SEM进行表征[23]。如图2所示,载体MIL-100(Fe)和固定化中性脲酶NU@MIL-100(Fe)的图谱在6.4°、10.4°、11.2°、20.3°处均表现出特征峰,与标准MIL-100(Fe)模拟图谱吻合良好,也与文献报道的结果基本相符[23-24]。结果表明了MIL-100(Fe)的成功制备,其晶体结晶度良好,且中性脲酶的引入并未对MIL-100(Fe)的晶体结构造成明显影响。
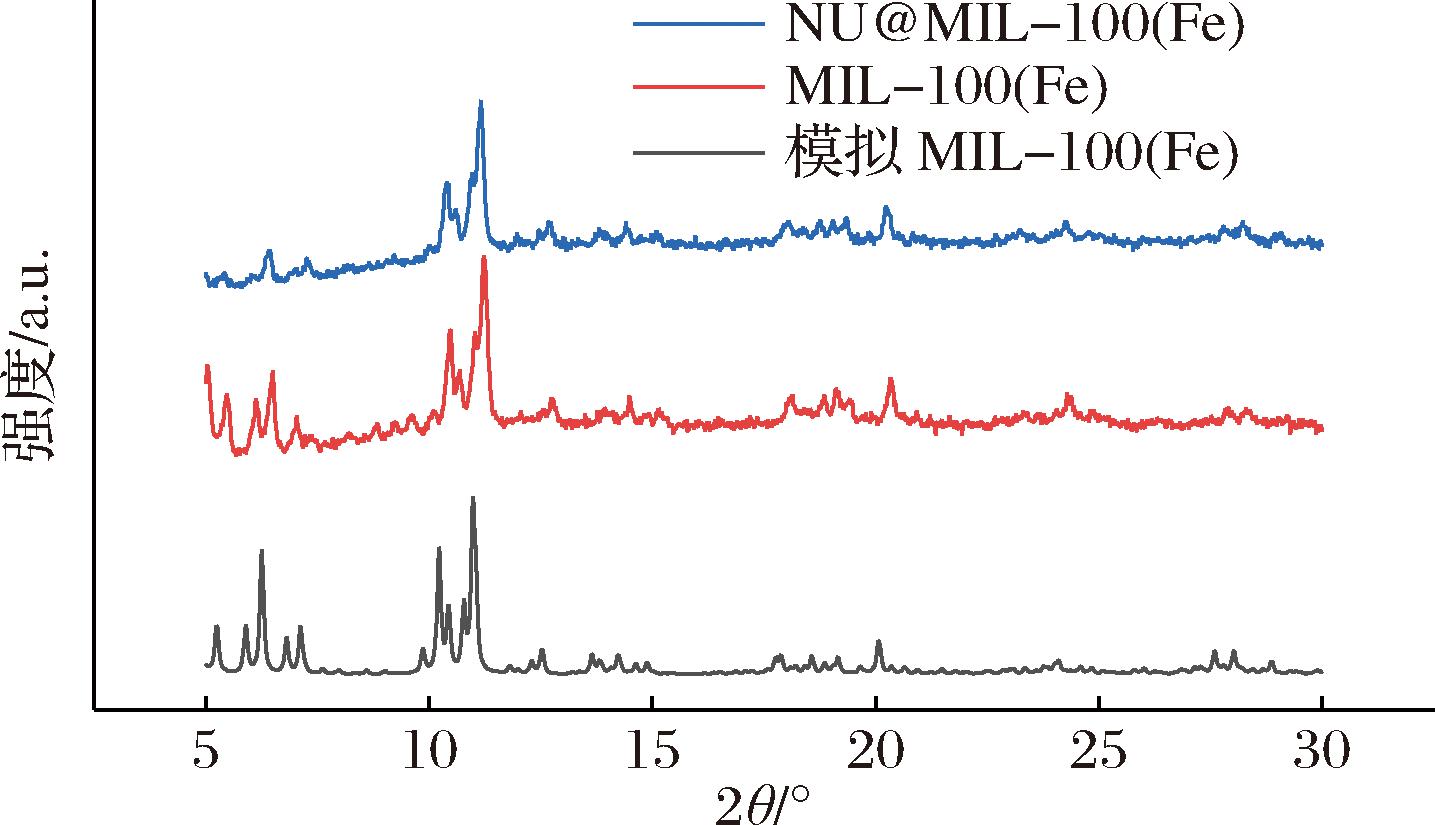
图2 MIL-100(Fe)、NU@MIL-100(Fe)和模拟MIL-100(Fe)的XRD图谱
Fig.2 XRD patterns of simulated MIL-100(Fe), NU@MIL-100(Fe), and simulated MIL-100(Fe)
载体MIL-100(Fe)和固定化中性脲酶NU@MIL-100(Fe)的SEM结果如图3所示,两者均表现为大小不一的多面体以及一些纳米颗粒聚集成团簇,XRD表明,这些多面体为MIL-100(Fe)纳米晶体,其形貌、大小与文献报道的结果基本相符[23-24],而纳米颗粒可能是MIL-100(Fe)的中间相,未完全转化为MIL-100(Fe)[23]。其中NU@MIL-100(Fe)的多面体相对于MIL-100(Fe)较小,且其中有更多的纳米颗粒,可能是酶分子的引入,对MIL-100(Fe)纳米晶体的大小产生了一定的影响,但并未对MIL-100(Fe)的形貌产生明显影响。

a-MIL-100(Fe);b-NU@MIL-100(Fe)
图3 MIL-100(Fe)和NU@MIL-100(Fe)的扫描电镜图
Fig.3 SEM images of MIL-100(Fe) and NU@MIL-100(Fe)
2.3 NU@MIL-100(Fe)酶学性质分析
测定分析pH、温度、酒精度等因素对制备得到的MOF固定化中性脲酶NU@MIL-100(Fe)催化活性和稳定性的影响,并与游离中性脲酶进行比较,考察NU@MIL-100(Fe)在黄酒中的适用性。
2.3.1 最适pH及其稳定性
在不同pH下,游离中性脲酶和NU@MIL-100(Fe)的相对酶活力和稳定性如图4所示。
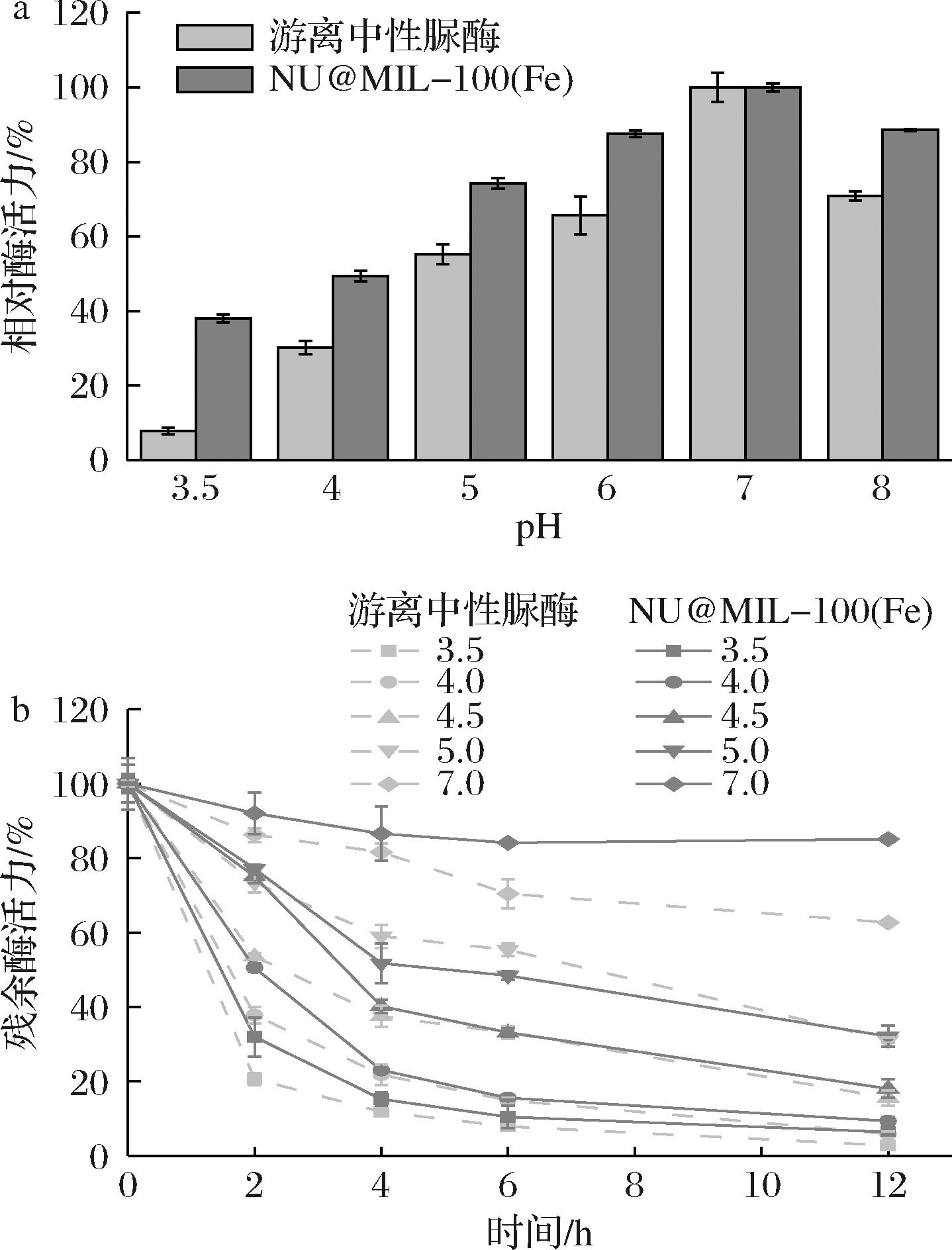
a-最适pH;b-pH稳定性
图4 游离中性脲酶和NU@MIL-100(Fe)最适pH及其pH稳定性比较
Fig.4 Comparison of optimum pH and pH stability between free neutral ureases and NU@MIL-100(Fe)
比较发现,经MOF原位合成固定化后,中性脲酶的最适pH未发生变化,仍为7.0,但其活性受pH的影响程度明显降低。随着pH的降低,游离酶的相对酶活力大幅降低,pH 3.5时游离酶几近失活,其相对酶活力仅有7.76%;而NU@MIL-100(Fe)由于载体的保护,其酶活受到pH的抑制相对较小,相对酶活力普遍高于游离酶,pH 3.5时,NU@MIL-100(Fe)的相对酶活力仍有38.02%。NU@MIL-100(Fe)在酸性条件下较高的相对酶活力有利于其对黄酒处理的应用。即使在碱性条件下,MIL-100(Fe)的保护也使得固定化酶的相对酶活力高于游离酶。这可能得益于原位合成的制备方法,酶分子被限制在MOF框架结构内,构象改变变得不再容易[13],从而维持了较高的活性。在不同pH缓冲体系下,2种中性脲酶的稳定性结果如图4-b所示。相较于游离酶,NU@MIL-100(Fe)在中性条件下的稳定性显著提高,在酸性条件下(pH 3.5~4.5)的稳定性也有所提高。pH 4.0和pH 3.5的环境下,固定化酶2 h后残余酶活力仍有50.53%和32%,而游离酶残余酶活力只有37.81%和20.68%;12 h后,固定化酶残余酶活力仍有9.37%和6.39%,而游离酶残余酶活力只有5.95%和2.82%。这一结果也有利于NU@MIL-100(Fe)在黄酒中的应用。
2.3.2 最适温度及其稳定性
在不同温度下对两种中性脲酶的活力进行测定,结果如图5-a所示。与游离中性脲酶相比,NU@MIL-100(Fe)的最适温度也没有发生变化,仍为60 ℃,酶活力受温度的影响差异也不是太大。但是两者的温度稳定性却存在较大的差异(图5-b)。在中低温(4~30 ℃)条件下12 h,NU@MIL-100(Fe)可保持约90%的酶活,明显高于游离中性脲酶。在50 ℃条件下放置12 h后,NU@MIL-100(Fe)残余酶活仍可达70.73%,而游离中性脲酶的残余酶活力仅有37.69%,表明固定化酶稳定性有显著提高。高温条件下(70 ℃),二者皆在6 h后失活,但是NU@MIL-100(Fe)酶活力损失更快,这可能是由于高温条件加速了Fe3+对脲酶活力的影响[25]。

a-最适温度;b-温度稳定性
图5 游离中性脲酶和NU@MIL-100(Fe)最适温度及其温度稳定性比较
Fig.5 Comparison of optimum temperature and temperature stability between free neutral ureases and NU@MIL-100(Fe)
2.3.3 酒精对脲酶活力及其耐受性的影响
酒精对两种中性脲酶活力的影响结果如图6-a所示。与游离酶类似,酒精对NU@MIL-100(Fe)的活性有较明显的影响,随着酒精体积分数的增大,脲酶相对酶活力逐渐降低。但两者在不同浓度酒精溶液中的稳定性差异明显,结果如图6-b所示。在14%酒精体积分数下12 h后,游离酶只有55.16%的残余酶活,而NU@MIL-100(Fe)的残余酶活仍可达83.16%,酒精体积分数进一步提高到30%,12 h后游离酶仅有27.5%的残余酶活,而NU@MIL-100(Fe)的残余酶活仍有60.67%,且较为稳定。结果表明,中性脲酶经MIL-100(Fe)固定化后,对酒精的耐受性有了较大提升。NU@MIL-100(Fe)优异的酒精稳定性有利于将其用于黄酒的处理。
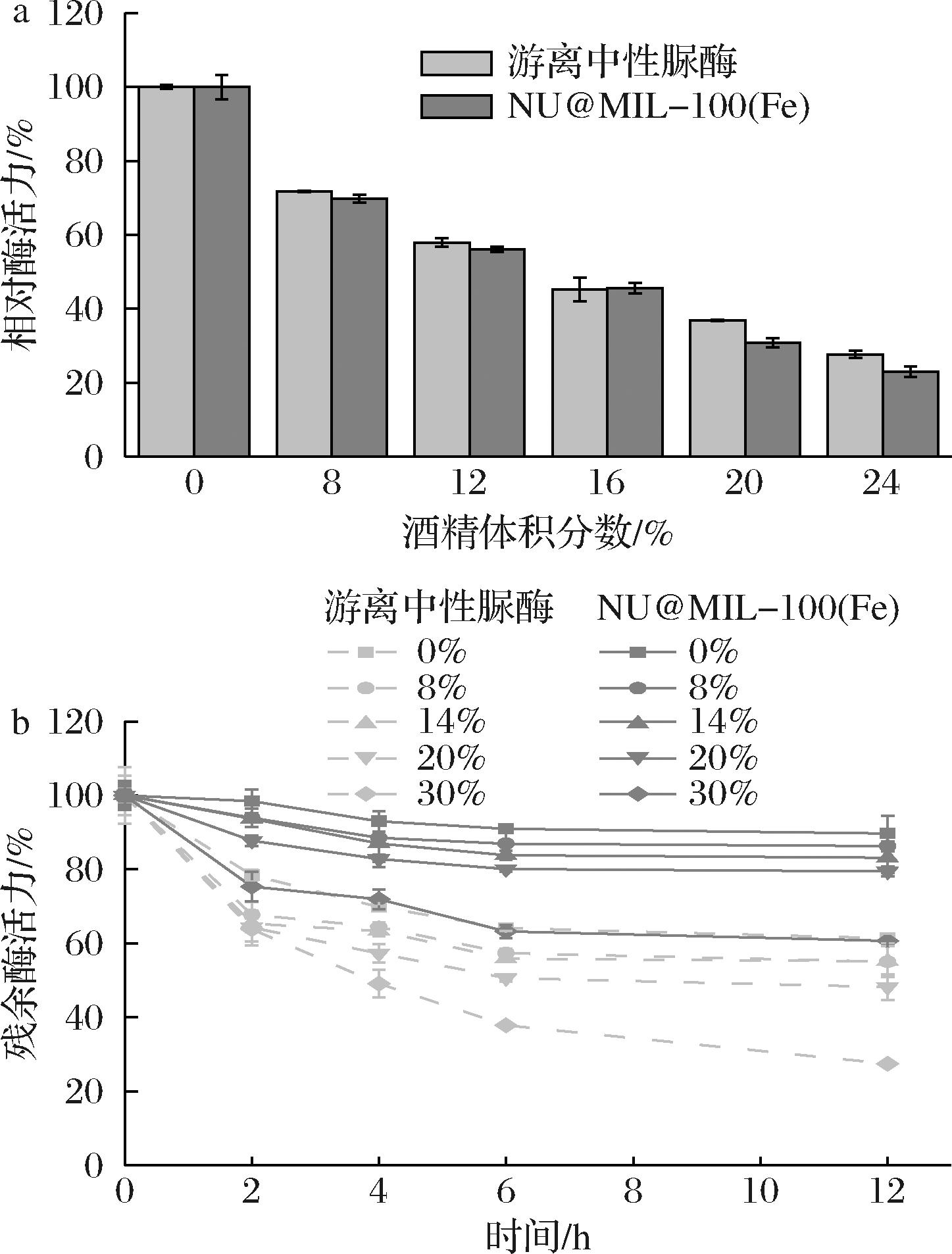
a-酒精对酶活力的影响;b-酒精耐受性
图6 不同体积分数酒精对游离中性脲酶和NU@MIL-100(Fe)活力及其酒精耐受性的影响
Fig.6 Effect of different volume fractions of alcohol on the activity and tolerance between free neutral ureases and NU@MIL-100(Fe)
以上结果表明,利用MOF材料MIL-100(Fe)作为载体固定化中性脲酶,对于酶活力特性没有显著的改变,但是减轻了酸性环境对于酶活力的抑制,同时不同程度地提高了中性脲酶的稳定性,特别是对于酒精的耐受性。这些变化与李童等[3]报道的以壳聚糖为载体,通过共价结合得到的固定化中性脲酶的特性明显不同,中性脲酶经共价结合固定化后,一些酶活力特性(如最适pH、最适温度等)发生了一定的变化,脲酶稳定性的变化情况与NU@MIL-100(Fe)也有所不同,说明不同的固定化机制对酶的特性会造成不同的影响。本研究基于MOF材料MIL-100(Fe)作为载体原位合成固定化脲酶,不会明显影响酶活特性,但可以一定程度上抵御外部环境对酶的影响,从而对酶起到一定的保护作用。
2.4 NU@MIL-100(Fe)的可重复使用性
固定化酶相较于游离酶的一大优势就是可以进行回收重复使用,这可以显著降低生产成本,有利于工业化应用。如图7所示,在酸性条件下,对NU@MIL-100(Fe)连续进行5次尿素的催化反应,经5次使用后,其催化活性仍有初始活性的64.68%,具有良好的可重复使用性。
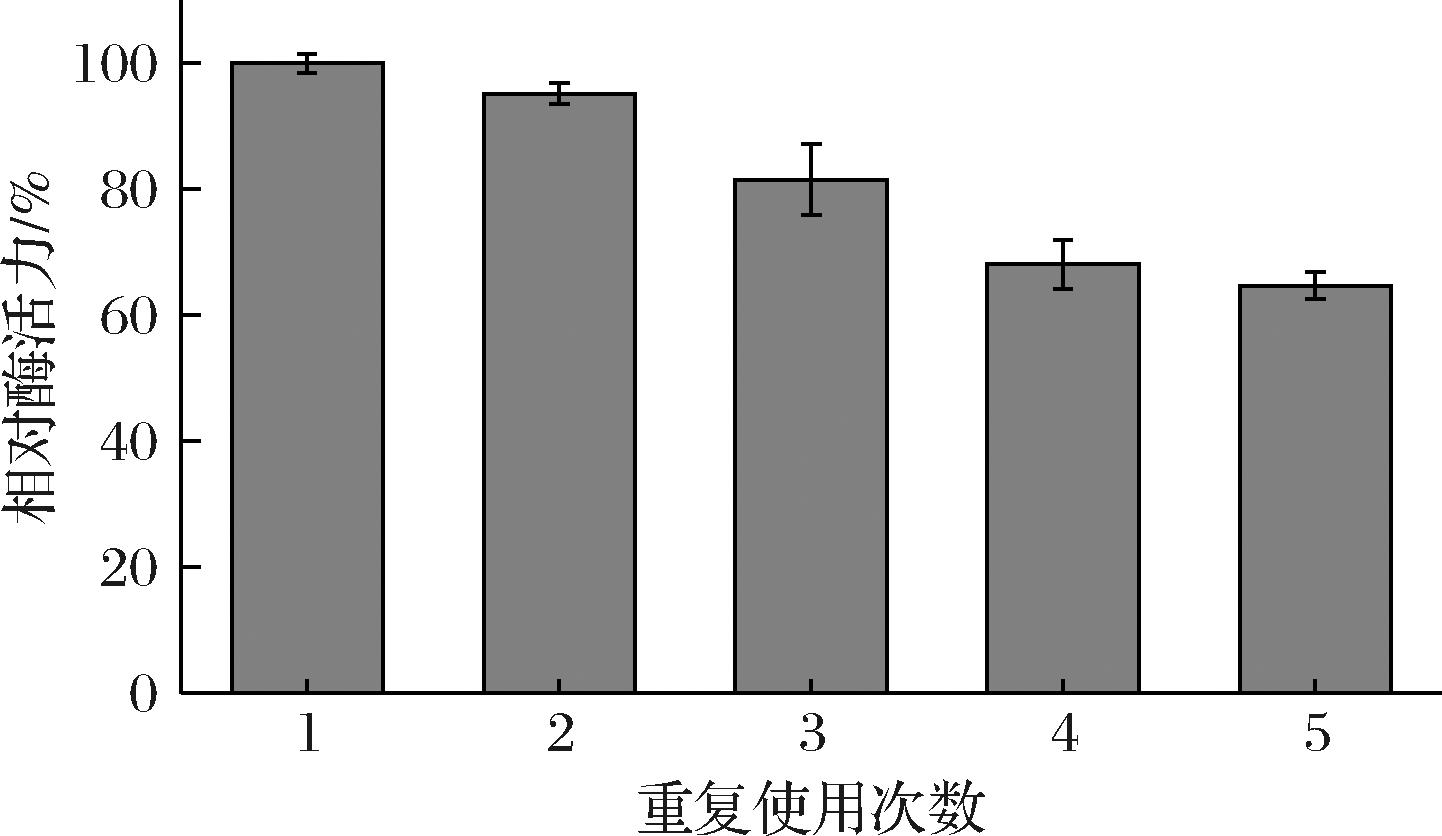
图7 NU@MIL-100(Fe)可重复使用性
Fig.7 Reusability of NU@MIL-100(Fe)
2.5 NU@MIL-100(Fe)处理黄酒
将NU@MIL-100(Fe)用于处理具有一定尿素含量的黄酒(18.95 mg/L)及模拟黄酒样品(20 mg/L),同时以游离酶和MOF载体MIL-100(Fe)处理黄酒作为对照,尿素的降解结果如图8所示。游离中性脲酶对于黄酒中的尿素降解基本没有效果,经过24 h处理,尿素仅降解了8.74%。这与通常的认识一致,游离中性脲酶不适合用于黄酒中尿素的降解[3],黄酒的酸性及其酒精含量显著降低了游离中性脲酶的活性和稳定性。MIL-100(Fe)载体在该处理条件下,对黄酒中尿素的含量也基本没有影响,尿素降解率小于10%。而在相同的加酶量下,固定化中性脲酶NU@MIL-100(Fe)处理黄酒2 h,尿素降解率>60%,4 h后尿素降解率达到79.96%,经过24 h的处理后,黄酒中尿素含量约1.17 mg/L,尿素降解了93.83%。与模拟黄酒样品相比,两者的尿素降解效果非常接近,表明相较于模拟黄酒样品,复杂的黄酒体系对NU@MIL-100(Fe)的影响很小。以上结果表明,固定化中性脲酶NU@MIL-100(Fe)在黄酒中具有良好的降解尿素效果,具有实际应用价值。
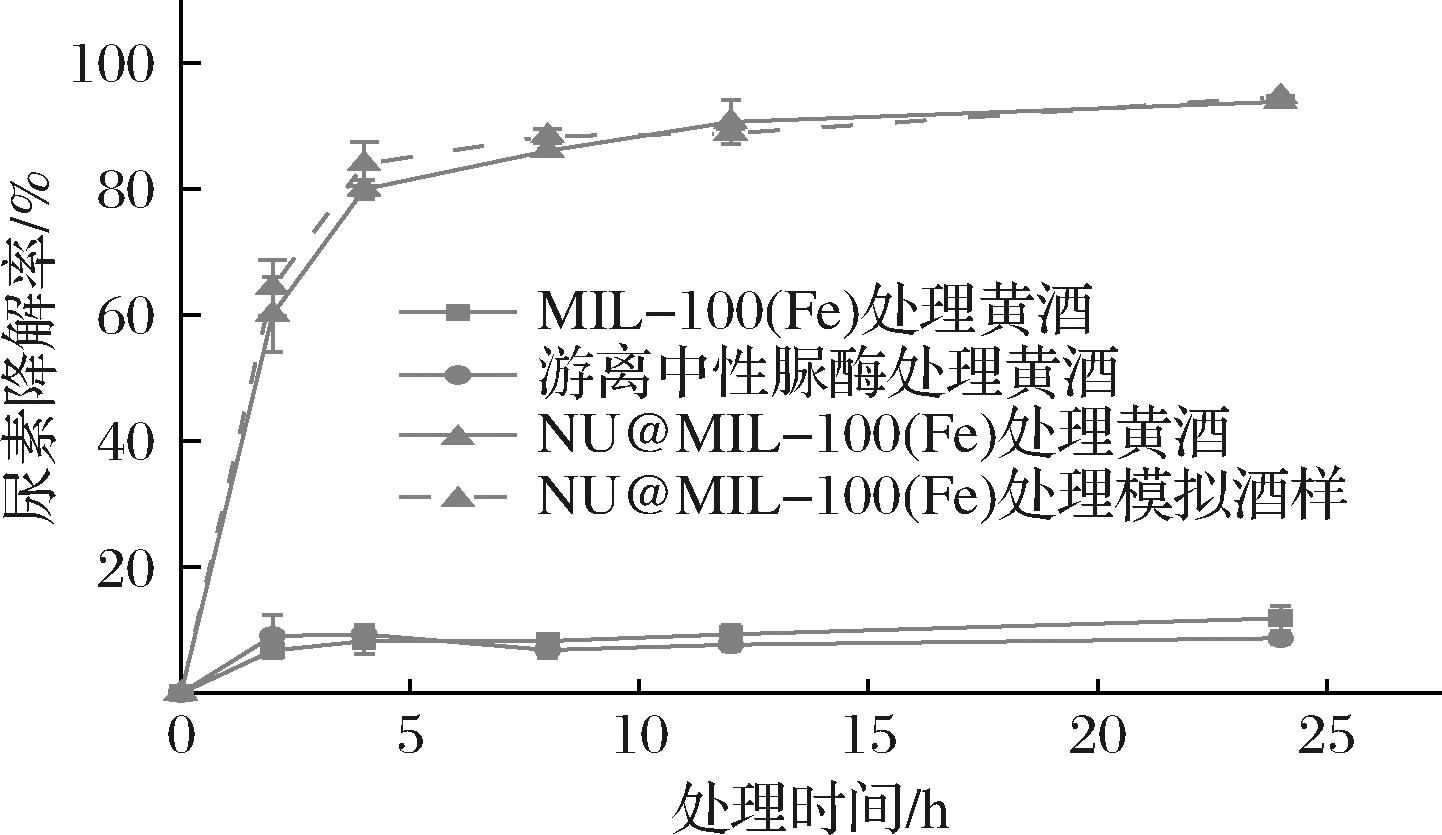
图8 NU@MIL-100(Fe)处理黄酒
Fig.8 Treatment of Huangjiu with NU@MIL-100(Fe)

图9 NU@MIL-100(Fe)批次处理黄酒
Fig.9 Batch treatment of Huangjiu with NU@MIL-100(Fe)
2.6 NU@MIL-100(Fe)批次处理黄酒
将NU@MIL-100(Fe)用于多批次处理黄酒,每批次处理时间4 h,考察其对黄酒中尿素的降解效果。第一次处理黄酒,尿素降解率可达近80%;经过两次处理黄酒后,第3次黄酒处理,仍可有48.29%的尿素降解率。相较于李童等[3]以壳聚糖为载体,制备得到的固定化中性脲酶第3次用于黄酒处理时,基本无尿素降解,NU@MIL-100(Fe)稳定性有所提升,在实际应用时也可具有较好的重复使用稳定性。
3 结论
本研究主要对基于MOF的新型固定化中性脲酶酶学性质及其在黄酒中的应用可行性进行了考察。比较ZIF-8与MIL-100(Fe)2种MOF载体的稳定性,结果表明,ZIF-8酸稳定性差,不适用于酸性环境,而MIL-100(Fe)的酸稳定性和酒精稳定性良好,可作为中性脲酶的固定化载体用于黄酒体系;对室温水环境下原位合成制备得到的固定化中性脲酶NU@MIL-100(Fe),利用XRD、SEM进行表征,结果证实了MIL-100(Fe)的成功合成,且中性脲酶的引入,未对其晶体结构与形貌产生明显影响。酶学性质分析表明,相较于游离中性脲酶,NU@MIL-100(Fe)对于酶活特性没有显著的改变,但是减轻了酸性条件对于脲酶活性的抑制,同时不同程度表现出了更好的酸稳定性、热稳定性和酒精耐受性,以及良好的重复使用性。将NU@MIL-100(Fe)用于黄酒中处理尿素,经24 h处理,尿素降解率可达93.83%,即使重复使用3次,处理4 h仍可达到48.29%的尿素降解率,具有较好的重复使用性。NU@MIL-100(Fe)良好的酶学特性和作用效果为在黄酒中降解尿素的实际应用提供了新的参考。
[1] WEBER J V, SHARYPOV V I.Ethyl carbamate in foods and beverages:A review[J].Environmental Chemistry Letters, 2009, 7(3):233-247.
[2] JIAO Z H, DONG Y C, CHEN Q H.Ethyl carbamate in fermented beverages:Presence, analytical chemistry, formation mechanism, and mitigation proposals[J].Comprehensive Reviews in Food Science and Food Safety, 2014, 13(4):611-626.
[3] 李童, 钱斌, 周建弟, 等.中性脲酶固定化降解黄酒中尿素[J].食品与发酵工业, 2021, 47(9):70-75.LI T, QIAN B, ZHOU J D, et al.Degradation of urea in Huangjiu by immobilized neutral urease[J].Food and Fermentation Industries, 2021, 47(9):70-75.
[4] 范文来, 王栋.近10年我国传统饮料酒白酒和黄酒品质安全研究现状与展望[J].食品安全质量检测学报, 2019, 10(15):4811-4829.FAN W L, WANG D.Current practice and future trends of alcoholic beverages safety of China traditional Baijiu and Huangjiu in recent decades[J].Journal of Food Safety &Quality, 2019, 10(15):4811-4829.
[5] GARCIA-GALAN C, BERENGUER-MURCIA  , FERNANDEZ-LAFUENTE R, et al.Potential of different enzyme immobilization strategies to improve enzyme performance[J].Advanced Synthesis &Catalysis, 2011, 353(16):2885-2904.
, FERNANDEZ-LAFUENTE R, et al.Potential of different enzyme immobilization strategies to improve enzyme performance[J].Advanced Synthesis &Catalysis, 2011, 353(16):2885-2904.
[6] MAGHRABY Y R, EL-SHABASY R M, IBRAHIM A H, et al.Enzyme immobilization technologies and industrial applications[J].ACS Omega, 2023, 8(6):5184-5196.
[7] DUAN W J, ZHAO Z F, AN H D, et al.State-of-the-art and prospects of biomolecules:Incorporation in functional metal-organic frameworks[J].Topics in Current Chemistry (Cham), 2019, 377(6):34.
[8] HU Y L, DAI L M, LIU D H, et al.Progress &prospect of metal-organic frameworks (MOFs) for enzyme immobilization (enzyme/MOFs)[J].Renewable and Sustainable Energy Reviews, 2018, 91:793-801.
[9] LIU W L, YANG N S, CHEN Y T, et al.Lipase-supported metal-organic framework bioreactor catalyzes warfarin synthesis[J].Chemistry, 2015, 21(1):115-119.
[10] CAO S L, YUE D M, LI X H, et al.Novel nano-/micro-biocatalyst:Soybean epoxide hydrolase immobilized on UiO-66-NH2 MOF for efficient biosynthesis of enantiopure (R)-1, 2-octanediol in deep eutectic solvents[J].ACS Sustainable Chemistry &Engineering, 2016, 4(6):3586-3595.
[11] ZHENG H Q, ZHANG Y N, LIU L F, et al.One-pot synthesis of metal-organic frameworks with encapsulated target molecules and their applications for controlled drug delivery[J].Journal of the American Chemical Society, 2016, 138(3):962-968.
[12] 苏伟, 李青云, 刘幽燕, 等.ZIF-8原位合成法固定化脂肪酶CRL[J].中国油脂, 2021, 46(2):107-113.SU W, LI Q Y, LIU Y Y, et al.Immobilization of lipase CRL on ZIF-8 by in situ synthesis[J].China Oils and Fats, 2021, 46(2):107-113.
[13] LIU J, LIANG J Y, XUE J Y, et al.Metal-organic frameworks as a versatile materials platform for unlocking new potentials in biocatalysis[J].Small, 2021, 17(32):e2100300.
[14] LIANG X, LI Q, SHI Z Y, et al.Immobilization of urease in metal-organic frameworks via biomimetic mineralization and its application in urea degradation[J].Chinese Journal of Chemical Engineering, 2020, 28(8):2173-2180.
[15] BUNZEN H.Chemical stability of metal-organic frameworks for applications in drug delivery[J].ChemNanoMat, 2021, 7(9):998-1007.
[16] HORCAJADA P, SURBLÉ S, SERRE C, et al.Synthesis and catalytic properties of MIL-100(Fe), an iron(III) carboxylate with large pores[J].Chemical Communications, 2007(27):2820-2822.
[17] QUIJIA C R, LIMA C, SILVA C, et al.Application of MIL-100(Fe) in drug delivery and biomedicine[J].Journal of Drug Delivery Science and Technology, 2021, 61:102217.
[18] MA X, LEPOITEVIN M, SERRE C.Metal-organic frameworks towards bio-medical applications[J].Materials Chemistry Frontiers, 2021, 5(15):5573-5594.
[19] ZHANG F M, SHI J, JIN Y, et al.Facile synthesis of MIL-100(Fe) under HF-free conditions and its application in the acetalization of aldehydes with diols[J].Chemical Engineering Journal, 2015, 259:183-190.
[20] GUESH K, CAIUBY C A D, SANCHEZ-SANCHEZ M.Sustainable preparation of MIL-100(Fe) and its photocatalytic behavior in the degradation of methyl orange in water[J].Crystal Growth &Design, 2017, 17(4):1806-1813.
[21] MEIJERS C A M, RUTTEN J C J M.A simple rapid method for the determination of total nitrogen in urine[J].Clinica Chimica Acta, 1969, 24(2):308-310.
[22] 周霞. 解淀粉芽孢杆菌脲酶基因在枯草芽孢杆菌中的重组表达及尿素降解应用研究[D].无锡:江南大学, 2021.ZHOU X.Heterologous expression of urease-encoded gene from Bacillus amyloliquefaciens in recombinant Bacillus subtilis and its application in urea degradation[D].Wuxi:Jiangnan University, 2021.
[23] ZHUANG J L, LIU X Y, MAO H L, et al.Hollow carbon polyhedra derived from room temperature synthesized iron-based metal-organic frameworks for supercapacitors[J].Journal of Power Sources, 2019, 429:9-16.
[24] BARJASTEH M, VOSSOUGHI M, BAGHERZADEH M, et al.MIL-100(Fe) a potent adsorbent of dacarbazine:Experimental and molecular docking simulation[J].Chemical Engineering Journal, 2023, 452:138987.
[25] DAIF M A, EL-DIN M M.Studies on urea hydrolysis.Part 2.Effects of some heavy metals on urease activity[J].Beitrage Zur Tropischen Landwirtschaft und Veterinarmedizin, 1979, 17(3):261-266.