糖尿病是一种以高血糖为特征的慢性代谢性疾病,目前是仅次于癌症和心血管疾病的第三大常见慢性非传染性疾病,其中2型糖尿病(type 2 diabetes,T2DM)是最常见的糖尿病类型,发病率高达90%以上[1],其并发症主要包括高血压、肾功能衰竭、视网膜病变和心脏病等[2]。控制血糖水平、维持血糖稳态是防治糖尿病及其并发症的关键,其中抑制α-淀粉酶和α-葡萄糖苷酶的活性是改善餐后血糖的有效途径,α-淀粉酶和α-葡萄糖苷酶是碳水化合物水解的关键消化酶,其活性被抑制能够延缓淀粉等碳水化合物水解成葡萄糖从而降低血糖水平[3]。目前,阿卡波糖和沙格列汀是常用的降糖药物,也是α-葡萄糖苷酶和α-淀粉酶抑制剂。然而,这些药物长期使用容易导致副作用,例如肠胃胀气和腹泻[4]。因此,开发无副作用的食源性生物活性物质尤为重要。近年来,食源性多肽因其能够减少胰岛素抵抗、抑制葡萄糖释放、提高胰岛素敏感性,作为一种新型降糖物质受到广泛的关注。
芸豆(Phaseolus vulgaris L.)学名菜豆,又名四季豆[5],属蝶形花科的小宗杂粮作物[6],营养丰富,富含蛋白质、膳食纤维、维生素(如维生素C、维生素A)和矿物质(如铁、钾、镁),具有一定的食用及药用价值[7]。据报道,芸豆抗性淀粉可以缓解肠道炎症,抑制氧化应激,并防止相关的肠道屏障损伤[8],芸豆多肽能够诱导内皮细胞NO的释放,引起血管舒张,改善氧化应激水平[9]。芸豆酚类化合物可以通过多种机制对心血管疾病和老年并发症产生积极影响[10]。芸豆多糖可以通过肠道菌群和脂质代谢调节糖尿病大鼠高血糖和高脂血症[11]。芸豆提取物具有抗炎抗菌、补气消肿等功效,可作为抗菌剂治疗动物和人类来源肠杆菌感染。
目前虽然有大量研究报道了芸豆多肽在抗氧化、降血压、抗肿瘤等方面的生物活性及其作用机理,但有关芸豆多肽降糖活性及胃肠消化特性研究甚少。因此,本实验采用体外模拟胃肠道消化实验探究经胃肠消化后白芸豆多肽(white kidney bean polypeptides,WKBPs)的体外降糖活性变化规律,评估WKBPs在体外模拟消化系统中生物活性的稳定性。这一结果可为开发白芸豆功能食品提供理论依据及数据支撑。
1 材料与方法
1.1 材料与试剂
白芸豆,黑龙江省齐齐哈尔市;玉米淀粉,市售;枯草芽孢杆菌(Bacillus subtilis)、米曲霉(Aspergillus oryzae),中国工业微生物菌种保藏中心;α-葡萄糖苷酶(≥100 u/mg)、α-淀粉酶(≥10 u/mg)、胃蛋白酶(>250 u/mg)、胰脂肪酶(90 U/mg)、唾液淀粉酶(>5 U/mg)、胰酶(4×USP)、淀粉葡萄糖苷酶(120 U/mg)、4-硝基苯-α-D-葡萄糖苷(4-nitrobenzene-α-D-glucoside,pNPG)、Gly-Gly-Gly(189 Da)、Gly-Gly-Tyr-Arg(451 Da)、杆菌肽(1 423 Da)、胰岛素(5 778 Da)、细胞色素C(12 384 Da),美国Sigma公司;3号胆盐,上海麦克林生化科技股份有限公司;3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS),北京索莱宝科技有限公司;葡萄糖检测试剂盒,南京建成生物技术有限公司;NaOH、盐酸,国药集团化学试剂有限公司。
1.2 仪器与设备
BSA124S高精度精密分析电子天平,德国Sartorius科学仪器有限公司;PHS-25型pH计,青岛明博环保科技有限公司;UV1902PC紫外可见分光光度计,上海奥析科学仪器有限公司;HSX-250 恒温恒湿培养箱,上海航配仪器有限公司;Thermo Sorvall ST16高速冷冻离心机,上海土森视觉科技有限公司;BKQ-Z75I高压蒸汽灭菌锅,山东博科科学仪器有限公司。
1.3 实验方法
1.3.1 WKBPs制备
挑取颗粒饱满的白芸豆洗净后烘干,粉碎机粉碎,100目过筛,用蒸馏水将白芸豆粉按料液比1∶10的比例混合,装瓶量30 mL,121 ℃灭菌20 min后冷却,在发酵培养基中接入9%的枯草芽孢杆菌和米曲霉(1∶1体积比)混合菌液,37 ℃、180 r/min振荡培养48 h,发酵液1.0×104 r/min低温离心15 min,收集上清液冷冻干燥,得到WKBPs粗提物。
1.3.2 氨基酸测定
依据GB 5009.124—2016《食品中氨基酸的测定》,采用茚三酮法测定白芸豆发酵前后游离氨基酸含量。以L-亮氨酸为标准品,绘制标准曲线。
1.3.3 相对分子质量分布
采用高效液相凝胶渗透色谱法(gel permeation chromatography,GPC)测定样品的分子质量分布,参考CAO等[12]的方法略有修改。色谱柱为TSKgelG2000SWXL(300 nm×7.8 nm),流速为0.3 mL/min,柱温为25 ℃,检测波长为220 nm,流动相为20%乙腈+80%水+0.1%三氟乙酸,样品用0.22 μm滤膜过滤,采用Gly-Gly-Gly、Gly-Gly-Tyr-Arg、杆菌肽、胰岛素和细胞色素C为校正标准品,用GPC软件对色谱数据进行处理,计算WKBPs的相对分子质量和分布情况。
1.3.4 体外降糖活性
1.3.4.1 α-葡萄糖苷酶抑制活性测定
参照LV等[13]的方法稍作修改。用0.1 mol/L pH值为6.8的磷酸盐缓冲液将α-葡萄糖苷酶和pNPG分别制备成0.2 U/mL和1 mg/mL的溶液,取100 μL α-葡萄糖苷酶和100 μL不同质量浓度(0.2、0.4、0.6、0.8、1.0 mg/mL)的WKBPs样品溶液混合,37 ℃孵育10 min,然后将100 μL pNPG溶液作为底物加入到反应体系中,37 ℃孵育20 min,最后加入10 mL 0.1 mol/L的Na2CO3溶液终止反应,在405 nm处测定OD值,以0.1 mg/mL阿卡波糖作为阳性对照,计算如公式(1)所示:
α-葡萄糖苷酶抑制率![]()
(1)
式中:A1,样品在405 nm处的吸光度;A2,不加样品时pNPG和酶在405 nm处的吸光度;A3,不加酶时pNPG和样品在405 nm处的吸光度;A4,pNPG在405 nm处的吸光度。
1.3.4.2 α-淀粉酶抑制活性测定
参照WANG等[14]的方法稍作修改。将100 μL不同质量浓度(0.2、0.4、0.6、0.8、1.0 mg/mL)的WKBPs样品溶液与100 μL α-淀粉酶(1 U/mL)溶液混合,37 ℃下培养10 min,随后添加200 μL 10 g/L的可溶淀粉溶液,并在37 ℃下培养20 min。最终,添加400 μL的DNS试剂,并在沸水浴中孵育10 min,待反应物冷却到室温,在540 nm波长下测定OD值。并以0.1 mg/mL的阿卡波糖作为阳性对照。计算如公式(2)所示:
α-淀粉酶抑制率![]()
(2)
式中:A5,样品在540 nm处的吸光度;A6,不加样品淀粉和酶在540 nm处的吸光度;A7,不加酶样品在540 nm处的吸光度;A8,淀粉在540 nm处的吸光度。
1.3.5 体外模拟消化实验
1.3.5.1 模拟胃肠消化
参照CHEN等[15]的方法稍作修改。模拟口腔液:将7 500 U唾液淀粉酶加入到100 mL口腔电解质溶液(0.75 mmol/L CaCl2·2H2O、2 mol/L KCl和0.5 mol/L KH2PO4)中,室温搅拌10 min,用2 mol/L NaOH将溶液pH值调节至7.0;模拟胃液:将2×105 U胃蛋白酶加入到100 mL胃电解质溶液(0.5 mol/L KCl、1 mol/L NaHCO3、2 mol/L NaCl和0.15 mol/L CaCl2)中,室温搅拌10 min,用2 mol/L HCl溶液将pH值调节至2.0;模拟肠液:将5×104 U胰脂肪酶加入到200 mL肠电解质溶液(40 mmol/L胆汁盐、0.5 mol/L KCl、1.5 mmol/L CaCl2·2H2O、400 U/mL胰液)中,室温搅拌10 min,用2 mol/L NaOH溶液将pH值调节至7.0。体外模拟消化:将1 mg/mL WKBPs样品溶液与口腔消化液1∶1(体积比)混合,于37 ℃、200 r/min振荡2 min,立即加入2 mol/L HCl溶液调节pH值至2.0以停止口腔模拟消化。然后加入10 mL的胃液,在37 ℃、200 r/min的振荡条件下孵化2 h,随后迅速添加2 mL 2 mol/L NaOH溶液调节pH值至7.0,以终止胃模拟消化。之后于消化体系中加入10 mL肠液,200 r/min、37 ℃振荡孵育2 h。分别于胃消化时间为0、30、60、90、120 min以及肠消化时间为0、30、60、90、120 min时吸取适量样品,于沸水浴中加热10 min进行灭酶处理,5 000 r/min离心10 min后取上清液,测定胃肠道消化过程中WKBPs对α-淀粉酶和α-葡萄糖苷酶活性影响。
1.3.5.2 WKBPs对淀粉消化率影响
参照WANG等[16]的方法稍作修改。参照1.3.5.1节的体外模拟消化体系,准确称取200 mg玉米淀粉,加入不同浓度的WKBPs(0、10、20、30、40、50 mg)模拟胃肠道消化,取1 mL肠消化时间为0、20、40、60、90、120、150、180 min的消化液,沸水浴灭酶10 min,于5 000 r/min离心10 min后取上清液100 μL,加入到900 μL淀粉葡萄糖苷酶溶液(1.1 mg/mL),使样品反应体系中淀粉葡萄糖苷酶终质量浓度为1 mg/mL,于37 ℃孵育20 min后,沸水浴加热10 min立即流动水冷却至室温,5 000 r/min离心10 min取上清液,用葡萄糖试剂盒测定上清液中葡萄糖的含量,淀粉水解率计算如公式(3)所示:
淀粉水解率![]()
(3)
式中:GT,葡萄糖含量,mg;TS,总淀粉含量,mg;0.9,淀粉与葡萄糖的质量转换系数。
1.4 数据处理
每组实验重复3次,实验结果采用“平均值±标准差(X±SD)”表示,使用Graphpad Prism 8和Origin 2019软件作图,通过SPSS 20对数据进行统计分析。
2 结果与分析
2.1 氨基酸组成成分分析
氨基酸是蛋白质的基本组成单位,必需氨基酸是指人体不能合成或合成速度不能满足人体需要的一类氨基酸,依赖食物蛋白质供给,必需氨基酸摄入不足会影响体内的氮平衡,严重时会引起一系列健康问题,如免疫系统受损、生长迟缓、代谢功能衰退等慢性疾病[17]。本研究利用氨基酸分析仪分析发酵前后白芸豆氨基酸组成变化,探究发酵产物降糖活性与氨基酸组成之间的潜在关系。结果如表1所示,发酵前后白芸豆中共有17种氨基酸被检测出来(由于氨基酸检测为酸水解法,因此色氨酸未检测)。与未发酵的白芸豆相比,发酵后的白芸豆必需氨基酸含量从6.47 g提高到10.66 g,疏水性氨基酸含量从7.36 g增加到13.81 g,碱性氨基酸含量从2.49 g/100 g增加到3.65 g/100 g。研究表明,疏水性氨基酸和碱性氨基酸可能与抗氧化、降血糖等生物活性有关,一般来说,疏水性氨基酸和碱性氨基酸含量越高,肽的抗氧化、降糖活性越强[18]。
表1 氨基酸组成成分分析 单位:g/100 g
Table 1 Analysis of amino acid composition
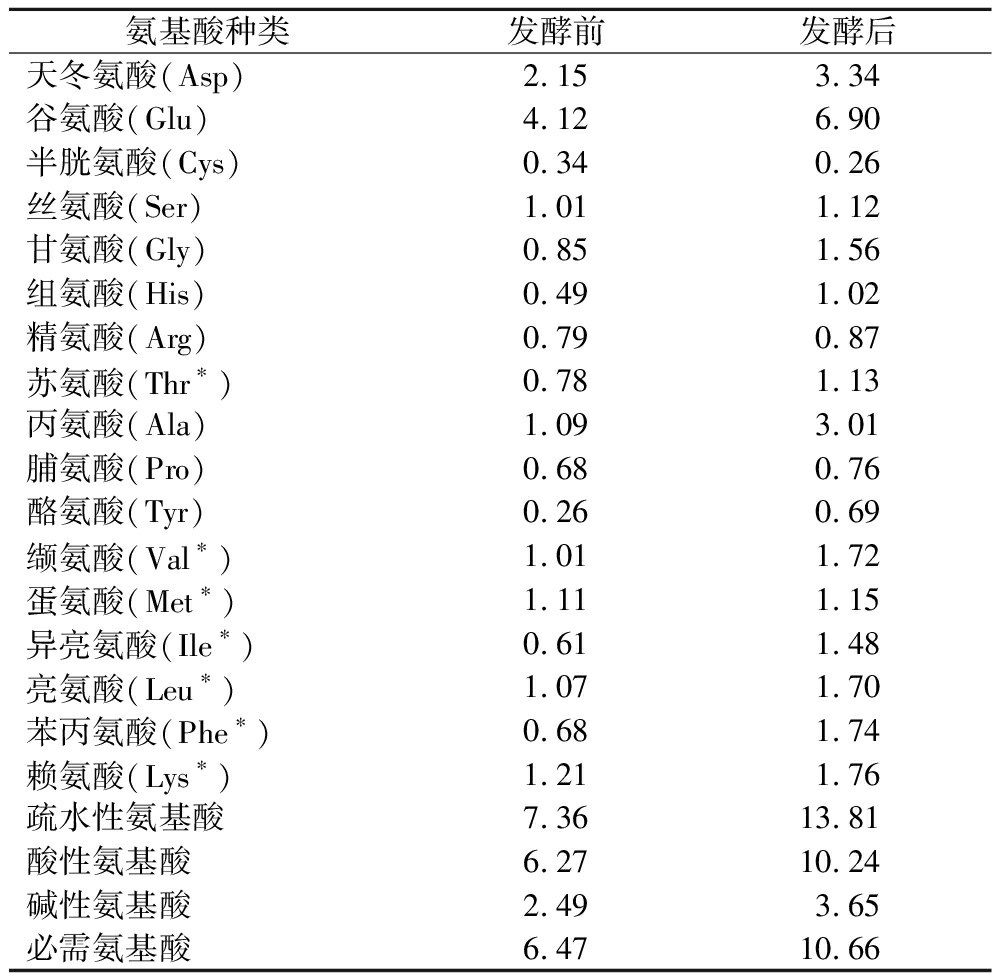
氨基酸种类发酵前发酵后天冬氨酸(Asp)2.153.34谷氨酸(Glu)4.126.90半胱氨酸(Cys)0.340.26丝氨酸(Ser)1.011.12甘氨酸(Gly)0.851.56组氨酸(His)0.491.02精氨酸(Arg)0.790.87苏氨酸(Thr∗)0.781.13丙氨酸(Ala)1.093.01脯氨酸(Pro)0.680.76酪氨酸(Tyr)0.260.69缬氨酸(Val∗)1.011.72蛋氨酸(Met∗)1.111.15异亮氨酸(Ile∗)0.611.48亮氨酸(Leu∗)1.071.70苯丙氨酸(Phe∗)0.681.74赖氨酸(Lys∗)1.211.76疏水性氨基酸7.3613.81酸性氨基酸6.2710.24碱性氨基酸2.493.65必需氨基酸6.4710.66
注:*为必需氨基酸。
2.2 相对分子质量分布
据报道,枯草芽孢杆菌和米曲霉复合发酵既能水解末端肽键,又能水解中间肽键,从而有效的将白芸豆蛋白水解成低分子肽或游离氨基酸[19]。通过GPC法分析复合发酵制备WKBPs的分子质量分布,结果如图1和表2所示,分子质量<10 000 Da的肽段含量为98.35%、分子质量<5 000 Da的肽段含量为92.62%、分子质量<3 000 Da的肽段含量为86.83%、分子质量<1 000 Da的肽段含量为68.44%。结果表明,WKBPs分子质量主要集中在1 000 Da以下,即复合发酵制备的WKBPs多集中在7肽、8肽、9肽。此外,结果显示白芸豆发酵液中也存在游离氨基酸(<180 Da)(保留时间范围为25~35 min)。相关研究指出,多肽相对于蛋白质来说具有较小的分子质量,通常低分子质量多肽更容易穿透细胞膜或者组织屏障,从而更容易达到靶位点并发挥其生物活性[20]。

图1 WKBPs相对分子质量分布
Fig.1 Relative molecular weight distribution of WKBPs
表2 WKBPs分子质量分布结果
Table 2 Molecular weight distribution of white kidney bean polypeptides
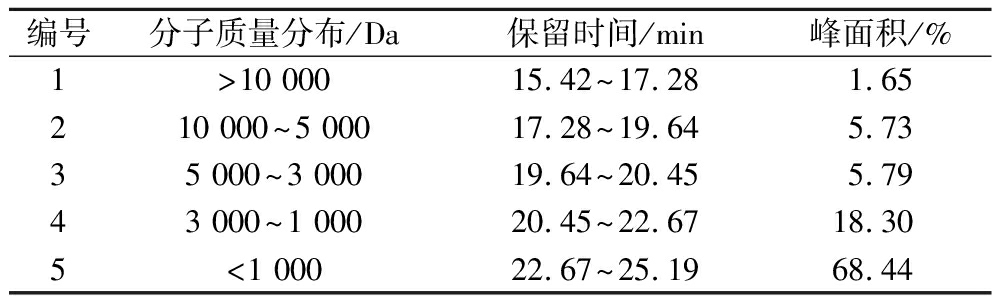
编号分子质量分布/Da保留时间/min峰面积/%1>10 00015.42~17.281.65210 000~5 00017.28~19.645.7335 000~3 00019.64~20.455.7943 000~1 00020.45~22.6718.305<1 00022.67~25.1968.44
2.3 体外降糖活性
α-淀粉酶和α-葡萄糖苷酶是碳水化合物消化吸收过程中的关键作用酶。评估WKBPs对α-淀粉酶和α-葡萄糖苷酶的抑制活性,结果如图2所示,在0.2~1.0 mg/mL质量浓度范围内,WKBPs对α-淀粉酶和α-葡萄糖苷酶的抑制作用呈剂量依赖性,随质量浓度的增加而升高;在相同质量浓度下,WKBPs对α-淀粉酶抑制作用高于α-葡萄糖苷酶,其IC50值分别为0.53和0.64 mg/mL。当WKBPs质量浓度为1.0 mg/mL时,其对α-淀粉酶和α-葡萄糖苷酶的抑制率分别为78.64%和65.69%,表明WKBPs具有较强的体外降糖活性,但对α-葡萄糖苷酶和α-淀粉酶的抑制作用整体略低于阿卡波糖。研究表明,α-淀粉酶抑制剂可有效阻断或延缓碳水化合物分解成小分子寡糖,使葡萄糖在人体小肠的吸收利用速度减缓,避免餐后血糖迅速升高。而α-葡萄糖苷酶抑制剂可抑制小肠刷状缘α-葡萄糖苷酶,阻断1,4-葡萄糖苷酶键的水解,延缓碳水化合物进一步转化为葡萄糖,从而有效降低餐后血糖[21]。
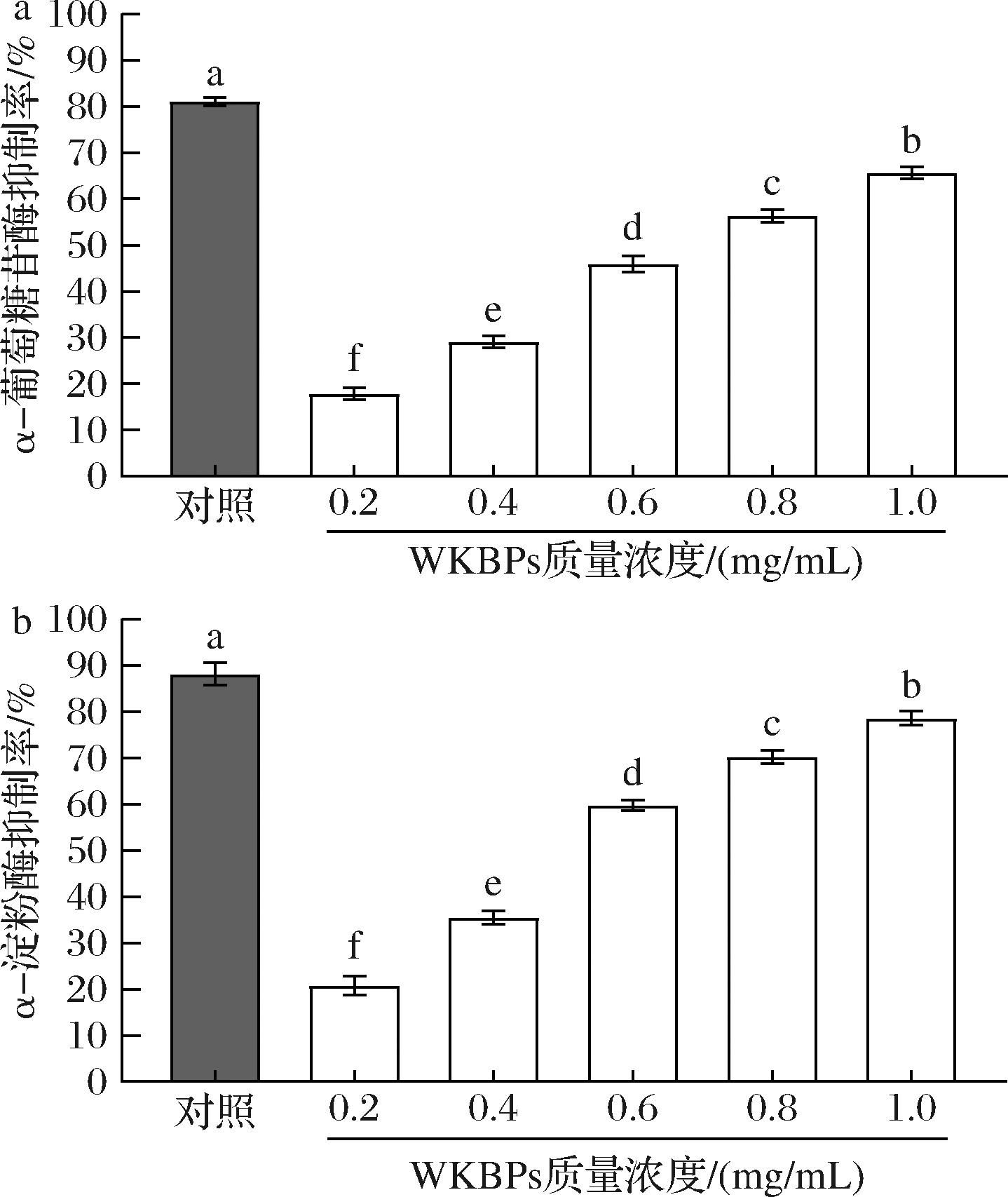
a-α-葡萄糖苷酶抑制率;b-α-淀粉酶抑制率
图2 WKBPs降糖活性
Fig.2 Hypoglycemic activity of WKBPs
注:不同小写字母表示差异显著性(下同)。
2.4 体外模拟消化分析
2.4.1 模拟胃肠消化对WKBPs降糖活性的影响
以WKBPs为研究对象,α-淀粉酶和α-葡萄糖苷酶抑制率为评价指标,采用体外模拟胃肠道消化实验探究经胃肠消化后WKBPs的体外降糖活性变化规律,结果如图3所示,在胃消化阶段,α-淀粉酶抑制率和α-葡萄糖苷酶抑制率随消化时间的增加而升高,在120 min达到最大值,分别81.69%和72.82%,进入肠消化阶段,抑制率随着消化时间的增加而降低,在240 min达到平衡,分别为66.75%和55.82%。推测可能是由于在胃消化阶段WKBPs经胃蛋白酶水解成低分子质量小肽,并且更多的疏水性氨基酸侧链暴露在外,消化产物与酶的接触面积增加[22],提高酶活抑制率,而进入肠消化阶段,由于pH环境(pH值为2.0~7.0)的急剧变化和胰蛋白酶对WKBPs的降解,导致WKBPs与降糖活性有关的关键氨基酸序列或结构被蛋白酶破坏从而使其活性降低。
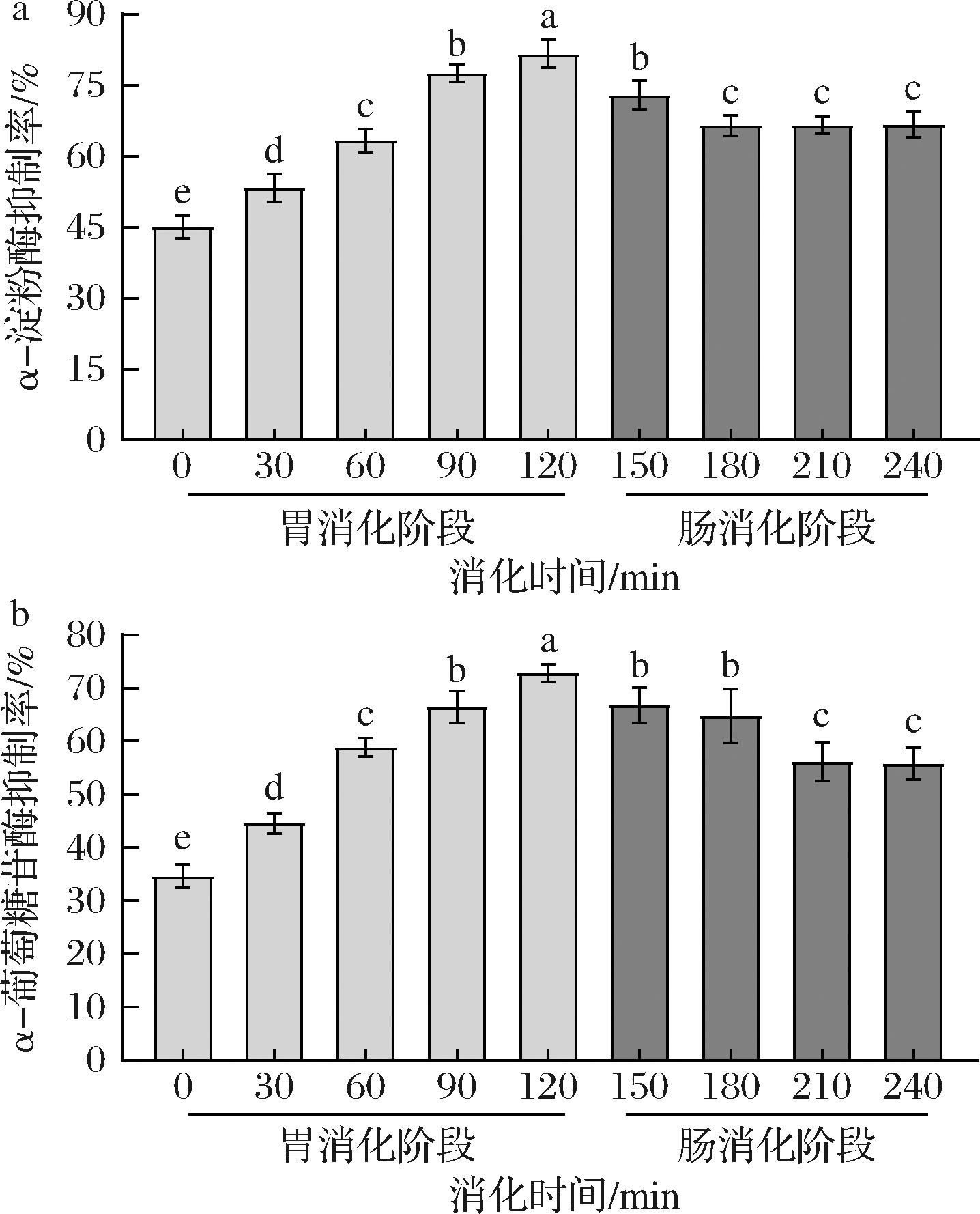
a-α-淀粉酶抑制率;b-α-葡萄糖苷酶抑制率
图3 体外模拟胃肠消化过程中WKBPs降糖活性变化
Fig.3 Changes of hypoglycemic activity of WKBPs during gastrointestinal digestion were simulated in vitro
2.4.2 WKBPs对淀粉消化率的影响
进一步基于体外模拟胃肠道消化实验评估不同添加量的WKBPs对玉米淀粉消化性的影响,如图4所示。
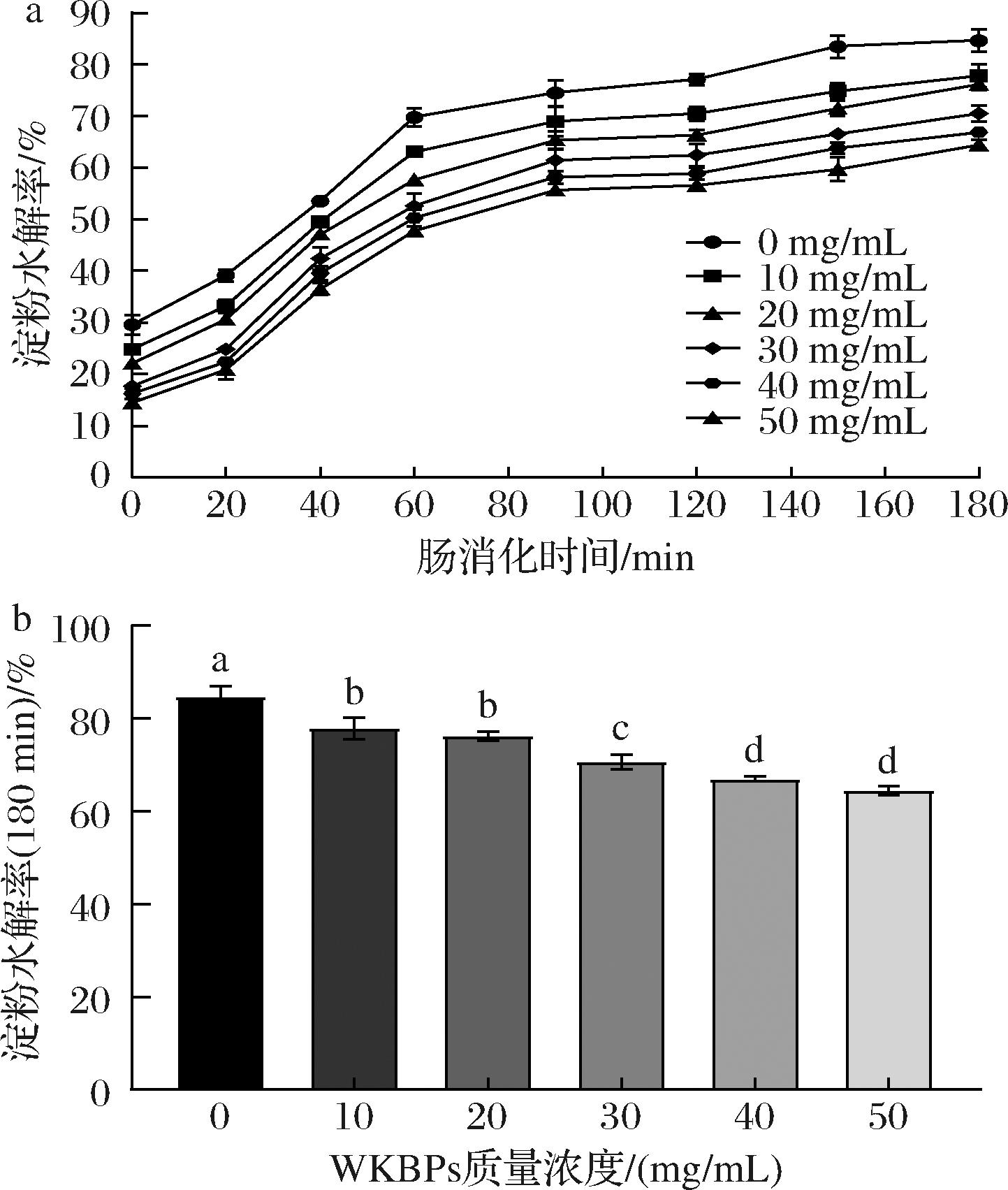
a-淀粉水解率;b-180 min淀粉水解率
图4 WKBPs对淀粉水解率影响
Fig.4 Effect of WKBPs on starch hydrolysis rate
由图4-a可知,在0~60 min内,淀粉水解率快速上升,60 min后呈缓慢上升并逐渐趋于平缓,且玉米淀粉水解率呈剂量依赖性,随着WKBPs添加量的增加,淀粉水解率呈下降趋势,模拟肠消化180 min后,对照组中玉米淀粉水解率为84.66%,其次为77.81%(10 mg/mL WKBPs)、76.16%(20 mg/mL WKBPs)、70.57%(30 mg/mL WKBPs)、66.91%(40 mg/mL WKBPs)和64.43%(50 mg/mL WKBPs)。以上结果表明,在体外模拟胃肠道消化体系下,WKBPs可以有效降低玉米淀粉的水解率,且呈现一定的量效关系,当WKBPs质量浓度为50 mg/mL时,玉米淀粉的水解率降低了20.23%。已有研究报道,小麦蛋白水解物的降糖活性研究中也发现了类似的结果[23]。这可能是由于WKBPs会黏附在淀粉颗粒表面或周围基质中,增大了淀粉颗粒尺寸进而减小酶作用面积,或阻碍了淀粉与消化酶的接触来减缓淀粉消化。同时,WKBPs也可以作为碳水化合物消化酶抑制剂,可能与底物淀粉存在竞争性结合消化酶的活性位点,从而减慢淀粉的消化速率[24]。
3 结论
体外模拟消化是探究摄入物在模拟胃肠道消化环境下是否能够发挥功能活性的重要技术手段,是连接体内试验与体外营养评价的重要桥梁。本研究采用体外模拟消化实验探究经胃肠道消化后WKBPs的体外降糖活性变化规律。结果表明:WKBPs对α-葡萄糖苷酶和α-淀粉酶的抑制作用呈剂量依赖性,其IC50值分别为0.64和0.53 mg/mL;在胃肠道模拟消化阶段,α-葡萄糖苷酶抑制率和α-淀粉酶抑制率随消化时间的增加呈先上升后下降趋于平缓的趋势;进一步基于体外模拟胃肠道消化实验评估不同添加量的WKBPs对玉米淀粉消化性的影响,结果表明,WKBPs对淀粉水解率呈显著的抑制作用和量效关系,与对照组(不含WKBPs)相比,当WKBPs质量浓度为50 mg/mL时,玉米淀粉最终水解率降低了20.23%。本研究证明WKBPs所发挥的降糖活性可指导开发适于患有高血糖和相关代谢疾病人群的低升糖指数食品,对高附加值豆类食品高值化利用具有重要的意义。在未来的研究中可以着重基于人体健康效应探究白芸豆多肽中功能活性肽的“构效-量效”关系、代谢通路及其临床应用。
[1] RACHDAOUI N. Insulin: The friend and the foe in the development of type 2 diabetes mellitus[J]. International Journal of Molecular Sciences, 2020, 21(5):1770.
[2] VAN SMOORENBURG A N, HERTROIJS D F L, DEKKERS T, et al. Patients’ perspective on self-management: Type 2 diabetes in daily life[J]. BMC Health Services Research, 2019, 19(1):605.
[3] RIYAPHAN J, PHAM D C, LEONG M K, et al. In silico approaches to identify polyphenol compounds as α-glucosidase and α-amylase inhibitors against type-II diabetes[J]. Biomolecules, 2021, 11(12):1877.
[4] BABA W N, MUDGIL P, KAMAL H, et al. Identification and characterization of novel α-amylase and α-glucosidase inhibitory peptides from camel whey proteins[J]. Journal of Dairy Science, 2021, 104(2):1364-1377.
[5] NAKAMURA A, OHBOSHI H, SAKAI M, et al. Extraction of water-soluble polysaccharides from kidney beans and examination of their protein dispersion and stabilization properties under acidic conditions[J]. Food Research International, 2021, 144:110357.
[6] WEN C T, LIU G Y, REN J Y, et al. Current progress in the extraction, functional properties, interaction with polyphenols, and application of legume protein[J]. Journal of Agricultural and Food Chemistry, 2022, 70(4):992-1002.
[7] 毛小雨. 体外模拟消化对芸豆蛋白结构特征及抗氧化活性的影响研究[D]. 大庆: 黑龙江八一农垦大学, 2020.MAO X Y. Effects of simulated digestion on structural characteristics and antioxidant activity of kidney bean protein in vitro[D]. Daqing: Heilongjiang Bayi Agricultural University, 2020.
[8] TANAKA M, HONDA Y, MIWA S, et al. Comparison of the effects of roasted and boiled red kidney beans (Phaseolus vulgaris L.) on glucose/lipid metabolism and intestinal immunity in a high-fat diet-induced murine obesity model[J]. Journal of Food Science, 2019, 84(5):1180-1187.
[9] GRAZIANI D, RIBEIRO J V V, CRUZ V S, et al. Oxidonitrergic and antioxidant effects of a low molecular weight peptide fraction from hardened bean (Phaseolus vulgaris) on endothelium[J]. Brazilian Journal of Medical and Biological Research, 2021, 54(6): e10423.
[10] BORGES MART NEZ J E, DEL ROSARIO MOGUEL CONCHA D, GALLARDO VEL
NEZ J E, DEL ROSARIO MOGUEL CONCHA D, GALLARDO VEL ZQUEZ T G, et al. Anti-inflammatory properties of phenolic extracts from Phaseolus vulgaris and Pisum sativum during germination[J]. Food Bioscience, 2021, 42:101067.
ZQUEZ T G, et al. Anti-inflammatory properties of phenolic extracts from Phaseolus vulgaris and Pisum sativum during germination[J]. Food Bioscience, 2021, 42:101067.
[11] BAI Z Y, HUANG X J, WU G J, et al. Polysaccharides from red kidney bean alleviating hyperglycemia and hyperlipidemia in type 2 diabetic rats via gut microbiota and lipid metabolic modulation[J]. Food Chemistry, 2023, 404:134598.
[12] CAO H W, HUANG Q L, SHI J R, et al. Effect of conventional and microwave heating treatment on antioxidant activity of quinoa protein after simulated gastrointestinal digestion[J]. Food Chemistry, 2023, 415:135763.
[13] LV Q Q, CAO J J, LIU R, et al. Structural characterization, α-amylase and α-glucosidase inhibitory activities of polysaccharides from wheat bran[J]. Food Chemistry, 2021, 341:128218.
[14] WANG S, LI Y, HUANG D J, et al. The inhibitory mechanism of chlorogenic acid and its acylated derivatives on α-amylase and α-glucosidase[J]. Food Chemistry, 2022, 372:131334.
[15] CHEN X C, XU Y T, DU X P, et al. Effect of Porphyra haitanensis polyphenols from different harvest periods on hypoglycaemic activity based on in vitro digestion and widely targeted metabolomic analysis[J]. Food Chemistry, 2024, 437:137793.
[16] WANG X, YANG Z T, SHEN S X, et al. Inhibitory effects of chlorophylls and its derivative on starch digestion in vitro[J]. Food Chemistry, 2023, 413:135377.
[17] MCCANN J R, RAWLS J F. Essential amino acid metabolites as chemical mediators of host-microbe interaction in the gut[J]. Annual Review of Microbiology, 2023, 77:479-497.
[18] AKINYEDE A I, FAGBEMI T N, OSUNDAHUNSI O F, et al. Amino acid composition and antioxidant properties of the enzymatic hydrolysate of calabash nutmeg (Monodora myristica) and its membrane ultrafiltration peptide fractions[J]. Journal of Food Biochemistry, 2021, 45(3): e13437.
[19] LI X D, YANG X K, UMAR M, et al. Expression of a novel dual-functional polypeptide and its pharmacological action research[J]. Life Sciences, 2021, 267:118890.
[20] REN Y, LIANG K, JIN Y Q, et al. Identification and characterization of two novel α-glucosidase inhibitory oligopeptides from hemp (Cannabis sativa L.) seed protein[J]. Journal of Functional Foods, 2016, 26:439-450.
[21] KAUR I, TANWAR B. Quinoa beverages: Formulation, processing and potential health benefits[J]. Romanian Journal of Diabetes Nutrition and Metabolic Diseases, 2016, 23(2):215-225.
[22] 赵才冬, 漆姚姚, 雷楚文, 等. 甲鱼蛋蛋白水解物的体外消化及对抗氧化和α-葡萄糖苷酶抑制活性的影响[J]. 中国食品学报, 2022, 22(10):126-133.ZHAO C D, QI Y Y, LEI C W, et al. The digestion characteristic of protein hydrolysate of soft-shelled turtle egg and its effects on antioxidative and α-glucosidase inhibitory activities[J]. Journal of Chinese Institute of Food Science and Technology, 2022, 22(10):126-133.
[23] LU X X, MA R R, ZHAN J L, et al. Starch digestion retarded by wheat protein hydrolysates with different degrees of hydrolysis[J]. Food Chemistry, 2023, 408:135153.
[24] GONZ LEZ-MONTOYA M, HERN
LEZ-MONTOYA M, HERN NDEZ-LEDESMA B, MORA-ESCOBEDO R, et al. Bioactive peptides from germinated soybean with anti-diabetic potential by inhibition of dipeptidyl peptidase-IV, α-amylase, and α-glucosidase enzymes[J]. International Journal of Molecular Sciences, 2018, 19(10):2883.
NDEZ-LEDESMA B, MORA-ESCOBEDO R, et al. Bioactive peptides from germinated soybean with anti-diabetic potential by inhibition of dipeptidyl peptidase-IV, α-amylase, and α-glucosidase enzymes[J]. International Journal of Molecular Sciences, 2018, 19(10):2883.