青刺果(Prinsepia utilis Royle),别名打油果,蔷薇科扁核木属,是一种常绿灌木,主要分布在云贵川等海拔较高的地区,也是滇少数民族长期食药用的植物之一。青刺多部位检测到橙皮苷、槲皮素等活性化合物,这些活性化合物具有极强的抗氧化性[1-2]。从青刺果中提取到的多糖类和黄酮类提取物,具有降血糖和血脂、保护和免疫调节等药理作用[3-4]。青刺果仁含油率40%以上,青刺果油具有一定调节血脂、抗氧化和体外抑制血小板聚集的作用[5]。青刺果种子和油粕中含有多种营养物质及酚类物质,具有良好的抗氧化活性。油粕含有丰富的活性物质,其中粗蛋白含量高达24.58%[6]。目前青刺果的开发利用以油为主[7-8],有关蛋白质的部分未得到合理开发利用,有必要对其进行综合利用。
干酪是一类以牛乳为原料的发酵制品,因含有丰富的营养成分,被冠以“黄金奶”的美称,是一种营养丰富的奶制品。在干酪的发酵成熟过程中,用于发酵的微生物会将其中的蛋白质、脂肪等物质分解成小分子物质,故成熟后的干酪相比牛奶更适于人体的吸收利用。干酪促熟的本质是加速其在成熟过程中的生化反应[9-10]。凝乳酶是干酪生产中使牛乳凝固的关键性酶,主要包含动物源凝乳酶、植物源凝乳酶和微生物源凝乳酶3种。除凝乳作用外,凝乳酶还对干酪的质构特性及特有风味的形成起到重要作用。凝乳酶能有效地凝固乳,并在胃中较长时间保留乳蛋白沉淀物,使沉淀物充分暴露于蛋白水解酶[11]。它专门裂解酪蛋白链中的部分多肽键,使牛奶凝结,可以用于干酪的生产加工[12]。传统工艺主要以动物源凝乳酶为酶制剂,但目前动物源凝乳酶的生产量远远无法满足工业生产的需要。奶牛数量的逐渐减少、干酪需求量的逐渐增加以及动物源凝乳酶可能会受到如犹太食品认证和素食批准等的宗教原因的限制等因素使研究人员逐渐把目光转移到其他凝乳酶的开发[12]。而微生物凝乳酶在干酪成熟过程中不能产生正确的风味,暴露于化学物质中还会使其性质发生重要变化。传统植物源凝乳酶在干酪加工中容易产生苦味肽,凝乳活性低,蛋白水解活性高,产品风味与传统差距较大而导致其开发受到限制,在干酪的加工应用较少。因此,寻找新的植物源凝乳酶成为了凝乳酶开发的一个重要途径。
前期发现青刺果蛋白提取物具有凝乳效果,有可能成为新的凝乳酶制剂应用于干酪的加工中。通过AS分级沉淀法[13]发现饱和度20%~50% AS沉淀出的蛋白具有较好的凝乳特性,可以将其作为凝乳剂用于干酪加工;通过酶学特性研究,结果显示,该凝乳酶的的最适温度为80 ℃,最适pH值为5,CaCl2对凝乳酶凝乳活力有促进作用,NaCl对凝乳酶凝乳活力主要起抑制作用,可以进一步用于干酪加工。本实验利用青刺果凝乳酶加工发酵型干酪,以木瓜凝乳酶和小牛凝乳酶为对照,通过分析3种凝乳酶加工干酪的色差、质构、游离脂肪酸和游离氨基酸等,探究青刺果凝乳酶对发酵型干酪质构特性和主要风味物质的影响,为青刺果凝乳酶在干酪加工中的应用提供参考。
1 材料与方法
1.1 材料与试剂
青刺果,云南省丽江市云南尚品馆;奶粉,市售安佳脱脂奶粉;新鲜牛奶,云南省昆明市嵩明镇农家自产奶。
(NH4)2SO4(分析纯)、NaCl(分析纯)、NaOH(分析纯),天津市风船化学试剂科技有限公司;CaCl2(分析纯),河南省豫万邦供应链管理有限公司;茚三酮(分析纯),天津市大茂化学试剂厂;甲醇(色谱纯),正己烷(色谱纯),赛默飞世尔科技(中国)科技有限公司;盐酸(分析纯),川东化工有限公司;发酵剂(50 DCU),丹尼斯克(中国)有限公司。
1.2 仪器与设备
FW-200高速万能粉碎机,北京中兴伟业仪器有限公司;FD-1A-50真空冷冻干燥机,上海比朗仪器制造有限公司;HH-6数显恒温水浴锅,国华电器有限公司;SHZ-D循环水式真空泵,巩义市予华仪器有限责任公司;AX223 ZH/E电子天平、STARTER3100pH计,奥豪斯仪器(常州)有限公司;EPED-ESL-10TH超纯水机,南京易普易达科技发展有限公司;SCQ-9201B超声波提取仪,上海声彦超声波仪器有限公司;EASY-nLC1200串联液相色谱仪、Q-Exactive HF-X串联质谱仪,美国Thermo Scientific公司;Vortex-Genie 2漩涡混匀仪,美国SI公司;ABS-MS-078恒温混匀仪,合肥艾本森科学仪器有限公司;TGL20M高速冷冻离心机,北京中兴伟业仪器有限公司;LNG-T98冷冻离心浓缩干燥器,太仓市华美生化仪器厂;HWS24电热恒温水浴锅,上海一恒科技有限公司;JJ-1电动磁力搅拌器,常州澳华仪器有限公司;LD-6M大型离心机,四川蜀科仪器有限公司;DW-40L262冰箱(-40 ℃),青岛海尔特种电器有限公司;SCIENTZ-18 N冷冻干燥机,宁波新芝生物科技股份有限公司;CM-5分光色差计,广州卓协议仪器设备有限公司;TA.XT-Plus质构仪,超技仪器有限公司;S-433氨基酸分析仪,德国Sykam公司。
1.3 实验方法
1.3.1 青刺果凝乳酶的制备
先将筛选过后的青刺果进行粉碎操作,称取100 g粉碎后的青刺果放入烧杯中。按照料液比1∶10,加入0.3 mol/L的NaCl溶液1 000 mL,后加入1 mol/L的NaOH溶液至混合液pH值为7.2。在30 ℃水浴条件下,用电动搅拌器搅拌,用纱布过滤提取1 h,再用高速离心机在4 000 r/min条件下离心15 min。去除上层油脂和下层沉淀,剩余澄清液即为目标盐提液。量取一定体积的盐提液,使用磁力搅拌器在500 r/min的条件下缓慢加入硫酸铵粉末至饱和程度达20%~50%,放置于4 ℃冰箱中,沉淀20 min,再使用高速离心机在4 500 r/min的条件下离心15 min,取出沉淀,溶解在水中,透析48 h(透析袋截留分子质量为3.5 kDa),经真空冷冻干燥后,得到青刺果凝乳酶,将其置于-40 ℃条件下进行保存,用于后续干酪加工。
1.3.2 发酵型干酪的加工工艺
新鲜水牛乳→巴氏杀菌(70 ℃,15 s)→冷却(38 ℃)→发酵剂(0.3%,质量分数,下同)→搅拌溶解→pH值降至6.2→CaCl2溶液(0.1%,质量浓度为200 mg/mL)→搅拌均匀→NaCl溶液溶解的凝乳酶(0.2%,质量浓度为2 mg/mL)→搅拌均匀→凝乳(40 ℃水浴)→pH值降至5.3→切割、排乳清→pH值降至5.0→倒出→堆叠(2%的食盐)→模型压制成型→真空包装→贮藏(4 ℃)。
1.3.3 干酪的得率及色差测定
准确记录所使用的各原料质量以便计算干酪得率。使用原料乳2 L加工干酪并计算得率。计算如公式(1):
得率![]()
(1)
式中:m,干酪的质量;M,原料总质量。
利用分光色差仪测定得到的青刺果凝乳酶加工干酪(以下简称QCG组)、木瓜凝乳酶加工干酪(以下简称MG组)和小牛凝乳酶加工干酪(以下简称XN组)的亮度值(L*)、红度值(a*)和黄度值(b*)。L*值表示从黑色(0)到白色(100) 变化,a*值表示从红色(100)到绿色(-80)变化,b*值表示从黄色 (100) 到蓝色(-80) 变化。利用公式计算总色差值ΔE,得到3种干酪之间的色度偏差。计算如公式(2):
(2)
1.3.4 干酪的质构测定
硬度为样品达到一定变形所必需的力(g);弹性为第1次压缩的结束与第2次压缩的开始间,样品能恢复的高度之间的比值;凝聚性为第2次压缩出现的峰面积与第1次的峰面积的比值;黏性为硬度与内聚性的乘积(g);咀嚼度为黏性与弹性的乘积,即硬度、内聚性、弹性三者之积(g)[14]。
利用TPA试验测定质构特性参数,使用样品2次压缩的方法,各项指标均重复3次。将样品切成2 cm×2 cm×2 cm的小块,放置在压缩盘中心,方向垂直于压缩盘。质构仪测定参数设定:T形探头,直径38 mm;测试压缩比50%;探头下行速度1 cm/sec;探头返回速度1 cm/sec,两次间隔时间5 s,触发力5.0 g,获得干酪的硬度、弹性、凝聚性、胶黏性、咀嚼性、恢复性等质构特性参数。
1.3.5 干酪中游离脂肪酸测定
参照GB 5009.168—2016《食品安全国家标准 食品中脂肪酸的测定》,对样品进行预处理。
样品前处理办法:称取样品0.3 g,加入3 mL正己烷,用0.8 mol/L NaOH-甲醇溶液密封,在超声振荡仪中超声2 h后,静置30 min,用高速离心机在3 000 r/min的条件下离心10 min,静置30 min,分层,取出上层溶液,样品用0.45 μm微滤膜过滤。使用色谱仪进行测定。GC色谱条件:色谱柱:Agilent 19091 N-133:HP-INNOWax(30 m×250 μm×0.25 μm);气体:氦气(99.99%);流速1 mL/min;进样口温度280 ℃;分流比20∶50;柱箱升温程序为初始温度50 ℃,保持3 min,运行时间3 min;梯度1:温度为210 ℃,保持0 min,速率为8 ℃/min,运行时间23 min;梯度2:温度为225 ℃,保持7 min,速率为1 ℃/min,运行时间45 min。MS参数条件:离子源温度230 ℃;柱温度50 ℃;进样口温度280 ℃;色谱柱流量1 mL/min;最高使用温度400 ℃;四极杆温度150 ℃;MSD质量选择检测器。
1.3.6 干酪中游离氨基酸测定
参照GB 5009.124—2016《食品安全国家标准 食品中氨基酸的测定》,使用氨基酸自动分析仪对样品中的游离氨基酸进行测定。
样品前处理方法:称取干酪样品30 mg,称好的样品放入20 mL安瓿瓶中(样品避免黏在瓶壁),随后加入6 mol/L的HCl溶液10 mL,超声波振荡,样品完全溶解后,用喷火枪封管,然后将封好口的安瓿瓶置于110 ℃的烘箱中,23 h后取出冷却,用滤纸过滤后的滤液放到石英坩埚中,在通风橱中水浴锅70 ℃蒸干,再加入样品稀释液3 mL,混匀后,用0.45 μm滤膜过滤,滤液加入进样瓶,等待上机。氨基酸自动分析仪的条件:采用离子交换色谱法-茚三酮柱后衍生法测定,阳离子交换柱(4.6 mm×60 mm);柱温57 ℃,检测器温度135 ℃;缓冲溶液的流速0.45 mL/min,茚三酮的流速0.25 mL/min;检测波长:第一通道570 nm,第二通道440 nm;进样量20 μL;分析时间130 min。
2 结果与分析
2.1 干酪的得率及色差分析
使用3种凝乳酶加工发酵型干酪,XN组得率15.2%,QCG组得率14.6%,MG组得率11.35%。表1给出了不同凝乳酶加工干酪的色差值结果。其中,QCG组的L*值和a*值与XN组差异不显著(P>0.05),但显著低于MG组(P<0.05)。3种干酪的a*值和b*值都为正值,MG组的色泽偏红,XN组的色泽偏黄。3种干酪的ΔE值存在显著差异(P<0.05),QCG组的ΔE值介于对照组之间,XN组与MG组的差异最大。整体来说,QCG组呈乳白色,稍有光泽,与传统干酪相近,可以用于干酪的加工。
表1 干酪色差值
Table 1 Color difference of cheese
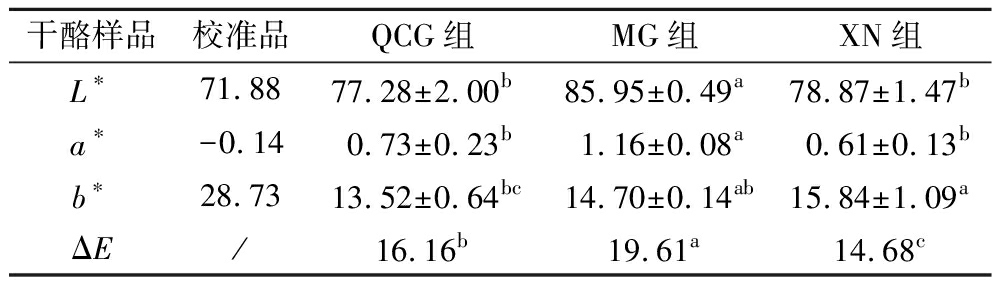
干酪样品校准品QCG组MG组XN组L∗71.8877.28±2.00b85.95±0.49a78.87±1.47ba∗-0.140.73±0.23b1.16±0.08a0.61±0.13bb∗28.7313.52±0.64bc14.70±0.14ab15.84±1.09aΔE/16.16b19.61a14.68c
注:同一行上标不同字母代表差异显著(P<0.05)(下同)。
2.2 干酪的质构特性分析
干酪质构对其口感影响深远,不同的加工方式对干酪质构特性也有不同的影响。如表2所示,3种干酪在硬度、凝聚性、黏性、咀嚼性和恢复性这5个方面均差异显著(P<0.05)。其中,QCG组在3种干酪中的硬度最大、凝聚性最好、黏性最强、咀嚼性最佳,恢复性最好,说明在此加工工艺条件下,QCG组具有更好的抗压性,可以形成更强劲稳定的胶束体系和较好的持续抵抗性[15]。QCG组和MG组的弹性差异不显著(P>0.05),相比XN组更富有弹性(P<0.05),这可能与不同种类凝乳酶作用的肽键差异有关。青刺果凝乳酶加工干酪相比传统干酪凝聚性更好、黏性更大、咀嚼性更好、恢复性更优,口感丰富,富有嚼劲,这说明青刺果凝乳酶加工干酪可以改善干酪质构特性,可以用于干酪的加工。
表2 质构测定特征参数
Table 2 Characteristic parameters of texture determination
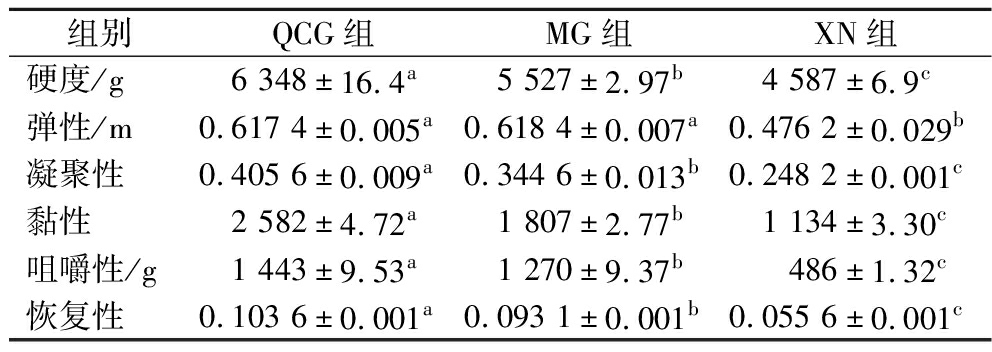
组别QCG组MG组XN组硬度/g6 348±16.4a5 527±2.97b4 587±6.9c弹性/m0.617 4±0.005a0.618 4±0.007a0.476 2±0.029b凝聚性0.405 6±0.009a0.344 6±0.013b0.248 2±0.001c黏性2 582±4.72a1 807±2.77b1 134±3.30c咀嚼性/g1 443±9.53a1 270±9.37b486±1.32c恢复性0.103 6±0.001a0.093 1±0.001b0.055 6±0.001c
2.3 干酪中游离脂肪酸分析
干酪的原料乳中存在脂肪。在发酵过程中,脂肪在脂肪酶的作用下水解成脂肪酸、醇类等化合物。脂肪降解对干酪风味的形成起着关键的作用。游离脂肪酸(free fatty acids,FFA)主要包含了短链脂肪酸(short-chain fatty acid,SCFA)、中链脂肪酸(medium-chain fatty acid,MCFA)、长链脂肪酸(long-chain fatty acid,LCFA)等,这些FFA是构成产品滋味和形成产品风味的重要原料。中短链的FFA具有典型的风味特征,长链FFA虽不直接呈味,但在食品风味形成中也有着特殊的作用[16]。在干酪制品中,月桂酸、肉豆蔻酸、棕榈酸、硬脂酸等游离脂肪酸的含量影响着干酪口感的圆润程度。
2.3.1 干酪的游离脂肪酸含量
如表3所示,QCG组和MG组的FFA共有23种。XN组共有22种,相较其他两组少了1种LCFA十三烷酸。QCG组的FFA总含量最高,但3种干酪的总含量差异不显著(P>0.05)。如图1所示,3组的LCFA在组内的含量均最多,MCFA次之,SCFA最低;QCG组的LCFA和MCFA含量相较MG组和XN组更高,SCFA含量高于XN组;MG组的LCFA和MCFA含量高于XN组,SCFA含量高于QCG组和XN组。
a-QCG组;b-MG组;c-XN组
图1 干酪游离脂肪酸测定谱图
Fig.1 Total ion chromatogram of free fatty acid in cheese
表3 干酪中游离脂肪酸含量
Table 3 Content of free fatty acids in cheese
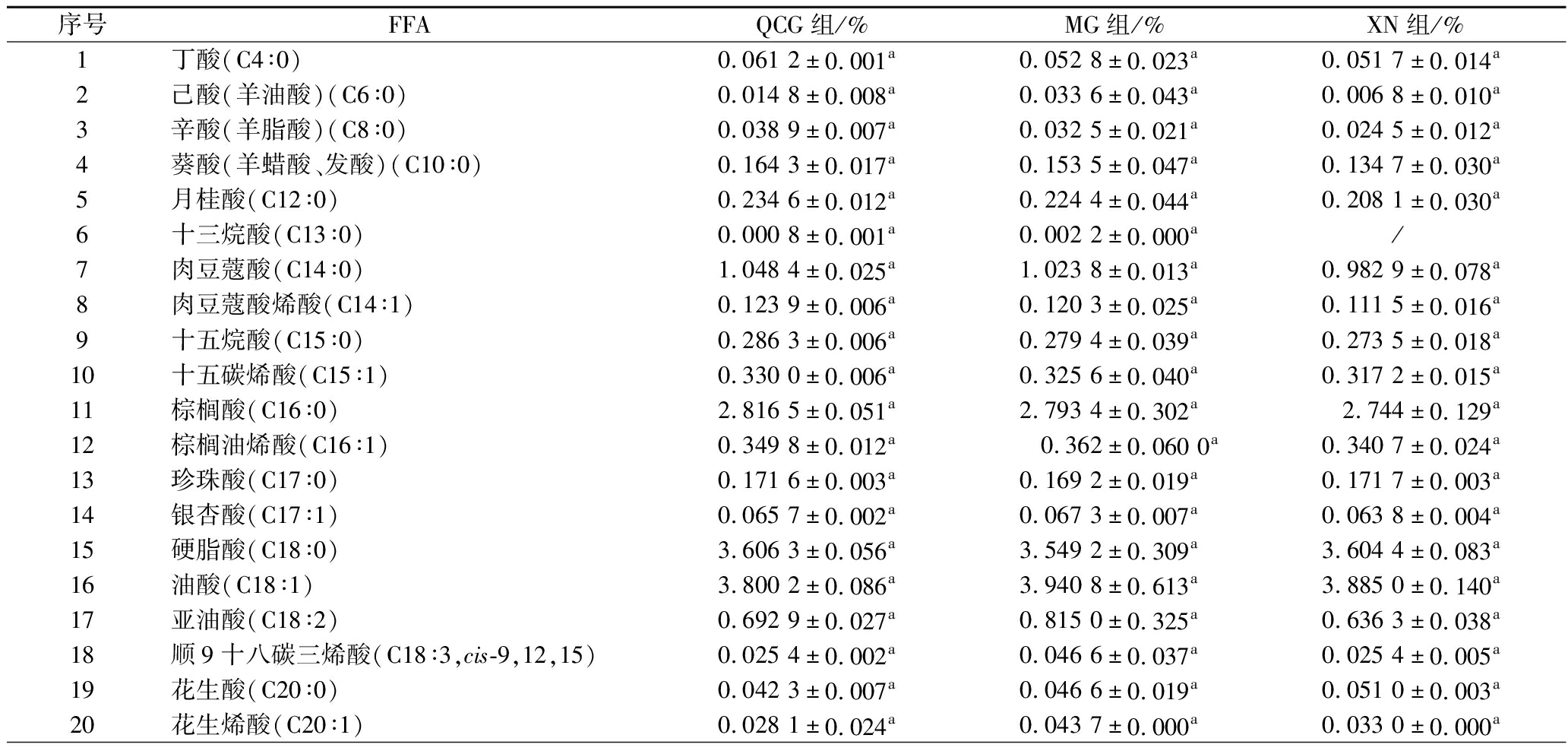
序号FFAQCG组/%MG组/%XN组/%1丁酸(C4∶0)0.061 2±0.001a0.052 8±0.023a0.051 7±0.014a2己酸(羊油酸)(C6∶0)0.014 8±0.008a0.033 6±0.043a0.006 8±0.010a3辛酸(羊脂酸)(C8∶0)0.038 9±0.007a0.032 5±0.021a0.024 5±0.012a4葵酸(羊蜡酸、发酸)(C10∶0)0.164 3±0.017a0.153 5±0.047a0.134 7±0.030a5月桂酸(C12∶0)0.234 6±0.012a0.224 4±0.044a0.208 1±0.030a6十三烷酸(C13∶0)0.000 8±0.001a0.002 2±0.000a/7肉豆蔻酸(C14∶0)1.048 4±0.025a1.023 8±0.013a0.982 9±0.078a8肉豆蔻酸烯酸(C14∶1)0.123 9±0.006a0.120 3±0.025a0.111 5±0.016a9十五烷酸(C15∶0)0.286 3±0.006a0.279 4±0.039a0.273 5±0.018a10十五碳烯酸(C15∶1)0.330 0±0.006a0.325 6±0.040a0.317 2±0.015a11棕榈酸(C16∶0)2.816 5±0.051a2.793 4±0.302a2.744±0.129a12棕榈油烯酸(C16∶1)0.349 8±0.012a0.362±0.060 0a0.340 7±0.024a13珍珠酸(C17∶0)0.171 6±0.003a0.169 2±0.019a0.171 7±0.003a14银杏酸(C17∶1)0.065 7±0.002a0.067 3±0.007a0.063 8±0.004a15硬脂酸(C18∶0)3.606 3±0.056a3.549 2±0.309a3.604 4±0.083a16油酸(C18∶1)3.800 2±0.086a3.940 8±0.613a3.885 0±0.140a17亚油酸(C18∶2)0.692 9±0.027a0.815 0±0.325a0.636 3±0.038a18顺9十八碳三烯酸(C18∶3,cis-9,12,15)0.025 4±0.002a0.046 6±0.037a0.025 4±0.005a19花生酸(C20∶0)0.042 3±0.007a0.046 6±0.019a0.051 0±0.003a20花生烯酸(C20∶1)0.028 1±0.024a0.043 7±0.000a0.033 0±0.000a
续表3
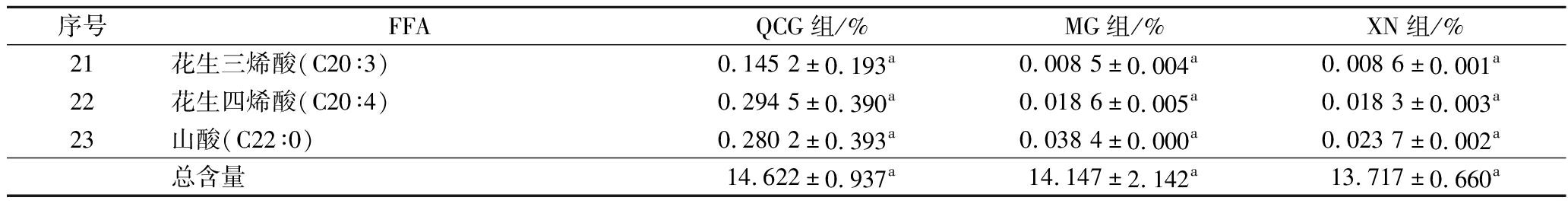
序号FFAQCG组/%MG组/%XN组/%21花生三烯酸(C20∶3)0.145 2±0.193a0.008 5±0.004a0.008 6±0.001a22花生四烯酸(C20∶4)0.294 5±0.390a0.018 6±0.005a0.018 3±0.003a23山酸(C22∶0)0.280 2±0.393a0.038 4±0.000a0.023 7±0.002a总含量14.622±0.937a14.147±2.142a13.717±0.660a
注:序号1~2为SCFA,3~5为MCFA,6~23为LCFA。
SCFA对干酪的风味影响最大。3种干酪的SCFA含量差异不显著,丁酸有助于干酪味的形成,己酸则赋予干酪一定的辛辣味[16]。QCG组的MCFA含量差异略高于对照组,其中辛酸赋予干酪奶味,月桂酸是干酪酸味的主要贡献物质,且在QCG组的含量最高(P>0.05)[17]。LCFA通常具有较高的风味感知阈值,在代谢途径中主要作为其他风味化合物的前体[18]。3种干酪共有的LCFA有17种,含量较高的是棕榈酸和硬脂酸,这两种FFA是脂肪的基本组成成分之一[19]。棕榈酸在不过量摄入的情况下,可以作为天然的饱和高级脂肪酸为机体提供能量。不饱和脂肪酸是人体不可缺少的一种脂肪酸,它能保证细胞的正常生理功能,降低血中胆固醇,改善血液循环等[20]。3组检测到不饱和脂肪酸共10种,QCG组含量高于对照组。人体需要摄入一定量的必需脂肪酸,如亚麻酸、亚油酸和花生四烯酸。亚油酸对人体的新陈代谢有重要作用,只能从外界摄取。花生四烯酸在人体可以通过亚油酸合成,是细胞膜不可缺少的物质,对调节血压有间接作用。3组都检测到亚油酸和花生四烯酸这两种必需脂肪酸,QCG组的花生四烯酸含量高于对照组,亚油酸含量略高于XN组而低于MG组。
2.3.2 干酪中游离脂肪酸的热图分析
聚类热图法是一类聚合试验结果、以渐进色带直观展现数据疏密及相关性的数据挖掘方法,可进行横向和纵向聚类,通常热图颜色的深浅反映数据结果的高低。
图2为游离脂肪酸的聚类热图,为更好的展现3组之间的FFA丰度差异,图中只展示组分平均值。QCG组在丁酸、花生三烯酸、十五烷酸、花生四烯酸、肉豆蔻酸烯酸、十五碳烯酸、棕榈酸、辛酸、葵酸、月桂酸、肉豆蔻酸这11组FFA丰度显著。MG组在十三烷酸、棕榈油烯酸、银杏酸、顺9十八碳三烯酸、己酸、亚油酸、油酸、花生烯酸这8组FFA丰度显著。XN组在花生酸、山酸这2组FFA丰度显著。其中,QCG组和XN组的珍珠酸和硬脂酸差异较小,丰度均大于MG组。
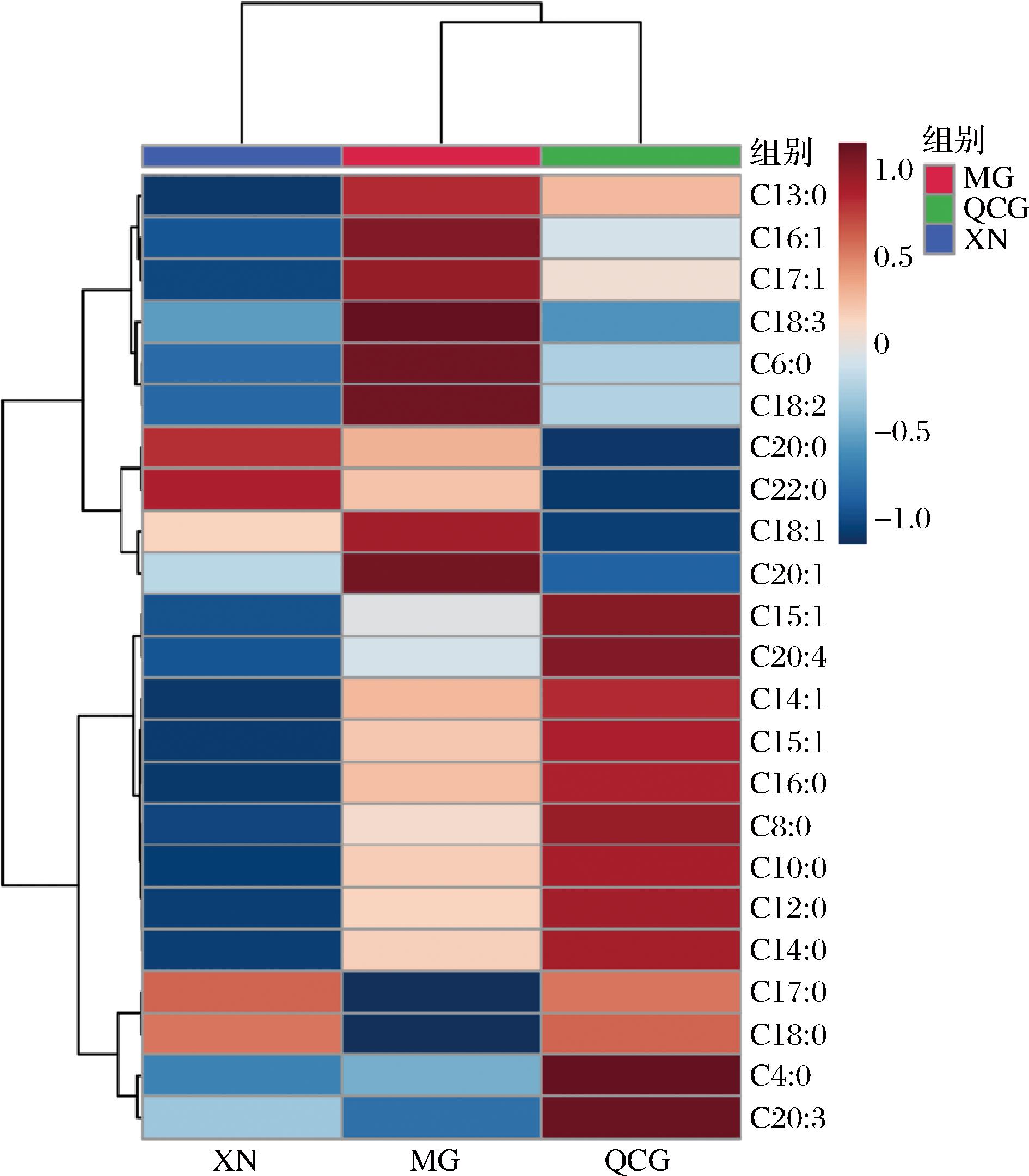
图2 干酪中的游离脂肪酸热图
Fig.2 Heatmap of free fatty acids in cheese
2.3.3 干酪中游离脂肪酸的主成分分析(principal component analysis,PCA)和偏最小二乘判别分析(partial least squares - discriminant analysis,PLS-DA)
图3-a中PC1贡献率为84.7%,PC2贡献率为7.7%,PC1和PC2之和为92.4%,总和大于80%,即两个主成分可以解释92.4%的变量,基本可以反映3组干酪FFA的大部分信息。QCG组分布在纵坐标的正半轴,XN组样品分布在中心附近,MG组样品分布在纵坐标的负半轴。QCG组与对照组组间差异显著,XN组和MG组组内差异显著,QCG组组内差异不显著。QCG组、MG组和XN组在PC1成分的差异较不显著,QCG组的分值略低于XN组而略高于MG组。PC2成分中,QCG组显著高于XN组和MG组,而XN组略高于MG组。
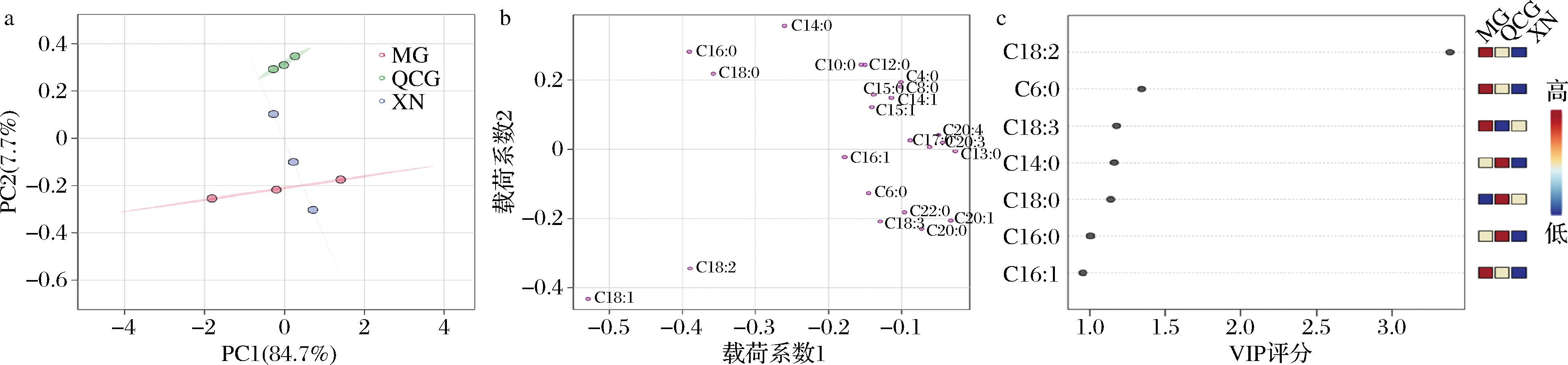
a-得分图;b-载荷图;c-VIP评分
图3 干酪中游离脂肪酸主成分分析和偏最小二乘判别分析
Fig.3 PCA and PLS-DA of free fatty acids in cheese
图3-b中可以看出,QCG组的主要贡献物质是棕榈酸、肉豆蔻酸、硬脂酸、葵酸、月桂酸、丁酸、辛酸、十五烷酸、肉豆蔻酸烯酸、十五碳烯酸。MG组的主要贡献物质是油酸、亚油酸、顺9十八碳三烯酸、棕榈油烯酸、花生酸、己酸、花生酸、山酸、花生烯酸。
通过PLS-DA筛选VIP得分>1的重要风味物质。图3-c中展示的是筛选出的6个重要风味物质,依次分别是:亚油酸、己酸、顺9十八碳三烯酸、肉豆蔻酸、硬脂酸、棕榈酸。其中棕榈酸、亚油酸、肉豆蔻酸对干酪特征风味的形成有重要影响。干酪在经过发酵液发酵后,乳酸菌可能对有机酸含量的增加具有贡献,部分有机酸之间存在协同效应,对干酪的口感起到调节作用,使酸味变得柔和、醇厚。花生四烯酸、十八碳烯酸等高级脂肪酸与小分子有机酸的协同作用可赋予发酵食品特有的酸香味和醇香味,增加滋味的丰富度和层次感[21-22]。
2.4 干酪中游离氨基酸分析
干酪中的蛋白质在残留的凝乳酶、蛋白酶以及微生物的作用下可以逐渐降解成肽及氨基酸。游离氨基酸是蛋白质水解过程中产生的,也是干酪特征风味物质的来源之一,它们是影响干酪味道的重要因素,尤其是在干酪后熟阶段,游离氨基酸是主要的呈味物质[23]。不同种类的乳酸菌和微生物在不同的干酪的发酵过程中可能产生不同的游离氨基酸(free amino acids,FAA)[24]。
2.4.1 干酪的游离氨基酸含量
如表4所示,从干酪中共检测出24种氨基酸,QCG组的FAA总含量与对照组具有显著差异(P<0.05),QCG组的总含量最低,其次是XN组,最优是MG组。呈现甜味有Thr、Ser、Gly、Ala、Pro这5种FAA,QCG组的Thr、Ser、Gly、Ala、Pro均显著低于对照组(P<0.05);Gly作为一种增味剂,能缓和酸味和碱味,XN组的Gly含量显著大于MG组;3组的Pro含量都高于组内其他甜味氨基酸。如图4所示,总体上,MG组的呈甜味氨基酸含量大于XN组,XN组显著大于QCG组。其中,呈现苦味有Val、Ile、Leu、His、Lys、Arg这6种FAA,QCG组的His含量显著高于对照组,Val、Ile、Leu、Lys含量均显著低于对照组;Arg具有多种生理功能,MG组的Arg含量显著低于QCG组和XN组,Ile、Leu和Lys含量均显著高于XN组[25]。

a-QCG组;b-MG组;c-XN组
图4 干酪游离氨基酸测定谱图
Fig.4 Total ion chromatogram of free amino acids in cheese
表4 干酪中的游离氨基酸含量
Table 4 The content of free amino acids in cheese

序号FAAQCG组/%MG组/%XN组/%1磷酸丝氨酸(P-Ser)0.022 4±0.000b0.029 3±0.000a0.016 9±0.000b2牛磺酸(Tau)0.003 6±0.000b0.011 9±0.000b0.161 6±0.022a3天冬氨酸(Asp,鲜味、酸味)1.330 6±0.002c1.598 3±0.002a1.366 8±0.001b4苏氨酸(Thr,甜味)∗∗1.076 7±0.001c1.267 4±0.002a1.219 4±0.001b5丝氨酸(Ser,甜味)∗1.275 2±0.001c1.665 3±0.001a1.420 0±0.001b6谷氨酸(Glu,鲜味、酸味)0.009 0±0.000c6.667 9±0.025a5.510 0±0.002b7α氨基己二酸(Aad)5.445 9±0.000a0.018 9±0.001b0.004 0±0.000b8甘氨酸(Gly,甜味)∗0.008 6±0.001c0.549 9±0.001b0.642 7±0.025a9丙氨酸(Ala,甜味)0.457 8±0.001c0.975 0±0.001a0.822 4±0.000b10缬氨酸(Val,苦味)∗∗0.797 8±0.002bc1.791 5±0.004a1.534 9±0.001ab11胱氨酸(Cys)∗1.482 4±0.001a0.076 2±0.001b0.055 7±0.000c12甲硫氨酸(Met)∗∗0.038 2±0.000c0.639 1±0.003a0.088 9±0.002b13异亮氨酸(Ile,苦味)∗∗0.025 0±0.000c1.342 0±0.002a1.155 9±0.000b14亮氨酸(Leu,苦味)∗∗1.171 0±0.002c2.528 1±0.002a2.174 0±0.001b15酪氨酸(Tyr,芳香味)∗2.026 9±0.005a1.674 5±0.003b1.367 1±0.002c16苯丙氨酸(Phe)∗∗1.111 1±0.001a0.917 4±0.002c0.966 9±0.020b17β丙氨酸(β-Ala)0.871 9±0.010a0.400 9±0.002b0.284 9±0.006c18β氨基异丁酸(BAIB)0.266 0±0.002a0.008 0±0.000b0.006 7±0.000b19γ氨基丁酸(GABA)0.009 0±0.000c0.514 3±0.002a0.449 3±0.003b20组氨酸(His,苦味)∗∗∗0.436 0±0.002a0.008 2±0.000b0.006 7±0.000b21鸟氨酸(Orn)1.506 4±0.000b1.787 8±0.004a1.512 2±0.020b22赖氨酸(Lys,苦味)∗∗3.196 4±0.011c3.859 8±0.050a3.724 7±0.017b23精氨酸(Arg,苦味)∗0.507 5±0.004b0.406 2±0.008c0.701 8±0.000a24脯氨酸(Pro,甜味)2.361 3±0.003c3.094 0±0.003a2.592 4±0.001b总含量25.437±0.051c31.832±0.118a27.786±0.128b
注:*表示半必需氨基酸;**表示必需氨基酸;***表示婴儿必需氨基酸;同一行上标相同字母者差异不显著(P>0.05),同一行上标不同字母者差异显著(P<0.05)。
总体上,MG组的呈苦味氨基酸含量大于XN组,XN组显著大于QCG组。其中,3组的Lys含量都高于组内其他苦味氨基酸。呈现鲜味有Asp、Glu这2种FAA。其中QCG组的Asp和Glu的含量显著低于对照组。MG组的Asp和Glu显著高于其他对照组,Asp与Glu同属酸性氨基酸。总体上,MG组的呈鲜味氨基酸含量大于XN组,XN组显著高于QCG组。因此可以得出,QCG组呈味氨基酸的总含量总体上低于XN组和MG组。
QCG组的必需氨基酸和非必需氨基酸总含量低于XN组,XN组低于MG组,半必需氨基酸含量高于MG组,MG组高于XN组。其中,QCG组的必需氨基酸Phe和His、非必需氨基酸Aad、β-Ala和BAIB、半必需氨基酸Cys、Tyr的含量均显著高于对照组。Lys在3组的必需氨基酸的含量都高于其他必需氨基酸,Lys具有增强胃液分泌、提高蛋白质的利用率、增强造血机能、增强抗病能力的作用;His是婴儿必需氨基酸,对婴儿的生长发育有促进作用;Tyr能促进黑色素生成,预防焦虑、调节情绪等作用。
2.4.2 干酪中游离氨基酸的热图分析
从图5中可以看出,Phe、Aad、Cys、BAIB、His、Tyr、β-Ala这7组在QCG组中丰度最高;P-Ser、Ser、Pro、Orn、Asp、Met、Ala、Thr、Val、Leu、Glu、Lys这12组在木瓜凝乳酶中丰度最高,Arg、Tau、Gly这3组在XN组中丰度最高,Ile、GABA在QCG组中丰度较差,在MG组和XN组中丰度较高。
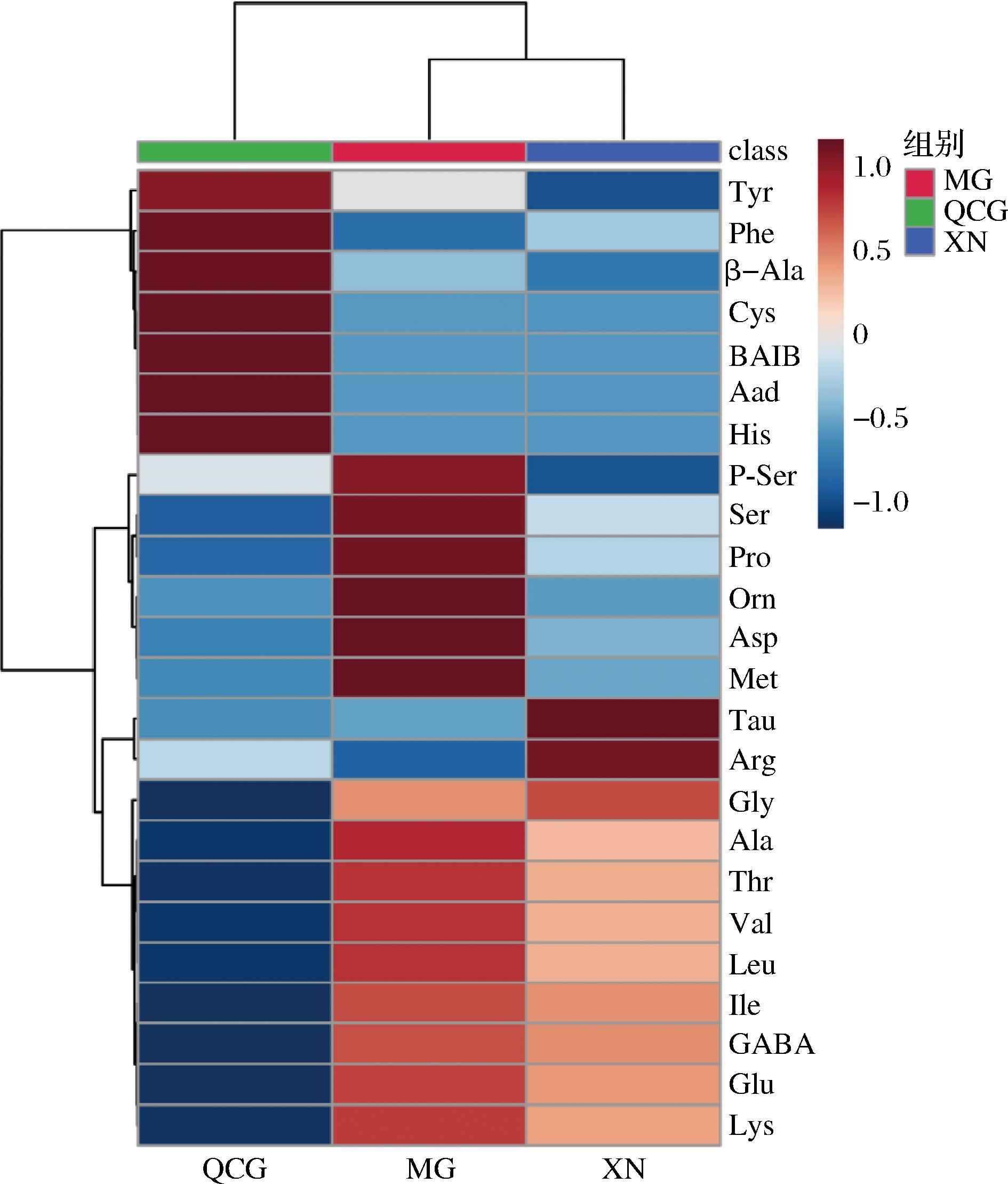
图5 干酪中游离氨基酸的热图
Fig.5 Heatmap of free amino acids in cheese
2.4.3 干酪中游离氨基酸的PCA和PLS-DA分析
图6-a PC1贡献率为90.2%,PC2贡献率为7.4%,PC1和PC2之和为97.6%,基本可以反映3种干酪FAA的大部分信息。QCG组样品分布在横坐标的正半轴。3组组间差异显著,MG组组内差异不显著,XN组组内差异较小,QCG组组内差异较大。PC1成分中QCG组分值最高,显著高于MG组和XN组。PC2中XN组分值最高,其次是QCG组,最后是MG组。
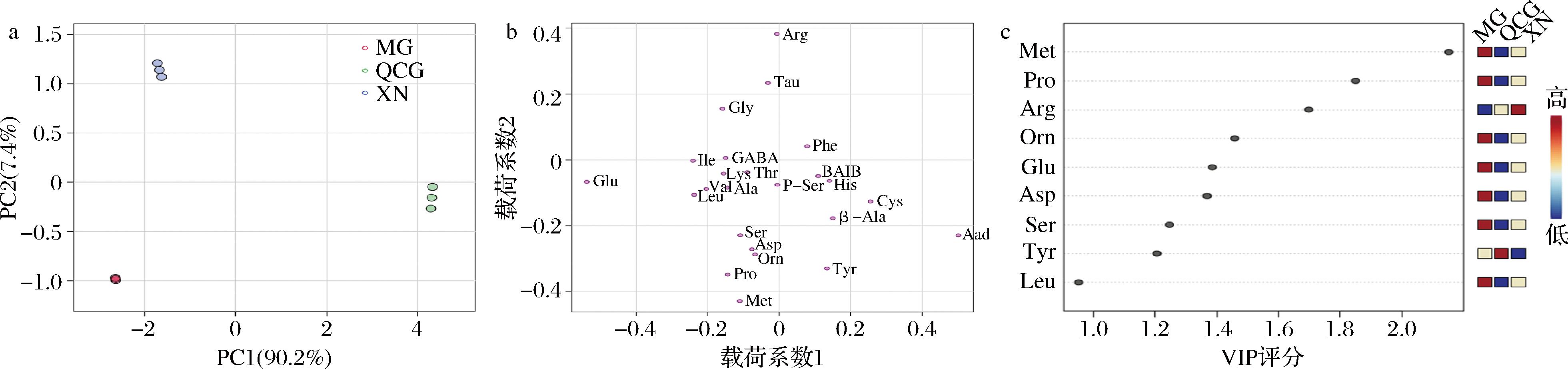
a-参看得分图;b-载荷图;c-VIP评分
图6 干酪中游离氨基酸主成分分析
Fig.6 PCA of free amino acids in cheese
图6-b中,XN组的主要贡献物质是Glu,QCG组的主要贡献物质是Aad、Cys、β-Ala、Tyr、His、BAIB,MG组主要的贡献物质是Glu、Met、Pro、Orn、Asp、Ser、Leu、Val、Ala、Lys、Thr。
通过PLS-DA筛选出8个重要风味物质,分别为:Tyr、Ser、Asp、Glu、Orn、Arg、Pro、Met,Ser、Pro、Orn的滋味特征为甜味,Asp、Glu滋味特征为鲜味,Arg滋味特征为苦味,Tyr滋味特征为芳香味。
2.5 干酪中游离脂肪酸与游离氨基酸的交互性热图分析
将图3和图6中筛选出的14个重要风味物质作交互性热图。分析游离脂肪酸和游离氨基酸对干酪风味物质的影响。结果如图7所示,6种游离脂肪酸和8种游离氨基酸的组内交互性好。顺9十八碳三烯酸、己酸、亚油酸这3种FFA与Glu、Ser、Pro、Orn、Asp、Met这6种FAA交互性好。Tyr、Arg与其他物质交互效果都较差。
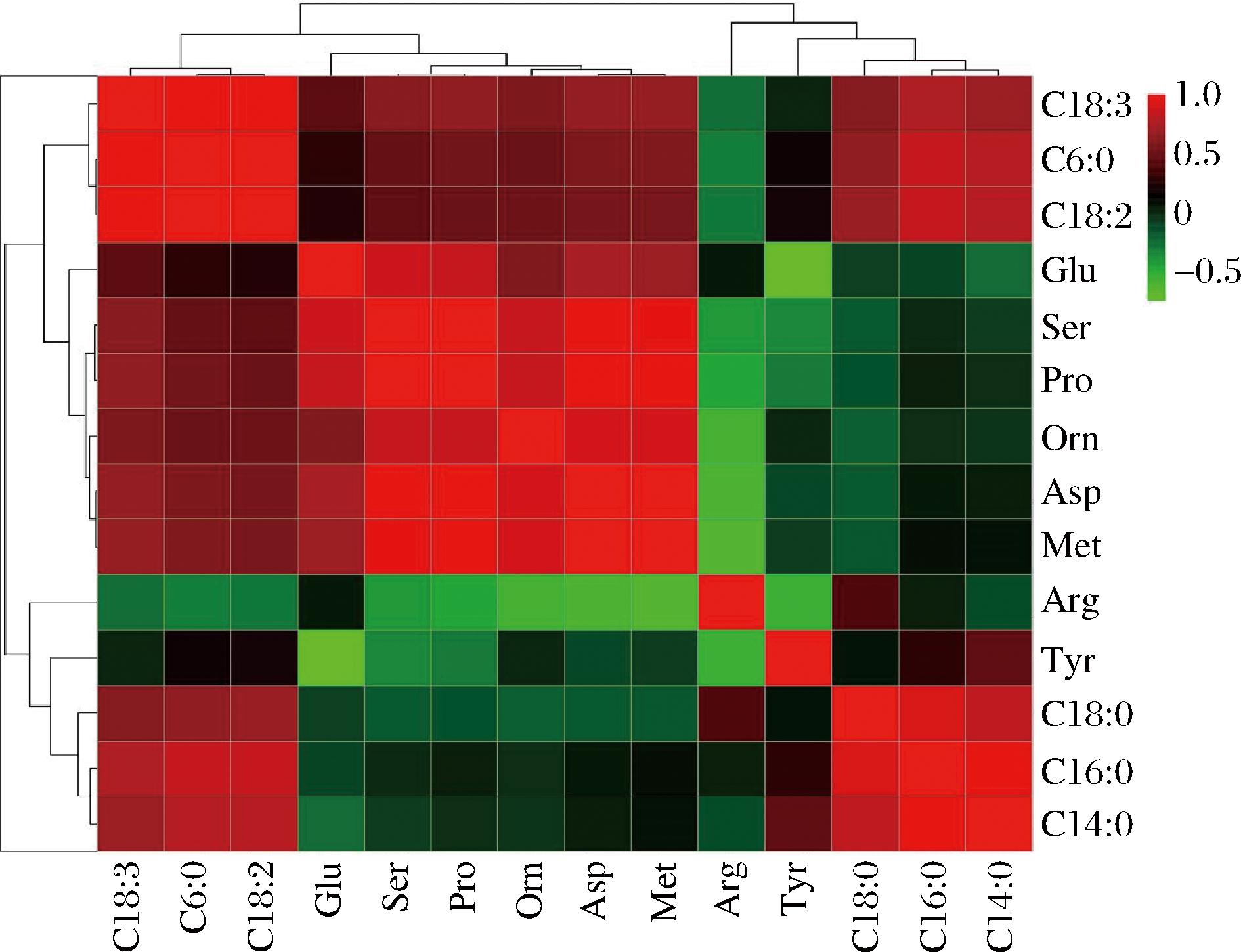
图7 游离脂肪酸与游离氨基酸VIP组分的交互性热图分析
Fig.7 Interactive heatmap analysis of VIP components in free fatty acids and free amino acids
其中,亚油酸、己酸、顺9十八碳三烯酸3种FFA可能通过氨基酸代谢途径与Glu、Ser、Pro、Orn、Asp、Met 6种FAA存在协同作用。肖甜甜等[21]对贵州米酸汤进行研究,发现甘油可通过原料中的脂肪在各种酶的作用下降解产生,然后在氨基酸代谢途径中通过羟基丙酮酸进一步合成。Arg、Gly、Thr可在多种生物合成途径中生成,然后在酶的作用下进入柠檬酸盐酸循环。一些脂肪族也是氨基酸代谢过程中的产物或中间物质[21]。而参与风味物质形成的氨基酸有Val、Leu、Ile、Ala、Phe等,其中Val、Leu、Ile、Ala、Phe这5种FAA在干酪中均有检出,这说明亚油酸、己酸、顺9十八碳三烯酸这3种FFA与Glu、Ser、Pro、Orn、Asp、Met这6种FAA之间可能存在协同作用,对干酪的风味有影响。
3 结论
实验利用青刺果凝乳酶加工发酵型干酪,所得干酪色泽乳白;与木瓜凝乳酶、小牛凝乳酶加工干酪相比,其在凝聚性、黏性、咀嚼性、恢复性等质构特性得到较好改善;从青刺果凝乳酶加工干酪共检测出23种游离脂肪酸和24种游离氨基酸,通过PLS-DA分析从3种凝乳酶加工干酪中共筛选出14种重要风味物质,其中有3种游离脂肪酸和6种游离氨基酸之间交互效果较好,可能存在协同效应,对干酪风味产生影响。研究为青刺果凝乳酶在干酪加工中的应用提供重要依据。
[1] 周帆, 郭伟民, 林华庆.青刺果的药理活性研究进展[J].中国药房, 2014, 25(7):670-672.ZHOU F, GUO W M, LIN H Q, et al.Research progress on pharmacological activity of Prinsepia utilis[J].China Pharmacy, 2014, 25(7):670-672.
[2] 赵燕强, 赵颖, 杨立新.青刺及其护肤相关传统知识的民族植物学研究[J].广西植物, 2023, 43(10):1941-1953.ZHAO Y Q, ZHAO Y, YANG L X.Ethnobotanical study on Prinsepia utilis and related traditional knowledge with skin care[J].Guihaia, 2023, 43(10):1941-1953.
[3] 贾仁勇, 李超, 殷中琼.青刺果多糖的提取及含量测定[J].时珍国医国药, 2008, 19(7):1641-1642.JIA R Y, LI C, YIN Z Q.Extraction and determination of Prinsepia utilis rogle polysaccharide[J].Lishizhen Medicine and Materia Medica Research, 2008, 19(7):1641-1642.
[4] 吴小兰, 殷中琼, 贾仁勇, 等.青刺果黄酮对糖尿病小鼠肝组织病理变化的影响[J].时珍国医国药, 2007, 18(11):2661-2663.WU X L, YIN Z Q, JIA R Y, et al.Effect of flavonoids from Prinsepia utilis royle on the histomorphology of liver in the diabetic mice[J].Lishizhen Medicine and Materia Medica Research, 2007, 18(11):2661-2663.
[5] 张晓鹏, 林晓明.青刺果油调节血脂及对人血小板体外聚集作用的影响[J].卫生研究, 2005, 34(1):79-81.ZHANG X P, LIN X M.Study of Qingciguo Oil’s function on blood lipid and other functions[J].Journal of Hygiene Research, 2005, 34(1):79-81.
[6] 高凡丁, 张成庭, 蔡圣宝.青刺果种子和油粕中的营养成分对比及酚类物质组成和抗氧化活性分析[J].食品与发酵工业, 2019, 45(2):151-158.GAO F D, ZHANG C T, CAI S B.Comparative analysis of multiple nutrients, phenolic compounds and antioxidant activities of the seeds and pomace of Prinsepia utilis Royle[J].Food and Fermentation Industries, 2019, 45(2):151-158.
[7] 殷小雅, 赵颖, 陈艳, 等.青刺果油组合物的抗氧化及保湿活性研究[J].日用化学品科学, 2023, 46(6):46-51;70.YIN X Y, ZHAO Y, CHEN Y, et al.Study on the antioxidant and moisturizing effects of Prinsepia utilis Royle composition[J].Detergent &Cosmetics, 2023, 46(6):46-51;70.
[8] 端木凡林, 闫开明, 李林开, 等.天然青刺果油低温萃取及其保健功能[J].粮食与油脂, 2001, (6):32-33.DUANMU F L, YAN K M, LI L K, et al.Extraction and healthful function of Prinsepla utilis rogle oil[J].Cereals &Oils, 2001, (6):32-33.
[9] 司阔林, 闫清泉, 李玲玉, 等.乳酸菌对干酪风味形成作用的研究进展[J].食品工业, 2022, 43(2):192-198.SI K L, YAN Q Q, LI L Y, et al.Review on the contribution of lactic acid bacteria to cheese flavor formation[J].The Food Industry, 2022, 43(2):192-198.
[10] 党亚丽. 中性蛋白酶和乳酸菌固定化及其对干酪促熟效果的研究[D].西安:陕西师范大学, 2005.Dang Y L.Neutral proteinase and starter lactic acid bacteria cell immobilization on sodium alginate and its effect on accelerating ripening of cheese [D].Xi’an:Shaanxi Normal University, 2005.
[11] KUMAR A, GROVER S, SHARMA J, et al.Chymosin and other milk coagulants:Sources and biotechnological interventions[J].Critical Reviews in Biotechnology, 2010, 30(4):243-258.
[12] ZHAO Q, SHI Y N, WANG X F, et al.Characterization of a novel antimicrobial peptide from buffalo casein hydrolysate based on live bacteria adsorption[J].Journal of Dairy Science, 2020, 103(12):11116-11128.
[13] 赵琼, 陈越, 施亚楠, 等.盐法结合两步分级沉淀法提取辣木籽蛋白质工艺优化[J].食品工业, 2019, 40(8):19-24.ZHAO Q, CHEN Y, SHI Y N, et al.Optimization of extraction process of moringaoleifera seed protein by salt method combined with two-step fractionation precipitation method[J].The Food Industry, 2019, 40(8):19-24.
[14] 刘同吉, 王艺会, 薛瑞, 等.贝莱斯芽孢杆菌YH-1凝乳酶对切达干酪成熟特性及生物活性的影响[J].食品与发酵工业, 2024, 50(8):8-17.LIU T J, WANG Y H, XUE R, et al.Effect of milk-clotting enzyme from Bacillus velezensis YH-1 on ripening properties and bioactivity of Cheddar cheese[J].Food and Fermentation Industries, 2024, 50(8):8-17.
[15] 马燕. 超声处理对牦牛乳凝胶特性及凝胶制品干酪成熟期间品质的影响研究[D].兰州:甘肃农业大学, 2022.MA Y.Effect of ultrasonic treatment on gel properties of yak milk and cheese quality during ripening[D].Gansu Agricultural University, 2022.
[16] 胥鑫钰. 泉香型白酒中长链脂肪酸的分析检测及月桂酸生物学活性研究[D].济南:齐鲁工业大学, 2023.XU X Y.Analytical detection of long-chain fatty acids and biological activity of lauric acid in Spring-flavor Baijiu[D].Jinan:Qilu industrial university, 2023.
[17] 史雨桦. 高产丁二酮菌株的筛选、产香特性及功能基因的表达研究[D].上海:上海应用技术大学, 2019.SHI Y H.Screening of high diacetyl-producing, aroma characteristics and function gene-expression of lactic acid bacteria [D].Shanghai:Shanghai Technology University, 2019.
[18] 李晏蝶. 乳酸菌与酵母菌混合发酵对奶酪风味的影响[D].石河子:石河子大学, 2022.LI Y D.Effect of mixed fermentation of lactic acid bacteria and yeast on cheese flavor [D].Shihezi:Shihezi University, 2022.
[19] 倪春梅. 乳酸菌分离筛选及其对新型半硬质干酪品质特性影响[D].呼和浩特:内蒙古农业大学, 2013.NI C M.ldentification and Screening of lactic acid bacteria and the influence on the characteristics of the new semi-hard cheese[D].Hohhot:Inner Mongolia Agricultural University, 2013.
[20] 牛婕. 牦牛乳软质干酪加工工艺技术及其成熟过程中风味物质的研究[D].兰州:甘肃农业大学, 2010.NIU J.Research on yak’s milk soft cheese technology and flavor research on yak’s milk soft cheese technology and flavor compounds in ripening process[D].Lanzhou:Gansu Agricultural University, 2010.
[21] 肖甜甜, 干昭波, 吴君海, 等.贵州米酸汤中呈味物质对滋味的影响[J].中国食品学报, 2022, 22(10):303-313.XIAO T T, GAN Z B, WU J H, et al.Effects of flavor components on taste in Guizhou rice sour soup[J].Journal of Chinese Institute of Food Science and Technology, 2022, 22(10):303-313.
[22] 龚云霞, 齐小保.检测不同菌群发酵产生有机酸种类与含量[J].食品工业, 2020, 41(7):174-178.GONG Y X, QI X B.Detecting the types and contents of organic acids produced by fermentation of different groups[J].The Food Industry, 2020, 41(7):174-178.
[23] 刘雅楠, 王青华, 赵征.蓝纹干酪成熟期间氨基酸的变化研究[J].中国乳品工业, 2008, 36(1):22-25.LIU Y N, WANG Q H, ZHAO Z.Variety of free amino acid of blue cheese ripening[J].China Dairy Industry, 2008, 36(1):22-25.
[24] 陶祥婕, 胡萍.复合菌种发酵黄浆水的风味品质分析[J].食品与发酵工业, 2024, 50(11):308-318.TAO X J, HU P.Analysis of flavor quality of soybean whey fermented by compound cultures[J].Food and Fermentation Industries, 2024, 50(11):308-318.
[25] ZHANG X, ZHENG Y R, ZHOU R, et al.Comprehensive identification of molecular profiles related to sensory and nutritional changes in Mongolian cheese during storage by untargeted metabolomics coupled with quantification of free amino acids[J].Food Chemistry, 2022, 386:132740.